Introducción
Colombia es una de las cinco naciones megadiversas del mundo. En su superficie continen tal de 114,17 millones de hectáreas, es decir, el 0,77 % del área terrestre del mundo, alberga aproximadamente el 10 % de las especies vegetales y animales conocidas (Valencia, et al., 2010), y ecosistemas estratégicos, entre ellos, los páramos. Los ecosistemas estraté gicos son "aquellas áreas dentro del territorio que, gracias a su composición biológica, características físicas, estructurales y procesos ecológicos, proveen bienes y servicios ambientales imprescindibles e insustituibles para el desarrollo sostenible y armónico de la sociedad". El ecosistema de páramo se encuentra en el límite superior de los bosques altoandinos, con una altitud que, según la ubicación geográfica, puede estar por encima de los 3.000 m s.n.m. (Pedraza-Peñalosa, et al., 2004; Chaparro & Chaparro, 2012).
Los ecosistemas de páramo se consideran únicos. En todo el continente solo Colombia, Venezuela, Ecuador, Perú y Costa Rica cuentan con páramos tropicales ubicados casi todos en la cordillera de los Andes, salvo los de la Sierra Nevada de Santa Marta y los de Costa Rica. Además de la vegetación que los caracteriza, poseen condiciones climáticas, de suelos y de altitud que los diferencian y hacen de ellos conjuntos de condiciones ambientales singulares (Hofstede, et al., 2003; Morales, et al., 2007; Buytaert, et al., 2006).
Se estima que el área cubierta por los páramos fluctúa entre 35.000 y 77.000 km2 (Buytaert, et al, 2006); su flora, única y característica, es el resultado de complejos procesos de evolución e incluye 3.399 especies de plantas vasculares descritas, de las cuales la gran mayoría es endémica, lo que convierte a los páramos en uno de los puntos calientes de biodiversidad (mini-hotspots) (Buytaert, et al., 2006; Londoño, et al., 2014). Las especies están adaptadas a las condiciones climáticas de baja presión atmosférica, intensa radiación y efectos de secado del viento (Buytaert, et al., 2006).
En muchos de estos lugares hay una mayor probabilidad de extinción de especies, lo que se atribuye a causas como el cambio climático, el aumento en la demanda de recursos naturales, la ampliación de la frontera agrícola (Reed, et al., 2011), la contaminación industrial, la deforestación, la pérdida de la diversidad genética, la erosión del suelo (Mohan, 2011) y, en ocasiones, el reducido número de individuos de una población o de las poblaciones de una especie y su distribución restringida (González-Benito & Martín, 2011). De ahí que la estrategia mundial para la conservación de plantas firmada por más de 180 países en el 2002 plantee frenar esta pérdida mediante la comprensión, la conservación de la diversidad vegetal y la promoción del uso sostenible con técnicas de conservación en campo y en laboratorio (ex situ) (Heywood & Dulloo, 2005). Esto último es importante en el caso de las especies con dificultades de reproducción, cuyas semillas son recalcitrantes o se pueden reproducir de forma vegetativa (Reed, et al., 2011; Mohan, 2011). Los frailejones son especies predominantes en los páramos que presentan un marcado endemismo relacionado, probablemente, con el hecho de que sus semillas, a diferencia de otras asteráceas, no tienen los paraguas que les permiten ser esparcidas por el viento, por lo que su distribución es más restringida (Morales, et al., 2007). Además, a pesar de su importancia, sus poblaciones se están viendo afectadas principalmente por actividades humanas. En este contexto, y con el fin de contribuir a su conservación, se hicieron ensayos para generar protocolos de propagación de Espeletia barclayana, Espeletia summapacis, Espeletia killipii y Espeletiopsis corymbosa bajo condiciones de invernadero, sobre todo teniendo en cuenta que esta última especie se encuentra amenazada de extinción (Avila, et al., 2020).
Materiales y métodos
Recolección del material vegetal
La recolección del material vegetal se llevó a cabo en tres páramos de Colombia. En el 2017 se recolectaron frutos de E. corymbosa en el páramo de Guacheneque (municipio de Villapinzón, Cundinamarca; N5°12.552', O73°34.063', 3.281 m s.n.m, voucher de herbario CISB 353); en el 2018 se recolectaron semillas de E. summapacis y E. killipii en el páramo de Sumapaz (Bogotá, D.C.; N4°16.214', O74°12.1603', 3866 m s.n.m.; CISB 817 y SLC 209), y en el 2019 se recolectó E. barclayana en el páramo El Tablazo (Subachoque, Cundinamarca; N5°00 28.2, 074° 12 17.4; 3582 m s.n.m.; CISB 343). Se verificó que las semillas tuvieran madurez fisiológica a partir del color y la dureza de la testa. Se recolectó material de por lo menos 20 individuos por especie con condiciones fitosanitarias adecuadas. La taxonomía de cada especie se verificó y los especímenes se ingresaron al Herbario del Jardín Botánico de Bogotá "José Celestino Mutis" (JBB). Las semillas se transportaron el mismo día de su recolección al Laboratorio de Conservación de Semillas del JBB y se limpiaron separándolas de las sinflorescencias. Se verificó la presencia de embrión en 100 semillas por especie mediante inspección con un estereos copio Motic® SMZ-168 (Hong Kong, China). Los ensayos de germinación se hicieron en el año de recolección de las semillas con material vegetal fresco.
Descripción morfológica de las semillas
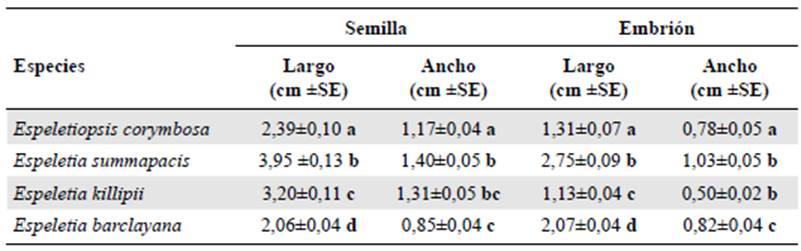
La descripción interna y la externa se hizo en 10 semillas y embriones de cada especie. Para las medidas se tuvieron en cuenta el largo, el ancho y las características de la testa, el endospermo y el embrión. Las medidas se tomaron con ayuda del programa Motic® Images Plus 3.0 (China). La descripción morfológica se hizo con base en Martin (1946) y Niembro (1988).
Prueba de tetrazolio
La prueba de tetrazolio se hizo en cuatro réplicas de 50 semillas, excepto en E. barclayana, en la que cada réplica fue de 25 semillas. A las semillas se les rompió la testa con una cuchilla para la imbibición durante 24 horas; seguidamente, se sumergieron en condiciones de oscuridad en una solución de 2,3,5 cloruro de trifenil tetrazolio al 1 % durante 24 horas a 40 °C en un horno de secado Binder ED53-UL (Tuttlingen, Alemania) (Mancipe-Murillo, et al., 2018). Una vez completado el tiempo, las semillas se enjuagaron con agua y se evaluaron en un estereoscopio Motic® SMZ-171 (Hong Kong). Las semillas se consideraron viables cuando la zona radicular y los cotiledones presentaron color rosa; se tuvo en cuenta la tinción en la radícula y los cotiledones, pues si el embrión presenta una tinción no homogénea puede significar menor vigor, aunque no ausencia de viabilidad (Da Silva, et al., 2012), en tanto que el color rosa claro no homogéneo en la radícula o la ausencia de coloración de los embriones indica que no es viable.
Prueba de germinación
Las pruebas de germinación se hicieron con cuatro réplicas de 30 semillas en cada tratamiento aplicado. Se hizo una prueba piloto en E. corymbosa aplicando tratamientos pregerminativos: control; aplicación de giberelinas GA3 con una concentración de 200, 300 y 400 ppm; adición de giberelinas siguiendo protocolos de otros investigadores para la propagación in vitro con estas hormonas (Bohórquez-Quintero, et al., 2016; Araque-Barrera, et al., 2016) mediante la imbibición de las semillas en las giberelinas durante 24 horas para su posterior siembra en un sustrato compuesto por tierra, turba y cascarilla en proporción de 60:20:20. Dado que el tratamiento de inmersión en giberelinas a 400 ppm fue el mejor tratamiento en esta especie, se aplicó también en E. summapacis, E. killipii y E. barclayana, es decir que en estas se aplicaron los tratamientos de control, 400 ppm de GA3 estratificación fría por un mes y estratificación fría por un mes seguida de 400 ppm de GA3. La estratificación se hizo durante un mes en un cuarto frío a 4°C y en cajas de Petri con doble papel de filtro, el cual se mantuvo húmedo; una vez cumplido el tiempo, las semillas se sembraron bajo condiciones de invernadero en sustrato. En el caso de E. barclayana se incluyó un tratamiento adicional en el que se cambió el sustrato por virutas de coco (chip de coco) y turba en proporción de 70:30; en este tratamiento las semillas se sembraron sin aplicar tratamientos pregerminativos. Las bandejas se mantuvieron en condiciones de invernadero con un fotoperiodo de 12 horas, temperatura media de 17 °C, máxima de 26 ° y mínima de 13 °C durante el día y de 11 °C y 19 °C durante la noche, y una humedad relativa promedio de 74 % con una máxima de 88 % y una mínima de 45,9 % en el día y de 89 % y 61 % en la noche, estos valores que se tomaron con un registrador de datos EBCHQ 94150 (China).
Las semillas se sembraron a una profundidad de 0,5 centímetros aproximadamente y se consideraron germinadas en el momento en que emergieron los cotiledones a través del sustrato (Villamil & García, 1998). La germinación se evaluó cada tercer día hasta que hubiera cesado por tres semanas consecutivas a partir de la germinación de la mayor parte de las semillas.
El porcentaje de germinación (PG) se calculó con base en el número de semillas con embrión y el tiempo medio de germinación (TMG) mediante la siguiente ecuación (Tompsett & Pritchard, 1998, Bewley, et al., 2006, Ranal & Santana, 2006):
donde N es el número de semillas germinadas y Ns el número total de semillas con embrión; ni es el número de semillas germinadas en la medida iésima; ti es el tiempo en días en la medida iésima y k es el tiempo total de germinación en días.
Para el cálculo se tuvo en cuenta el resultado de las pruebas de corte en cada especie, de manera que al número total de semillas por réplica se le restó el número de semillas vacías y con el resultado se calculó el porcentaje de germinación.
Comparación entre la prueba de tetrazolio y la prueba de germinación
El resultado del mejor tratamiento de la prueba de germinación se comparó con la prueba de tetrazolio en cada especie para determinar el número de semillas viables sin germinar.
Crecimiento y supervivencia
Con el fin de describir el comportamiento de las semillas después de su germinación, se registró el crecimiento semanal de las primeras 30 plántulas obtenidas por especie sin tener en cuenta el tratamiento aplicado; dado que los tratamientos se aplicaron para favorecer la germinación, se registró la altura, el número de hojas y la permanencia de los cotiledones durante cuatro meses. Las medidas se tomaron con un calibrador digital. La supervivencia se evaluó en otras 30 plántulas por especie una vez por mes durante cuatro meses.
Análisis estadístico
En cada conjunto de datos se evaluó el supuesto de normalidad con la prueba de Shapiro-Wilk. Los datos que se comportaron de forma normal se analizaron con un ANOVA modelo I, balanceado y simple, para evaluar diferencias entre: 1) la morfometría de las semillas, y 2) la viabilidad con la prueba de tetrazolio entre las especies evaluadas. Para los datos no paramétrico se empleó la prueba de Kruskal-Wallis, con el fin de evaluar si existían diferencias entre: 1) el porcentaje de germinación según el tratamiento pregerminativo utilizado en cada especie evaluada; 2) el tiempo medio de germinación entre las especies, y 3) el porcentaje de germinación y el de semillas viables según la prueba de tetrazolio para cada especie. En todos los análisis se utilizó un nivel de confianza del 95 % con el programa estadístico StatGraphics® Centurion XVI versión 16.1.11.
Resultados
Descripción morfológica de las semillas
Las semillas de las cuatro especies presentaban características similares. A nivel externo son de forma ovoide a piramidal, con una cubierta seminal lustrosa de consistencia papirácea, delgada y blanda, de color negro. En cuanto al tamaño, E. summapacis presentó las semillas más grandes y E. barclayana las más pequeñas. Las semillas presentaron diferencias en el largo (F3.36=71,01; p=<0,05) y en el ancho (F3.36=25,79; p=<0,05). A nivel interno, las semillas no tienen endospermo visible, los embriones se encuentran en la parte central, son de forma ovoide a piramidal, lisos, de color blanco y con cotiledones gruesos y carnosos separados entre sí. En E. summapacis el embrión era el más grande y en E. killipii, el más pequeño (Figura 1). Se registraron diferencias significativas en el largo (F3.36=135,7; p=<0,05) y en el ancho (F3.36=26,22; p=<0,05) de los embriones (Tabla 1).
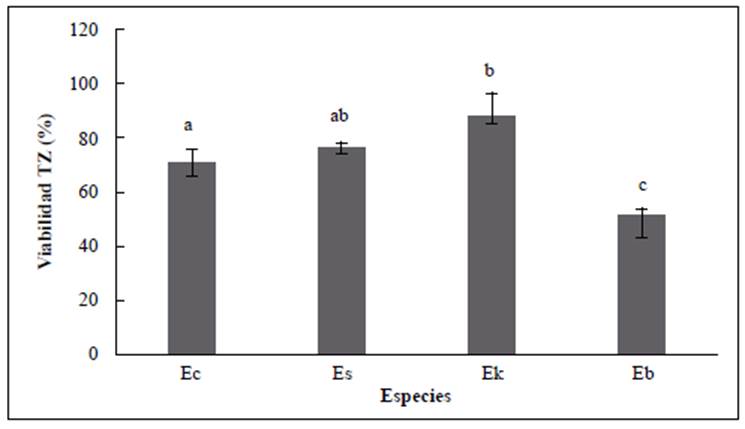
Figura 1 Viabilidad evaluada con la prueba de tetrazolio en cuatro especies de frailejones: E. corymbosa (Ec), E. summapacis (Es), E. killipii (Ek), y E. barclayana (Eb). Las letras diferentes indican que se presentaron diferencias significativas entre las pruebas (Kruskal-Wallis; p<0,05). Las verticales indican el error estándar.
Prueba de tetrazolio
Se presentó tinción en todas las especies evaluadas. En E. corymbosa la tinción fue del 71 %, en E. summapacis de 76 %, en E. killipii de 88 % y en E. barclayana de 52 %. Se registraron diferencias significativas en la viabilidad de las semillas de las diferentes especies (F312=8,9; p<0,05) (Figura 1yFigura 2).
Prueba de germinación
Hubo un alto porcentaje de semillas vacías, con un porcentaje de embriones de 42,5 % en E. corymbosa, 34,9 % en E, summapacis, 37,3 % en E, killipii y 61 % en E, barclayana. E. corymbosa presentó la germinación más alta (48 %) con el tratamiento de 400 ppm de GA3, sin embargo, no se presentaron diferencias significativas entre los tratamientos (K=5,53; p=0,13). En el caso de E. summapacis y E. killipii hubo mayor germinación con el tratamiento de control, cuyos valores fueron 12,5 y 36,4 %, respectivamente; en estas especies tampoco se presentaron diferencias significativas en la germinación con los diferentes tratamientos (K=0,05; p=0,99 y K=2,32; p=0,50). E. barclayana registró la mayor germinación al sembrarse en sustrato de virutas de coco y turba (39 %), con diferencias significativas entre los tratamientos, siendo la siembra en este sustrato el tratamiento diferente (K=13,03; p<0,05) (Figura 3).
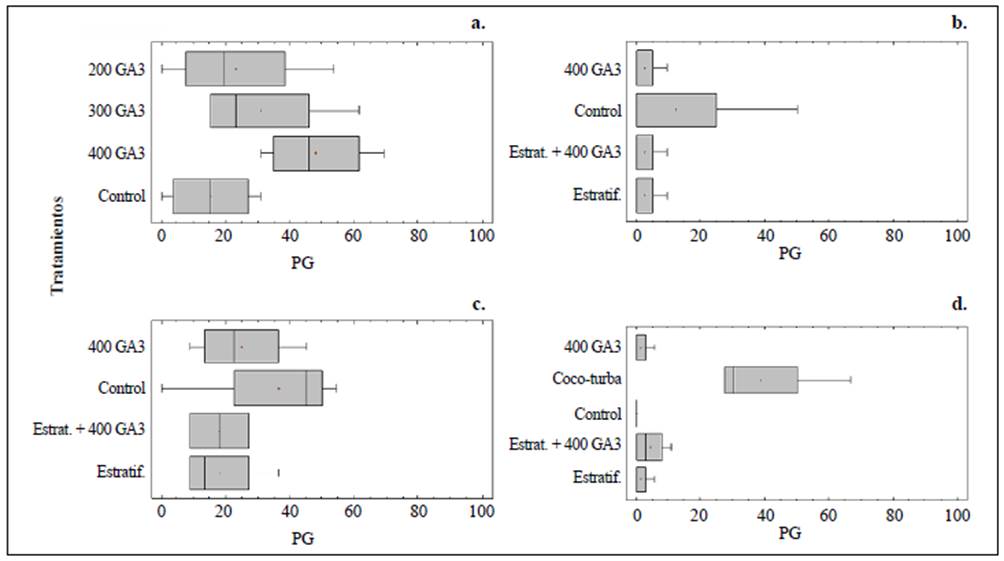
Figura 3 Porcentaje de germinación (PG) de a. E. corymbosa, b. E. summapacis, c. E. killipii, y d. E. barclayana, sembradas en sustrato bajo condiciones de invernadero. Las especies se sembraron en sustrato compuesto por tierra, turba y cascarilla en proporción de 60:20:20. En E. barclayana se incluyó la siembra en un sustrato compuesto por viruta de coco y turba en proporción de 70:30. Las letras diferentes indican que se presentaron diferencias significativas entre las pruebas (Kruskal-Wallis; p<0,05). GA3: ácido giberélico, Estrat.: estratificación fría por un mes
Por otra parte, el tiempo medio de germinación fue similar en tres de las especies y no hubo diferencias significativas en el tiempo medio de germinación (TMG) de cada espe cie: 33 días en E, corymbosa (K=0,90; p=0,82), 30 días en E, killipii (K=1,80; p=0,61) y 32 días en E, barclayana (K=5,59; p=0,23). En E. summapacis el TMG fue de nueve días (K=0,08; p=0,99).
Comparación entre la prueba de tetrazolio y la prueba de germinación
En la comparación se tuvo en cuenta el tratamiento que arrojó los mejores resultados en la prueba de germinación. En todas las especies se presentó una mayor viabilidad con la prueba de tetrazolio, con diferencias significativas en las pruebas (p<0,05) excepto en E. corymbosa, la cual no las registró (K=3,0; p=0,08) (Figura 4).
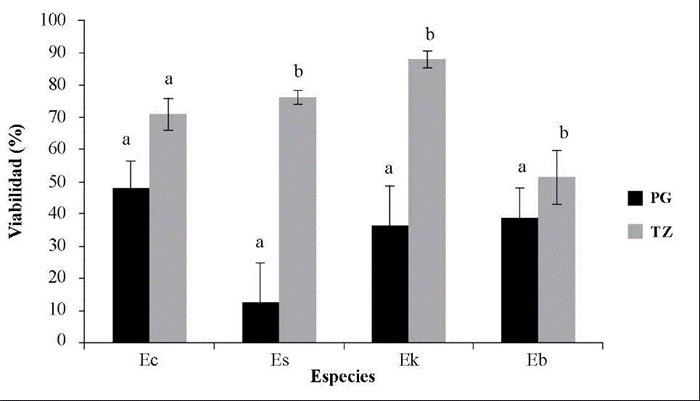
Figura 4 Comparación de la viabilidad evaluada con la prueba de germinación (PG) y con la prueba de tetrazolio (TZ). Ec: Espeletiopsis corymbosa, tratamiento de germinación en 400 ppm GA3; Es: Espeletia sumapacis, tratamiento de germinación de control; Ek: Espeletia killipii, tratamiento de germinación de control; Eb: Espeletia barclayana, tratamiento de germinación en sustrato de viruta de coco y turba en proporción de 70:30. Las verticales indican el error estándar. Las letras diferentes indican diferencias significativas entre la prueba de germinación y la de tetrazolio (Kruskal-Wallis; p<0,05).
Crecimiento
En general, las especies presentaron un crecimiento lento. En E. corymbosa fue de 0,25 cm a los cuatro meses, en E. summapacis de 0,82 cm, en E. killipii de 0,88 cm y en E. barclayana de 0,66 cm (Figura 5), con cuatro hojas verdaderas y sin que los cotiledones permanecieran en ninguna de las especies. En la figura 6 se muestran una plántula de cada especie 30 días después de la siembra.
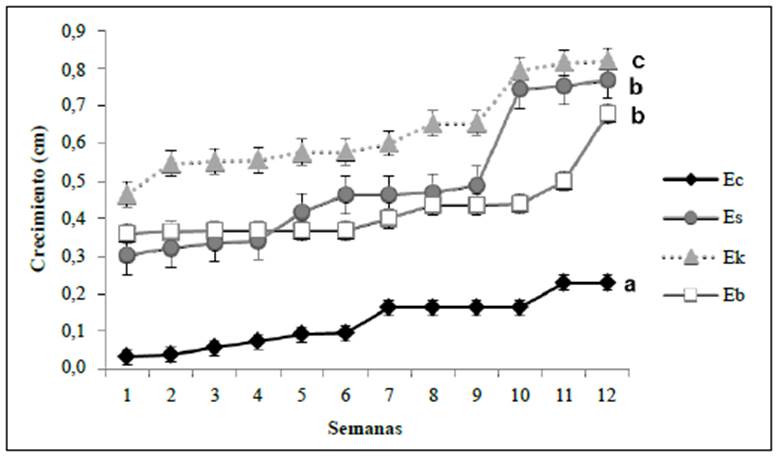
Figura 5 Curva de crecimiento de E. corymbosa (Ec), E. summapacis (Es), E. killipii (Ek), y E. barclayana (Eb), sembradas en sustrato bajo condiciones de invernadero. Las especies se sembraron en sustrato compuesto por tierra, turba y cascarilla en proporción de 60:20:20. En la especie E. barclayana se incluyó la siembra en un sustrato compuesto por viruta de coco y turba en proporción de 70:30. Las verticales indican el error estándar.
Supervivencia
Las especies presentaron una alta supervivencia cuatro meses después de la germinación: en E. corymbosa del 70 %, en E. summapacis del 67 % en E. killipii del 88 % y en E. barclayana del 90 % (Figura 6).
Discusión
Las características morfológicas de las especies en estudio concuerdan con la morfología de Espeletia uribei descrita por Gallego & Bonilla (2016), pues se observaron semillas pequeñas (2,06-3,85 x 0,85-1,40 mm), sin endospermo visible, con testas delgadas y quebradizas y embrión con cotiledones carnosos. La morfología de las semillas está rela cionada con la forma de dispersión, la colonización y el establecimiento. Según Velasco (2018), algunas especies de Espeletia son pioneras después de disturbios. El tamaño y el peso de las semillas pueden estar relacionados con la tolerancia a la desecación, ya que las semillas menos pesadas toleran la deshidratación sin perder la viabilidad, siendo esta característica importante si se quieren almacenar en bancos de semillas (Gold, et al., 2004; Correa, et al., 2013; Engels & Visser, 2003; Santos, et al., 2015; Romero-Saritama & Pérez-Ruiz, 2016). La morfología de las especies estudiadas puede ser indicio de que las semillas tienen un comportamiento ortodoxo frente a la desecación, sin embargo, esto debe corroborarse en ensayos de germinación con diferentes contenidos de humedad (Hong & Ellis, 1996).
En cuanto a la evaluación de la viabilidad con tetrazolio, es necesario acondicionar las semillas para garantizar el contacto de los embriones con el reactivo (Milosevic, et al., 2010), sin embargo, en las semillas de Espeletia basta con hacerles una pequeña ruptura, ya que la testa es quebradiza (Mancipe-Murillo, et al., 2018). En el presente estudio, la especie de menor viabilidad fue E. barclayana (51,6 %) y la de mayor viabilidad, E. killipii (88 %). Estos valores se encuentran dentro del rango de tinción encontrado por Mancipe-Murillo, et al., (2018) en cuatro especies de Espeletia bajo las mismas condiciones de prueba. Entre los aportes hechos por otros autores cabe mencionar que Velasco (2018) hizo la prueba en embriones de Espeletia curialensis Cuatrec., utilizando tetrazolio al 0,075 % a 22 °C teniendo una tinción del 100, 65 y 87 % en semillas de plantas provenientes de tres alturas diferentes. Asimismo, Bohórquez-Quintero, et al. (2016) hicieron la prueba de viabilidad en embriones de Espeletiapaipana S. y obtuvieron una viabilidad promedio de 29 %.
Por otro lado, el porcentaje de embriones en las especies en estudio fue inferior al 61 %, pero mayor que el obtenido por Velasco (2018) en semillas de E. curialensis var. exigua recolectadas en Tame, Arauca, en jurisdicción del Parque Nacional Natural El Cocuy, que en agosto y septiembre se encontraban vacías, en tanto que las recolectadas en noviembre presentaron un 5 % de embriones. En este sentido, se sabe que el porcentaje de embriones puede estar relacionado con la época de recolección y que en el caso de una floración temprana pueden corresponder a óvulos no fertilizados, en tanto que en la floración tardía podrían reflejar un estado de absorción temprana, lo que a su vez se relacionaría con la limitación de recursos y los daños por las heladas. Por ejemplo, los factores previos al evento reproductivo pueden generar una reducción de la energía asimilada en las hojas que finalmente se refleja en el fruto y las semillas; asimismo, pueden influir las lluvias y la polinización (que en el caso de las especies de Espeletia ocurre por la acción de los insectos), las cuales inciden en la producción y la calidad de las semillas (Vargas, 2016; Velasco, 2018). Esto es importante y debe tenerse en cuenta en los ensayos de germinación de especies del mismo género que presentan un alto porcentaje de semillas vacías para evitar errores en la evaluación de los reportes de germinación.
En el presente estudio se observó que al emplear giberelina (GA3), el valor más bajo de germinación se presentó en E. barclayana (0 %), en tanto que el valor más alto se obtuvo en E. corymbosa (48,1 %). Sin embargo, este tratamiento no fue el más efectivo para las demás especies evaluadas. En E. summapacis y E. killipii la mejor germinación ocurrió cuando no se aplicaron tratamientos pregerminativos y en E. barclayana el cambio de sustrato la favoreció (39 %). Estos valores fueron mayores que los reportados por Mancipe-Murillo, et al. (2018), quienes obtuvieron una germinación del 23 % en E. barclayana y del 24 % en E. killipii sembradas en condiciones de laboratorio (cajas de Petri con papel filtro, 20 °C de día y 10 °C de noche, fotoperiodo y termoperíodo de doce horas). Las germinaciones alcanzadas son buenas comparadas con las obtenidas por otros investigadores (Guariguata & Azocar, 1988; Mendoza & Martínez, 2011; Bohórquez-Quintero, et al., 2016; Araque-Barrera, et al., 2016; Velasco, 2018).
Según Velasco (2018), la germinación en laboratorio de especies de alta montaña es baja, lo que se relaciona con las condiciones ambientales en estas zonas: se han observado porcentajes de germinación en especies endémicas de Espeletia en la cordillera Oriental que oscilan entre 10 y 20 % y, además, la corta duración de la estación favorable para la germinación en campo hace que las semillas no germinen de manera inmediata.
Es importante considerar que las semillas que germinan de forma inmediata y sin crónica no requieren formar un banco de semillas en el suelo, en tanto que las semillas que requieren tratamientos pregerminativos serían capaces de crear un mecanismo de latencia o permanecer en el suelo hasta que se presenten las condiciones adecuadas para su germinación y establecimiento (Cavieres, 1999; Figueroa & Cárdenas, 2015; Velasco, 2018; Romero-Saritama & Pérez-Ruiz, 2016; Mancipe-Murillo, et al., 2018).
Hay muy pocos estudios sobre la germinación de las especies de Espeletia.Mendoza & Martínez (2011) sembraron Espeletia conglomerata A.C. Sm. al voleo y registraron la germinación de la primera semilla a los 40 días. Velasco (2018) hizo ensayos de germinación de E. curialensis var. exigua Rodr-Cabeza y S. Díaz recolectada en el Parque Nacional Natural El Cocuy, flanco oriental de la cordillera Oriental, en tres épocas diferentes y no hubo germinación. Guariguata & Azocar (1988) estudiaron la dinámica del banco de semillas y la ecología de la germinación de Espeletia timotensis en el páramo de las cruces en Mérida, Venezuela; el estudio arrojó una germinación (en laboratorio) de 80 % con luz y 67 % en la oscuridad, mayor que la registrada en campo, con un porcentaje de germinación del 17 % y una mortalidad del 30 %.
También se han hecho estudios de la propagación de los frailejones in vitro.Bohórquez-Quintero, et al. (2016) trabajaron en la propagación in vitro de Espeletiapaipana S. Díaz y Pedraza: sembraron 1.160 embriones, de los cuales solo germinaron 90 (8 %), valor inferior al obtenido en el presente estudio, lo que evidenció la baja capacidad germinativa in vitro.
Por otro lado, Rache & Pacheco (2009) trabajaron en la generación de un protocolo de micropropagación de Espeletiopsis muiska (Cuatrec.) Cuatrec. en medio de cultivo Murashige y Skoog y obtuvieron una germinación del 91 % de los embriones sin agre gar reguladores de crecimiento, en tanto que Araque-Barrera, et al. (2016) hicieron ensayos para generar un protocolo de micropropagación de Espeletiopsis rabanalensis en condiciones in vitro y obtuvieron una baja germinación de embriones (8,9 %) en medio Murashige y Skoog (MS/4) y adición de 1 mg/L de giberelinas (GA3).
En las pruebas de germinación es importante determinar el número de semillas que, a pesar de ser viables, no germinan. Una forma de hacerlo es mediante la comparación de la viabilidad obtenida con la prueba de germinación y con la de tetrazolio. La de la prueba de germinación puede ser menor que la del tetrazolio debido a que las semillas con latencia no germinan, pero se consideran las semillas o embriones vivos independientemente de si tienen o no latencia. En caso de que la viabilidad con tetrazolio sea menor que la de la prueba de germinación, es necesario hacer ajustes en la de tetrazolio (Mancipe-Murillo, et al., 2018).
Las semillas de las especies en estudio presentaron una viabilidad mayor con la prueba en tetrazolio (Figura 4), lo que indicaría que las semillas presentan algún tipo de latencia, posiblemente fisiológica, que es de las más frecuentes y ha sido reportada en el orden (Baskin & Baskin, 2004, 2014); sin embargo, con los tratamientos aplicados en las pruebas de germinación no fue posible evidenciar esto. Solo en la especie E. corymbosa se evidenció una mayor germinación al adicionar 400 ppm de GA3. En pruebas realizadas por Mancipe-Murillo, et al. (2018) también se registró una mayor viabilidad con la prueba de tetrazolio en algunas especies de Espeletia. Es necesario hacer más pruebas de germinación variando las condiciones de siembra de las semillas y evaluando, por ejemplo, la temperatura, ya que las condiciones de siembra utilizadas pudieron no haber sido las adecuadas para las especies (Godefroid, et al., 2010). En los páramos se presenta una alta radicación, que es constante por la ubicación en la línea del ecuador, y la temperatura es variable, pues depende del gradiente altitudinal y de la humedad del aire, y está determinada por el clima local con variaciones de temperatura de 20 °C en el curso del día y bajas temperaturas en la noche (Buytaert, et al., 2006).
Las especies evaluadas presentaron un lento crecimiento en su fase de plántulas, con una altura máxima de 0,88 cm en cuatro meses. Por su parte, Mendoza & Martínez (2011) reportaron un crecimiento de 3 a 5 cm en Espeletia conglomerata un año después del trasplante de las plántulas a bolsas con un sustrato de arena, tierra y capote de frailejón en una proporción de 50:25:25. Es importante considerar que el crecimiento de las plantas puede variar según su estado fenológico; según Fagua & Gonzáles (2006), en Espeletia grandiflora el crecimiento disminuye con la edad del individuo, ya que en las plantas jóvenes los nutrientes son usados para el crecimiento vegetativo y en las adultas para la formación de estructuras reproductivas, lo que se ve influenciado, a su vez, por las con diciones medioambientales. Por ejemplo, Venegas (2011) encontró que la elevación influía en la producción de hojas en E. grandiflora, siendo menor la producción a mayor altitud, aunque otros autores señalan que la biomasa aumenta porque hay menos relaciones de competencia y depredación.
En el presente estudio se registró una elevada supervivencia de las plántulas: entre el 67 y el 90 %. Rache & Pacheco (2009) sembraron plántulas provenientes de ensayos de germinación in vitro en un sustrato compuesto por tierra de capote y obtuvieron una supervivencia del 60 %. Mendoza & Martínez (2011) hicieron estudios de germinación en sustrato de E. conglomerata y obtuvieron una supervivencia del 84 % al trasplantar las plántulas a bolsa después de su germinación. La supervivencia de las plantas depende en gran medida de la calidad del sustrato empleado, su porosidad y textura, que determinan la retención de agua y el intercambio de gases del sistema radical, así como de la adición de nutrientes y la frecuencia de riego (Rodríguez, 2010; Gutiérrez-Castorena, et al., 2011; Valenzuela, et al., 2014; Morales-Maldonado & Casanova-Lugo, 2015; Tintinaco, 2019). Asimismo, es importante tener en cuenta el estado fitosanitario de las especies, pues según García-Castañeda, et al. (2015), en el frailejón Espeletia grandiflora Bonpl. se evidenció que en las etapas iniciales del desarrollo de las plántulas los fitopatógenos afectaron su supervivencia en vivero.
El determinar con precisión las condiciones específicas para la germinación, creci miento y desarrollo de los frailejones es un proceso bastante complejo en el que intervienen numerosas variables que seguramente guardan una estrecha relación con las condiciones naturales muy particulares de los ecosistemas paramunos en los que subsisten estas espe cies (Mendoza & Martínez, 2011).
Los ecosistemas de páramo son únicos de la alta montaña y se consideran islas bio-geográficas desde Venezuela hasta el norte de Perú. Se localizan solo en Ecuador, Perú, Venezuela, Costa Rica y Colombia, país donde se encuentra el 50 % de los páramos del mundo. Estos ecosistemas presentan una singularidad biológica y son muy importantes por los servicios ecosistémicos que prestan, entre ellos, la provisión continua de agua y el almacenamiento de carbono atmosférico (Morales, et al., 2007; González-Benito & Martin, 2011).
El presente estudio constituye un aporte al conocimiento de la germinación, creci miento y supervivencia en sustrato de E. corymbosa, E. summapacis, E. killipii y E. barclayana, especies características de los ecosistemas de páramo que están siendo afectadas por las diferentes actividades humanas hasta el extremo de que E. killipii y E. corymbosa se encuentran amenazadas (Avila, et al., 2020). En consecuencia, la información aquí presentada es un referente para la propagación y conservación de estas especies, aunque es necesario continuar investigando para encontrar las mejores condiciones para su propagación. La siembra de E. barclayana en un sustrato compuesto por viruta de coco y turba en proporción de 70:30 arrojó los mejores resultados de germinación, por lo cual se recomienda continuar probando este sustrato combinado con otros tratamientos en la propagación de frailejones.
Conclusiones
Las semillas de E. corymbosa, E. summapacis, E. killipii y E. barclayana tienen una morfología similar: son pequeñas, sin endospermo visible, testas delgadas quebradizas y embrión con cotiledones carnosos. Presentan altos porcentajes de semillas vacías, de 39 a 65 %, valores que deben tenerse en cuenta en las pruebas de germinación y de tetrazolio.
La viabilidad obtenida en la prueba germinación fue menor que en la de tetrazolio, lo que indicaría que las semillas presentan algún tipo de dormancia, probablemente fisiológica, aunque esto no se pudo evidenciar con las pruebas realizadas en el presente estudio, por lo que es necesario variar las condiciones de germinación, entre ellas, la temperatura, pues la prueba de viabilidad con tetrazolio indica que las semillas tienen un mayor potencial de germinación.
El crecimiento E. corymbosa, E. summapacis, E. killipii y E. barclayana es lento, pero la supervivencia es alta y llega a ser hasta del 90 %, por lo que si se recolectan semillas de calidad en el momento adecuado se puede tener una buena producción de plántulas de estas especies en vivero.