Introducción
La tecnología actual requiere el empleo de grandes cantidades de metales preciosos que son extremadamente útiles por sus excepcionales propiedades químicas y físicas. Metales como el oro (Au), el platino (Pt), el paladio (Pd) y la plata (Ag) se utilizan en los dispositivos electrónicos y en la industria química como catalizadores en reacciones para la obtención de productos de alto valor comercial, sanitario o industrial (Fotoohi & Mercier, 2015; Braibant, Bourgeois, Meyer, 2018). Su relativa escasez, elevado costo y creciente demanda en varios sectores de la industria han llevado a los investigadores de diversos campos a dedicar sus esfuerzos a la recuperación de metales, por lo que los métodos para su extracción a partir de soluciones acuosas han cobrado gran importancia en las últimas décadas.
Los métodos más comúnmente utilizados para la recuperación de metales a partir de soluciones acuosas son la extracción con disolventes y la precipitación química. En el caso específico del oro, los sistemas tradicionalmente usados han sido la lixiviación con cianuro de sodio y la extracción con mercurio. La primera se ha empleado durante más de 100 años, pero el cianuro es muy tóxico y la elevada cantidad de residuos debidos a fugas y derrames accidentales tiene gran impacto en el medio ambiente, principalmente en los ríos (Hilson & Monhemius, 2006). En cuanto al mercurio, el estado colombiano ha prohibido su uso para la extracción de oro por los graves problemas sanitarios y ambientales que genera.
En este contexto, se han desarrollado nuevas estrategias económicamente viables, ami gables con el medio ambiente y funcionalmente eficientes para la extracción de metales (Gohil, et al., 2006; Tan, et al., 2017; Ata, et al., 2008; Hosseini, et al., 2010; Fu & Wang, 2011; Wang, et al, 2017; Judd, 2017). En los estudios recientes en busca de alternativas a la extracción de la hidrometalurgia convencional se destacan dos procesos que cobran cada vez más relevancia: el primero es el uso de tiourea y tiousulfato para la extracción selectiva de oro (Zhang, et al., 2014) y el segundo es el empleo de membranas y absorbentes fabricados con polímeros que contienen agentes quelantes. Esta última alternativa ha llamado la atención debido a su alta selectividad y eficiencia en términos del porcentaje de extracción de metales a partir de soluciones acuosas. Además, las membranas presentan la ventaja de ser fáciles de manejar y generan una cantidad significativamente menor de residuos en comparación con los métodos convencionales, pueden ser usadas en varios ciclos y su selectividad se puede modificar según el agente quelante o los grupos funcionales incorporados (Tofan, et al., 2017).
Hay pocos estudios sobre membranas poliméricas complejantes de metales que hayan sido sintetizadas de tal forma que contengan un grupo funcional por unidad monomérica. Villalobos (2014) sintetizó politiosemicarbazida en la fabricación de una membrana para la extracción de oro. Cada unidad monomérica de este polímero contiene dos grupos tiosemicarbazida que forman un sitio activo con una eficiencia de extracción mayor al 97 % empleando la membrana en procesos de permeación impulsada por presión.
En estudios sobre la recuperación de metales a partir de la chatarra electrónica, Kubota & Kono (2019) utilizaron N-[N,N-di(2-etilhexil) aminocarbonilmetil] glicina como extractante en membranas poliméricas de inclusión (MPI) para la extracción de Au3+ a partir de una solución de 2 M de ácido clorhídrico y lograron un porcentaje de extracción del 96 %. Aunque se han reportado porcentajes de extracción altos con este tipo de membranas, tienen problemas de estabilidad y vida útil debido a la pérdida de materiales y la degradación de sus componentes durante el uso, lo que las hace costosas para la implementación a gran escala (Song, et al., 2018).
En otros estudios (Monier, et al., 2014) se ha podido establecer que la selectividad de un agente extractante frente a un ion metálico en particular, se relaciona con el tamaño y la carga del ion que se extrae. No obstante, un extractante debe mantener características básicas, como la presencia de heteroátomos con pares electrónicos libres apropiadamente distribuidos en la estructura molecular, que permitan la formación de complejos de los iones metálicos de interés.
Los heteroátomos presentes en el agente complejante generan una cavidad cuyo tamaño depende de la distribución, las distancias y la movilidad de los grupos que los contienen. El tamaño de la cavidad permite seleccionar iones metálicos que, por el tamaño de su radio iónico, se ajusten y puedan formar un complejo con relativa estabilidad. Sin embargo, cuanto mayor sea la carga del ion metálico, el complejo formado será más estable debido, probablemente, a que reciben con mayor facilidad los pares electrónicos del ligando en comparación con los iones metálicos de menor carga.
Estos nuevos materiales deben ser sintetizados y probados para obtener una completa extracción de metales de alto valor económico y, además, su uso puede extenderse a pro cesos de purificación del agua. En este estudio se sintetizó y se analizó un nuevo polímero extractante con grupos funcionales amino, imino e hidroxilo para fabricar membranas y determinar su selectividad y eficiencia en la extracción de oro a partir de soluciones acuosas.
Materiales y métodos
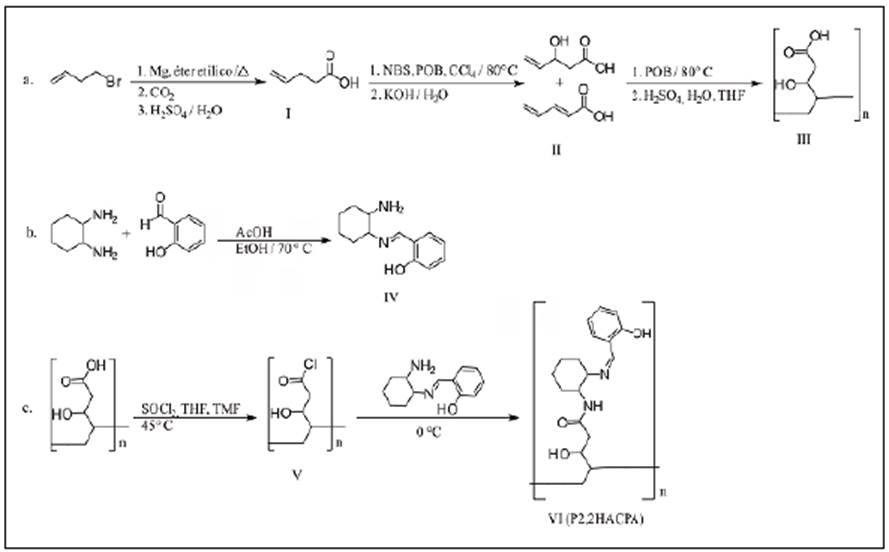
Los materiales y reactivos, así como el procedimiento para la obtención de poli-N-(2-((2-hidroxibenciliden) amino) ciclohexil)-4-pentenamida (P2,2HACPA) y su ruta de síntesis, se presentan en la figura 1. Esta sustancia se utilizó posteriormente en la extracción selec tiva de oro como se describe en el material suplementario.
Fabricación de las membranas para extracción de Au 3+
Se empleó P2,2HACPA para la fabricación de las membranas posteriormente empleadas en la extracción de oro a partir de disoluciones acuosas del metal. Los componentes usados en la fabricación de las membranas fueron: P2,2HACPA, entre 20 y 50 %, como extractante; policloruro de vinilo (PVC), entre 24 y 60 %, como material estructural, y 2-nitrofenil octil éter (NPOE), entre 24 y 47 %, como plastificante. Los porcentajes se calcularon con base en un peso total de 0,5 g de membrana. Con el fin de mejorar el intercambio de iones metálicos entre la solución de trabajo y las membranas, en algunas de ellas se incorporó entre 2,9 y 4,8 % de Na-TFBa como sal intercambiadora. En este caso se esperaba que el ion Na+ saliera de la membrana hacia la solución, en tanto que los iones Au3+ ingresarían desde la solución a la membrana. La composición se varió hasta lograr un material apropiado para obtener un elevado porcentaje de extracción del ion metálico de interés, pero también la consistencia, la facilidad de manipulación y la resistencia adecuadas con respecto a la presión ejercida por las soluciones de trabajo. Todos los componentes de la membrana se disolvieron en 2 mL de tetrahidrofurano (THF) y se mezclaron hasta obtener un sistema homogéneo. La solución se esparció sobre una superficie de vidrio y se dejó en reposo durante 24 horas a temperatura ambiente, con el fin de eliminar por completo el disolvente. Con el mismo procedimiento se prepararon membranas de 50, 100 y 200±5 µm de espesor medidos con un calibre de Vernier para evaluar el efecto de este parámetro sobre el porcentaje de extracción de Au3+.
Extracción de oro con las membranas fabricadas
Se construyeron dos celdas cúbicas de polipropileno con capacidad de 85 cm3 cada una (Figura 1S,https://www.raccefyn.co/index.php/raccefyn/article/view/938/2824). En una celda se adicionaron 75,0 mL de solución de partida de Au3+ en forma de ácido cloro-áurico 5x10-4 M (solución donadora). En la otra celda se adicionaron 75,0 mL de solución de 0,1 M de KNO3 (solución receptora). En las dos celdas se ajustó el pH a 4,0 con una solución de 2,5 M de hidróxido de potasio en la solución donadora y con 2,5 M de ácido clorhídrico en la solución receptora. Las dos celdas se conectaron mediante un tubo de PVC de 1,50 cm de diámetro en el cual se incrustó una sección de la membrana sintetizada del mismo diámetro que sirvió como barrera entre las dos soluciones. El sistema se mantuvo en contacto durante 108 horas con agitación magnética a 600 rpm. Cada 12 horas se tomaron alícuotas de 2,00 mL de la solución donadora y de la solución receptora. Las alícuotas se diluyeron hasta 10,00 mL con una solución de 0,1 M de KNO3 a un pH de 4,0 y sin más tratamiento se introdujeron en el espectrofotómetro de absorción atómica, con el fin de determinar la concentración de Au3+ en cada solución.
Para evaluar la vida útil de la membrana, se llevaron a cabo tres ciclos de extracción de Au3+ con una duración de 108 horas por ciclo. Para la recuperación de la membrana entre ciclos, se agregó una solución de 0,2 M de tiourea y 1 M de HCl en agitación magnética a 600 rpm durante una hora para lixiviar el oro retenido.
Efecto del pH de las soluciones en la membrana
Para determinar el efecto del pH de las soluciones, se colocó la membrana en medio de las dos celdas como se indicó anteriormente. En cada celda se adicionaron 75,0 mL de solución de 0,1 M de KNO3 y se ajustó el valor del pH a 6,0. Con el fin de comparar el comportamiento del sistema en presencia y ausencia de tampón, el valor del pH se ajustó inicialmente con 0,05 M de ácido 2-(N-morfolino)-etanosulfónico (MES) y ácido clorhí drico, en tanto que en otra serie de experimentos se empleó solamente una solución de 2,5 M de ácido clorhídrico. A cada lado de la membrana se puso un electrodo de referencia de Calomel. Los electrodos de referencia se conectaron a un medidor de pH Orion Star™ A211 Thermo Scientific™ bajo agitación constante y se midió el potencial de la membrana cada 5 segundos. Se disminuyó el valor de pH de una de las soluciones en una unidad cada 20 minutos hasta llegar a un valor de pH de 1,0 utilizando una solución de 2,5 M de ácido clorhídrico y registrando continuamente el potencial de la membrana.
Evaluación del grado de selectividad de la membrana
Se evaluó el grado de selectividad de la membrana con respecto a siete iones metálicos comunes en soluciones acuosas o que pueden tener algún grado de interferencia con Au3+. Para ello se empleó la membrana de mejor desempeño en la extracción de oro. En una de las celdas de trabajo se adicionaron 75,0 mL de solución de 0,1 M de KNO3 con los iones Au3+, Cu2+, Pb2+, Ca2+, Zn2+, Fe3+, Ni2+ y Al3+, cada uno en una concentración de 1x10-4 M y un pH ajustado a 4,0 usando 2,5 M de hidróxido de potasio. En el otro compartimiento se agregó una solución de 0,1 M de KNO3 con un pH ajustado a 4,0 utilizando 2,5 M de ácido clorhídrico y se mantuvo la agitación magnética a 600 rpm durante 72 horas. Se tomaron alícuotas de 5,0 mL al inicio y al final del proceso y se diluyeron en un volumen de 10 mL con agua desionizada. Se determinó la variación de la concentración de cada uno de los iones metálicos en las dos disoluciones mediante espectrofotometría de absorción atómica y con los resultados obtenidos se determinó la selectividad de la membrana hacia Au3+ comparada con los demás iones.
Resultados y discusión
Caracterización del P2,2 HACPA y los intermediarios
Acido 4-pentenoico (I). Líquido de color amarillo claro. IR (ATR): λ (cm1) 2400-3100 (st, OH), 1709 (st, C=O), 1415 (d, C-H), 1257 (st, C-O), 910 (d, OH), 1641 (st, C=C), 3079 (st, C=C-H), 933 (d, C=C-H), 2978 (st.asym, CH2), 2926 (st.asym, CH2), 1415 (d, C-H). MS-IE: (m/z) 100,06 (C5H8O2+ [M+]), 82,07 (C5H6O1+), 55,11 (C4H7+bp), 41,09 (C3H5+). RMN 1H (400 MHz, THF): δ (ppm) 8,3 (s,1H, OH), 5,8 (m, 1H, CH), 5 (d, 2H, CH2), 2,43 (t, 2H, CH2), 2,37 (dt, 2H, CH2). RMN 13C (400 MHz, THF): δ (ppm) 178 (-OH), 33 (C-2), 28,6 (C-3), 136 (C-4), 116 (C-5).
Acido 3-hidroxi-4pentenoico/ácido 2,4-pentadienoico (II). Líquido viscoso de color naranja: IR (ATR): λ (cm-1) 3489 (st, CH2-OH), 1709 (st, C=O), 2400-3100 (st, OH), 1260 (st, C-O), 914 (d, OH), 1640 (st, C=C), 1043 (d, CH2-OH), 1414 (d, C-H). MS-ES: (m/z) 115,97 (C5H8O3+ [M+]), 114,97 (C5H7O3+), 97,97 (C5H6O2+ [M+]).
Poli (ácido-3-hidroxi-4-pentenoico) (III). Líquido altamente viscoso de color marrón oscuro: IR (ATR): λ (cm-1) 3450 (st, CH2-OH), 1705 (st, C=O), 2300-3100 (st, OH), 1258 (st, C-O), 914 (d, OH), 1065 (d, CH2-OH), 2917 (st.asym, CH2), 2849 (st.asym, CH2), 1451 (d, C-H). MS-ES: (m/z) 1359, 1584, 2035, 2451, 3038, 3464, 3553, 3916, 3967.
2-(((2-aminociclohexil) imino) metil) fenol (IV). Líquido de color amarillo claro: IR (ATR): λ (cm-1) 3418 (st, N-H), 1350 (st, C-N), 1629 (st, C=N), 3070-3600 (st, OH), 1274 (d, NH), 2855 (st.sym, CH2), 2926 (st.asym, CH2. RMN 1H (400 MHz, DMSO): δ (ppm) 8,7 (s, 1H, CH), 5,3 (s, 1H, OH), 6,8 (m, 2H, CH2), 3 (s, 2H, NH2) RMN 13C (400 MHz, THF): δ (ppm) 161 (C-1), 118 (C-2), 134 (C-3), 120 (C-4), 134 (C-5), 124 (C-6), 160 (C-7), 67 (C-8), 29 (C-9), 25 (C-10), 25 (C-11), 33 (C-12), 53 (C-13).
P2,2HACPA (VI). Líquido altamente viscoso de color marrón: IR (ATR): λ (cm1) 3455 (st, CH2-OH), 1202 (d,-OH), 2917 (st.asym, CH2), 2849 (st.sym, CH2), 1451 (d, C-H), 1579 (st, C=O), 1629 (st, C=N). RMN 1H (400 MHz, DMSO): δ (ppm) 5,8 (s, 1H, NH), 5,1 (s, 1H, OH). RMN 13C (400 MHz, THF): δ (ppm) 165 (C-5), 160 (C-8) 70 (C-3)161 (C-9). MS-ES: (m/z) 3995.
La caracterización mediante espectroscopía IR (Figura 2S,https://www.raccefyn.co/index.php/raccefyn/article/view/938/2825) del compuesto I mostró una banda amplia y característica de estiramiento del OH del carboxilo entre 3.100 y 2.400 cm-1, de 1.709 cm-1 de estiramiento del C=O, de 1.257 cm-1 de estiramiento del C-O del grupo carboxilo y de 910 cm-1 de deformación del OH. Se observaron claramente bandas características de un doble enlace terminal a 1.641 cm-1 del estiramiento del doble enlace (C=C), y a 3.079 y 993 cm-1 de estiramiento y deformación, respectivamente, del C-H de un doble enlace terminal. La caracterización por resonancia magnética nuclear confirmó la presencia de un grupo carboxilo y un grupo vinilo (Figuras 3S,https://www.raccefyn.co/index.php/raccefyn/article/view/938/2826y 4S,https://www.raccefyn.co/index.php/raccefyn/article/view/938/2827), en tanto que el espectro de masas (Figura 5S,https://www.raccefyn.co/index.php/raccefyn/article/view/938/2828) evidenció un pico de ion molecular de 100 m/z.
Mediante espectroscopía IR se comprobó la formación de un alcohol (Figura 6S,https://www.raccefyn.co/index.php/raccefyn/article/view/938/2829) en el compuesto II, encontrándose una banda ancha y característica del estiramiento de un grupo alcohol a 3.489 cm-1. Mediante espectroscopía de masas usando ionización por electronebulización se encontraron las especies con M+=116 y M+=98, lo que sugiere la formación de dos pro ductos (Figura 7S,https://www.raccefyn.co/index.php/raccefyn/article/view/938/2830): uno por reacción de eliminación de E2 y otro por sustitución nucleofílica de SN2.
Después de la polimerización vía radicalaria con peróxido de benzoilo (POB) como iniciador de la reacción, se detectó la presencia de dobles enlaces en el compuesto corres pondientes al compuesto obtenido por la ruta de la reacción de E2 en el paso anterior. Para obtener un polímero con grupos hidroxilo únicamente en la posición beta del ácido carboxílico fue necesaria una hidratación del grupo alqueno utilizando ácido sulfúrico, agua y tetrahidrofurano (THF) como solvente. En el espectro IR (Figura 8S,https://www.raccefyn.co/index.php/racceíyn/article/view/938/2831) se observó que, después del tratamiento con ácido sulfúrico, las bandas correspondientes al doble enlace (1.641 cm-1) desaparecieron y aumentó la banda característica del grupo alcohol.
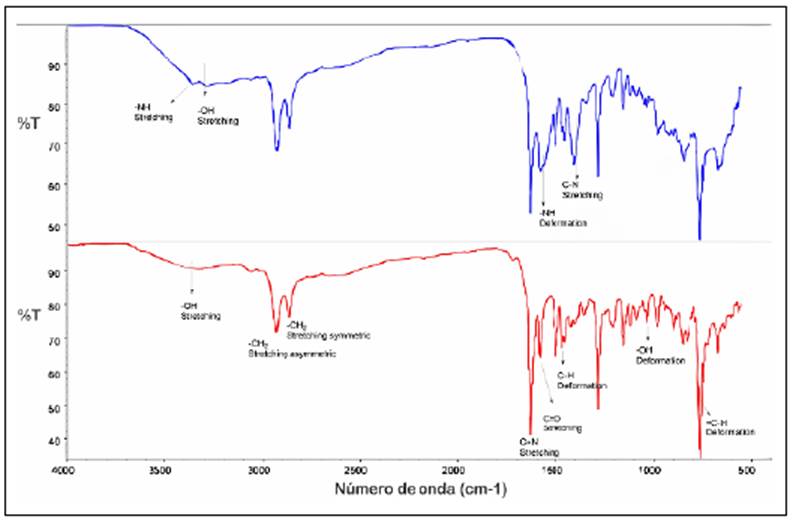
La obtención del compuesto IV se confirmó por espectroscopía IR (Figura 2). Se aprecia la formación de un grupo imina representado en la señal a 1.629 cm-1, característica de un grupo C=N, y entre la región de 3.070 cm-1 a 3.600 cm-1, la banda del grupo OH junto con bandas características de una amina primaria. Al comparar el espectro IR del compuesto IV con el del compuesto VI fue evidente que las señales cercanas a los 3.350 cm-1 del grupo amino desaparecieron debido a la formación del grupo imino. En la RMN-1H (Figura 9S,https://www.raccefyn.co/index.php/raccefyn/article/view/938/2832) y la RMN-13C (Figura 10S,https://www.raccefyn.co/index.php/raccefyn/article/view/938/2833) se evidenció la obtención de un grupo amida e hidroxilo con los desplazamientos característicos de la estructura de la molécula planteada. En el espectro MS obtenido con ionización ES (Figura 11S,https://www.raccefyn.co/index.php/raccefyn/article/view/938/2834) se observaron valores de masa altos, con un máximo de 3.967 m/z debido a la limitación del instrumento.
Extracción de Au 3 +
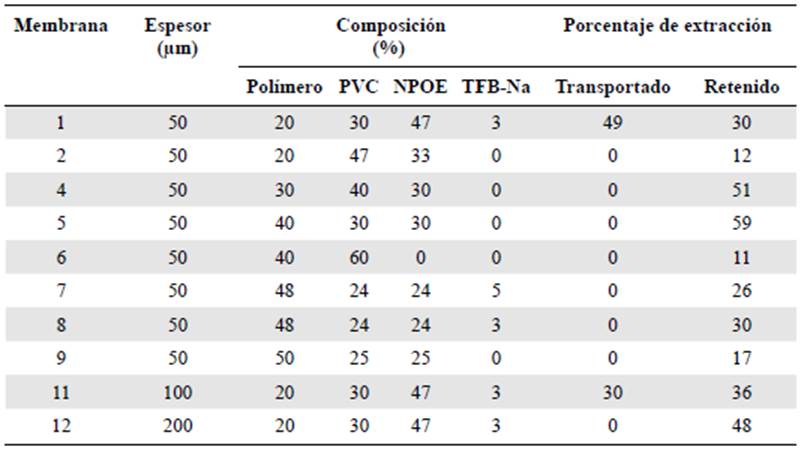
En la fabricación de las membranas se usó el polímero sintetizado, el cual genera los sitios activos de interacción con los iones de Au3+. La composición y el espesor de las membra nas fabricadas, así como el porcentaje de extracción de oro, se presentan en la tabla 1. El porcentaje de extracción corresponde a la suma del porcentaje de metal transportado desde la solución donadora hacia la solución receptora más el porcentaje de metal retenido en la membrana. Este último se determinó después de la lixiviación del metal con una solución de 1,5 M de tiourea a un pH de 4,0.
Tabla 1 Porcentajes de extracción de oro empleando membranas fabricadas con diferente compo sición y espesor
Con la membrana 1 los resultados obtenidos mediante espectrofotometría de absor ción atómica indicaron la presencia de oro en ambas fases; en la figura 3 se observa cómo la concentración final de iones de oro en la fase receptora (solución inicialmente libre de Au) fue de 49 %, y en la fase donadora (solución con 100 ppm de Au al inicio del experimento) fue de 21 %, lo que sugiere que en las primeras horas se generó un gradiente de concentración a través de la membrana que permitió el transporte. Más allá de las 72 horas, la concentración en la fase receptora se mantuvo constante, lo cual sugiere que el transporte de iones a través de la membrana hacia la solución receptora se detuvo, probablemente porque los sitios activos se saturaron con los iones de oro y se favoreció el proceso de retención en la misma membrana. El cambio de coloración de marrón a rosa de la membrana también evidenció que los iones extraídos de la solución donadora se acumularon sobre la misma membrana. Este fenómeno de retención puede considerarse otra forma eficiente de extracción. La recuperación de la membrana se hizo mediante lixiviación del oro retenido sumergiendo la membrana durante una hora en una solución de 1,5 M de tiourea a un pH de 4,0 en agitación magnética. La suma de las cantidades de oro determinadas tanto en la solución receptora como en la superficie de la membrana permitió establecer que se había alcanzado una extracción del 78,6 % del oro contenido en la fase donadora. Por ello, se estableció que la membrana de composición 1 generó un alto porcentaje de extracción de oro comparado con los porcentajes que se obtienen con técnicas tradicionales como la cianuración, que no supera el 50 % de extracción a menos que se cumplan numerosos pasos para aumentar dicho valor (Syed, 2012).
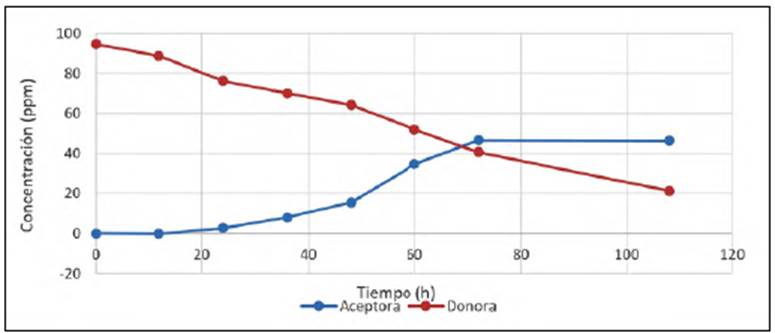
Figura 3 Variación de la concentración en la fase receptora y en la fase donadora en relación con el tiempo (108 h) con la membrana de composición 1.
A diferencia de lo encontrado con la membrana 1, la membrana de composición 2 no generó transporte de Au3+ hacia la solución receptora, en tanto que la concentración del metal en la solución donadora disminuyó 15 %. No obstante, la retención de oro por parte de la membrana alcanzó el 12 % con respecto a la concentración inicial de la fase donadora, lo que sugiere que la presencia del Na-TFB es necesaria para generar una especie de transporte facilitado a través de la membrana, ya que al ser una sal, su estructura per mite el intercambio iónico y tiene un posible efecto sinérgico con el polímero sintetizado, lo cual facilita el ingreso del ion desde la solución donadora al interior de la membrana, en tanto que el polímero genera los sitios activos de interacción permitiendo el movimiento de los iones hacia la solución receptora.
La membrana de composición 3, fabricada sin P2,2HACPA, generó un porcentaje de extracción de solo 3 % del oro contenido en la solución donadora, el cual no fue trans portado a la solución receptora. Luego del proceso de lixiviación con solución de tiourea se recuperó el 2 % del metal, lo cual evidencia que la extracción observada con las mem branas 1 y 2 se debe a la presencia de P2,2HACPA en el material.
El aumento del contenido de P2,2HACPA (membranas 4 y 5) permitió aumentar el porcentaje de extracción de oro sin que hubiera transporte hacia la solución receptora, lo que presuntamente se debió a la ausencia de Na-TFB. En estas membranas se observó una relación proporcional entre el porcentaje de extracción y la cantidad de polímero, ya que al aumentar el porcentaje de P2,2HACPA aumentaron los sitios activos de interacción con los iones de oro y, por lo tanto, hubo un mayor porcentaje de metal retenido en compara ción con el observado al emplear la membrana 1, que contenía solo 20 % de P2,2HACPA. Se debe recordar que el Na-TFB se empleó como una alternativa para mejorar el intercam bio iónico entre la solución donadora y la membrana. Sin embargo, el intercambio iónico también ocurrió en ausencia de Na-TFB.
Es evidente, asimismo, que la ausencia del plastificante en la membrana 6 causó una considerable disminución del porcentaje de oro extraído, a pesar de contener el 40 % del polímero sintetizado, lo que se debió a la excesiva rigidez y pérdida de homogeneidad de la estructura y confirma que, para este tipo de membranas, es indispensable usar un plastificante que permita mejorar las propiedades de resistencia mecánica y de plasticidad y que, conjuntamente con el polímero, proporcionen las condiciones apropiadas para alojar y, si es el caso, transportar las especies de interés.
Las membranas 7, 8 y 9 presentaron un cambio significativo en la elasticidad al aumentar el porcentaje de polímero hasta cerca del 50 %. El bajo contenido de PVC generó membranas con tendencia a fluir y, por lo tanto, difíciles de manipular. Las membranas con esta misma composición, pero de mayor espesor, se dejaron manipular mejor. Sin embargo, a pesar de su alto contenido de P2,2HACPA, el porcentaje de extracción de oro fue significativamente menor que el obtenido con las membranas precedentes.
En cuanto a la influencia del espesor de la membrana sobre el porcentaje de extrac ción, se registró una relación inversamente proporcional, ya que al aumentar el espesor de la membrana disminuyó el porcentaje de extracción. No obstante, es importante señalar que la cantidad de oro retenido en la membrana aumentó con el espesor, en tanto que la cantidad de oro transportado a la solución receptora disminuyó con ese mismo factor, lo que evidenció que la difusión del metal a través de la membrana se hizo a una velocidad relativamente baja y al cabo de 72 horas de contacto no alcanzó a atravesar la membrana de 200 micrómetros, en consecuencia, la concentración de oro en la solución receptora estuvo por debajo de los límites de detección cuando se emplearon membranas de ese espesor. Según lo planteado por Benavente (1998), el Na-TFB puede estar parcialmente retenido en la matriz polimérica debido a la interacción iónica entre los grupos cargados negativa mente y algunos grupos protonados del polímero; así, el agente transportador pudiera estar presente en el interior de la membrana tanto en forma libre como enlazado iónicamente, por lo cual, al aumentar el espesor de la membrana, disminuye el flujo del transportador así como el porcentaje de oro transportado. En el presente estudio se confirmó que tanto la composición como el espesor de la membrana tienen un efecto significativo en la interac ción con los iones de oro y su respectivo porcentaje de extracción y se logró fabricar una membrana 1 con espesor de 50 µm con la cual el porcentaje de extracción de oro fue del 79 %. Estos resultados son prometedores en cuanto a la síntesis de nuevos materiales y el diseño de métodos alternativos para la extracción de oro.
Por otro lado, es importante establecer la posibilidad de reutilizar la membrana, es decir, su comportamiento en varios ciclos de extracción de oro, ya que según la literatura especializada (Mora-Tamez & Rodríguez de San Miguel, 2014) esta es una de las principales ventajas de este tipo de materiales. Se llevaron a cabo tres ciclos de extracción de 108 horas con la misma membrana (membrana 1) y bajo las condiciones de lixiviación ya mencionadas. En el primer ciclo se obtuvo un 78 % de extracción de oro y en el tercero, 76 %, lo que evidencia que la membrana puede soportar cerca de 324 horas (3 ciclos de 108 h cada uno) de uso en los procesos de extracción sin que se modifique significativamente el porcentaje de extracción de oro.
En un estudio se reportaron agentes extractantes como el N-[N,N-di(2-etillhexil) aminocarbonilmetil]glicina (D2EHAG) usados en membranas poliméricas de inclusión (Kubota, et al., 2019) cuyos porcentajes de extracción fueron mayores (96 %) a los obtenidos en este trabajo. En otro estudio se sintetizó politiosemicarbazida en la fabrica ción de una membrana para la extracción de oro, lo que representó una ventaja, pues cada unidad monomérica de este polímero contiene dos grupos tiosemicarbazida que forman un sitio activo, lo que permite una eficiencia de extracción cercana al 97 % mediante adsor ción (Villalobos, et al., 2014). Los copolímeros acrílicos con grupos funcionales como el dimetilaminobenzaldehído y resinas de tiourea, también pueden adsorber con eficiencia algunos metales nobles como el oro (Tofan, et al., 2017; Atia, 2005). Sin embargo, no hay reporte de que ese tipo de membrana sea capaz de soportar varios ciclos. Por lo anterior, se evidencia que un agente extractante polimerizado como el sintetizado en este trabajo (P2,2HACPA) tiene la ventaja de una mayor vida útil y permite obtener altos porcentajes de extracción de oro a partir de soluciones acuosas.
La retención de oro en la membrana 1 se confirmó, además, por el cambio de color observado mediante microscopía electrónica de barrido (SEM-EDS) antes y después de la extracción de Au3+. Para ello se utilizó un microscopio electrónico JEOL Modelo JSM 6490LV (McCrone Microscopes) con detector de espectroscopía de dispersión de energías por rayos X (EDS) (Oxford Instruments, modelo INCA PENTAFETx3) en un voltaje de aceleración de 20 kV y magnificaciones desde 500X hasta 1000X. En las membranas de referencia, es decir, aquellas que no habían sido utilizadas para la extracción, se requirió la adición de una capa de oro para formar una superficie conductora, en tanto que las membranas usadas en los experi mentos de extracción de oro no requirieron la adición del metal debido a que el oro adsorbido durante el experimento se había reducido formando una capa conductora.
En la imagen de la figura 4a se observa la fotografía de una membrana con superficie homogénea poco porosa y en la imagen b se observan partículas sobresalientes de formas irregulares. El análisis de composición mediante SEM-EDS reveló que estas partículas correspondían a oro depositado y reducido en el proceso de extracción, lo que confirma que, durante el proceso, además de un mejor transporte, ocurrió también la retención y la posterior reducción de oro sobre la membrana. La reducción de Au3+ sobre la membrana se explica por el alto potencial de reducción de esta especie y por la presencia de Na-TFB, el cual puede oxidarse fácilmente en presencia de un agente oxidante como el mismo Au3+.
Determinación del efecto del pH de las soluciones en la membrana
El comportamiento de la variación del potencial de la membrana en función del valor de pH de la solución se presenta en la figura 5. Al inicio de las mediciones la diferencia de potencial permaneció constante en el tiempo y cercana a 0,0 mV. En un sistema perfecta mente homogéneo se esperaría una diferencia de 0,0 mV en virtud de que la medición se hizo con dos electrodos de referencia idénticos. Sin embargo, las pequeñas diferencias en la concentración del electrolito soporte o el tampón empleados, así como en la simetría de las caras de la membrana, generaron una pequeña desviación del comportamiento esperado. Al añadir 2,5 M de HCl en uno de los compartimientos, se observó una variación abrupta del potencial de la membrana producto de la diferencia de actividades del ion hidronio entre las dos soluciones. A medida que disminuyó el valor de pH, la variación del potencial aumentó debido a la mayor diferencia de actividades entre las soluciones. La lenta variación del potencial en cada valor de pH se relacionó con el intercambio de iones hidronio entre las soluciones y la membrana en búsqueda del equilibrio del sistema. Con valores de pH por debajo de 3, se observó que el potencial tendió a volver a su valor inicial, lo que indica que se generó el transporte de iones hidronio a través de la membrana. Es importante tener en cuenta el comportamiento que se ilustra en la figura 5, ya que lo ideal sería trabajar en un intervalo de pH en el que el transporte de iones H+ sea mínimo, ya que estos podrían ocupar sitios activos de la membrana. Con valores de pH entre 7 y 6 el cambio de potencial fue casi nulo, pero sabiendo que con valores de pH mayores de 5.0 los metales tienden a precipitar, se decidió trabajar con un pH de 4,0.
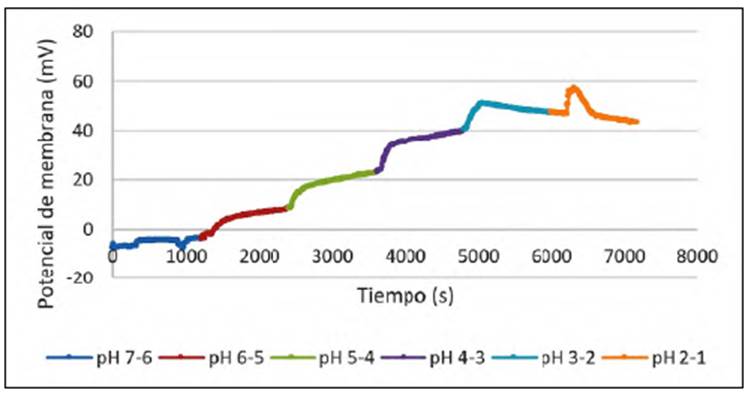
Figura 5 Potencial de membrana variando el pH una unidad cada 20 minutos con la membrana de composición 1
El principal inconveniente de la síntesis de polímeros con grupos funcionales que poseen pares electrónicos libres en su estructura es la propensión a hidrolizarse en medios ácidos, lo que conlleva la pérdida de sitios activos y la consecuente degradación de las membranas. No obstante, en este trabajo se encontró que la membrana era estable en soluciones de pH desde 7,0 hasta 1,0, lo cual favorece la extracción de metales con valores de pH bajos. Para comprobarlo se prepararon siete soluciones de 25 mL con valores de pH entre 7,0 y 1,0 ajustados con 2,5 M de HCl y, posteriormente, se sumergió en cada solución un fragmento de membrana durante 72 horas. A continuación, los fragmentos de membrana se extrajeron, se lavaron y se secaron para luego registrar el espectro IR de cada uno. Los resultados no evidenciaron cambios ni pérdidas de los grupos funcionales en el intervalo de pH evaluado (Figura 12S,https://www.raccefyn.co/index.php/raccefyn/article/view/938/2835).
Evaluación de la selectividad de la membrana
En la tabla 2 se presentan los valores del porcentaje de extracción de diferentes iones metálicos transportados y retenidos en la membrana como indicativo de su selectividad frente a cada uno de los metales estudiados.
Tabla 2 Porcentajes de extracción de iones metálicos empleando la membrana de composición 1. Tiempo de contacto: 72 horas
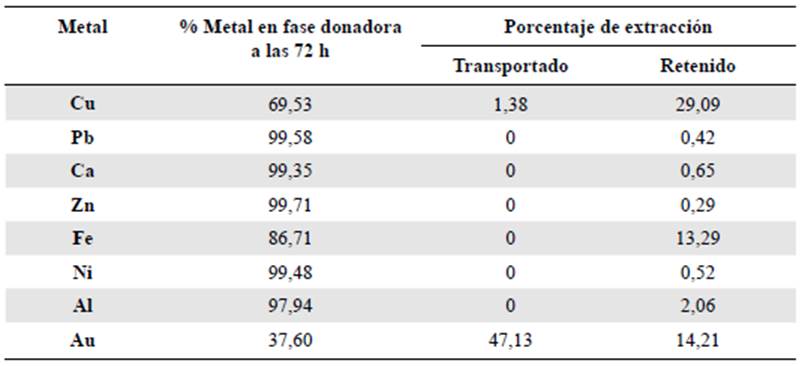
Además de oro, solo se detectó cobre en la fase receptora (1,38 %). El cobre también fue el metal con mayor porcentaje de retención en la membrana polimérica, con 29,09 %. Este hecho lleva a pensar en la posibilidad de que la configuración electrónica del ion metálico pudiera tener algún efecto sobre la capacidad de formar complejos con cierta estabilidad entre el mismo ion y los sitios activos del polímero. Lo anterior se infiere del hecho de que los iones de oro y cobre pertenecen al mismo grupo de la tabla periódica y son precisamente los que presentan mayores porcentajes de extracción. Sin embargo, el hierro (II) también presenta cierta afinidad con la membrana, con un 13,29 % de adsor ción, pero sin transporte hacia la fase receptora. Otros factores que pueden influir en la selectividad de la membrana son el radio iónico del metal y el valor de su carga. En este caso, sin embargo, dada la similitud de los valores de radio iónico de los diferentes metales estudiados, la selectividad hacia el oro puede explicarse por el mayor valor de la carga del ion Au3+ con respecto a los iones M2+. Además, según la teoría del campo de los ligantes, los iones metálicos pueden formar complejos estables con números de coordinación y formas estructurales definidas. En algunos casos, la flexibilidad de las cadenas poliméricas favorecería la adopción de estructuras que faciliten la coordinación de uno u otro ion presente en la solución, lo que también sería un factor con efectos en la selectividad del polímero sintetizado, aspecto que está fuera del alcance de este trabajo.
En resumen, los metales que pueden actuar como posibles interferentes frente a la extracción de oro son el cobre y el hierro, ya que, a pesar de que el transporte del cobre es bajo y el del hierro nulo, hay retención en la membrana polimérica, lo que implica que los sitios activos se ocupan y disminuye el porcentaje de extracción de oro.
Por el otro lado, como se observa en la tabla 2, el contenido de plomo, calcio, zinc, níquel y aluminio permaneció casi inalterable en la solución donadora, por lo cual no representó interferencia para la recuperación de oro. Para confirmarlo, se hizo un nuevo experimento en el que se incluyeron en la solución de metales solamente Au3+, Fe2+ y Cu2+ en concentraciones iguales y se monitoreó el porcentaje de extracción de oro por espectrofotometría de absorción atómica. Como era de esperarse, el porcentaje de extracción de oro disminuyó de 78 %, logrado en una solución con oro únicamente, a un 62 % en presencia de los otros dos metales evaluados.
Sin embargo, la presencia de cobre no representa un inconveniente mayor, ya que, según lo reportado por Miller (2002), el prelavado con ácido es un método eficiente para eliminar este tipo de interferencia, ya que la mayoría de los metales es sensible a algunos ácidos.
Conclusiones
Se sintetizó el nuevo polímero extractante P2,2HACPA con el propósito de extraer oro con base en diversos estudios en los que se ha demostrado que los grupos imina, amida y, en algunos casos los grupos carboxilo e hidroxilo, son adecuados para la extracción selec tiva de oro. La caracterización por espectroscopía IR, MS y RMN de los intermediaros y el producto final demostró la formación del compuesto.
La obtención de un nuevo material extractante de oro a partir de soluciones acuo sas es de gran importancia para reemplazar metodologías convencionales poco eficientes y contaminantes del medio ambiente. Lo resultados demostraron que el nuevo polímero P2,2HACPA utilizado como agente extractante en membranas poliméricas es selectivo hacia Au3+ como complejo [AuCl4]- en presencia de otros iones metálicos en una solución con un pH de 4,0.
Los resultados evidenciaron que la membrana de composición 1 con 20 % de P2, 2HACPA y un espesor de 50±5 generó los porcentajes más altos de extracción de oro, con un máximo de 79 % comparado con la concentración inicial de oro en la solución donadora, evidenciándose el transporte de metal a través de la membrana.
Las membranas obtenidas en el presente estudio podrían emplearse en sistemas piloto de la industria minera para la extracción en minas de oro no refractario y en la recupera ción del metal a partir de chatarra electrónica después de realizar una hidrólisis ácida y el respectivo ajuste del pH de las soluciones obtenidas. La posibilidad de emplear la misma membrana en varios ciclos disminuye los costos de fabricación y reduce sustancialmente los residuos generados.
El porcentaje de extracción de oro en presencia de otros metales puede disminuir hasta un 15 %, especialmente por la presencia de cobre, que actúa como interferente al ocupar sitios activos del agente extractante, y por el que P2,2HACPA muestra afinidad, como se verificó con una extracción de hasta 29 % de este metal.