Introducción
La temperatura es uno de los factores ambientales de más impacto en los procesos fisiológicos y comportamentales de los animales (Angilletta, et al., 2002; Du, et al., 2010a), en especial en lagartos ectotérmicos cuya temperatura corporal está fuertemente influenciada por las condiciones térmicas de su microambiente (Diele-Viegas, et al., 2018). Entre estos procesos se encuentra la termorregulación, definida como la habilidad de un organismo para mantener su temperatura corporal dentro de unos límites preferidos (Angilletta, 2009), cuya eficacia conductual está determinada, en gran medida, por los cambios cardiovasculares (Seebacher & Grigg, 2001). Es por esta razón que la frecuencia cardíaca puede ejercer cierto control sobre el intercambio de calor entre algunos reptiles y su ambiente, especialmente a través de la regulación de la velocidad del transporte sanguíneo caliente o frío (Seebacher & Franklin, 2005). Esta capacidad de los reptiles de controlar la conductancia térmica a través de la frecuencia cardíaca y el flujo sanguíneo se conoce como histéresis frente al calentamiento y al enfriamiento (Seebacher & Grigg, 2001), y permite a los animales mantenerse durante más tiempo al día dentro de su rango térmico preferido (Seebacher, 2000).
La muda o ecdisis es otro proceso morfo-fisiológico que se ve afectado por la temperatura ambiental. En vertebrados la muda se define como el proceso de renovación constante de la parte externa de la piel por el desprendimiento periódico del estrato corneo (capa externa de la epidermis) conformado por células queratinizadas (Wells, 2010). Durante este proceso la parte eliminada se desprende en una sola pieza, o el animal la arranca por partes con la ayuda de la boca y las extremidades. Los animales pequeños suelen ingerirla con el propósito de reciclar materiales para una rápida generación de la epidermis (Ling, 1972), para recuperar sus proteínas epidérmicas (Sabagh & Carvalho-e-Silva, 2008), o como suplemento de vitamina D en su dieta (Bustard & Maderson, 1965). La frecuencia de muda está regulada principalmente por los niveles de actividad de la glándula tiroides (Jargensen & Larsen, 1960) bajo la estimulación de la glándula pituitaria, y varía con la edad o la masa corporal (Triana, et al., 2013), y por factores ambientales como la humedad o la temperatura (Patrakov & Kuranova, 2006; Meyer, et al., 2012).
Además de su importancia termorreguladora, la frecuencia cardíaca en lagartos es fundamental para establecer el estado de salud de un animal. Por ejemplo, Raske, et al. (2012) mencionan que los datos sobre la frecuencia cardíaca, la respiratoria y la temperatura corporal pueden proporcionar información sobre la mejoría en los tratamientos clínicos en vertebrados ectotérmicos; sin embargo, la información sobre los parámetros de base que determinan la salud de un individuo es muy escasa en reptiles. En estudios previos también se ha demostrado que la frecuencia cardíaca puede usarse como un indicador confiable de la tasa metabólica siempre que se cumplan ciertos criterios (Green, 2011; Piercy, et al., 2015); por ello la frecuencia cardíaca puede proporcionar información sobre los costos energéticos de actividades como la locomoción, el forrajeo, la reproducción y la capacidad de respuesta de un organismo ante factores ambientales. En el caso de la muda, su recambio es importante para el reemplazo de los microorganismos que se alojan en la piel, como bacterias y hongos, que pueden resultar patógenos si no se reemplazan frecuentemente (Meyer, et al., 2012). Además, la frecuencia de muda ayuda en el diagnóstico de problemas como la mala alimentación o el bajo nivel de hidratación (Ling, 1972). Dada la poca información sobre estos parámetros fisiológicos en ectotérmos, especialmente en especies de lagartos, en el presente estudio se reporta por primera vez la frecuencia cardíaca en reposo y la frecuencia de muda de dos especies de lagartijas endémicas de Colombia, Anolis huilae y A. tolimensis, expuestas a tres temperaturas. Además, se evaluó la sensibilidad de estos dos parámetros fisiológicos a los cambios en la temperatura ambiental. Se espera que esta información sirva de referencia para el estudio de otros lagartos y ectotérmos empleados como modelo en ecología, fisiología, desarrollo y evolución.
Materiales y métodos
Especies estudiadas
Se seleccionaron dos especies de lagartijas endémicas de Colombia, Anolis huilae y A. tolimensis, las cuales son abundantes en el departamento del Tolima y se encuentran comúnmente expuestas a fluctuaciones térmicas diarias, por lo que se consideran un buen modelo biológico para el desarrollo de este trabajo.
Anolis huilae (Williams, 1982) se encuentra registrada en los departamentos de Huila y Tolima, en localidades alrededor de los 2.000 m s.n.m. (Williams, 1982). Habita en zonas de bosques secundarios y áreas con marcada intervención antrópica. Los machos tienen una longitud promedio entre hocico y cloaca (LHC) de 70,5 ± 5,6 mm y las hembras de 62,8 ± 5,4 mm (Bejarano-Bonilla & Bernal-Bautista, 2019). En este estudio la especie se recolectó en un bosque secundario en el corregimiento de Juntas, municipio de Ibagué (Tolima) (4°33'13" N & 75°19'29" O), a 2.000 m s.n.m. Allí la temperatura ambiental promedio durante las horas del día es de 21,07 ± 2,99 °C (rango diario de 15,1 a 24,6 °C) según Bejarano-Bonilla & Bernal-Bautista (2019), y la humedad relativa es del 96,37 %. En esta zona la especie es abundante y fácil de observar y capturar.
Anolis tolimensis (Boulenger, 1908) se encuentra distribuida en los departamentos de Tolima, Cauca, Valle del Cauca, Risaralda, Caldas y Huila, entre los 1.000 y 2.000 m s.n.m. (Uetz, et al., 2020). Su longitud entre hocico y cloaca es de 47,91 ± 3,79 mm en los machos y de 51,92 ± 2,57 mm en las hembras (Ardila-Marín, et al., 2008). La especie se recolectó en un área con cultivos de plátano (Musa paradisiaca) en el corregimiento de Llanitos, municipio de Ibagué, (Tolima) (4°29'24" N & 75°17'10" O), a una altitud de 1.150 m y con una temperatura ambiental promedio de 22,7 ± 3,4 (rango diario de 17,8 a 27 °C). Previamente, Gallego-Carmona, et al. (2016) habían nombrado la especie como A. antonii, sin embargo, Grisales-Martínez, et al. (2017) aclararon luego que corresponde a A. tolimensis.
Recolección de los individuos
Entre octubre y diciembre de 2016, durante las horas de la mañana, se capturaron 18 individuos de cada especie mediante la técnica de relevamientos por encuentros visuales (A. huilae, LHC: 57,8 ± 1,26 mm, masa corporal: 3,77 ± 1,55 g; A. tolimensis, LHC: 52,9 ± 6,1 mm, masa corporal: 2,18 ± 0,52 g). Se registró la temperatura corporal, la temperatura del sustrato y la temperatura ambiental del sitio de recolección para todos los individuos. La temperatura corporal se midió en la parte dorsal del animal usando un termómetro infrarrojo (EXTECH IR200, Estados Unidos), con una precisión de ± 0,3 °C, a una distancia aproximada de 20 cm. Las temperaturas del sustrato y del ambiente (a 30 cm por encima del animal) se registraron utilizando una termocupla (EXTECH 421502, Estados Unidos) con una precisión de ± 0,3 °C. Posteriormente, los individuos fueron transportados en recipientes plásticos a la Universidad del Tolima en donde se registró la longitud hocico-cloaca con un calibrador digital (Mitutoyo 500-196-20, Japón) de precisión ± 0,025 mm. Tanto los machos como las hembras se colocaron aleatoriamente por parejas (en ningún caso se observaron agresiones entre los animales) dentro de otros recipientes plásticos (15 x 10 x 10 cm) para ser sometidos a los experimentos.
Tratamientos térmicos
Debido a las diferencias en la temperatura ambiental a la que se encuentran las dos especies de estudio, las temperaturas experimentales se seleccionaron con base en el rango ya mencionado registrado en su hábitat. Por lo tanto, las temperaturas experimentales para A. huilae fueron de 15 °C (temperatura baja), 20 °C (temperatura media) y 25 °C (temperatura alta), y para A. tolimensis, de 17 °C (temperatura baja), 22 °C (temperatura media) y 27 °C (temperatura alta). Estas temperaturas se obtuvieron mediante el uso de cabinas térmicas (SISTEMA DANFOS ERC 102 KIT) programadas a las temperaturas experimentales deseadas (± 1 °C). Para confirmar las temperaturas de exposición, en cada cabina se colocó un sensor que registraba en un panel externo la temperatura a la cual se encontraban los individuos, considerada como similar o muy cercana a la temperatura corporal de las lagartijas según los ensayos preliminares.
Medición de la frecuencia cardíaca
Los registros de la frecuencia cardíaca se hicieron durante tres días consecutivos a partir del día en que los individuos fueron capturados y transportados al laboratorio. El orden de exposición de los individuos a cada una de las temperaturas experimentales se determinó de manera aleatoria. Los individuos se mantuvieron durante una hora a la temperatura experimental y, transcurrido este tiempo, se registró dentro de la cabina térmica la frecuencia cardíaca (latidos por minuto, lpm) con el medidor infrarrojo de frecuencia cardíaca (sistema BUDDY, AVIAN BIOTECH, Reino Unido) (Du, et al., 2010b). Se obtuvieron tres registros de la frecuencia cardíaca de cada individuo en intervalos de 2 minutos para hallar un valor promedio. Este mismo procedimiento se repitió en el segundo y el tercer día con las otras dos temperaturas, de tal manera que cada animal fue sometido a las tres temperaturas experimentales. Por último, al cuarto día todos los individuos fueron expuestos nuevamente a la temperatura experimental inicial para confrontar los valores de la frecuencia cardíaca antes y después de la exposición a los tres tratamientos térmicos. No se encontraron diferencias significativas (prueba de Wilcoxon, p>0,05). Durante los días de experimentación, los animales fueron alimentados ad libitum con insectos recolectados en la Universidad del Tolima y se les dejó agua dentro de cada recipiente plástico.
Medición de la frecuencia de muda
Para estos registros se utilizaron los mismos 18 individuos de cada una de las dos especies del experimento anterior una vez este finalizó. Los individuos de cada especie se dividieron en tres grupos de seis y fueron sometidos permanentemente a las tres temperaturas experimentales hasta la aparición de la muda. Cada animal se marcó en el dorso mediante un punto pintado con esmalte de uñas de color blanco (Vogue), tal y como se ha reportado en otros estudios con lagartos (Carvajal-Cogollo & Urbina-Cardona, 2008) y anuros (Meyer, et al., 2012). Se hicieron dos observaciones diarias, una en la mañana (7:00) y otra en la noche (19:00) hasta el día en que ocurrió la muda, lo cual se verificó con la ausencia de la marca dorsal. Una vez ocurrido esto, se marcó nuevamente el animal y se inició el registro del tiempo hasta la siguiente muda, repitiendo este procedimiento dos veces más por cada animal para obtener tres registros, con los cuales se calculó un valor promedio de la frecuencia de muda.
Análisis de datos
Los datos de la frecuencia cardíaca de los 18 individuos de A. huilae y los 18 de A. tolimensis expuestos a las tres temperaturas experimentales se compararon mediante el análisis de medidas repetidas previa comprobación del cumplimiento de los supuestos de la prueba, incluida la prueba de esfericidad de Mauchly (p>0,05), con la cual se comprobó si había diferencias significativas en la frecuencia cardíaca al exponer a cada lagartija a las tres temperaturas diferentes, controlando las diferencias de los tamaños corporales del análisis de medidas repetidas. Los datos sobre la frecuencia de muda en los tres tratamientos térmicos se compararon utilizando la prueba no paramétrica de Kruskal-Wallis (Kruskal & Wallis, 1952) debido a que no se cumplieron los supuestos de las pruebas paramétricas, probablemente por el reducido número de datos, ya que no se trataba de un experimento de medidas repetidas. Esta prueba se hizo para comprobar si la frecuencia de muda cambiaba significantemente en las tres temperaturas experimentales. Los análisis estadísticos se hicieron con el programa SPSS (versión 21). Además, se calcularon los valores Q10 (Randall, et al., 2002) para la frecuencia cardíaca y la frecuencia de muda con el propósito de establecer la sensibilidad térmica de estos dos parámetros fisiológicos al aumentar 10 °C en la temperatura experimental.
Resultados
La frecuencia cardíaca en A. huilae estuvo en un rango entre 45,2 ± 5,4 lpm a 15 °C y 50,7 ± 5,5 lpm a 25 °C (Tabla 1,Figura 1), con un Q10 de 1,12. En el caso de A. tolimensis, la frecuencia cardíaca presentó un rango entre 53,3 ± 6,5 lpm a 17 °C y 57,3 ± 6,2 lpm a 27 °C (Tabla 1,Figura 1), con un Q10 de 1,07. A pesar del bajo índice Q10, en ambas especies la frecuencia cardíaca se incrementó significativamente con el aumento de la temperatura experimental (Figura 1) (A. huilae: Anova F (2,16, N=18)=21,50, p=0,000; A. tolimensis: Anova F (2,16, N=18)=3,64, p=0,049). Específicamente los datos de la frecuencia cardíaca en A. huilae arrojaron diferencias significativas entre las tres temperaturas 15 °C Vs. 20 °C (diferencia mínima significativa (DMS)=-2,81, p=0,000); 15 °C Vs. 25 °C (DMS=-5,46, p=0,000); 20 °C Vs. 25 °C (DMS=-0,66, p=0,001), en tanto que en A. tolimensis se presentaron entre la temperatura baja y la alta: 17 °C Vs. 27 °C (DMS=-3,94, p=0,019).
Tabla 1 Valores promedio de la frecuencia cardíaca (latidos por minuto) y de muda (número de días) en A. huilae y A. tolimensis a tres temperaturas experimentales
| A. huilae | A. tolimensis | ||||
|---|---|---|---|---|---|
| T | FC | FM | T | FC | FM |
| 15 °C | 45,2 ± 5,4 | 135 ± 8,2 | 17 °C | 53,3 ± 6,5 | 52,2 ± 11,8 |
| 20 °C | 48,0 ± 4,8 | 68,6 ± 7,9 | 22 °C | 54,6 ± 6,6 | 24 ± 4,9 |
| 25 °C | 50,7 ± 5,5 | 38,2 ± 4,9 | 27 °C | 57,3 ± 6,2 | 27 ± 8,1 |
T: temperatura, FC: frecuencia cardíaca, FM: frecuencia de muda; promedio ± desviación estándar
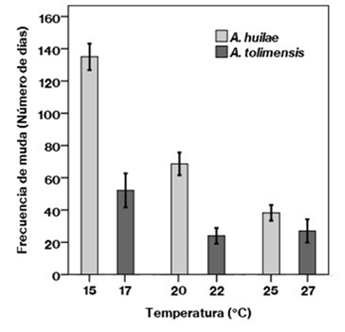
Figura 1 Comparación de la frecuencia cardíaca con relación a la temperatura en Anolis huilae y Anolis tolimensis. Las barras indican error estándar.
Con respecto a la frecuencia de muda, se encontraron diferencias significativas entre las temperaturas experimentales de las dos especies (A. huilae: Kruskal-Wallis H=10,68, p=0,000; A. tolimensis: Kruskal-Wallis H=9,10, p=0,010). La frecuencia de muda en las lagartijas fue más lenta en las temperaturas experimentales bajas (A. huilae: 135 ± 8,2 días; A. tolimensis: 52,2 ± 11,8 días), y más rápida en las temperaturas altas (A. huilae: 38,3 ± 4,9 días; A. tolimensis: 27 ± 8,1 días) (Tabla 1,Figura 2). Los valores Q10 para la frecuencia de muda en A. huilae fueron de 0,28 (entre 15 y 25 °C), y 0,52 en A. tolimensis (entre 17 y 27 °C).
Discusión
Los datos obtenidos en A. huilae y A. tolimensis sobre el aumento de la frecuencia cardíaca con el incremento de las temperaturas experimentales reflejan la tendencia general reportada en otros estudios con reptiles (Bennett, 1972; Butler, et al., 2004; Aubret, et al., 2013) cuyos procesos fisiológicos funcionan mejor dentro de ciertas temperaturas corporales y disminuyen fuera de su rango óptimo o curva de desempeño térmico (Angilletta, 2001; 2006). Este resultado implica que los incrementos en las temperaturas ambientales que actualmente se reportan pueden aumentar la frecuencia cardíaca y otras variables fisiológicas asociadas, como la tasa de asimilación energética (Angilletta, 2001) y la tasa metabólica de los organismos (Bennett & Dawson, 1976; Zari, 1991). Sin embargo, dado que en el valor Q10 encontrado para las dos especies (alrededor de 1,1) no hay un cambio que incremente notablemente la frecuencia cardíaca, es posible que estas especies se encuentren dentro del grupo de lagartos que tienen cierta capacidad de regular fisiológicamente su temperatura interna a través de la frecuencia cardíaca y el flujo sanguíneo (Grigg & Seebacher, 1999; Dzialowski & O'Connor, 2001; Seebacher & Grigg, 2001). También es posible que la respuesta individual al cautiverio ejerza algún impacto diferencial sobre las mediciones de la frecuencia cardíaca y su sensibilidad a la temperatura y que unas lagartijas sean más sensibles que otras, lo que se reflejó en el análisis de medidas repetidas, pero no en el valor Q10.
Al comparar la frecuencia cardíaca de A. huilae medida a 25 °C (50,7 lpm) con las frecuencias cardíacas reportadas por Licht (1965) en otras especies de lagartos a la misma temperatura, estas presentaron valores notablemente más bajos, desde los 25 lpm en Dipsosaurus dorsalis, que tiene una longitud corporal (longitud hocico-cloaca) promedio de 13 cm, hasta 40 lpm en Sceloporus graciosus, con una longitud corporal de 4,7 a 6,9 cm. Tales diferencias en los resultados podrían explicarse por las variaciones en el tamaño corporal, ya que los individuos pequeños presentan una frecuencia cardíaca mayor (Randall, et al., 2002), lo que también se comprobaría al contrastar los resultados de las dos especies aquí estudiadas, pues A. huilae, que es más grande que A. tolimensis, presentó una frecuencia cardíaca menor (Figura 1). No obstante, en otros lagartos como Podarcis muralis, con un tamaño corporal (5,2 a 6,5 cm) dentro del rango de las dos especies de este estudio, las frecuencias cardíacas reportadas a 25 °C por Aubret, et al. (2013) fueron de alrededor de 100 lpm, un valor alto en comparación con los datos reportados aquí con la misma metodología de registro cardíaco. Esto indica que la relación inversa y significativa entre el tamaño corporal y la frecuencia cardíaca no se presenta en todos los casos, y abre la posibilidad de que distintas especies de lagartos presenten diferencias fisiológicas asociadas con su grupo filogenético. Debido a la poca información que hay sobre las frecuencias cardíacas en lagartos, se requieren más estudios para establecer generalidades sobre estas variaciones dentro de cada especie y entre ellas, y sobre su sensibilidad ante los cambios de temperatura ambiental.
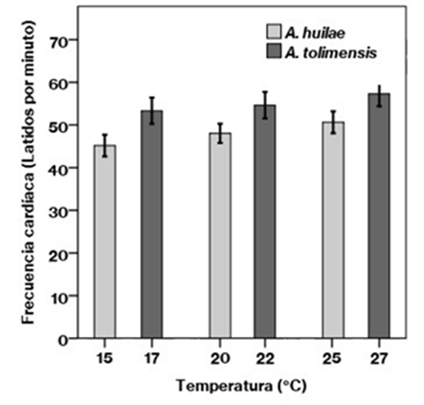
Figura 2 Comparación de la frecuencia de muda con relación a la temperatura en Anolis huilae y Anolis tolimensis. Las barras indican error estándar.
En cuanto a la frecuencia de muda, por primera vez se brinda información sobre las lagartijas A. huilae y A. tolimensis y sus variaciones en función de la temperatura ambiental. En ambas especies hubo una reducción en el tiempo de muda en las temperaturas altas: en A. huilae pasó de 135 ± 8,2 días a 15 °C a 38,3 ± 4,9 días a 25 °C, en tanto que en A. tolimensis cambió de 52,2 ± 11,8 días a 17 °C a 27 ± 8,1 días a 27 °C. Específicamente los datos del Q10 evidenciaron una reducción del tiempo de muda de 3,5 veces en A. huilae (Q10=0,28) y de casi 2 veces en A. tolimensis (Q10=0,52), lo que refleja un retardo importante en la renovación de su piel frente a un cambio en la temperatura ambiental de 10 °C, lo que sucede en condiciones naturales, como ya se indicó. La relación inversa entre la frecuencia de muda y la temperatura se ha reportada en otros vertebrados ectotérmicos (Stefano & Donoso, 1964; Meyer, et al., 2012) y está relacionada con la reducción del metabolismo de los animales en las temperaturas más bajas, lo que hace que todos sus procesos fisiológicos sean más lentos, incluida la renovación de la capa epidérmica de su piel. Esto también se puede atribuir al hecho de que en las temperaturas bajas los animales redistribuyen su gasto energético en otro tipo de actividades vitales como la digestión, la locomoción, y la selección de microhábitats, entre otros (Harwood, 1979; Angilletta, et al., 2009; Schofield, et al., 2009), y el proceso de muda representa un gasto significativo de energía (Semlitsch, 1979) que se podría disminuir, especialmente bajo estas condiciones térmicas, por ejemplo en un 3% en Elaphe guttata o hasta en un 11 % en Heterodon platyrhinos (Smith, 1976).
De la poca información publicada sobre la frecuencia de muda en los lagartos a diferentes temperaturas para comparar con los resultados del presente estudio, se encuentra el reporte en Tupinambis teguxin. En ese estudio se encontró que los juveniles (longitud hocico-cloaca: 11 - 25 cm) tuvieron una frecuencia de muda de 28,01 ± 7,1 días, y los inmaduros (longitud hocico-cloaca: 25 - 32 cm) de 24,62 ± 6,3 días al mantenerlos a temperaturas diarias entre los 21 y los 34 °C (Yanosky & Mereolli, 1991), valores similares a los encontrados para la especie A. tolimensis expuesta a 22 y 27 °C. En otros reptiles como las serpientes, Smith (1976) reportó para Heterodon platyrhinos una frecuencia de muda de 38,3 ± 3,66 días, y para Elaphe guttata, de 40,5 ± 2,75 días a una temperatura de 25 °C, en tanto que los individuos expuestos a 15 °C tuvieron una frecuencia de muda más prolongada, aunque dicho tiempo no se especificó. Por su parte, Semlitsch (1979) encontró que en Natrix fasciata mantenida a 30,6 °C la frecuencia de muda fue de 18,1 días, en tanto que a 20,4 °C fue aproximadamente de 43 días. Como en el caso de la frecuencia cardíaca, son necesarios más estudios para determinar la frecuencia de muda en diversas especies de lagartos y evaluar cómo los factores ambientales asociados con el hábitat la pueden afectar, pues podrían potenciar enfermedades infecciosas asociadas con la piel. Por ejemplo, la presencia muy frecuente de ectoparásitos (Gallego, et al., 2012) o de microbios patógenos en lagartijas podría tener un mayor efecto negativo en las temperaturas bajas que en las altas, ya que el recambio de la piel y de los organismos asociados con ella son más lentos (Meyer, et al., 2012).
En conclusión, la frecuencia cardíaca aumentó en las lagartijas con el incremento de la temperatura experimental, así como la frecuencia de muda. Por su parte, la sensibilidad térmica de la frecuencia de muda fue notablemente más alta que la de la frecuencia cardíaca ante cambios experimentales de 10 °C. Sin embargo, debido a los múltiples factores internos y externos que pueden afectar la medición de estos dos parámetros fisiológicos, se requieren más estudios para ampliar el conocimiento sobre la fisiología de los lagartos y ectotermos en general y su forma de responder a cambios en condiciones naturales como la temperatura ambiental.















