Introducción
Las ciénagas o lagos de planos inundables son ecosistemas de río con conexión directa o indirecta, temporal o permanente, con una columna de agua que no supera los 10 m (Ríos, et al., 2008) y que, entre otras funciones, amortiguan los pulsos hidrológicos, influyen en los ciclos biogeoquímicos y constituyen hábitats de gran biodiversidad (Gopal, et al., 2000; Millennium Ecosystem Assessment, 2005). En Colombia este tipo de ecosistemas acuáticos cubren un área aproximada de 5.622.750 ha, y la zona media y baja del río Atrato es uno de los más importantes por su gran diversidad biológica y sus características ecológicas y ambientales (Corpouraba & Codechoco, 2007).
La mayoría de estos ecosistemas son poco profundos y, generalmente, soportan extensos bancos de macrófitas acuáticas que constituyen centros importantes para el mantenimiento de la diversidad acuática (Mormul, et al., 2010), especialmente el fitoperifíton, pues ofrecen una gran superficie para la colonización de esta comunidad adherente (Algarte, et al., 2009); además, las características morfoanatómicas de las macrófitas aumentan la heterogeneidad espacial y pueden incidir en la composición, abundancia, biomasa y productividad de la comunidad fitoperifítica que, vive en las hojas, tallos y raíces sumergidas de estas plantas (Hinojosa-Garro, et al., 2010).
El fitoperifíton es una biopelícula que se forma en sustratos sumergidos naturales y artificiales y está compuesta por algas y cianobacterias, bacterias, hongos y micro-invertebrados, cuya compleja estructura también incluye mucílagos y detritos orgánicos, así como un componente inorgánico proveniente de diferentes tipos de partículas (Hameed, 2003). Esta comunidad tiene un papel fundamental en el ciclo de nutrientes, el flujo de la energía y la productividad primaria de los sistemas de tipo cenagoso (Steinman, et al., 2016).
En Colombia son varios los estudios que han contribuido al conocimiento de la composición, la estructura y la ecología de las comunidades fitoperifíticas asociadas con macrófitas en ciénagas, entre ellos cabe mencionar los de Montoya-Moreno & Aguirre-Ramírez (2008, 2009), Montoya-Moreno, et al. (2013), Osorio-Avila & Manjarrés-García (2015), De la Hoz-Barrientos & Osorio-Ávila (2016), Andramunio-Acero, et al. (2018), y Lozano-Peña, et al. (2019). En el departamento del Chocó los únicos trabajos publicados sobre esta comunidad son los de Maturana, et al. (2002), quienes estudiaron la estructura del fitoperifíton en Nymphaea sp., así como los de Abuhatab, et al. (2005) y Salas, et al. (2011) sobre el fitoperifíton asociado con sustratos naturales y artificiales en ríos.
El objetivo del presente estudio fue estudiar la composición y la similitud taxonómica de las comunidades fitoperifíticas adheridas a tres especies de macrófitas arraigadas en hojas y tallos flotantes de diferente morfología en una ciénaga tropical de la cuenca del río Atrato (Chocó) Colombia.
Materiales y métodos
Área de estudio
Los muestreos se hicieron en la ciénaga Plaza Seca, ubicada en el corregimiento de Sanceno, Quibdó (Chocó), Colombia, entre los 5°45'15,5" N, 76°42'42,1" O a 43 m s.n.m., con una precipitación promedio anual de 8.000 mm, temperatura promedio de 26,8 °C y una humedad relativa del 85,7 %, correspondiente a una zona de vida de bosque muy húmedo tropical (bmh-T) (Rangel-Ch, et al., 2004). Plaza Seca es la ciénaga principal de un conjunto de ciénagas en racimo y está conectada directamente con el río Atrato por medio del caño Gerunguidó. Las macrófitas Ludwigia sedoides (Humb. and Bonpl.) Hara 1953, Nymphoides indica (L.) Kuntze 1891 y Eichhornia azurea (Schwartz) Kunth 1843 dominan la vegetación enraizada de hojas o tallos flotantes en esta ciénaga (Figura 1).

Figura 1 Especies de macrófitas dominantes en la ciénaga Plaza Seca: a. Nymphoides indica, b. Eichhornia azurea, c-d. Ludwigia sedoides
Según Correa (2014), los sistemas cenagosos de la cuenca del río Atrato se caracterizan por su alta transparencia, pH ácido, baja conductividad, y concentración de sólidos, oxígeno y nutrientes. Asimismo, tienen un desarrollo genérico de suelos arcillosos muy incipientes, de la edad terciaria, que permanecen inundados casi todo el año y se localizan en las áreas más bajas (pendientes entre 1 y 8 %), poseen poca fertilidad, son químicamente ácidos, orgánicos, de textura generalmente fina, y se ven afectados por un acentuado intemperismo (Duque, 1990). La elevada precipitación, característica de esta región, induce procesos intensos de alteración y lavado, por lo cual los suelos son ácidos y pobres en nutrientes (Instituto Geográfico Agustín Codazzi - IGAC, 2006).
Fase de campo
Los muestreos se hicieron entre mayo y agosto del 2014 durante los periodos hidrológicos de aguas altas y aguas bajas de la zona. Las muestras se tomaron en cada periodo de los parches de las macrófitas dominantes en la ciénaga (L. sedoides, N. indica y E. azurea) en las raíces de tres ejemplares adultos de cada especie. Las raíces se cortaron con tijeras podadoras, se depositaron en bolsas plásticas a las que se les agregó agua de la ciénaga previamente filtrada y, posteriormente, se fijaron con formol al 4 %. En la zona superficial de la ciénaga se midió in situ el oxígeno disuelto, el pH, la temperatura del agua, la conductividad eléctrica y los sólidos totales disueltos con una sonda multiparamétrica HACH® HQ30d, en tanto que la transparencia se evaluó con un disco de Secchi. Se tomaron muestras de agua para el análisis de nutrientes (nitratos, nitritos, amonio y ortofosfatos) y de la alcalinidad total siguiendo las recomendaciones de la American Public Health Association (APHA), la American Water Works Association (AWWA), y la Water Environment Federation (WEF) (2012).
Fase de laboratorio
Las muestras se llevaron al laboratorio de limnología de la Universidad Tecnológica del Chocó donde se rasparon las raíces con un cepillo de cerdas suaves y el material fitoperifítico se almacenó en frascos plásticos de 50 ml. La identificación taxonómica se efectuó en un microscopio binocular considerando 50 campos y un objetivo de 40X según los trabajos de Parra, et al. (1983), Prescott, et al. (1983), Krammer & Lange-Bertalot (1991), Komárek & Anagnostidis (2005), y Bicudo & Menezes (2006) y bases de datos digitales (Guiry & Guiry, 2019). Se consideraron como individuos organismos unicelulares, colonias y filamentos, los cuales se cuantificaron mediante la fórmula propuesta por Hauer & Lamberti (2007), donde la densidad se expresa como el número de individuos por área de superficie (cm2).
Análisis de los datos
Mediante estadística descriptiva se analizaron los datos físicos y químicos estableciendo el promedio, el rango y el coeficiente de variación de Pearson. En cuanto al fitoperifíton, se determinó la densidad relativa a partir del número de individuos recolectados de cada taxón y su relación con el número total de individuos registrados en cada especie de macrófita. La estructura de la comunidad fitoperifítica se evaluó usando los índices de diversidad (Shannon & Wiener, 1949) y de dominancia (Simpson, 1949), y la riqueza específica, empleando el programa Past 1.57 (Hammer, et al., 2001). Para evaluar las diferencias en la densidad, la diversidad, la dominancia y la riqueza entre las especies de macrófitas se empleó un ANOVA, y sus supuestos inherentes se verificaron como aceptables (p>0,05) usando el programa Minitab® (2014). La similitud en la composición de la comunidad perifítica de las macrófitas estudiadas se analizó con el índice de Jaccard (Magurran, 1988), con el cual se ejecutaron análisis de agrupamiento cualitativo utilizando datos sobre la presencia o ausencia de los taxones registrados en el estudio mediante el programa BioDiversity Pro (McAleece, et al., 1997).
Resultados
Condiciones físicas y químicas de la ciénaga
En la tabla 1 se resume la expresión de las variables físicas y químicas evaluadas durante el tiempo de muestreo. Los valores de oxígeno disuelto fueron bajos 
Tabla 1 Valores promedios, rangos y coeficientes de variación de las variables fisicoquímicas
| Variables | Unidades | Promedio | Rango | CV % |
|---|---|---|---|---|
| Oxígeno disuelto | mg. l-1 | 5,69 | 5,53 - 5,86 | 4,06 |
| Temperatura del agua | °C | 27,91 | 27,86 - 27,97 | 0,27 |
| Conductividad eléctrica | μS/cm | 192,17 | 200,33 - 188,00 | 9,31 |
| Solidos totales disueltos | mg. l-1 | 100,95 | 105,23 - 96,67 | 6,00 |
| pH | Unidades | 5,40 | 5,08 - 5,72 | 8,34 |
| Alcalinidad total | mg. l-1 CaCO3 | 13,33 | 16,66 - 10,0 | 35,33 |
| Nitritos | mg. l-1 | 0,10 | 0,11 - 0,09 | 15,99 |
| Nitratos | mg. l-1 | 0,98 | 0,91 - 1,05 | 9,88 |
| Amonio | mg. l-1 | <0,010 | ||
| Ortofosfatos | mg. l-1 | 0,10 | 0,12 - 0,07 | 37,27 |
| Transparencia (Secchi) | m | 0,89 | 1,03 - 0,76 | 15,64 |
Comunidad perifítica asociada con las macrófitas
La composición de la comunidad perifítica en las tres macrófitas estudiadas totalizó 1,160,63 ind.cm-2, distribuidos en 82 morfoespecies pertenecientes a 26 familias, 16 órdenes y ocho clases (Tabla 2). La macrófita L. sedoides presentó la mayor densidad promedio, con 365,32 ind.cm-2 (61,34 %), seguida de E. azurea, con un promedio de 136,5 ind.cm-2 (23,44 %) y N. indica, con un promedio de 88,10 ind.cm-2 (15,11 %). La prueba de varianza mostró diferencias significativas entre las distintas especies de macrófitas con respecto a la densidad de organismos perifíticos (ANOVA, F=16,67; p= 0,0237) (Figura 2).
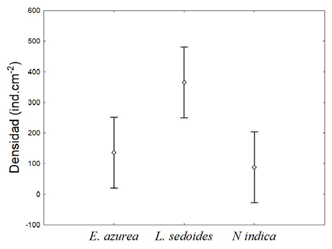
Figura 2 Gráfico de medias para la densidad de organismos fitoperifíticos asociados con tres macrófitas en una ciénaga tropical en el río Atrato (Chocó-Colombia). Las barras verticales denotan un intervalo de confianza de 0,95.
La clase Bacillariophyceae fue la más abundante, con una densidad relativa promedio de 78,04 % (±10,69), seguida por Zygnemaphyceae, con 12,83 % (±8,22); las restantes clases presentaron densidades promedio inferiores al 10% (Figura 3). En términos de riqueza, la clase Zygnemaphyceae ocupó el primer lugar, con un porcentaje promedio de 48,82 % (±7,23) de las morfoespecies, seguida de Bacillariophyceae, con el 33,24 % (± 7,61) (Tabla 2).
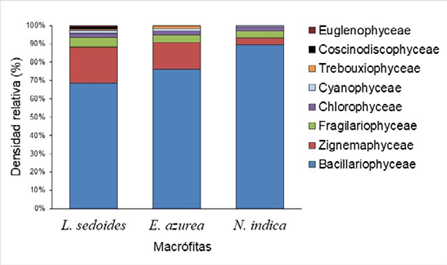
Figura 3 Contribución por clases de la comunidad fitoperifítica asociada con tres especies de macrófitas
Tabla 2 Composición taxonómica y densidad (ind. x cm-2) de la comunidad fitoperifítica asociada con tres especies de macrófitas
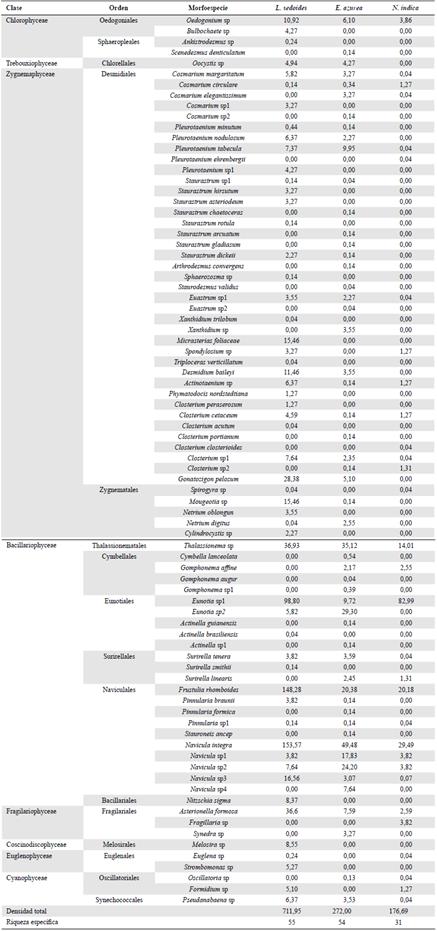
Navicula integra (W. Smith) Ralfs, Frustulia rhomboides (Ehrenberg) De Toni, Eunotia sp1 Ehrenberg, Asterionella formosa Hassall, Surirella tenera W. Gregory y Oedogonium sp. Link ex Hirn se encontraron entre los organismos más frecuentes en la mayoría de las raíces de las macrófitas estudiadas, siendo las tres primeras las que presentaron las mayores abundancias relativas, con el 56,41 % del total de organismos perifíticos cuantificados (Tabla 2).
La riqueza específica fue mayor en L. sedoides (34 a 38 morfoespecies) y en E. azurea (27 a 40 morfoespecies) que en N. indica (17-22 morfoespecies); la diversidad fue también mayor en L. sedoides y E. azurea (H'= 2,52 y 2,42 bits.ind1 respectivamente), en comparación con N. indica (H'= 1,61 bits.ind1); asimismo, el índice de dominancia registró valores entre 0,109 y 0,151 para L. sedoides y E. azurea y entre 0,253 y 0,325 para N. indica, es decir, hubo diferencias entre macrófitas (p<0,05). El análisis de varianza evidenció diferencias significativas en la riqueza, la diversidad y la dominancia de las distintas macrófitas estudiadas (p<0,05).
Similitud entre macrófitas
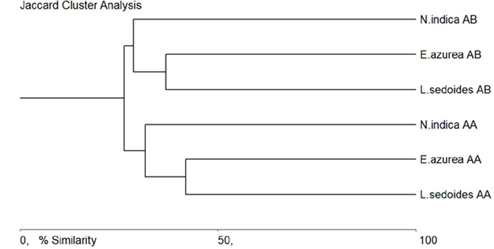
21 morfoespecies fueron exclusivas de L. sedoides (25,60 %), 18 (21,95 %) de E. azurea y tres (3,65 %) de N. indica, en tanto que las tres macrófitas compartieron 19 morfoespecies (23,17 %) (Tabla 2). El análisis de agrupamiento basado en el índice de Jaccard arrojó un intervalo de similitud cercano al 27 % en la composición de la comunidad fitoperifítica presente en las tres macrófitas estudiadas, con la formación de dos grupos definidos según el periodo hidrológico, siendo el 67,07 % de las morfoespecies exclusivas de uno u otro. Tanto en aguas altas como bajas se evidenció una mayor afinidad entre L. sedoides y E. azurea (41,86 y 36,84 %, respectivamente), en tanto que entre L. sedoides y N. indica fue de alrededor de 28 % en ambos periodos (Figura 4).
Discusión
Condiciones fisicoquímicas de la ciénaga
La ciénaga Plaza Seca se caracterizó por presentar un comportamiento fisicoquímico típico de la zona tropical, con valores relativamente bajos de oxígeno disuelto (<6,0 mg. l-1), pH ligeramente ácido (<6 unidades) y alta temperatura del agua (>27 °C). Los valores de oxígeno fueron similares a los registrados por Mosquera-Murillo (2017, 2018) y Mosquera & Córdoba (2015) en ciénagas de la cuenca del Atrato. Los ecosistemas lénticos tropicales tienden a presentar valores relativamente bajos de oxígeno disuelto (Lewis, 2000; Roldán, 2003), lo que coincide con lo reportado en este estudio. Los valores de pH registrados pueden atribuirse en gran medida a la naturaleza de los suelos de la zona, los cuales son ácidos, como los de la mayoría del departamento del Chocó, y se encuentran dentro los límites aptos para la supervivencia de los organismos acuáticos (entre 4,5 y 8,5) (Roldán & Ramírez, 2008). En el caso de la temperatura del agua, los valores superiores a 27 °C, como los de esta ciénaga, son característicos de los ambientes acuáticos ubicados en regiones tropicales, es decir, entre 25 y 30 °C (Asprilla, et al., 1998; Roldán & Ramírez, 2008).
La alcalinidad, los sólidos totales disueltos y la conductividad eléctrica estuvieron dentro de los rangos reportados para ecosistemas neotropicales colombianos, con valores menores a 100 mg. l-1, 1.500 μS/cm y 200 mg. l-1, respectivamente (Roldán & Ramírez, 2008). En cuanto a la transparencia, esta se encuentra dentro del rango establecido para las ciénagas en Colombia: entre 0,17 y 1,13 m (Arias, 1985).
En el caso de los nutrientes, los nitritos registraron bajas concentraciones (<0,10 mg. l-1), en tanto que los nitratos, ligeramente altas (>0,91 mg. l-1). Según Wetzel (2001), el nitrógeno en forma de nitritos tiende a ser bajo en los sistemas acuáticos, ya que se transforma rápidamente en nitratos dependiendo de la concentración de oxígeno en el agua, o en formas reducidas como el amonio si las condiciones son de anoxia. Los ortofosfatos presentaron promedios por encima de 0,05 mg. l-1, límite requerido para la vida acuática; la alta variación que registra se explicaría por las variaciones en el caudal del río Atrato producto del régimen climático de la zona, el cual se caracteriza por grandes variaciones en la precipitación. En el caso del amonio, los valores estaban por debajo del rango de detección.
Fitoperifíton asociado con las macrófitas
La comunidad perifítica asociada con macrófitas que aquí se reporta es similar a la registrada en otros estudios realizados en ciénagas del país (Osorio-Ávila & Manjarrés-García, 2015; De la Hoz-Barrientos & Osorio-Avila, 2016; Lozano-Peña, et al., 2019), en los que la clase Bacillariophyceae sobresale como la de mayor abundancia. Esta clase predomina en los ambientes de tipo léntico debido a su rapidez para ocupar sustratos en corto tiempo y a la presencia de estructuras especializadas que le permite a los individuos fijarse al sustrato con mayor facilidad y competir con ventaja frente a otros grupos (Fonseca & Rodríguez, 2005; De la Hoz-Barrientos & Osorio-Avila, 2016). La abundancia de la clase Bacillariophyceae se asocia, asimismo, a las condiciones fisicoquímicas de la ciénaga estudiada, ya que la dominancia de este grupo tanto en el fitoperifíton como en el fitoplancton, se relaciona con la baja concentración de nutrientes y el pH ácido (Rivera-Rondón, et al., 2010), lo cual coincide con las condiciones registradas en la ciénaga Plaza Seca durante el tiempo de estudio.
En términos de riqueza, la clase Zygnemaphyceae, principalmente las desmidiáceas, fue la mejor representada. Según Biolo, et al. (2015) y Algarte, et al. (2017), entre otros, la presencia de macrófitas contribuye considerablemente a aumentar la riqueza de este grupo, ya que estas plantas, además de servir de sustrato para la fijación, también liberan nutrientes como resultado de su proceso de envejecimiento y muerte, además de reducir la turbulencia del agua. Otras características que favorecieron la riqueza de las desmidiaceas en la ciénaga estudiada fueron los valores de temperatura registrados (>26 °C), la baja concentración de nutrientes, la baja conductividad eléctrica (<100μS/cm) y la prevalencia de un pH ligeramente ácido (Rivera-Rondón, et al., 2010).
La densidad, la riqueza específica, la diversidad y la dominancia fueron significativamente diferentes entre las tres macrófitas bajo estudio, resultados similares a los reportados por Montoya-Moreno & Aguirre-Ramírez (2008) en la ciénaga de Paticos, sistema cenagoso de Ayapel, Colombia. Dichas diferencias pueden explicarse por el tipo de colonización de los organismos perifíticos debido a las diferencias en las características morfológicas de las macrófitas, de allí que la influencia de la morfología de las macrófitas en los ensambles perifíticos haya sido reportada en diversos estudios que demuestran que esta comunidad es capaz de desarrollar preferencias de sustrato durante la etapa de colonización en las macrófitas (Schneck, et al., 2011; Ferreiro, et al., 2013). Es decir, la arquitectura morfológica de una macrófita en particular puede influir en el desarrollo y estructura del perifíton (Tunca, et al., 2014; Grutters, et al., 2017).
La macrófita L. sedoides presentó los valores más altos de densidad, riqueza específica y diversidad, lo que podría asociarse especialmente con su morfología de planta enraizada que desarrolla tallos sumergidos con hojas circulares flotantes en roseta de entre 5 y 20 cm de diámetro capaces de formar grandes bancos monoespecíficos (Moreira-Barbosa, et al., 2014), por lo que ofrece una mayor superficie disponible para la colonización por parte de los organismos del fitoperifíton dada su abundancia en la zona de estudio. Según Pott & Pott (2000), L. sedoides crece naturalmente en llanuras de inundación y lagunas permanentes con poco profundidad y suelos limoso-arcillosos, es de amplia distribución natural y se encuentra comúnmente en el Neotrópico, aunque la información sobre su ecología es escasa en la literatura científica.
Eichhornia azurea ocupó el segundo lugar en términos de densidad, riqueza y diversidad de organismos fitoperifíticos. Esta macrófita presenta raíces insertadas en el tallo semejantes a largas cabelleras que se componen de múltiples ramificaciones capaces de alcanzar longitudes de hasta un metro (Padial, et al., 2009), lo que le permite ser un sustrato adecuado para el desarrollo de una significativa comunidad fitoperifítica. En el caso de N. indica, los bajos valores de densidad, riqueza y diversidad se asociaron con su morfología, cuyo sistema radicular presenta un área más pequeña, principalmente en los nodos, además de poseer un tallo largo flotante, cilíndrico y sin ramificaciones que alcanza hasta los tres metros de largo (Marwat, et al., 2009)
Las diatomeas N. integra, F. rhomboides y Eunotia sp. se encontraron entre las especies de mayor abundancia en las tres macrófitas estudiadas. Los géneros Frustulia y Navicula producen matrices mucilaginosas que facilitan su fijación al sustrato y son a menudo dominantes en los ambientes acuáticos (Werum & Lange-Bertalot, 2004; Metzeltin & Lange-Bertalot, 2009). Eunotia, por su parte, tiene la facilidad de colonizar los ambientes por su rápido crecimiento, desarrollándose en parches y aumentando progresivamente su densidad (Ferrari, et al., 2007). Asimismo, según diversos autores como Lange-Bertalot (2001) y Sala, et al. (2002), los géneros Frustulia y Eunotia son abundantes en ambientes oligotróficos y con pH ácido, lo que coincide con las condiciones registradas en la ciénaga Plaza Seca durante el tiempo del estudio.
Similitud entre macrófitas
En la comunidad fitoperifítica la similitud entre las macrófitas estudiadas fue poca, lo que estaría relacionado con su arquitectura y textura, como lo sugieren los trabajos de Sultana, et al. (2010) y Thomaz & Cunha (2010), entre otros. Según Rodrigues, et al. (2003), el desarrollo del fitoperifíton está intrínsecamente relacionado con las características estructurales del sustrato vivo al que esté adherida, de manera que la composición y riqueza del fitoperifíton pueden diferir entre diferentes especies de macrófitas acuáticas (Wehr, et al., 2015). Así, macrófitas con diferente estructura morfológica pueden albergar naturalmente diferentes comunidades perifíticas (Cano, et al., 2016).
Por otro lado, la marcada influencia del periodo hidrológico sobre la comunidad fitoperifítica estudiada es atribuible al significativo número de morfoespecies exclusivas de alguno de los periodos hidrológicos estudiados. El pulso hidrológico es uno de los factores que regula y estructura las comunidades fitoperifíticas (Rodrigues & Bicudo, 2001; Pereira, et al., 2007; Agostinho, et al., 2009), ya que genera variaciones en profundidad, lo que afecta directamente la irradiación subsuperficial y la abundancia de las plantas acuáticas en las que esta comunidad se desarrolla (Goldsborough, et al., 2005).
Conclusiones
El presente estudio constituye una línea base para el conocimiento de las comunidades fitoperifíticas que se desarrollan en ciénagas de zonas bajas tropicales como las del río Atrato en el departamento del Chocó. Las diferencias en densidad, riqueza y composición del fitoperifíton en las macrófitas estudiadas corroboran los hallazgos de otros trabajos en relación con la importancia de la morfología en el desarrollo de esta comunidad biológica. Las diatomeas fueron el grupo dominante en las tres macrófitas debido a sus estructuras y adaptaciones para fijarse al sustrato (pedúnculos, ganchos, sustancias mucilaginosas).