Introducción
La región Caribe de Colombia exhibe variación ambiental a lo largo de su geografía, así como distintas formas de uso del suelo en esas condiciones heterogéneas (IDEAM, et al., 2007). Con altitudes bajas, un territorio de gran extensión formado por colinas, contrafuertes montañosos y planicies aluviales, la región tiene clima cálido seco y una vegetación modelada por condiciones de marcada estacionalidad en la distribución de las lluvias, lo que influye en sus rasgos estructurales, fisonómicos y funcionales y la configura con un bosque seco tropical (BST) (Instituto de Investigación de Recursos Biológicos Alexander von Humboldt - IAvH, 1998; Miles, et al., 2006). Este bosque, parte del grupo florístico de Centro América y el norte de Suramérica (Pizano, et al., 2014; Dryflor, 2016; Kattan, et al., 2019), con pocos remanentes de estructura y composición semejantes a las condiciones originales (González-M., et al., 2018), luce como un mosaico de parches de variada extensión cubiertos por vegetación natural e inmersos en matrices de hábitats modificados (Portillo-Quintero & Sánchez-Azofeifa, 2010). Dicha fragmentación se reconoce como un rasgo del bosque seco neotropical de existencia antigua relacionada con la evolución y la biogeografía de los linajes de plantas que contiene (Pennington, et al., 2009; Dick & Pennington, 2019), así como con la intervención humana durante tiempo prolongado (Fajardo, et al., 2005; Portillo-Quintero, et al., 2015).
Los estudios sobre la cobertura vegetal en el Caribe colombiano (IAvH, 1998) y las publicaciones de los últimos años reflejan un interés creciente en el conocimiento del BST (Mendoza-C., 1999; Marulanda, et al., 2003; Ruiz & Fandiño, 2009; Carbonó-Delahoz & García-Q., 2010; Patiño & Rangel-Ch., 2011; Rangel-Ch., et al., 2011; Rangel-Ch., 2012; Rodríguez, et al., 2012; Olascuaga, et al., 2016; Sanmartín-Sierra, et al., 2016; Herazo, et al., 2017; Aldana-Domínguez, et al., 2017; García-Martínez & Mercado-Gómez, 2017; Lücking, et al., 2019), aunque es común escuchar afirmaciones de que lo alcanzado hasta el momento es insuficiente (Kattan, et al., 2019). En lo referente a la estimación de la diversidad de plantas, los estudios hacen énfasis en una mayor proporción de la diversidad alfa, en tanto que entre los análisis de la diversidad beta se destacan las importantes contribuciones de Castellanos-Castro & Newton (2015) y Kattan, et al. (2019). El estudio de ambos componentes es de considerable importancia, sobre todo el de la diversidad beta, pues permite establecer la relación directa de la escala local con el conjunto amplio de las especies a escala regional, es decir, la diversidad gamma (Baselga & Leprieur, 2015).
El concepto de diversidad beta se aplica al grado de cambio en la composición de una comunidad entre una unidad de muestreo y otra a lo largo de gradientes (Carvalho, et al., 2012), o a la variación en la composición de la comunidad entre las unidades de muestreo (Anderson, et al., 2011). Se han propuesto muchas medidas para lograr una estimación apropiada (Koleff, et al., 2003; Legendre & De Cáceres, 2013; Calderón-Patrón, et al., 2016), pero aún no se alcanza un consenso general sobre la forma más adecuada de responder con mayor exactitud a cuestionamientos específicos, aunque hay diferentes enfoques válidos para obtener resultados verificables.
En estudios a escala local en el BST del Caribe se ha estimado la rotación entre fragmentos con distinto grado de intervención, y se ha encontrado una gran diversidad beta atribuible a diferencias ambientales y de manejo (Castellanos-Castro & Newton, 2015). Se sabe que la fragmentación del hábitat, entendida como su ruptura, puede conducir a una mayor diversidad beta (Fletcher, et al., 2018), pero debe advertirse que con los valores obtenidos mediante los índices de disimilitud habituales es difícil avanzar en la elucidación de los posibles procesos responsables de las diferencias en la composición y la rotación de especies de los sitios (Calderón-Patrón, et al., 2016). Por ello, la división de la diversidad beta en sus componentes permite una mejor comprensión de las posibles causas de las diferencias, lo que incide en las estrategias de conservación (Moreno, et al., 2017). En ese sentido, se han propuesto varios métodos para los casos en que se producen diferentes patrones de composición (Baselga, 2010; 2012; Carvalho, et al., 2012; 2013; Podani & Schmera, 2016).
En este sentido, el objetivo del presente trabajo fue cuantificar la diferenciación en la composición del BST del Caribe colombiano y determinar los factores responsables de la variación en sus comunidades florísticas, tratando de responder a las siguientes preguntas: ¿cuál es el grado de variación en la composición florística entre los fragmentos remanentes del BST en el norte del Caribe colombiano? ¿A qué componente de la diversidad beta puede atribuirse la variación en la composición florística entre fragmentos del bosque seco en la costa caribe de Colombia? Para responderlas se midió la composición de las comunidades de plantas con flores en cuatro fragmentos distanciados geográficamente ubicados en la zona norte de la región. Se espera que los resultados obtenidos contribuyan a mejorar el conocimiento de la biodiversidad del BST en el Caribe colombiano y sirvan de respaldo en la proyección de estrategias para su manejo.
Materiales y métodos
Area de estudio
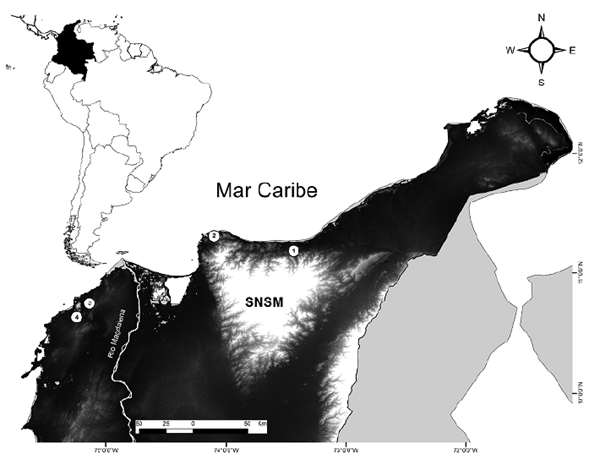
Se analizaron los datos obtenidos de los muestreos realizados entre septiembre del 2018 y junio del 2019 en cuatro fragmentos del BST en el norte del Caribe de Colombia (Figura 1). Los sitios se escogieron utilizando mapas nacionales de coberturas de la tierra (IDEAM, 2015a) y considerando su localización en la región, la homogeneidad en la cobertura y la accesibilidad para el desarrollo del trabajo (seguridad, garantía de acceso y movilidad). Se ubicaron a distancias de 20 a 200 km entre sí en matrices de más de 300 ha de BST con historias de intervención similares (remanentes de bosque fragmentado, áreas de ganadería y cultivos abandonados) en lugares que hoy están dedicados a la protección de la biodiversidad. El clima en la región de estudio es cálido semiárido (clasificación de Caldas-Lang), con una precipitación media anual entre 1.000 y 1.500 mm en un patrón bimodal de máxima pluviosidad en octubre, una temperatura media anual que oscila entre 26 y 28 °C y una máxima de 34 °C (IDEAM, 2015b). Los sitios de muestreo fueron: 1) la reserva Miramar, a 180 m s.n.m., en jurisdicción del municipio de Dibulla (departamento de La Guajira), denominado GUA, con un relieve de colinas bajas en estribaciones de la Sierra Nevada de Santa Marta (SNSM), surcado por corrientes permanentes de agua e inmerso en una zona de ganadería y cultivos transitorios; 2) en inmediaciones del Parque Nacional Natural Tayrona (departamento de Magdalena), a 50 m s.n.m., denominado MAG, con relieve de laderas y cauces de quebradas intermitentes en las estribaciones noroccidentales de la SNSM en un área de amortiguación del parque natural con indicios de ganaderías; 3) en la reserva El Palomar, municipio de Piojó (departamento del Atlántico), a 200 m s.n.m., denominado ATL, de relieve quebrado con pendientes moderadas y cauces de quebradas intermitentes, rodeado de fincas ganaderas y cultivos transitorios; (4) en la hacienda El Ceibal, municipio de Santa Catalina (departamento de Bolívar), a 40 m s.n.m., denominado BOL, de relieve plano con presencia de colinas bajas e influido por inundaciones temporales del Canal del Dique en un área de fincas ganaderas.
Toma de datos y análisis de la información
En cada sitio se registraron los individuos leñosos con un diámetro de 1 cm o más a la altura del pecho y a 1,3 m de la base siguiendo la metodología descrita por Villareal, et al. (2006). Las plantas se identificaron en campo y en casos necesarios se recolectaron muestras (permiso No.1293 de 2013 expedido por la Autoridad Nacional de Licencias Ambientales - ANLA), y se procesaron según los estándares establecidos. Para la determinación taxonómica se consultó a especialistas en grupos taxonómicos de la colección del herbario UTMC y las plataformas virtuales de los herbarios COL, GH, NY, Jstor Plant Science, The Plant List y Trópicos. Los especímenes producidos (Tabla 1S, https://www.raccefyn.co/index.php/raccefyn/article/view/1267/2945) se depositaron en la colección del herbario UTMC bajo la serie E. Carbonó (EC).
Con el propósito de evaluar la completitud del muestreo, se estimó su cobertura en cada fragmento (Chao & Jost, 2012) con el paquete estadístico en línea iNEXT (Chao, et al., 2016). Se calculó el índice de valor de importancia (IVI) de las especies, y para evaluar la distribución de los individuos por tamaños, se construyeron intervalos de clase a partir del diámetro a la altura del pecho (DAP) (Rangel-Ch. & Velásquez, 1997). La estructura vertical de la vegetación se evaluó a partir de los datos de altura por individuo y según los estratos propuestos por Rangel & Lozano (1986). La estructura se analizó con base en los índices de diversidad alfa verdadera expresados en los números efectivos de especies (Jost, 2006) y se elaboró el gráfico de distribución de abundancia de las especies (species abundance distribution, SAD (Ulrich, et al., 2020). La similitud florística entre fragmentos se calculó mediante el coeficiente de similitud de Serensen (cualitativa) basado en la presencia o ausencia de especies, en tanto que con las abundancias se calculó el índice de similitud de Morisita Horn (cuantitativa). La relación entre la distancia física (geográfica) y la distancia biológica (diversidad beta) entre los fragmentos se determinó con una prueba de Mantel (método de Pearson y Spearman) en la matriz de distancias biológicas construida a partir del coeficiente de similitud de Serensen (presencia o no de especies) y la distancia en kilómetros entre los sitios. La diversidad beta de los fragmentos se exploró mediante un análisis de ordenación Bray-Curtis no direccional y se generó el respectivo NMDS (non-metric multidimensional scaling) (coeficiente de Jaccard). Para explorar la diversidad beta entre sitios se estimaron las tasas de recambio de especies según los índices propuestos por Baselga (2010). También se hallaron los valores obtenidos mediante los índices propuestos por Carvalho, et al. (2012) y para detectar el anidamiento se aplicó el índice NODF (nestedness metric based on overlap and decreasing fill) (Almeida-Neto, et al., 2008). Mediante rutinas de comparación entre múltiples sitios (multiplesite dissimilarities, n>2), se valoró el peso (participación o influencia) que tienen los componentes de la diversidad beta en los sitios estudiados. Los análisis se hicieron con los paquetes betapart 1.5.1 (Baselga, et al., 2018) y vegan 2.5-6 (Oksanen, et al., 2019), y el programa R versión 3.6.2 (R Development Core Team, 2019).
Resultados
La representatividad de las plantas con flores en los sitios de muestreo en los cuatro fragmentos de bosque seco tropical del Caribe colombiano estudiados fue alta (cobertura del muestreo, Ĉn>0,96=96 %).
Composición y estructura
Se registraron 166 especies pertenecientes a 55 familias de plantas con flores (Tabla 1S, https://www.raccefyn.co/index.php/raccefyn/article/view/1267/2945). Las especies reconocidas son típicas de sectores secos y, en general, corresponden a flora característica del ecosistema de BST dominante en el cinturón árido pericaribeño (Pizano & García, 2014). En los cuatro sitios las familias con mayor riqueza específica fueron Fabaceae (28 especies), Rubiaceae (12 especies), Malvaceae (10 especies), Bignoniaceae (8 especies) y Capparaceae (8 especies). Astronium graveolens, Bursera simaruba y Acacia polyphylla se encontraron en todos los fragmentos, 109 especies solo en alguno de ellos, 35 en dos y 19 en tres. Especies poco frecuentes como Homalolepis cedrón y Pterygota colombiana se encontraron únicamente en GUA.
Se registraron 1.977 individuos con un DAP ≥ 1 cm. El fragmento BOL presentó la mayor abundancia (534 individuos), seguido de GUA con 528 y de MAG con 495; ATL registró el valor más bajo, con 420 individuos. Las especies más abundantes fueron Protium tenuifolium (140 individuos), B. simaruba (108), Mayna grandifolia (90), Capparidastrum tenuisiliquum (88), H. cedron (77) y Calycophyllum candidissimum (76).
En general, la distribución de la abundancia de las especies (SAD) se ajustó al modelo del tipo de series logarítmicas (Figura 2), con mayor proporción de "especies raras" y pocas "especies de abundancia intermedia" y "muy abundantes".
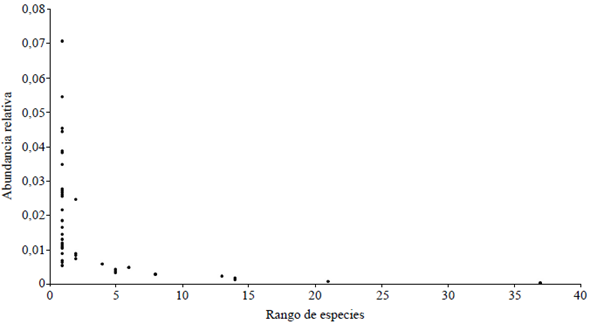
Figura 2 Distribución de abundancia de las especies registradas en fragmentos de bosque seco tropical del Caribe colombiano
La mayoría de los individuos (80 %) se encontró en los estratos arbustivo y arbolito, la porción restante (20 %) correspondió a árboles (Figura 1S, https://www.raccefyn.co/index.php/raccefyn/article/view/1267/2943). El promedio de altura durante todo el estudio fue de 8,26 m. El mayor promedio de altura se dio en ATL (9,18 m), seguido de BOL (8,32 m) y GUA (8,24 m); el de menor altura fue en MAG, con 7,44 m.
La distribución de los individuos muestreados según los intervalos de las clases diametrales arrojó una curva en forma de J invertida (Figura 2S, https://www.raccefyn.co/index.php/raccefyn/article/view/1267/2944) en todos los sitios, con la mayor proporción de los individuos incluidos en la menor clase (valores de DAP ≤ 12 cm).
Al observar el índice de valor de importancia (IVI) de cada fragmento (Tabla 2S, https://www.raccefyn.co/index.php/raccefyn/article/view/1267/2946), se evidenció que en ATL cinco de las siete especies con mayores IVI eran árboles y dos mostraban porte de arbolitos; en BOL, de nueve especies, seis eran árboles y tres arbolitos; en GUA, cinco de siete especies eran árboles, una tenía porte de arbolito y otra era una palma; en MAG, cinco de nueve especies eran árboles y cuatro arbolitos. En los tres primeros fragmentos el atributo que más influyó sobre el IVI fue la cobertura relativa y, en el último, la densidad relativa.
Diversidad
Los índices de diversidad alfa utilizados mostraron un comportamiento similar en los fragmentos de BST estudiados; los fragmentos ATL, BOL y GUA presentaron mayores valores de especies efectivas y el fragmento MAG fue el ensamblaje más uniforme (Tabla 1).
Tabla 1 Abundancia e índices de diversidad, dominancia y equidad calculados para cuatro fragmentos de bosque seco tropical del Caribe colombiano
| Índices | Atlántico | Bolívar | La Guajira | Magdalena |
|---|---|---|---|---|
| N (número de individuos) | 420 | 534 | 528 | 495 |
| λ (índice de Simpson) | 0,05 | 0,05 | 0,10 | 0,07 |
| N0 (número de Hill 0 = S=q 0 ) | 65 | 74 | 66 | 43 |
| N1 (número de Hill 1 = e H =q¡) | 33,59 | 36,11 | 22,01 | 21,28 |
| N2 (número de Hill 2 = 1/λ=q2) | 21,73 | 20,20 | 9,73 | 14,49 |
| H' (índice de Shannon-Wiener) | 3,51 | 3,59 | 3,09 | 3,06 |
| J ' (índice de equidad de Píelou) | 0,84 | 0,83 | 0,74 | 0,81 |
| E' (índice de equidad de Hill) | 0,64 | 0,55 | 0,44 | 0,68 |
Los índices de diversidad beta más altos se presentaron en el GUA y el MAG (Psor=0,87), lo que permite afirmar que las mayores diferencias (disimilitud) se expresaron entre este par de fragmentos; la diversidad beta más baja se registró en las comunidades de ATL y BOL (Psor=0,49), confirmando la similitud existente entre ellas (Tabla 2). Además, se observó una relación poco importante (Pearson rM=0,384; p<0,05 y Spearman rM=0,2571; p<0,05) entre la distancia física y la distancia biológica, lo que sugiere que el aislamiento geográfico no fue de mayor influencia en la diferenciación de la composición de estas comunidades.
Tabla 2 Índices de diversidad beta calculados en cuatro fragmentos de bosque seco tropical del Caribe colombiano
| Índices | Atlántico-Bolívar | Atlántico-La Guajira | Atlántico-Magdalena | Bolívar La Guajira | Bolívar -Magdalena | La Guajira Magdalena |
|---|---|---|---|---|---|---|
| J | 35 | 19 | 18 | 18 | 13 | 7 |
| IJ | 0,20 | 0,13 | 0,14 | 0,11 | 0,10 | 0,06 |
| Isor | 0,50 | 0,29 | 0,33 | 0,25 | 0,22 | 0,12 |
| βsor | 0,49 | 0,70 | 0,66 | 0,74 | 0,77 | 0,87 |
| βsim | 0,46 | 0,70 | 0,58 | 0,72 | 0,69 | 0,83 |
| βnes | 0,034 | 0,002 | 0,085 | 0,015 | 0,080 | 0,034 |
| Βcc | 0,663 | 0,830 | 0,80 | 0,852 | 0,875 | 0,931 |
| β-3 | 0,576 | 0,821 | 0,555 | 0,786 | 0,576 | 0,705 |
| βrich | 0,086 | 0,008 | 0,244 | 0,065 | 0,298 | 0,225 |
| NODF | 0,538 | 0,292 | 0,418 | 0,272 | 0,302 | 0,162 |
J: número de especies compartidas; Ij coeficiente cualitativo de similitud de Jaccard; Isor: coeficiente cualitativo de similitud de Serensen; βsor: diversidad beta (disimilaridad de Serensen); βsim: diversidad beta de Simpson (disimilaridad debida a reemplazo); βnes: diversidad beta resultante (disimilaridad debida a anidamiento); βcc: diversidad beta total (disimilaridad de Jaccard); β-3: reemplazo de especies relativizadas (disimilaridad debida a reemplazo): βrich: diferencia de riqueza de especies relativizadas (disimilaridad debida a diferencia de riqueza): NODF: medida de anidamiento basado en superposición y decrecimiento
Según el índice de partición de la diversidad beta (β sor ), se presentó un fuerte patrón de recambio de especies (βsim) entre los cuatro fragmentos, con valores muy bajos de anidamiento (βnes); el mayor valor de recambio se dio en el GUA y el MAG (βsmi=0,83), y la mayor pérdida de especies (βnes=0,085) se presentó en el ATL y el MAG (Tabla 2).
Los valores de β (disimilaridad) obtenidos mediante rutinas de comparación entre múltiples sitios evidenciaron el marcado peso, la participación o la influencia que tiene el recambio de especies sobre la diferenciación relativa en la composición de los sitios estudiados (Figura 3), lo que permite afirmar que la estructura de las comunidades está modelada por la rotación espacial de especies; la diversidad beta observada fue, en general, alta (>70 %).
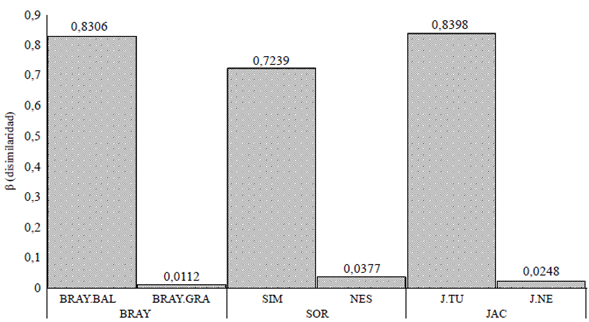
Figura 3 Valores de (disimilaridad) calculados con datos cuantitativos (abundancia) aplicando el índice de Bray-Curtis (BRAY = BRAY.BAL + BRAY.GRA) y datos cualitativos (presencia o ausencia) aplicando los índices de Serensen (SOR = SIM + NES) y Jaccard (JAC = J.TU + J.NE) en los fragmentos de bosque seco tropical del Caribe colombiano estudiados
El análisis de conglomerados evidenció que los fragmentos de BST estudiados se agruparon en tres grupos según la composición florística, con una disimilitud general entre zonas por encima del 50 % (Figura 4). Un primer grupo lo conformaron el ATL y el BOL, los cuales presentaron una menor disimilitud. El GUA conformó el segundo grupo y el MAG el tercero, siendo este último más disímil frente a los demás y con una menor semejanza frente al primer grupo.
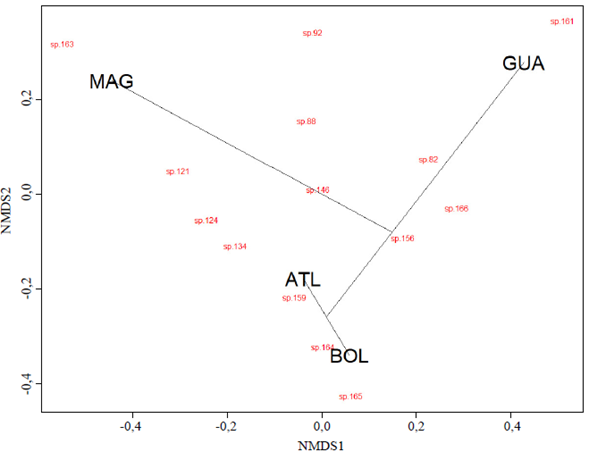
Figura 4 Agrupación de los fragmentos de bosque seco tropical del Caribe colombiano estudiados con base en la similitud de la comunidad de especies de plantas con flores (presencia o ausencia). Método de agrupación: UPGMA; ajuste cofenético: 0,8294978
Utilizando el método multiplicativo,
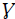 = α x β (Chao, et al., 2012), para evaluar la diferenciación relativa en la composición de especies en los fragmentos estudiados, se presentaron en esta región 2,67 comunidades virtuales distintas en la composición de especies de plantas con flores, es decir, se registró una diversidad
= α x β (Chao, et al., 2012), para evaluar la diferenciación relativa en la composición de especies en los fragmentos estudiados, se presentaron en esta región 2,67 comunidades virtuales distintas en la composición de especies de plantas con flores, es decir, se registró una diversidad
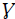 (regional) 2,67 veces mayor que el promedio de los cuatro fragmentos estudiados.
(regional) 2,67 veces mayor que el promedio de los cuatro fragmentos estudiados.
Discusión
Los resultados obtenidos evidenciaron la heterogeneidad en la composición de los fragmentos de BST a lo largo de la región norte del Caribe colombiano. Con base en la literatura existente (Pennington, et al., 2009), la diferenciación entre los fragmentos evaluados permite conjeturar que estos han derivado de una matriz de vegetación originalmente heterogénea establecida en la región bajo el influjo de procesos favorecedores de esa condición que, afectada por la intervención antrópica, sufrió el fraccionamiento en par-ches con ensamblajes florísticos diferenciados en distintas condiciones ambientales (Tscharntke, et al., 2012; Arroyo-Rodríguez, et al., 2013; Soares, et al., 2019); sin embargo, sería conveniente contemplar la influencia del historial de perturbación particular de cada localidad en la modelación estructural de la vegetación. La proporción de especies en cada fragmento fue menor que en el conjunto general y la estructura de sus comunidades se ha modelado por rotación espacial. La diversidad beta observada fue alta, resultado que coincide con lo encontrado por Castellanos-Castro & Newton (2015) en el BST del Caribe colombiano, por Kattan, et al. (2019) en el BST de Colombia, y por distintos autores en bosques tropicales estacionalmente secos (Pennington, et al, 2009; Apgaua, et ah, 2014; Soares, et al, 2019). Se reitera que la diversidad beta se ve afectada por la marcada alteración en la configuración espacial del paisaje (Fletcher, et ah, 2018), proceso que puede ocasionar distintos cambios ambientales y generar diferenciación florística entre comunidades locales (Arroyo-Rodríguez, et al, 2016). En el caso del presente estudio, aunque no se sometió a comprobación, se puede inferir que la variabilidad ambiental en el paisaje influyó sobre la composición de las comunidades más que el impulso de las características locales en la composición particular de cada fragmento. Se sabe que los patrones de diversidad beta se relacionan con los procesos que operan a escala local y regional dependiendo de la configuración espacial regional y de las comunidades de plantas (Arroyo-Rodríguez, et al, 2013), hecho observado en otros ambientes secos (De Jesus, et ah, 2018). Con base en los resultados, es posible concluir, al igual que otros autores (Soares, et al, 2019), que la diversidad beta es la que más contribuye a la diversidad regional, generando el patrón de muchas especies restringidas localmente y con conjuntos distintos de especies exclusivas en cada fragmento.
En los cuatro fragmentos las especies que representaron más de la mitad del índice de valor de importancia (mayores IVI) correspondieron a aquellas con las características del bosque seco tropical americano. Entre ellas se destacan B. simaruba y C. candidissimum, reconocidas como especies de amplia distribución en el Neotrópico y constantes en los ensamblajes de este ecosistema. Algunas otras registradas en los fragmentos estudiados y en sitios adyacentes son generalistas ecológicos de amplia distribución en los bosques secos, pero poco abundantes localmente (Maclura tinctoria, Guazuma ulmifolia y Cordia alba), lo que coincide con lo reportado por Dryflor (2016) para el bosque seco tropical estacional americano.
Dada la alta tasa de recambio en los fragmentos, pocas especies fueron de amplia distribución, en tanto que muchas estaban confinadas a lugares definidos, lo que denota un patrón considerado propio de los bosques tropicales y de los secos en particular (Soares, et al., 2019). Con un bajo grado de uniformidad, el modelo de distribución de abundancias (SAD) general podría ajustarse al tipo de series logarítmicas (Ulrich, et al., 2020), en el que aparecen de forma proporcionalmente menor las especies de amplia distribución en comparación con las espacialmente restringidas, lo que se vería incentivado por la heterogeneidad ambiental (Jenkins, et al., 2018). Se admite que el comportamiento de la distribución de la abundancia local puede reflejar una complejidad en la que contrastan las expresiones de cada fragmento específico según el influjo de factores locales y los patrones comunitarios regionales (Ulrich, et al., 2016).
La diferencia de la composición florística entre los fragmentos podría responder a la distancia: el BOL (El Ceibal) y el ATL (El Palomar), separados por menos de 50 km, fueron menos disímiles comparados con el MAG (Tayrona) y el GUA (Miramar), separados entre sí por más de 50 km. La presencia de este patrón de decaimiento de la disimilitud se ve respaldada por una diversidad beta menor entre zonas consecutivas (Rosabal, et al., 2016), hecho atribuible a la similitud de las condiciones ambientales en sitios cercanos o a la separación de las especies con diferentes características fisiológicas. La diversidad beta puede verse influida por la distancia geográfica o ambiental y la composición de especies puede variar en las comunidades debido a diferencias ambientales entre sitios o a limitaciones espaciales e históricas (De Jesús, et al., 2018). En este caso en particular, los resultados arrojados por la prueba de Mantel no evidenciaron una relación entre los dos elementos, lo que sugiere que la distancia contribuye en menor medida a la diferencia en la composición de las comunidades.
Se observó una diferencia entre el MAG (Tayrona) y el resto de fragmentos, en especial en cuanto a la riqueza específica, que se explicaría por factores que influyen en la variación estacional en la disponibilidad de agua (Castellanos-Castro & Newton, 2015) y generan un enclave seco en el flanco noroccidental de la Sierra Nevada de Santa Marta, lo que aunado a la poca conexión con los otros sitios, determina la preponderancia de impulsores ambientales de la diversidad beta, ya que en hábitats con fuertes filtros ambientales solo un pequeño número de especies del grupo regional logra tolerar las duras condiciones, por lo que la estructuración de las comunidades de plantas puede verse determinada por procesos de selección de nicho, como se ha señalado para otros grupos biológicos (Audino, et al., 2017). En el fragmento GUA (Miramar) dominó P. tenuifolium, especie perennifolia, rasgo este que se ha observado en varias especies presentes en el sitio. Se ha reportado la presencia de bosques secos con especies de hoja perenne en algunas regiones neotropicales (Fajardo, et al., 2005) y la adaptación a la pobreza de nutrientes en los suelos de las laderas costeras de la Sierra Nevada explicaría su presencia allí, así como en algunas regiones de Venezuela.
Las pocas muestras de especies reconocidas como útiles en los sitios estudiados reflejarían el tipo de degradación a que han sido sometidos. Por ejemplo, la escasez de muestras de especies consideradas valiosas por su madera como la caoba (Swietenia macrophylla King), el cedro (Cedrela odorata L.), el carreto (Aspidosperma polyneuron Müll.Arg.) y el nazareno (Peltogyne purpurea Pittier) (Cárdenas & Salinas, 2007), y la palma amarga (Sabal mauritiiformis (H. Karst.) Griseb. y H. Wendl), usada en la construcción de techos, cuya limitada presencia o total ausencia en los transectos analizados puede atribuirse a la extracción selectiva durante largo tiempo. Si bien la evaluación de la degradación de un bosque requiere el uso de una metodología apropiada, en este caso la ausencia de algunas clases diamétricas, la baja densidad o desaparición de especies de valor comercial y la mayor densidad y dominancia de especies de poco valor comercial, permiten definirlos como bosque degradados (Vásquez-Grandón, et al., 2018).
El estudio de la diversidad beta cobra importancia porque ofrece respaldo para la planeación de estrategias de conservación biológica. La interpretación acertada de los patrones de diversidad en este paisaje, donde la fragmentación del hábitat a causa de las actividades humanas compromete la conservación de las comunidades biológicas, permite proyectar acciones de manejo o de intervención con mayor grado de certidumbre (Si, et al., 2015). Dado que la diversidad beta fue la que más contribuyó a la diversidad total, todos los fragmentos estudiados merecen catalogarse como objetivos para la conservación. Además de proteger los parches estudiados, la gran diferencia en la composición de las especies sugiere la necesidad de integrar más fragmentos, independientemente de su extensión (Soares, et al., 2019), para mantener la diversidad en proporción con la escala del paisaje (Arroyo-Rodríguez, et al., 2009) en los bosques secos del Caribe colombiano.