Introducción
Aunque los líquenes son producto de una de las interacciones mutualistas mejor conocidas (Lutzoni, et al., 2018), es difícil definirlos debido a su carácter simbiótico. Tradicionalmente se los define como holobiontes conformados por un hongo (micobionte) y una o varias poblaciones fotosintéticas de algas o cianobacterias (fotobiontes) (Hawksworth, 1988), pero la interacción micobionte-fotobionte debe presentar propiedades emergentes y el talo conformado debe ser morfológicamente diferente al de las especies separadas (Ahmadjian, 1982). Recientemente se han encontrado más integrantes de la simbiosis y se tiene una visión más holística del liquen como un microhábitat en donde varias especies de hongos del clado Dikarya, microalgas y bacterias coexisten en un intrincado sistema simbiótico (Banchi, 2018; Arnold, et al., 2009; Muggia & Grube, 2010; U'Ren, et al., 2012; Spribille, et al., 2016, Hawksworth & Grube, 2020).
Además de ser una de las regiones con mayor riqueza de especies del mundo, el Neotrópico tiene una gran diversidad de líquenes y se estima que es posible encontrar una media de 600 especies por hectárea (Lücking, 2008; Lücking, et al., 2011). Los ecosistemas neotropicales tienen una historia dinámica, con cambios abruptos en la diversidad vegetal y una posible relación con la orogénesis de la cordillera de los Andes, que cambió el drenaje del río Amazonas y alteró por completo el paisaje en la región incrementando la diversidad (Hoorn, et al., 2010). Uno de los países neotropicales con mayor biodiversidad y menos explorados es Colombia, pues de las cerca de 3.600 especies de líquenes que se estima existen en el país, solo se han registrado alrededor de 1.800, es decir, que falta por registrar casi la mitad de la riqueza estimada (Sipman & Aguirre, 2016; Lücking, et al., 2009). Una de las razones de esta gran riqueza de especies es que, por su posición privilegiada con respecto al istmo de Panamá, Colombia está compuesta por tierras tropicales de una gran diversidad. Además, con la posterior formación de los Andes, se establecieron nuevas zonas de vida (como los valles interandinos) que potenciaron la ya considerable riqueza del territorio (Antonelli & Sanmartin, 2011) y transformaron la ecología de sus ecosistemas tropicales mediante intrincadas y complejas interacciones biológicas.
El catálogo actual de la flora del país incluye angiospermas, helechos briofitos y líquenes, con 24.000 especies de plantas y 1.750 de líquenes (Bernal, et al., 2016). Este catálogo ha sido un gran avance para el conocimiento de la flora de Colombia, pero aún hay enormes vacíos biogeográficos, taxonómicos y ecológicos. Algunas aproximaciones biogeográficas se enfocaron en las regiones donde ha habido más recolecciones, como la andina y la Amazonía (Rangel-Ch., 2004), pero no se ha analizado la liquenobiota del bosque seco, la del Chocó ni la del Caribe, lo que implica que tampoco se han analizado las relaciones fitogeográficas con base en los líquenes de las regiones y los biomas de Colombia.
La vida no se distribuye de manera uniforme; por ejemplo, las especies presentan patrones que van desde una amplia distribución (por ejemplo, las especies pantropicales) hasta los de distribución restringida debido a eventos de dispersión y a las particularidades ecológicas de estos organismos (Hutchinson, 1965; Feuerer & Hawksworth, 2007). Se pensaba que los hongos liquenizados tenían patrones similares a los de los microorganismos y, por ende, se ajustaban a la hipótesis de que todo está en todos lados, pero el ambiente selecciona ("everything is everywhere, but the environment selects") (Baas-Becking, 1934), lo que permite analizar la conexión entre las agrupaciones espaciales no solo por su cercanía, si no por las especies que conformen las comunidades biológicas de cada agrupación. En este contexto, el objetivo de este trabajo fue analizar la riqueza de los líquenes y las relaciones biogeográficas entre zonas de vida en Colombia, así como definir especies y géneros indicadores.
Materiales y métodos
Recopilación de la información
Se hizo una búsqueda de registros de hongos liquenizados en Colombia en distintas bases de datos y herbarios a nivel nacional (GBIF, SIB, COL, Univalle) y, además, se consultaron los registros de trabajos de grado y los artículos disponibles (Peláez, et al., 2013; Vargas-Mendoza, et al., 2014; Díaz-Escandón, et al., 2016; Feria & García, 2019). Posteriormente, los nombres se actualizaron en las bases de datos del Index Fungorum y Mycobank.
Se depuraron los datos de las localidades y se catalogaron en 11 regiones según la propuesta del IAvH (IDEAM, et al., 2017): 1) bosque húmedo del Amazonas (BHAma); 2) bosque húmedo del Chocó (BHCho); 3) bosque húmedo del Magdalena (BHMag); 4) bosque premontano; 5) Caribe; 6) montano; 7) Orinoquía; 8) páramo; 9) bosque seco del Caribe (SecoCar); 10) bosque seco del valle geográfico del río Cauca (SecoCau); 11) bosque seco del Magdalena (SecoMag); región andina (premontano a páramo); bosque seco (general), y bosque húmedo (Amazonas y Chocó), para así estimar el número de especies por zona de vida.
Análisis de los datos
Inicialmente se estimó el número de especies y géneros de cada zona de vida y se determinó el número de especies y géneros indicadores o endémicos de cada región (especies o géneros con presencia exclusiva en esa región). Se hicieron análisis de agrupamiento (enlazamiento simple) basados en especies y géneros para establecer las relaciones entre las regiones utilizando el índice de Jaccard. Para definir qué géneros determinan los agrupamientos en las regiones, se hizo un análisis de agrupamiento de dos vías (McCune & Grace, 2002), así como un escalamiento no métrico multidimensional (non-metric multidimensional scaling, NMS) para establecer las relaciones entre las zonas de vida, pero separando las andinas según el sistema cordillerano (cordillera Occidental, Central, Oriental y Sierra Nevada de Santa Marta), así como para establecer un potencial gradiente de la liquenobiota y obtener un modelo multivariado para clasificar zonas de vida con base en registros de líquenes. Se usó el índice de similitud de Jaccard para el NMS. Todos los análisis se efectuaron en PAST® 4.0 (Hammer, et al., 2001).
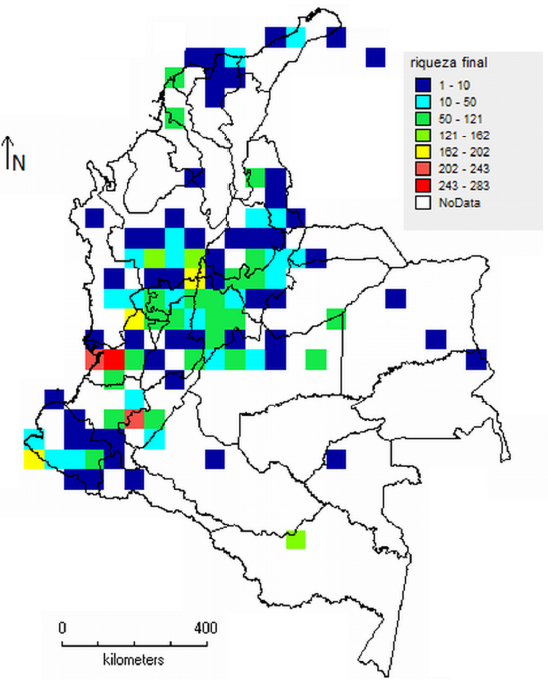
Por último, se estimó un mapa de la riqueza de los líquenes de toda Colombia (solo de los lugares con datos de líquenes). Para este fin, se asignaron coordenadas a todas las especies en las localidades de recolección y en DIVA-GIS se estimó la riqueza por cada celda de 0,5 ° (Hijmans, et al., 2001). También se calculó la elevación por celda de muestreo (promedio), con el fin de evaluar su relación con la riqueza de especies de líquenes.
En cuanto a la riqueza de especies, se usaron los estimadores de riqueza Chao 1 y Jackknife 1 para estimar la riqueza por región y determinar qué tanto se conoce de la diversidad en cada región.
Resultados
Se registraron cerca de 1.617 especies de hongos liquenizados para toda Colombia agrupados en 259 géneros y 66 familias. La región paramuna presentó 419 especies, la montana 475, la premontana 421 y Chocó 405, en tanto que en el Caribe solo se registraron 60 especies, es decir que las regiones montana y premontana, el páramo y Chocó aportaron el mayor número de géneros. Al considerar las regiones en un sentido más amplio, en la región de zonas bajas (Ama + Cho) se encontraron 357 especies, en la Andina, 504 y en el bosque seco, 141 (Tabla 1). En cuanto a los géneros, en la región Amazonía+Chocó se registraron 127, en el bosque seco, 91 y en los Andes, 181.
Tabla 1 Número de géneros y especies restringidos de cada región analizada
| Región | Especies | Géneros | Recolecciones | Especies restringidas | Géneros restringidos | Especies RES (%) | Géneros RES (%) |
|---|---|---|---|---|---|---|---|
| BHAma | 275 | 78 | 291 | 117 | 15 | 43 | 19,2 |
| BHCho | 385 | 103 | 790 | 158 | 12 | 41 | 11,7 |
| BHMag | 229 | 81 | 317 | 64 | 3 | 28 | 3,7 |
| Premontano | 385 | 118 | 803 | 86 | 8 | 22 | 6,8 |
| Caribe | 66 | 27 | 64 | 14 | 0 | 21 | 0,0 |
| Montano | 449 | 118 | 1518 | 127 | 8 | 28 | 6,8 |
| Orinoquía | 168 | 56 | 194 | 48 | 4 | 29 | 7,1 |
| Paramo | 400 | 99 | 1273 | 203 | 23 | 51 | 23,2 |
| SecoCar | 142 | 57 | 163 | 51 | 0 | 35 | 0,0 |
| SecoCau | 181 | 83 | 449 | 65 | 0 | 36 | 0,0 |
| SecoMag | 79 | 38 | 111 | 12 | 0 | 15 | 0,0 |
| Andina | 890 | 181 | - | 289 | 65 | 32 | 35,9 |
| Seco | 320 | 91 | - | 132 | 10 | 41 | 11,0 |
| Amazonía+Cho | 556 | 127 | 1078 | 316 | 38 | 57 | 29,6 |
BHAma= bosque húmedo Amazonía, BHCho= bosque húmedo Chocó, BHMag= bosque húmedo Magdalena, SecoCar= bosque seco Caribe, SecoCau= seco Cauca, SecoMag= seco del Magdalena
De las especies encontradas, 903 están presentes exclusivamente en una región (56 %), 321 en dos (19 %), 262, en 3 a 4 regiones (16 %) y 23 especies se registraron en 8 a 14 regiones (0,5 %). En cuanto a las especies indicadoras por región, en el páramo hubo el mayor número de especies restringidas, seguido por el bosque húmedo del Chocó y el premontano, en tanto que en el bosque seco del Magdalena y el Caribe se registraron menos especies restringidas (Tabla 1). En términos de regiones en el más amplio sentido, los bosques húmedos (Amazonía+Chocó) tuvieron 316 especies restringidas, la región Andina, 289 y el bosque seco, 132. En términos de géneros indicadores, el páramo presentó el mayor número (21), seguido por la Amazonía (15), y Chocó (11), en tanto que en las regiones Caribe, Caribe seco, Valle seco y Magdalena seco, no se registraron géneros (Tabla 1). En la región andina se registraron 65 géneros de distribución restringida, en el bosque húmedo de zonas bajas, 37 y en el seco, 10.
Relación entre regiones
El análisis de agrupamiento por especies de líquenes evidenció la existencia de dos grupos grandes: uno formado por ecosistemas andinos (Andes) y otro por el resto de regiones. El segundo grupo se subdividió en un ecosistema húmedo de zonas bajas (Amazonía y Chocó) y en otro de bosques secos, el Caribe y la Orinoquía. Los grupos más pequeños estaban conformados por el bosque seco del Cauca, el bosque húmedo del Magdalena y el bosque seco del Caribe, así como por el bosque seco del Magdalena y la Orinoquía. El análisis desde la perspectiva de los géneros evidenció un patrón similar al basado en las especies (Figura 1).
Las relaciones de recambio de especies entre zonas de vida evidenciaron varios patrones (Tabla 2). La liquenobiota de los bosques húmedos tuvo gran afinidad con la de los bosques del Chocó y Amazonas, incluida la Orinoquía. En contraste, en estos bosques de elevaciones bajas se registró poca similitud con los páramos (3,3-5,0 %) y los bosques montanos (13,67-14,82 %). Debe señalarse que en el bosque húmedo del Chocó se registró una gran similitud con el bosque seco del Magdalena. Asimismo, el bosque húmedo de esta región mostró una mayor afinidad con el bosque seco de la misma región, el bosque seco del río Cauca y el bosque del Caribe, pero poca similitud con el bosque húmedo de la Amazonía y el páramo. La Orinoquía, además de su gran similitud con los bosques de la Amazonía, Chocó y Magdalena, también tuvo una alta afinidad con los bosques secos y el Caribe; en esta zona de vida se reportaron índices de similitud con poca variación, con valores bajos solo en los páramos y el bosque montano (Tabla 2). Los bosques secos presentaron altas afinidades entre sí y con los bosques húmedos de la Amazonía; el bosque seco del río Cauca tuvo una mayor afinidad con el bosque seco del Magdalena, el cual registró gran similitud con el bosque húmedo del Magdalena y el Chocó. Estos bosques secos también tuvieron gran afinidad con el bosque premontano.
Tabla 2 Similitud entre las zonas de vida con base en su liquenobiota
| Porcentaje | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| BHAma | BHCho | BHMag | Premontano | Caribe | Montano Orinoquía Páramo | SecoCar | SecoCau | SecoMag | |||
| BHAma | 17,26 | 8,78 | 7,36 | 4,76 | 3,78 | 9,45 | 1,60 | 7,12 | 7,36 | 5,87 | |
| BHCho | 34,31 | 13,55 | 13,31 | 3,04 | 7,19 | 9,14 | 1,36 | 8,18 | 13,40 | 9,32 | |
| BHMag | 32,66 | 34,21 | 15,54 | 13,65 | 5,34 | 25,64 | 2,14 | 20,83 | 33,42 | 24,77 | |
| Premontano | 24,59 | 30,38 | 34,53 | 6,00 | 29,64 | 8,81 | 14,64 | 9,32 | 18,85 | 6,13 | |
| Caribe | 22,53 | 11,25 | 30,69 | 13,63 | 1,77 | 13,02 | 1,35 | 12,34 | 8,97 | 17,14 | |
| Montano | 14,0 | 18,2 | 16,80 | 51,62 | 6,07 | 2,52 | 31,89 | 3,21 | 7,52 | 1,96 | |
| Orinoquía | 31,50% | 23,38 | 51,50 | 22,64 | 42,99 | 11,86 | 1,12 | 19,11 | 19,33 | 22,90 | |
| Páramo | 7,99 | 4,75 | 8,44 | 31,23 | 4,79 | 52,90% | 4,50 | 1,11 | 4,30 | 1,30 | |
| SecoCar | 24,43 | 21,41 | 50,21 | 22,98 | 38,05 | 11,54% | 50,32 | 6,27% | 53,27 | 18,98 | |
| SecoCau | 22,12 | 32,15 | 60,29 | 43,17 | 21,92 | 24,31% | 39,07 | 12,56 | 53,36 | 22,14 | |
| SecoMag | 23,46 | 19,76 | 46,95 | 19,04 | 44,83 | 8,10% | 54,96 | 3,18 | 51,83 | 35,78 | |
BHAma= bosque húmedo Amazonía, BHCho= bosque húmedo Chocó, BHMag= bosque húmedo Magdalena, SecoCar= bosque seco Caribe, SecoCau= seco Cauca, SecoMag= seco del Magdalena
En cuanto al bosque del Caribe, se registró su gran afinidad con los bosques premontanos y húmedos del Magdalena, y poca afinidad con los bosques altoandinos, aunque fue la zona de vida de elevaciones bajas de mayor similitud con el páramo. Por otro lado, los páramos registraron poca afinidad con los bosques húmedos, la Orinoquía y los bosques secos, y tuvo los valores promedios de similitud más bajos comparados con las otras zonas de vida (en promedio de 11,63 %), patrón que también se registró en el bosque húmedo de la Amazonía (16,17 %).
El NMS tuvo un patrón similar al encontrado en el análisis de agrupamiento, con una clara separación entre el bosque seco, el húmedo, el premontano, el montano y el páramo (Figura 2). Estas regiones formaron un gradiente a lo largo del primer eje del NMS, con los bosques de elevaciones bajas (húmedo y seco) al lado izquierdo y los páramos al lado derecho. También se encontró un agrupamiento con respecto a la cordillera a lo largo del segundo eje del NMS. Solamente el bosque montano y el páramo de la Sierra Nevada mostraron un agrupamiento.
Géneros indicadores o endémicos
En la composición de los géneros se evidenció un patrón de separación entre regiones, lo que se vio reflejado en la presencia de géneros potencialmente indicadores en cada región analizada (Tabla 3). El análisis de agrupamiento de dos vías permitió establecer cuáles especies definían las regiones en un sentido amplio y cuáles eran indicadoras de una región específica. Este análisis permite establecer los géneros que conforman el bosque seco, la región andina y el bosque húmedo, así como los géneros de amplia distribución en las regiones (Figura 3).
Tabla 3 Géneros de líquenes indicadores por región
| Región | Géneros |
|---|---|
| BHAma | Arthotheliopsis, Brasilicia, Caleniopsis, Dimelaena, Eremothecella, Lasioloma, Loflammea, Loflammiopsis, Microtheliopsis, Phylloblastia, Phyllogyalidea, Physcidia, Platythecium, Rubrotricha, |
| BHCho | Amazonomyces, Malmidea, Clypeopyrenis, Distopyrenis, Fibrillithecis, Graphina, Lecania, Myeloconis, Pyrenidium, Sulzbacheromyces, Thecaria, Wirthiotrema |
| BHMag | Anthracothecium, Bogoriella, Sulcopyrenula, |
| Premontano | Acanthotheciopsis, Architrypethelium, Auriculora, Gomphillus, Redingeria, Rinodina, Schismatomma, |
| Montano | Acarospora, Corella, Candelariella, Nephromopsis, Flavopunctelia, Phlyctis, Relicina, |
| Orinoquia | Mycoporum, Polyblastidium, Flegographa, Erythrodecton |
| Páramo | Acantholichen, Alectoria, Baeomyces, Bryoria, Cetraria, Cetrariastrum, Coccotrema, Cryptococcus, Flavoparmelia, Hypogymnia, Lepraria, Megaspora, Menegazzia, Micarea, Parmelia, Parmelina, Placopsis, Psoroma, Solorina, Thamnolia, Umbilicaria |
| Amplia | Arthonia, Bacidina, Coccocarpia, Graphis, Coenogonium, Herpothallon, Leptogium, Malmidea, Ocellularia, Parmotrema, Phaeographis, Porina, Phyllopsora, Pyrenula, Trypethelium |
| Amazonas + Chocó | Aderkomyces, Aulaxina, Bapalmuia, Byssolecania, Calenia, Chroodiscus, Coniarthonia, Gyrotrema, Sporopodium, Amazonomyces, Arthotheliopsis, Brasilicia, Caleniopsis, Clypeopyrenis, Dimelaena, Distopyrenis, Eremothecella, Fibrillithecis, Lasioloma, Lecania, Loflammea, Loflammiopsis, Malcolmiella, Microtheliopsis, Myeloconis, Phylloblastia, Phyllogyalidea, Physcidia, Platythecium, Pyrenidium, Rubrotricha, Sclerophyton, Sulzbacheromyces, Thecaria, Triclinum, Wirthiotrema, |
| Seco | Bactrospora, Lecanographa, Peltula, Ramonia, Sanguinotrema, Schistophoron, Sporostigma |
| Andes | Acantholichen, Acanthotheciopsis, Acarospora, Alectoria, Anzia, Architrypethelium, Auriculora, Baeomyces, Bryoria, Bunodophoron, Candelariella, Cetraria, Cetrariastrum, Cladina, Coccotrema, Collema, Cora, Corella, Cryptococcus, Dibaeis, Diploschistes, Erioderma, Hypotrachyna, Flavoparmelia, Flavopunctelia, Gomphillus, Phyllogyalidea, Gyalideopsis, Hypogymnia, Icmadophila, Leioderma, Lepraria, Sanguinotrema, Lobariella, Megaspora, Menegazzia, Micarea, Nephromopsis, Normandina, Oropogon, Pannaria, Parmelia, Parmeliella, Parmelina, Parmotremopsis, Peltigera, Phlyctis, Phlyctidia, Phyllophthalmaria, Placopsis, Pseudocyphellaria, Psoroma, Punctelia, Redingeria, Relicina, Rhizocarpon, Rinodina, Schismatomma, Solorina, Sticta, Tephromela, Thamnolia, Umbilicaria, Xanthoparmelia |
BHAma= bosque húmedo Amazonía, BHCho= bosque húmedo Chocó, BHMag= bosque húmedo Magdalena
Riqueza de líquenes en Colombia
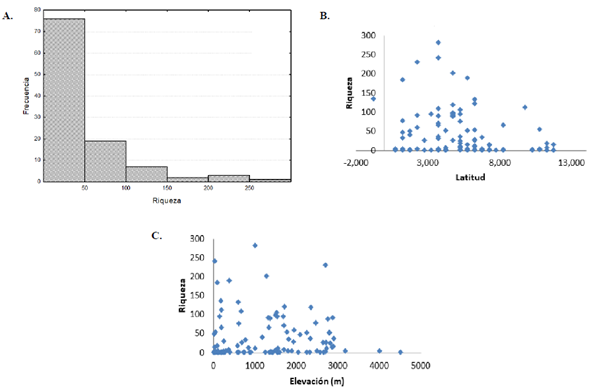
Con base en la presencia de las especies se estimó la riqueza con una resolución de 50 km (Figura 4). El mapa mostró una variación entre 1 y 283 especies por celda, siendo las regiones de la Amazonia, los Andes y el Chocó aquellas con las celdas de mayor riqueza. La mayoría de las celdas mostraron valores entre 1 y 50 (70 %), en tanto que el 12 % de las celdas presentó valores de más de 100 especies. El mapa de la riqueza también evidenció un gran número de celdas en los departamentos de Antioquia, Boyacá, Cauca, Caldas, Nariño, Risaralda, Tolima y Valle, con una elevada frecuencia de muestreo en la región andina.
La riqueza mostró un gradiente latitudinal a lo largo de Colombia, siendo más alta en latitudes intermedias. Por otro lado, la riqueza presentó un patrón decreciente con la elevación, siendo más alta en elevaciones más bajas (Figura 5).
Riqueza de líquenes por regiones
La mayor riqueza estimada se registró en las regiones de páramo y bosque montano, en tanto que fue más baja en el bosque seco (Tabla 4). Este patrón se observó para todos los estimadores de riqueza usados. Las curvas de acumulación de especies sugieren que se ha muestreado entre 42 y 79 % de la diversidad de líquenes de cada región. El bosque seco fue la región con menor representatividad y el bosque húmedo del Chocó, el de la más alta. Para Colombia se estimaron entre 1.971 y 2.980 especies, lo cual se refleja en un 54 a 82 % de representatividad del muestreo.
Discusión
Este estudio constituye una aproximación a la composición y riqueza de líquenes de las distintas zonas de vida en Colombia. Los resultados evidenciaron la presencia de cerca de 1.617 especies de hongos liquenizados en su territorio, agrupadas en 259 géneros y 66 familias siendo las tres familias de mayor riqueza Graphidaceae, Parmeliaceae y Ramalinaceae, patrón diferente al que se ha propuesto en el gran árbol de las familias de mayor riqueza en el trópico: Graphidaceae, Trypetheliaceae y Pyrenulaceae (Mendonça, 2019). Por zonas de vida, el bosque montano fue el que más especies registró (449 especies), seguido del páramo (400 especies), el bosque premontano y el bosque húmedo del Chocó (385 especies), en tanto que el Caribe solo registró 66 especies. Asimismo, la región montana, la premontana, el páramo y el Chocó fueron las que más géneros registraron.
Esta mayor diversidad en las zonas de vida andinas y de bosque húmedo con elevaciones bajas puede explicarse por el efecto de un mayor muestreo y, posiblemente, una mayor diversidad inherente a estas zonas.
Previamente se habían reportado 189 especies de hongos liquenizados en el Chocó (385 en este estudio), 322 en la Amazonía (275), 379 en el Caribe (208), 131 en la Orinoquía (168), 285 en los páramos (400), 632 en el bosque premontano (385) y 758 en el montano (449), lo que se aparta en mucho de este estudio, tal vez porque antes no se había considerado la liquenobiota del bosque seco (Caribe, Cauca, Magdalena) y el bosque húmedo del Magdalena. Las diferencias en el número de especies reportadas se deben, primero, a los conceptos de zonas de vida manejados y a la incorporación de nuevos registros en el presente estudio. En este sentido, en el reporte anterior en el Caribe se tuvieron en cuenta todas las formaciones vegetales, desde el bosque seco hasta el páramo, en tanto que en este se analizaron por separado los bosques secos y los húmedos del Caribe. Por otro lado, para el Chocó solo se contaba con registros puntuales en Cauca, Nariño y Chocó, en tanto que en este se incluyen registros en varias localidades del Cauca y el Valle del Cauca, lo cual explica el notorio incremento del número de especies para esta región. En cuanto a la Amazonía, no fue posible acceder a todos los registros y en las zonas de vida de la región andina, el menor registro para el bosque premontano y el montano se explicaría por la clasificación de las localidades, que antes frecuentemente carecían de georreferencias adecuadas. Por el otro lado, se cuenta con buenos registros para los páramos y se incorporaron listados recientes de otros en Colombia, lo cual incrementó el número de especies para esta zona de vida.
Además, en este estudio se reportan solo nueve especies de amplia ecología, en tanto que 903 tenían una distribución restringida. En estudios previos se registró un menor número de especies de distribución restringida y uno mayor de especies de amplia distribución, lo cual se explicaría por la inclusión de nuevos registros, los nuevos conceptos de especie y las nuevas especies consideradas en este estudio, lo que aumenta el número de aquellas con distribución restringida. Por otro lado, se encontró un mayor porcentaje de especies endémicas de las zonas de vida de páramo y de bosque húmedo de Amazonía y Chocó, así como de la Orinoquía, en tanto que fue más bajo en los bosques secos del Cauca y el Magdalena, en los bosques del Caribe y en los bosques húmedos del Magdalena; también se reportaron porcentajes intermedios en los bosques premontanos y montanos. Estos resultados coinciden con lo encontrado en otros grupos de organismos con mayor endemismo en los páramos, los bosques altoandinos y los bosques de la Amazonía, que son, a la vez, fuente de especies (fuente-sumidero) (Kattan & Franco, 2004; Antonelli, et al., 2018). En contraste, los bosques premontanos y del Caribe registraron un fuerte efecto en masa desde estas fuentes, lo cual explica el bajo endemismo. El patrón de distribución restringida fue más acusado cuando se consideraron los géneros de líquenes, los cuales mostraron un mayor nivel de "endemismo" en las regiones andinas y de boques húmedos.
La composición de géneros mostró patrones de separación entre las regiones, lo que se vio reflejado en especies y géneros potencialmente indicadores de cada región según el análisis de agrupamiento de dos vías, en el que se establecieron los géneros que definen las regiones en sentido amplio y las zonas de vida. Los hongos liquenizados se han usado ampliamente como bioindicadores de contaminación atmosférica y continuidad ecológica (Riva-Plata, et al., 2008), tanto a nivel de especie como de biotopos (Ramírez-Moran, et al., 2016). En este caso se observó que los líquenes tienen un gran potencial como bioindicadores en las zonas de vida de Colombia tanto a nivel de especie como de géneros, lo que se explicaría por la selectividad ecológica de los líquenes, la cual produce ensamblajes únicos a lo largo de gradientes climáticos y ecológicos.
Las relaciones de recambio de especies entre las zonas de vida adoptaron varios patrones. En la Orinoquía se evidenció un alto intercambio de especies con los bosques secos y húmedos, lo que indica que en esta región se da un tipo de transición hacia la liquenobiota de bosque seco (Caribe, Magdalena y río Cauca). El bosque premontano tuvo una gran afinidad con los bosques montanos, los secos y del Caribe, lo cual indica un flujo de especies de los bosques secos y montanos hacia los bosques premontanos. Por otro lado, los páramos fueron las regiones de menor afinidad con el resto de regiones, excepto con los bosques montanos. Los páramos están compuestos por especies principalmente meridionales, con un nivel de endemismo y una tasa de especiación elevados, lo que da lugar a una zona de vida única (Madriñán, et al., 2013). Asimismo, los bosques de la Amazonía y el Chocó se consideran puntos calientes y fuente de especies para otras regiones neotropicales (Antonelli, et al., 2018). La gran similitud entre los bosques húmedos de la Amazonia y el Chocó coincide con lo encontrado en animales, plantas y líquenes folícolas, lo cual se atribuye a que estas regiones son refugios de vida del Pleistoceno, el Pleioceno y el Mioceno (Carvalho, 2013; Latrubesse, et al., 2010; van der Hammen, 1991; Santos, et al., 2019). Sin embargo, estos bosques presentan diferencias tanto en especies como géneros, lo cual indica que a pesar del surgimiento de los Andes, estas dos regiones previamente conectadas se ha diferenciado (Hoorn, et al., 2010; Pennington & Dick, 2010).
Las relaciones biogeográficas de los hongos liquenizados se han estudiado poco, sobre todo en el trópico. Sin embargo, algunos estudios han abordado la biogeografía histórica a gran escala (Arcadia, 2013) y las relaciones de riqueza y la composición de las especies en ecorregiones de Italia (Martelos, et al., 2020). En el Neotrópico se han hecho estudios como el de Santos, et al. (2019) que muestran las afinidades biogeográficas de los líquenes folícolas de los brejos de altitude de Brasil con otras regiones del Neotrópico, como el Chocó y la Amazonía, lo que evidencia su diversidad excepcional, resultado similar al de este estudio. También se ha encontrado que los líquenes son indicadores de la diferenciación de los brejos de altitude de la Catinga (Leite, et al., 2015).
Este trabajo es el primero que trata de establecer las afinidades biogeográficas entre distintas ecorregiones de Colombia. La riqueza de especies de líquenes estimada para el país fluctuó entre 1.972 y 2.980, lo cual indica que faltan muchas especies por reportar en el país. En estudios previos se estimó un número de 3.600 especies para Colombia (Lúcking, et al., 2009), es decir, casi 700 especies más. Esta diferencia se debe principalmente a los algoritmos usados para estimar dicha riqueza: en este estudio se estimó usando cada zona de vida como unidad de muestreo, en tanto que Lücking, et al. (2009) emplearon el área y los tipos de ecosistemas, lo que implicaría que en dicho estudio se habría estimado mejor la riqueza de líquenes del país. El mapa de la riqueza de especies de líquenes evidenció que esta era mayor en las zonas del Chocó, Amazonas y Andes, comparada con las de bosque seco. Varios grupos de organismos han registrado una elevada riqueza en estas regiones (Kattan & Franco, 2004; Gentry, 1982; Madriñán, et al., 2013; Soto, et al., 2019), lo que se ha relacionado con factores históricos y climáticos que han favorecido una gran diversificación. Los boques húmedos del Amazonas y el Chocó fueron los más diversos en hongos liquenizados, un patrón que ocurre en plantas y animales (Antonelli, et al., 2018), y que en estos ecosistemas se ha asociado con una elevada productividad debido a las altas temperaturas y la precipitación.
La riqueza de hongos liquenizados con respecto al gradiente de elevación en Colombia evidenció un decrecimiento monotónico, con un ligero aplanamiento en elevaciones bajas. Este patrón se ha observado en plantas y animales (Gentry, 1982; Kattan & Franco, 2004; Soto, et al., 2019) asociado con factores climáticos. El patrón encontrado en este estudio es contrario al registrado en el catálogo de plantas (Bernal, et al., 2015), en el que la riqueza responde a un patrón unimodal, con un pico en elevaciones medias. Esta diferencia se debe a las distintas formas de estimación de la riqueza: basada en bandas altitudinales en el catálogo de plantas y en celdas geográficas en este estudio. Debe señalarse que Colombia tiene distintos sistemas de gradientes altitudinales en los valles interandinos secos y las planicies húmedas de la Amazonía y el Chocó, por lo que se presentan distintos gradientes de riqueza asociados con las particularidades climáticas del gradiente altitudinal (Kattan & Franco, 2004). En este sentido, la aproximación adoptada en este estudio permite evidenciar esas variaciones, aunque debe estudiarse cada gradiente.
Por último, este es el primer análisis de las relaciones biogeográficas y la riqueza de los líquenes en Colombia. La Amazonía, el Chocó biogeográfico y los páramos fueron las regiones con mayor riqueza y endemismo de especies y géneros. En cuanto a las relaciones fitogeográficas, fue posible establecer una mayor afinidad entre los bosques húmedos de la Amazonía y el Chocó, entre los bosques premontanos, montanos y páramos, y entre los bosques secos interandinos y del Caribe. En la Orinoquía se registró una mayor relación con el bosque seco del Magdalena, pero también tuvo un alto recambio de especies con la Amazonía. Estas diferencias entre regiones implican la presencia de especies y géneros indicadores de cada región. La riqueza de especies de líquenes evidenció un patrón unimodal con la latitud y decreciente con la elevación, lo cual se relacionaría con factores climáticos. Al considerar las amenazas que se ciernen sobre los bosques húmedos y secos de Colombia, los resultados del estudio en estas zonas de vida resaltan la importancia de generar estrategias de conservación, pues estos organismos son muy sensibles a la perturbación.