Introducción
El dinucleotido de adenina y nicotinamida (NAD) y su análogo fosforilado (NADP) están involucrados en una gran diversidad de procesos biológicos en los que actúan como cofactores en reacciones de oxidación-reducción (redox) y como sustratos en procesos relacionados con la expresión genética, la reparación de ADN y la muerte celular, entre muchos otros. Según la información indexada en la Kyoto Encyclopedia of Genes and Genomes (KEGG), el NAD está involucrado en 997 reacciones y el NADH (su forma reducida) en 981, en las cuales están implicadas 601 y 586 enzimas, respectivamente. El NAD no solo es una coenzima que actúa como uno de los aceptores principales de iones hidruro de la célula, involucrado en muchas de las reacciones del metabolismo redox, sino que también actúa como sustrato (Katsyuba, et al., 2020) en procesos de señalización celular (Cantó & Auwerx, 2011). La modulación de las rutas y las enzimas en las que está involucrado el NAD permite controlar procesos esenciales como el metabolismo energético, la reparación del ADN, y el crecimiento y la muerte celulares tanto en seres vivos superiores o a nivel de microorganismos patógenos (Singhal & Cheng, 2019).
El conocer los mecanismos mediante los cuales los seres vivos obtienen NAD es particularmente importante para comprender la relación entre su metabolismo y las alteraciones que conducen a enfermedades (Berger, et al., 2004). Las perturbaciones en la regulación de la síntesis del NAD derivan en deficiencias fatales para el organismo (Dolle, et al., 2013; Mao, et al., 2016; Padiadpu, et al., 2016; Sauve, 2008). Además, las particularidades de las rutas bioquímicas que involucran el NAD en organismos patógenos pueden considerarse como posibles blancos terapéuticos contra enfermedades infecciosas.
Uno de los pasos fundamentales de la biosíntesis del NAD es la reacción del mono-nucleótido de ácido nicotínico (NaMN) o de la nicotinamida (NNM) con el ATP para sintetizar NaAD o NAD, respectivamente (Berger, et al., 2004). Esta reacción es catalizada por la enzima nicotinamida/nicotinato mononucleótido adenililtransferasa (NMNAT, EC 2.7.7.1/18), objeto de estudio del presente trabajo (Figura 1A).
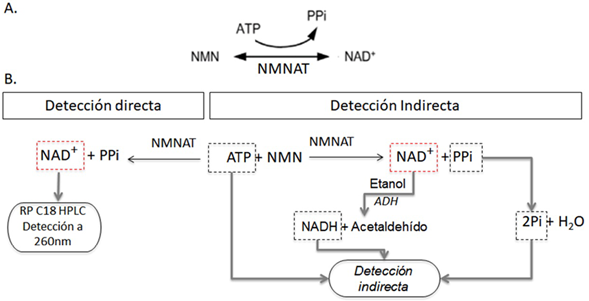
Figura 1 Reacción enzimática de la NMNAT y sus estrategias de detección. A. La NMNAT está involucrada tanto en la biosíntesis de NAD como de NaAD. B. Detección directa del producto NAD mediante RP-HPLC. La determinación indirecta se completa mediante tres rutas: 1) Análisis de subproductos (Pi, fosfato inorgánico; PPi, pirofosfato). 2) Obtención de NADH por medio de una reacción acoplada catalizada por la alcohol deshidrogenasa (ADH). 3) Consumo de ATP generado en la reacción reversa de la NMNAT.
En el diseño experimental de los protocolos de evaluación de la actividad de una enzima deben hallarse las condiciones bajo las cuales se puede obtener la mayor cantidad de información libre de interferencias que afecten el resultado final y conduzcan a malinterpretaciones. La actividad enzimática de las NMNAT se puede evaluar mediante la detección directa del producto o, de manera indirecta, mediante la reducción del NAD a NADH por acople con la enzima alcohol deshidrogenasa (ADH). El método directo se basa en la detección cromatográfica del NAD producido utilizando patrones estándar en el análisis (Balducci, et ah, 1995). Sin embargo, no es fácil hacer el cribado de alto rendimiento de posibles candidatos a inhibidores (high-throughput screening, HTS) de grandes colecciones de moléculas usando esta estrategia, principalmente por los costos y el tiempo de obtención de resultados y su posterior análisis.
Por otro lado, se han propuesto tres estrategias indirectas, dos de ellas basadas en los productos de la reacción (NAD y pirofosfato inorgánico, PPi) y una tercera basada en la determinación del ATP producido por la NMNAT en su reacción reversa (Figura 2). El NAD se puede reducir enzimáticamente generando NADH, el cual se detecta directamente por fluorescencia o absorción a 340 nm (Balducci, et ah, 1995). Asimismo, el NAD se puede determinar colorimétricamente por la conversión del reactivo WST-1 a formazán, el cual absorbe a 450 nm. El pirofosfato se detecta con verde de malaquita a 620 nm después de su conversión enzimática en ortofosfato por medio de una pirofosfatasa. Los métodos de detección de la actividad de la NMNAT a 450 nm y 620 nm (Rodionova, et ah, 2015; Sorci, et al., 2009), se han implementado para la búsqueda de inhibidores de las NMNAT de procariotas (Bacillus anthracis, Escherichia coli y Mycobacterium tuberculosis). Recientemente, se ha propuesto la detección del ATP mediante una reacción acoplada con la luciferasa de Photinus pyralis dependiente de ATP. Este ensayo permite la identificación de nuevos moduladores de la actividad de la NMNAT mediante luminiscencia (Haubrich, et al., 2020).
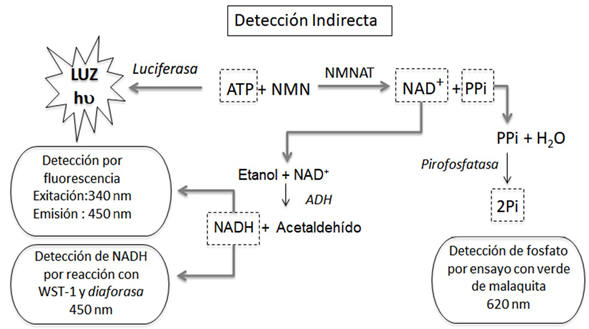
Figura 2 Detección indirecta de la actividad de la LbNMNAT. En línea discontinua se identifican los analitos que permiten la determinación indirecta de NAD. En letra cursiva se indican las enzimas que se usan para catalizar las transformaciones necesarias para los análisis de detección.
Los métodos espectroscópicos permiten el análisis de grandes colecciones de compuestos al escalar el número de pruebas paralelas en multiplacas y realizar numerosos ensayos simultáneamente. Sin embargo, el uso de la reacción acoplada para la detección de la actividad de la NMNAT es susceptible de reaccionar de forma cruzada con la enzima acoplada ADH, lo que afecta los resultados. Esta limitación reduce las colecciones de compuestos que podrían ser analizados como posibles inhibidores.
Por otra parte, la leishmaniasis, perteneciente al grupo de enfermedades denominadas por la Organización Mundial de la Salud (OMS) como enfermedades tropicales desatendidas, afecta zonas tropicales, subtropicales y de la cuenca del Mediterráneo. Aunque es pequeña la proporción de personas infectadas que desarrollan la enfermedad, se estima que cada año se producen un millón de nuevos casos (World Health Organization, 2017).
No se dispone de una vacuna contra la leishmaniasis en humanos y su tratamiento requiere medicamentos altamente tóxicos, cuyo uso ha generado resistencia según algunos reportes (Gillespie, et al., 2016). Nuestro grupo de investigación identificó y caracterizó la NMNAT de L. braziliensis (LbNMNAT) (Contreras, et al., 2015), que representa un interesante blanco terapéutico contra la enfermedad dadas las diferencias cinéticas y estructurales que exhibe con respecto a las isoenzimas humanas (HsNMNAT 1-3). Dichas diferencias se relacionan con la organización oligomérica, los parámetros cinéticos, las inserciones exclusivas de regiones en la estructura primaria de la enzima del parásito y la localización intracelular de las proteínas en mención (Contreras, et al., 2015).
Basados en antecedentes que demuestran que polifenoles como la galotanina, presente en las bellotas de R. chinensis inhiben las isoenzimas humanas HsNMNAT 1-3, se utilizó este compuesto para evaluar y estandarizar un método indirecto de evaluación de la inhibición enzimática. Se observó que la galotanina inhibe tanto la LbNMNAT como la enzima acoplada ADH. Para superar esta limitación, se propuso una estrategia que evita el efecto de la actividad inhibitoria cruzada con el sistema acoplado de detección. Dicho método recurre a la extracción en fase sólida de los inhibidores utilizados en la primera etapa del sistema para inhibir específicamente la proteína de interés (LbNMNAT) sin afectar la ADH, posibilitando así la evaluación selectiva de la actividad de la LbNMNAT. Además, con los resultados obtenidos se comprobó el efecto inhibitorio de la galotanina sobre la NMNAT de un parásito protozoario de interés como L. braziliensis.
Materiales y métodos
Obtención de la proteína recombinante 6xHis-LbNMNAT
Se transformaron células competentes de E. coli M15 con el vector pQE30-LbNMNAT construido previamente (Contreras, et al., 2015). Las células se indujeron con 0,1 mM de isopropil-β-D-1-tiogalactopiranósido (IPTG) cuando alcanzaron una absorbancia (OD600 nm) de 0,7. El lisado de las células se realizó por ultrasonido en solución reguladora con pH 8,0 (50 mM de PBS, 300 mM de NaCl, 10 mM de imidazol, 1 mM de MgCl2) suplementada con 1mg/mL de lisozima e inhibidores de proteasas (Sigma P8340). Las células se lisaron a 4 °C aplicando ciclos de 15 segundos de ultrasonido y 15 segundos de reposo, completando 5 minutos de sonicación a 50 % de amplitud (VibraCell™, Sonics®, 130 watts, 20 kHz). La identificación de la proteína recombinante 6xHis-LbNMNAT se hizo por electroforesis sobre geles de poliacrilamida al 12 % en condiciones desnaturalizantes (SDS-PAGE), acoplando su identificación a experimentos de electrotransferencia sobre membranas de nitrocelulosa e inmunodetección (Western blot) con el anticuerpo primario anti-6xHis.
Purificación de la proteína recombinante 6xHis-LbNMNAT
La proteína recombinante se expresa fusionada a una etiqueta de hexa-histidinas (6xHis), razón por la cual se purificó usando un soporte de agarosa funcionalizado con níquel (ProBond™, Thermo Fisher Scientific). Las proteínas se eluyeron con solución reguladora de pH 8,0 (50 mM de PBS, 300 mM de NaCl y 200 mM de imidazol).
Después de analizar los pasos de purificación de la proteína por SDS-PAGE, esta se cuantificó usando el método de Bradford con albúmina de suero bovino (BSA) como patrón de concentración. Para optimizar la purificación se utilizó la cromatografía de exclusión molecular usando soportes Sephadex® G150 o Bio-Gel® P100 y solución reguladora con pH 8,0 (50 mM de PBS, 300 mM de NaCl, 0,62 mM de MgCl2 y 1 mM de DTT).
Ensayos de actividad enzimática
La reacción catalizada por la NMNAT para producir NAD a partir de NMN y ATP, se comprobó mediante el método de detección directa del NAD usando HPLC y el método espectrofotométrico indirecto para detectar el NADH, como se describe a continuación.
Ensayo directo de actividad enzimática
Este ensayo analiza la síntesis de NAD a partir de la reacción entre NMN y ATP después de separar los productos de los sustratos a través de una columna de cromatografía RP C18. Con 25 µL de tampón (100 mM de HEPES, 40 mM de MgCl2, pH 7,4) se adicionaron 3 µL de NMN (50 mM en agua), 42 µL de agua y 20 µL de la enzima (1,25-12,5 mM). Esta solución se incubó a 37 °C durante 10 minutos, tras lo cual se inició la reacción agregando 10 µL de ATP (12,5 mM en tampón con 100 mM de HEPES y pH 7,4). Esta mezcla se incubó durante 20 minutos a 37 °C. Luego, a 100 µL de reacción se adicionaron 50 µL de 1,2 mM de HClO4 para detener la reacción. Esta suspensión se incubó durante 10 minutos sobre hielo y se centrifugó a 6.000 rpm a 4 °C. Del sobrenadante resultante se tomaron 130 µL y se neutralizaron con 35 µL de 1 M de NaHCO3, mezcla que se incubó 15 minutos sobre hielo y se centrifugó a 12.000 rpm durante 5 minutos. Se utilizaron 100 µL del sobrenadante para el análisis por HPLC en el equipo Agilent Technologies de la serie 1260®, equipado con una bomba cuaternaria (Quaternary Pump VL, G1311C), un muestreador automático (ALS, G1329B), un compartimiento de columna termostatizado (TCC, G1316A) y un detector de onda variable (VWD VL, G1314B), controlado por el programa OpenLAB CDS ChemStation Edition. Para la separación cromatográfica se usó una columna Kinetex® de Phenomenex (5,0 µm C18 100 Å, 100 x 4,6 mm). Como sistema de solventes se usaron: a) PBS con pH 6,0 y b) metanol. El programa cromatográfico constó de las siguientes etapas: 2 minutos con 100 % de a; 2 minutos de 0 al 20 % de b; 1,5 minutos de 20 a 25 % de b; 1,5 minutos de 25 % de b; 3,5 minutos de 25-0 % de b, y 2 min de 100 % de a.
Ensayo directo de inhibición enzimática de la LbNMNAT
Se aplicó el protocolo descrito en la sección anterior reemplazando el volumen correspondiente de agua por el inhibidor bajo estudio (galotanina) en diferentes concentraciones finales (0,05, 2,5 y 10 µM).
Ensayo indirecto de actividad enzimática
La enzima LbNMNAT se diluyó hasta una concentración final de 2 µg/µL en el tampón del ensayo. La mezcla inicial se preparó sin ATP en tampón HEPES (200 µL, 100 mM de HEPES, 40 mM de MgCl2, y pH 7,5), NMN (16 µL, 50 mM en agua), ADH (Sigma-Aldrich, A7011, 4 µL correspondientes a 2 U), etanol (8 µL, 1 % final), LbNMNAT (50 µL) y agua hasta completar 800 µL de volumen final. Cada medida se realizó por triplicado adicionando 180 µL de esta solución por pozo. La reacción se inició adicionando la solución de ATP (20 µL, 100 mM en agua). Se incluyeron reacciones sin sustratos o sin enzima como controles. La absorbancia se midió a 340 nm durante 5 minutos a 25 °C. Los datos se obtuvieron en el lector de placas BIORAD xMark® con el programa Microplate Manager®, v 6.3. Las soluciones de partida de ATP y NMN se prepararon usando su coeficiente de absortividad a 260 nm, 4,2 mM-1cm-1 y 15,4 mM-1cm-1, respectivamente.
Ensayo indirecto de inhibición enzimática de la LbNMNAT
Se aplicó el protocolo descrito en la sección anterior reemplazando el volumen correspondiente de agua por el inhibidor bajo estudio (galotanina) en diferentes concentraciones finales (0,05, 2,5 y 10 µM). Cada ensayo se realizó por triplicado con los respectivos controles.
Ensayo indirecto de inhibición de la LbNMNAT modificado
Este ensayo se hizo en dos etapas, en la primera se ejecutó la reacción entre NMN y ATP en presencia de la enzima LbNMNAT, en tanto que en la segunda el NAD producido se redujo mediante la reacción catalizada por la enzima ADH en presencia de etanol. A la reacción inicial se adicionó solución amortiguadora (200 µL, 100 mM de HEPES, 40 mM de MgCl2, y pH 7,5), NMN (16 µL, 50 mM en agua), NMNAT (50 µL, 0,5 ng/µL), inhibidor (concentraciones de estudio) y agua hasta completar 800 µL de volumen final. La reacción se inició adicionando ATP (25 µL, 100 mM en agua) en 230 µL de la mezcla anterior. Después de incubar a 25 °C durante 30 minutos, se adicionaron 50 mg del soporte sólido de extracción de fase reversa (Supelco® 18 Silica gel, malla de 200-400, volumen de poro de 0,7-0,9 cm3/g, tamaño de poro 70 Å). Se incubó durante 5 minutos a temperatura ambiente y después la solución se filtró a través de unidades de centrifugación Ultrafree-MC con membrana microporosa (Merck) en tubos de 1,5 mL a 2.000 rpm durante 5 minutos. A la solución filtrada se adicionó ADH (5 µL, 2 correspondientes a 2U), se homogenizó con pipeteo suave y 190 µL de esta mezcla se pasaron a placas de 96 pozos. Antes de obtener los datos en el lector de placas se adicionó etanol (10 µL) para iniciar la reacción.
Resultados y discusión
Una vez obtenida la proteína 6xHis-LbNMNAT purificada por cromatografía de afinidad a níquel, su actividad enzimática se verificó con el método directo de detección. Este ensayo de actividad mide la síntesis de NAD a partir de la reacción entre NMN y ATP después de separar los productos de los sustratos a través de una columna de cromatografía RP C18. Como se observa en la figura 3, en presencia de galotanina disminuyó o desapareció la señal correspondiente al NAD. La curva de inhibición demostró que bajo las condiciones experimentales se alcanzó la inhibición total de la actividad enzimática con 10 µM del inhibidor. Estos resultados permitieron confirmar que se obtuvo una enzima activa para comparar los diferentes métodos indirectos de inhibición enzimática propuestos.
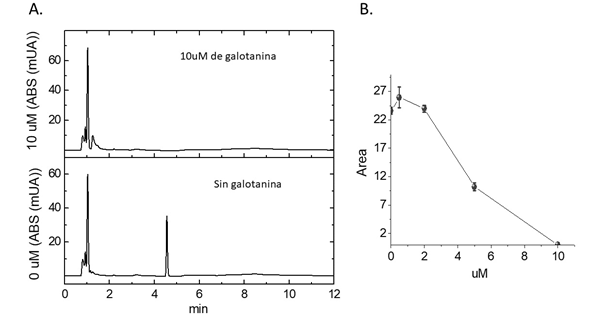
Figura 3 Detección directa de la actividad de la LbNMNAT inhibida por la galotanina. A. Cromatogramas de los ensayos de actividad de la enzima LbNMNAT por determinación directa de NAD en presencia y ausencia de 10 uM de galotanina. Los analitos se monitorearon a 260 nm. El pico correspondiente al NAD se detectó a los 4,6 minutos de retención. B. Curva de inhibición de la LbNMNAT. Se indica el área bajo el pico del NAD detectado por HPLC para ensayos enzimáticos ejecutados en presencia de diferentes concentraciones de galotanina
Posteriormente, se hizo el ensayo de actividad acoplado (indirecto), mediante el cual se puede seguir la formación de NAD detectando el NADH formado a expensas de la oxidación de etanol a acetaldehído por la enzima ADH. Esta enzima usa como cofactor el NAD y lo reduce a NADH, el cual se detecta específicamente a 340 nm. Este ensayo permite la paralelización en placas multipozo, lo que lo hace ventajoso como método de evaluación de numerosos candidatos a inhibidores de la NMNAT. No obstante, uno de los problemas de la optimización de métodos enzimáticos indirectos es la posibilidad de reacciones cruzadas entre las enzimas acopladas. Esto se observó claramente en el proceso de optimización del ensayo, dado que la ADH puede inhibirse con altas concentraciones de imidazol y de galotanina, esta última un conocido inhibidor de las NMNAT (Petrelli, et al., 2011). Este efecto probablemente se relaciona con la similitud topológica entre la ADH y las NMNAT, dado que comparten un plegamiento tipo Rossmann de unión a nucleótidos. Dicha similitud favorece que algunos de los inhibidores de la NMNAT interaccionen con el sitio de unión del NAD propio de la ADH, afectando la actividad de ambas enzimas y resultando en la sumatoria de la inhibición de las dos reacciones (Figura 4).
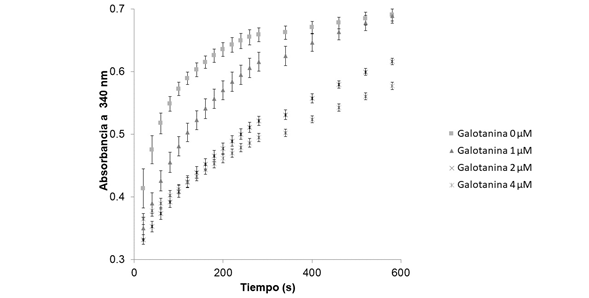
Figura 4 Interferencia del sistema acoplado en ensayos de inhibición. La galotanina inhibió la enzima ADH que se utiliza en el sistema enzimático acoplado. En presencia de 2,5 mM de NAD se observó el efecto inhibitorio de la galotanina sobre la actividad de la ADH bajo condiciones idénticas al ensayo indirecto de actividad de las NMNAT. Los datos se muestran como promedios +/- la desviación estándar
La figura 5 muestra las estructuras tridimensionales de algunas de las enzimas que actualmente se acoplan en los ensayos enzimáticos indirectos de las NMNAT, como la ADH, la diaforasa y la PPASE. En todos los casos se observa un plegamiento Rossmann de unión a NAD, el cual es similar entre estas enzimas acopladas y la propia NMNAT. Esta evidencia estructural supone que la probabilidad de reacciones cruzadas con inhibidores candidatos es plausible. En general, los métodos de detección indirectos ostentan ventajas en cuanto a sensibilidad y costos. Aunque es difícil estandarizar una estrategia de análisis perfecta, lo ideal es establecer un diseño experimental con el menor riesgo de obtener falsos negativos o positivos (Acker & Auld, 2014). El máximo control de los parámetros experimentales permite disminuir las interferencias inherentes del ensayo de actividad in vitro, reduciendo el número de resultados no reproducibles en condiciones reales de la acción de la enzima de interés en el sistema biológico (Thorne, et al., 2010).
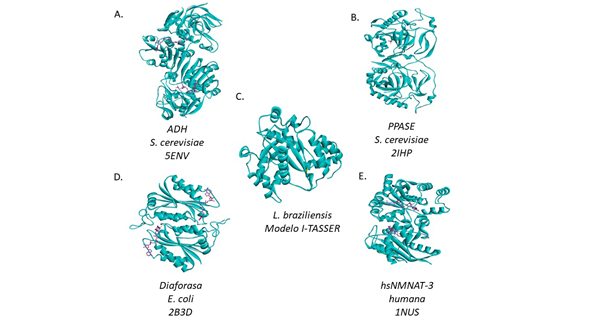
Figura 5 Estructura tridimensional de la NMNAT comparada con algunas de las enzimas usadas en los ensayos de detección indirecta. A. ADH de levadura (PDB: 5ENV). B. Pirofosfatasa de levadura (PPASE, PDB: 2IHP). C. NMNAT de L. braziliensis, modelo tridimensional generado con I-TASSER. D. Diaforasa de E. coli (PDB:2B3D). E. NMNAT humana III (PDB: 1NUS. La agrupación de hojas paralelas rodeadas de hélices corresponde al plegamiento Rossmann de unión a nucleótidos
Aunque se han ensayado numerosos compuestos inhibitorios con métodos indirectos, nuestro resultado sugiere que los posibles inhibidores de la NMNAT también inhiben las enzimas acopladas para medir su actividad (Genomics, 2012). En estudios de gran escala se han cribado hasta 362.388 compuestos candidatos a inhibidores, y se reportaron aproximadamente 3.000 posibles inhibidores de la NMNAT de S. aureus en un ensayo basado en la pirofosfatasa (PPASE) como enzima de detección. Aunque en este caso se detectó la actividad de NMNAT mediante el seguimiento de la producción de PPi, también las dos enzimas tienen en común los sitios de unión a fosfatos. De todas maneras, el alto potencial para escalar el número de ensayos de estos métodos revela su importancia en el cribado paralelo de miles de compuestos. Para intentar solventar este inconveniente en el ensayo de actividad enzimática de la NMNAT, en este estudio se propuso un método que implementa la ADH como método indirecto de detección, pero de forma desacoplada, separando ambas reacciones para así evitar la reacción cruzada y obtener datos de la actividad enzimática específica de la LbNMNAT en presencia o ausencia de candidatos a inhibidores.
Para evitar la interacción cruzada entre las enzimas se introdujo un paso intermedio en el protocolo del ensayo de actividad. La nueva estrategia separa los dos procesos enzimáticos en el ensayo: en una primera etapa la reacción enzimática de la LbNMNAT se hace en presencia del inhibidor. Posteriormente, se separa el NAD producido por extracción en fase sólida usando como soporte silica-C18 (Supelco®). Después de la extracción de los inhibidores utilizados en la primera reacción, la fracción líquida no retenida en el soporte, es decir, el producto NAD, se utiliza en la reacción de detección en presencia de etanol y ADH, en la cual se reduce el NAD obtenido a NADH. La producción de NADH se mide a partir de su absorbancia a 340 nm. La separación de las reacciones enzimáticas mejoró notablemente la medición, ya que se eliminó la posibilidad de reacción cruzada de la enzima analizada (LbNMNAT) y la usada en el método de detección (ADH) (Figura 6).
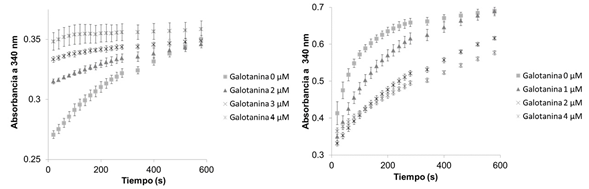
Figura 6 Detección indirecta de la actividad de la LbNMNAT inhibida por la galotanina. A. Ensayo acoplado ejecutado en presencia simultánea de las enzimas LbNMNAT y ADH junto con el inhibidor (0,2,3,4 μM). B. Ensayo desacoplado en el cual se realizó la reacción de la LbNMNAT en presencia del inhibidor, seguida por la extracción del NAD y su adición a los reactivos de la reacción catalizada por la ADH
Como se observa en la figura 6, la reacción del inhibidor en el sistema de detección indirecto acoplado produjo curvas de reacción que se saturan rápidamente, lo que indica una actividad inhibitoria mayor de la galotanina, sobreestimando el efecto de inhibición.
En las curvas obtenidas en el método indirecto desacoplado que proponemos se evidenció que correspondían solo a una reacción enzimática, la reacción catalizada por la enzima de detección ADH. El NAD producido en la primera reacción con la LbNMNAT se usó como agente oxidante al catalizar la producción de acetaldehído a partir de etanol. Por lo tanto, el efecto de inhibición de la galatonina solo afectó la producción del NAD catalizado por la NMNAT. La introducción de un paso adicional en el método es aún paralelizable usando multiplacas filtrantes que permiten el cribado farmacológico de alto rendimiento (HTS).
La introducción de un paso de filtración adicional en el ensayo aumenta los costos del análisis y su tiempo de realización ligeramente. Sin embargo, exhibe la gran ventaja de eliminar la incertidumbre debida a falsos positivos o reacciones inespecíficas en la reacción enzimática, asegurando un resultado fehaciente que lo hace útil para el cribado de grandes quimiotecas de compuestos.
Conclusión
La semejanza estructural de la enzima de estudio LbNMNAT y la enzima ADH acoplada al sistema de detección puede explicar la reactividad inhibitoria cruzada de la galotanina en el ensayo de actividad acoplado. La adición de un paso de separación de los inhibidores utilizados en la primera reacción permitió aislar la reacción acoplada, evitando dicha inhibición cruzada. El método propuesto en este estudio, aunque implica mayor tiempo de ejecución, permitiría evaluar diferentes inhibidores con mayor certidumbre en caso de que las enzimas usadas en los métodos de detección acoplados exhiban semejanzas estructurales de los sitios de unión de los candidatos analizados. En último término, la selección de candidatos específicos a inhibidores de la LbNMNAT podría conducir al desarrollo de nuevas terapias antimicrobianas contra enfermedades parasitarias como la leishmaniasis.















