Introducción
El mal manejo del petróleo y de sus residuos, así como los derrames accidentales en el curso de las actividades de explotación, refinación, distribución y almacenamiento, generan impactos sanitarios, sociales y ambientales (Flores, et al., 2004; Bravo, 2007). Estos últimos se dan cuando la explotación de los recursos naturales provoca trastornos en el ecosistema y, específicamente, la contaminación de los recursos hídricos por incorporación de petróleo crudo directamente o a través de sedimentos con petróleo adherido que pueden ingresar a las cadenas alimenticias a través del zooplancton y el fitoplancton (Bravo, 2007; Becerra, et al., 2013).
El petróleo crudo es una mezcla compleja de compuestos, principalmente de hidrocarburos, en la que el carbono está entre un rango de 83 y 87 % y el hidrogeno, entre 10 y 14 % (Hsu & Robinson, 2019). Si bien su composición es fundamentalmente la de un compuesto insoluble, tiene una fracción soluble, conocida como fracción acumulada de petróleo (FAP), que constituye el componente más tóxico del crudo, el cual se incorpora al agua después de los derrames de petróleo, por lo que los organismos acuáticos quedan más expuestos a este componente que a los demás (Wilson & Ralph, 2008; Wang, et al., 2018). La FAP consta de componentes alifáticos, naftaleno y aromáticos, como el benceno, el tolueno (presente en mayor proporción que el benceno), el etilbenceno, el xileno y los fenoles (Wilson & Ralph, 2008; Salaberria, et al., 2014), siendo los hidrocarburos aromáticos policíclicos los de mayor peso molecular y los que presentan un coeficiente de reparto elevado, por lo que solo están presentes en concentraciones trazas (Neff, et al., 2000).
Los hidrocarburos de petróleo pueden afectar negativamente las especies acuáticas, causando asfixia e intoxicación (Avila, et al., 2010) por su acumulación en la membrana celular, lo que altera las propiedades fisicoquímicas y fisiológicas de esta (Campos, et al., 2017). Asimismo, los componentes de petróleo crudo ligero pueden ser tóxicos para las plantas debido a que se absorben fácilmente y causan daño a nivel celular (Lopes, et al., 2009).
Son varios los estudios en que se evalúan los efectos de los diferentes componentes del petróleo (como los compuestos aromáticos) en diversos bioindicadores (Oliveira, et al., 2017; Calderón-Delgado, et al., 2020; Xu, et al., 2020), en tanto que aquellos relativos al petróleo crudo y la FAP son menos frecuentes. Por ello, el presente estudio se centró en los efectos negativos del crudo en tres bioindicadores recomendados por las guías internacionales.
Para determinar el grado de contaminación del agua y los efectos tóxicos que generan los contaminantes en el ambiente, se recurre a diversas especies de organismos acuáticos denominados "bioindicadores". Estos organismos pueden detectar cambios en el ambiente ocasionados por la presencia de contaminantes debido a su resistencia a la variabilidad ecológica y tienen la ventaja de determinar los efectos tóxicos tanto a nivel individual como a niveles superiores de la organización biológica (Parmar, et al., 2016).
Uno de los bioindicadores utilizado para determinar los efectos tóxicos de los contaminantes en los cuerpos de agua es la "lenteja de agua", Lemma minor. Es una planta vascular macrófita flotante de frondas y raíces sumergidas propia de zonas tropicales y templadas que se utiliza en los bioensayos de toxicidad debido a que su pequeño tamaño, rápida tasa de crecimiento y bajo costo facilitan su recolección, cultivo y manipulación en el laboratorio (Fekete-Kertész, et al., 2015).
La "pulga de agua", Daphnia magna, es otro buen bioindicador de la alteración del ecosistema en cuerpos de agua dulce (Yang, et al., 2014). Es una especie partenogenética usada comúnmente en pruebas de toxicidad por ser sensible a muchos contaminantes ambientales, tener una amplia distribución geográfica y una alta fecundidad y por cumplir un papel importante en la comunidad zooplanctónica como consumidor primario de fitoplancton y como alimento para los consumidores secundarios (Iannacone, et al., 2012).
El pez cebra, Danio rerio, es un ciprínido que habita en lugares tropicales dulceacuícolas y salobres con abundante vegetación. Esta especie se utiliza como bioindicador para ensayos ecotoxicológicos por su pequeño tamaño, alta fecundidad y crecimiento rápido, características propias de un organismo complejo y fácil para evaluar los efectos ecotóxicos agudos (Martínez-Jerónimo, et al., 2005; Silva, et al., 2017).
En la evaluación de riesgo ambiental (ERA) se asignan magnitudes, rangos y probabilidades a los efectos tóxicos de un contaminante y su relación con el ambiente, lo que permite tomar decisiones en el ámbito social, legal y económico que garanticen la salud humana y la conservación de la biota (Barros, et al., 2017). En este estudio se utilizaron bioindicadores de los diferentes niveles de la cadena trófica, con el fin de obtener una mejor evaluación de las consecuencias ecológicas generadas por los contaminantes (Silva, et al., 2017) y del riesgo ambiental del petróleo crudo determinando los efectos letales y subletales en las especies acuáticas L. minor, D. magna y D. rerio.
Materiales y métodos
Fracción acumulada de petróleo
El petróleo crudo fue suministrado por la refinería de La Pampilla - Repsol (Lima - Perú) y registraba una densidad de 0,8 g/cm3. Para la preparación de la FAP para los tres bioensayos, se mezcló petróleo crudo y agua en un matraz Erlenmeyer en las siguientes proporciones de volumen (v:v): 1:80 para la lenteja de agua (Wilson & Ralph, 2008), 1:20 para la pulga de agua según se determinó en un ensayo preliminar, y 1:9 para el pez cebra. La solución mezclada se selló con papel aluminio para evitar la evaporación de los compuestos volátiles del petróleo y se agitó en un agitador magnético (sin formar un vórtice mayor a 25 % verticalmente y evitar la formación de gotas suspendidas en el agua) (Salaberria, et al., 2014) durante 20 h a una temperatura de 20 °C y en oscuridad; posteriormente se dejó la solución en una pera de decantación durante 3 horas. Se obtuvieron dos fases; se usó la fase acuosa de la parte inferior de la pera de decantación, que representaba el 100 % de la FAP, y a partir de esta se hicieron las diluciones para los ensayos. No fue necesario ajustar el pH debido a que en la FAP se mantuvo en valores de 7 a 8.
Determinación de la concentración de hidrocarburos totales de petróleo en la fracción acumulada de petróleo
Los hidrocarburos totales de petróleo (HTP) presentes en la FAP se calcularon con base en el petróleo crudo, el cual presenta aproximadamente un 75 % de estos. Este valor está en el rango del estudio de Neff, et al. (2000), quienes determinan la cantidad de HTP en cuatro tipos de crudos con un rango entre 47 y 81 % del peso. En el presente estudio se determinó la concentración de petróleo y agua en ml/L y se halló su equivalencia en mg/L mediante el valor de densidad del petróleo crudo. Posteriormente, se multiplicó la concentración por 75 % para determinar la concentración de los HTP presente en la mezcla. Para obtener su concentración en la FAP, se multiplicó el valor obtenido de HTP en la mezcla de crudo por el factor determinado mediante la proporción de la concentración de los HTP presentes en la FAP y el crudo. Los datos de dicho factor se obtuvieron de varios estudios en que la densidad era similar a la de este; luego se promediaron y se obtuvo el factor de 0,00085833 (Avila, et al., 2010; Lari, et al., 2015a; Philibert, et al., 2016).
Diseño experimental
Los bioensayos se hicieron según las guías de ensayo de la Organización para la Cooperación y Desarrollo Económico (OCDE) para L. minor (OCDE, 2006), D. magna (OCDE, 2004) y D. rerio (OCDE, 2018). En los tres experimentos se midieron las variables físico-químicas al inicio y al final del bioensayo. El pH, la conductividad eléctrica (CE) y la temperatura se midieron con una sonda multiparámetro (Hanna® HI98130), y el oxígeno disuelto (OD) con un medidor Hanna® HI9146.
Lemna minor
Las lentejas de aguas no requirieron una aclimatación debido a que el proveedor las mantuvo aclimatadas en agua declorada y con nutrientes esenciales "Plant Gro" Nutrafin®: nitrógeno, boro, cobre, hierro, manganeso, molibdeno y zinc, y una iluminación constante de 2.800 lux durante las dos semanas previas al ensayo (OECD, 2006).
El bioensayo consistió en adicionar 10 colonias de L. minor, cada una conformada por dos hojas del mismo tamaño, en cada envase de plástico con capacidad de 250 mL agregando 100 mL de la solución con hidrocarburo. El ensayo se hizo con cuatro réplicas, cinco concentraciones y un control: 0, 0,40, 0,80, 1,61, 3,22 y 6,44 mg/L. La temperatura se mantuvo a 24 ± 2 °C y se empleó iluminación continua de 4.200 lux. La prueba duró 168 horas y los parámetros finales de lectura fueron la formación de hojas nuevas, el número total de frondas, el peso seco, el peso húmedo, la clorosis (50 % de pérdida de pigmento) y la ruptura de colonias.
Daphnia magna
La aclimatación de las hembras partenogénicas se hizo en contenedores de plástico con agua embotellada. Se les suministró diariamente la microalga Chlorella vulgaris (Ha, et al., 2019). La temperatura se mantuvo en 20 ± 2 °C, con un pH de 7, aireación constante con oxígeno disuelto de 7 a 8 mg/L y un fotoperiodo de 12 h de luz: 12 h de oscuridad durante 14 días antes del ensayo. Para el desarrollo de la prueba se adicionaron 10 ejemplares neonatos (<24 h de nacidos) por envase.
Las pruebas se hicieron con cuatro réplicas y las concentraciones fueron de 0, 1,61, 3,22, 6,44, 12,87 y 25,5 mg/L. La prueba se consideró válida al comprobar que en el recipiente de control hubiera una mortalidad menor al 10 %. Los puntos de lectura de la mortalidad e inmovilización se fijaron a las 24 y las 48 horas de exposición. Los organismos no fueron alimentados durante el ensayo. Para la lectura de las variables, se agitaron previamente los envases, con el fin de reactivar el movimiento de los organismos. El criterio de inmovilidad fue la ausencia de movimiento por 15 segundos y el de mortalidad, la ausencia de ritmo cardiaco a los 15 segundos verificada con el microscopio estereoscópico.
Danio rerio
Se acondicionó a los peces en un acuario acondicionado con termómetro, termostato y piedra difusora para proporcionar oxígeno constantemente. La aclimatación se mantuvo por dos semanas a una temperatura de 23 ± 2 °C, pH de 7, aireación constante con 7 a 8 mg/L de oxígeno disuelto y un fotoperiodo de 12 h luz:12 h oscuridad. Se les suministró diariamente alimento para peces tropicales (Nutrafin Max®).
Los peces juveniles mostraban una apariencia saludable, requisito indispensable para el inicio del bioensayo. La prueba se llevó a cabo con 10 organismos por envase. El bioensayo tuvo cuatro réplicas con las siguientes concentraciones: 3,58, 7,15, 14,31, 28,61, y 57,22 mg/L, y el control. La duración de la prueba fue de 96 h. Las variables consideradas puntos finales de lectura fueron la hipoactividad, el escape hacia el fondo y la hipoventilación (determinada mediante el conteo del movimiento del opérculo durante 30 segundos). Los peces no se alimentaron durante el ensayo.
Evaluación del riesgo ambiental
La evaluación del riesgo ambiental (ERA) se basó en la guía de la OCDE (2011); se emplearon condiciones de mayor exposición utilizando tres organismos modelos de la cadena trófica acuática: la lenteja de agua L. minor (OCDE, 2006), que representa los productores primarios; la pulga de agua D. magna (OCDE, 2004), como consumidor primario, y el pez cebra D. rerio (OCDE, 2018) como consumidor secundario. La selección de estas tres especies bioindicadoras componentes de la cadena trófica no respondió a la relación de conexión trofodinámica en el ecosistema dulceacuícola y siguió lo propuesto por Oliveira, et al. (2017), Fekete-Kertész, et al. (2017) y Sobrino-Figueroa (2018).
La estimación del coeficiente de riesgo (CR) se calculó dividiendo la concentración ambiental prevista (PEC) y el valor obtenido de los estándares de calidad ambiental (ECA) del agua - categoría 4 (Conservación del ambiente acuático: hidrocarburos totales de petróleo, Decreto Supremo 004-2017) (Ministerio del Ambiente - MINAM, 2017) en la concentración esperada sin efecto en el ambiente (PNEC). Se calculó la PNEC dividiendo la NOEC por un factor de seguridad de 100. Este factor se determinó según la guía de OCDE (2011) utilizando tres especies de diferentes niveles tróficos que representan los productores primarios, el consumidor primario y el consumidor secundario, respectivamente, y tomando como variable a evaluar la NOEC. Cuando el cociente de riesgo (CR) obtenido para cada especie representante de cada nivel trófico es inferior a 1, hay ausencia de riesgo, en tanto que un CR superior a 1 representa un riesgo significativo.
Análisis estadístico
Las pruebas de toxicidad aguda de la FAP en los organismos acuáticos se hicieron en cinco concentraciones más el control, con cuatro réplicas y con un diseño de bloque completo al azar (DBCA) de 6 x 4. Cada parámetro se analizó con las pruebas de normalidad y de homogeneidad de varianzas utilizando la prueba de Shapiro-Wilk y la de Levene, respectivamente. Si los datos cumplían con los supuestos de normalidad y homogeneidad, se evaluaba la eficacia de los tratamientos mediante un análisis de varianza (ANOVA). En el caso de que no cumplieran con los supuestos, se sometían a la prueba no paramétrica de Kruskall Wallis (K-W). Si la prueba de ANOVA o la de K-W mostraban diferencias significativas, se recurría a la prueba de Tukey (p=0,05) para obtener la LOEC y la NOEC con base en lo señalado por Picone, et al. (2021). Todos los datos se analizaron mediante el programa estadístico de cómputo SPSS, versión 22, de IBM para Windows. Las CL50 y CE50 se obtuvieron a partir de una hoja de cálculo del programa de cómputo Excel®, Probit versión.
Resultados
Lemna minor
En cuanto a las variables analizadas en los ensayos de exposición a la FAP (número de frondas totales, peso húmedo, ruptura y formación de hojas nuevas), no se observaron diferencias estadísticamente significativas entre las concentraciones de FAP y el control. Además, no se pudo determinar la CI50 debido a que no se observó una afectación mayor al 50 % en las variables medidas comparadas con el control (Tabla 1). Por otro lado, a las 168 h de exposición de la lenteja de agua, los valores de la NOEC y la LOEC evidenciaron una mayor toxicidad de los TPH en la variable de porcentaje de clorosis, viéndose afectada por concentraciones más bajas que la de peso seco (Figura 1). Además, al analizar las variables físico-químicas se observó una disminución del pH en todas las concentraciones de FAP, en tanto que en el control el valor final superó al inicial. Los datos de conductividad eléctrica y oxígeno disuelto mostraron un incremento, pero con respecto a la temperatura no disminuyeron significativamente (Tabla 1S,https://www.raccefyn.co/index.php/raccefyn/article/view/1398/3095).
Tabla 1 Efectos subletales evaluados en el bioensayo con Lemna minor expuesta a la fracción acumulada de petróleo crudo expresada en mg/L a las 168 h de exposición
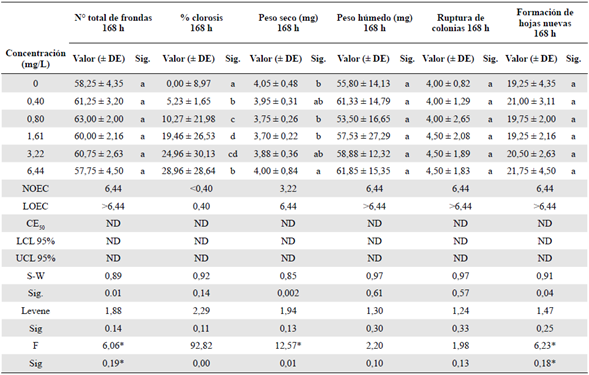
Sig.: significación; h=horas; DE: desviación estándar
Las letras que figuran en minúscula para cada columna representan la variación en la significación entre las variables de los tratamientos (prueba de Tukey: p<0,05). NOEC: concentración en la que no se observa efecto; LOEC: concentración más baja en la que se observa efecto; CEJ0= concentración efectiva media; LCL: nivel mínimo de confianza al 95 %. UCL: nivel máximo de confianza al 95 %; ND: valor no determinado. Los porcentajes de las variables analizadas corresponden al promedio de las cuatro réplicas. S-W: prueba de Shapiro-Wilk para evaluar la normalidad. Estadístico de Levene: prueba para evaluar la homogeneidad de varianzas. F: estadístico de Fisher del Anova. *: Significación en la prueba de Kruskall - Wallis
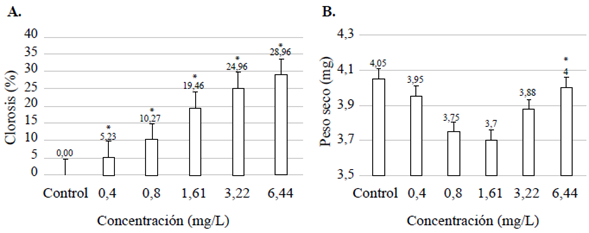
Figura 1 Efectos subletales evaluados en el bioensayo con Lemna minor expuesta a la fracción acumulada de petróleo crudo expresado en mg/L a las 168 h. Efecto subletal, porcentaje de clorosis (A); efecto subletal, peso seco (B). Las barras representan el promedio de valores ± la desviación estándar de las variables medidas. Variación de significación entre los tratamientos y el control (p<0,05) (*)
Daphnia magna
Se evaluó el efecto toxicológico agudo de la FAP en los neonatos de D. magna a las 24 y las 48 horas de exposición (Tabla 2), observándose un mayor efecto de la FAP a las 48 horas en las dos variables evaluadas: porcentaje de inmovilidad y mortalidad (Figura 2). En cuanto al pH, no se observó un cambio significativo, en tanto que los valores finales de la CE se mantuvieron similares a los iniciales. Los valores de oxígeno disuelto y temperatura no disminuyeron significativamente (Tabla 2S,https://www.raccefyn.co/index.php/raccefyn/article/view/1398/3095).
Tabla 2 Efectos subletal y letal evaluados en el bioensayo conDaphnia magna expuesta a la fracción acumulada de petróleo crudo expresada en mg/L a las 48 h de exposición
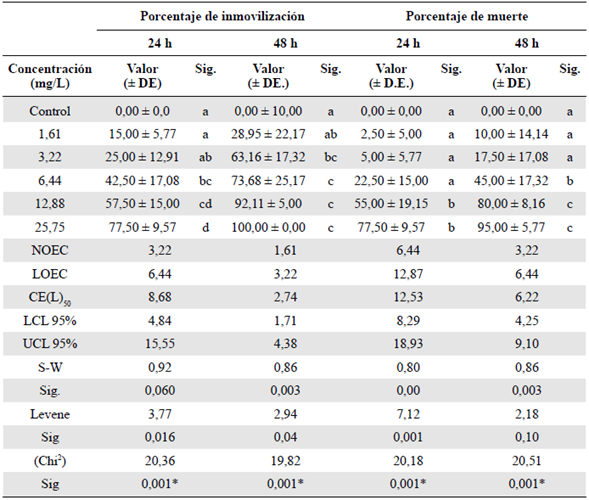
Sig.: significancia; h: horas; DE: desviación estándar
Las letras que figuran en minúscula para cada columna representan la variación de la significación entre las variables de los tratamientos (prueba de Tukey, p<0,05). NOEC: concentración en la que no se observa efecto; LOEC: concentración más baja en la que se observa efecto; CEJ0: concentración efectiva media; LCL: nivel mínimo de confianza al 95 %; UCL: nivel máximo de confianza al 95 %; ND: valor no determinado. Los porcentajes de las variables analizadas corresponden al promedio de las cuatro réplicas. S-W: prueba de Shapiro-Wilk para evaluar la normalidad. Estadístico de Levene: prueba para evaluar la homogeneidad de varianzas. %2: ji al cuadrado de la prueba no paramétrica. *: Significación en la prueba de Kruskall-Wallis
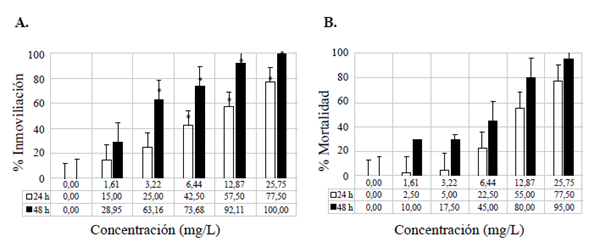
Figura 2 Efectos subletal y letal evaluados en el bioensayo con Daphnia magna expuesta a la fracción acumulada de petróleo crudo expresada en mg/L a las 24 y 48 h. Efecto subletal, porcentaje de inmovilización (A); efecto letal, porcentaje de mortalidad (B). Las barras representan el promedio de valores ± la desviación estándar de las variables medidas. Las barras blancas corresponden a las variables medidas a las 24 h. Las barras negras corresponden a las variables medidas a las 48 h. Variación de significación entre los tratamientos y el control (p<0,05) (*)
Danio rerio
No se observó afectación en las variables de mortalidad e inmovilización. Se observó un decrecimiento de la actividad natatoria con el aumento de la concentración de FAP en comparación con el control. Los valores de la NOEC, la LOEC y la CE50 más tóxicos fueron a las 72 h de exposición (Tabla 3). Por otro lado, a las 96 h se observó una recuperación (Figura 3), sin que se determinara la CE50 debido a que no hubo afectación mayor al 50 % en comparación con el control (Tabla 3). En la variable de porcentaje de escape hacia el fondo se determinó una mayor toxicidad comparado con las otras variables. La toxicidad evaluada mostró mayor afectación a partir de las primeras 24 h y de la concentración más baja de FAP (Tabla 4).
Tabla 3 Efecto subletal en la hipoactividad evaluado en el bioensayo con Danio rerio expuesto a la fracción acumulada de petróleo crudo expresada en mg/L a las 96 h de exposición
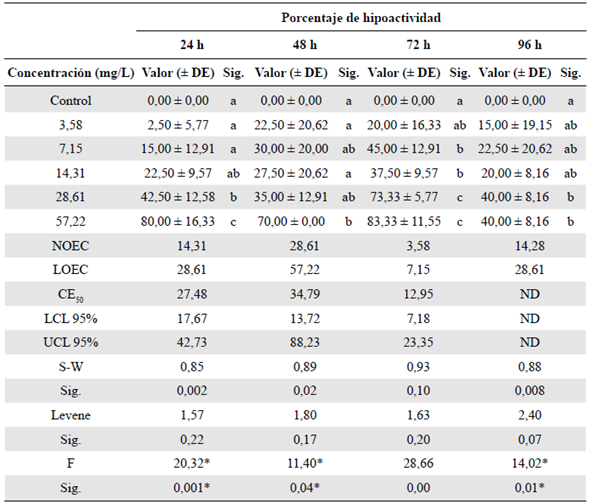
Sig.: significación; h: horas; DE: desviación estándar
Las letras que figuran en minúscula para cada columna representan la variación de significación entre las variables de los tratamientos (prueba de Tukey, p<0,05). NOEC: concentración en la que no se observa efecto; LOEC: concentración más baja en la que se observa efecto; CE50: concentración efectiva media; LCL: nivel mínimo de confianza al 95 %; UCL: nivel máximo de confianza al 95 %; ND: valor no determinado. Los porcentajes de las variables analizadas corresponden al promedio de las cuatro réplicas. S-W: prueba de Shapiro-Wilk para evaluar la normalidad. Estadístico de Levene: prueba para evaluar la homogeneidad de varianzas. F: estadístico de Fisher del Anova. *: Significación en la prueba de Kruskall - Wallis
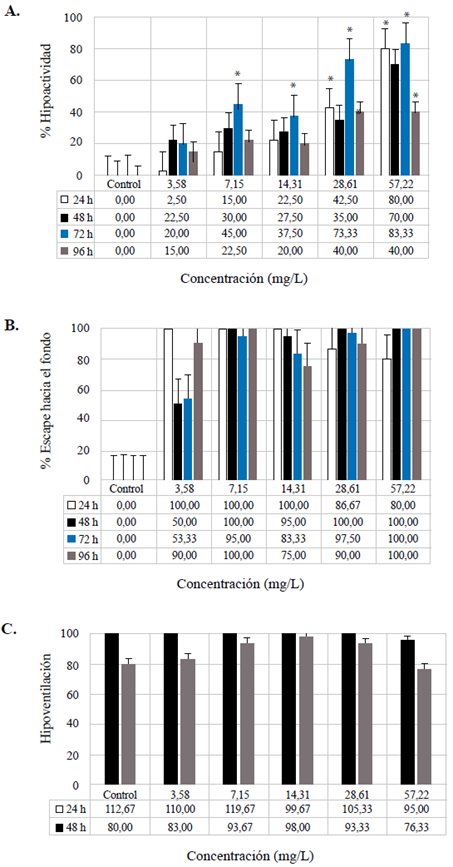
Figura 3 Efectos subletales evaluados en el bioensayo con Danio rerio expuesta a la fracción acumulada de petróleo crudo expresada en mg/L a las 24, 48, 72 y 96 h. Efecto subletal, porcentaje de hipoactividad (A); efecto subletal, porcentaje de escape hacia el fondo (B); efecto subletal, hipoactividad (C). Las barras representan el promedio de valores ± la desviación estándar de las variables medidas. Las barras blancas corresponden a las variables medidas a las 24 h. Las barras negras corresponden a las variables medidas a las 48 h. Las barras azules corresponden a las variables medidas a las 72 h. Las barras grises corresponden a las variables medidas a las 96 h. Variación de significación entre los tratamientos y el control (p<0,05) (*)
Tabla 4 Efecto subletal en la variable escape hacia el fondo evaluado en el bioensayo con Danio rerio expuesta a la fracción acumulada de petróleo crudo expresada en mg/L a las 24, 48, 72 y 96 h de exposición
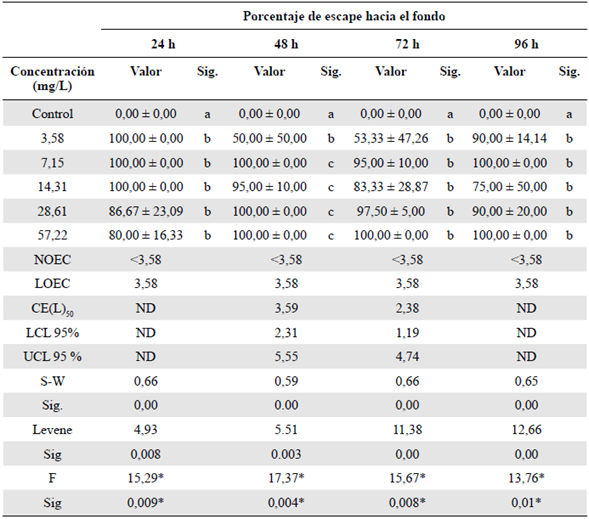
Sig.: significación; h: horas; DE: desviación estándar
Las letras que figuran en minúscula para cada columna representan la variación de significación entre las variables de los tratamientos (prueba de Tukey, p< 0,05). NOEC: concentración en la que no se observa efecto; LOEC: concentración más baja en la que se observa efecto; CE50: concentración efectiva media. LCL: nivel mínimo de confianza al 95 %. UCL: nivel máximo de confianza al 95 %; ND: valor no determinado. Los porcentajes de las variables analizadas corresponden al promedio de las cuatro réplicas. S-W: prueba de Shapiro-Wilk para evaluar la normalidad. Estadístico de Levene: prueba para evaluar la homogeneidad de varianzas. F: estadístico de Fisher del Anova. *: Significación en la prueba de Kruskall-Wallis
La variable de hipoventilación (Tabla 5) registró valores de NOEC de 3,58 y 7,15 mg/L a las 48 h y a las 96 h de exposición. En cuanto a las diferentes concentraciones, se observó una disminución de la frecuencia respiratoria, excepto en las concentraciones de 7,15 mg/L (48 h y 96 h) y 14,31 mg/L (96 h), en las cuales se registró un aumento significativo del movimiento opercular comparadas con el control. En la tabla 3S,https://www.raccefyn.co/index.php/raccefyn/article/view/1398/3095, se presentan las variables fisicoquímicas analizadas. El pH y la CE no mostraron un cambio significativo.
Tabla 5 Efecto subletal de hipoventilación evaluado en el bioensayo con Danio rerio expuesta a la fracción acumulada de petróleo crudo expresada en mg/L a las 96 h
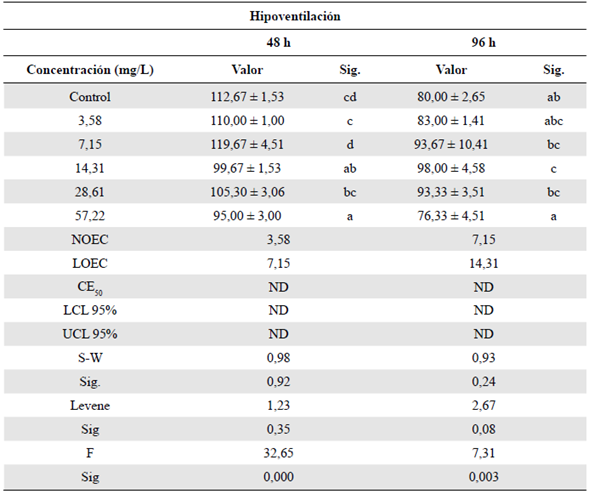
Sig.: significación; h: horas; DE: desviación estándar
Las letras que figuran en minúscula para cada columna representan la variación de significación entre las variables de los tratamientos (prueba de Tukey, p<0,05). NOEC: concentración en la que no se observa efecto; LOEC: concentración más baja en la que se observa efecto; CE50: concentración efectiva media; LCL: nivel mínimo de confianza al 95 %. UCL: nivel máximo de confianza al 95 %; ND: valor no determinado. S-W: prueba de Shapiro-Wilk para evaluar la normalidad. Estadístico de Levene: prueba para evaluar la homogeneidad de varianzas. F: estadístico de Fisher del Anova
Evaluación de riesgo ambiental
En la tabla 6 se presenta el resumen de la evaluación del riesgo ambiental de la fracción soluble de petróleo en los tres organismos acuáticos. Todos los valores de CR fueron mayores a 1, por lo que se concluyó que la FAP en el ambiente acuático genera un riesgo ambiental para los ecosistemas acuáticos.
Tabla 6 Resultados de la evaluación del riesgo ambiental (ERA) de la fracción acumulada de petróleo (FAP) en tres especies bioindicadoras del ecosistema acuático
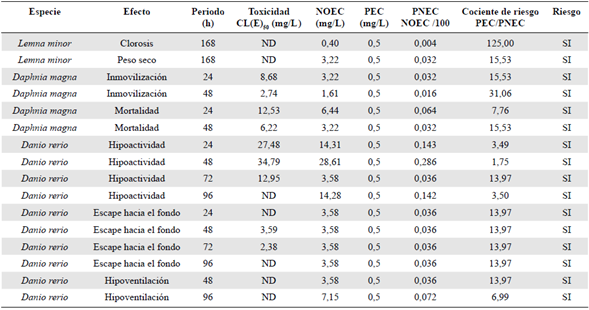
H: horas; CL(E)50: concentración letal o efectiva media; NOEC: concentración en la que no se observa efecto; PEC: concentración ambiental prevista; PNEC: concentración esperada sin efecto en el ambiente
Discusión
Las concentraciones de petróleo en el ecosistema acuático debidas a derrames y sus efectos tóxicos dependen de diversos factores: la escala temporal y espacial, la topografía, la dinámica del agua, la magnitud del derrame y el tipo de petróleo crudo, con 20 a 40 ppm o más en las capas superiores de la columna de agua (Almeda, et al., 2014). La toxicidad de la FAP se debe principalmente a los hidrocarburos monoaromáticos como el benceno, el tolueno, el etilbenceno y el xileno (BTEX) (Neff, et al., 2000), así como al naftaleno y a los alcanos presentes en mayor proporción (Omar-Ali, et al., 2015). El petróleo crudo de Repsol presentó un grado API de 45,15, lo que corresponde a petróleo ligero, siendo este tipo tóxico para los ensayos agudos. El petróleo crudo ligero es más tóxico que el pesado, pues penetra en la columna de agua con más eficiencia que el pesado; por otro lado, los crudos ligeros tienden a evaporarse con mayor rapidez, por lo que pueden permanecer menor tiempo en el ambiente (Martínez-Jerónimo, et al., 2005).
En cuanto a la variable peso seco evaluada en L. minor, en las concentraciones más bajas se obtuvieron valores similares al control, en tanto que en la concentración más alta se observó inhibición. Este resultado es similar al del estudio de Eshagberi (2017)), quien registró un aumento en el peso húmedo de la planta acuática Ceratophyllum demersum en la concentración más baja (25 % de fracción soluble de petróleo, FSP), lo que fue superior al control, así como una inhibición en la concentración más alta (100 % de FSP).
La disminución del grosor de las hojas y la longitud de las raíces en el presente estudio sería la causa de la disminución del peso seco de L minor. Según Lopes, et al. (2009)), se observó estimulación en el crecimiento de las raíces en concentraciones medias mientras que, en concentraciones altas, hubo inhibición. Asimismo, se observó un adelgazamiento en las hojas de la macrófita Eichhornia crassipes causado por los HTP, lo que provocó estrés en la planta y afectó su desarrollo.
En cuanto a la clorosis en L. minor, esta aumentó con la concentración de FAP debido a que componentes como los iones presentes en la FAP causan estrés al provocar degradación de la clorofila (Edema, et al., 2007; Edema & Okoloko, 2008).
Entre los componentes orgánicos presentes en la FAP los hidrocarburos aromáticos policíclicos (HAP) se consideran los principales responsables de los efectos tóxicos en los organismos acuáticos (Sørensen, et al., 2017). Por ende, se sugiere que la clorosis en L. minor se evidenció al aumentar los HAP en la FAP, pues al entrar en contacto con la luz, estos aumentan la toxicidad de los hidrocarburos debido a que tales compuestos 'fotomodifi-cados' son más solubles en el agua, por lo que presentan una mayor biodisponibilidad para la lenteja de agua (Huang, et al., 1993). Sin embargo, en investigaciones futuras deberá evaluarse la concentración de HAP en la FAP para corroborar estos resultados.
Con respecto al pH medido en las soluciones de los HTP y L. minor, se observó una ligera disminución comparado con el control. Edema, et al. (2007) reportaron en su estudio la presencia de amonio en la FAP. Según estos autores, las macrófitas liberan oxígeno, lo que promueve el proceso de nitrificación que, a su vez, libera iones de hidrógeno. Los iones de hidrógeno son neutralizados por los iones de bicarbonato, pero este proceso no se cumple en su totalidad, por lo que se obtiene mayor cantidad de iones de hidrógeno que de bicarbonato, produciéndose la disminución del pH (Sekomo, et al., 2012).
El aumento de la CE en el presente bioensayo se dio con todas las concentraciones comparadas con el control. Edema & Okoloko (2008) han señalado que el aumento de la CE es un indicador de contaminación. Estos autores reportaron una alta concentración de iones en la FAP, lo que produjo la destrucción de la pared celular al ocasionar lixiviación de iones en el agua, ocasionando estrés a la planta y aumentando la CE al final del ensayo (Edema, et al., 2007).
Daphnia magna mostró inhibición en la actividad natatoria con la FAP, la cual resultó tóxica y produjo casi un 100 % de mortalidad y de inmovilización a las 48 h de exposición. El parámetro de inmovilización en D. magna fue mayor que el de mortalidad frente a la FAP debido a la exposición a concentraciones más bajas de HTP. Blewett, et al. (2018) determinaron una mayor toxicidad en la variable de inmovilización de la pulga de agua expuesta a efluentes de una fractura hidráulica de TPH. Los efectos negativos en D. magna pueden atribuirse a la presencia de BTEX y a los HAP en la FAP, como se ha observado en estudios previos (Müller, et al., 2019). Se sugiere que, al ser el compuesto predominante en los HAP (Müller, et al., 2019), y debido a su alta toxicidad, el naftaleno incrementa la mortalidad y las alteraciones subletales en organismos acuáticos como la pulga de agua (Arfsten, et al., 1996; Almeda, et al., 2014; Blinova, et al., 2016).
La mortalidad de la pulga de agua estuvo en función de la concentración de los HTP, resultados similares a los del estudio de Ndimele (2011), quien analizó la toxicidad de la FAP en un microcrustáceo, Desmocaris trispinosa, y demostró que estos organismos son buenos bioindicadores para determinar la toxicidad del petróleo. Por otro lado, al incrementarse los periodos de exposición, las variables analizadas se vieron más afectadas por concentraciones más bajas de HTP, por lo que se obtuvieron valores más tóxicos de CL50 y CE50. Bobra, et al. (1989) evaluaron la FSP preparada en la misma proporción de agua y petróleo y la misma temperatura que en el presente estudio, y obtuvieron un valor de CL50 de 7 mg/L de TPH, efecto posiblemente causado por los HAP y los alcanos de bajo peso molecular. Sin embargo, debe considerarse que la composición del petróleo es altamente variable, por lo que no necesariamente todos los resultados en los bioensayos con D. magna son comparables e iguales (Müller, et al., 2019). Ekanem, et al. (2011) atribuyeron la mortalidad de las pulgas de agua al petróleo en sus branquias, que las incapacitó para realizar el intercambio gaseoso a una temperatura que se mantuvo en los 22 °C. Por ello se obtuvieron resultados más sensibles, ya que la FAP es más tóxica a los 20 °C que a los 5 °C (Bobra, et al., 1989). Además, la concentración de oxígeno disuelto no cambió significativamente. Al haber una alta concentración de oxígeno y luz solar, la toxicidad de los HAP se incrementa debido a que son compuestos 'fotomodificados' (Arfsten, et al., 1996).
En D. rerio no se observó efecto letal ni subletal (inmovilización) en ninguna de las concentraciones analizadas, probablemente debido a la volatilización de los HTP de la FAP, lo cual concuerda con Lari, et al. (2015b), quienes también obtuvieron una reducción de 30 % en los TPH en su FSP con una preparación de igual proporción de petróleo y agua a la empleada en el presente ensayo. La ausencia de efectos letales y de inmovilización en D. rerio se debe probablemente a que la FAP contiene una baja proporción de BTEX o se volatilizó hacia el final del ensayo (Neff, et al., 2000).
En la etapa juvenil el pez cebra no presentó gran sensibilidad hacia ciertos contaminantes en comparación con la etapa embrionaria. Philibert, et al. (2016) observaron mortalidades en larvas del pez cebra a partir de una concentración más alta (80 % de FAP), relacionada, además, con el tipo de crudo empleado en el ensayo. Holth, et al. (2014) no observaron efectos letales en peces adultos y con una concentración mayor de FAP a la del presente estudio, de 1:1, y una duración del ensayo de tres semanas. Asimismo, el pez cebra no presentó sensibilidad a la FAP en la respuesta de inmovilidad en etapa embrionaria o juvenil (Wang, et al., 2018).
Si bien la FAP no afectó al pez cebra en las variables de mortalidad e inmovilización, este organismo es un buen indicador en cuanto al comportamiento, pues se han observado otros efectos subletales a partir de los 5 μg/L, como alteraciones en su actividad locomotora en la etapa larval (Wang, et al., 2018). Un efecto subletal observado en el presente ensayo fue la respuesta de escape hacia el fondo a partir de la concentración de 3,58 mg/L, con efectos mayores al 50 % comparado con el control. En efecto, la afectación de la FSP en el comportamiento de los peces ha sido corroborado por Lari, et al. (2015a) y Claireaux, et al. (2018) quienes determinaron que el pez evita el contaminante a partir de la concentración de 2 mg/L de FSP y de 3 a 15 μg/L de HTTP. La respuesta de escape hacia el fondo o hacia las esquinas inferiores del envase ocurre como un modo de evitar el tóxico, lo cual representa un comportamiento de estrés de los peces al tener que buscar un refugio (Philibert, et al., 2016).
En el pez cebra se observaron efectos subletales como la hipoventilación, con disminución de la frecuencia respiratoria en las concentraciones más altas, en tanto que en las concentraciones medias se observaron valores superiores al control. Al evaluar el efecto subletal de la FSP en peces, Lari, et al. (2015b) observaron un aumento en la frecuencia respiratoria con el aumento de la concentración, lo que se explica porque la FSP ocasiona hipoxia en la sangre de los peces, es decir, una disminución de oxígeno y un aumento de dióxido de carbono. En su estudio, además, evidenciaron una pérdida de la postura horizontal similar a la registrada en el presente estudio y que provocó el escape de los peces hacia el fondo del recipiente. Por otro lado, la disminución de la frecuencia respiratoria se puede atribuir al cambio en la tasa del metabolismo o a que el pez reduce el área de las branquias para evitar el paso del contaminante, lo que resulta en la reducción de la respiración y el intercambio iónico (Leadley, et al., 2015).
La hipoactividad puede emplearse para determinar la toxicidad de los contaminantes en los peces (Yu, et al., 2015). Estos autores y Lari, et al. (2015b) obtuvieron resultados similares, con un aumento en el porcentaje de hipoactividad al incrementarse la concentración del tóxico debido a la toxicidad de la FAP y la disminución de oxígeno disuelto en el agua. Gonçalves, et al. (2008) señalaron que la reducción de 30 a 12 % en la actividad natatoria de los peces se debe a los HAP. Wang, et al. (2018), por su parte, observaron una disminución de la actividad natatoria de los peces cebras en las etapas larval y juvenil causada por la toxicidad de los HAP presentes en la FAP.
Si bien el comportamiento de las variables de hipoactividad e hipoventilación evidenció el efecto tóxico de la FAP, a las 96 horas de exposición se observó una ligera recuperación, respuesta que se explicaría porque los peces tienden a depurar los HAP de su sistema con el paso del tiempo (Djomo, et al., 1996). Por otro lado, en las variables analizadas se observó que los valores aumentaban proporcionalmente y, en algunos casos, se determinó una afectación mayor en concentraciones medias (Blinova, et al., 2016).
La toxicidad en la FAP se redujo en los tres organismos, siendo la lenteja de agua más sensible que la pulga de agua, y el pez cebra el menos sensible. Este resultado podría deberse a que el petróleo crudo ligero tiene efecto a nivel celular modificando la permeabilidad de la membrana celular o interrumpiendo los procesos de metabolismo de la planta (Lopes, et al., 2009). Asimismo, la concentración de FAP en el ensayo con L. minor contenía menor proporción de petróleo crudo y mayor cantidad de agua en comparación con los otros bioensayos. En este sentido, Blinova, et al. (2016) demostraron que cuanto mayor era la concentración de petróleo crudo, menor era la eficiencia de extracción de componentes solubles como los hidrocarburos, y con las diluciones se observó una menor toxicidad. Cleuvers (2003) concluyó que la lenteja de agua es un bioindicador muy sensible a los contaminantes al determinar su comportamiento frente a diversos productos farmacéuticos en comparación con la pulga de agua y la microalga Desmodesmus subspicatus. En el presente estudio, la lenteja de agua presentó dos variables afectadas por la FAP y valores de NOEC y LOEC menores que la pulga de agua y el pez cebra debido a que los HTP producen una mayor toxicidad a partir de concentraciones bajas, desde 0,4 mg/L.
Por otro lado, los datos obtenidos de CL50 a las 96 h, y la NOEC y la LOEC en la pulga de agua evidenciaron mayor sensibilidad en comparación con el pez cebra, pues son más vulnerables a la toxicidad ocasionada por los HAP y a su intensificación por la radiación UV (Duesterloh, et al., 2002), tanto que se registró hasta un 100 % de inmovilización y mortalidad en la pulga de agua, lo que demuestra que es buen bioindicador frente a la FAP. Al evaluar la toxicidad de la FAP en varios organismos acuáticos, Blinova, et al. (2016) también reportaron que la pulga de agua fue la más sensible.
Con las variables analizadas en los tres bioensayos se obtuvo un coeficiente de riesgo mayor a 1, por lo que se determinó que la FAP representa un riesgo para el ambiente. Los resultados corresponden a tres organismos representativos de la cadena trófica dulceacuí-cola de forma individual, por lo que se podría producir una mayor toxicidad de la FAP en el ecosistema acuático cuando haya interacción entre estas especies y factores ambientales como el pH, la luz y la temperatura. Las condiciones ambientales del ecosistema acuático aumentan la toxicidad de la FAP provocando un mayor impacto en los organismos acuáticos (Wernersson, 2004). Huang, et al. (1993) demostraron que la luz UV aumenta la toxicidad de los HAP en bioensayos con la lenteja de agua. Berrojalbiz, et al. (2009) concluyeron que en el ambiente acuático el zooplancton estaría expuesto a una mayor concentración de TPH, pues lo obtendría del fitoplancton contaminado con petróleo y directamente de la FAP. A pesar que el zooplancton y los peces tienden a depurar los HAP en pequeñas concentraciones, no lo hacen completamente (Berrojalbiz, et al. , 2009), por lo que el riesgo ambiental de la FAP sería mayor en el medio natural acuático.
Por último, aunque se observaron valores tóxicos con efectos letales y subletales en las tres especies acuáticas bajo estudio (estandarizadas según normas internacionales en ensayos a largo plazo), podría demostrarse una mayor toxicidad si se evalúan otros biomarcadores enzimáticos, metabolitos endógenos, citotoxicidad y genotoxicidad, entre otros, por lo que se recomienda llevar a cabo ensayos crónicos y de metabolómica ecológica para estudiar los efectos de la FAP en los diferentes niveles de la organización trófica (Müller, et al., 2019; Turja, et al., 2020).
Conclusiones
Los tres organismos evaluados, L. minor, D. magna y D. rerio, mostraron una vulnerabilidad diferenciada ante la fracción acumulada de petróleo (FAP) como se evidenció en los efectos letales y subletales. Con base en la NOEC, las variables más sensibles en la lenteja de agua fueron la clorosis y el peso seco a las 168 horas de exposición. La CL50 y la CE50 a las 48 h de exposición mostraron gran sensibilidad en la pulga de agua. Por último, la NOEC del ensayo con el pez cebra para las variables de hipoactividad, escape hacia el fondo e hipoventilación a las 96 horas de exposición resultaron ser las de mayor sensibilidad. El cociente de riesgo en la evaluación de riesgo ambiental fue mayor a 1, lo que evidenció en todos los casos la existencia de riesgo para el ecosistema dulceacuícola, con el valor más tóxico registrado en la LOEC de la lenteja de agua (0,4 mg/L). Si bien los tres organismos evaluados fueron sensibles al tóxico, se determinó un orden de ecotoxicidad decreciente tomando la variable más sensible de cada indicador con base en la LOEC: L. minor (clorosis, a las 168 h) > D. magna (inmovilidad, a las 48 h) > D. rerio (escape hacia el fondo, a las 96 h).















