Introducción
Los ríos de la cuenca del Orinoco inundan periódicamente las sabanas adyacentes, conformando así diferentes tipos de humedales y condiciones ambientales que se caracterizan por un alto grado de variabilidad espacio-temporal (Lewis, et al., 2000; Pennington, et al., 2006; Rodríguez, et al., 2009), lo que genera un efecto en la composición, la abundancia y la distribución de las especies acuáticas (Rosales, et al., 2010; Osorio-Peláez & Lasso, 2015).
Asimismo, la secuencia hidrológica producto de los pulsos de inundación (Junk, et al., 1989) somete a las comunidades ícticas a sucesiones ecológicas regulares y repetidas y establece relaciones recíprocas entre las corrientes de agua y los cuerpos lénticos (Lewis, et al., 2000; Bozelli, et al., 2015). En consecuencia, estas comunidades logran dispersarse en todos los ambientes acuáticos disponibles a medida que los ecosistemas fluctúan (Lacambra & Pinilla, 2004; Gutiérrez, et al., 2018).
Las comunidades ícticas son un componente importante de estos ecosistemas, pues gran parte del flujo energético proveniente de la producción primaria pasa a través de los peces hacia depredadores de orden superior (Lacambra & Pinilla, 2004; Hernández, 2009). Además, pueden servir de indicadoras de la degradación del hábitat, el estado ecológico y la productividad del ecosistema (Fischer, 2007; Daufresne, et al., 2015; Poveda, et al., 2018). Para una mejor comprensión de su papel es necesario conocer cómo varía su abundancia y distribución a nivel espacial y temporal, así como su relación con la funcionalidad y estabilidad de los ecosistemas (Chase, 2003; Loreau, et al., 2001; López-Delgado, et al., 2019).
La mayoría de los estudios sobre las comunidades ícticas en el departamento de Casanare se ha centrado en la elaboración de inventarios y en la estimación de su riqueza y diversidad en las sabanas inundables adyacentes a ríos como Cravo-Sur (Villa-Navarro, et al., 2011), Pauto (Maldonado, et al., 2013) y Casanare (Zamudio, et al., 2017). Estas sabanas, no obstante, constituyen un complejo sistema de humedales (Lasso, et al., 2014) sujeto a la conectividad lateral y, por lo tanto, se ha encontrado que sus comunidades ícticas se estructuran según los diferentes tipos de humedales (Villa-Navarro, et al., 2015).
En este contexto se planteó la hipótesis de que los caños del sistema río-planicie de inundación albergaban una mayor diversidad de especies que los esteros del sistema periférico inundable debido a las características propias de cada tipo de humedal. Se propuso, entonces, determinar la estructura de los ensamblajes ícticos en los humedales, caños del sistema río-planicie de inundación y en los esteros del sistema periférico de las sabanas inundables del río Ariporo.
Materiales y métodos
Area de estudio
El complejo de humedales de los municipios de Paz de Ariporo y Hato Corozal en el departamento de Casanare cubre 20.766,53 ha (Osorio-Peláez, et al., 2015) y se encuentra en las sabanas inundables del río Ariporo, caracterizadas por tener una geoforma cóncava pronunciada en tierras que soportan inundaciones prolongadas, con ríos divagantes y amplias llanuras de desborde (Sanabria-Ochoa, et al., 2006). En estas sabanas se ubican dos grandes sistemas con diferentes tipos de humedales: a) el sistema río-planicie de inundación, que se caracteriza por la presencia de ríos y caños, y b) el sistema periférico inundable, conformado principalmente por esteros, cañadas y lagunas. Esta clasificación responde a criterios fisiográficos, geomorfológicos, altitudinales, hidrológicos y geoquímicos (Lasso, et al., 2014).
Muestreo
El muestreo se llevó a cabo durante el descenso de aguas, del 24 de noviembre al 3 de diciembre de 2014, y en aguas bajas, del 17 al 22 de febrero de 2015, y se abarcaron siete tipos de humedales: ríos, caños, cañadas, esteros, madreviejas, lagunas de inundación y jagüeyes. Los peces se recolectaron en diez arrastres cubriendo tanto las orillas como la zona central de cada cuerpo de agua con redes de 10 m x 1.5 m y ojo de malla de 2 mm (Villa-Navarro, et al., 2015).
Los ejemplares recolectados fueron anestesiados con eugenol y se fijaron en una solución de formol al 10 % para su determinación taxonómica; se ingresaron a la Colección de Zoología de la Universidad del Tolima, sección de ictiología (CZUT-IC) y a la Colección de Peces de Agua Dulce del Instituto de Investigación de Recursos Biológicos Alexander von Humboldt (IAvH-P) (Villa-Navarro, et al., 2015). Las especies se revisaron con el listado de especies para Colombia (DoNascimiento, et al., 2017) y sus recientes actualizaciones (DoNascimiento, et al., 2020) (Tabla 1S,https://www.raccefyn.co/index.php/raccefyn/article/view/1305/3097).
Análisis de los datos
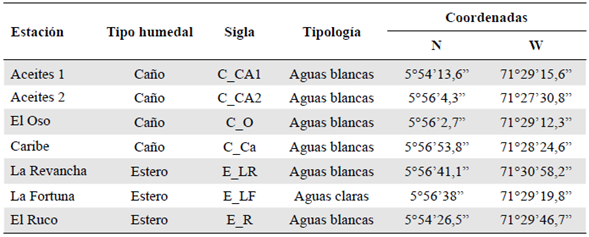
En los análisis estadísticos se tuvieron en cuenta solo dos tipos de humedales: caños, con cuatro estaciones, y esteros, con tres estaciones (Tabla 1,Figura 1), ya que los demás tipos no contaban con el número de estaciones suficiente para su comparación.
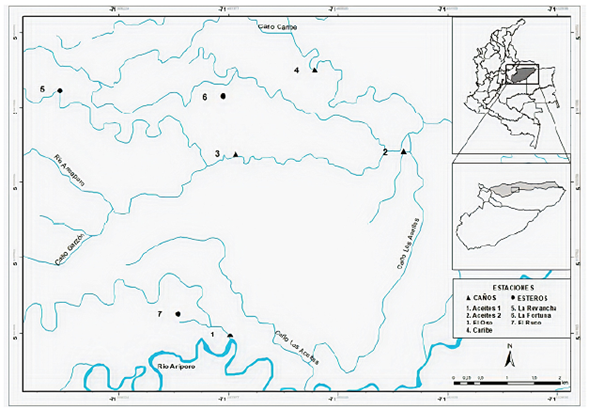
Figura 1 Estaciones de muestreo en los humedales, caños y esteros de la sabana inundable del río Ariporo
Tabla 1 Estaciones de muestreo en los humedales, caños y esteros de la sabana inundable del río Ariporo
La abundancia relativa se calculó a partir del número de individuos de cada especie y su relación con el número total de registrados. Para determinar si existían diferencias significativas entre los tipos de humedales en cuanto a su abundancia y su relación espacial y temporal se hizo un análisis de varianza (ANOVA) no paramétrica (prueba U de Mann-Whitney, p<0,05) con el programa estadístico R, versión 3.2.5 (R Development Core Team, 2016).
La diversidad se calculó utilizando el número efectivo de especies, o números de Hill (Hill, 1973), que están dados por los ordenes q0, q1 y q2, los cuales son equivalente a la riqueza de especies (S), exponencial de Shannon (eH') y el inverso de Simpson (1-D), respectivamente. (Moreno, et al., 2011). Asimismo, se calcularon las curvas de rarefacción, interpolación y extrapolación para comparar y evaluar muestras de diferentes tamaños con base en la estimación de la cobertura y el tamaño de la muestra (Chao, et al., 2014) utilizando el programa estadístico R, versión 3.2.5, y las librerías vegan e iNEXT (R Development Core Team, 2016).
La estructura del ensamblaje en los dos tipos de humedales se determinó con los modelos de serie geométrica, logarítmica y vara quebrada de MacArthur (Ferreira & Petrere, 2008; Magurran, 2004), los cuales evalúan la distribución de las abundancias de cada una de las especies en cada ensamblaje. No se empleó el modelo log normal debido a que requiere un gran número de datos (Magurran, 2004). Para establecer cuál de ellos explicaba mejor la distribución de los datos, se empleó la prueba de bondad de ajuste de Kolmogorov-Smirnov (Magurran, 2004).
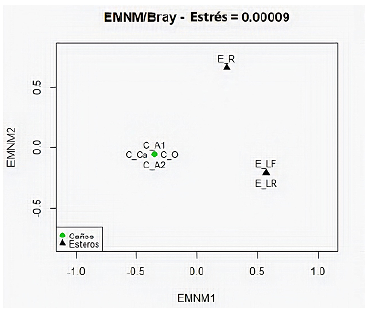
Para determinar si los ensamblajes ícticos se agrupaban según los tipos de humedales, se hizo un análisis de escalamiento no métrico multidimensional (ENMM) utilizando el índice de similitud de Bray-Curtis. Asimismo, para establecer si había diferencias significativas en la composición de especies y sus abundancias, se hizo el análisis global de permutaciones y múltiple ANOVA (PERMANOVA) (Anderson, 2005) empleando la librería vegan del programa estadístico R, versión 3.2.5 (R Development Core Team, 2016).
Las especies indicadoras se determinaron con el método IndVal propuesto por Dufrene & Legendre (1997), el cual se basa en la abundancia de las especies en cada hábitat (fidelidad) y las veces que estas se encuentran en los diferentes hábitats evaluados (especificidad), a partir de lo cual se calcula el índice IndVal por especie para cada hábitat y se evalúa su significación estadística. Este índice permitió identificar especies como indicadoras ecológicas potenciales en los tipos de humedales evaluados (McGeoch, et al., 2002). El análisis se hizo con el programa estadístico R, versión 3.2.5 y la librería lavdsv (R Development Core Team, 2016).
Resultados
Abundancia y distribución
El ANOVA de U de Mann-Whitney no evidenció diferencias significativas (p=0,5653) a nivel temporal; sin embargo, durante la temporada de aguas bajas a nivel espacial se observaron diferencias estadísticamente significativas (p=0,05) (Tabla 2S,https://www.raccefyn.co/index.php/raccefyn/article/view/1305/3097).
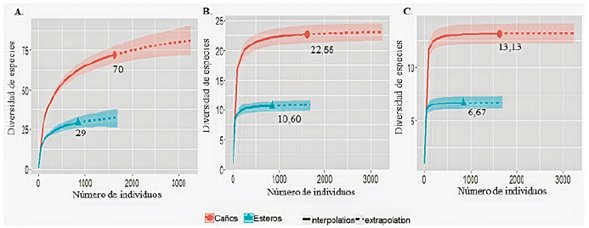
En los caños el ensamblaje íctico estuvo representado por 70 especies distribuidas en 22 familias y cuatro órdenes, en tanto que en los esteros se hallaron 29 especies distribuidas en 10 familias y cuatro órdenes. Tanto en caños como en esteros los characiformes fueron los más abundantes (87,25 y 94,56 %, respectivamente), mientras que los siluriformes fueron el segundo orden más abundante en caños (10,96), aunque en esteros su abundancia fue menor al 1 %.
A nivel de familias, tanto en caños como en esteros, el orden Characidae tuvo la mayor representatividad (68,41 y 59,81 %, respectivamente), en tanto que el Gasteropelecidae (6,03 %) fue el segundo más abundante en caños y el Lebiasinidae (15,1 %) en esteros.
En cuanto a las especies, Odontostilbe pulchra (16,50 %) y Odontostilbe splendida (13,67 %) fueron las más abundantes en caños, y Odontostilbe splendida (30,50 %) y Pirrhulina lugubris (15,01 %) las dos más abundantes en esteros.
Las curvas de rarefacción, con una tendencia a la asíntota (Figura 1S,https://www.raccefyn.co/index.php/raccefyn/article/view/1305/3097), así como la cobertura de la muestra (0,99) (Figura 2S,https://www.raccefyn.co/index.php/raccefyn/article/view/1305/3097), indicaron que el muestreo fue representativo de las comunidades reales evaluadas en los dos tipos de humedales.
El mayor número efectivo de especies, así como su riqueza (q0) y su diversidad basada en las especies comunes (q1) y abundantes (q2), se registró en los caños (Figura 2). Los intervalos de confianza de las curvas de interpolación y extrapolación, al no estar solapadas, mostraron que había diferencias significativas, lo cual indicaría que los esteros albergan cerca de la mitad de la diversidad observada en los caños.
Estructura y composición
El análisis EMNM (stress=0,00009) reveló la conformación de dos ensamblajes ícticos de acuerdo a los dos tipos de humedal (Figura 3), entre los cuales se evidenciaron diferencias significativas según el PERMANOVA (p=0,028) (Tabla 3S,https://www.raccefyn.co/index.php/raccefyn/article/view/1305/3097).
Diversidad
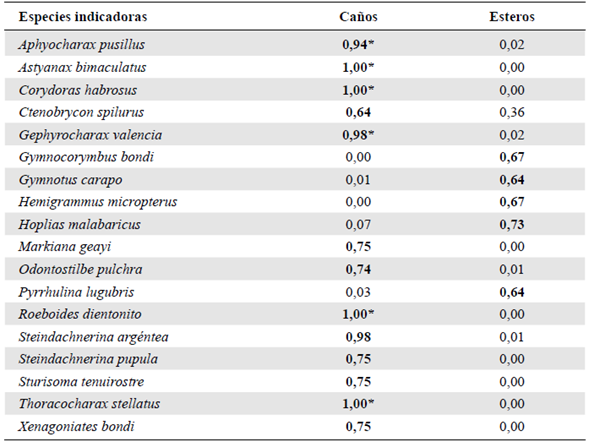
Con el método IndVal fue posible identificar 13 especies indicadoras en los caños, de las cuales seis obtuvieron un alto índice IndVal, estadísticamente significativo para este tipo de humedal: Aphyocharax alburnus, Astyanax bimaculatus, Corydoras habrosus, Gephyrocharax valencia, Roeboides dientonito y Thoracocharax stellatus (Tabla 2). En contraste, los esteros no presentaron especies indicadoras asociadas significativamente a ellos, sin embargo, cinco especies mostraron altos valores en el índice IndVal (Tabla 2).
Tabla 2 Especies indicadores (IndVal) de los humedales, caños y esteros de la sabana inundable del río Ariporo. Las especies con valores resaltados en negrilla (IndVal>0,6) se consideran indicadoras. (*): estadísticamente significativos (p<0,05)
Los ensamblajes en caños y en esteros se ajustaron al modelo de serie logarítmica (D72=0,0704 y D29=0,0859; p>0,05) (Tabla 4S,https://www.raccefyn.co/index.php/raccefyn/article/view/1305/????), modelo que explica más adecuadamente aquellas comunidades ricas en especies que se caracterizan por una elevada proporción de especies raras y pocas abundantes (Magurran, 2004).
Discusión
Las sabanas inundables de la cuenca del río Orinoco presentan una hiperestacionalidad hidrométrica, con cuatro estaciones: aguas altas, descenso de aguas, aguas bajas y ascenso de aguas, lo que genera cambios graduales en la conectividad lateral de los humedales y en sus comunidades (Lasso, et al., 2014; Osorio-Peláez & Lasso, 2015). Sin embargo, en las comunidades ícticas de los humedales analizados no se detectaron cambios a nivel temporal, lo cual puede ser un efecto del muestreo e indicar que las variaciones entre el descenso de aguas y las aguas bajas son leves y, por lo tanto, que las condiciones ambientales serían similares. Por el contrario, los cambios observados a nivel espacial estarían relacionados con el aislamiento temporal a que se ven sometidos los esteros en periodos de aguas bajas (Trujillo, et al., 2014).
Asimismo, la mayor diversidad observada en los caños puede estar relacionada con su complejidad y heterogeneidad, lo que permitiría mayor empaquetamiento de especies y segregación de nicho (Tonn & Magnuson, 1982; Petry, et al., 2003). Como estos humedales se interconectan con otros cuerpos de agua (ríos, cañadas, esteros, lagunas, entre otros), optimizan condiciones como la disponibilidad de nutrientes y recursos en los distintos hábitats (Lasso, et al., 2014; Villa-Navarro, et al., 2015). La heterogeneidad espacial en los humedales también se ha considerado como uno de los principales promotores del mantenimiento de una alta riqueza y diversidad de especies, ya que permite la oferta de diferentes tipos de hábitat (Jackson, et al., 2001; Arrington & Winemiller, 2006).
Es importante resaltar que los esteros pueden ser, además, efímeros e inestables, ya que dependen de las fluctuaciones hidrométricas, lo que condiciona su diversidad a la conectividad lateral con ecosistemas lóticos adyacentes (Lasso, et al., 1999; Trujillo, et al., 2014). Esta inestabilidad sugiere que sus especies deberían migrar o dispersarse durante la temporada de descenso de aguas para obtener recursos alimenticios y disponer de áreas de reproducción y refugio para evitar la depredación (Peres-Neto, 2004; Mercado, et al., 2015; Villa-Navarro, et al., 2015).
Ahora bien, la conformación de los ensamblajes observada en estos humedales puede estar asociada a las características intrínsecas de cada humedal: en los caños, a la disponibilidad de una mayor variedad de hábitats (remansos y rápidos), de diferentes tipos de sustratos (guijarro, arena, lodo, hojarasca y troncos) y de vegetación riparia densa y condiciones ambientales idóneas (temperatura y oxígeno disuelto) (Lasso, et al., 2014; Villa-Navarro, et al., 2015). La gran variedad de hábitats que ofrece este tipo de humedal explicaría el elevado número de especies indicadoras, como Sturisoma tenuirostre y C. habrosus, que se caracterizan por ser exclusivamente bentónicas (Delariva & Agostinho, 2001), así como G. valencia, A. bimaculatus, T. stellatus y R. dientonito, las cuales tienen la capacidad de explotar una alta variedad de hábitats (Winemiller, et al., 2008).
A diferencia de los esteros, su ensamblaje podría estar determinado por su carácter léntico, con fondos lodosos, presencia de macrófitas flotantes y enraizadas y baja cobertura de la vegetación riparia, lo que favorece temperaturas más altas y condiciones de hipoxia (Trujillo, et al., 2014; Villa-Navarro, et al., 2015). Tales condiciones ambientales usualmente propician ensamblajes de poca diversidad íctica, dominados por especies nectónicas y oportunistas (Gymnocorymbus bondi, P. lugubris, Steindachneri guentheri y Hoplias malabaricus) (Prieto, 2000; Sarmiento, 2000; Sarmiento, et al., 2014).
Estos resultados parecen coincidir con los de algunos estudios sobre las áreas inundables de los ríos tropicales en los que se ha reportado que la estructura de los ensamblajes ícticos puede verse influenciada por factores ambientales como la disponibilidad y la complejidad de los hábitats (Arrington & Winemiller, 2006; Carvalho & Tejerina-Garro, 2015; Montoya, et al., 2019), la transparencia y profundidad (Tejerina-Garro, et al., 1998) y el oxígeno disuelto (Petry, et al., 2003).
Por otra parte, al estar sujetos a las variaciones hidrométricas generadas por los pulsos de inundación (Junk, et al., 1989; Arrington, et al., 2005), los humedales de las sabanas inundables pueden contener ensamblajes de especies predominantemente pioneras (Lowe-McConnell, 1999), las cuales se caracterizan por tener una alimentación facultativa, alta fecundidad y tasas de crecimiento poblacional rápido, tamaño corporal pequeño y capacidad de dispersarse luego de una perturbación (Winemiller & Rose, 1992; Echevarría & Gonzáles, 2017), y explicaría, por lo menos en parte, el predominio de unas pocas especies abundantes en los ensamblajes, tales como O. splendida, O. pulcra y G. valencia en caños, y S. guentheri, O. splendida y P. lugubris en esteros.
Nuestros resultados, además, podrían tener implicaciones importantes para la conservación de estos ecosistemas al evidenciar que la estructura del ensamblaje íctico de cada tipo de humedal difiere, y que su diversidad está sujeta tanto a la heterogeneidad ecosisté-mica como a la conectividad lateral de los distintos tipos de humedales, aspectos claves para la formulación de estrategias de conservación.
Conclusión
La variación espacial de estas comunidades parece obedecer a las características de los dos sistemas de inundación de las sabanas inundables: los caños del sistema río-planicie de inundación, con un ensamblaje más complejo conformado por especies que necesitan condiciones y hábitats muy diversos, lo cual sugiere una segregación de especies debida a la heterogeneidad ambiental, y los esteros del sistema periférico inundable que albergan ensamblajes menos estructurados dominados por aquellas especies capaces de establecerse en ambientes inestables y con recursos limitados.