El dióxido de carbono en la evolución de la Tierra
Se estima que tanto el carbono como el agua llegaron a la Tierra durante su formación en planetesimales que la impactaron constantemente (Hayes & Waldbauer, 2006; Kasting & Ackerman, 1987). La atmósfera primitiva de la Tierra fue reductora durante los primeros 2.000 millones de años (Rasool & McGovern, 1966; Tang & Chen, 2013). Los modelos más aceptados indican que inicialmente la atmósfera contenía principalmente H2, CO2, H2O, NH3, CH4, H, y O (Trigo-Rodríguez, et al., 2013). El hidrógeno era el principal componente, pero durante los primeros 1.000 millones de años escapó al espacio, quedando CO2, H2O, N2, NH3 y CH4 en la atmósfera. Bajo estas condiciones, la temperatura de la atmósfera fue controlada por el efecto invernadero del NH3, el CH4, la H2O y el CO2. Buena parte del CO2 pasó a formar carbonatos y silicatos y a disolverse en el mar, con lo cual bajó significativamente su concentración. La acumulación de CO2 en el mar fue muy importante, debido a que hace unos 3.500 millones de años la Tierra tenía casi el doble del agua en los mares y la masa continental era solamente de 3 a 5 % de la que tenemos hoy (Johnson & Wing, 2020). Con este proceso se iniciaron también las reacciones de fotosíntesis que generan O2 (Sagan & Mullen, 1972). Simultáneamente, empezó a darse la fotodisociación del NH3 para formar aminoácidos en fase acuosa, dando lugar a la formación de los componentes orgánicos del origen de la vida en los mares primitivos. Las reacciones de fotosíntesis condujeron a la aparición de O2 en la atmósfera de forma extremadamente lenta; transcurrieron unos 1.000 millones de años desde que empezaron a darse las reacciones de fotosíntesis hasta la aparición de O2 en la atmósfera con una concentración de ~ 0,02 % (Shih, et al., 2016). Cuando este oxígeno salió a la atmósfera reaccionó con el amoníaco y metano atmosféricos, reduciendo grandemente el efecto invernadero de estos dos gases y estableciendo las condiciones para una glaciación muy importante de la Tierra. Esta etapa se identifica geológicamente como el periodo de la "Gran oxidación", a partir del cual empezó a darse la transición irreversible para la Tierra de un ambiente reductor a un ambiente oxidante. Desde entonces, en la segunda mitad de la existencia de la Tierra, el ciclo del CO2 ha sido el factor regulador de las condiciones de efecto invernadero. La glaciación que indujo la transición de atmósfera reductora a atmósfera oxidante ocurrió en el periodo conocido como Hurónico, hace unos 2.200 millones de años, durante el cual toda la Tierra quedó cubierta por una capa de hielo que se conoce como "bola de nieve" y que pudo durar hasta unos 300 millones de años. Algunos investigadores estiman que la temperatura llegó hasta los -50 oC, en tanto que otros plantean que la glaciación no fue global sino parcial (Sagan & Mullen, 1972) para poder explicar que los primeros indicios de vida en ese entonces sobrevivieran a estas condiciones tan drásticas.
Los ciclos en los que interviene el CO2 son extremadamente complejos, ya que involucran procesos que pueden durar desde algunos minutos hasta varios millones de años (Berner, 2003). La variación periódica en la concentración del CO2 atmosférico se considera el factor más importante tanto en el inicio como en la terminación de las glaciaciones. Entre 500 y 900 millones de años atrás la Tierra sufrió varias glaciaciones globales conocidas como tierra-bola de nieve.
En periodos más recientes, las condiciones paleoclimáticas de la Tierra han sido estudiadas con simulaciones que toman en consideración las variaciones climáticas, el albedo, la circulación de los océanos y la topografía continental. De esta manera se calculó la concentración del CO2 atmosférico durante el periodo Carbonífero y comienzos del periodo Permiano. El resultado que se observa en la figura 1 (Feulner, 2017) indica que los niveles de CO2 estuvieron entre 300 y 700 ppm durante todo el periodo Carbonífero. Es importante observar que al final de este periodo hubo un descenso drástico en la concentración de CO2 que, según el modelo utilizado, llegó a valores tan bajos como las 37 ppm. Este evento estuvo acompañado de las fluctuaciones orbitales y la reducción de ~3 % de la luminosidad del sol, llevando a la Tierra a la mayor glaciación del tipo "bola de nieve" de los últimos 500 millones de años (Montañez, et al., 2016), posiblemente similar a la descrita en el periodo Hurónico.
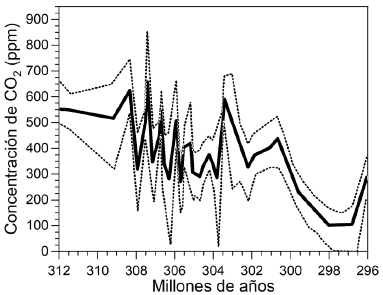
Figura 1 Simulación de la concentración de CO2 atmosférico en la segunda mitad del periodo Carbonífero (hace 359 a 299 millones de años) y comienzos del pérmico (hace 299 a 252 millones de años). Cada 1 a 2 millones de años se presentaron grandes cambios en la concentración del CO2 atmosférico, dando lugar a enfriamientos parciales de la Tierra antes de presentarse la gran glaciación a finales del Carbonífero y principios del pérmico. Figura adaptada de Feulner (2017)
Además de la información sobre la concentración del CO2 en el período geológico observado en la figura 1, se han hecho investigaciones para evaluar la concentración de O2 en la atmósfera. La evidencia sugiere que la concentración de este gas ha fluctuado relativamente poco en los últimos 600 millones de años, con excepción de un periodo hace 250 a 350 millones, cuando la concentración de O2 atmosférico pudo llegar a valores elevados, 35 a 40 %; este punto máximo ocurrió hace 300 millones de años y se cree que se debió a la evolución de las grandes plantas vasculares en la parte final del Carbonífero. El crecimiento de una vegetación exuberante dio como resultado la producción de grandes cantidades de biomasa rica en lignina resistente a la descomposición por el tipo de bacterias que existían en ese ambiente; por ello se acumuló en pantanos y lechos marinos dando lugar a las extensas formaciones de carbón (Feulner, 2017) que hoy tenemos en diferentes lugares de Europa, Asia y Norteamérica.
Por otro lado, la concentración de CO2 en la atmósfera en los últimos 800.000 años se ha evaluado analizando el aire atrapado en el hielo de los polos en muestras tomadas hasta a 3.200 m de profundidad en la Antártida (Lüthi, et al., 2008). Las muestras se analizaron por espectroscopia láser de absorción, determinación isotópica y cromatografía de gases; los datos que se muestran en la figura 2 son el promedio de 4 a 6 muestras tomadas en diferentes perforaciones. Como se ilustra en esta figura, la concentración de CO2 en la atmósfera terrestre ha sido cíclica, similar a lo observado hace 300 millones de años. El CO2 varió entre 172 ppm hace 667.000 años y 300 ppm hace 340.000 años; en este periodo la Tierra tuvo ocho ciclos de glaciaciones parciales.
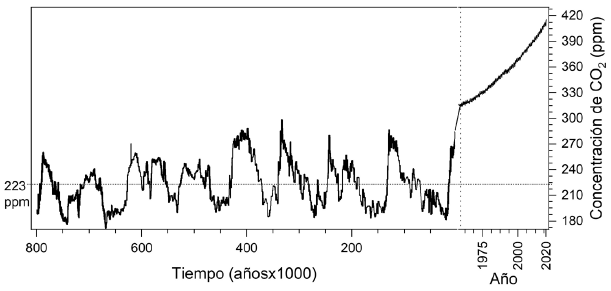
Figura 2 En la parte izquierda se encuentra la variación de la concentración de CO2 atmosférico en los últimos 800.000 años determinada experimentalmente en muestras de hielo antártico. Obsérvese que en todo este tiempo la concentración no supera las 300 ppm de CO2, y cada mínimo en la curva corresponde a una glaciación parcial de la Tierra. En la parte derecha se presenta la concentración de CO2 en los últimos 70 años y se ve que el valor en mayo de 2020 fue de 417 ppm de CO2, casi el doble del promedio en los últimos 800.000 años. Figura adaptada de Lüthi, et al., 2008 y la National Oceanic and Atmospheric Administration - NOAA, 2020
En la parte derecha de la figura 2 se presenta la concentración del CO2 atmosférico de los últimos 70 años obtenida de los datos de una estación atmosférica para el monitoreo de gases en la tropósfera que puedan inducir cambios en el clima terrestre. El observatorio está localizado en el volcán de Mauna Loa en Hawai, en un sitio remoto que no se ve afectado directamente por las grandes fuentes contaminantes. Regularmente se analizan el CO2, el CH4, el SO2, el N2O, el CO y el O3, los CFC, aerosoles y parámetros de radiación solar (NOAA, 2020). La figura 2 ilustra un aumento vertiginoso en la concentración de CO2 atmosférico en décadas recientes, casi el doble del promedio (223 ppm) registrado en los últimos 800.000 años, valor que es muy superior a los propios del desarrollo natural de la evolución geológica de la Tierra. En julio del 2020 se registró una concentración de 417 ppm de CO2, y es claro que este aumento tan alto corresponde al CO2 antropogénico originado por el uso intensivo de combustibles fósiles (carbón, petróleo y gas natural), principalmente por los países más desarrollados (Inglaterra, Alemania, Estados Unidos, Japón, Corea y, actualmente, China e India). Hoy se liberan anualmente a la atmósfera alrededor de 40.000.000.000 toneladas de CO2 (Babacan, et al., 2020; Intergovernmental Panel on Climate Change - IPCC, 2019). De esta cantidad, el 25 a 30 % es absorbido por los océanos (Fuss, et al., 2014) y un 8 a 30 % por la vegetación existente y la meteorización de minerales. El resto del CO2 se acumula en la atmósfera causando el efecto invernadero, que se traduce en un aumento continuo de la temperatura promedio de la Tierra. Se estima que en la atmósfera hay 3x1012 toneladas de CO2, y en los océanos unas 45 veces la cantidad equivalente de carbono (Renforth & Henderson, 2017). El tiempo de permanencia del carbono inorgánico disuelto en el mar es alrededor de 100.000 años; sin embargo, este tiempo puede variar con los cambios en la alcalinidad. Para limitar el calentamiento global a 1.5 °C se requiere que las emisiones de CO2 estén entre 25.000 y 30.000 millones de toneladas para el 2030 (Babacan, et al., 2020) , con cero emisiones a partir del 2050. En un informe publicado en el 2019 por el Fondo Monetario Internacional (FMI, 2019) se estimó que los daños causados al ambiente por los principales países consumidores de combustibles fósiles pueden estar alrededor de los dos trillones de dólares.
Ciclos del carbono
En la figura 3 se ilustran los grandes macro-ciclos en los que participa el carbono. El carbono se encuentra en el océano, las rocas, los sedimentos, el manto, el núcleo, los organismos vivos y la atmósfera. Cada uno de estos sitios tiene su propio ciclo de transformación, que involucra procesos de alta complejidad química y física evaluados con diferentes modelos. El principal mecanismo de rotación del carbono en cada uno de los ciclos es a través del CO2 (Galvez, et al, 2020; Hartmann, et al., 2013; Renforth & Henderson, 2017), lo que permite la transformación de carbono inorgánico a carbono orgánico, y que dio origen a la vida en la Tierra.
Todos los ciclos que se presentan en la figura 3 son de muy larga duración debido a que tienen una cinética muy lenta, por lo que algunos de ellos duran millones de años. A continuación se presentan las principales reacciones del CO2 en el ciclo orgánico e inorgánico.
Ciclo orgánico del carbono
De las reacciones esquematizadas en la figura 3, la fotosíntesis es una etapa fundamental para la incorporación del carbono en materiales orgánicos. A través del proceso de la fotosíntesis, el CO2 facilita la formación de las estructuras químicas necesarias para la evolución de los seres vivos, provee oxígeno, alimentos y la energía para el sostenimiento de la vida. Esquemáticamente la reacción neta de fotosíntesis se puede representar como:
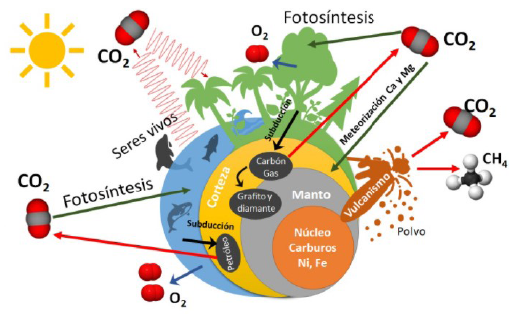

Figura 3 Representación esquemática de los principales macro-ciclos de transformación del carbono en la Tierra. El carbono tiene dos orígenes: uno está asociado al CO, el CO2 y el CH4 durante su formación, y el otro es el carbono que llegó por el bombardeo de planetesimales durante la primera etapa de formación de la Tierra. El principal mecanismo de interacción con los ecosistemas terrestres es a través del CO2 en el proceso de fotosíntesis, que transforma el carbono inorgánico en carbono orgánico dando lugar a un proceso espontáneo de almacenamiento de energía solar. Los diamantes se forman en la interfase entre el manto y la corteza. Se estima que la mayor cantidad de carbono en la Tierra está en el núcleo, en forma de carburos de Ni y de Fe.
Sin embargo, la reacción no tiene lugar por interacción directa de las moléculas de CO2 y de H2O como se presenta en la Reacción 1, sino que constituye una reacción de altísima complejidad química que se puede dividir en dos etapas: la primera consistente en la fijación del carbono y la segunda en su transformación en glucosa.
En la fijación del CO2 hay una enzima conocida como la rubisco (ribulosa-1,5 bifosfato carboxilaza/oxigenasa). Es la enzima más abundante en la Tierra (Gómez-Fernández, et al., 2018), que fue determinante en el origen de la vida al permitir la transformación del carbono inorgánico en carbono orgánico (Shih, et al., 2016). La reacción de conversión del CO2 se ha venido dando desde hace más de 4.000 millones de años, cuando la atmósfera era aún predominantemente reductora (Trigo-Rodríguez, et al., 2013). La enzima rubisco ha evolucionado a través del tiempo, dando origen a la rubisco 1B en las plantas superiores, algas y la mayoría de las cianobacterias, y a la rubisco 1A en las protobacterias y las cianobacterias marinas. Ambas enzimas existieron en ambientes que tenían muy altas concentraciones de CO2, unas 1.000 veces superiores a la actual. Una característica muy particular de esta enzima es que discrimina entre 13C y 12C. Selectivamente procesa más 12C, lo cual ha sido de gran importancia para identificar rutas metabólicas en la biosfera primitiva, ya que la materia orgánica que pasó por el proceso de fotosíntesis tiene cerca de 20 % menos 13C que el existente en la atmósfera (Berner, 2003). Paradójicamente, el sitio activo de la enzima rubisco no diferencia entre una molécula de CO2 y una de O2, ya que tiene la capacidad de procesarlas en una secuencia catalítica análoga para ambas reacciones (Kannappan & Gready, 2008). Este comportamiento se ha explicado por las similitudes en el potencial electrostático del O2 y del CO2. El mecanismo es de una reacción ácido-base en multietapas, donde la descomposición del CO2 es asistida por una molécula de agua que facilita el acceso del CO2 al sitio activo. La química de estas reacciones se sigue investigando tanto experimental como computacionalmente (Kannappan & Gready, 2008). Las principales reacciones se presentan en el esquema de la figura 4. La actividad catalítica de la rubisco se activa por la luz solar e inicia el proceso de incorporación de una molécula de CO2 en la estructura de la molécula de ribulosa 1,5 bifosfato (RuBP), un proceso de varias etapas, ilustradas en la figura 4, que conducen a la formación de dos moléculas del ácido 3-fosfoglicérico (PGA), las cuales posteriormente forman fosfatos de fructosa y glucosa. Esta secuencia de reacciones fue descrita en 1954 en una serie de investigaciones con un muy elegante tratamiento experimental usando 14CO2 y cromatografía de papel para la caracterización de los productos (Bassham, et al., 1954). Los experimentos realizados en tiempos de reacción muy cortos les permitieron a estos autores plantear la existencia de una enzima que cataliza la reacción de carboxilación (Quayle, et al., 1954). Por estas investigaciones sobre asimilación del CO2 en las plantas, Calvin fue galardonado con el Premio Nobel de Química en 1961.
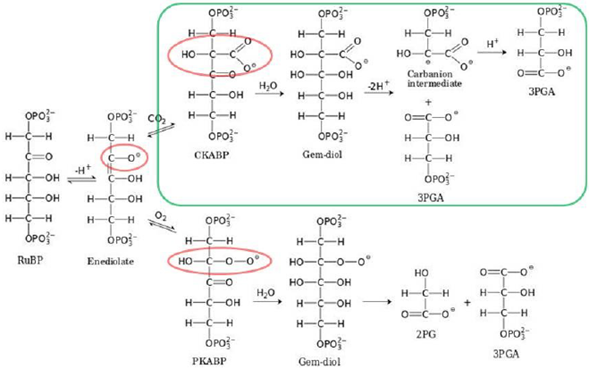
Figura 4 Esquema simplificado de las reacciones químicas acido-base que tienen lugar en el sitio activo, el cual puede reaccionar con una molécula de CO2 o con una molécula de O2, ambas catalizadas por la enzima rubisco, y en los dos casos asistidas por una molécula de agua. Cada paso que aquí se ilustra consiste de muchas reacciones elementales. Cuando llega una molécula de O2 al sitio activo (parte inferior de la figura) el proceso pierde hasta un 50 % de eficiencia. Figura adaptada de Kannappan & Gready, 2008.
Cuando una molécula de O2 llega al sitio activo de la enzima rubisco, esta la procesa y la incorpora en una molécula RuBP en el sitio donde se produce la reacción con el CO2 (Figura 4). Sin embargo, el mecanismo químico posteriormente conduce a la formación de una molécula de PGA y una molécula de 2-fosfoglicolato (PG), la cual es tóxica, ya que inhibe varias de las enzimas requeridas para el procesamiento del CO2 (Erb & Zarzycki, 2018; Kannappan & Gready, 2008; Parry, et al., 2006). Lo paradójico de este proceso es que ambas reacciones tienen lugar en el mismo sitio activo (Figura 4), donde los intermediarios están coordinados en un complejo Mg2+. En el caso de la reacción con oxígeno, la planta pierde hasta un 50 % de eficiencia de la actividad catalítica.
Por otro lado, es verdaderamente asombroso el diseño que la naturaleza ha logrado con la enzima rubisco, la cual tiene una altísima capacidad para "atrapar" moléculas de CO2 que se encuentran extremadamente diluidas (~0,041 % en la atmósfera) entre las moléculas de O2 (~20 %) y las moléculas de N2 (~80 %). Para que una molécula de CO2 llegue al sitio activo que está ubicado en las hojas de la planta, primero debe pasar por un poro (estoma) en la epidermis de la hoja, formado por dos células que cambian de forma para controlar la entrada y salida de gases. El poro puede tener entre 600 y 3.000 nanómetros (nm) mientras que la molécula de CO2 tiene un diámetro cinético de 0,33 nm, y la molécula de O2 un diámetro de 0,34 nm; es decir, se puede suponer que, entrópicamente, en esos poros hay una distribución estadística de moléculas similar a la del aire. En época de sequía el poro se cierra para evitar pérdida de agua en la planta, pero al mismo tiempo restringe la entrada del CO2, que es su fuente de carbono, y, por lo tanto, se reduce el crecimiento del organismo.
La fotosíntesis es una reacción que ha evolucionado durante miles de millones de años (Hayes & Waldbauer, 2006; Shih, et al., 2016). Se espera entonces que termodinámica-mente se encuentre en las mejores condiciones energéticas, tanto de configuraciones geométricas, sitios activos, intermediarios, rangos de temperatura y rangos de concentración de reactivos. Sin embargo, se considera que es una reacción muy lenta, ya que procesa solo entre 1 y 10 moléculas de CO2 por segundo (Erb & Zarzycki, 2018). A este mecanismo hay que adicionarle que, como se mencionó anteriormente, el O2 interfiere con la reacción de asimilación del CO2; por esta razón se adelantan muchas investigaciones (Erb & Zarzycki, 2018; Kannappan & Gready, 2008; Parry, et al., 2006) para tratar de mejorar la eficiencia de la reacción y, de esta manera, buscar que las plantaciones sean más productivas. Se han logrado algunos avances trasladando la enzima rubisco de unas plantas a otras, pero en lo fundamental, la reacción sigue siendo la misma (Parry, et al., 2006), y los aumentos en la productividad no han sido los deseados.
Durante muchos años se consideró que la única ruta de transformación de carbono inorgánico a carbono orgánico era la indicada por el ciclo de Calvin, tanto en zonas continentales como en el mar. Sin embargo, investigaciones recientes han permitido elucidar al menos cinco mecanismos adicionales para estas reacciones autotróficas, las cuales tienen importancia para las reacciones de asimilación del CO2 en el mar. De todas maneras, las reacciones indicadas en el ciclo de Calvin son las más importantes para la conversión del carbono inorgánico a carbono orgánico (Hügler & Sievert, 2011; Kono, et al., 2017).
Una vez la molécula de CO2 es incorporada en una estructura orgánica, el proceso químico puede seguir diferentes rutas según sea el ambiente en el que se encuentra, acuático o terrestre, como se ilustra en la figura 3. En la segunda parte de esta revisión de la literatura se presentará la ruta que conduce a la formación del carbón en la Tierra.
Ciclo inorgánico del carbono
Entre los macro-ciclos del carbono en la Tierra está la ruta de reacciones del CO2 presente en la atmósfera, que conducen a su atrapamiento en compuestos inorgánicos en presencia o en ausencia de agua. Las reacciones inorgánicas en la eliminación del CO2 atmosférico son: a) la interacción alcalina con los océanos y b) la meteorización de carbonatos y silicatos. En el caso de las reacciones en medio acuoso, el CO2 presente en la atmósfera puede reaccionar con el agua de los océanos para formar un ácido débil (ácido carbónico): CO2 + H2O -» H2CO3, que se disocia para formar el ion bicarbonato (HCO3 -) y el ion carbonato (CO3 2-). La proporción de esta disociación depende de la alcalinidad de la solución, entre más alta sea esta, mayor será el grado de disociación del ácido carbónico y, por lo tanto, aumenta la cantidad de carbono que se puede retener en los océanos. Se ha encontrado que el equilibrio CO2-H2O en los primeros 100 m por debajo del nivel del mar puede tardar alrededor de un año, en tanto que el equilibrio CO2-H2O a grandes profundidades puede tardar cientos de años (Kheshgi, 1995). Dado que el océano tiene alta alcalinidad y un alto volumen de agua, la cantidad de carbono que se puede retener en los océanos es la equivalente a 1,4x1014 toneladas de CO2 (Renforth & Henderson, 2017).
Hipotéticamente, si solo se utilizara este procedimiento para reducir la cantidad de CO2 atmosférico, sería necesario incrementar la alcalinidad de los océanos. Esto se puede lograr por adición de Na2CO3, que se disuelve fácilmente en agua, pero este compuesto no es muy abundante en la Tierra. El CaCO3, por otro lado, sí existe en buenas cantidades, pero para que sea soluble se necesita tratarlo térmicamente y convertirlo en CaO, con un alto consumo de energía y liberación de CO2. Se estima que en los océanos hay alrededor de 1,5x1019 mol de Ca (Kheshgi, 1995). Si se quisiera absorber todo el CO2 producido en un año (~ 4,0x1010 toneladas), se requerirían cerca de 1x1015 mol de Ca, lo que cambiaría la concentración de Ca en los océanos en aproximadamente 0,01 %. Teóricamente, el mar podría ser el sistema que ayude a la humanidad a reducir significativamente la cantidad de CO2 en la atmósfera, teniendo en cuenta que el tiempo de permanencia del carbono inorgánico disuelto en el mar es alrededor de 100.000 años (Renforth & Henderson, 2017). Actualmente los océanos absorben de 30 a 40 % del carbono producido por el hombre. Si no se hace absolutamente nada, las simulaciones indican que el mar podría reducir el nivel de CO2 en la atmósfera a valores existentes en la era preindustrial en unos 200.000 años (Renforth & Henderson, 2017).
En cuanto a la meteorización de minerales naturales y antropogénicos, estas son reacciones a través de las cuales se puede remover el CO2 atmosférico en grandes cantidades. Las transformaciones químicas de los silicatos y carbonatos contenidos en las rocas están íntimamente relacionadas con el clima y el ambiente terrestre a través de los ciclos biogeoquímicos de estos minerales. Dichos mecanismos han sido factores determinantes del clima terrestre durante miles de millones de años (Hartmann, et al., 2013). En general, los silicatos se producen por reacciones a altas temperaturas y tienen la característica de ser inestables en presencia de agua en la superficie de la Tierra, degradándose en una serie de reacciones conocidas como meteorización química.
Las siguientes son algunas de las reacciones del CO2 con minerales naturales y antropogénicos:
Magnesita: MgCO3 (s)+ CO2 (g)+ H2O (l) →Mg2+ (sln)+ 2HCO3 - (sln)
Calcita: CaCO3 (s)+ CO2 (g)+ H2O (l) →Ca2+ (sln)+ 2HCO3 - (sln)
Dolomita: CaMg (CO3)2 (s)+2CO2 (g)+2H2O(l) →Ca2+ (sln)+Mg2+ (sln)+ 4HCO3 - (sln)
Fosterita: MgSiO4 (s)+ 4CO2 (g)+ 4H2O (l) →2Mg2+ (sln) + H4SiO4 (sln) + 4HCO3 - (sln)
Anortita: CaAl2Si2O8 (s)+ 2CO2 (g)+ 3H2O (l) →Ca2+ (sln)+ Al2Si2(OH)4 (sln)+ 2HCO3 - (sln)
Lima: CaO (s) + 2CO2 (g)+ H2O (l) →Ca2+ (sln)+ 2HCO3 - (sln)
Portlandita: Ca(OH)2 (s)+ 2CO2 (g)+ H2O (l) →Ca2+ (sln)+ 2HCO3 - (sln)
Periclasa: MgO (s)+ 2CO2 (g)+ H2O(l) Mg2+ (sln) + 2HCO3 - (sln)
Brucita: Mg(OH)2 (s)+ 2CO2 (g)+ H2O (l) →Mg2+ (sln)+ 2HCO3 - (sln)
Las primeras investigaciones sobre la reacción del CO2 con minerales fueron realizadas por el químico francés Jacques Josep Ebelmen en 1845, quien en su momento planteó que los cambios en la concentración de CO2 atmosférico podrían inducir variaciones en la temperatura de la superficie de la Tierra (Hartmann, et al., 2013). Los iones alcalinos y alcalinotérreos (Ca2+, Mg2+, Na+, K+) que se producen en las reacciones de meteorización son transportados por los ríos al océano, aumentando su alcalinidad. En los océanos, a lo largo de periodos geológicos de tiempo se precipitan como minerales o se intercambian con otros elementos en los basaltos submarinos. Además, la meteorización trae asociada la liberación de elementos químicos que son nutrientes para las plantas cuando están a nivel de trazas, por ejemplo: P, Fe, Ni, Cr, Cd, etc.
La principal dificultad para utilizar la meteorización de minerales para retener el CO2 es que la cinética de estas reacciones es muy lenta; para mejorar este aspecto se han propuesto varias estrategias como la reducción del tamaño de las partículas minerales, cambios del pH, y variaciones en la temperatura y la presión. A pesar de estas limitaciones, recientemente se ha propuesto la remoción de CO2 atmosférico a gran escala usando la meteorización de minerales. Estas propuestas usan principalmente los basaltos, rocas abundantes en la superficie de la Tierra, ricas en silicatos de Fe y Mg. Se ha planteado un mega-proyecto de varias décadas con proyección al 2050 para capturar hasta 2.000 millones de toneladas de CO2 por año (Beerling, et al., 2020), nivel de captura de CO2 que se requiere para mantener el aumento de la temperatura dentro de los rangos propuestos en el Acuerdo de París. Es indudable que este tipo de tratamientos tan voluminosos y agresivos tienen impactos ambientales en las zonas de aplicación. Por ejemplo, las variaciones en el pH de la Tierra, los ríos y el mar tienen consecuencias desconocidas. Hasta donde se pudo establecer, no hay estudios del uso de este tipo de control del CO2 en grandes espacios y por largos periodos de tiempo. La aplicación de dicho proceso es extremadamente costosa: los datos obtenidos por simulaciones indican que el costo por tonelada de CO2 absorbido puede variar entre 80 y 180 dólares dependiendo de la región donde se realice en proceso. El modelo ha sido propuesto para su implementación en los Estados Unidos, India, China, Brasil y algunos países europeos.
Formación del carbón
Como se ilustra en la figura 3, parte del carbono inorgánico que se transforma en carbono orgánico a través de la fotosíntesis conduce a la formación de vegetación terrestre, tan importante en la evolución del clima. Geológicamente, la vegetación más exuberante sobre la Tierra se presentó en un lapso de aproximadamente 60 millones de años, en el periodo conocido como Carbonífero (359-299 millones de años atrás). Durante el Carbonífero la vegetación creció en zonas pantanosas donde, al morir los árboles, se descomponían en un ambiente acuoso con limitada concentración de oxígeno; asimismo, las bacterias existentes en este periodo no eran muy eficientes para oxidar la lignina, a pesar de tener concentraciones de O2 hasta del 40 % (Figura 5). El crecimiento y muerte de la vegetación se repitió durante innumerables ciclos a lo largo de millones de años dando lugar a la sedimentación de la materia orgánica. En esta etapa ocurrieron principalmente dos eventos: uno bioquímico o diagenético, en el que el material vegetal se descompuso por acción de hongos y bacterias en las condiciones anaerobias de pantanos y humedales, produciendo un material conocido como turba. Esta acumulación de material condujo a la subsidencia del suelo dando lugar a que la materia orgánica fuera desplazada cada vez a mayores profundidades, donde cada 100 m de profundidad la temperatura aumenta 3 a 5 oC. El segundo evento en la formación del carbón es el geoquímico, que ocurre a temperaturas moderadas (usualmente menores de 100 oC), muy altas presiones que pueden llegar a miles de atmósferas, y tiempos de reacción de millones de años en un ambiente libre de oxígeno. Durante este periodo tuvieron lugar un gran número de reacciones químicas que transformaron lentamente la materia vegetal en un producto con alta concentración de carbono y cantidades variables de oxígeno, hidrógeno, nitrógeno y azufre, producto que hoy conocemos como "carbón". Este es un nombre genérico que se usa para identificar un material con una composición química que depende de las condiciones en las cuales se formó. Además, durante el periodo de sedimentación el material vegetal recibió gran cantidad de componentes inorgánicos arrastrados por las aguas o el viento y, por esta razón, el carbón es un sólido que tiene una mezcla muy variada de componentes orgánicos e inorgánicos, lo que lo convierte en un material altamente heterogéneo que contiene la energía solar almacenada por fotosíntesis durante millones de años en enlaces carbono-carbono, carbono-hidrógeno, carbono-oxígeno, carbono-nitrógeno y carbono-azufre, principalmente. En este proceso enormes cantidades de CO2 fueron consumidas por la exuberante vegetación que creció durante esta época. Al mismo tiempo la atmósfera terrestre tuvo las más altas concentraciones de oxígeno de toda la existencia de la Tierra, llegando a valores tan altos como 40 % (Figura 5). Según la información obtenida por simulaciones del clima en el Carbonífero, la concentración de CO2 bajó de aproximadamente 700 ppm a valores inferiores a 100 ppm, dando lugar a una glaciación importante de la Tierra al final del periodo Carbonífero (Feulner, 2017) (Figura 1). Si se mantuvieran los parámetros solares y terrestres constantes, las simulaciones indican que para una concentración de CO2 de 100 ppm la temperatura de la superficie de la Tierra fluctuaría entre -1,5 y +0,5 oC. Al periodo Carbonífero le siguió el periodo Permiano, una época durante la cual la mayoría de la fauna y la flora terrestres desapareció de la superficie de la Tierra.
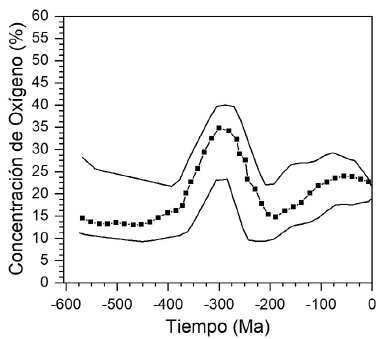
Figura 5 Variación en la concentración atmosférica de O2 en los últimos 600 millones de años estimada a partir de las proporciones de 13C/12C y 32S/34S en experimentos de laboratorio y en análisis de sedimentos. El máximo en la concentración de O2 atmosférico, hasta un 40%, coincide con la mayor abundancia de vegetación en la Tierra durante el periodo Carbonífero como producto de la reacción de fotosíntesis (Reacción 1). Obsérvese que la concentración de O2 ha tenido una tendencia a permanecer más o menos estable por millones de años fluctuando alrededor de un 20 % de O Figura adaptada de la publicación de Berner (2000).
Es importante tener presente que cuando se inicia el Carbonífero toda la masa continental estaba agrupada en un supercontinente concentrado en el hemisferio sur de la Tierra, el cual empieza a separarse por movimientos tectónicos para dar lugar a los continentes que hoy conocemos. Por esta razón, mucho del carbón formado durante el periodo Carbonífero se encuentra diseminado en los diferentes continentes, el 90 % concentrado en seis países: USA, Rusia, China, India, Australia y Sur África (van Krevelen, 1993) Sin embargo, no todo el carbón que se conoce en la Tierra se formó en el Carbonífero. Hoy encontramos formaciones carboníferas de hace más de 500 millones años, como las reservas de Shungite en Rusia, con concentraciones de carbono superiores al 95 % (van Krevelen, 1993). Carbones de formación reciente como los colombianos, tienen menos de 100 millones de años; por ejemplo, los carbones de Boyacá se formaron hace unos 70 millones de años, los de Cerrejón hace unos 60 millones de años y los de Antioquia hace unos 30 millones de años (Suescún-Gomez, 1978).
Como ya se mencionó, las mayores transformaciones químicas del material vegetal tuvieron lugar durante la etapa geoquímica, en un ambiente reductor libre de oxígeno. Las principales reacciones fueron la pérdida de grupos polares del tipo -OH y -COOH en forma de agua y CO2, lo cual hizo que el material pasara de ser hidrofílico a hidrofóbico. En esta etapa también hubo evolución del metano, que, en muchos casos, quedó atrapado en el lecho del carbón. Entre más altas sean las temperaturas (cercanía a volcanes o grandes profundidades) del área donde se formó el carbón, y entre mayor sea el tiempo de reacción a esas condiciones, mayor es el grado de pérdida de grupos hidroxilos, carboxilos y metilos, y, por lo tanto, el contenido de carbono aumenta su concentración en el carbón, de manera que hoy se encuentran carbones que tienen desde un 50 hasta un 95 % de carbono.
Desde el punto de vista químico, en los carbones con bajos contenidos de carbono las estructuras predominantes son monoaromáticas y nafténicas, altamente sustituidas y entrelazadas en una estructura de tipo polímero. A medida que aumenta el contenido de carbono se forman unidades con 2, 3, 4 y más anillos aromáticos, heteroaromáticos, hidroaromáticos y nafténicos. Ejemplos de este tipo de estructuras son el benceno, el naftaleno, el fenantreno, el fluoreno, la antraquinona, el dibenzofurano, el benzotiofeno, el dibenzotiofeno, la piridina, la quinolina, y el carbazol, entre otros (Figura 6) (Berkowitz, 1985).
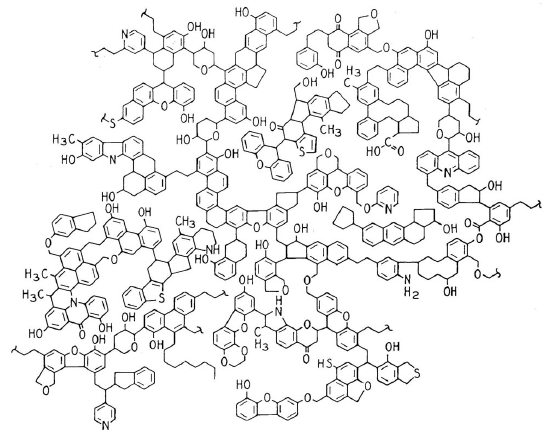
Figura 6 Esquema en dos dimensiones que ilustra el tipo de estructuras químicas promedio que se encuentran en un carbón. La cantidad de estructuras aromáticas, heteroaromáticas, hidroaromáticas y alifáticas en un carbón determinado dependen del grado de metamorfismo de la materia vegetal. Dada la alta complejidad del material, para la representación de las moléculas que hay en un carbón es necesario hacer análisis por resonancia magnética nuclear (13C, 1H, 18O) en estado sólido y en líquidos de los extractos solubles en solventes, así como espectroscopia infrarroja con transformadas de Fourier, espectroscopia de fluorescencia, espectroscopia ultravioleta, difracción de rayos-X, espectrometría de masas, peso molecular promedio, análisis elemental (C, H, N, S, O), y reacciones de oxidación, hidrogenación y solubilización en solventes. Los de bajo grado de carbonificación son predominantemente monoaromáticos, y al aumentar el contenido de carbono aumentan los anillos aromáticos y heteroaromáticos. Figura adaptada de Shinn (1984)
Todas las estructuras aromáticas e hidroaromáticas están unidas entre sí por grupos éter, metilenicos, carbonilo, puentes de azufre, o enlaces C-C entre las unidades aromáticas formando una red macromolecular en tres dimensiones (Figura 6). Este tipo de estructuras hipotéticas ha sido de gran utilidad para entender los procesos en los cuales se utiliza el carbón.
Usos del carbón
El carbón tiene muchos usos entre los cuales están la generación de electricidad, la producción de hierro en altos hornos, de aluminio, cemento, papel, productos químicos y farmacéuticos, amoníaco, hidrógeno, fertilizantes agrícolas, solventes, plásticos, carburos metálicos, carbones activos, fibras de carbono, nanotubos de carbono, grafeno, supercapacitores, enmiendas húmicas, diésel, gasolinas, etc. De todas estas aplicaciones, los combustibles fósiles han sido mayoritariamente utilizados como fuente energética. En el caso de la energía primaria, el consumo mundial reportado en el 2019 muestra la siguiente distribución: petróleo 33 %, carbón 27 %, gas natural 24 %, hidroeléctrica 6 %, renovables 5 %, y nuclear 4 %. Esto indica que el 84 % de la energía que consume la humanidad es fósil; se estima que para el 2050 los combustibles fósiles continuarán aportando el 70 % de la energía (Höök, et al., 2010). Asimismo, hay proyecciones que indican que los combustibles fósiles alcanzarán su máximo uso en el 2025, y ese valor se sostendrá por unos 50 años, para luego disminuir lentamente hasta el año 2200 (Mohr, et al, 2015). Esto evidencia la enorme dependencia de la humanidad de estos recursos, con un porcentaje muy importante de la canasta energética mundial representado por el carbón, con la consecuente producción de CO2 y otros gases de efecto invernadero. Esta proyección de la balanza energética puede cambiar cuando se haga uso intensivo de energías sostenibles y se acceda al uso masivo del hidrógeno, especialmente con la fusión nuclear.
Como ya se mencionó, el carbón se forma a muy altas presiones en un ambiente reductor. En el momento en que este material se extrae de la mina sufre un cambio drástico en presión y queda expuesto a un ambiente oxidante, lo que induce grandes cambios tanto morfológicos como químicos que afectan su reactividad y, por lo tanto, sus usos. La oxidación del carbón no solo causa reducción del poder calorífico, sino pérdida de la solubilidad en solventes, la capacidad coquizante, la transferencia de hidrógeno y, en muchos casos, la oxidación con el oxígeno del aire conduce a la autocombustión (García, et al., 1999; López, et al., 1998).
Dependiendo del uso que se le dé al carbón, hay dos aproximaciones conceptualmente diferentes:
a. La destrucción completa de la estructura química, lo que se hace con dos propósitos, uno, para recuperar la energía de los enlaces C-C en la reacción de combustión con O2, en la que los productos finales son el calor, el CO2 y H2O. El otro es la reacción del carbón con H2O o CO2, llamada reacción de gasificación, donde los principales productos finales son H2 y CO, los cuales se utilizan para combustión o como materia prima para otros procesos como las reacciones de Fischer-Tropsch (Pérez, et al., 2019), para la producción de combustibles o productos químicos y el H2 para uso en celdas de combustible.
Tanto la combustión como la gasificación del carbón son procesos que se desarrollaron empíricamente hace más de 100 años, y, por lo tanto, no se tenía información de los mecanismos a nivel molecular de las reacciones elementales de adsorción y desorción de productos, de las geometrías termodinámicamente estables, la naturaleza de sitios activos, los estados de transición, y las migraciones de las especies superficiales, entre otros. Todo esto es importante para buscar la optimización de procesos que contribuyan a reducir el impacto ambiental causado por el uso de los combustibles fósiles. Con el desarrollo de equipos con gran capacidad de cómputo y programas basados en la mecánica cuántica, ha sido posible analizar problemas de alta complejidad química, como los de las reacciones de combustión, gasificación, licuefacción y pirólisis del carbón. Por ejemplo, utilizando los métodos más actualizados, se analizaron en detalle las reacciones de gasificación de materiales carbonosos con O2, CO2, H2 y H2O. Por primera vez se elucidó el mecanismo de desorción de una molécula de CO a partir de especies carbonilo. Asimismo, para buscar una simplificación en el tiempo de cómputo se desarrolló una aproximación con modelos multicapa que facilitara el uso de altos niveles de teoria en los sitios activos y átomos vecinos en las estructuras químicas donde ocurren las reacciones de combustión y gasificación (Espinal, et al., 2009; Montoya, et al., 2002; Montoya, et al., 2001).
b. La otra forma de utilizar el carbón es tratar de conservar las estructuras químicas antes mencionadas por medio de reacciones selectivas que rompan los enlaces más débiles que se muestran en la figura 6 con la utilización de hidrógeno molecular a alta presión o hidrógeno naciente generado in situ, catalizadores y solventes apropiados (Mondragon, et al., 1984; Mondragon, et al., 1982) para despolimerizar las macromoléculas en el carbón. Estas reacciones se utilizan para producir combustibles, solventes, productos químicos, etc. También se pueden aprovechar las estructuras químicas en el carbón para inducir reacciones controladas de condensación y producir carbones activos de diferente porosidad: grafito, electrodos, supercapacitores, nanotubos de carbono, grafeno, etc.
Impacto ambiental del uso intensivo de los combustibles fósiles
Utilizar la energía almacenada en los recursos fósiles impacta el medio ambiente en toda la cadena de los procesos, desde su recuperación en la mina o yacimiento, su transporte y procesamiento hasta uso final. En cada una de estas etapas se generan residuos de naturaleza específica que deben ser tratados adecuadamente. Son muchos y muy variados los contaminantes que afectan el suelo, el agua y el aire. En el caso de las emisiones gaseosas tenemos la producción de CO2, CO, SOx, NOx, H2S, CH4, y el material particulado, entre otros.
De todos estos gases el CO2 es el mayor causante de impactos ambientales por los enormes volúmenes en los que se produce y por sus propiedades físicas de irradiar la frecuencia infrarroja de nuevo hacia la Tierra induciendo el calentamiento de los océanos y del aire cercano a la superficie terrestre. Hoy se estima que la temperatura promedio de la Tierra ha aumentado de 1,0 a 1,1 oC con respecto a la temperatura en la era preindustrial, es decir, el periodo entre 1850 y 1900. En el Acuerdo de Paris del 2015 las Naciones Unidas piden a todos los países adelantar actividades para que el aumento de la temperatura de la Tierra se mantenga 2 oC por debajo de la temperatura de la era preindustrial y que, en lo posible, ese aumento sea inferior a 1,5 oC, recomendaciones planteadas sin poner fechas límites para su cumplimiento (United Nations Framework Convention on Climate Change - UNFCCC, 2015). Posteriormente, en el 2019, las Naciones Unidas publicaron un informe del Panel sobre el Cambio Climático donde determinaron fechas para el cumplimiento de ciertas metas (IPCC, 2019), las cuales se presentan más adelante. La expansión térmica de los océanos es una de las consecuencias indirectas más serias del CO2, ya que aumenta el nivel del mar, el cual se ha venido elevando a una velocidad de 3 mm/año desde 1993 (Vermeersen, et al., 2018). Hay modelos que predicen para el año 2100 aumentos que van desde 20 hasta 160 cm, según sea el control de las emisiones; las consecuencias serán bastante serias y afectarán a millones de personas en todo el mundo. El otro efecto indirecto son los cambios en el clima que tienen como consecuencia sequías, lluvias torrenciales, inundaciones e intensas olas de calor mortíferas y que generan continuos incendios forestales. Entre los efectos directos del CO2 está el impacto en ecosistemas marinos debido a la acidificación de los mares, perjudicando el crecimiento de corales y el proceso de fotosíntesis. Hay otro efecto directo que apenas se empieza a evaluar, que es el relacionado con la reducción de capacidades cognitivas de las personas al estar expuestas a concentraciones de CO2 de alrededor de 700 ppm (Karnauskas, et al., 2020). Estos niveles se alcanzan fácilmente en espacios cerrados, como salones de clase, restaurantes, submarinos, aviones, etc; se estima que si no hay mitigación de las emisiones de CO2, para el año 2100 las capacidades cognitivas de la humanidad podrían verse reducidas en un 20 % (Karnauskas, et al., 2020).
Dada la magnitud de la contaminación atmosférica con CO2, no hay un procedimiento que por sí solo pueda mitigarla. El Panel de la Naciones Unidas plantea cinco acciones (IPCC, 2019): a) uso de bioenergía (biomasa de segunda generación y residuos forestales) con captura y almacenamiento de CO2; b) aforestación y reforestación intensiva; c) secuestro de carbono usando biochar; d) fertilización de los océanos, y e) captura del CO2 del aire y almacenamiento del mismo. En el informe se plantea que, para cumplir con la meta de 1,5 oC en el año 2030, se debe reducir la emisión de CO2 a unas 30.000.000.000 toneladas por año. Para el 2050 se deben tener cero emisiones netas de CO2 a la atmósfera junto con reducciones drásticas de las emisiones de CH4, y a partir del 2050 y hasta el 2100 las emisiones deben ser negativas. Sin embargo, a pesar de los grandes esfuerzos que hoy se hacen en todo el mundo, ninguna de las cinco acciones antes mencionadas se encuentra en desarrollo a gran escala, lo cual hace pensar que será muy difícil lograr el objetivo propuesto por las Naciones Unidas.
Se espera que la bioenergía en procesos de gasificación y combustión sea la opción más importante para reducir el CO2, ya que puede utilizarse para generar electricidad, combustibles líquidos, compuestos químicos (reacciones de Fischer-Tropsch), biogás, y para producir hidrógeno. A pesar de que las tecnologías de combustión y gasificación de biomasa son ampliamente conocidas requieren ajustes y posiblemente un cambio conceptual de estos procesos para la recuperación eficiente del CO2. Otro aspecto que es fundamental en la bioenergía es la necesidad de enormes extensiones de tierra para producir la biomasa requerida de cultivos, que para el año 2050 podría ser de 7.000.000 km2 (un área similar a la de Estados Unidos), con el consecuente impacto sobre el suelo, las aguas y las emisiones gaseosas de N2O (IPCC, 2019). La decisión sobre la bioenergía dependerá de un análisis económico consistente con el costo a largo plazo que va a implicar el cambio climático. Se estima que las inversiones globales para el suministro de energía baja en carbono pueden llegar a cuatro trillones de dólares hasta el 2050.
A las opciones ya planteadas debe añadirse la eficiencia energética y la optimización de los procesos actuales como los únicos métodos que pueden contribuir a reducir las emisiones de CO2 en un lapso de 4 a 5 años (Babacan, et al., 2020). Para optimizar los procesos de transformación de los recursos fósiles y así disminuir las emisiones de CO2 es necesario conocer en detalle su química. En este sentido se vienen investigando diferentes reacciones a nivel experimental y computacional: por ejemplo, cómo se genera una molécula de CO2 en las reacciones de combustión y gasificación (Orrego, et al., 2009; Radovic, 2009; Sánchez & Mondragón, 2007). Asimismo, se exploran alternativas para usar el CO2 como reactivo en la gasificación de la biomasa y el carbón (Molina & Mondragón, 1998), y el coque de petróleo y el reformado de metano con diferentes tipos de catalizadores, como las perovskitas o hidrotalcitas, para producir gas de síntesis y posteriormente elaborar productos químicos mediante el proceso de Fisher Tropsch (Daza, et al., 2008; Gallego, et al., 2009; Gallego, et al., 2006). Utilizando técnicas analíticas avanzadas se estudia la química involucrada en la formación de material particulado y las opciones para reducir su emisión a la atmósfera (Salamanca, et al., 2012; Santamaria, et al., 2010). La mayor parte de estas investigaciones están en la fase de prueba de concepto y la implementación de las tecnologías que de ellos se deriven y muestren ser promisorias requiere de la experimentación en plantas piloto, lo que puede tomar varios años.
Conclusiones
La investigación científica ha permitido entender a partir de la geología, la química, la biología y la física los procesos que han tenido lugar en la Tierra desde su formación hasta nuestros días. Por ejemplo, entender cómo en periodos geológicos el CO2 almacenó energía solar por la ruta fotosintética basada en la enzima rubisco que hoy recuperamos mediante procesos de combustión y gasificación. La utilización de los recursos fósiles en un periodo de tiempo muy corto (100 a 200 años) está rápidamente retornando a la atmósfera todo el CO2 almacenado mediante reacciones que ocurrieron en periodos geológicos sin permitir que se establezcan los equilibrios naturales, lo que tiene serias consecuencias por la enorme acumulación de CO2 en la atmósfera, por ejemplo, el aumento de la temperatura promedio de la Tierra con la consecuente alteración de todos los ecosistemas.
Uno de los retos más grandes que tiene la humanidad en este siglo es encontrar formas para descarbonizar los procesos energéticos que utilizamos y así reducir los niveles de CO2 en la atmósfera, lo que requiere grandes cambios en los sistemas sociales, económicos y tecnológicos. Las Naciones Unidas han propuesto metas específicas para el 2030 y el 2050 relacionadas con la descarbonización de la atmósfera. Sin embargo, será extremadamente difícil cumplir dichas metas debido a la enorme cantidad de investigación básica que se requiere y, además, las tecnologías necesarias para lograrlo aún están por desarrollarse. En este análisis hay que incluir el gran impacto positivo que representará la energía nuclear obtenida por la fusión de deuterio y tritio, experimentos que se adelantan en varios países y que se espera que empiecen a generar energía eléctrica en unos 20 a 30 años.
Gran parte del cambio climático del que ya estamos siendo testigos se debe a un aumento promedio de solo 1,0 a 1,1 oC en la superficie de la Tierra; si no se toman medidas contundentes para reducir las emisiones de CO2 y otros gases de efecto invernadero, la temperatura seguirá aumentando y tendremos ciclones e inundaciones mucho más frecuentes, aumentará el nivel del mar y habrá sequías, olas de calor, incendios forestales, etc. Seremos testigos de la acidificación de los océanos, de la aparición de enfermedades transmitidas por vectores, y algo que apenas se empieza a evaluar, es decir, la reducción de las capacidades cognitivas de los humanos.
Las opciones que tendrían un efecto más rápido en la reducción de las emisiones de CO2 son: a) la implementación pronta de políticas para la optimización de la eficiencia energética en todos los procesos antropogénicos; b) la implementación de la bioenergía utilizando biomasa de segunda generación, y c) la aceleración de los procesos de descarbonificación de la atmósfera. No es mucho el tiempo que tenemos para tratar de dejar un planeta con mejores condiciones a las generaciones futuras.














