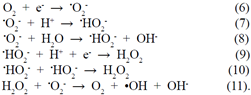Introducción
En la naturaleza se presentan diferentes interfaces: principalmente sólido-sólido, sólido-líquido, sólido-gas y líquido-gas, en las que ocurren toda una serie de procesos fisicoquímicos de gran interés científico y tecnológico. El análisis y estudio de la interface sólido-gas han permitido el desarrollo de campos del conocimiento importantes, de gran interés tecnológico, como es el caso de la catálisis (Suib, 2013) y los sensores de gases (Jaaniso & Tan, 2013). Otras interfaces más específicas, como las de metal-metal, metal-semiconductor, semiconductor-semiconductor y metal-dieléctrico, entre otras, han contribuido al desarrollo de una gran variedad de dispositivos de importancia tecnológica (Rhoderick, 1980; Sze & Ng, 2007). En la actualidad hay gran interés por una interface muy particular denominada nano-biointerface o bio-nanointerface, dependiendo de cómo se la mire, que es la que se genera entre un nanomaterial, o una nanopartícula en particular, y un sistema biológico (Nel, et al., 2009). Esta interface es importante cuando se estudia la interacción de las nanopartículas con los sistemas biológicos en la perspectiva de su potencial aplicación en la medicina (Ciofani, 2018), en la biología (Salata, 2004; De, et al., 2008) y, específicamente, en la agricultura (López-Valdez & Fernández-Luqueño, 2018; Faisal, et al., 2018). En esta biointerface ocurre una serie de interacciones fisicoquímicas dinámicas, así como intercambios cinéticos y termodinámicos, entre la superficie de los nanomateriales y la de los sistemas biológicos, incluidas las proteínas, la membrana celular, la pared celular, los fosfolípidos, las organelas, el ADN y los fluidos biológicos, entre otros. La comprensión e interpretación de las interacciones y los fenómenos que ocurren en esta interface facilitarían la aplicación de la nanotecnología a la biología. Comúnmente, estos estudios consideran que las nanopartículas se encuentran "inmersas" o "suspendidas" en un cultivo o medio biológico y se estudia su interacción con la membrana celular, las organelas o el citoplasma, considerando las fuerzas de interés para la fisicoquímica coloidal, dada la naturaleza de las nanopartículas, y la forma en que se modifican estas interacciones en presencia del sistema biológico (Lyklema, 1993; Ohshima, 2012).
Para entender los fenómenos y procesos que ocurren en la nano-biointerface, se deben tener en cuenta, principalmente, tres factores (Nel, et al., 2009: Pulido-Reyes, et al., 2017): 1) las características de la superficie del nanomaterial; 2) las características del medio donde esté inmerso o suspendido, y 3) las propiedades y el efecto del sistema o sistemas biológicos presentes. Con relación a la superficie del nanomaterial, sus características están determinadas por su composición química, su forma y tamaño, el valor de su superficie específica, su porosidad, los grupos funcionales y ligandos que determinan su naturaleza ácida o básica, así como su hidrofobicidad o su carácter hidrofílico, el tipo de estructura cristalina superficial y sus heterogeneidades y el estado de oxidación de los cationes superficiales, entre otros aspectos (Nel, et al., 2009; Pulido-Reyes, et al., 2017; Verma & Stellaci, 2010; Pulido-Reyes, et al., 2015). El segundo factor que debe considerarse es externo al sólido, pero afecta las características y el comportamiento de las nanopartículas. Las características del medio donde estas se suspenden determinarían su tamaño hidrodinámico, su carga efectiva, la valencia de los cationes superficiales, así como su estado de agregación y su capacidad de disolución (Pulido-Reyes, et al., 2017; Brian, et al., 2011). La interacción del nanomaterial con el medio puede, además, promover la adsorción de iones, proteínas, compuestos orgánicos y surfactantes, así como la formación de una estructura de doble capa a su alrededor, o minimizar su energía libre superficial mediante la reestructuración o "relajación" de la superficie (Nel, et al., 2009; Min, et al., 2008).
Un tercer factor se relaciona con las características del sistema biológico que interactúa con el nanomaterial, las que estarían determinadas por su composición y su capacidad para afectar el entorno (Pulido-Reyes, et al., 2017). El sistema biológico puede contener grandes moléculas orgánicas: proteínas, fosfolípidos, ácidos nucleicos y sacáridos, entre otras. Cuando la nanopartícula interactúa con estas biomoléculas pueden ocurrir tres procesos: 1) la adsorción de las biomoléculas sobre la superficie del nanomaterial; 2) la reconstrucción y alteración de las funciones de las proteínas, y 3) las reacciones redox entre la nanopartícula y las especies reactivas (Tian, et al., 2020). Estas nano biointeracciones no solo pueden afectar las características y funcionalidad de las nanopartículas sino, también, la función biológica celular (Liu, et al., 2013).
La adsorción de las biomoléculas es un proceso crítico cuando el nanomaterial interactúa con el sistema biológico. Considerando específicamente la presencia de proteínas, su adsorción se ve favorecida si la superficie del nanomaterial está cargada y es hidrofóbica. Además, la adsorción de las proteínas por el nanomaterial está determinada por la afinidad del enlace proteína-nanomaterial, así como por las interacciones proteína-proteína, las cuales llevan a la conformación de un ensamble entre el nanomaterial y las proteínas adsorbidas denominado "corona nanomaterial-proteína" (Rahman, et al., 2013). Esta corona de proteínas es una entidad dinámica en la que las proteínas se adsorben continuamente en la superficie de la nanopartícula; si estas no se adsorben a través de enlaces covalentes, se desorben y son reemplazadas, rápidamente, por otras proteínas (Pulido-Reyes, et al., 2017). Esta corona de proteínas no es espacialmente homogénea (Cai, et al., 2017), ya que presenta una capa interna, denominada "corona dura", muy robusta y estable, constituida por proteínas que se adsorben fuertemente a la superficie de la nanopartícula a través de un mecanismo de naturaleza entrópica. En esta "corona dura", las proteínas prolongan bastante el tiempo de residencia, y tienen un intercambio lento y grandes cambios de configuración. El modelo estructural y composicional de la corona nanopartícula-proteínas (Pulido-Reyes, et al., 2017; Rahman, et al., 2013; Cai, et al., 2017) considera la presencia de otra capa sobre la "corona dura", denominada "corona blanda", constituida por proteínas débilmente ligadas, con baja afinidad entre ellas, y favorecidas termodinámicamente (Goppert & Muller, 2005), que presentan muy pocos cambios de configuración (Pulido-Reyes, et al., 2017; Rahman, et al., 2013). Esta "corona blanda" (externa) es más dinámica, por lo que las proteínas que la conforman presentan un rápido intercambio con las proteínas libres que se encuentran en el medio que rodea el nanomaterial. Es por ello que se considera el mapa proteómico de la corona blanda como la "antena comunicante" entre la nanopartícula y el sistema biológico (Cai, et al., 2017), lo que indica que la cinética de asociación y disociación del sistema nanopartícula-proteínas, así como el intercambio con las proteínas libres en el medio, determinarían la interacción del nanomaterial con el sistema biológico correspondiente. Por lo tanto, para entender la interacción de las biomoléculas con la nanopartícula, es necesario considerar, además del tamaño y la forma de la partícula, la naturaleza fisicoquímica de su superficie: hidrofobicidad, radio de curvatura, carga eléctrica, y tipo de defectos, entre otros aspectos. Además, en la superficie pueden existir grupos funcionales o especies químicas que reflejen la historia previa de las nanopartículas y afectarían la cinética de adsorción de las proteínas (Nel, et al., 2009). Estas especies químicas preexistentes tendrían su origen en el método de síntesis utilizado en la obtención de las nanopartículas, o en su exposición al medio ambiente.
La naturaleza eléctrica de los nanomateriales es una característica que habría que considerar al analizar su interacción con un sistema biológico. Aunque actualmente es de interés estudiar el efecto de las nanopartículas semiconductores en ciertos sistemas biológicos, principalmente su toxicidad (Yan, et al., 2017), esta característica no se ha considerado. Un efecto importante que se generaría a partir de la interacción semiconductor-sistema biológico, es el propiciado por el potencial redox de las especies químicas que conforman dicho sistema y que afectaría la posición del nivel de Fermi del semiconductor, así como los bordes de sus bandas de conducción y de valencia, afectando el comportamiento eléctrico del material. Lo anterior ocasionaría que las bandas de energía del semiconductor se curvaran (Zhang & Yates, 2012), generando la transferencia de carga interface y, por lo tanto, una región de carga espacial cuya extensión dependería de la naturaleza y concentración de las impurezas presentes en la superficie del material (átomos metálicos o especies químicas adsorbidas), así como el tipo de defectos del nanomaterial. Tanto las impurezas como los defectos generan estados localizados en el interior de la brecha de energía del semiconductor, originando niveles cuasi-Fermi que, al alinearse con los orbitales moleculares no llenos de las biomoléculas de la interface, propiciarían reacciones electroquímicas y, por lo tanto, la estimulación celular.
Si se consideran los fenómenos y procesos fisicoquímicos que ocurren en la biointerface semiconductor-membrana celular, estos permitirían justificar, en parte, el efecto de la presencia de nanopartículas de estos semiconductores, entre ellas las del óxido de zinc (ZnO), en los sistemas biológicos. El interés específico de esta revisión es señalar la importancia de ciertos fenómenos fisicoquímicos que pueden ocurrir en la nano-biointerface, con el fin de explicar el efecto antifúngico y nanotóxico de las ZnO-NPs reportado en la literatura científica y que se ilustra a continuación indicando, a la vez, algunos resultados experimentales obtenidos en nuestro laboratorio.
Resultados experimentales que evidencian la capacidad antifúngica y antibacterial de las ZnO-NPs
Las interacciones y los diversos fenómenos fisicoquímicos que ocurren en la bio-interface nanomaterial-membrana celular, así como sus características, permiten explicar y justificar los efectos favorables o tóxicos que se generan al poner en contacto las nanopartículas de un cierto material, por ejemplo un óxido metálico, con un sistema biológico particular. Estos efectos están ampliamente registrados e ilustrados en la literatura científica mediante reportes que presentan los resultados de la evaluación de la toxicidad de las nanopartículas en general, es decir, la nanotoxicidad (Zhao, et al., 2016), y la de las ZnO-NPs en particular (Singh, 2019; Demir, 2020). Existe un gran interés en evaluar la capacidad antifúngica de estas nanopartículas (Alghuthaymi, et al., 2021), así como conocer su efecto antibacterial (Gudkov, et al., 2021; Sirelkhatim, et al., 2015). El interés específico de nuestro grupo de investigación se ha centrado en evaluar la nanotoxicidad de las ZnO-NPs (Medina, et al., 2018) y su efecto en los hongos que afectan los cultivos de café: Cercospora sp. (Patiño-Portela, et al., 2021), Mycena citricolor (Arciniegas-Grijalba, et al., 2019), Collecotrihum sp. (Mosquera-Sánchez, et al., 2020), y Erythrium salmolicolor (Arciniegas-Grijalba, et al., 2017), y en otros más comunes como Aspergillus niger y Botrytis cinerea (Erazo, et al., 2019).
Para ilustrar el efecto de las ZnO-NPs en ciertos sistemas biológicos, se indican a continuación resultados obtenidos recientemente en nuestro laboratorio después de una rigurosa observancia de los protocolos establecidos para realizar los ensayos correspondientes, los cuales se describen detalladamente en los artículos publicados y en los trabajos referenciados. Además, las ZnO-NPs empleadas se sintetizaron en nuestro laboratorio siguiendo rutas químicas, como el método diol (Patiño-Portela, et al., 2021; Arciniegas-Grijalba, et al., 2019; Erazo, et al., 2019), el sol-gel (Arciniegas-Grijalba, et al., 2017), el complejo polimérico de Pechini (Vargas, et al., 2021), o precipitación controlada (Rodríguez-Páez, 2013; Rodríguez-Páez, et al., 2019).
En la figura 1 se muestran las características del crecimiento micelial macroscópico del hongo Omphalia sp. a los 17 días de edad, considerando el testigo (Figura 1a) y una cepa sometida al tratamiento con ZnO-NPs (12) (Figura 1b). Según los resultados, a los 17 días de tratamiento con las ZnO-NPs en la concentración indicada, se observó la inhibición del crecimiento del hongo, efecto evidenciado por cambios morfológicos del área de su crecimiento, así como por el halo de inhibición que se observó en el medio de cultivo (Figura 1b).

Figura 1 Crecimiento micelial macroscópico del hongo Omphalia sp. a los 17 días de edad: (a) testigo y (b) tratado con una concentración de 12 de nanopartículas de ZnO (Agredo-Trochez & Molano-Cabezas, 2020).
En las micrografías obtenidas con microscopia electrónica de transmisión (Figura 2), se observan cortes transversales de muestras representativas de Colletotrichum sp. sin tratamiento (Figura 2a) y con tratamiento con ZnO-NPs (Figura 2b) . En ellos se evidencia el efecto de la presencia de estas nanopartículas en la estructura de la hifa, caracterizada, principalmente, por la gran vacuolización en las muestras tratadas con el nanomaterial (Figura 2b). Por otro lado, en la pared celular se evidencia la acción de las ZnO-NPs: en la muestra de control (Figura 2a) la pared celular fue menos electrodensa que en las hifas que crecieron en presencia de las ZnO-NPs (Figura 2b). Además, en estas últimas se formó una capa de apariencia fibrilar (indicada por la flecha delgada en la figura 2b) bastante electrodensa, lo que podría sugerir la adherencia de las ZnO-NPs a la capa externa de la pared celular (flecha gruesa), o su afectación del entorno de la capa celular. Se requiere un análisis más cuidadoso de esta zona (Figura 2b) para determinar la presencia de las nanopartículas en esta capa fibrilar.
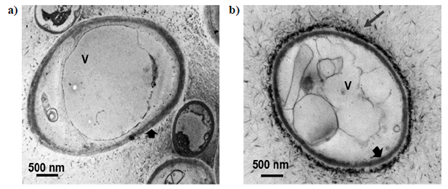
Figura 2 Micrografías electrónicas de corte transversal de Colletotrichum sp. en ausencia (a) y presencia (b) de nanopartículas de óxido de cinc (ZnO-NPs) donde se observa la pared celular (flecha gruesa), la capa fibrilar que rodea la pared celular de la hifa (flecha delgada) y vacuolas (V) (Mosquera Sánchez, 2021).
En el estudio de Agredo-Trochez & Molano-Cabezas (2020) y en el de Mosquera-Sánchez (2021), las ZnO-NPs se sintetizaron utilizando el método diol y se obtuvieron partículas primarias esferoidales entre 20 y 70 nm, con bajo nivel de aglomeración (Mosquera-Sánchez, et al., 2020), no estequiométricas, en las que las vacancias de oxígeno fueron el defecto puntual más importante (Erazo, et al., 2019; Agredo-Trochez & Molano-Cabezas, 2020).
Un resultado similar se obtuvo cuando se trató el hongo Phoma sp. con ZnO-NPs, tal como se observa en la figura 3(Arciniegas-Grijalba & Patiño-Portela, 2015). En ella es evidente un incremento en el número de vacuolas (V), y un aumento de la red fibrilar (Rf) que rodea la pared celular (Pc) de la célula. Para realizar este ensayo se utilizaron ZnO-NPs sintetizadas por el método sol-gel (Arciniegas-Grijalba, et al., 2017; Arciniegas-Grijalba & Patiño-Portela, 2015). Estas nanopartículas presentaron dos morfologías: esferoidal y acicular, aunque observando más cuidadosamente estas últimas, se vio que estaban conformadas por una agregación ordenada de nanopartículas esferoidales. Es decir que, realmente, las partículas primarias tendrían una forma esferoidal y un tamaño entre 20 y 35 nm (Arciniegas-Grijalba, et al., 2017).
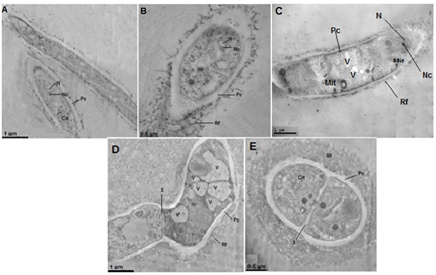
Figura 3 Micrografía electrónica de transmisión de Phoma sp.: (A y B) testigo, (C) sometido al tratamiento con el fungicida (oxicloruro de cobre - Cu2(OH)3Cl), y (D y E) tratado con ZnO-NPs en una concentración 12 mmol.L-1 [núcleo (N), nucléolo (Nc), pared celular (Pc), vacuolas (V) y mitocondrias (Mit)] (Arciniegas-Grijalba & Patiño-Portela, 2015).
También se ha evaluado en nuestro laboratorio el efecto antibacterial de las ZnO-NPs (Benítez-Salazar, 2021). En la figura 4(i) se muestran dos cultivos en agar sangre de una dilución de 10-2 de la bacteria Escherichia coli: sin ningún tratamiento (Figura 4i-a) y tratada con una concentración de 250 (μg/mL de ZnO-NPs (Figura 4i-b). Como se observa en la Figura 4(i), en el cultivo de las bacterias tratadas con nanopartículas (Figura 4i-b) se redujo apreciablemente el número de colonias comparado con las bacterias que no tuvieron ningún tratamiento (Figura 4i-a). Este resultado puso en evidencia la capacidad de inhibición del crecimiento microbiano propiciado por las ZnO-NPs.
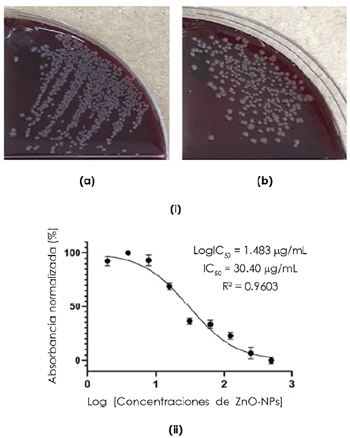
Figura 4 (i) Bacterias E. coli a una dilución de 10-2, (a) sin tratamiento y (b) tratadas con ZnO-NPs [250 μg/mL], así como (ii) la curva utilizada para determinar el valor IC50 de las ZnO-NPs para inhibir el crecimiento de la bacteria E. coli (Benítez-Salazar, 2021).
Los resultados obtenidos en este trabajo (Benítez-Salazar, 2021) mostraron que las ZnO-NPs sintetizadas, en concentraciones altas y medias (entre 500 y 32 (μg/mL), inhibieron el crecimiento de las bacterias E. coli entre un ~70 y ~50 %, respectivamente, con una MIC50 (parámetro que indica la capacidad de una sustancia de inhibir una función biológica o bioquímica específica en un 50%) de 30,40 μg/mL. Para obtener el valor experimental de la MIC50 (Benítez-Salazar, 2021), se recurrió al programa GraphPad Prism. En la figura 4(ii) se pueden visualizar los datos normalizados y el cálculo de la IC50 con su respectivo coeficiente de correlación. El resultado obtenido de MIC50=30,40 μg/mL (Figura 4(ii)) es del mismo orden de magnitud al reportado por Abbasi, et al. (2020) al tratar E. coli con ZnO-NPs obtenidas por síntesis verde (~15,62 μg/mL), pero menor al obtenido por Verma, et al. (2018) cuando sometieron la bacteria a la acción de ZnO-NPs obtenidas por molienda a alta energía (~550 μg/mL después de 15 horas de molienda). Estos resultados reiteran el efecto del método de síntesis empleado en las propiedades y funcionalidad de las nanopartículas obtenidas.
Las ZnO-NPs utilizadas por Benítez-Salazar en su trabajo de grado (2021), se obtuvieron empleando el método del complejo polimérico de Pechini (Vargas, et al., 2021). Estas nanopartículas presentaron una morfología esferoidal, con un tamaño de partícula primaria menor a los 100 nm, las cuales experimentaron una aglomeración especial generando partículas secundarias con forma de barras o láminas, del orden de las micras. Además, en el análisis químico elemental con la microsonda EDS del microscopio de barrido, se encontró que la muestra no era estequiométrica y predominaban zonas ricas en oxígeno, lo que llevo a concluir que en estas ZnO-NPs el defecto más importante era el oxígeno intersticial (Oi).
Discusión
Para explicar y justificar estos resultados sobre el efecto antifúngico y antibacterial de las ZnO-NPs (Agredo-Trochez & Molano-Cabezas, 2020; Mosquera Sánchez, 2021; Arciniegas-Grijalba & Patiño-Portela, 2016; Patiño-Portela, et al., 2021; Arciniegas-Grijalba, et al., 2019; Erazo, et al., 2019; Mosquera-Sánchez, et al., 2020; Benítez-Salazar, 2021), puede aducirse el efecto del tamaño nanométrico de la partícula y el correspondiente alto valor de superficie específica o área superficial, lo que reflejaría el número de sitios activos en los cuales ocurre la producción de especies reactivas de oxígeno ERO (ROS), así como su morfología y composición (Yang, et al., 2009). Pero lo que ha mostrado la experiencia es que, para explicar más precisa y completamente estos efectos, no es suficiente considerar los mecanismos químicos (disolución y disociación del ZnO para generar el ion cinc - Zn2+ y la generación de las ERO (ROS)) y físicos (abrasión, penetración de la membrana y fuerzas) (Sirelkhatim, et al., 2015; Ma, et al., 2013; Sawai, et al., 1996), también es necesario considerar otros fenómenos fisicoquímicos que podrían ocurrir en la bio-interface entre el ZnO y la membrana celular, a los cuales se hará referencia a continuación. Indudablemente, para determinar el papel específico de cada uno de ellos y el grado de importancia que tendrían en la capacidad antifúngica y antibacterial de las nanopartículas en general, y de las ZnO-NPs en particular, es necesario estudiarlos de manera más cuidadosa y sistemática.
Procesos bio-fisicoquímicos regulados por la entropía
La entropía es un concepto importante de la termodinámica (DeHoff, 2006) que ayuda a analizar y explicar fenómenos que involucran tanto la formación estructural como las transiciones estructurales que ocurren en la naturaleza. La entropía permite cuantificar la irreversibilidad de los procesos termodinámicos y una de sus más importantes aplicaciones en los sistemas compuestos constituidos por un gran número de partes elementales, como es el caso de la nano-biointerface, pues suministra información sobre la reacomodación de sus componentes debido a la redistribución espacial de la masa y la energía que ocurriría al interior del sistema. Además, se puede utilizar para analizar la regulación de la estructura del sistema biológico involucrado, su respuesta y su función (Zhu, et al., 2020). Los potenciales efectos entrópicos que podrían ocurrir en esta interface permitirían regular algunas de las propiedades fisicoquímicas en el ordenamiento lipídico, la organización estructural de las proteínas propiciada por la curvatura de la pared celular y el óptimo enlace ligando-receptor, entre otros fenómenos (Zhu, et al., 2020). Cuando una nanopartícula entra en contacto con un sistema biológico, sea un hongo o una bacteria, las interacciones fisicoquímicas en la nano-biointerface podrían conducir al desarrollo de procesos biocatalíticos, a la formación de coronas de proteínas, el enrollamiento o envolvimiento de la nanopartícula por parte de la pared o membrana celular y, en últimas, a una respuesta intracelular del sistema biológico que consideraría a la nanopartícula como un objeto biocompatible o no (Nel, et al., 2009). Cuando una nanopartícula se acopla a un sistema biológico, se pueden generar interacciones complejas que involucran las de naturaleza entálpica y entrópica, las cuales propiciarían en el sistema transiciones de ordenamiento (Xu, et al., 2017). Por ejemplo, cuando se presenta adsorción de las proteínas sobre las nanopartículas, tanto la carga superficial que estas poseen (que daría origen a una interacción entálpica), como la naturaleza hidrofóbica de su superficie (que generaría una interacción entrópica), favorecen su adsorción (Cai, et al., 2017). El potencial general que se produciría en la nano-biointerface, resultado de todas las fuerzas de interacción entre las nanopartículas y la superficie de la membrana, podría ocasionar la ruptura física de esta debido al incremento de la tensión superficial sobre ella (Arakh, et al., 2015).
Al utilizar la entropía para describir la interacción nanopartícula-sistema biológico, se pueden considerar tres tipos de fuente de entropía: 1) la entropía conformacional o configuracional, 2) la entropía traslacional y vibracional, y 3) la entropía de forma (Zhu, et al., 2020; Zhu, et al., 2018). Indudablemente, la más importante es la entropía configuracional, ya que las biomoléculas que conforman el sistema biológico presentan una arquitectura de cadenas largas que puede conducir a diferentes configuraciones (Frederick, et al., 2007). Específicamente en cuanto a las proteínas, y entre estas las proteínas desordenadas (Frederick, et al., 2007; Zeno, et al., 2019), constituyentes importantes de la pared celular de los hongos, por ejemplo (Figura 5), la entropía configuracional contribuiría significativamente a su energía estructural (Frederick, et al., 2007), así como a la energía libre del enlace ligando-receptor (Hu, et al., 2013) y a aquella relacionada con la funcionalidad de la membrana cercana a las proteínas (Zeno, et al., 2019). Además, este tipo de entropía puede afectar las funciones de los lípidos y la organización espacial de las nanopartículas al interior de la membrana (Ren & Ma, 2009).
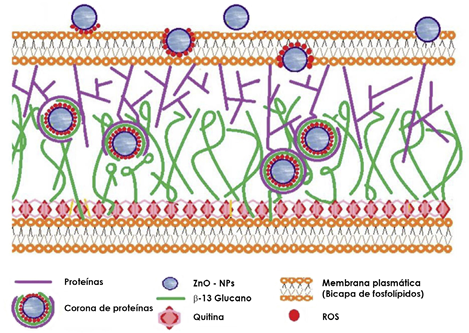
Figura 5 Esquema que ilustra la pared celular de un hongo y describe cualitativamente la interacción de las nanopartículas con las proteínas que esta contiene (adaptada de la referencia Arciniegas-Grijalba, et al., 2019).
Por otro lado, existe la posibilidad de que la membrana celular, por plegamiento de su estructura, introduzca la nanopartícula en su interior (fenómeno denominado endocitosis) (Zhang, et al., 2015), lo que incrementaría la complejidad de las interacciones. Estas pueden variar dependiendo de las condiciones experimentales: naturaleza del sistema biológico (célula, bacteria, hongo, virus, etc.), estados de diferenciación y la composición del medio de cultivo, entre otras. También el método de síntesis utilizado para obtener las nanopartículas es importante (Nel, et al., 2009). Cuando la nanopartícula entra en la membrana celular, esta se recubre de proteínas, lo que propiciaría cambios configuracionales y la formación de la corona de proteínas sobre su superficie (Figura 5). Como ya se indicó previamente, esta corona es una entidad dinámica en la que las proteínas continuamente se adsorben sobre la superficie de la nanopartícula, luego se desorben y son reemplazadas por otras proteínas (Pulido-Reyes, et al., 2017; Rahman, et al., 2013; Cai, et al., 2017). Indudablemente, esta cinética de asociación y disociación entre nanopartículas y proteínas, así como el continuo intercambio con las proteínas libres en el medio, determinaría la interacción de la nanopartícula con la superficie biológica receptora (Nel, et al., 2009).
Para comprender mejor la interacción nanopartícula-sistema biológico es necesario conocer lo que puede suceder en la estructura del biosistema (hongo, bacteria, virus, célula, etc.). El biosistema está constituido, principalmente, por proteínas, fosfolípidos, ácidos nucleicos y polisacáridos (Bowman & Free, 2006). Para ilustrar los efectos entrópicos que pueden ocurrir en esta estructura ante la presencia de las nanopartículas, se considerará la organización de las proteínas sobre una membrana lipídica (Figura 5) (Zhu, et al., 2020; Rahman, et al., 2013). A diferencia de las moléculas lipídicas, las proteínas poseen unas propiedades físicas particulares: forma, rigidez, conformación y heterogeneidades superficiales, propiedades que pueden inducir efectos entrópicos importantes a través de su organización estructural y funcional. Es por ello que las interacciones de tipo entrópico pueden ocasionar el agrupamiento y la localización espacial de las proteínas en la membrana celular, lo que afectaría significativamente sus funciones en diversos procesos biofísicos (Zhu, et al., 2020). Además, la estructura única de las proteínas favorece el desarrollo de efectos entrópicos. Así, las "fluctuaciones de la entropía" en la membrana lipídica regularían las funciones de las proteínas ancladas en ella debido a la alteración de su distancia de enlace y sus ángulos de anclaje, parámetros que determinan su "constante de enlace" y, por lo tanto, su funcionalidad (Zhu, et al., 2020).
El ingreso de las nanopartículas en la membrana celular generaría efectos entrópicos debido al desarrollo de transiciones desorden-orden (Figura 5) que serían compensadas por la capacidad que tiene la membrana de ajustarse a diversas estructuras de patrones de enlace, dada su movilidad estructural para plegarse o aferrarse a la superficie de las nanopartículas, lo que origina una extensa superficie de interacción y, por ende, un aumento de la energía de interacción y favorecería la interacción de las proteínas con la superficie de las nanopartículas (Romashchenko, et al., 2017); su acción provocaría respuestas de la membrana que podrían conducir a la alteración o inactivación del sistema biológico, tal como se ilustra en las figuras 1 a 4 en hongos y bacterias.
Efecto de la naturaleza semiconductora de las ZnO-NPs en el sistema biológico
Los semiconductores inorgánicos, como es el caso del ZnO, pueden propiciar la formación de interfaces funcionales con un sistema biológico, ocasionando, por ejemplo, el ordenamiento o alineamiento de las proteínas (Figura 5), así como del organismo completo (Jiang & Tian, 2018). Además, los semiconductores inorgánicos son sensibles a las heterogeneidades celulares o a las interacciones biológicas transitorias, como ocurre con las nanopartículas, y puede interactuar de manera directa con la membrana celular, específicamente con las proteínas.
Hay que considerar, inicialmente, que el medio donde la nanopartícula estaría suspendida, es decir, la interface semiconductor-biofluido (Nel, et al., 2009; Jiang & Tian, 2018), puede ser de naturaleza metaestable debido a la ausencia de homogeneidad y a la dinámica o ambiente transitorio que este puede presentar debido a la distribución y diferente localización espacial de las estructuras que contienen las proteínas, los lípidos y los glicosilados en la superficie de la membrana celular (Nel, et al., 2009). Como se ilustra en la figura 6a, la interface ZnO-NPs- biofluido (electrolito) adquiere una condición de equilibrio debido al flujo de carga que se presentaría entre el sólido y la fase líquida, lo que conduciría a que el nivel ox/red de la solución, Eox/red o, se alinee con el nivel de Fermi del semiconductor, EF, en este caso el ZnO (semiconductor de tipo n) (Gerisher, 1990). Para alcanzar esta condición de equilibrio, el EF del semiconductor debe igualarse a la cantidad - eμe s, donde "μe s" es el potencial electroquímico del electrón en la solución y "e" la carga absoluta del electrón (Lichterman, et al., 2015). Este proceso espontáneo daría como resultado el curvado de las bandas de energía en la superficie del semiconductor (Figura 6a) (Zhang & Yates, 2012). Específicamente para el ZnO, en el cual predominan los electrones (semiconductor de tipo n), la transferencia de carga que se generaría ocasionaría que el interior del sólido quedara con una alta concentración de electrones (carga negativa) y en su superficie predominaran los "huecos" (carga positiva), conformándose una región de carga espacial (Zhang & Yates, 2012) y la correspondiente separación de carga. Además, considerando la "contra carga" que se localizaría sobre el biofluido (electrolito), se generaría un campo eléctrico que estaría localizado muy cerca de la membrana plasmática o celular (Figura 6a), dentro de la doble capa de Helmholtz (Jiang & Tian, 2018). Asimismo, los estados superficiales del semiconductor, generados por la terminación abrupta de la estructura cristalina del sólido o por las impurezas, es decir, los defectos o especies adsorbidas por su superficie, podrían intercambiar carga con las bandas de valencia y conducción del semiconductor, así como con las especies redox que existen en el fluido biológico (Zhang & Yates, 2012), favoreciendo la formación del campo eléctrico cercano a la membrana (Jiang & Tian, 2018).
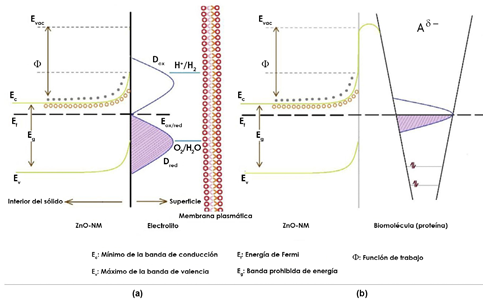
Figura 6 Esquema que ilustra las interacciones eléctricas propuestas entre las ZnO-NPs y la membrana celular (a), así como con las biomoléculas (proteínas) (b) (adaptada de la referencia Patiño-Portela, et al., 2021).
Por otro lado, cuando las nanopartículas ingresan en la membrana celular, se puede presentar una interacción eléctrica entre ellas y las proteínas (grandes biomoléculas), algunas de las cuales estarían adsorbidas sobre su superficie conformando la corona de proteínas (Figura 5). Si la nanopartícula es de ZnO, esta interacción propiciaría un intercambio de electrones tal que las bandas de energía se curvarían hacia arriba, como se indica en la figura 6b.Zhang & Yates (2012) indican en su trabajo que durante la adsorción de una biomolécula de naturaleza aceptora "A" (Figura 6b) en la superficie de una nanopartícula semiconductora de tipo n, cuando la biomolécula se acerca a la superficie del sólido, alguno de sus orbitales moleculares no llenos interactuaría con el semiconductor, nivelándose con el nivel de Fermi, EF, de la nanopartícula. Esta interacción ocasionaría el ensanchamiento del orbital molecular para aceptar los electrones que se transferirían desde el semiconductor, y propiciaría la generación de un campo eléctrico acompañado del curvado hacia arriba de las bandas de energía (Zhang & Yates, 2012) cerca de la superficie del semiconductor, tal como se muestra en la figura 6b. Además de propiciar la generación de un campo eléctrico localizado, este proceso afectaría el transporte de los portadores de carga, huecos y electrones, a través de la nano-biointerface de la nanopartícula y la biomolécula (proteína), favoreciendo la acumulación de electrones dentro de la nanopartícula y de huecos en su superficie. Por lo tanto, la posición relativa del nivel de Fermi en el semiconductor frente a los potenciales redox de las especies químicas o los orbitales moleculares no llenos de las biomoléculas que conforman el sistema biológico, determinaría en gran parte las reacciones electroquímicas que ocurrirían en la superficie del sólido semiconductor. Es por ello que las reacciones de tipo Faraday y las de acoplamiento pueden modificar el potencial electroquímico local y, por lo tanto, el voltaje de la membrana celular (diferencia entre los potenciales intracelular y extracelular), modificando el ambiente químico local y afectando la fisiología celular (Jiang y Tian, 2018), lo que contribuiría a la citotoxicidad del semiconductor.
Como resultado de estas interacciones de naturaleza eléctrica entre la nanopartícula y el elemento biológico (Figura 6), se generarían campos eléctricos localizados sobre la membrana celular y las proteínas, lo que las afectaría fuertemente, tal como lo propusieron De Lucas-Gil, et al. (2017) y De Lucas-Gil, et al. (2018). Además, la superficie del nano semiconductor contendría una alta concentración de "huecos" que favorecería el desarrollo de reacciones generadoras de ERO (ROS), como las siguientes (Nosaka & Nosaka, 2017; Jedsukontorn, et al., 2018):
A través de estas reacciones se produciría peróxido de hidrógeno (H2O2) y radicales hidroxilo (•OH) por la oxidación de las moléculas de agua presentes en la nano-biointerface. Además, si en el sistema existen grupos hidroxilo (OH-), estos podrían reaccionar con el peróxido para generar otras ERO (ROS), como el superoxígeno •O2 -), a través de las siguientes reacciones (Nosaka & Nosaka, 2017; Jedsukontorn, et al., 2018):
El desarrollo de las anteriores reacciones (ecuaciones 1 a 5) garantizaría la presencia de especies reactivas de oxígeno en las interfaces entre nanopartícula y membrana y nanopartícula y biomolécula (proteína), las cuales podrían propiciar estrés oxidativo en el sistema biológico. Este efecto, así como la aplicación de campos eléctricos localizados sobre la membrana y las proteínas, generado por la carga eléctrica existente en la superficie de las nanopartículas semiconductoras, podrían ocasionar daños irreparables en la membrana celular de los hongos y de las bacterias, lo que respaldaría los resultados que se observan en las figuras 1 a 4.
Efecto de los defectos puntuales presentes en las ZnO-NPs
Ya desde los primeros trabajos que evaluaron el potencial tóxico de los materiales de tamaño nanométrico, se consideró que las discontinuidades de los planos cristalinos ocasionadas por la reducción del tamaño de la partícula, que producían un aumento en la cantidad de defectos estructurales (desorden en la estructura geométrica), así como perturbación en la bien estructurada configuración electrónica del material (desorden en la estructura electrónica), favorecían los efectos tóxicos de las nanopartículas en los sistemas biológicos (Nel, et al., 2006).
La presencia de defectos en los cristales es un fenómeno universal y muy común, y más cuando se trata de nanocristales o nanopartículas (Li, et al., 2017). Estos defectos introducen en los sólidos sitios no saturados coordinativamente que son altamente activos y que, además, espacialmente suministran canales para la transferencia de energía y de electrones (Zhang, et al., 2019). Por mucho tiempo los defectos se consideraron indeseables en los materiales y por eso se evitaba su presencia. Pero, estudiando más en profundidad los procesos catalíticos mediante técnicas más avanzadas de análisis, se encontraron "méritos maravillosos" de los defectos para la catálisis (Yan, et al., 2017). Por ejemplo, la formación de vacancias de oxígeno (remoción de un ion de oxígeno de la red) favorece la generación de iones metálicos coordinativamente no saturados, con acumulación de electrones en exceso (Wendt, et al., 2008). Estos sitios metálicos coordinativamente no saturados, ricos en electrones o con menor estado de valencia, propiciarían lugares para la quimisorción molecular ofreciendo sus orbitales "d", y servirían como puente de transferencia de electrones entre el semiconductor y la molécula (por ejemplo, O2-N2 o CO2) (Zhang, et al., 2019).
Para las ZnO-NPs específicamente, Verma, et al. (2018) señalaron que la actividad antibacterial de estas nanopatículas estaría inducida por los defectos intrínsecos y propusieron un mecanismo para explicar esta funcionalidad, considerando un modelo núcleo-revestimiento para la disposición de estos defectos (Parashar, et al., 2012). Los resultados del ensayo de resonancia paramagnética electrónica (electronic paramagnetic resonance, RPE), específicamente los EPR x-band obtenidos por Verma, et al. (2018), mostraron dos señales: una de alrededor de g ⁓1,96 y otra alrededor de g -2,00, y las asignaron a dos centros diferentes de defectos ubicados en el interior del nanocristal (bulk o núcleo), donde predominarían los defectos cargados negativamente, principalmente vacancias de oxígeno mono-ionizadas [Vo •] (Wang, et al., 2009), y en su superficie (Shell o recubrimiento), donde predominarían los defectos cargados positivamente, principalmente vacancias de cinc mono-ionizadas [VZn'] (Parashar, et al., 2012). Estos defectos intrínsecos generarían las ERO (ROS) que ocasionarían los cambios en el potencial de la membrana y las correspondientes consecuencias en el sistema biológico (Verma, et al., 2018).
Estos resultados indican que la presencia de vacancias de oxígeno en el nanocristal es muy importante debido a la acumulación del exceso de electrones, ya que estas podrían mediar en la producción de las ERO (ROS), lo que reitera el importante papel que pueden tener estos defectos en la determinación de las propiedades fisicoquímicas de los óxidos metálicos (Gunkel, et al., 2020), específicamente en su capacidad antibacterial (Xu, et al., 2013).
Tal como lo indican Prasanna & Vijayaraghavan (2015) para justificar la capacidad antibacterial de las ZnO-NPs, el oxígeno presente en el medio ambiente podría reaccionar con los electrones que se encuentran atrapados en los defectos superficiales del ZnO, formando radicales superoxígeno (reacción 6), los cuales podrían propiciar la formación de radicales hidroperoxil, en presencia de protones o agua (reacciones 7 y 8, respectivamente). A través de diversas reacciones (reacciones 9 y 10), estos radicales hidropiroxil llevarían a la formación de peróxido de hidrógeno, H2O2, que, a su vez, podría reaccionar con el radical superoxígeno para formar iones y radicales hidroxil (reacción 11). Las reacciones mencionadas, se pueden expresar de la siguiente manera:
Estas generarían, principalmente, peróxido de hidrógeno (H2O2) y radicales hidroxilo (•OH) y superoxígeno •O2 -) mediante la oxidación del agua presente en el entorno del ZnO. Ya que los radicales hidroxilo (•OH ) y superoxígeno •O2 -) están cargados negativamente, no podrían penetrar la membrana celular, por lo que permanecerían en contacto directo con la superficie externa de la bicapa (Xie, et al., 2011), y la especie que penetraría la membrana sería el peróxido de hidrógeno (H2O2), principal responsable, por lo tanto, de la muerte de la bacteria (Padmavathy & Vijayaraghavan, 2008; Sawai, et al., 1996). Por otro lado, como lo indican Winkler, et al. (2021), la anisotropía del contenido de oxígeno superficial que presentan frecuentemente las ZnO-NPs sintetizadas (Erazo, et al., 2019; Agredo-Trochez & Molano-Cabezas, 2020; Benítez-Salazar, 2021), podría afectar las reacciones superficiales y favorecer el desarrollo de las reacciones indicadas (reacciones 6 a 11).
Conclusiones
En los estudios realizados en nuestro laboratorio se ha podido evidenciar el efecto antifúngico de nanopartículas de ZnO síntetizadas por diferentes rutas químicas, específicamente en cepas de Omphalia sp., Colletotrichum sp. y Phoma sp., así como su efecto antibacterial en la cepa de E. coli. Esta acción de las ZnO-NPs en los diferentes patógenos se explicaría a partir de varios fenómenos fisicoquímicos que podrían ocurrir en la nano-biointerface entre el semiconductor y la membrana o pared celular. Los modelos cualitativos propuestos para esclarecer el mecanismo de acción de las ZnO-NPs en los patógenos consideran que la generación de especies reactivas de oxígeno ERO (ROS) es el principal proceso propiciador de la inhibición de su crecimiento y la afectación de su ultraestructura. Además, los defectos presentes en las nanopartículas ayudarían a mediar la generación de dichas ERO (ROS). Asimismo, el potencial que se generaría en la nano-biointerface como resultado de todas las fuerzas de interacción entre las nanopartículas y la superficie de la membrana celular, podría propiciar la ruptura física de la bicapa por el incremento de la tensión superficial sobre esta. Por otro lado, las interacciones de naturaleza entrópica ocasionarían el agrupamiento y la localización espacial de las biomoléculas en la membrana celular, propiciando transiciones desorden - orden, fenómenos que afectarían las funciones de las biomoléculas y provocarían respuestas de la membrana que podrían conducir a la inactivación del sistema biológico. Además, los campos eléctricos localizados que se generarían en la nano-biointerface debido a la naturaleza semiconductora de las ZnO-NPs, modificarían el potencial electroquímico local y, por lo tanto, el voltaje de la membrana, alterando el ambiente químico local y afectando la membrana y las biomoléculas, así como la fisiología celular. En consecuencia, estos campos eléctricos localizados contribuirían a la citotoxicidad del semiconductor porque podrían generar daños irreparables.