Introducción
Pese a la presión antropogénica que lo está degradando (Laurance, et al., 2014; Campbell, et al., 2018), el sistema fluvial del Amazonas todavía alberga una gran riqueza de especies de vertebrados e invertebrados de agua dulce, lo que requiere una adecuada gestión, así como el desarrollo y adaptación de herramientas para recopilar e interpretar información sobre los patrones de diversidad (Lessmann, et al., 2016; Jézéquel, et al., 2020). Es preocupante que muchas especies de invertebrados tropicales están poco documentadas en comparación con las europeas y norteamericanas (Touron-Poncet, et al., 2014; Sarremejane, et al., 2020).
Los ecosistemas fluviales tienen a los macroinvertebrados acuáticos como uno de los principales componentes biológicos y en gran medida son responsables del flujo de energía desde los productores primarios a niveles superiores (Walteros & Castaño, 2020). El conocimiento de los macroinvertebrados en América del Sur es aún escaso y gran parte de la información se halla dispersa en publicaciones europeas, norteamericanas y suramericanas (Roldán-Pérez, 2016; De León, et al., 2020). Los avances en su descripción y la comprensión de su relación con patrones geográficos y rangos altitudinales también son limitados (Jacobsen, 2004; Castro, et al., 2019).
Una de las cuencas poco estudiadas en la Amazonía peruana es la del río Alto Madre de Dios, la cual nace en la parte oriental de la cordillera de Vilcanota y hace parte del sistema fluvial del Amazonas y forma el río Madre de Dios la confluencia con el río Manu, lo que constituye el sistema fluvial más importante del sureste de Perú (Figueroa & Stucchi, 2010). En esta cuenca existen asentamientos humanos (colonos) y comunidades nativas que desarrollan la agricultura y extracción forestal como principales actividades económicas (Mayor & Bodmer, 2009).
En este contexto, el conocimiento de la distribución y diversidad de los macro-invertebrados acuáticos en el gradiente altitudinal contribuirá a desarrollar acciones de gestión y conservación adecuadas, por lo que se propuso evaluar su diversidad y su relación con algunas variables ambientales a lo largo del gradiente altitudinal de la cuenca del río Alto Madre de Dios.
Materiales y métodos
Área de estudio
El estudio se llevó a cabo en la cuenca del río Alto Madre de Dios, en la zona de amortiguamiento de la Reserva de Biosfera del Manu (12°08' S y 71°40' O), entre las provincias de Paucartambo (departamento del Cusco) y Manu (departamento de Madre de Dios) en el sur de Perú. El río Alto Madre de Dios fluye de sur a norte durante 275 km, drenando un área aproximada de 1.600 km2. El gradiente altitudinal va desde los 3.500 a los 300 m s.n.m. hasta su unión con el río Manu, abarcando cinco zonas de vegetación andina: puna (4.500-3.500 m), bosque de nubes superior (3.500-2.500 m), bosque de nubes inferior (2.500-1.000 m), piedemonte (1.000-400 m) y tierras bajas (400-50 m) (Brack & Mendiola, 2000).
Se tomaron muestras en 22 estaciones (Tabla 1): la de mayor altitud a 2.411 m s.n.m. y la de menor altitud, a 398 m s.n.m. 80 km río abajo (Figura 1). Los ríos fluyen a través de profundos y estrechos valles y laderas escarpadas desde la fuente hasta alrededor de los 700 m s.n.m., para luego abrirse en amplias planicies de inundación de tierras bajas. El régimen de caudal está influenciado por la presencia de precipitaciones estacionales con mayor descarga entre noviembre y abril.
Tabla 1 Ubicación y descripción de las estaciones de muestreo en la cuenca del río Alto Madre de Dios (Perú)
| Estaciones de | Descripción | Coordenadas | Altitud |
|---|---|---|---|
| muestreo | Sur Oeste | (m s.n.m.) | |
| 01R | Río Madre de Dios en la localidad de Aguas Calientes | 12°40’18” 71°16’02” | 398 |
| 02R | Río Shintuya en la localidad de Shintuya | 12°40’17” 71°18’18” | 424 |
| 03A | Quebrada Anaconda en la localidad de Shintuya | 12°40’54” 71°17’50” | 428 |
| 04Q | Quebrada Mascuitania en la localidad de Mascuitania | 12°47’24” 71°23’09” | 459 |
| 05Q | Quebrada Puente a 2,50 Km en la localidad de Dos Cincuenta | 12°41’18” 71°20’54” | 462 |
| 06R | Río Carbón en la localidad de Atalaya | 12°53’33” 71°20’56” | 499 |
| 07R | Río Pilcopata en la localidad de Villa Carmen | 12°53’44” 71°23’59” | 511 |
| 08R | Piñi-Piñi en la localidad de Villa Carmen | 12°53’19” 71°24’21” | 518 |
| 09Q | Quebrada Piñi-Piñi en la localidad de Villa Carmen | 12°53’19” 71°24’21” | 518 |
| 10R | Río Hospital en la localidad de comunidad nativa Huacari | 12°55’14” 71°25’21” | 547 |
| 11R | Río Tono en la localidad de comunidad nativa Huacari | 12°55’01” 71°25’44” | 551 |
| 12R | Río Salvación en la localidad de Salvación | 12°50’23” 71°21’09” | 558 |
| 13R | Río Queros en la localidad de Pampa Azul | 12°58’07” 71°20’28” | 587 |
| 14R | Río Sabaluyoc en la localidad de Sabaluyoc | 12°57’27” 71°20’09” | 593 |
| 15A | Aguajal en la localidad de Agua Santa | 12°56’33” 71°24’46” | 622 |
| 16R | Río Kosñipata en la localidad de Asunción | 13°00’36” 71°25’50” | 720 |
| 17Q | Quebrada Quitacalzón en la localidad de Consuelo | 13°01’34” 71°29’59” | 1064 |
| 18R | Río Kosñipata en la localidad de San Pedro | 13°03’23” 71°32’36” | 1347 |
| 19R | Río San Pedro en la localidad de San Pedro | 13°03’19” 71°32’48” | 1394 |
| 20R | Río Unión en la localidad de Unión | 13°04’17” 71°34’11” | 1673 |
| 21Q | Quebrada Américo en la localidad de Wayquecha | 13°07’46” 71°34’41” | 2218 |
| 22Q | Río Pacchayoc en la localidad de Pacchayoc | 13°09’30” 71°35’51” | 2411 |
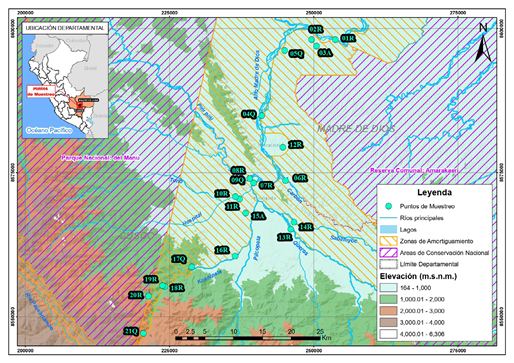
Figura 1 Mapa del sistema fluvial de la cuenca del río Alto Madre de Dios (Cusco-Madre de Dios) con la ubicación de las 22 estaciones de muestreo. R: ríos, Q: Quebradas y A: Aguajal
Actualmente, la mayor parte del área adyacente al río Alto Madre de Dios todavía está cubierta por bosque primario amazónico, aunque parte de ella fue deforestada y el suelo se utiliza para la ganadería (Hamilton, et al., 2007). También hay presencia de instalaciones turísticas con hostales y una red de senderos forestales que son utilizados por un número relativamente bajo de turistas (Yu, et al., 1997).
Muestreo
El muestreo se realizó en junio del 2012, durante la época seca. Se eligió la época de vaciante debido a la mayor estabilidad ambiental y biótica, además de ser un período más seguro para el muestreo (Henriques-Oliveira & Nessimian, 2010).
Se determinaron las siguientes características fisicoquímicas: potencial de hidrógeno (pH), temperatura (T, °C) y conductividad eléctrica (CE, ¡iS/cm) empleando un multi-parámetro portátil HI-98129 (Hanna Instruments, Woonsocket, RI, USA).
El hábitat se caracterizó a partir de la medición del ancho del río (A, m), la profundidad (P, cm), la velocidad de la corriente (V, m/s), el sustrato dominante y el porcentaje de sombra en transectos según la recomendación de Armantrout (1998). En cada estación de muestreo se establecieron cinco transectos a lo largo del río, con tres puntos de muestreo en cada uno. Las profundidades se midieron con una regla graduada de metal, se determinaron los porcentajes y se clasificaron en tres grupos: baja (PB, <30 cm), media (PM, 30-60 cm) y alta (PA, >60 cm). Las velocidades de corriente se midieron con un reómetro (Speed Coach OC 2, Nielsen-Kellerman Co., Boothwyn, PA, USA) y se clasificaron en cuatro grupos: baja (VB, <0,3 m/s), media (VM, 0,3-0,75 m/s), alta (VA, 0,76-1,2 m/s) y muy alta (VMA, >1,2 m/s). El sustrato dominante se clasificó como fino (F, < 2 mm), de gravas (G, 2-64 mm), canto rodado (CR, 64-256 mm), piedras (PI, >256 mm) y rocas.
Para la recolección de los macroinvertebrados acuáticos se utilizó una red de patada (tamaño de malla 200 μm) y se emplearon 20 patadas de esfuerzo. Todas las muestras fueron compuestas (multihábitat) hasta formar una única muestra representativa de cada estación de muestreo, y se conservaron en etanol al 70 %. En el laboratorio se identificaron hasta el nivel taxonómico más bajo utilizando claves y descripciones taxonómicas especializadas (Roldán, 1996; Manzo, 2005; Domínguez, et al., 2006; Merrit, et al., 2008; Domínguez & Fernández, 2009), para luego contabilizarlas a nivel de familia y género. Las muestras identificadas fueron depositadas en la colección de macroinvertebrados acuáticos del Departamento de Limnología del Museo de Historia Natural de la Universidad Nacional Mayor de San Marcos.
Análisis de datos
Los datos fisicoquímicos y del hábitat fluvial (variables ambientales) se transformaron a raíz cuadrada antes del análisis multivariado de clasificación y agrupamiento (Henriques-Oliveira & Nessimian, 2010), obteniéndose un dendrograma de distancia euclidiana. Se utilizó la prueba de Simproff (p<0,05) con el dendrograma para identificar los grupos estadísticamente significativos (Oyanedel, et al., 2008) y se hizo un análisis de componentes principales (ACP) para simplificar las 19 variables ambientales e identificar las de mayor importancia.
Los datos de abundancia de los taxones identificados se transformaron a log10 (X+1) para el análisis de correspondencia canónica (ACC), con el fin de inferir la relación entre los parámetros de mayor importancia y la presencia de taxones de invertebrados dulceacuícolas. Los análisis se hicieron son los paquetes Vegan (Oksanen, et al., 2017) y FactoMineR del programa R, versión 3.5.1 (Lê, et al., 2008)
Resultados
Características fisicoquímicas y del hábitat fluvial
Las características fisicoquímicas del agua y del hábitat fluvial presentaron variaciones a lo largo del gradiente altitudinal (Tabla 2). Entre las variaciones más relevantes estuvo el ancho (2,5-28,3 m), la profundidad media (5,1-57,4 cm) y la velocidad media (0,04-0,9 m/s); asimismo, el pH (4,4-8,8), la temperatura del agua (16,1-29 °C) y la conductividad eléctrica (26-188 μS/cm) aumentaron a medida que el gradiente disminuyó. El sustrato fino y el de canto rodado dominaron en las estaciones bajas. El porcentaje de sombra varió desde la condición abierta (0 %) hasta la totalmente cubierta (100 %).
Tabla 2 Valores de los parámetros fisicoquímicos y características del hábitat fluvial obtenidos en las estaciones de muestreo en la cuenca del río Alto Madre de Dios (Perú)
| Estación de muestreo | Fisicoquímicos/hábitat fluvial | Profundidades (%) | Velocidades (%) | Tipo de sustrato (%) | Sombra (%) | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| pH | T (°C) | CE (μS/cm) | A (m) | P (cm) | V (m/s) | PB | PM | PA | VB | VM | VA | VMA | F | G | CR | PI | R | S | |
| 01R | 8,0 | 24,3 | 105,0 | 18,2 | 25,1 | 0,5 | 58,0 | 42,0 | 0,0 | 17,0 | 67,0 | 17,0 | 0,0 | 14,2 | 0,0 | 77,5 | 8,3 | 0,0 | 0,0 |
| 02R | 8,1 | 24,4 | 99,0 | 11,2 | 13,7 | 0,2 | 100,0 | 0,0 | 0,0 | 58,0 | 42,0 | 0,0 | 0,0 | 46,7 | 15,8 | 35,0 | 2,5 | 0,0 | 41,7 |
| 03A | 7,4 | 26,4 | 119,0 | 3,5 | 16,8 | 0,1 | 100,0 | 8,0 | 0,0 | 100,0 | 0,0 | 0,0 | 0,0 | 94,2 | 0,0 | 0,0 | 5,8 | 0,0 | 100,0 |
| 04Q | 6,8 | 29,0 | 44,0 | 7,9 | 25,6 | 0,2 | 58,0 | 33,0 | 8,0 | 58,0 | 42,0 | 0,0 | 0,0 | 58,3 | 0,0 | 41,7 | 0,0 | 0,0 | 8,3 |
| 05Q | 8,0 | 26,1 | 169,0 | 5,5 | 18,7 | 0,2 | 92,0 | 8,0 | 0,0 | 67,0 | 33,0 | 0,0 | 0,0 | 60,8 | 0,0 | 20,0 | 19,2 | 0,0 | 75,0 |
| 06R | 8,8 | 26,3 | 102,0 | 14,4 | 34,5 | 0,4 | 33,0 | 50,0 | 17,0 | 17,0 | 75,0 | 8,0 | 0,0 | 15,0 | 2,5 | 82,5 | 0,0 | 0,0 | 16,7 |
| 07R | 6,9 | 24,8 | 119,0 | 15,7 | 15,6 | 0,0 | 83,0 | 17,0 | 0,0 | 92,0 | 8,0 | 0,0 | 0,0 | 0,0 | 0,0 | 70,8 | 29,2 | 0,0 | 0,0 |
| 08R | 6,9 | 22,3 | 131,0 | 6,9 | 44,1 | 0,2 | 17,0 | 67,0 | 17,0 | 67,0 | 33,0 | 0,0 | 0,0 | 58,3 | 0,0 | 0,0 | 41,7 | 0,0 | 0,0 |
| 09Q | 7,2 | 22,3 | 126,0 | 4,5 | 5,1 | 0,1 | 100,0 | 0,0 | 0,0 | 78,0 | 22,0 | 0,0 | 0,0 | 100,0 | 0,0 | 0,0 | 0,0 | 0,0 | 33,3 |
| 10R | 7,6 | 23,1 | 26,0 | 28,3 | 36,6 | 0,7 | 50,0 | 50,0 | 8,0 | 0,0 | 50,0 | 42,0 | 8,0 | 0,0 | 26,7 | 36,7 | 36,7 | 0,0 | 16,7 |
| 11R | 7,7 | 19,1 | 50,0 | 6,9 | 22,1 | 0,3 | 83,0 | 17,0 | 0,0 | 25,0 | 75,0 | 0,0 | 0,0 | 19,2 | 22,5 | 58,3 | 0,0 | 0,0 | 0,0 |
| 12R | 7,3 | 24,0 | 33,0 | 4,4 | 30,1 | 0,4 | 75,0 | 8,0 | 17,0 | 33,0 | 58,0 | 8,0 | 0,0 | 27,5 | 0,0 | 39,2 | 33,3 | 0,0 | 33,3 |
| 13R | 8,0 | 20,0 | 61,0 | 10,4 | 39,5 | 0,3 | 17,0 | 83,0 | 0,0 | 42,0 | 58,0 | 0,0 | 0,0 | 14,2 | 2,5 | 78,3 | 5,0 | 0,0 | 0,0 |
| 14R | 7,7 | 19,7 | 44,0 | 22,9 | 31,0 | 0,4 | 58,0 | 58,0 | 0,0 | 8,0 | 83,0 | 8,0 | 0,0 | 0,0 | 0,0 | 92,5 | 7,5 | 0,0 | 16,7 |
| 15A | 5,8 | 23,9 | 26,0 | 2,5 | 57,4 | 0,0 | 9,0 | 36,0 | 55,0 | 100,0 | 0,0 | 0,0 | 0,0 | 97,5 | 2,5 | 0,0 | 0,0 | 0,0 | 83,3 |
| 16R | 7,4 | 26,4 | 65,0 | 5,2 | 19,9 | 0,3 | 83,0 | 25,0 | 0,0 | 45,0 | 55,0 | 0,0 | 0,0 | 35,8 | 5,8 | 28,3 | 30,0 | 0,0 | 16,7 |
| 17Q | 7,8 | 20,9 | 52,0 | 4,1 | 31,4 | 0,5 | 50,0 | 50,0 | 8,0 | 25,0 | 58,0 | 17,0 | 0,0 | 11,7 | 16,7 | 30,8 | 40,8 | 0,0 | 100,0 |
| 18R | 7,5 | 22,2 | 89,0 | 6,4 | 24,4 | 0,2 | 67,0 | 33,0 | 0,0 | 75,0 | 25,0 | 0,0 | 0,0 | 70,0 | 0,0 | 0,0 | 30,0 | 0,0 | 0,0 |
| 19R | 7,8 | 20,1 | 43,0 | 7,7 | 49,4 | 0,5 | 25,0 | 42,0 | 33,0 | 25,0 | 42,0 | 33,0 | 0,0 | 30,8 | 2,5 | 22,5 | 44,2 | 0,0 | 0,0 |
| 20R | 7,7 | 20,2 | 64,0 | 8,4 | 32,0 | 0,7 | 50,0 | 58,0 | 0,0 | 0,0 | 50,0 | 50,0 | 0,0 | 0,0 | 22,5 | 53,3 | 15,8 | 8,3 | 25,0 |
| 21Q | 7,4 | 17,3 | 51,0 | 4,0 | 30,2 | 0,8 | 50,0 | 58,0 | 0,0 | 8,0 | 17,0 | 75,0 | 0,0 | 8,3 | 8,3 | 16,7 | 50,0 | 16,7 | 66,7 |
| 22Q | 4,4 | 16,1 | 188,0 | 6,1 | 23,9 | 0,9 | 83,0 | 33,0 | 0,0 | 0,0 | 27,0 | 73,0 | 0,0 | 2,5 | 2,5 | 38,3 | 48,3 | 8,3 | 75,0 |
T=temperatura del agua; CE=conductividad eléctrica; A=anchura media; P=profundidad media; V=velocidad media; B= baja; M=moderada; A=alta, MA=muy alta, F=fino, G=grava, CR=canto rodado, PI=piedras, R=rocas y S=sombra
Mediante los análisis de clasificación y ordenamiento de los datos ambientales registrados en las estaciones de muestreo, se conformaron cuatro grupos significativamente diferentes (p<0,05) (Figura 2A). El grupo I (10R, 20R, 21Q y 22Q), conformado por estaciones ubicadas en las mayores altitudes, con excepción de la estación 10R (ubicada en altitudes medias), se caracterizó por el pH ligeramente alcalino (7,6; 7,7 y 7,4), excepto en la 22Q (4,4), mayores velocidades y predominio de sustratos de piedras y rocas. En las del grupo IV (08R, 12R, 15A, 16R, 17Q, 18R y 19R), de estaciones ubicadas en altitudes altas y medias, predominaron las conductividades eléctricas bajas, las velocidades y profundidades bajas y moderadas, y el sustrato fino y de piedras (Figura 2B). En las estaciones del grupo II (01R, 04Q, 06R, 07R, 11R, 13R y 14R), ubicadas en la parte media y baja, se observaron velocidades medias, predominó el canto rodado en los fondos y hubo menor cobertura. En las del grupo III (02R, 03A, 05Q y 09Q), ubicadas en la parte baja, las profundidades y velocidades fueron bajas, predominó el sustrato fino y hubo mayor cobertura.
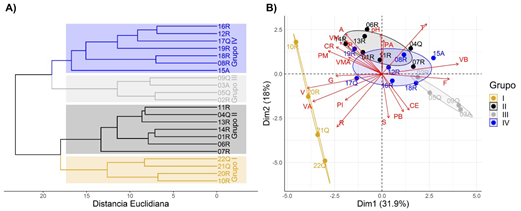
Figura 2 A) Dendrograma de agrupamiento de las 22 estaciones de muestreo en base a variables ambientales (características fisicoquímicas del agua y del hábitat fluvial). B) Diagrama de dispersión biespacial del análisis de componentes principales (ACP) basados en las variables ambientales según agrupamiento de las estaciones de muestreo (grupos I, II, III y IV) de la cuenca del río Alto Madre de Dios (Perú). T=temperatura del agua; CE=conductividad eléctrica; A=anchura media; P=profundidad media; V=velocidad media; B= baja; M=moderada; A=alta, MA=muy alta, F=fino, G=grava, CR=canto rodado, PI=piedras, R=rocas y S=sombra
Los dos primeros componentes del ACP explicaron un poco más del 50 % de las características: el CP1 (31,9 %) relacionado con la temperatura, la velocidad media, baja y alta y los sustratos rocosos y de piedras, y el CP2 (18 %), con el pH, el ancho, la velocidad moderada, y los sustratos finos y de canto rodado con sombra.
Composición de la comunidad de macroinvertebrados acuáticos
La curva de rarefacción (Figura 3) reveló poco aumento en la riqueza de taxones por encima de las primeras 21 estaciones, con lo que se constató que una gran parte de la riqueza se recolectó en las muestras del estudio.
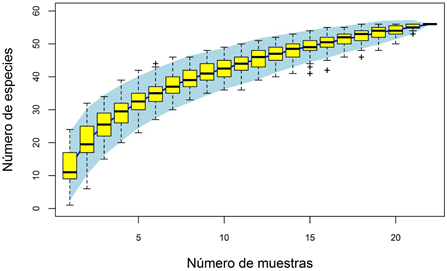
Figura 3 Curva de acumulación según el número de muestras tomadas en la cuenca del río Alto Madre de Dios (Perú)
Se recolectaron 7.187 individuos de 56 taxones distribuidos en los órdenes Acari, Ephemeroptera, Coleoptera, Diptera, Hemiptera, Megaloptera, Odonata, Plecoptera, Trichoptera y Decapoda (Tabla 3). La clase más abundante y diversa fue Insecta, cuyo orden Ephemeroptera presentó el mayor número de individuos (2.596), con 5 familias (Baetidae, Euthyplociidae, Leptohyphidae, Leptophlebiidae y Oligoneuriidae) y ocho géneros, seguido del orden Diptera (2.060 individuos, 8 familias y 10 géneros, dos de ellos indeterminados).
Tabla 3 Macroinvertebrados acuáticos registrados en las estaciones de muestreo de la cuenca del río Alto Madre de Dios (Perú)
| Clase | Orden | Familia | Género | Clase | Orden | Familia | Género | ||
|---|---|---|---|---|---|---|---|---|---|
| Arachnida | Acari | Indeterminado | Indeterminado | Insecta | Hemiptera | Gerridae | Eurygerris Trepobates | ||
| Insecta | Ephemeroptera | Baetidae | Americabaetis | Naucoridae | Cryphocricos | ||||
| Andesiops | Pelocoris | ||||||||
| Baetodes | Veliidae | Rhagovelia | |||||||
| Camelobaetidius | |||||||||
| Euthyplociidae | Euthyplocia | Megaloptera | Corydalidae | Corydalus | |||||
| Leptohyphidae | Leptohyphes | Odonata | Aeshnidae | Aeshna | |||||
| Leptophlebiidae | Thraulodes | Calopterygidae | Hetaerina | ||||||
| Oligoneuriidae | Lachlania | Coenagrionidae | Argia | ||||||
| Coleoptera | Elmidae | Macrelmis | Libellulidae | Dhytemis | |||||
| Heterelmis | Plecoptera | Perlidae | Anacroneuria | ||||||
| Stenelmis | Gripopterygidae | Claudioperla | |||||||
| Cylloepus | Trichoptera | Calamoceratidae | Phylloicus | ||||||
| Gyrinidae | Gyrinus | Helicopsychidae | Helicopsyche | ||||||
| Hydrophilidae | Hydrophilus | Hydrobiosidae | Atopsyche | ||||||
| Ptylodactylidae | Indeterminado | Hydropsychidae | Leptonema | ||||||
| Psephenidae | Psephenus | Smicridea | |||||||
| Psephenops | Hydroptilidae | Ochrotrichia | |||||||
| Staphylinidae | Indeterminado | Glossosomatidae | Mortoniella | ||||||
| Scirtidae | Scirtes | Leptoceridae | Nectopsyche | ||||||
| Diptera | Blephariceridae | Limonicola | Grumichella | ||||||
| Ceratopogonidae | Indeterminado | Philopotamidae | Chimarra | ||||||
| Alluaudomyia | Odontoceridae | Marilia | |||||||
| Chironomidae | Indeterminado | Malacostraca | Decapoda | Trichodactylidae | Indeterminado | ||||
| Empididae | Hemerodromia | Palaemonidae | Macrobrachium amazonicum | ||||||
| Ephydridae | Ephydra | Macrobrachium | |||||||
| Simuliidae | Simulium | 1 | |||||||
| Tabanidae | Tabanus | ||||||||
| Tipulidae | Hexatoma | ||||||||
| Tipula |
La familia Chironomidae fue la más abundante, con 21 % del total (1.550 individuos), seguido de los géneros Baetodes (614 individuos), Thraulodes (603 individuos) y Anacroneuria (528 individuos), distribuidos en todo el gradiente altitudinal evaluado, así como los géneros Americabaetis (198 individuos) y Smicridea (171) (Tabla 3). Por otro lado, Plecoptera registró 1.040 individuos, dos familias y dos géneros, Trichoptera (954 individuos, 9 familias y 11 géneros), Coleoptera (532 individuos, 7 familias y 11 géneros, con dos indeterminados), Hemiptera (308 individuos, 3 familias y 5 géneros), Odonata (147 individuos, 4 familias y 4 géneros), Decapoda (76 individuos, 2 familias, 2 géneros y un género indeterminado) y Acari (15 individuos de una familia y un género no determinado).
Las estaciones del grupo I (zonas más elevadas con altas velocidades de corriente) presentaron 33 taxones y 2.284 individuos, predominantemente del orden Plecoptera (833 individuos y 2 géneros), seguido del orden Ephemeroptera, Diptera y Trichoptera, este último con una mayor diversidad en las estaciones ubicadas a altitudes altas y medias. En el grupo II (velocidades medias con canto rodado) se registraron 37 taxones y 2.647 individuos, con predominio de Ephemeroptera (1.322 individuos y 7 géneros), siendo los más importantes los géneros Camelobaetidius y Thraulodes. El grupo III (zona baja con velocidades bajas y sustrato fino) presentó 21 taxones y 1.081 individuos, con predominio del orden Diptera (734 individuos y 3 géneros), y dentro de este, la familia Chironomidae (673 individuos). Por último, el grupo IV (altitudes altas y medias con profundidades y velocidades bajas a moderadas), fue el más diverso, con 40 taxones y 1.787 individuos y el predominio de los órdenes Diptera, Ephemeroptera y Trichoptera y de la familia Chironomidae (232 individuos) y el género Nectopsyche (189 individuos).
Según los rangos altitudinales y las abundancias relativas (porcentaje) de los órdenes de los macroinvertebrados (Figura 4) (Tabla 4), entre los más persistentes y abundantes se encontraron Ephemeroptera, con los géneros Baetodes, Thraulodes y Americabaetis, Diptera (Chironomidae), Trichoptera (Smicridea) y Plecoptera (Anacroneuria), este último abundante a mayor altitud y en aguas relativamente ácidas.
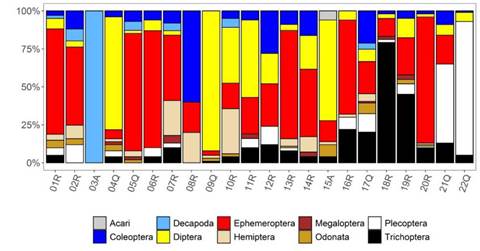
Figura 4 Porcentaje de órdenes de macroinvertebrados acuáticos registrados en cada estación de la cuenca del río Alto Madre de Dios (Perú)
Tabla 4 Distribución altitudinal y abundancia de taxones de macroinvertebrados acuáticos registrados en la cuenca del río Alto Madre de Dios (Perú)
| Taxones | Rangos altitudinales (msnm) | Abundancia (n° individuos) | |||||
|---|---|---|---|---|---|---|---|
| 2411-2000 | 2000-1500 | 1500-1000 | 1000-500 | 500-398 | |||
| Chironomidae | 1550 | ||||||
| Baetodes | 614 | ||||||
| Thraulodes | 603 | ||||||
| Anacroneuria | 528 | ||||||
| Leptohyphes | 516 | ||||||
| Claudioperla | 485 | ||||||
| Camelobaetidius | 372 | ||||||
| Nectopsyche | 233 | ||||||
| Americabaetis | 198 | ||||||
| Smicridea | 171 | ||||||
| Cylloepus | 163 | ||||||
| Ochrotrichia | 159 | ||||||
| Rhagovelia | 148 | ||||||
| Pelocoris | 134 | ||||||
| Leptonema | 128 | ||||||
| Simulium | 114 | ||||||
| Atopsyche | 104 | ||||||
| Tipula | 103 | ||||||
| Corydalus | 71 | ||||||
| Dhytemis | 71 | ||||||
| Ptylodactylidae | 70 | ||||||
| Psephenus | 70 | ||||||
| Heterelmis | 52 | ||||||
| Macrobrachiun amazonicum | 50 | ||||||
| Hexatoma | 49 | ||||||
| Phylloicus | 45 | ||||||
| Aeshna | 42 | ||||||
| Alluaudomyia | 40 | ||||||
| Euthyplocia | 26 | ||||||
| Psephenops | 26 | ||||||
| Macrelmis | 22 | ||||||
| Stenelmis | 22 | ||||||
| Macrobrachium | 22 | ||||||
| Helicopsyche | 19 | ||||||
| Acari | 15 | ||||||
| Marilia | 15 | ||||||
| Ephydra | 11 | ||||||
| Eurygerris | 11 | ||||||
| Trepobates | 11 | ||||||
| Grumichella | 11 | ||||||
| Chimarra | 11 | ||||||
| Lachlania | 8 | ||||||
| Hydrophilus | 8 | ||||||
| Andesiops | 7 | ||||||
| Staphylinidae | 7 | ||||||
| Scirtes | 7 | ||||||
| Ceratopogonidae | 7 | ||||||
| Hemerodoromia | 7 | ||||||
| Gyrinus | 4 | ||||||
| Limonicola | 4 | ||||||
| Tabanus | 4 | ||||||
| Cryphocricos | 4 | ||||||
| Hetaerina | 4 | ||||||
| Mortoniella | 4 | ||||||
| Trichodactylidae | 4 | ||||||
| Argia | 3 | ||||||
| Total, taxones (n°) | 18 | 13 | 28 | 48 | 25 | 7187 | |
| Presencia | |||||||
Por otra parte, la riqueza específica (S) varió considerablemente, desde un solo taxón en la estación 03A a 24 en el sitio 17Q, en tanto que la mayor abundancia se registró en la estación 09Q (722 individuos) y la menor en la 03A (7 individuos). Según los grupos de estaciones (Figura 2A), la riqueza varió entre 21 taxones en el grupo III y 40 en el grupo IV, en tanto que la mayor abundancia de individuos, 2.647 se registró en el grupo II y la menor en el III (1.081 individuos).
Composición taxonómica según características ambientales
El ordenamiento en el ACC (41,4 % de la varianza total) con base en la abundancia de los taxones y las variables ambientales (Figura 5) evidenció relaciones importantes entre las comunidades de macroinvertebrados y los rangos de velocidades. Para el caso de Chironomidae, Dhytemis y Alluaudomyia, sus abundancias se asociaron a velocidades bajas; las de Psephenus, Heterelmis, Camelobaetidius y Simulium se relacionaron con las velocidades medias, y Baetodes, Anacroneuria, Atopsyche, Smicridea y Tipula se asociaron con velocidades altas y mayores altitudes. También se registraron asociaciones entre Thraulodes y Americabaetis y el ancho promedio del cauce, así como de Ochrotrichia y Leptonema y la profundidad.
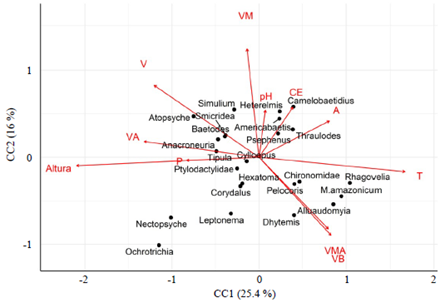
Figura 5 Diagrama de ordenación del análisis de correspondencia canónica (ACC) que muestra la relación entre los taxones más abundantes registrados en los sitios de muestreo de la cuenca del río Alto Madre de Dios (Cusco-Madre de Dios). T=temperatura del agua; CE=conductividad eléctrica; A=anchura media; P=profundidad media; V=velocidad media; B= baja; M=moderada; A=alta y MA=muy alta
Discusión
Según la distancia que recorren (orden al cual pertenecen), los ríos muestran cambios morfológicos y ambientales (grosor de las partículas del lecho, ancho y velocidad del cauce, forma del valle, entre otros) (Gordon, et al., 2004), de la fisicoquímica del agua, la conductividad eléctrica, la dureza, la temperatura y la turbidez (Roldán & Ramírez, 2008), los cuales condicionan las características del ensamble de las comunidades biológicas (Vannote, et al., 1980). Esta relación se manifiesta como influencia natural del gradiente altitudinal, que determina las adaptaciones a las condiciones ambientales en las que se desarrollan y han evolucionado (Roldán, 1996; 2003). Tales cambios también ocurren en el curso de los ríos estudiados bajo la influencia de características ambientales como el gradiente altitudinal, determinante en la dinámica de los organismos acuáticos y clave en la estructura de las comunidades acuáticas (Mendes, et al., 2018).
La biodiversidad tiende a disminuir a mayor latitud y con el incremento del gradiente altitudinal (Whittaker, et al., 2001; Willig, et al., 2003) en respuesta a factores ambientales más restrictivos (Vannote, et al., 1980; Rahbek, 1995). En el caso de los macroinvertebrados acuáticos, dicha relación es menos clara, tal vez por la falta de un mayor número de estudios (Jacobsen, 2004). En este sentido, Cressa (2000) en 28 arroyos de Venezuela y Monaghan, et al. (2000) en 45 arroyos ecuatorianos, no hallaron ninguna o poca relación con la altitud. En nuestros resultados, la riqueza de taxones de las 22 estaciones de muestreo no reveló un comportamiento regular con la altitud, siendo mayor la diversidad a altitudes medias, lo que coincide con otros estudios (Jacobsen, 2004; Henriques-Oliveira & Nessimian, 2010; Lujan, et al., 2013; Arana & Cabrera, 2017; Carrasco, et al., 2020).
Debido a la influencia del hombre hoy la biodiversidad en ecosistemas acuáticos epicontinentales se está perdiendo (Dudgeon, et al., 2006), efecto que se observa sobre todo en aquellos que se hallan próximos a centros urbanos (Meyer, et al., 2005; Roldán-Pérez, 2016) como consecuencia de los cambios en sus características fisicoquímicas naturales. Aparentemente dicho efecto no se manifiesta en los ríos estudiados por hallarse rodeados mayormente de bosques primarios, pese a que varias estaciones de muestreo se encontraban próximas a centros urbanos pequeños. Por ello se considera que la información recopilada corresponde a lugares poco o no alterados, y de ahí su importancia para conocer más sobre el ensamble de los macroinvertebrados y aproximarse a una mejor comprensión de sistemas fluviales (Paggi, 1999) tan poco descritos.
El número de taxones registrados en este estudio fue mayor a lo reportado en los cuerpos de agua ubicados dentro del área de influencia de la comunidad nativa de Puerto Arturo, en la confluencia del río Las Piedras con el río Madre de Dios, y la asociación de mineros de Manuani, donde se reportaron 42 taxones distribuidos en 6 clases, 13 órdenes y 31 familias (Araujo, 2010). También es mayor a lo reportado por Ortega, et al. (2007), quienes identificaron 20 géneros en parte de la cuenca hidrográfica del río Huallaga; sin embargo, en el Bajo Urubamba (Cusco Ucayali) Ortega, et al. (2010) reportaron 112 taxones a partir de un monitoreo biológico entre el 2003 y 2009. Las diferencias halladas probablemente se deban a la magnitud del esfuerzo desplegado.
Los organismos responden con adaptaciones fisiológicas y morfológicas a las exigencias del medio en el cual se hallan (Krebs, 2009; Molles, 2015; Smith & Smith, 2015), por ello, los componentes de los macroinvertebrados presentan adaptaciones según el grupo taxonómico al cual pertenecen, y responder a las variables del medio donde se desarrollan (Florencio, et al., 2010) manteniendo su presencia o ausentándose (mediciones cuantitativas) y la magnitud de la abundancia (mediciones cualitativas) según las características del rango de tolerancia frente a las variables ambientales (González, 2006).
Chironomidae (Diptera) estaba presente en todo el gradiente altitudinal, con mayores abundancias en zonas donde la velocidad de la corriente es baja y el sedimento fino, gracias a que se ha adaptado para sobrevivir en entornos más extremos (Lods-Crozet, et al., 2001; Scheibler, et al., 2014), con abundante materia orgánica y periodos de anoxia (Vimos-Lojano, et al., 2017). El orden Ephemeroptera también fue uno de los más abundantes y con mayor distribución; Camelobaetidius se asoció con velocidades medias y menores altitudes; Baetodes con mayores velocidades y altitudes, al igual que Anacroneuria (Plecoptera), Atopsyche y Smicridea (Trichoptera), que presentan adaptaciones para esos tipos de hábitats (Bispo, et al., 2006; Schmitt, et al., 2016). Entre los Coleoptera están los asociados a corrientes con velocidades medias: Psephenus (Psephenidae) y Heterelmis (Elmidae), aunque este último es característico de ambientes con altas velocidades y elevado contenido de oxígeno (Manzo, 2013; González-Córdoba, et al., 2020), así como larvas de Simulium (Diptera) (Coscarón-Arias, 2009), que pueden sobrevivir en condiciones temporales de anoxia alimentándose de materia orgánica, por lo que están presentes en diferentes ambientes (Docile, et al., 2015), tal como se recoge en el análisis de ACC.
La composición y la abundancia de los macroinvertebrados en el río Alto Madre de Dios se atribuyen a la velocidad y la cantidad del flujo de las corrientes, las cuales moldean los sustratos y controlan la acumulación de nutrientes y sedimentos en los lechos fluviales (Scholl, et al., 2015; Wolters, et al., 2018). Ello confirma que el gradiente altitudinal (en el que está inmerso el efecto de las variables ambientales) tiene un efecto en la composición, riqueza y abundancia de macroinvertebrados (García-Ríos, et al., 2020). La heterogeneidad de la riqueza, la composición y la abundancia observadas en el gradiente altitudinal se ajusta a lo planteado en el modelo de río continuo, el cual sostiene que las comunidades biológicas se modifican de acuerdo al incremento del orden del río (dimensión fluvial) (Vannote, et al., 1980), sin descartar la influencia antropogénica.
Conclusiones
La diversidad del ensamble de los macroinvertebrados acuáticos se relacionó con las condiciones físicas y ambientales de la cuenca del río Alto Madre de Dios, determinadas por el gradiente altitudinal, registrándose mayores valores de composición y abundancia en el rango intermedio de 1.000 a 500 m s.n.m. Las variables de mayor importancia fueron la velocidad de la corriente y la profundidad del cauce, sumadas a la posible influencia de la actividad antrópica en las poblaciones aledañas.















