Introducción
El orden Lepidoptera es uno de los grupos de insectos más abundantes y diversos del Neo-trópico. A nivel mundial hay 157.424 especies de mariposas y polillas descritas hasta el momento (Storck, 2018), y se estima que existe un mínimo de 255.000 (Heppner, 1998) y un máximo de 500.000 especies a nivel mundial (Kristensen, 1999; Kristensen, et al., 2007; García-R, et al., 2020). Colombia es uno de los cuatro países megadiversos del mundo y ocupa el segundo lugar en cuanto a riqueza de especies de mariposas. Aunque aún faltan por explorar algunas partes del territorio, se han registrado 3.274 especies, de las cuales 350 son endémicas (Andrade-C., 2011). En lo que se refiere a la región del Amazonas, hay registro de 1.228 especies y subespecies pertenecientes a las seis familias de mariposas de Hesperio-idea y Papilionoidea (Andrade-C., et al., 2015), y, específicamente en el Vaupés se reportan 453 especies (Fagua, 1996; Rodríguez & Miller, 2013; Henao-B & Díaz-U, 2021).
Algunos de los principales obstáculos para el desarrollo de estudios regionales en la Amazonía, especialmente en el departamento del Vaupés, han sido los cultivos ilícitos y el conflicto armado dentro del territorio, sobre todo en las áreas rurales donde la mayoría de la población es indígena (Zárate, 2014). Otro es la incomunicación entre sus municipios, comunidades y asentamientos indígenas, ya que la red fluvial es el único sistema de transporte y no es navegable en su totalidad debido a los continuos raudales o 'cachiveras' que se presentan en su recorrido, lo cual limita la navegabilidad de grandes embarcaciones (Salazar, et al., 2006). Además, existen pocas vías de comunicación terrestre y actualmente solo está habilitado un trayecto de aproximadamente 50 kilómetros entre Mitú y Timbo (Gobernación del Vaupés, 2000).
Una de las actividades más representativas y más problemáticas de las comunidades indígenas y los colonos es la explotación e intervención de la selva para establecer zonas de cultivo llamadas "chagras", destinadas a la obtención de alimento y vivienda. Dichas actividades se sitúan principalmente en las márgenes del río Vaupés y en afluentes como los ríos Querarí y Cuduyarí, así como a lo largo de la vía Mitú-Monfort hacia la frontera de Brasil (Viatela, et al., 2000), en un proceso de extracción, tumba, transformación y cambios del uso del suelo que causa fragmentación de los hábitats y pérdida de la biodiversidad (Andrade-C., 2002; Corporación para el Desarrollo Sostenible del Norte y Oriente Amazónico-CDA, 2018), la cual es el sostén de una gran variedad de servicios ambientales, por lo que, al desestabilizarse o perder componentes, da lugar a un comportamiento caótico que afecta o amenaza dichos servicios (Andrade-C., 2011).
En este contexto, la caracterización de lepidópteros diurnos es necesaria para el registro de especies aún no descritas que pueden desaparecer, y con ellas, la posibilidad de conocer el papel ecológico que desempeñan (Gordon, 1985). Gracias a la facilidad de observación en campo, su alta fidelidad ecológica, la corta temporalidad generacional y la fragilidad ante las perturbaciones, estas especies se consideran indicadoras de la calidad del hábitat (Brown, 1991; Andrade-C., 1998). Por esta razón, su recolección, análisis y la determinación de su composición permiten la descripción de áreas de endemismo o de alta biodiversidad, la identificación de especies amenazadas y el establecimiento de prioridades de conservación (Valencia, et al., 2005). El escaso número de estudios sobre lepidópteros y las grandes extensiones de bosque del departamento del Vaupés evidencian la poca información disponible (Andrade-C, et al., 2015), lo que orientó en este estudio el planteamiento de las siguientes preguntas de investigación: ¿cuál es la diversidad de especies de mariposas en dos zonas del departamento del Vaupés? y, ¿varía la diversidad de lepidópteros diurnos entre la temporada de invierno y la de verano?
Materiales y métodos
Área de estudio
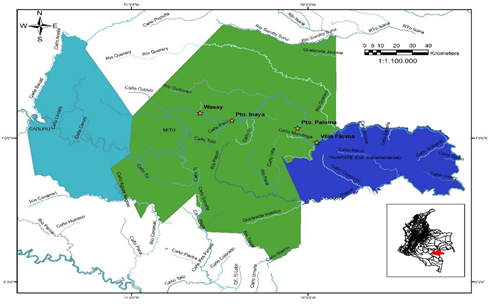
El estudio se realizó en el departamento del Vaupés, que se caracteriza por ser un sector de transición entre las llanuras secas de la Orinoquia y el bosque húmedo de la Amazonía colombiana (CDA, 2011). Tiene una extensión de 54.135 km2, equivalente al 4,7 % del territorio continental colombiano y al 11,34 % de la región amazónica del país, siendo el cuarto departamento en extensión después de Amazonas, Caquetá y Guainía (Salazar-C., et al., 2006). Su territorio está inmerso en su totalidad en la región amazónica y está dividido en tres municipios: Mitú (capital), Carurú y Taraira, y en tres áreas no municipalizadas: Pacoa, Papunaua y Yavaraté (Decreto 632 de 2018 del Ministerio del Interior). El clima es cálido, la temperatura fluctúa entre los 25 y 30 °C y la humedad relativa promedio es de 84 %; el periodo entre los meses de octubre y abril el de mayor temperatura, y el de menor temperatura entre los meses de mayo y septiembre (CDA, 2011).
Se escogieron dos zonas comunicadas fluvialmente por el río Vaupés: zona media y zona baja. La Amazonía colombiana no posee cambios altitudinales marcados y estas zonas están asociadas con el significado que los indígenas le otorgan al río. La zona baja corresponde al sector aguas abajo, es decir, el más cercano a Brasil, y la zona media al más cercano a la Orinoquía. En cada zona se seleccionaron dos comunidades indígenas: Wasay (01° 10' 30,50" N y 70° 36 38,80 O) y Puerto Inayá (01° 07' 25,7" N y 70° 25 49,6 O), separadas entre sí por 20 km en la zona media; y Villa Fátima (00° 58' 15,17" N y 69° 56 59 O) y Puerto Paloma (01° 04' 08,58" N y 70° 03 28,42 O), separadas entre sí por 40 km en la zona baja (Figura 1). En todas se realizó la consulta previa para obtener el permiso de investigación.
Recolección del material biológico
La recolección de los organismos se efectuó utilizando dos metodologías: red entomológica (jama, muestreo activo) y trampas Van Someren-Rydon (muestreo pasivo), según las descripciones de De Vries (1987) en los meses de julio a septiembre del 2017 (temporada de invierno) y de enero a marzo del 2018 (temporada de verano). En cada comunidad se situaron diez (10) trampas Van Someren-Rydon en el interior del bosque, en un transecto de 250 m, distribuidas linealmente cada 30 m y ubicadas en diferentes estratos: herbáceo (>0,3 m - <1,5 m), arbustivo (>1,5 - <6 m) y arbolitos (> 6 m - <12 m) (Prieto, 1995). Se emplearon cebos alternando banano fermentado y pescado podrido durante cinco días para un total de 90 horas/trampa por temporada en cada comunidad.
Para la recolección con red entomológica se establecieron transectos de longitud indefinida en los puntos óptimos de captura (Andrade, et al., 2013) entre las 07:00 y las 18:00 con dos personas encargadas de la recolección para un total de 45 horas/red entomológica/hombre. Los ejemplares recolectados se sacrificaron usando la técnica de presión digital en el tórax, se depositaron en sobres triangulares de papel glassine blanco con la información de campo (zona, comunidad, estrato, entre otros), y luego se guardaron en recipientes herméticos de plástico con sílica gel para evitar el exceso de humedad y la aparición de hongos.
Métodos de laboratorio
Los individuos recolectados se trasladaron y depositaron en el Instituto de Ciencias Naturales de la Universidad Nacional de Colombia (ICN) en Bogotá, D.C., y se dispusieron en cuarentena para evitar el ingreso de plagas a la colección. Posteriormente, se relajaron y ablandaron para su montaje en láminas de icopor (De Vries, et al., 1997), se etiquetaron y se fotografiaron los ejemplares dorsal y ventralmente. El material se identificó con base en la literatura especializada: Vélez & Constantino (1989), Vélez & Salazar (1991), Fagua (1996), Le Crom, et al. (2002), Le Crom, et al. (2004), Pinzón (2009), Salazar, et al. (2010), Rodríguez & Miller (2013), Andrade, et al. (2015), y Andrade, et al. (2017), así como en la revisión de material digital en www.neotropicalbutterflies.com. Los ejemplares se compararon con los de la colección de referencia del Instituto de Ciencias Naturales de la Universidad Nacional de Colombia en Bogotá (ICN-MHN-L) en consulta con especialistas.
Análisis de datos
Para estimar la diversidad asintótica en cada una de las comunidades (zona media: Puerto Inayá y Wasay; zona baja: Puerto Paloma y Villa Fátima) en las dos temporadas (invierno y verano), se empleó el estimador de riqueza q=0 propuesto por Chao & Jost (2012), calculado con el paquete iNEXT (iNterpolation and EXTrapolation) (Hsieh, et al., 2016). Para comparar la diversidad alfa en cada una de las comunidades y en ambas temporadas, se empleó los número de riqueza (q=0) de Hill (Jost, 2006; Moreno, et al., 2011), con intervalos de confianza del 95 % obtenidos mediante el método bootstrap con 100 repeticiones y bajo la misma cobertura de muestreo (Cq). La riqueza (q0) desestima la abundancia de las especies y permite determinar si existen diferencias significativas a partir de interpolaciones y extrapolaciones (Chao, et al., 2014), para lo cual se empleó el paquete iNEXT (Hsieh, et al., 2016). Este enfoque estandarizado permite la cuantificación y comparación de la riqueza entre ensamblajes aunque las muestras posean diferente tamaño (Moreno, et al., 2011; Cultid-M & Escobar, 2019).
Para medir la diversidad beta (β), correspondiente al grado de diferenciación en la composición de especies (Whittaker, 1960) de mariposas, se empleó el paquete betapart (Baselga, A & Orme, 2012), el cual genera un valor de diversidad beta total (βBRAY) compuesto por los componentes de variación balanceada de la abundancia (βBRAY.BAL) y el gradiente de abundancia (βBRAY.GRA) (Baselga, 2013) calculados a partir del índice de Bray-Curtis. La variación balanceada de la abundancia se presenta cuando hay cambios de la misma magnitud en la abundancia de las especies de un sitio a otro (Baselga, 2013), y el gradiente de abundancia cuando esta disminuye en las especies de un sitio a otro (Baselga, 2013; Calderón-Patrón & Moreno, 2019).
Como medida exploratoria para visualizar gráficamente el grado de similitud del ensamblaje de mariposas en las comunidades en cada temporada, se hizo un análisis de escalamiento multidimensional no paramétrico (NMDS) a partir del índice de similitud de Bray Curtis (Palacio, et al., 2020). Con el fin de comprobar si la similitud de estos ensamblajes difería significativamente entre comunidades, se hizo un análisis de similitudes (ANOSIM) utilizando las temporadas y las comunidades como factores (Clarke & Warwick, 2001). Todos los paquetes se ejecutaron en RStudio (RStudio Team, 2020).
Resultados
Se recolectaron 2.199 ejemplares de mariposas diurnas en las temporadas de invierno y verano distribuidos en seis familias, 18 subfamilias, 132 géneros, 272 especies y 123 subespecies (Figura 2a) (Tablas 1S, 2S,https://www.raccefyn.co/index.php/raccefyn/article/view/1402/3149). Se presenta el primer registro en el país de Battus crassus paraensis K. Brown, 1994 y Protesilaus telesilaus vitellus (Fruhstorfer, 1907). Además, se amplió la distribución en el país de Protesilaus telesilaus dolius (Rothschild & Jordan, 1906), Protesilaus protesilaus protesilaus (Linnaeus, 1758), Protesilaus aguiari (R.F. d'Almeida, 1937) y Eurytides dolicaon hebreus K. Brown & Lamas, 1994.
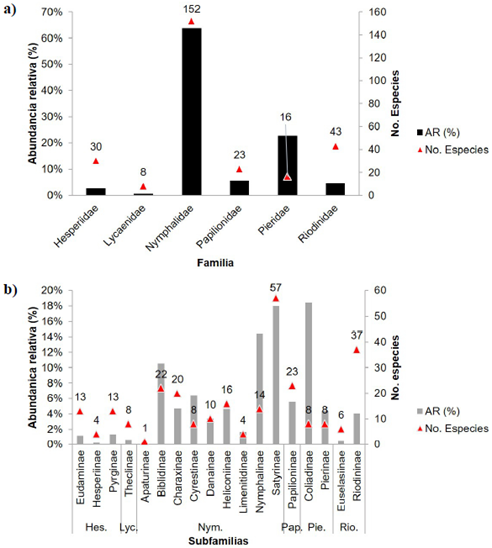
Figura 2 a. Abundancia relativa (% de individuos) y número de especies de las familias de mariposas en cuatro comunidades indígenas del departamento de Vaupés. b. Abundancia relativa (% de individuos) y número de especies de las subfamilias de mariposas registradas
De las 18 subfamilias encontradas, Satyrinae se destacó por su alta representatividad tanto por el número de especies (57; 21 %) como por el número de individuos (396; 18 %). Riodininae se destacó en cuanto al número de especies (37) y Coliadinae en cuanto a la abundancia (18,5 %). Las demás subfamilias registraron menor número de especies (desde 23 hasta una) y abundancias relativas entre 14,4 % (Nymphalinae) y 0,05 % (Apaturinae) (Figura 2). Junonia (7,37 %) y Marpesia (6,41 %) fueron los géneros más abundantes y Aphrissa statira la especie más representativa, con 262 individuos (11,91 %) (Figura 2b).
Dimensión espacial
La mayor riqueza de especies se observó en la zona media. En la comunidad de Puerto Inayá (PI) se registraron 156 especies, de las cuales 50 son únicas (30 en invierno, 15 en verano y 5 en las dos temporadas), y en Wasay (W) 129 especies, de las cuales 33 son únicas (17 en invierno, 5 en verano y 3 en las dos temporadas). En la zona baja, en la comunidad de Puerto Paloma (PP) se contaron 116 especies, 33 de ellas exclusivas (20 en invierno, 9 en verano y 4 en las dos temporadas) y en Villa Fátima (V) 111 especies, 33 exclusivas (15 en invierno, 15 en verano y 3 en las dos temporadas) (Figura 1S,https://www.raccefyn.co/index.php/raccefyn/article/view/1402/3150) (Tabla 3S,https://www.raccefyn.co/index.php/raccefyn/article/view/1402/3149).
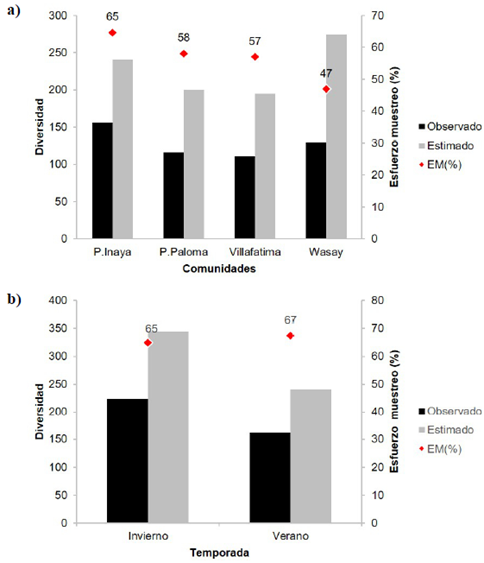
Figura 3 Diversidad asintótica estimada (q=0) a nivel espacial (a) y temporal (b) de mariposas diurnas en cuatro comunidades indígenas del departamento del Vaupés. EM (%): esfuerzo de muestreo
En la comunidad indígena de Puerto Inayá, zona media, se recolectaron 724 ejemplares de mariposas diurnas distribuidas en 6 familias, 17 subfamilias, 82 géneros, 156 especies y 76 subespecies. Nymphalidae fue la más representativa, con 495 individuos (68,4 %) y 60,9 % de la riqueza con 95 especies, seguida por Pieridae, con 118 individuos (16,3 %), aunque con una riqueza del 9 % (14 especies). Las demás familias registraron abundancias inferiores al 7 % y una riqueza de entre 18 y 2 especies, siendo la más baja Lycaenidae. En la temporada de invierno se recolectaron 389 individuos de 6 familias, 17 subfamilias, 75 géneros, 116 especies y 60 subespecies. En la temporada de verano se recolectaron 335 individuos de 6 familias, 15 subfamilias, 57 géneros, 91 especies y 45 subespecies.
En la comunidad indígena de Puerto Wasay, zona media, se recolectaron 639 ejemplares de mariposas diurnas distribuidas en 6 familias, 16 subfamilias, 78 géneros, 129 especies y 63 subespecies. La familia más representativa, con 390 individuos (61 %) y 80 especies (62 %), fue Nymphalidae, seguida por Pieridae, con 163 individuos (25,5 %) y una riqueza de 10 especies (7,8 %). Las demás familias registraron abundancias inferiores a 7,2 % (46 individuos) y riquezas de entre 11 y 3 especies, siendo la más baja Lycaenidae (3 individuos y 3 especies). En la temporada de invierno se recolectaron 370 individuos de 6 familias, 15 subfamilias, 64 géneros, 95 especies y 49 subespecies. En la temporada de verano se recolectaron 269 individuos de 6 familias, 15 subfamilias, 54 géneros, 80 especies y 42 subespecies.
En la comunidad indígena de Puerto Paloma, zona baja, se recolectaron 396 ejemplares de mariposas diurnas distribuidas en 6 familias, 17 subfamilias, 77 géneros, 116 especies y 60 subespecies. Nymphalidae fue la familia más representativa, con 251 individuos (63,4 %) y una riqueza de 75 especies (64,7 %), seguida por Pieridae, con 96 individuos (24,2 %) y 7 especies registradas (6,3 %). Las demás familias registraron abundancias inferiores a 21 ejemplares (5,3 %) y una riqueza entre 9 y 1 especie, siendo Lycaenidae la más baja. En la temporada de invierno se recolectaron 268 individuos de 5 familias (Lycaenidae no se reportó), 16 subfamilias, 68 géneros, 95 especies y 53 subespecies. En la temporada de verano se recolectaron 128 individuos de 6 familias, 15 subfamilias, 41 géneros, 53 especies y 28 subespecies.
En la comunidad indígena de Villa Fátima, zona baja, se recolectaron 440 ejemplares de mariposas diurnas distribuidas en 6 familias, 17 subfamilias, 76 géneros, 111 especies y 50 subespecies. La familia más representativa, con 268 individuos (60,9 %) y 70 especies (63,1 %), fue Nymphalidae, seguida por Pieridae, con 125 individuos (28,4 %) y una riqueza de 7 especies (6,3 %). Las demás familias registraron abundancias inferiores a 19 ejemplares y una riqueza entre 11 y 3 especies; Papilionidae fue la familia con menor abundancia (0,9 %) y riqueza (2,7 %). En la temporada de invierno se recolectaron 298 individuos de 6 familias, 17 subfamilias, 65 géneros, 91 especies y 43 subespecies. En la temporada de verano se recolectaron 142 individuos de 5 familias (Papilionidae no se registró), 14 subfamilias, 42 géneros, 52 especies y 21 subespecies.
Dimensión temporal
En la temporada de invierno con las trampas Van-Someren Rydon se recolectaron 347 individuos correspondientes a 94 especies, y en la temporada de verano, 185 individuos pertenecientes a 76 especies.
En las trampas Van-Someren Rydon con cebo de fruta fermentada (banano) se registraron un total de 303 individuos representados en 89 especies (41 de ellas únicas), en tanto que en aquellas con cebo de pescado en descomposición se registraron 229 individuos representados en 91 especies (41 de ellas únicas). Por otra parte, con la jama se obtuvieron registros de todas las familias de mariposas, con 1.667 individuos que representaron el 76 % de la abundancia, y un total de 208 especies, especialmente aquellas que se alimentan de néctar en el bosque y complementan su dieta buscando en arena húmeda, charcos, orillas de río, heces de aves, orina, etc., por lo que se pudieron atrapar a diferentes alturas (0-2 m.).
Diversidad asintótica estimada
La diversidad asintótica estimada a nivel espacial permitió evidenciar que en la comunidad de Puerto Inayá (65 %) se registró el mayor esfuerzo de muestreo, en tanto que en Puerto Paloma (58 %), Villa Fátima (57 %) y Wasay (47 %) este fue menor (<60 %) (Figura 3a). A nivel temporal, tanto en verano (67 %) como en invierno (65 %) se registró un esfuerzo de muestreo similar pero inferior al 70 % (Figura 3b).
Diversidad alfa y beta
En cuanto a la diversidad estimada en número efectivo de especies (q0, cobertura de muestreo: 0,87) a nivel espacial y en invierno (Figura 4a), no se evidenciaron diferencias significativas entre las comunidades de Puerto Inayá (la más rica y abundante), Wasay y Villa Fátima, en tanto que sí la hubo entre las comunidades de Puerto Paloma y Wasay. Asimismo, la diversidad estimada en número efectivo de especies (q0, cobertura de muestreo: 0,89) a nivel espacial en la temporada de verano (Figura 4b), permitió observar que la riqueza (q0) fue significativamente mayor en las comunidades de Puerto Inayá y Wasay en comparación con Puerto Paloma y Villa Fátima. Por otro lado, en cuanto a la diversidad estimada en número efectivo de especies (q0, cobertura de muestreo: 0,96) a nivel temporal, se evidenció una diferencia significativa entre las temporadas, siendo la de invierno en la que se registró el mayor número efectivo de especies (Figura 4c).
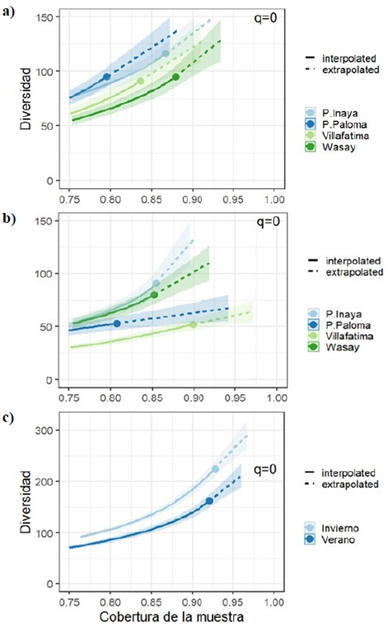
Figura 4 Curvas de rarefacción y extrapolación de mariposas basadas en la cobertura de muestreo a nivel temporal (a) y espacial en invierno (b) y verano (c) para los números de Hill de orden (q=0). Diversidad rarefaccionada (líneas continuas) y extrapolada (líneas discontinuas, hasta el doble del tamaño de la muestra referenciada). Las muestras de referencia se muestran mediante puntos sólidos.
A nivel temporal la diversidad beta total fue mayor en verano (βBRAY=0,75) que en invierno (βBRAY=0,65), y la variación balanceada de la abundancia fue la principal responsable de la diversidad beta total tanto en verano (βBRAY.BAL=0,66; 88 %) como en invierno (βBRAY.BAL=0,60; 68 %). Así, la diversidad beta pareada en verano permitió evidenciar que Villa Fátima fue la comunidad más disímil (0,6) en comparación con el grupo formado por las otras tres comunidades (disimilitud <0,45), siendo Puerto Inayá y Puerto Paloma las comunidades más similares entre sí (0,6) (Figura 5a). En invierno, la disimilitud entre las comunidades estuvo alrededor de 0,45, y las comunidades más similares entre sí fueron Wasay y Villa Fátima (Figura 5b).

Figura 5 Diagrama de agrupamiento de la diversidad beta de mariposas en: a. temporada de invierno y b. temporada de verano en cuatro comunidades indígenas en el departamento del Vaupés
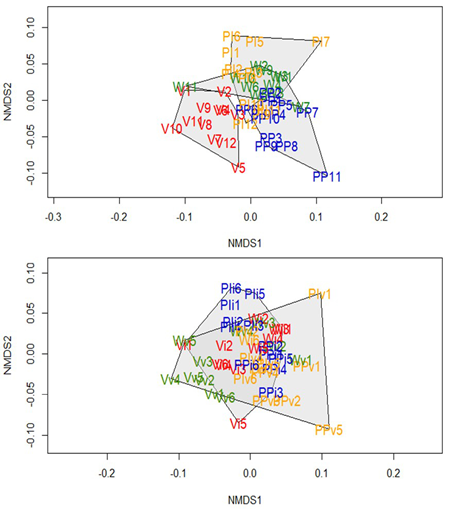
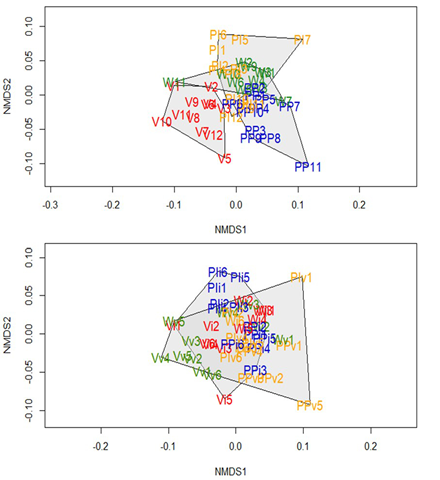
Figura 6 a. Diagrama NMDS basado en la composición de especies en cuatro comunidades indígenas del departamento del Vaupés (PI: Puerto Inayá, PP: Puerto Paloma, V: Villa Fátima y W: Wasay). b. Diagrama NMDS basado en la composición de especies en cuatro comunidades indígenas del departamento del Vaupés en las temporadas de invierno y verano (PI: Puerto Inayá, PP: Puerto Paloma, V: Villa Fátima y W: Wasay)
A nivel espacial, en general la composición de especies fue significativamente diferente en las cuatro comunidades, aunque con algún solapamiento (NMDS estrés= 0,18; ANOSIM: R=0,394; p=0,001) (Figura 6a). A nivel temporal, el ensamblaje fue significativamente diferente en invierno y en verano, aunque esta diferencia fue baja (NMDS: stress=0,1864677; ANOSIM: R=0,094; p=0,007) (Figura 6b).
La composición de especies en la temporada de invierno fue diferente a nivel espacial. Se observaron dos grupos significativamente diferentes (NMDS stress=0,1627732;, ANOSIM: R=0,543; p=0,001): uno compuesto por las comunidades de Wasay y Puerto Inayá y otro por Puerto Paloma y Villa Fátima (Figura 7a). Por otra parte, en la temporada de verano la composición de especies, aunque fue significativamente diferente, presentó un solapamiento entre las comunidades, evidenciándose dos grupos: uno conformado por las comunidades de Puerto Inayá, Wasay y Puerto Paloma, y el otro por Villa Fátima, la cual apareció alejada (NMDS stress=0,1108962; ANOSIM: R=0,448; p=0,001) (Figura 7b).
Discusión
Las 272 especies registradas representan el 8,31 % de la riqueza lepidopterológica del país (3.274 especies) (Andrade-C., 2011). En el presente estudio, centrado en la variación espacio-temporal y de distribución vertical (utilizando como cebo fruta fermentada y pescado descompuesto), se registraron 106 especies y 62 subespecies de lepidópteros diurnos adicionales a las registradas anteriormente en la región. Fagua (1996) reportó 112 especies en la Serranía de Taraira; Rodríguez & Miller (2013) reportaron 312 especies (sin incluir Hesperiidae) en las áreas adyacentes a Mitú (Vaupés), y Henao-B & Díaz-U (2021) registraron 159 especies en la expedición Bio Apaporis 2018.
Además, se amplió el inventario de riqueza de lepidópteros diurnos al registrar por primera vez en el país Battus crassus paraensis K. Brown, 1994 (reportada únicamente en Belém de Pará en Brasil) y Protesilaus telesilaus vitellus (Fruhstorfer, 1907) (reportada únicamente en el sureste de Brasil) (Warren, et al, 2016). Asimismo, se registró la ampliación de la distribución de Protesilaus telesilaus dolius (Rothschild & Jordan, 1906), que se había reportado en las zonas de la costa Pacífica y el Magdalena; de Protesilaus protesilaus protesilaus (Linnaeus, 1758), registrada en el Meta, Amazonas y Caquetá, y de Eurytides dolicaon hebreus K. Brown & Lamas, 1994, reportada en la Sierra Nevada de Santa Marta y el norte de Colombia (Lecrom, et al, 2002).
La familia Nymphalidae registró la mayor riqueza y abundancia de mariposas, lo que coincide con la mayoría de estudios realizados en Colombia (Andrade & Gantiva, 2019; Andrade & Henao, 2017; Andrade, et al., 2015; Rodríguez & Miller, 2013; Fagua, 1996, entre otros), en los que se da cuenta que este grupo está representado en un gran porcentaje por subfamilias y especies que han logrado colonizar diversos ecosistemas terrestres debido a sus hábitos generalistas y su fácil adaptación a diferentes ambientes (DeVries, 1987, Ríos-M & Vélez, 2018). Entre las especies más abundantes de esta familia se encontraron Hermeuptychia hermes, Taygetis thamyra, Pareuptychia ocirrhoe y Morpho helenor (subfamilia Satyrinae), la mayoría de ellas asociadas con el sotobosque, ya que vuelan a ras del suelo, en zonas abiertas y sobre hojarasca, y se alimentan de frutas, hongos de descomposición y carroña, y muy pocas de néctar de flores, tal como lo han indicado DeVries (2000), Valencia, et al. (2005) y Ríos-M & Vélez (2018), entre otros. También fueron abundantes Junonia evarete, Colobura dirce, Historis odius y Baeotus beotus, de la subfamilia Nymphalinae, que se caracterizan por alimentarse de néctar, frutas fermentadas, carroña, estiércol y exudados de árboles (DeVries, 2000; Valencia-C., et al., 2005; Ríos-M & Vélez, 2018), y se registran con mayor frecuencia en áreas abiertas, bordes de bosque, sitios sombríos, bosques húmedos tropicales y, algunos grupos, en la copa de los árboles (DeVries, 2000).
Por otra parte, la familia Pieridae, muy frecuente en áreas abiertas (DeVries, 2001; Lecrom, et al., 2004), registró la mayor abundancia, aunque no la mayor riqueza, y estuvo representada por Aphrissa statira (subfamilia Coliadinae). Estas mariposas se encontraron congregadas en las playas de arena húmeda a orillas del río libando los minerales disueltos del agua, tal como lo han registrado otros autores (DeVries, 2000; Valencia, et al., 2005).
En contraste, la familia Lycaenidae (Theclinae) registró la menor abundancia (13 individuos representados principalmente por Arawacus aetolus) y la menor riqueza (8 especies), como ya lo había registrado Fagua (1996), quien encontró tan solo cuatro especies. Sin embargo, Pinzón (2006), Rodríguez & Miller (2013) y Henao-B & Díaz-U (2021) han registrado entre 15 y 18 especies en la Amazonía colombiana. Es importante señalar que estos ejemplares presentan una estacionalidad marcada y se observan más frecuentemente en la transición entre invierno y verano (Campos-Salazar, et al., 2011), y no resulta fácil atraerlos con cebos, pues muchas especies vuelan en estratos altos y se posan en la copa de los árboles (Prieto & Dahners, 2009), lo cual podría explicar el bajo número de registros en el presente estudio.
A nivel espacial, en la zona media (comunidades de Puerto Inayá y Wasay) la lepidopterofauna estuvo bien representada tanto en abundancia como riqueza, posiblemente porque estas presentan un mayor nivel de conservación, pues tienen pocos habitantes, hay árboles grandes con un dosel más cerrado, y mejores recursos de plantas hospederas y alimenticias; además, solo hay una vía de acceso a través del río Vaupés. En la zona baja (comunidades de Puerto Paloma y Villa Fátima), el nivel de conservación es menor, las vías de acceso son más fáciles (carretera o río), hay más viviendas y mayor número de habitantes, más áreas intervenidas con perturbaciones en sus alrededores (quema y tala de árboles), además de un dosel menos cerrado y de baja altura. Sin embargo, se requerirían estudios a mayor escala espacial para determinar cómo la variación de estas características podría explicar la estructuración del ensamblaje de lepidópteros en la Amazonía colombiana. La diversidad beta total tanto en invierno como en verano fue mayor a 65 %, determinada principalmente por la variación balanceada de la abundancia, lo que indica que las especies están asociadas a microhábitats específicos que ofrece la disposición espacial de cada comunidad indígena, lo que respondería a la oferta de plantas hospederas, periodos de fructificación y floración vegetal, estratificación vertical del bosque, y ciclos de vida, entre otros (DeVries, et al., 1997; DeVries & Walla, 2001; Freitas, et al., 2021). Se registraron entre 50 y 33 especies únicas a nivel espacial, lo que probablemente obedece a que la planta nutricia de sus orugas está en un lugar específico y las hembras permanecen allí donde se halla la planta nutricia en la que pueden poner sus huevos y garantizar el desarrollo de las larvas. Por otra parte, los machos tienen una distribución más amplia, pues están buscando las hembras de su especie para poder copular con ellas. Esto necesariamente conlleva que en estudios posteriores se realice una caracterización vegetal para establecer las diferencias en la composición vegetal en cada una de estas comunidades.
A nivel temporal la riqueza y abundancia de mariposas fue mucho mayor en invierno que en verano. Algunos estudios realizados en el trópico han registrado mayor riqueza de mariposas al inicio y al final de la temporada de lluvias (DeVries & Walla, 2001; Checa, et al, 2019), donde la disponibilidad de vegetación (hojas, tejidos vegetales nuevos) y de recursos puede ser mucho más alta y estimula la actividad y la reproducción en los insectos (Kishimoto-Yamada & Itioka, 2015). Lo contrario puede suceder en la temporada de verano, cuando los recursos alimenticios varían y el pico floral se reduce, lo que conlleva la disminución de la riqueza y la abundancia de especies (Brown Jr. & Freitas, 2000). Todo ello genera ensamblajes de mariposas dinámicos en los que se pueden registrar especies abundantes y comunes en un año y especies raras e imposibles de registrar y ubicar en otros (DeVries & Walla, 2001). Además, varias especies de mariposas migran en las diferentes estaciones o temporadas (DeVries, 1987) y ello podría contribuir al aumento de la abundancia en momentos específicos del año; por ejemplo, durante la temporada de lluvias en este estudio Battus crassus paraensis K. Brown, 1994 y Protesilaus telesilaus vitellus (Fruhstorfer, 1907) se registraron por primera vez en Colombia, siendo originalmente de Brasil.
La red entomológica (jama) en conjunto con las trampas Van Someren Rydon y cebo de fruta fermentada y pescado descompuesto se complementaron de manera exitosa para incrementar el registro local de especies. Con la jama se registró la mayor abundancia y riqueza de mariposas, especialmente de aquellas que obtienen su alimento de diferentes maneras: nectarívoras (flores), hidrófilas (arena húmeda, charcos, etc.) y acimófagas (frutas en descomposición, carroña, excretas), aunque varias de las especies capturadas pueden ubicarse en diferentes categorías (Andrade-C., 1998, Checa, et al., 2019). También se registraron en diferentes microhábitats, como orillas de río, playa, bosque, pastizal, entre otros, en tanto que con las trampas se capturaron especies generalmente asociadas al dosel (DeVries & Walla, 2001) y otras difíciles de atrapar con la jama (subfamilias Charaxinae, Nymphalinae y Satyrinae) debido a su rapidez y vuelo alto (Freitas, et al., 2014).
En el presente estudio se registró una gran riqueza de especies de Riodinidae, Hesperiidae, Nymphalidae, Papilionidae, Pieridae y Lycaenidae, a diferencia de lo reportado por DeVries (1988), Devries, et al. (2001, 2012) y Lorenço, et al. (2019) en los bosques tropicales de Costa Rica, Ecuador y Brasil, lo que probablemente se deba a que se enfocaron en grupos específicos de Nymphalidae usando únicamente trampas VSR y banano fermentado como cebo, en tanto que en este trabajo se emplearon dos técnicas de muestreo (jama y VSR), y dos tipos de cebo (banano fermentado y pescado descompuesto). Checa, et al. (2019) obtuvieron resultados similares al registrar la mayor riqueza en la temporada de invierno con el uso de jama, aunque el cebo más efectivo fue camarón descompuesto y en nuestro estudio el banano fermentado. Por otra parte, en trabajos desarrollados en el Vaupés por Fagua (1996), Rodríguez & Miller (2013) y Henao-B & Díaz-U (2021) con el uso de jama y TVSR y pescado o camarón descompuesto y fruta fermentada de cebo, se registró Nymphalidae como el grupo más diverso, así como las demás familias reportadas aquí, excepto Hesperidae (Rodríguez & Miller, 2013).
A nivel espacial y temporal, la composición de especies fue significativamente diferente en las cuatro comunidades y las dos temporadas, aunque se presentó el solapamiento de varias especies. Esta diferenciación podría deberse a que en la zona media las comunidades de Puerto Inayá (80 km aprox.) y Wasay (60 km aprox.) están aisladas del casco urbano de Mitú, siendo el único medio de acceso el río Vaupés (3 a 4 horas en canoa con motor Yamaha 15 HP) y el número de familias es pequeño (14 y 28 familias, respectivamente), en tanto que en la zona baja las comunidades de Puerto Paloma (32 km aprox.) y Villa Fátima (40 km aprox) (13 y 60 familias, respectivamente) al estar más cerca al casco urbano de Mitú, son de más fácil acceso por carretera (abierta), por río (1-2 horas en canoa con motor Yamaha 15 HP) o avioneta (7 minutos). Por otra parte, la similitud en la composición de especies de lepidópteros en las cuatro comunidades podría explicarse por sus características comunes, pues las chagras tienen una gran diversidad de plantas como yuca brava (Manihot sculentum), yuca dulce (Manihot dulcis), piña (Ananas spp), lulo (Solanum spp), ñame (Dioscorea bulbifera), batata (Ipomoea batata), ají (Capsicum spp), coca (Erythroxylum coca), caruru (Phytolaca rivinioides), plátano (Musa spp), maíz (Zea mays), caña (Saccharum sp), pupuña (Bactris gasipaes), uva caimarona (Pourouma cecropiaceae), guamos (Inga spp), caimos (Crysophyllum auratum), y umarí (Paraqueiba serícea), entre otras (Giraldo & Yunda, 2000). Asimismo, los bosques aledaños a estas comunidades se caracterizan por una flora variada y diversa que es aprovechada como alimento, medicina, madera, artesanías, látex, fibras, aceites o con fines ornamentales (CDA, 2018). Entre las especies que se hallan en la selva densa de gran porte y de uso maderable se podrían mencionar el arenillo (Simarouba amara), el loiro (Nectrandra sp), el acaricuara (Minquartia guianensis), el arrayán (Eugenia sp), el wacapu (Brosimun sp), el caraná (Mauritia arana), el mirapiranga (Brosimun brasiliensis), y el bejuco yaré (Heteropsis jenmanii), entre otras (CDA, 2018; Giraldo & Yunda, 2000).
Conclusiones
Se recolectaron y analizaron 2.199 ejemplares de mariposas diurnas pertenecientes a 272 especies y 123 subespecies, de las cuales 106 especies y 62 subespecies son nuevos registros en el Vaupés. Así, la riqueza total en el departamento se incrementó a 559 especies y 233 subespecies. Además, se generaron dos nuevos registros (Battus crassus paraensis, Protesilaus telesilaus vitellus) y tres ampliaciones de distribución (Protesilaus telesilaus dolius, Protesilaus protesilaus protesilaus, Eurytides dolicaon hebreus) en Colombia.
A nivel espacial las comunidades de Puerto Inayá y Wasay fueron las que registraron mayor número de especies e individuos, en contraste con la zona baja, representada por las comunidades de Puerto Paloma y Villa Fátima, que registraron menor riqueza y abundancia probablemente debido a las diferencias en el acceso a las comunidades y la transformación del bosque, determinantes en la variación de la composición y riqueza a nivel espacial.
La temporada de lluvia registró mayor abundancia y riqueza de especies en contraste con la de verano, situación que podría deberse a factores ambientales que varían según la época del año en la región amazónica y la fuerte relación que existe entre la distribución y la abundancia de las plantas nutricias y hospederas y el ciclo de vida de las mariposas.