Introducción
Según los últimos datos de la Organización Mundial de la Salud (OMS), el cáncer es fue responsable de 10 millones de muertes en el 2020, convirtiéndose en la segunda causa de muerte a nivel mundial. Debido a la letalidad de la enfermedad, la probabilidad de supervivencia aumenta con una detección temprana y eficaz. Sin embargo, los métodos diagnósticos actuales no proporcionan una detección oportuna; por ejemplo, los análisis de sangre pueden proporcionar resultados erróneos, como falsos positivos o falsos negativos, lo que conlleva un exceso de estudios y procedimientos más profundos y costosos. La resonancia magnética puede mejorar la visibilidad de células afectadas, cuando se suminis-tran agentes que potencian el contraste de la imagen de los tejidos y facilitan información detallada sobre la ubicación exacta y la extensión de la enfermedad, mientras que el diagnóstico mediante imágenes tradicionales (radiografía, tomografía, rayos x), en ocasiones no proporcionan un buen enfoque y contraste (International Day of Radiology-IDoR, 2012; Instituto Nacional del Cáncer, 2012; Organización Mundial de la Salud-OMS, 2021).
Por otra parte, los tratamientos tradicionales que se suministran ampliamente a los pacientes a nivel mundial, como la quimioterapia y la radioterapia, no son suficientemente efectivos, ya que provocan daños considerables a los órganos y tejidos sanos y limitan la distribución de la dosis terapéutica, además de que son invasivos y tóxicos, lo que provoca que el paciente presente efectos adversos como alopecia, pérdida de apetito, vómito, cansancio y cambios en la piel, entre otros (Blasto & Caballero, 2019; Yigit, et al., 2012).
Con el desarrollo de "nanoterapias" dirigidas específicamente a los órganos y tejidos enfermos, se ha podido focalizar el tratamiento en la zona afectada y se logra proteger la integridad de las células sanas, reduciendo notablemente los efectos nocivos de los tratamientos actuales y brindando una mejor calidad de vida a los pacientes (Lechuga, 2011).
Las nanopartículas magnéticas (NPM) se han probado recurrentemente en varias aplicaciones y estudios en nanomedicina; debido a su pequeño tamaño (10 - 100 nm) y su gran relación de superficie y volumen son medios resistentes, versátiles y reactivos, propiedades que potencian su acción en los sistemas biológicos, mejorando los problemas de solubilidad y estabilidad química de los medicamentos anticancerígenos e incrementando la captación y administración de medicamentos poco solubles, ya que actúan como nano-portadores hidrófilos (Cardoso, et al., 2018; Farzin, et al., 2020; Wicki, et al., 2015).
En términos de terapéutica, las NPM se diseñan para la administración selectiva de fármacos a órganos y tejidos específicos. También pueden utilizarse para tratar el daño genético oculto reemplazando o desactivando genes supresores de tumores en las células cancerosas. Además, pueden inducir la muerte de células cancerosas por hipertermia magnética mediante la aplicación de un campo magnético externo, en tanto que en el diagnóstico las NPM se emplean como agentes de contraste que permiten una mejor visualización del tejido tumoral mediante imágenes de resonancia magnética (IRM) (Gobbo, et al., 2015; Ramos & Castillo, 2011; Zaimy, et al., 2017).
En este artículo de revisión se discute el uso de diferentes nanopartículas magnéticas en nanomedicina y sus principales aplicaciones, especialmente en el tratamiento y detección temprana del cáncer. Se individualizaron cuatro categorías principales: agentes terapéuticos, agentes de contraste para imágenes en resonancia magnética, hipertermia magnética y terapias genéticas características que pueden emplearse en sistemas terag-nósticos (diagnóstico y tratamiento simultáneo de la enfermedad). Por último, se discuten las ventajas y desventajas de este tipo de tratamientos halladas en los estudios in vivo e in vitro reportados, así como sus perspectivas.
Materiales y métodos
Se hizo un estudio descriptivo y comparativo de los reportes científicos con alto factor de impacto en el área de medicina, nanomedicina y nanopartículas magnéticas. Como se muestra en la figura 1, la búsqueda de la literatura especializada se efectuó en las bases de datos Google Scholar, Scopus, Elsevier, PubMed, Zlibrary, Springer y Medline empleando el rango de tiempo de la década del 2010 al 2020. Se seleccionaron 128 artículos y, mediante los criterios de inclusión y exclusión, se escogieron indicadores como el tipo y el tamaño de las nanopartículas magnéticas para describir los métodos de obtención. Para describir las propiedades magnéticas se seleccionaron los indicadores de anisotropía magnética (K), potencia de pérdida específica (specific loss power, SLP), magnetización de saturación (Ms) y coercitividad (Hc). En cuanto a las aplicaciones biomédicas se incluyeron indicadores como la toxicidad, la biocompatibilidad y la captación para evaluar el funcionamiento de las nanopartículas en los sistemas biológicos. Se excluyeron artículos duplicados y artículos originales que no contenían los indicadores propuestos y de este universo se seleccionaron, analizaron y discutieron 61 artículos. En la tabla 1 se muestra el porcentaje de citación de cada indicador.
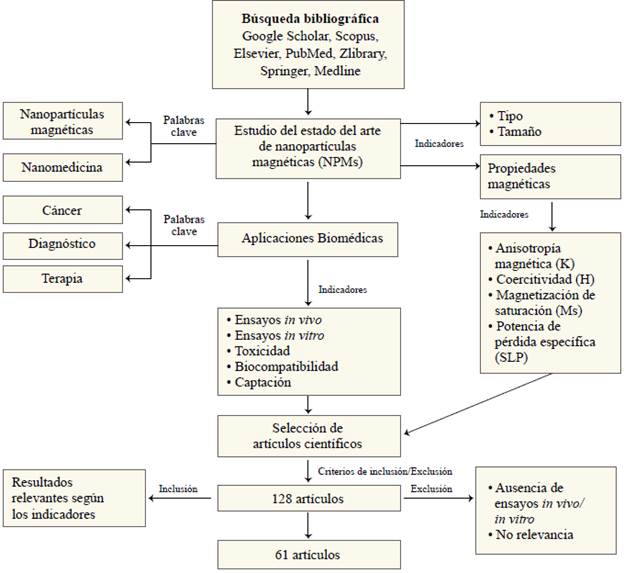
Figura 1 Diagrama de flujo de la revisión del estado del arte para el estudio y selección de artículos científicos a ser discutidos
Tabla 1 Porcentaje de citación de cada indicador en el análisis de las NPM
| Indicadores | Porcentaje de citación (%) |
|---|---|
| Anisotropía magnética | 9 |
| Potencia de pérdida específica | 8 |
| Magnetización de saturación | 11 |
| Coercitividad | 12 |
| Toxicidad | 25 |
| Biocompatibilidad | 16 |
| Captación | 19 |
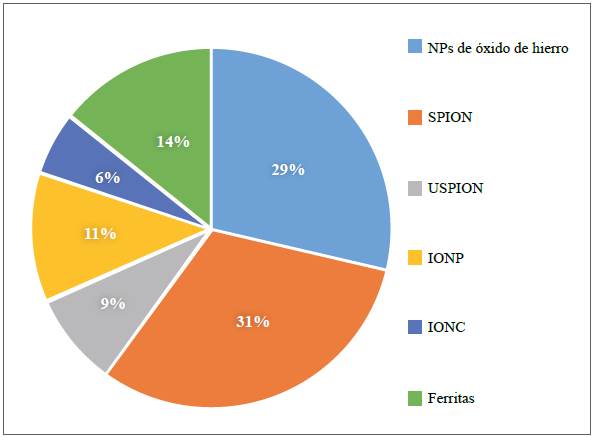
Con base en el tipo y el tamaño de las nanopartículas, en los 61 artículos analizados se detectaron seis tipos: óxido de hierro, citado en el 29 % de los artículos, óxido de hierro superparamagnéticas (SPION), en el 31 %, óxido de hierro superparamagnéticas ultrapequeñas (Ultra-small superparamagnetic iron oxide, USPIO), en el 9 %, óxido de hierro (iron oxide nanoparticle, IONP) en el 11 %, nanoclusters de óxido de hierro (iron oxide nanoclusters, IONC) en el 6 % y, por último, ferritas en el 14 % (Figura 2). Además, en la discusión y los resultados se definieron diferentes tipos de siglas y acrónimos para facilitar la lectura, información que se incluye en el material suplementario S1, https://www.raccefyn.co/index.php/raccefyn/article/view/1560/3183.
Resultados y discusión
Métodos de producción de las NPM
Los métodos químicos de coprecipitación, descomposición térmica, hidrotermal y micro-emulsión son los más frecuentemente empleados para producir nanopartículas biocompatibles de buena calidad, pues proporcionan una síntesis simple, efectiva, fácil de manejar y económica con control del tamaño y la forma durante la síntesis (Rahim, et al., 2020).
Coprecipitación. Es probablemente el método más sencillo para la fabricación de nanopartículas solubles en agua, ya que no se requiere una gran cantidad de reactivos. Básicamente consiste en agregar una disolución salina de iones de hierro (Fe2+) y (Fe3+) en forma de sulfatos, cloruros o nitratos y percloratos disueltos en agua. Al utilizar el reactivo diluyente Diaton (CD), el FeCl3 y el FeCl2 (Tabla 2), se produce magnetita de ~9 nm después de 6 h de agitación continua a temperatura ambiente. Al incrementar la temperatura a 70 °C con agitación magnética, el tiempo de reacción disminuye a 30 min, pero el diámetro de las magnetitas obtenidas se incrementa a tamaños entre 31 y 40 nm (Coral & Mera, 2017; Yallapu, et al., 2012).
Tabla 2 Resumen de los métodos de síntesis de las NPM y de su recubrimiento y funcionalización según los resultados estudiados
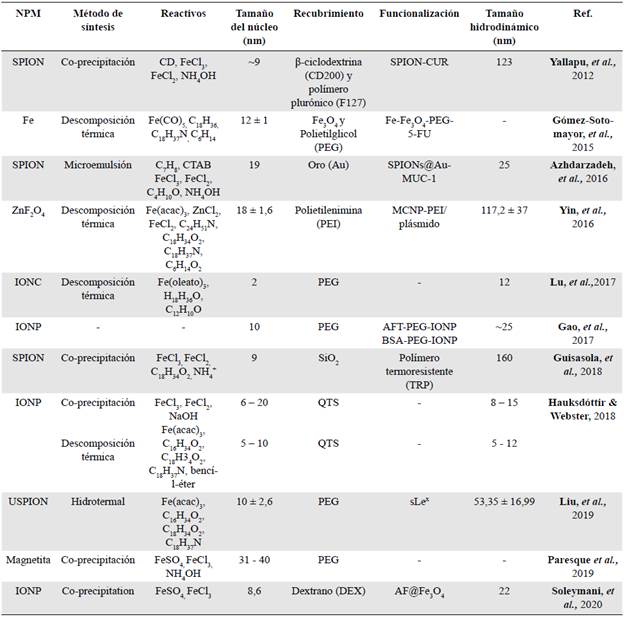
Por otra parte, bajo condiciones oxidantes, la magnetita (Fe3O4) obtenida previamente se oxida formando maghemita (γ-Fe2O3), con un tamaño que oscila entre 10 y 40 nm y una mayor biocompatibilidad. Por ejemplo, en un estudio reciente las magnetitas se oxidaron a una temperatura de 100 °C durante 5 h bajo un ambiente de nitrógeno (N2), produciendo maghemitas de 8,8 nm altamente estables (Baba, et al., 2012; Barrow, et al., 2018; Frimpong & Hilt, 2010; Paresque, et al, 2019).
En otro estudio se reportó que al agitar la mezcla durante aproximadamente 3 h se podían producir IONP de dimensiones entre los 6 y los 20 nm con un potencial zeta de 25,01 mV (Hauksdóttir & Webster, 2018).
Además, al usar isopropanolamina (MIPA) o diisopropanolamina (DIPA) como bases combinadas con los reactivos CoCl2*6H2O y FeCl3*6H2O, después de 2 h de agitación mecánica a 100 °C se produjeron ferritas de CoFe2O4 y MnFe2O4 con tamaños de distribución estrecha que variaban entre 4,2 y 4,8 nm y 9,3 y 11,7 nm, respectivamente, en tanto que al utilizar como base hidróxido de sodio (NaOH), se obtuvieron nanopartículas entre 18,6 y 59,5 nm. Por consiguiente, puede inferirse que las bases tienen un papel fundamental en cuanto al tamaño, la composición química y las propiedades. Al aplicar NaOH como base se produjeron nanopartículas significativamente más grandes que aquellas obtenidas al emplear MIPA y DIPA, lo que proporciona nuevos horizontes en la síntesis de ferritas mediante un método de precipitación versátil y fácil de manejar (Pereira, et al., 2012).
También se han obtenido ferritas de cobalto (CoFe2O4) de tamaño reducido, ~ 6 nm, en una reacción única añadiendo dietilglicol y dietanolamina con CoCl2 y FeCl3 y aproximadamente 2 h de agitación vigorosa a una temperatura de 180 a 240 °C (Wu, et al., 2011).
La principal ventaja de este método es que puede considerarse una síntesis verde, debido al uso de reactivos económicos que son amigables con el medioambiente y brindan tiempos de reacción cortos. Sin embargo, su principal desventaja es el control del tamaño de las nanopartículas, ya que la precipitación rápida conduce a obtenerlas de gran tamaño, aunque para disminuir este efecto pueden emplearse tensoactivos (Valencia-Barrón, 2013).
Durante la última década se ha demostrado que varios agentes biológicos pueden reemplazar los reactivos tóxicos para lograr una síntesis verde mediante la biorremediación de microorganismos y plantas (Gómez-Garzón, 2018).
Descomposición térmica. Para la producción de nanopartículas a partir de este método se requieren precursores metálicos orgánicos como el pentacarbonilo de hierro, el oleato de hierro, o el acetilacetonato de hierro, entre otros. La reacción se produce en presencia de ligandos (ácido oleico y oleilamina) junto con disolventes de alto punto de ebullición y agentes reductores; esta mixtura se calienta a 180 °C bajo una atmósfera controlada de N2 debido a esta elevada temperatura. La síntesis ocurre en 30 min y las nanopartículas obtenidas presentan dimensiones de 12 ± 1 nm, las cuales son altamente estables y dispersables en agua (Gallo, et al., 2013; Gómez-Sotomayor, et al., 2015).
Asimismo, se reporta que el uso de reactivos como Fe(acac)3, ZnCl2 y FeCl2 en la preparación de ferritas de zinc produce nanopartículas de 18,93 ± 1,6 nm con un alto grado de monodispersión. Para sintetizar IONP de dimensiones reducidas (5 a 10 nm), la reacción se conduce a una temperatura superior a los 200 °C bajo una atmosfera controlada de N2 durante aproximadamente una hora, es decir que cuanto mayor sea la temperatura, menor será el tiempo de reacción. Además, el uso de una atmosfera controlada de N2 evita la aglomeración de nanopartículas durante la síntesis y les otorga mejores propiedades, lo que las convierte en materiales magnéticos prometedores para aplicaciones biomédicas (Hauksdóttir & Webster, 2018; Yin, et al., 2016).
En otro estudio se obtuvieron IONC de 4,2 y 5,8 nm mediante descomposición térmica a alta temperatura. Lo interesante es que estas sirvieron más tarde como precursores o semillas para producir IONC de 7,9 y 9,8 nm, respectivamente, hasta alcanzar dimensiones de hasta 22,5 nm. Este método de crecimiento mediado por semillas ofrece una ventaja, ya que se obtienen nanopartículas de diferentes tamaños a partir de las ya sintetizadas. De manera similar, al mezclar oleato de hierro y alcohol oleico con difenil durante 30 min a 200 °C, se pueden obtener IONC muy pequeñas, de ~2 nm (Jeun, et al., 2012; Lu, et al., 2017).
Método hidrotermal. Al igual que la descomposición térmica, este método requiere altas temperaturas y presiones en la reacción, con la diferencia de que se hace en condiciones acuosas, lo que evita la manipulación de disolventes orgánicos tóxicos y proporciona nanopartículas con una distribución de tamaño estrecha. Sin embargo, en términos de rendimiento y calidad son inferiores a aquellas obtenidas con los métodos ya descritos. Por ejemplo, para producir USPION de 10 ± 2,6 nm, se utilizan precursores de hierro como el Fe(acac)3 en presencia de ácido oleico (C18H34O2) y oleilamina (C18H37N), la mezcla se lleva a altas temperaturas, entre 200 y 265 °C, y se centrifuga a temperatura ambiente y el tiempo de reacción es de aproximadamente 2 h, con lo que se obtienen nanopartículas con una distribución uniforme y gran 'dispersabilidad' (Frimpong & Hilt, 2010; Liu, et al., 2019), es decir, su tamaño depende principalmente del tiempo y la temperatura de la reacción.
Microemulsión. El método de microemulsión consiste en formar dos soluciones precursoras, A y B, donde A contiene tolueno, bromuro de cetiltrimetilamonio (CTAB) y una solución de hierro, en tanto que en B se sustituye la solución de hierro por hidróxido de amonio. Las dos soluciones precursoras se mezclan por separado y, posteriormente, B se añade a A bajo agitación para ser homogenizada. Mediante este método se pueden obtener las SPION de un tamaño promedio de alrededor de 19 nm (Tabla 2), monodispersas y con un potencial zeta de -13 mV, por lo que le considera un método sencillo que no requiere equipos especiales y costosos, pero que no es muy eficaz, puesto que utiliza grandes cantidades de disolventes para producir pequeñas cantidades de NPM (Azhdarzadeh, et al., 2016; Banerjee, et al, 2010; Valencia-Barrón, 2013).
En cuanto a los diferentes métodos de sintetización, puede decirse que la descomposición térmica presenta una síntesis un tanto más compleja que la coprecipitación, puesto que requiere altas temperaturas, atmosferas controladas y reactivos más invasivos, perjudiciales y costosos, en tanto que con el método hidrotermal se genera una solución menos invasiva para el experimentador, ya que se puede conducir la reacción en soluciones acuosas minimizando el empleo de disolventes tóxicos. Asimismo, el método de microemulsión ofrece una alternativa sencilla para la sintetización de las NPM, aunque su relación costo-beneficio repercute directamente en el rendimiento.
Recubrimiento y funcionalización de nanopartículas magnéticas
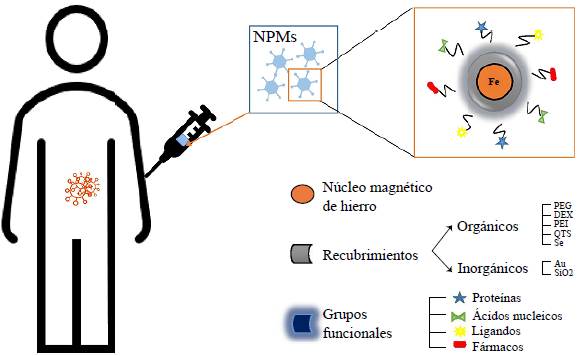
El recubrimiento y la funcionalización son pasos fundamentales para que las NPM puedan utilizarse en aplicaciones biomédicas una vez son sintetizadas. Para ello, su superficie debe modificarse con recubrimientos orgánicos o inorgánicos, con el fin de funcionalizarlas con moléculas específicas que les permitan unirse a células cancerosas para interactuar de manera localizada (Figura 3).
Los recubrimientos orgánicos más comunes incluyen polímeros como el polietilglicol (PEG), el dextrano (DEX), la polietilenimina (PEI), o el quitosano (QTS). Su principal función es recubrir la superficie de las nanopartículas para proteger el núcleo de Fe, evitando la aglomeración y oxidación al momento de ser sintetizadas, lo que las convierte en herramientas adaptables que pueden ser modificadas para que detecten compartimentos biológicos característicos como los de los ganglios linfáticos, los grupos sanguíneos, el hígado, etc. (Yigit, et al., 2012).
Entre todos los recubrimientos sobresale el polietilenglicol (PEG). Es el más empleado y proporciona un revestimiento eficaz que mejora la adhesión a las células cancerosas y la reduce frente a células normales. Además, mejora la biocompatibilidad de las nanopartículas y les da mayor estabilidad en ciclos de circulación sanguínea más largos. Asimismo, el PEG se emplea a menudo como vector genético para administrar plásmidos y ácidos nucleicos, incluidos los ARN de interferencia pequeños (ARNip) (Hu, et al., 2018; Liu, et al., 2019; Yin, et al, 2016).
Por otro lado, los recubrimientos inorgánicos, como la sílice (SiO2) y el oro (Au), también se emplean ampliamente, pues poseen la capacidad de estabilizar el núcleo magnético y reducir la corrosión y degradación de las nanopartículas. Uno de los beneficios adicionales del recubrimiento de oro es que no solo tiene una reactividad química muy baja, sino que también facilita la unión de fármacos y puede reducir la citotoxicidad (Azhdarzadeh, et al., 2016).
La funcionalización con proteínas como la triptorelina, una hormona liberadora de luteinizante, proporciona una adhesión 14 veces mayor a las células del cáncer de mama comparada con la de las células normales y facilita aún más la focalización celular específica (Hu, et al., 2018).
La alfafetoproteína (AFT) y la proteína de suero bovino (BSA) proporcionan una buena estabilidad y focalización, aunque la AFT presenta una mayor focalización hacia las células tumorales, con lo que se obtienen mejores resultados en el tratamiento del cáncer de páncreas (Gao, et al., 2017).
Por otra parte, entre los ligandos más empleados cabe mencionar el carbohidrato de E-selectina sialyl Lewis X (sLe X), que generalmente se usa para la detección temprana de metástasis, ya que marca y reconoce células cancerosas. Por último, el ácido fólico (AF) es uno de los candidatos preferidos para el direccionamiento activo de las nanopartículas. Este complejo de vitamina B con fuerte afinidad por el receptor de folato (RF) permite una funcionalización que mejora la captación de las nanopartículas en la superficie de las células cancerosas (Liu, et al., 2019; Soleymani, et al., 2020).
Principales propiedades magnéticas de las nanopartículas usadas en el tratamiento y el diagnóstico de cáncer
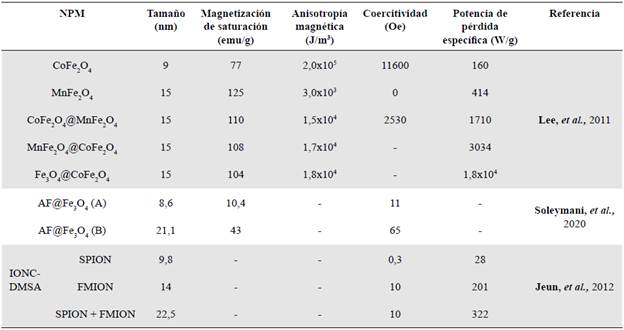
En la tabla 3 se presenta un resumen de las principales propiedades magnéticas: magnetización de saturación (Ms), coercitividad (Hc), anisotropía magnética (K) y potencia de pérdida específica (SLP).
Según Lee, et al. (2011), la magnetización de saturación reportada para las nanopartículas sin recubrimiento alcanza un valor de 104 emu/g, pero con la combinación entre las ferritas de cobalto y manganeso (Tabla 3) este parámetro disminuye a 110 emu/g, provocando una disminución en la magnetización de saturación.
Por otra parte, se ha reportado que la coercitividad con el CoFe2O4 presenta un valor máximo de 11600 Oe a una temperatura de 5 K, en tanto que al combinar con CoFe2O4@ MnFe2O4, este parámetro varía, ubicándose en 2530 Oe, lo que implica que se encuentran acopladas magnéticamente por intercambio.
En cuanto a la pérdida de potencia específica, en la combinación Fe3O4@CoFe2O4 se reporta un valor evidentemente alto, de 1,8 x 104 W/g, como se observa en la tabla 3. Esto implica que al combinar ferrita y cobalto se puede elevar significativamente la potencia de pérdida específica, lo que permite optimizar el tiempo de calentamiento de las nanopartículas para garantizar una destrucción eficaz de las células tumorales en un corto período de tiempo.
En lo que concierne a la anisotropía magnética, los valores obtenidos para las tres combinaciones oscilan entre 1,5x104 y 1,8x104 J/m3 y se encuentran dentro del rango óptimo para aplicaciones biomédicas (Lee, et al., 2011).
Soleymani, et al. (2020) reportan que tras haber sido sintetizadas, las nanopartículas AF@Fe3O4 (A) fueron sometidas a un tratamiento hidrotermal que indujo el crecimiento de las AF@Fe3O4 (B), con lo que se logró que las propiedades magnéticas, el tamaño y la eficacia del calentamiento aumentaran y mejoraran.
Después del tratamiento hidrotermal, las nanopartículas se alejan del régimen superparamagnético, lo que conlleva un aumento de la coercitividad, lográndose alcanzar un máximo valor en el estado ferromagnético de dominio único para luego disminuir. De ahí que cuando los valores magnetización de saturación y coercitividad aumentan, las nanopartículas se convierten en nanomateriales útiles para aplicaciones teranósticas, como en el caso de la combinación de la hipertermia (THM) y la resonancia magnética (IRM). Por ejemplo, las NPM con valores altos de coercitividad y magnetización de saturación generan una mayor intensidad de señal en las IRM (Soleymani, et al., 2020).
Las IONC recubiertas con ácido dimercaptosuccínico (IONC-DSMA) pueden crecer a partir de semillas, con lo que se obtienen diferentes tamaños y tres fases magnéticas diferentes: SPION puras, la fase ferrimagnética (FMION) y la combinación de ambas (Tabla 3). Las SPION puras tienen un valor de coercitividad cercano al 0 Oe, por ende, su pérdida de potencia específica también es baja, lo que limita críticamente la aplicación de hipertermia magnética (THM) debido a una menor pérdida de bucle de histéresis, en tanto que las FMION presentan un gran incremento de la coercitividad, lo que implica una fase ferrimagnética y una pérdida de potencia específica por encima de los 300 W/g, con un incremento frente a la fase anterior convirtiéndolas en ideales para aplicaciones biomédicas. Por último, en la fase mixta formada de SPION puras y FMION se presenta una potencia de pérdida específica ligeramente más baja (> 250 W/g), por lo que se concluye que a medida que aumenta el tamaño de la nanopartícula también lo hace su potencia de pérdida específica, dotándola de una capacidad de calentamiento ideal para la THM (Jeun, et al., 2012).
Tomando en cuenta que las propiedades magnéticas dependen de la composición química de las nanopartículas y del recubrimiento, cuando se añade un recubrimiento de liposomas poliméricos (PL) a las SPION se provoca una pérdida de magnitud de saturación, y sus bucles de histéresis aparecen insignificantes. Por otra parte, una nanopartícula de óxido de hierro sin recubrimiento presenta una magnetización de saturación de 77,5 emu/g, que al añadir un recubrimiento de PL, disminuye a 61,3 emu/g, en tanto que con un doble recubrimiento de polímero el valor es de 58,2 emu/g. Este es un claro ejemplo de la pérdida de magnetización se saturación debida a los recubrimientos, disminución que se ve compensada por la generación de nanopartículas más uniformes y la mejoría de las alteraciones de la superficie. Muchas de las formulaciones de nanopartículas de óxido de hierro estabilizadas con polímeros no presentan histéresis, lo que indica la naturaleza superparamagnética de los nanomateriales (Gómez-Sotomayor, et al., 2015; Liao, et al., 2011; Yallapu, et al., 2011).
En resumen, las propiedades magnéticas dependen del tamaño de la nanopartícula; cuanto más grande sea el núcleo, mejores serán sus propiedades magnéticas, lo que es deseable en los tratamientos, ya que estas aumentan de tamaño con su funcionalización sin que se alteren sus propiedades magnéticas, manteniendo el superparamagnetismo y, aunque su SLP y Ms disminuyen, ambas propiedades pueden seguir utilizándose en los tratamientos. Sin embargo, las nanopartículas de núcleos grandes no son adecuadas para el diagnóstico porque al ser funcionalizadas aumentan su tamaño, con lo cual disminuyen varias de sus capacidades magnéticas y se corre el riesgo de que sean capturadas por el sistema retículo endotelial o se vea comprometido su paso por el sistema circulatorio.
Aplicaciones biomédicas
El cáncer se considera una enfermedad maligna en la que se produce un desarrollo incontrolado de células anormales y la consiguiente formación de tumores capaces de diseminarse por todo el cuerpo y, en consecuencia, afectar las células y tejidos sanos. En Ecuador la tasa de incidencia es de 154,6 por cada 100.000 habitantes, lo que representa costos económicos sumamente altos para el sistema de salud (Bray, et al., 2018; Pointer, et al., 2021).
Actualmente los principales tratamientos utilizados son la cirugía, la radioterapia y la quimioterapia. Para la erradicación de cánceres locales, la elección principal es la cirugía y la radioterapia, seguida en algunos casos de compuestos quimioterapéuticos, sin embargo, estos adolecen de una falta de especificidad que da lugar a efectos secundarios graves debido a la destrucción simultánea e incontrolada de células sanas (Pérez-Herrero & Fernández-Medarde, 2015). En este contexto, las nanopartículas magnéticas dirigidas pueden proporcionar una mejor selectividad tumoral.
Las aplicaciones biomédicas de las NPM frecuentemente utilizadas son los óxidos de hierro, las ferritas de espinela y los metales puros como el hierro (Fe). En los artículos analizados sobresalen óxidos de hierro como la magnetita (Fe3O4) y la maghemita (y-Fe2O3) por sus propiedades magnéticas, buena biocompatibilidad y su fácil degradación en el organismo (Banerjee, et al., 2010; Farzin, et al., 2020; Ramos & Castillo, 2011).
Las nanopartículas más pequeñas se emplean para las IRM y la administración de fármacos, en tanto aquellas con núcleos más grandes se utilizan en la terapia de hipertermia magnética (THM).
Las NPM poseen una amplia gama de aplicaciones biomédicas, pero esta revisión se centró en cuatro de ellas (Figura 4) por sus resultados prometedores en la lucha contra el cáncer durante la última década. Además, el diagnóstico y la terapia se pueden combinar en una misma plataforma para lograr una mayor eficacia y menor toxicidad en los tratamientos (teragnosis). En la tabla 4 se presentan los resultados de los ensayos in vitro e in vivo de estas cuatro aplicaciones.
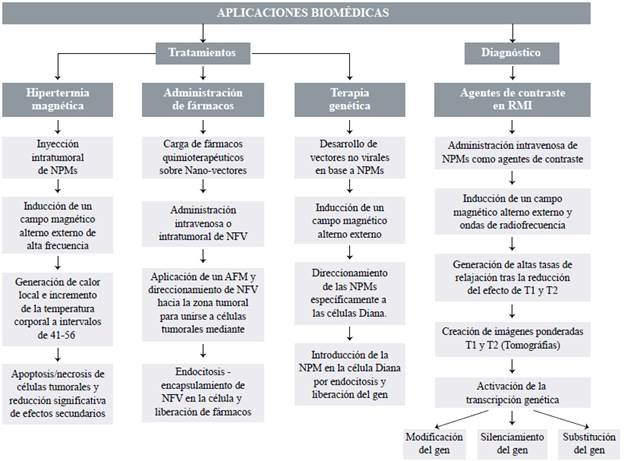
Figura 4 Procedimiento y administración de nanopartículas magnéticas en las principales aplicaciones biomédicas reportadas
Tabla 4 Principales resultados en ensayos in vivo e in vitro sobre la administración de NPM en aplicaciones biomédicas
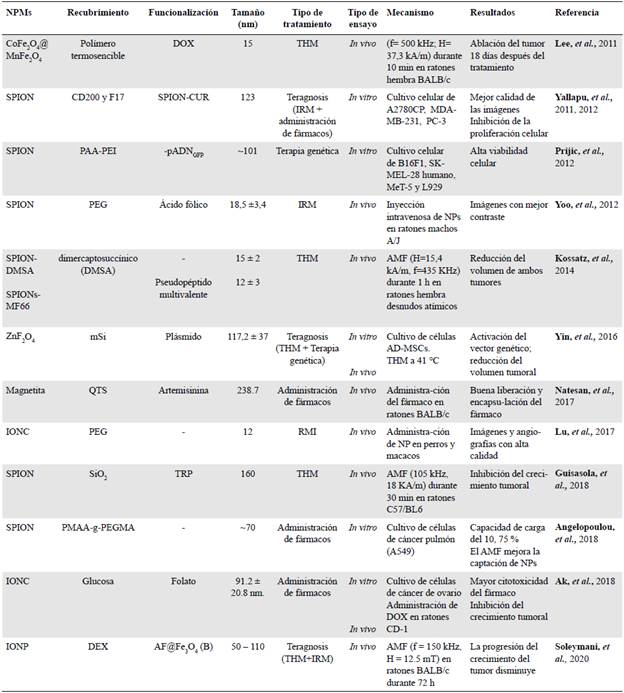
Hipertermia magnética (THM). Esta técnica se emplea mayormente como terapia adyuvante para prevenir la reaparición del cáncer. En el caso de las SPION y las IONC, su notable capacidad calorífica les permite convertir energía en calor, alterando los dominios dentro de sus núcleos y creando una reacción exotérmica que provoca apoptosis y necrosis en las células cancerosas, ya que estas son sensibles al calor (Fernández, 2013; Jeun, et al, 2012; Kossatz, et al, 2015).
En un estudio realizado con SPION recubiertas de DMSA, a las cuales unieron un pseudopéptido multivalente (N6L) y doxorrubicina (DOX), para determinar la capacidad destructiva y selectiva en un adenocarcinoma mamario en células MDA-MB-231 en ratones hembra desnudos atímicos, se observó que tras la aplicación de un campo magnético alterno (alternating magnetic field, AMF), se produjo un 85 % de muerte celular debido al mayor potencial de calentamiento generado, así como un 40 % de disminución de la masa tumoral mamaria. Además, la biocompatibilidad y la captación específica en el tejido tumoral fueron excelentes, lo que significa que es una terapia tolerable y eficaz con poca captación en el hígado (Kossatz, et al., 2014, 2015).
En otro estudio se aplicaron CoFe2O4@MnFe2O4 y DOX en ratones desnudos con células de glioblastoma (U87MG), lo que resultó en la ablación del tumor después de 18 días de inducir la THM, en tanto que el área tratada solo con DOX mostró una disminución significativa del volumen tumoral pero a los 18 días volvió a crecer (Lee, et al., 2011).
Asimismo, las nanopartículas de sílice mesoporosas causan una inhibición significativa del crecimiento tumoral con bajas dosis magnéticas 48 horas después de aplicar la THM sin un aumento general de la temperatura (Guisasola, et al., 2018).
Administración de fármacos. El diseño de nanoportadores permite una ruta de administración específica hacia el tejido tumoral de fármacos quimioterapéuticos como la doxorrubicina (DOX), la dapagliflozina (DAPA), la artemisinina, la β-lapachona (β-lap) y el 5-fluorouracilo (5-FU), evitando o reduciendo la cantidad de fármaco absorbido por las células sanas. Comúnmente, las IONP cargadas de fármacos inhiben significativamente el desarrollo de los tumores pancreáticos sin toxicidad. Debido a su pequeño tamaño (<50 nm), la retención en el peritoneo antes de ingresar a la circulación sistémica a través del sistema linfático es relativamente más prolongada y pueden ser eliminadas en 24 a 48 h (Gao, et al., 2017; Yigit, et al., 2012).
Un estudio con cultivos de células de cáncer de pulmón A549 evidenció que las nanopartículas con un núcleo de óxido de hierro magnético y un poli-injerto en poli (ácido metacrílico y metacrilato de etilenglicol, PMAA-g-PEGMA) sin fármaco tuvieron una citoxicidad <10 %, lo que demuestra una buena biocompatibilidad, en tanto que cargadas con el fármaco dapagliflozina (PMAA-g-PEGMA-DAPA) presentaron una citoxicidad dependiente de la concentración del farmaco. Al inducir un AMF debajo de la placa celular, la citoxicidad aumentó frente a las células A549, puesto que este induce una mayor tasa de captación de PMAA-g-PEGMA-DAPA por parte de las células cancerosas, produciendo un 10 % de apoptosis adicional (Angelopoulou, et al., 2018).
Por otra parte, las núcelas de SPION produjeron una acción sinérgica con p-lap, un nuevo fármaco contra el cáncer, por el estrés oxidativo que se genera cuando se liberan iones de hierro dentro de las células de cáncer de mama. Sin embargo, dicho efecto sinérgico no dio lugar a citotoxicidad significativa y más del 80 % de las micelas de SPION se localizaron en endosomas tardíos y lisosomas (Huang, et al., 2013).
En un estudio reciente, un nanoportador compuesto por Fe3O4 (GNP) y cargado con DOX (DGNP), recubierto de glucosa y funcionalizado con ligandos de folato, se dirigió específicamente al RF sobreexpresado en células de cáncer de ovario (A2780, SKOV3 y OVCAR3), lo que permitió una liberación controlada del fármaco con mayor citotoxicidad en las células cancerosas. En el mismo estudio se inoculó DOX y DGNP en ratones hembras desnudos CD-1 con células de cáncer de ovario (SKOV3) y se observó una inhibición del 86 % del crecimiento tumoral. Por la focalización magnética y la unión específica al RF, este resultó ser un importante tratamiento tumoral, reduciendo drásticamente los efectos secundarios, pues el fármaco se acumuló específicamente en la zona tumoral y, por lo tanto, la captación de DGNP en el hígado y el pulmón disminuyó, a diferencia de lo reportado para el grupo tratado solo con DOX, que presentó una focalización deficiente con acumulación principalmente en el bazo, el hígado y los pulmones (Ak, et al., 2018).
En otro estudio se diseñó un nanoportador formado por quitosano y magnetita y cargado con artemisinina, un fármaco antipalúdico y anti-angiogénico, para apuntar a las células de cáncer de mama (4T1) en ratones BALB/c mediante la aplicación de un AMF. El nanoportador ofreció una encapsulación del 55 al 62,5 % y una liberación controlada del fármaco del 62 al 78 % en el tumor, con baja toxicidad para las células sanas, pues se evitó la acumulación inespecífica gracias al campo aplicado (Natesan, et al., 2017).
Por otra parte, para transportar magnéticamente 5-FU y DOX se empleó un nuevo diseño de nanopartículas consistente en un núcleo de Fe cubierto con una capa de magnetita y PEG (Fe-Fe3O4-PEG). Los estudios de rendimiento indicaron que después de 43 h se liberó el 90 % de DOX en el área del tumor con un efecto quimioterapéutico satisfactorio incluso en bajas concentraciones, en tanto que el 5-FU se liberó más lentamente, por debajo del 13 %, durante el mismo periodo de tiempo, lo cual se debe a la atracción hidrófoba entre las cadenas de PEG y DOX, ya que DOX posee una carga positiva y 5-FU negativa, es decir, es un ácido débil (Gómez-Sotomayor, et al., 2015).
Agentes de contraste en imágenes de resonancia magnética
En la detección del cáncer por imagen, las nanopartículas están emergiendo como potentes agentes de contraste, ya que reducen la relajación longitudinal (T1) y transversal (T2), produciendo imágenes ponderadas en T1 (tejidos blandos y grasas) y T2 (tumores e inflamaciones) con buena resolución espacial y mejor contraste que los agentes quelantes de gadolinio, lo que permite la diferenciación entre tejidos sanos y enfermos (Banerjee, et al., 2010). Por ejemplo, gracias a sus propiedades superparamagnéticas, la SPION presenta una alta relaxividad, generando así un fuerte contraste T2 que mejora la visualización de cualquier anomalía (tumores, ganglios linfáticos y metástasis) (Azhdarzadeh, et al., 2016).
Por otra parte, las USPION se han ensayado de manera segura como agentes de contraste en ensayos in vivo gracias a su pequeño tamaño, cerca de 50 nm, que hace difícil su captación por el sistema retículo endotelial, con un tiempo de circulación sanguínea de hasta 24 h (Lim, et al., 2011; Liu, et al., 2019).
A continuación, se presentan diversos estudios in vitro e in vivo en los que se han ensayado varias combinaciones de nanopartículas para obtener una mejor y más eficiente visualización de células y masas tumorales.
En uno se evidenció que al emplear nanopartículas de SPION unidas a liposomas poliméricos (PLs) y ligandos de folato (SPION-PLs-folato) como agentes de contraste en cultivos de células de carcinoma cervical (HeLa), se obtuvieron imágenes ponderadas de alta calidad. Además, la funcionalización con folato permitió obtener ligandos que reconocieron las proteínas de unión sobreexpresadas en la superficie de las células HeLa, y un tropismo más directo con una mejor interacción celular, así como una baja citoxicidad para las células sanas y una alta biocompatibilidad (Liao, et al., 2011).
En otro estudio un recubrimiento de Au funcionalizado con aptámeros de oligo-nucleótidos modificados con tiol (MUC-1), utilizado como agente blanco permitió que la SPION tuviera un alto potencial como agente de contraste, proporcionando una mejora significativa del contraste in vitro a partir del cultivo de células de cáncer de colon (HT-29), con baja citotoxicidad, alta captación celular y mayor viabilidad en bajas concentraciones (Azhdarzadeh, et al., 2016).
En el estudio se formaron nanopartículas de PEG unidas a SPION (PEG-SPION) conjugadas con folato (AF-PEG-SPION), las cuales se inocularon como agentes de contraste en ratones macho A/J. Se observó que las imágenes con mejor contraste se lograban con las AF-PEG-SPION, ya que la captación intracelular se vio fuertemente inhibida por la endocitosis mediada por el receptor de ácido fólico (Yoo, et al., 2012).
Asimismo, para la detección de metástasis de xenoinjertos de carcinoma nasofaríngeo en ratones desnudos BALB/C se empleó USPIO-PEG como agente de contraste, la cual al fusionarse con un ligando sialyl Lewis X (sLe X), mejoró el contraste negativo en las imágenes, ya que el sLe X permitió la detección temprana del carcinoma nasofaríngeo, así como una determinación más precisa del estadio y un mejor seguimiento del tratamiento (Liu, et al., 2019).
Con el objetivo de determinar la seguridad y la biocompatibilidad, se realizaron estudios in vivo en una población de conejos, perros Beagle y macacos, a los cuales se les administraron por vía intravenosa nanopartículas PEG-IONC. Como resultado, se obtuvieron imágenes ponderadas de alta calidad y angiografías arteriales de todo el cuerpo en conejos y perros Beagle, en tanto que en los macacos fue posible obtener una angiografía del sistema vascular de la parte superior del cuerpo con alta resolución espacial. Es decir que las nanopartículas de PEG-IONIC arrojaron imágenes mejoradas de la IRM, así como hipoperfusión y restricción de la difusión; además, tuvieron menos efectos secundarios que los agentes de contraste de gadolinio (Gd+3), los cuales suponen un riesgo para personas que sufren de insuficiencia renal grave (Lu, et al., 2017).
Terapia genética
El desarrollo de vectores no virales a base de nanopartículas ha permitido solucionar los problemas de toxicidad y focalización que presentan actualmente los vectores virales, ya que las nanopartículas proporcionan un transporte seguro y la transferencia de genes específica y controlada a las células diana. Específicamente las SPION y las ferritas se diseñan frecuentemente como nanoportadores que brindan protección al gen y permiten una transfección eficiente al aplicar un AMF. Además, las ferritas de zinc (ZnFe2O4) con alta magnetización de saturación se emplean a menudo para activar células madre en el cáncer de ovario (Lee, et al., 2012; Yin, et al., 2016; Zaimy, et al., 2017).
En un estudio realizado con SPION recubiertas con una bicapa polimérica compuesta de ácido poliacrílico y polietilenimina (PAA y PEI) en combinación con ADN plasmídico que codifica la proteína verde fluorescente (GFP) (SPIONs-PAA-PEI-pDNAGFP), la magnetofección estudiada en cuatro líneas celulares fue superior a los kits de SPION comerciales en términos de eficacia de transfección. Además, se evaluó la citotoxicidad en las líneas celulares mencionadas con SPIONs-PAA-PEI y SPIONs-PAA-PEI-pDNAGFP, y se encontró que reducían la supervivencia celular en un 80 y un 70 %, respectivamente (Prijic, et al., 2012).
Por otra parte, con la terapia genética se obtuvieron células madre derivadas del tejido adiposo (AD-MSC) mediante cultivo celular aplicando hipertermia con una placa magnética de Nd-Fe-B. Estas células se encontraban unidas a nanopartículas formadas por ferritas de Zn, recubiertas por sílice mesoporosa (MCNP) y unidas a PEI (MCNP-PEI), lo que les confiere la capacidad de administrar y activar un vector genético inducible por calor que codifica una forma secretable del ligando generador de apoptosis (TRAIL). El recubrimiento de la nanopartícula con PEI facilitó la complejación con el plásmido formado, redujo la citotoxicidad, mejoró la eficacia de transfección y aumentó la biocompatibilidad. Además, después de la transfección de AD-MSC con complejos MCNP-PEI/plásmido, las células de cáncer de ovario (A2780) expuestas a una THM leve (41 °C) mostraron una disminución del 40 % en la viabilidad celular debido la secreción de TRAIL y se produjo la apoptosis al unirse a receptores de muerte celular, como el DR4 y el DR5, expresados en la superficie de las células. Más aun, el volumen tumoral se redujo en un 50 % (Yin, et al., 2016).
En otro estudio se desarrollaron SPION térmicamente reticuladas (TL) unidas a PEI (bPEI-TCL-SPION) para la liberación del gen supresor de tumores p53 en células HUVEC por magnetofección. El gen P53 se liberó en las células y se activó iniciando un programa de transcripción mediado por una señal de estrés que le permitió inducir apoptosis mediante transactivación genética. Simultáneamente, se rastrearon mediante IRM en las que es evidente que el contraste negativo mejoró al aumentar la concentración de bPEI-TCL-SPION en las células tratadas. Se demostró así que este nanoportador puede emplearse de manera eficiente en el suministro de genes supresores (Lee, et al., 2012).
Las nanopartículas multifuncionales pueden formar sistemas teragnósticos. Por ejemplo, la SPION con recubrimiento de P-ciclodextrina (CD200) y polímero plurónico (F127) permite verificar mediante IRM la eficacia de la administración de fármacos como la curcumina (CUR), la cual mejora la capacidad de carga farmacéutica y captación en las células tumorales gracias a los recubrimientos empleados. Se mejora, asimismo, la capacidad de la CUR de controlar la proliferación del cáncer ovárico, del mamario y el prostático (Yallapu, et al., 2011, 2012).
También se encontró que la combinación de THM e IRM con AF@F3O4 dirigidos a células de cáncer mamario en ratones BALB/c permitió mejorar el contraste en la IRM, en tanto que el tratamiento en los tumores después de aplicar la THM produjo un ligero aumento del volumen en comparación con los no expuestos a THM (Soleymani, et al., 2020).
Ventajas y desventajas de las nanopartículas magnéticas en el tratamiento y diagnóstico del cáncer
En cuanto al tratamiento del cáncer, los estudios reportan una ventaja importante relacionada con el tamaño de la nanopartícula, siendo un factor fundamental para el tiempo de circulación medio en la sangre, pues las más pequeñas tienen un mayor tiempo de circulación sanguínea, además de que el tamaño desempeña un papel determinante en sus propiedades físicoquímicas y biológicas. Además, aquellas suficientemente pequeñas se convierten en superparamagnéticas, con capacidad de magnetizarse solamente en presencia de un AMF. Sin embargo, un tamaño muy pequeño puede ser una desventaja, ya que la nanopartícula puede perderse fácilmente al ingresar al organismo o ser filtrada directamente por los riñones, de ahí que se haya establecido un rango óptimo que oscila entre 10 y 100 nm para aplicaciones biomédicas in vivo (Lim, et al., 2011; Ramos & Castillo, 2011).
Otra desventaja se relaciona con la administración de la inyección intravenosa de nanopartículas, ya que únicamente alrededor del 1 % del material magnético alcanza el área de interés, por lo que se requieren altas dosis para liberar suficiente calor, por ejemplo cuando se emplea la THM, por lo que en la mayoría de estudios se inyectan directamente las nanopartículas en la zona tumoral para aprovecharlas al máximo. Cuando se analiza el ligando generador de apoptosis, el TRAIL, se ve que las nanopartículas aún tienen dificultad para entregar plásmido al tumor, más aun cuando se ha producido metástasis, por lo que todavía no se puede considerar una terapia efectiva para probarla en ensayos en humanos en el marco de los sistemas de salud convencionales (Guisasola, et al., 2018; Yin, et al., 2016).
Conclusión
En la actualidad las NPM en el campo médico tienen varias aplicaciones, entre las que se destacan cuatro como las principales: la hipertermia magnética, la administración de fármacos, los agentes de contraste y la terapia genética, cuyos avances se centran en un uso combinado de las terapias (teragnosis) que han demostrado ser eficaces contra el cáncer.
Por sus propiedades superparamagnéticas y su baja toxicidad, las SPION son las más investigadas, representando el 31 % de los estudios aquí analizados, ya que poseen la capacidad de magnetizarse en presencia de un campo magnético externo alterno, son excelentes nanoportadores para la administración de fármacos quimioterapéuticos y suministro de genes y, además, su capacidad de calentamiento produce altas tasas de muerte en células cancerosas reduciendo drásticamente el volumen tumoral.
Asimismo, se han utilizado con éxito como agentes de contraste que mejoran significativamente las imágenes ponderadas en resonancia magnética. Por otra parte, la eficacia terapéutica de estos tratamientos está relacionada con la toxicidad de las nanopartículas cuando ingresan al sistema biológico, de ahí la importancia de los recubrimientos. Sin embargo, tras el análisis de los resultados, no se reportaron riesgos significativos relacionados con las pruebas in vivo. En cuanto a los beneficios más significativos, se pueden mencionar la disminución de los efectos secundarios, una mejor focalización, pues son tratamientos guiados hacia la zona tumoral, la necesidad de menos dosis de los fármacos terapéuticos y un menor tiempo de duración del tratamiento.
A pesar de los buenos resultados, es importante continuar la investigación para dar solución a problemas como la dificultad de controlar el tamaño de las nanopartículas durante la síntesis; la necesidad de encontrar o mejorar algún método que permita obtenerlas de un solo tamaño, lo que mejoraría significativamente la eficacia de los tratamientos debido a que todas tendrían las mismas propiedades, y una mayor efectividad y menor toxicidad en los tratamientos actuales de cáncer con el diseño de nuevas nanopartículas que permitan su uso en la medicina convencional. De hecho, las nuevas tecnologías de síntesis de nanopartículas Janus pueden llegar a ser las más utilizadas, pues poseen más de un compartimento, lo que las hace versátiles a la hora de la aplicación de diferentes tratamientos de cáncer y son las favoritas para futuras investigaciones (Feng, et al., 2019; Lattuada & Hatton, 2011).