Introducción
Las características fisicoquímicas del agua en un río están dadas por variables ambientales específicas del sitio como la temperatura, la precipitación, la humedad, el viento, la nubosidad y la evaporación, así como por aspectos que determinan su geomorfología, como la solubilidad de las rocas, la cantidad de materiales en suspensión y el tipo de sustrato (Welcomme, 1992; Allan & Castillo, 2007). Las especies se distribuyen por zonas de acuerdo con el gradiente longitudinal del río, lo que permite la asociación de especies íntimamente relacionadas con la geomorfología o con discontinuidades de las condiciones abióticas y la estructura del hábitat (Esselmen, et al., 2006). Estas zonas están determinadas por el patrón de comportamiento de variables como la velocidad de la corriente, los tipos de fondo, la cantidad de oxígeno disuelto, la temperatura del agua, la luz, la vegetación riparia y la del río (refugio), y, de forma sistémica, por la aparición de potenciales depredadores e interacciones con otras especies (Granado-Lorencio, 1995). Las comunidades de peces en un río funcionan como indicadores de su calidad y salud, tanto así que su declinación constituye un indicador negativo de la influencia humana en el ecosistema (Mueller & Pyron, 2010), la cual puede producir, por ejemplo, la disminución considerable del caudal debido a la creación de presas o las sequías producidas por la desviación del cauce para el riego de cultivos, así como procesos físicos y biológicos perturbadores como las tormentas e inundaciones. En este sentido, es necesario determinar la abundancia relativa y la distribución de estas comunidades y establecer su relación con factores bióticos y abióticos que inciden en el tamaño de sus poblaciones (Oliveira & Pessanha, 2014; Montoya-Ospina, et al, 2018), pues se sabe que las relaciones de las variables y parámetros fisicoquímicos en los ríos, por ejemplo, las existentes entre el caudal y el flujo de agua y la temperatura y el pH, pueden influir en la distribución y abundancia de las especies (Resh, et al., 1988; Wootton, 1990; Montoya-Ospina, et al., 2018).
La información disponible acerca de la composición de la ictiofauna del río Córdoba de la Sierra Nevada de Santa Marta (SNSM) se recoge en el estudio de López & Pulido (2002); los autores reportaron diez especies pertenecientes a cinco órdenes, ocho familias y nueve géneros. Sin embargo, estos resultados son el producto de muestreos realizados a 500 m s.n.m. y no se tienen datos de la zona baja.
La fluctuación del régimen pluvial de la región Caribe colombiana tiene incidencias en la estructura y composición de la fauna íctica a nivel temporal y espacial. En época seca los niveles de los ríos de la SNSM descienden abruptamente, casi hasta secarse, por lo que se plantea la hipótesis de que existe variación espacial y temporal en la estructura y composición de río Córdoba. En este contexto, el presente estudio tuvo como objetivo determinar la estructura y composición de la ictiofauna presente en el tramo bajo del río Córdoba de la SNSM, establecer los posibles patrones y relaciones de los parámetros fisicoquímicos y el tipo de sustrato a nivel espacial y temporal.
Materiales y métodos
Area de estudio
El estudio se llevó a cabo en el río Córdoba (Figura 1) (10°59'N, 74°14'W y 11°5'N, 73°59'W) que corre por las vertientes noroccidental y suroriental de la SNSM, en la cuchilla de San Lorenzo, departamento del Magdalena, Colombia.
Fase de campo
Se seleccionaron cuatro estaciones en el tramo del río: la primera en la desembocadura (11°02'33,6" N - 74°14'32,2" W), la segunda en Papare (11°01'02,1" N- 74°13'02,7" W), la tercera en Cordobita (11°02'02,1" N - 74°13'10,0" W) y la cuarta, arriba (11°01'10,0" N- 74°11'53,7" W). Los muestreos se hicieron en época de lluvias (septiembre-noviembre de 2017) y de sequía (diciembre de 2017- abril de 2018), en remansos y rápidos. Para recolectar los peces se usaron dos atarrayas de diferente ojo de malla y una red de arrastre de 4 m con ojo de malla de 1 cm de diámetro. Después de las capturas se midieron in situ las variables fisicoquímicas de pH, conductividad, oxígeno disuelto y temperatura del agua con una celda multiparámetro WTW (Multi 3630 IDS SET F); asimismo se hizo una valoración cualitativa de la vegetación riparia a cada lado del río y se midió el caudal estimando la profundidad, el largo y el ancho de cada sector de muestreo del río con una varilla métrica (Rondan, 2017), en tanto que la velocidad de la corriente se calculó utilizando la técnica del flotador.
Fase de laboratorio
Los peces fueron identificados con las claves de Dahl (1971), Maldonado-Ocampo, et al., (2005), Nelson (2016) y la actualización de Fricke, et al. (2021) y luego se trasladaron a la planta piloto pesquera de la Universidad del Magdalena ubicada en el corregimiento de Taganga (Santa Marta) para su conservación.
Representatividad del muestreo
Esta se evaluó estimando el número de especies esperadas mediante la curva de acumulación de especies empleando los estimadores Chao 1, ACE y Cole y el programa EstimateS 9.0 (Colwell, 2013).
Distribución de abundancias
Con base en la presencia y abundancia total de cada especie en los sitios de muestreo, se estimó la frecuencia de aparición y se verificó su ajuste a los modelos teóricos de abundancia de serie geométrica, log-normal y vara quebrada de MacArthur (Moreno, 2001; Magurran, 2004). Para determinar cuál de estos explicaba mejor la distribución de los datos, se utilizó la prueba de bondad de ajuste de ji al cuadrado.
Abundancia relativa
La abundancia relativa (AR%) se determinó a partir del número de individuos recolectados de cada especie y su relación con el número total de individuos de la muestra. Este parámetro se calculó para establecer la importancia y la proporción de las especies con respecto a la comunidad en las dos épocas evaluadas utilizando la siguiente fórmula: AR= (ni / N) x 100, donde AR corresponde a la abundancia relativa de la especie i; ni al número de individuos de la especie capturados u observados, y N al número total de individuos capturados u observados. La abundancia relativa se evaluó con base en las categorías establecidas por Lasso, et al. (1995) como especies escasas (E): <5; poco comunes (PC): 5-20; comunes (C): 21-40; abundantes (A): 41-60, y muy abundantes (MA): 61-100.
Estructura y composición de la ictiofauna en el tramo bajo del río
Para determinar la relación entre los peces y el sustrato se utilizó un análisis de componentes principales (ACP) considerando la presencia (uno) y ausencia (cero) de rocas, piedras, guijarros, grava, arena gruesa, arena fina, limo, materia orgánica en descomposición (hojarasca) y vegetación acuática en cada estación de muestreo. Asimismo, se hizo un análisis de correspondencia canónica (ACC) para determinar la correlación entre los parámetros fisicoquímicos y la composición de especies observadas, para lo cual se construyó otra matriz tomando los datos de abundancia de las especies en cada estación de muestreo. Para cumplir con los supuestos de homogeneidad de varianzas, los datos de abundancia para el ACC se ajustaron y transformaron a √ (x+1), y las variables del hábitat, a Log (x+1) (Zar, 1999). Todos los análisis multivariados se hicieron con el programa estadístico Past-Program® 3.0 (Hammer, et al., 2001).
Se calcularon los índices de composición del sustrato (S) y complejidad estructural de hábitat según Winemiller, et al. (2008), los cuales estandarizaron el índice (S) por medio de la siguiente formula:  , donde S corresponde a los índices de composición del sustrato y complejidad estructural del hábitat; xi representa cada uno de los componentes del sustrato y estructura del hábitat en cada estación muestreo, y N, el número de componentes combinados o estructura del hábitat observado en las estaciones de muestreo; los valores cercanos a 0 indican la mínima complejidad y a 1, la máxima (Winemiller, et al., 2008).
, donde S corresponde a los índices de composición del sustrato y complejidad estructural del hábitat; xi representa cada uno de los componentes del sustrato y estructura del hábitat en cada estación muestreo, y N, el número de componentes combinados o estructura del hábitat observado en las estaciones de muestreo; los valores cercanos a 0 indican la mínima complejidad y a 1, la máxima (Winemiller, et al., 2008).
Para medir la diversidad a nivel espacial se hallaron los números efectivos de especies o números de Hill con la ecuación denominada qD (Jost, 2006): qD 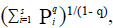 donde qD es la diversidad; pi es la abundancia relativa de la especie i, es decir, la abundancia de la especie i dividida entre la suma total de abundancia de las especies que integran la comunidad, y el exponente q es el orden de la diversidad. El exponente q determina la sensibilidad del índice frente a la abundancia relativa de las especies y tiene tres componentes: la diversidad del orden cero (q = 0), el cual es sensible a las abundancias de las especies, y con el cual se obtiene el valor equivalente a la riqueza de las especies; la diversidad de orden 1 (q = 1), que incluye todas las especies con un peso exactamente proporcional a su abundancia en la comunidad y tiene en cuenta las especies comunes, y los valores de q mayores a 1 (q = 2), los cuales contemplan las especies dominantes (Hill, 1973). Para estos cálculos se utilizó el paquete estadístico PRIMER + 6 versión 1.0.1 (Clarke & Warwick, 2006).
donde qD es la diversidad; pi es la abundancia relativa de la especie i, es decir, la abundancia de la especie i dividida entre la suma total de abundancia de las especies que integran la comunidad, y el exponente q es el orden de la diversidad. El exponente q determina la sensibilidad del índice frente a la abundancia relativa de las especies y tiene tres componentes: la diversidad del orden cero (q = 0), el cual es sensible a las abundancias de las especies, y con el cual se obtiene el valor equivalente a la riqueza de las especies; la diversidad de orden 1 (q = 1), que incluye todas las especies con un peso exactamente proporcional a su abundancia en la comunidad y tiene en cuenta las especies comunes, y los valores de q mayores a 1 (q = 2), los cuales contemplan las especies dominantes (Hill, 1973). Para estos cálculos se utilizó el paquete estadístico PRIMER + 6 versión 1.0.1 (Clarke & Warwick, 2006).
Para determinar si existía una diferencia estadística significativa a nivel espacial y temporal de la diversidad en los sectores de muestreo y en las épocas evaluadas, así como entre las variables fisicoquímicas, se aplicó un ANOVA de Friedman después de una prueba de Tukey, dado que los datos no cumplieron los supuestos de normalidad; estos fueron evaluados con la prueba de Shapiro Wilk con el programa estadístico Past-Program® 3.0 (Hammer, et al., 2001). Se consideró un nivel de significación del 5 %.
Resultados
Características del hábitat
El río es de aguas claras con flujo continuo en época de lluvias y, aunque en época seca los niveles descienden, la corriente se mantiene. Se presentan dos biotopos bien característicos: los remansos con velocidades medias de corriente (desembocadura y Papare), y los rabiones, que presentan zonas con rápidos de corriente y bajas profundidades caracterizadas por sustrato rocoso (Cordobita y arriba).
Se diferenciaron tres sectores: una zona baja, correspondiente a la desembocadura, donde el río drena sus aguas directamente al mar Caribe (municipio de Ciénaga); allí la vegetación riparia está conformada por pocos arbustos de higuereta (Ricinus communis), dividivi (Caesalpina coriria), banano (Musa paradisiaca) y Cecropia sp, por lo que recibe totalmente la entrada de luz. El hábitat es de remansos, con sustrato formado por arena fina, limo o fango, vegetación acuática asociada a madre vieja conformada por enea (Typha dominguensis), carrillo (Phragmites australis), tarulla (Eichhornia crassipes) y Heliconia sp, lo que brinda hábitats y recursos a la fauna íctica. El oxígeno disuelto presentó valores bajos comparados con las zonas media y alta (6 mg/l), mayores valores de conductividad (117,5 μS/cm), pH básico (7,5) y temperatura alta (27,1 °C).
La zona media (Papare y Cordobita) presentó las siguientes características: vegetación riparia, conformada por higuereta y árboles de guacamayo (Albizia niopoides), y abundante plantación de mango (Mangifera indica) y M. paradisiaca. El hábitat está conformado principalmente por remansos con presencia de rápidos sobre un sustrato constituido por cantos rodados, grava, piedras y materia orgánica en descomposición. En este sector hay una fuerte intervención antrópica, pues en varios sectores del río hay extracción de arena y se capta agua para el riego de cultivos de las fincas bananeras aledañas. El oxígeno disuelto registró valores similares a los de la zona baja (6,3 mg/l), menor valor de conductividad (105,53 μS/cm), pH ácido (6,1) y menor temperatura (25,4°C) que la zona baja.
En la zona alta (arriba) la vegetación está conformada por caracolí (Anacardium excelsum), guamacho (Pereskia guamacho), higuereta, orejero (Enterolobium cyclocarpum), Cecropia sp, y también hay sectores de suelo desnudo. Al borde del cauce se encuentran plantaciones tecnificadas de M. paradisiaca. El hábitat está conformado por remansos y rápidos, y el sustrato corresponde a cantos rodados, arena, grava, piedras, rocas y vegetación acuática en el cauce. Se registraron valores de oxígeno disuelto altos comparados con los sectores medio y bajo (7 mg/l), un pH básico (7), conductividad de 99 μS/cm y temperaturas bajas (24,8 °C) en comparación con las zonas baja y media.
Parámetros fisicoquímicos según las temporadas climáticas
Las características físicas de las estaciones en época de lluvias evidenciaron un cauce más ancho (27 m), profundo (74 cm) y con mayor caudal (4,65 cm3.s) en la desembocadura, y menos ancho (12,42 m), profundo (36,75 cm) y caudaloso (3,2 cm3.s) arriba; por el contrario, la corriente fue más rápida arriba y en Cordobita (0,47 m/s), pero lenta en la desembocadura (0,73 m/s). En época seca la cuenca fue más ancha en Papare (22,84 m) y menor en la desembocadura (9,26 m), y más profunda en Cordobita (48,65 cm); el mayor caudal se registró en Papare (3,12 cm3.s) y el menor en Cordobita (2,14 cm3.s); la corriente fue más rápida en Cordobita (0,21 m/s) y lenta en Papare (0,37 m/s). El ANOVA de Friedman y la prueba de Tukey no mostraron diferencias significativas entre la profundidad (70,25±15,95 cm durante las lluvias y 42,37±6,51 cm durante la sequía), pero sí entre la velocidad de la corriente (0,53±0,13 m/s durante las lluvias y 0,26±0,05 m/s durante la sequía) (p<0,05), el caudal (4,05±0,62 cm3/s durante las lluvias y 2,7±0,48 cm3/s durante la sequía) y el ancho (22,02±20,78 m durante las lluvias y 15,3±6,2 m durante la sequía).
En cuanto a las variables fisicoquímicas en época de lluvias, la desembocadura presentó los valores más altos de temperatura (26,7 °C) y conductividad (128,37 μS/cm), y menos oxígeno disuelto (6,1 mg/l) y pH (6,38); la estación de arriba mostró los valores más bajos de temperatura (25,1 °C), conductividad (103,72 μS/cm) y pH (6,5), y valores altos de oxígeno disuelto (6,8 mg/l). En la época seca los valores de temperatura (27,5 °C) y conductividad (106,7 μS/cm) también fueron mayores en la desembocadura; el oxígeno disuelto fue mayor en la estación de arriba (6,8 mg/l) y menor en Papare (5,6 mg/l), con un pH básico en todas las estaciones. Los valores de las variables fisicoquímicas en el tramo bajo del río Córdoba durante la temporada de lluvias y la sequía no mostraron diferencias significativas (p>0,05) en la temperatura (26,02±0,67°C durante las lluvias y 25,5±1,4°C durante la sequía), la conductividad (108,76±13,13 μS/cm durante las lluvias y 103,72±14,82 μS/cm durante la sequía) y el oxígeno disuelto (6,48±0,29 mg/l durante las lluvias y 6,2±0,5 mg/l durante la sequía), pero sí hubo diferencias en el pH (6,43±0,08 durante las lluvias y 7,7±0,71 durante la sequía).
Representatividad del muestreo
El número total de especies (S) en el río Córdoba en las épocas de lluvias y de sequía fue de 27, resultados concordantes con el 95 % del valor esperado según el estimador de riqueza Chao 1, y con el 95,7 % según los estimadores ACE y Cole; la curva de singletons mostró una tendencia a descender y la de doubletons, un comportamiento asintótico que evidenció la buena representatividad del muestreo (Anexo 1S, https://www.raccefyn.co/index.php/raccefyn/article/view/1409/3197).
Modelos de abundancia
En la desembocadura el río se ajustó al modelo log-normal (X 2: 1,50; p: 0,02), Cordobita (X 2: 24,1; p: 0,004), Papare (X 2: 1,69; p: 0,42) y arriba (X 2: 18,8; p: 0,004) se ajustaron al modelo de serie geométrico (Anexo 2S, https://www.raccefyn.co/index.php/raccefyn/article/view/1409/3197).
Composición de la ictiofauna presente en el tramo bajo del río
Se capturaron 948 individuos (692 en época de lluvias y 256 en sequía) distribuidos en 11 órdenes, 14 familias, 24 géneros y 27 especies (Tabla 1). Los órdenes Characiformes, Gobiiformes y Perciformes fueron los más representativos, en tanto que se recolectaron 14 especies (51,85 %) consideradas de agua dulce, 11 (42,30 %) estuarinas, y dos (7,9 %) marinas, las cuales eventualmente ingresan al río. Durante la época de lluvias se capturaron especímenes de seis órdenes, 10 familias y 21 especies, y en época seca, de ocho órdenes, 12 familias y 19 especies. Además, se capturaron más especies estuarinas en época de lluvias que en época seca. El ANOVA de Friedman y la prueba de Tukey no evidenciaron diferencias significativas entre el número de individuos (p=0,05) ni el de especies (p>0,05). Al comparar el número de especies en las dos temporadas, se encontraron diferencias significativas a nivel espacial. Las estaciones de Papare (225 especímenes en época de lluvias versus 43 en época seca) y Cordobita (256 especímenes en época de lluvias versus 34 en época seca) registraron diferencias significativas (p<0,05) en el número de individuos.
Tabla 1 Composición y abundancia de la ictiofauna del tramo bajo de río Córdoba. (Ll) lluvias, (S) sequía, (Ab) abundancias

La abundancia relativa de las especies presentó algunas variaciones entre épocas. Las especies más frecuentes durante la época de lluvias (Tabla 2) fueron Psalidodon fasciatus (24,1), Hemibrycon jabonero (16,59), Geophagus steindachneri (11,69) y Creagrutus affinis (8,08), que en total acumularon el 76 %, en tanto que en época seca (Tabla 3), las más frecuentes fueron Mugil curema (22,1), Sturisomathicthys panamense (17,9), C. affinis (21,1) y P fasciatus (12,9), con un 75 % del total de las capturas.
Tabla 2 Abundancia total (AT), abundancia relativa (AR), y categoría de las especies capturadas en el tramo bajo de río Córdoba en época de lluvias. Categorías: escasa (E), poco común (PC), común (C)
| Especies | AT | AR | C |
|---|---|---|---|
| P. fasciatus | 167 | 24,10 | C |
| H. jabonero | 115 | 16,59 | PC |
| C. affinis | 56 | 8,08 | PC |
| R. dayi | 12 | 1,73 | E |
| A. latifrons | 41 | 5,92 | E |
| G. Steindachneri | 81 | 11,69 | PC |
| O. niloticus | 2 | 0,29 | E |
| K. umbrifer | 4 | 0,58 | E |
| C. kraussii | 4 | 0,58 | E |
| S. antillarum | 5 | 0,72 | E |
| A. banana | 21 | 3,03 | E |
| E. pisonis | 8 | 1,15 | E |
| D. maculatus | 6 | 0,87 | E |
| Caranx sp | 8 | 1,15 | E |
| C. undecimalis | 3 | 0,34 | E |
| P. croco | 8 | 1,15 | E |
| M. incilis | 13 | 1,88 | E |
| D. monticola | 16 | 2,31 | E |
| H. hondae | 2 | 0,29 | E |
| S. panamense | 112 | 16,16 | PC |
| P. caucana | 10 | 1,44 | E |
Tabla 3 Abundancia total (AT), abundancia relativa (AR) y categoría de las especies capturadas en el tramo bajo de río Córdoba en época seca. Categorías: escasa (E), poco común (PC), común (C)
| Especies | AT | AR | C |
|---|---|---|---|
| C. hujeta | 2 | 0,90 | E |
| P. fasciatus | 28 | 12,9 | PC |
| H. jabonero | 6 | 2,70 | E |
| C. affinis | 46 | 21,1 | C |
| A. latifrons | 7 | 3,20 | E |
| C. kraussi | 1 | 0,40 | E |
| S. antillarum | 11 | 5,00 | E |
| A. banana | 2 | 0,92 | E |
| E. amblyopsis | 1 | 0,46 | E |
| D. maculatus | 2 | 0,90 | E |
| Caranx sp | 4 | 1,80 | E |
| C. undecimalis | 1 | 0,40 | E |
| M. curema | 48 | 22,10 | C |
| S. panamense | 39 | 17,90 | PC |
| P. caucana | 9 | 4,10 | E |
| A. lineatus | 1 | 0,40 | E |
| A. rostratus | 8 | 3,60 | E |
| M. brachyurus | 1 | 0,60 | E |
Estructura de la ictiofauna en el tramo bajo del río
El análisis de componentes principales (ACP) para la presencia de peces y el tipo de sustrato y vegetación acuática permitió diferenciar dos hábitats dentro del río: uno constituido por rápidos de corriente, sustrato rocoso, arena gruesa, hojarasca, bajos niveles de pH y alto oxígeno disuelto, y otro por remansos, sustrato de limo, arena fina, materia orgánica en descomposición y vegetación acuática y bajos niveles de oxígeno disuelto. Según este análisis, el 86,24 % de la varianza se debió a los dos primeros componentes (Figura 2): el componente uno (eje X) aportó el 59,72 % de la variabilidad, siendo la grava, los cantos rodados, las piedras, las rocas y la materia orgánica los de mayor importancia. A este tipo de sustrato se asociaron S. panamense, Sicydium antillarum y Awaous banana. El componente dos (eje Y) contribuyó con un 26,52 % de la variabilidad, siendo la arena fina, el limo y la vegetación acuática los de mayor importancia. Las especies Hypostomus hondae, M. incilis, Oreochromis niloticus, Caranx sp, Roeboides dayi, P. fasciatus, Caquetaia kraussii, Kronoheros umbrifer y C. affinis se asociaron a este sustrato.

Figura 2 Análisis de componentes principales (ACP) entre los peces y el tipo de sustrato en época de lluvias. Componente 1 (eje X), componente 2 (eje Y).
Asimismo, en época de sequía el 73,11 % de la varianza del ACP se debió los dos primeros componentes (Figura 3); el componente 1 (eje X) proporcionó el 47,84 % de la variabilidad, siendo las grava, los cantos rodados, las piedras, y las rocas los de mayor importancia, en tanto que la vegetación acuática se relacionó negativamente; S. panamense, S. antillarum y A. banana se asociaron a este hábitat. El componente dos (eje Y) aportó un 25,27 % de la variabilidad y la arena fina y el limo fueron los componentes de mayor importancia. P. fasciatus, H. jabonero, Ctenolucius hujeta, M. incilis, M. curema, Poecilia caucana, C. affinis, Caranx sp y Andinoacara latifrons se capturaron en estos sustratos.
Relación entre la presencia de peces y los parámetros fisicoquímicos
El análisis de correspondencia canónica (ACC) evidenció un gradiente asociado con las variables ambientales y las relacionadas con la forma del río. Se pudo apreciar el aumento de la profundidad y el ancho del río desde su parte alta hasta su desembocadura; la conductividad y la temperatura también presentaron este aumento. El oxígeno disuelto y el pH mostraron un patrón contrario al resto de las variables, ya que los sitios con mayor valor de oxígeno disuelto y menor pH se presentaron a medida que las estaciones de muestreo se alejaban de la desembocadura del río.
Según este análisis, en época de lluvias (Figura 4) el 78,46 % de la varianza acumulada en el triplot de especies y parámetros fisicoquímicos se explicó por los dos primeros componentes. El componente 1 (eje X) aportó el 49,97 % de la variabilidad y el componente 2 (eje Y), el 28,49 %. Los valores de correlación indican que el caudal (eje X, 0,80%) y el ancho (0,58%) fueron las variables fisicoquímicas más importantes en la distribución de las especies; la composición de la ictiofauna se relacionó inversamente con el caudal y el ancho, y solamente H. jabonero, G. steindachneri, R. dayi, Eliotrispisonis, C. affinis y, en menor medida, C. kraussi, A. banana, H. hondae y S. panamense mostraron preferencia por estas variables. El ancho (eje Y, 0,71 %) registró el valor más alto en el componente 2. P. fasciatus, S. panamense, O. niloticus, C. kraussi y Centropomus undecimalis mostraron preferencia por esta variable.

Figura 4 Análisis de correspondencia canónica (ACC) entre variables fisicoquímicas y la presencia de peces en época de lluvias. Componente 1 eje X, componente 2 eje Y
En época seca (Figura 5) el 95,51 % de la varianza acumulada en el triplot de especies y parámetros fisicoquímicos correspondió a los dos primeros componentes. El componente 1 (eje X) aportó el 58,03 % de la variabilidad y el componente 2 (eje Y), el 37,47 %. Los valores de correlación indican que el caudal (eje X 0,83%), y la velocidad (0,79%) fueron los parámetros fisicoquímicos más importantes en la distribución de las especies. La composición de la ictiofauna se relacionó inversamente con el caudal y la velocidad, A. rostratus, C. affinis, H. jabonero y, en menor medida, S. panamense y P. fasciatus se relacionaron positivamente con estas variables. El ancho (0,75 %) registró el valor más alto en el componente 2. S. panamense, Achirus lineatus y Microphis brachyurus mostraron preferencia por este parámetro.

Figura 5 Análisis de correspondencia canónica (ACC) entre las variables fisicoquímicas y la presencia de peces en época seca. Componente 1 eje X, componente 2 eje Y
La extrapolación del número de especies (0D) a nivel espacial evidenció que en la época de lluvias las estaciones de Cordobita (19 especies), Papare (17 especies) y la desembocadura (11 especies) presentaron mayor riqueza, en tanto que el sector de arriba (10 especies) presentó la menor riqueza de especies. En cuanto al número de especies típicas o comunes (1D), la desembocadura (8 especies) y Cordobita (7 especies) obtuvieron los mayores valores, y los más bajos se observaron en el sector de arriba (5 especies). Con respecto al número de especies dominantes (2D), las estaciones de arriba (2 especies) y Cordobita (2 especies) registraron los valores más altos, y la desembocadura (1 especie) y Papare (1 especie), los más bajos.
En la época de sequía, la desembocadura (15 especies) y Papare (6 especies) registraron la mayor riqueza de especies, en tanto que Cordobita y el sector de arriba (5 especies cada una) tuvieron la menor. A partir del número de especies típicas o comunes (1D), se evidenció que la desembocadura y Cordobita (5 especies) registraron los mayores valores, y los más bajos se observaron en el sector de arriba (4 especies). En cuanto al número de especies dominantes (2D), Papare (2 especies) y el sector de arriba (2 especies) obtuvieron los valores más altos y los más bajos se observaron en la desembocadura (1 especie) y Cordobita (1 especie). El ANOVA de Friedman y la prueba de Tukey no evidenciaron diferencias significativas en el número efectivo de especies en los ordenes 0 (q=1), 1 (q=1) y 2 (q=2) a nivel espacial (p>0,5) o temporal (p>0,05).
Discusión
Los ríos de la Sierra Nevada de Santa Marta (SNSM) presentan características físicas e hidrológicas afines a los sistemas costeros del Chocó biogeográfico, Centroamérica y las Antillas. En estas cuencas hidrográficas los ríos desembocan al mar siendo aún esteros de primero a cuarto orden, con distancias cortas desde sus cabeceras hasta la desembocadura (decenas de kilómetros), así como caudales reducidos (Blanco, et al., 2013). En los ríos de la SNSM se hallan más de 95 especies agrupadas en 13 órdenes y 33 familias (Prosierra, 1998) y, aunque los resultados del presente trabajo equivalen solo al 28,42 % del total, se reportan más especies que las descritas por Guardiola & Torrealbo (2011) en el río Piedras, y las reportadas por López-Delgado (2002).
Las familias Cichliidae y Characidae presentaron el mayor número de organismos en los muestreos realizados, lo que posiblemente se deba a que son las más representativas de la región (Maldonado-Ocampo, et al., 2008), e indica una adaptabilidad y especialización frente a los hábitats que ofrecen los ríos. Con relación al número de organismos, la especie más abundante en el río Córdoba fue P. fasciatus, capturada tanto en época de lluvias (Tabla 1S, https://www.raccefyn.co/index.php/raccefyn/article/view/1409/3197) como en época seca (Tabla 2S, https://www.raccefyn.co/index.php/raccefyn/article/view/1409/3197), lo que podría atribuirse a su reproducción continua a lo largo del año, con lo que mantiene elevado el número de individuos de la población (Castro-Roa, 2006). Además de ser la especie más abundante, se catalogó como la más común. P. fasciatus se capturó en todos los sectores de muestreo evaluados, con una leve tendencia a preferir los remansos.
La captura principalmente de especies como M. curema y M. incilis en época seca estaría relacionada con los patrones de migración de estas especies. Según Mármol-Rada, et al. (2010), en época de lluvias estas migran hacia el mar para desovar (octubre-noviembre) y regresan en época seca (enero-marzo), coincidiendo con la época de mayor captura de especies en este trabajo.
La ictiofauna de la SNSM hace parte de la vertiente del Magdalena, conformada por las cuencas de los ríos Cauca, Magdalena, San Jorge, Sinú, y las de la costa Caribe y el altiplano de Bogotá, y en ella se halla el 50 % de las especies que se encuentran en esta vertiente, compartiendo un total de 74 especies con dicho sistema fluvial (Mojica, 1999). Lo anterior explicaría las capturas de C. hujeta, C. affinis, R. dayi, G. steindachneri, C. kraussii, K. umbrifer, H. hondae, S panamense y A. rostratus, que en Colombia se distribuyen en los ríos Magdalena y Cauca. Es de particular interés destacar la captura de H. hondae y K. umbrifer, especies que se encuentran en el Libro Rojo de Peces dulceacuícolas colombianos como casi amenazados (Mojica, et al., 2012).
Otro resultado notable es una mayor captura de especies dulceacuícolas que estuarinas y marinas. Este río pertenece a la macrocuenca del Caribe, en la que el mar y la Ciénaga Grande de Santa Marta (CGSM) funcionan como barreras de asilamiento para la especiación de la fauna íctica y evitan la colonización de especies dulceacuícolas primarias en estos ríos, por lo que los peces de las cuencas del flanco norte de la SNSM presentan características marinas hacia la vertiente norte (Caribe) que les permiten soportar cambios en la salinidad (Galvis, et al., 1997).
La fuerte intervención antrópica observada en los sectores de Papare y Cordobita, en los que se desvía la corriente para el riego de las plantaciones de banano de las fincas aledañas al río y se extrae arena para su comercio en el municipio de Ciénaga, incidiría en la distribución de las especies. En general, el modelo de distribución de abundancias que mejor explicó la distribución de los organismos fue el de serie geométrica, en el que solo unas pocas especies fueron abundantes y las restantes prácticamente raras, lo cual es característico de comunidades con pocas especies (riqueza específica baja) y algún grado de intervención (Hill & Hamer, 1998). McGill et al. (2007) arguyen que los modelos de distribución de abundancia incorporan información sobre la riqueza, la distribución y, en algunas ocasiones, el número de especies no observadas en una comunidad. Además, son una herramienta para describir la estructura de una comunidad y pueden ser indicadores de perturbaciones (Hill & Hamer, 1998).
Influencia del hábitat sobre la comunidad íctica de río Córdoba
En el presente estudio se encontraron algunas asociaciones particulares de los peces con los remansos, entre ellos, G. steindachneri, C. kraussi, A. latifrons, O. niloticus, C. affinis, H. jabonero, M. incilis, M. curema, C. hujeta, A. lineatus, M. brachyurus, D. maculatus, K. umbrifer, R. dayi y P. caucana, especies probablemente relacionadas con la presencia de arena fina, lodo o fango, materia orgánica en descomposición (hojarasca), vegetación riparia, bajos niveles de oxígeno disuelto y alto pH. Los rasgos ecomorfológicos de estas especies probablemente estén incidiendo en su preferencia por los hábitats lentos, entre los que se pueden destacar la forma de la natación y la alimentación (Casatti & Castro, 2006; Oliveira, et al., 2010).
Sturisomatichthys panamense, S. antillarum y A. banana se capturaron en hábitats de rápidos de corriente, lo que probablemente se debe a que se alimentan de detritos y perifiton, alimentos comunes en ecosistemas lóticos. Los rasgos morfológicos de estos organismos incliuyen pedúnculos caudales bien fuertes y aletas pectorales con espinas muy pequeñas que les permiten adherirse a las rocas. Estas modificaciones les facilitan afrontar la dificultad causada por las fuertes corrientes (Casatti & Castro, 2006; Oliveira, et al., 2010). Los miembros de la familia Loricariidae poseen bocas inferiores con modificaciones en la cavidad oral a manera de ventosa y cuerpos comprimidos dorso-ventralmente con pedúnculos caudales desarrollados, características típicas de especies bentónicas que habitan cuerpos de agua con velocidades de corriente (Oliveira, et al., 2010; López-Delgado, 2013).
Los parámetros fisicoquímicos específicos del río fueron el ancho, la velocidad de la corriente, el caudal y el pH. En este sentido, Angermeier & Kar (1993) argumentan que las características estructurales del río, como el ancho, la velocidad de la corriente, la profundidad, la depredación y la competencia, así como los parámetros fisicoquímicos, son esenciales al analizar los resultados sobre la composición de especies por estación, ya que constituirían evidencia de por qué se recolectaron dichas especies en esos sectores y en esa época climática (Maldonado-Ocampo, et al., 2005). El ancho del río se relaciona directamente con el caudal, así que a mayor caudal, mayor es el ancho del río (Grenouillet, et al, 2004), hecho que se corroboró en las estaciones de Papare y Cordobita, pues presentaron el mayor ancho y, por ende, el mayor caudal. Además, la riqueza local, la composición y el ensamblaje de peces tienden a incrementarse de forma directa con el ancho y volumen en los cuerpos de agua (Toepfer, et al., 1998).
Los valores de temperatura, pH, oxígeno disuelto y conductividad obtenidos se hallaron dentro de los valores aceptables para mantener a las especies vivas. La temperatura desempeña un rol esencial en todos los procesos biológicos, ya que al aumentar, acelera los procesos fisiológicos y químicos (Pankhurst & Munda, 2011) e incide en la tasa de crecimiento y el rendimiento reproductivo (Harrod, 2016). Valores de temperaturas superiores a 33 °C tienen efectos anómalos en los peces (Corcuera-Zabarburu, 2015) y valores por debajo de 8 °C corresponden a temperaturas de letargo (Hernández-Rodríguez & Bückle-Ramírez, 2010). Los valores de pH en este estudio oscilaron entre 6 y 8, lo que se considera óptimo en aguas naturales. La mayoría de las especies ícticas habitan aguas que generalmente tiene un pH entre 6 y 9 (Chapman & Kimtsach, 1992). Serafy & Harrel (1993) mencionan que valores mayores de 9 lesionan tejidos superficiales y producen una excesiva secreción de mucus. Los valores de oxígeno disuelto también estuvieron dentro de las condiciones aceptables (Carrillo-López, 2013); 4 mg/l se considera como la concentración mínima letal, valor muy por debajo de los obtenidos en este estudio.
Otro factor que podría estar incidiendo en la distribución de las especies es la mayor duración de la estación seca en el Caribe colombiano como producto del cambio climático, el cual traerá consigo importantes consecuencias para los ecosistemas acuáticos. Entre sus efectos inmediatos están los cambios de temperatura y regímenes de flujo del caudal, cambios en la vegetación ribereña, alteración de la química del agua, y en las interacciones entre especies (Poff, 1992). El principal reto para la macrofauna lótica en los bosques secos ha sido la sequía, por lo que se han seleccionado diferentes estrategias que les han permitido adaptarse a estos ambientes (Lytle & Poff, 2004). Los bosques secos se caracterizan por presentar una pronunciada estacionalidad en la distribución de la precipitación, lo que genera una temporada seca de hasta seis meses (Sánchez-Azofeifa, et al., 2005; Pennington, et al., 2006). La precipitación influye directamente en el flujo de agua superficial, por lo que el régimen hidrológico de los arroyos del bosque seco del Caribe colombiano presenta también una marcada estacionalidad, con ausencia o intermitencia del flujo en la temporada seca (Lake, 2003). Es probable que estas sequías estacionales generen variaciones hidrológicas que se reflejarían en la comunidad de peces debido a la discontinuidad en el flujo del agua, el ancho del río y la conectividad entre la cabecera y los sectores medio y bajo (Herbert & Gelwick, 2003). Sin embargo, los resultados de nuestro estudio no sustentan dicha teoría, ya que no se observaron diferencias en la composición y estructura de la comunidad íctica en las dos épocas evaluadas. Se sugiere un efecto en el tamaño del muestreo, debido a que la relación entre la estructura de las comunidades y el régimen hidrológico no siempre puede verificarse a escalas temporales ecológicas y espaciales locales (Herbert & Gelwick, 2003). Ese efecto en el tamaño del muestreo se reflejó en la temporada seca, ya que fuimos expulsados del río por los trabajadores de fincas bananeras aledañas a su margen, lo que no permitió terminar los muestreos en la época seca con la consecuente incidencia en el objetivo principal del estudio; por ello, no se cumplió a nivel temporal la hipótesis planteada en el estudio.
Los números efectivos de Hill permiten una mejor interpretación de la diversidad de las comunidades a nivel espacial y temporal; en época de lluvias los mayores valores en diversidad y riqueza se registraron en Papare y Cordobita, y en la época seca, en la desembocadura, reflejando la mayor complejidad del hábitat, en tanto que los menor valores se registraron en la estación de arriba. Según Oliveira, et al. (2010), el gradiente de diversidad y abundancia que se registra en un río a lo largo del curso constituye una segregación efectiva de diversas comunidades de peces en la que inciden factores físicos como la velocidad, la temperatura, el caudal, las pendientes y las barreras geográficas, por lo que la ictiofauna de estos sistemas fluviales tiende a presentar cambios en sus patrones espaciales de distribución y en el uso del hábitat debido a variaciones temporales asociadas a la precipitación, la reproducción y la búsqueda de alimento. Además, Toepfer, et al. (1998) argumentan que los cambios en la estructura de las comunidades de peces de un río se producen siguiendo un gradiente longitudinal desde su nacimiento hasta su desembocadura, observándose un aumento de la riqueza de las especies a medida que se desciende en el río, lo que talvez se relaciona con una mayor oferta alimenticia (arena, hojarasca, lodo y vegetación riparia) y sugiere más refugios para las especies que facilitan la colonización de un mayor número de ellas (Cala, 2002), o la presencia de depredadores, o especializaciones tróficas interespecíficas e intraespecificas, (Machado-Allison, et al., 1993).
Conclusión
La composición de la ictiofauna en el tramo bajo del río no presentó cambios a nivel temporal, pero sí a nivel espacial durante las dos épocas evaluadas, cambios posiblemente ocasionados por fluctuaciones del régimen pluviométrico de la región Caribe colombiana que provocan variaciones en las características físicas del cauce, es decir, en el ancho, el caudal y la velocidad de la corriente; estos cambios incidieron en la dispersión de las especies, situación que se evidenció en la abundancia debido a las características disímiles de las estaciones entre sí y a nivel temporal. En los sectores cercanos a la desembocadura se observó la mayor abundancia y diversidad de especies, con una mayor heterogeneidad del hábitat, incluida la complejidad del sustrato, y zonas de mayor ancho, lo que brinda recursos a la fauna íctica. Los resultados de este estudio concuerdan con la hipótesis de un río continuo y un pulso de inundación que implica el aumento de especies en las zonas bajas. Por último, se recomienda la continuidad de las investigaciones en este cuerpo de agua encaminadas a su protección y conservación, ya que esta es una cuenca fuertemente intervenida que alberga especies amenazadas como Hypostomus hondae y Kronoheros umbrifer.

















