Introducción
El perifiton es una biopelícula que se forma en sustratos sumergidos y constituye una de las comunidades más importantes en los sistemas acuáticos; se compone principalmente de algas y cianobacterias, así como bacterias, hongos y microinvertebrados, que se desarrollan sobre superficies solidas sumergidas, tales como rocas, sedimento, material vegetal, arenas, hojas y macrófitas (Romaní, 2001; Trbojević, et al., 2018). Su compleja estructura incluye también mucílagos y detritos orgánicos, así como un componente inorgánico procedente de diferentes tipos de partículas (Trbojević, et al., 2018).
Particularmente las algas del perifiton desempeñan un papel fundamental en la dinámica de los ríos y de otros ecosistemas acuáticos: en el ciclo de nutrientes, el flujo de la energía y la productividad primaría. Recientemente, además, se vienen utilizando como indicadores de la calidad del agua, ya que pueden desarrollarse adheridos a diferentes sustratos y reflejan los cambios ocurridos por alteraciones físicas, químicas y biológicas (Pérez, et al, 2007; Steinman, et al., 2016), por lo que es posible obtener información derivada de su presencia o su ausencia como indicación del estado ecológico de su entorno (Lobo, et al., 2016).
Estas comunidades se desarrollan en función de diversos factores, entre los que se destacan la disponibilidad de luz, la temperatura, la transparencia, el tipo y disponibilidad de los sustratos, la dinámica del agua, las concentraciones de nutrientes y materiales disueltos (fósforo, nitrógeno, sílice, carbono, calcio, hierro y cobre, entre otros), el pH y el pastoreo (Biggs, 2000; Stevenson, et al., 2006, Roldán & Ramírez, 2008). Debido a su habilidad para responder a los cambios ambientales, las algas del perifiton han sido utilizadas en estudios ecológicos (Murakami, et al., 2009).
Las características hidrológicas, físicas y químicas, así como las perturbaciones y la heterogeneidad espacial y temporal de los ríos, definen la distribución, la dispersión, la colonización y la respuesta de los organismos al medio (Martínez & Donato, 2003). Hay factores que gobiernan los procesos físicos y morfológicos de los ríos; entre los factores morfológicos están el clima local, la naturaleza de la vegetación riparia, el uso de la tierra en su área de influencia y la intervención directa del hombre por extracción de materiales y modificación del curso (Roldán & Ramírez, 2008).
En Colombia, los trabajos de Zapata & Donato (2005), López-Muñoz & Pérez-Gallego (2014), Bustamante, et al. (2008), Pedraza & Donato (2011), Jiménez-Pérez, et al. (2014), y Godoy-Lozada & Peláez-Rodríguez (2020) son importantes contribuciones al conocimiento de las algas del perifiton en sistemas lóticos. En el departamento del Chocó son pocos los trabajos publicados sobre esta importante comunidad, aunque se destacan en los ríos los de Abuhatab, et al. (2005) y Salas, et al. (2011), en ciénagas los de Maturana, et al. (2002) y Mosquera-Murillo (2020), y los de Mosquera, et al., (2020) en pozas mineras.
Teniendo en cuenta la escaza información sobre las comunidades de algas del perifiton en los ecosistemas lóticos en el Chocó, es de gran importancia hacer este tipo de estudios sabiendo de la gran diversidad de diferentes grupos biológicos en esta zona y de los procesos antrópicos de tipo minero que se han desarrollado desde hace décadas en el departamento, en especial en la zona del río San Juan (Medina, et al., 2011), con las consecuentes alteraciones en los ecosistemas acuáticos. En este orden de ideas, en el presente estudio se analizó la variación espacial de las comunidades de algas del perifiton, así como su relación con las variables fisicoquímicas en cinco quebradas de la cuenca del río San Juan, Chocó-Colombia, como una forma de contribuir al conocimiento de esta comunidad en los ecosistemas acuáticos de la región y generar una línea de base para futuros programas de conservación, dado el impacto de la actividad minera en la zona.
Materiales y métodos
Area de estudio
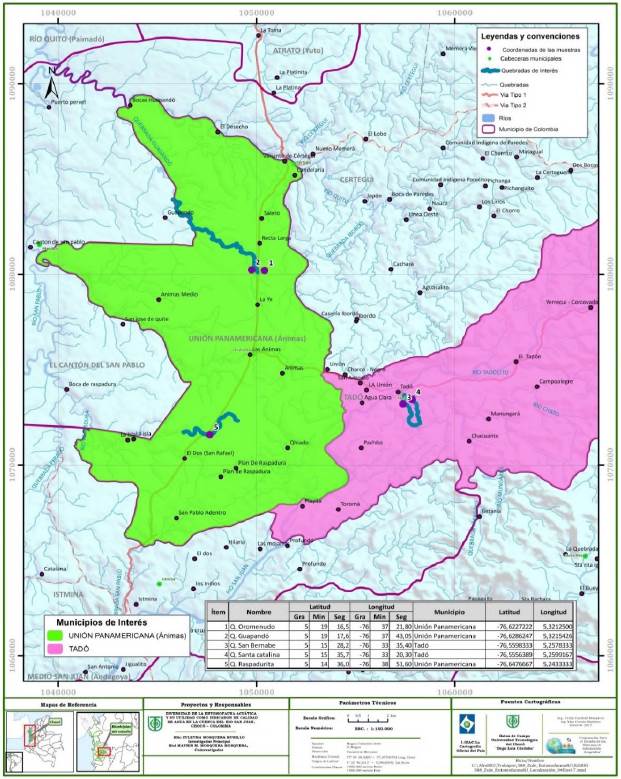
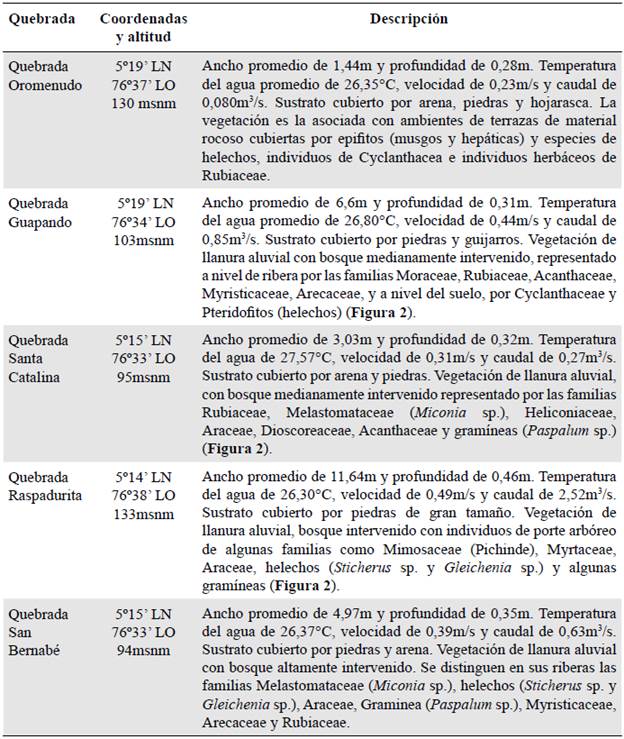
La zona de estudio se encuentra localizada en los municipios de Tadó y Unión Panamericana, ubicados en la cuenca media del río San Juan, departamento del Chocó, Colombia (Figuras 1 y 2). La cuenca está entre los 5°16'N y los 76°73'O, y presenta una temperatura entre los 27 y los 29 °C y una precipitación anual promedio que oscila entre los 6.800 y los 7.600 mm; está a una altura de 75 m s.n.m. y pertenece a la zona de vida de bosque pluvial tropical (bp-T) (Holdridge, 1996). En la tabla 1 se describen las características de las cinco quebradas seleccionadas en la zona de estudio.

Figura 2 Quebradas de la cuenca del río San Juan: a) Quebrada Santa Catalina. b) Quebrada Guapandó. c) Quebrada Raspadurita
Fase de campo
Los muestreos se hicieron mensualmente entre abril y agosto del 2015; para la recolección de las algas del perifiton en cada quebrada se seleccionaron al azar cinco piedras sumergidas en la corriente, en las cuales se hizo el raspado de la comunidad adherida utilizando como unidad de área un cuadrante de 8 cm2 y raspando cinco veces, con lo que se obtuvo un área total de 200 cm2; se tomaron una muestra y una repetición por sección. Posteriormente, la muestra recolectada fue almacenada en frascos de 50 ml con agua estéril y fijada con lugol al 10 % (Tümpling & Friedrich, 1999).
En cada quebrada estudiada se midieron in situ con un equipo digital multiparámetros (HACH HQ30d) el oxígeno disuelto, el pH, la temperatura del agua, la conductividad eléctrica y los sólidos totales disueltos; además, se tomaron muestras de agua para el análisis de nutrientes (nitratos, nitritos, amonio y ortofosfatos) y de la alcalinidad total siguiendo las recomendaciones de la American Public Health Association (APHA), la American Water Works Association (AWWA), y la Water Environment Federation (WEF) (2012).
Fase de laboratorio
Las muestras se llevaron al laboratorio de limnología de la Universidad Tecnológica del Chocó, en donde se hizo la identificación taxonómica y la cuantificación de los organismos perifíticos con un microscopio binocular considerando 100 campos con un objetivo de 40X (Uehlinger, 1964), según los trabajos de Förster (1982), Parra, et al. (1983), Prescott, et al. (1983), Krammer & Lange-Bertalot (1991), Komárek & Anagnostidis (2005), y Bicudo & Menezes (2006), y bases de datos digitales (Guiry & Guiry, 2021). Los organismos unicelulares, las colonias y los filamentos se consideraron como individuos y su cuantificación se obtuvo mediante la fórmula propuesta por Hauer & Lamberti (2007), donde la densidad se expresa como el número de individuos por área de superficie (cm2).
Análisis de datos
Mediante estadística descriptiva se analizaron los datos físicos y químicos estableciendo el promedio y el coeficiente de variación de Pearson; se empleó un análisis de varianza (ANOVA) para evaluar las diferencias de los datos físicos y químicos entre quebradas. La diversidad de la comunidad de algas del perifiton se estimó mediante los índices de diversidad de Shannon-Weaver (Shannon & Wiener, 1949) y de dominancia de Simpson (Simpson, 1949), en tanto que la riqueza específica se estimó con la función diversity del programa estadístico Past 1.57 (Hammer, et al., 2001). Las diferencias en la densidad y la diversidad totales, y en la riqueza y la dominancia de la comunidad en las quebradas se evaluaron mediante un análisis de varianza (ANOVA de una vía). Este mismo análisis se empleó para evaluar las diferencias en la proporción de las distintas divisiones de algas entre las quebradas estudiadas; los supuestos inherentes a esta prueba se verificaron como aceptables (p>0,05), las diferencias significativas se registraron con una prueba de Tukey y se usó el programa Minitab (2014). Para comparar la composición de la comunidad de algas del perifiton entre quebradas se hizo un análisis de cluster, utilizando el índice de similitud de Bray-Curtis (Magurran, 1988). Además, se empleó un análisis de correlación múltiple para determinar la relación entre las variables físicas y químicas y la densidad total, la diversidad, la dominancia, la riqueza específica, y las divisiones de algas presentes en las quebradas estudiadas utilizando el programa Statgraphics Centurion XV (2006).
Resultados
Variables físicas y químicas
Las variables de oxígeno disuelto, alcalinidad, conductividad eléctrica y amonio presentaron diferencias significativas entre las quebradas estudiadas (p<0,05), siendo el oxígeno disuelto, la alcalinidad y la conductividad eléctrica mayores en la quebrada Santa Catalina, y el amonio en la quebrada Guapando. Las variables restantes no presentaron diferencias significativas; sin embargo, el pH y la temperatura del agua registraron sus mayores valores en la quebrada Santa Catalina y los más bajos en Raspadurita. En el caso de los nutrientes, estos tienden a ser mayores en Raspadurita (nitritos y nitratos) y Santa Catalina (ortofosfatos) (Tabla 2). El oxígeno disuelto, la temperatura del agua y el pH, se caracterizaron por su poca variación (<15 %), en tanto que la alcalinidad, la conductividad y los nutrientes fueron los de mayor variabilidad (>25 %).
Comunidad fitoperifítica
La comunidad de algas del perifiton de las quebradas estudiadas registró una densidad total de 2.797,28 org/cm2, distribuidos en 106 morfoespecies pertenecientes a 26 familias, 17 órdenes, 6 clases y 5 divisiones (Tabla 3). La división Bacillariophyta fue la más representativa, con una densidad promedio de 451,10 org/cm2, seguida por la división Charophyta, con 40,88 org/cm2 (Figura 3). No se presentaron diferencias significativas en la densidad de las divisiones entre las quebradas (p>0,05). En términos de riqueza, la división Bacillariophyta ocupó el primer lugar, con un promedio de 22 de las morfo-especies, seguida de las Charophytas, con un promedio de 11 morfoespecies por quebrada (Tabla 3).
Tabla 2 Valores promedios, coeficientes de variación (CV) y resultados del análisis de varianza de las variables físicas y químicas
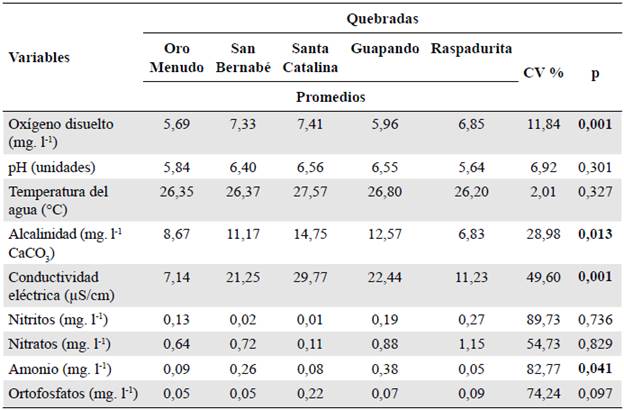
Los valores en negrilla corresponden a las variables que presentaron diferencia significativa entre quebradas
La quebrada Oromenudo registró la mayor densidad de organismos perifíticos (39,23 %), seguida de la quebrada San Bernabé (23,99 %), la Santa Catalina (20,27 %), la Guapando (10,63 %) y la Raspadura (5,88%) (Figura 3). La riqueza promedio fue mayor en la quebrada Santa Catalina y menor en la quebrada Raspadura; en el caso de la diversidad, esta fue mayor en la quebrada San Bernabé y menor en la quebrada Oromenudo, y la dominancia fue mayor en Oromenudo y menor en San Bernabé (Tabla 3). El análisis de varianza evidenció la existencia de diferencias significativas entre las quebradas estudiadas en cuanto a la diversidad de la comunidad de algas del perifiton (ANOVA, F=4,68; p=0,051) y la riqueza (ANOVA, F=8,85; p=0,017); en el caso de la diversidad, las diferencias se presentaron entre la quebrada Oromenudo y las restantes, en tanto que para la riqueza, las quebradas Bernabé y Santa Catalina difirieron del resto. La densidad y la dominancia no presentaron diferencias significativas entre quebradas (p>0,05) (Figura 4).
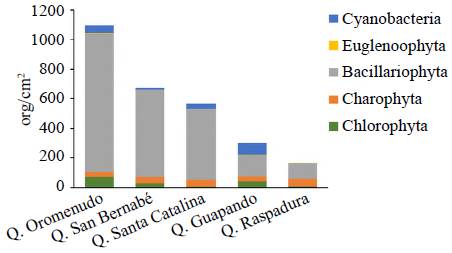
Figura 3 Densidad promedio (org/cm2) y contribución por divisiones de la comunidad de algas del perifiton en las quebradas estudiadas
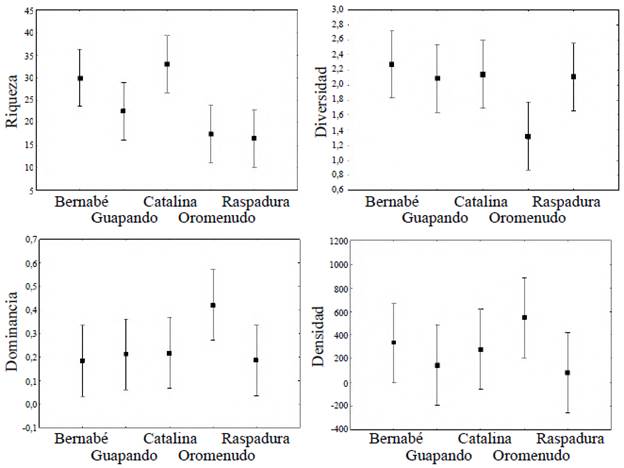
Figura 4 Gráfico de medias para la densidad, diversidad, riqueza específica y dominancia de la comunidad de algas del perifiton en cinco quebradas de la cuenca del río San Juan, Chocó-Colombia
Solo el 2,83 % de las morfoespecies (3 morfoespecies) se encontró presente en las cinco quebradas, en tanto que el 52,83 % (56 morfoespecies) resultó ser exclusivo de alguna de ellas (Tabla 3). Los valores del índice de similitud de Bray-Curtis revelaron un bajo rango aproximado de similitud del 6,95 % en la composición de la comunidad de algas perifíticas entre las cinco quebradas (Figura 5), siendo las quebradas de San Bernabé y Santa Catalina las que presentaron mayor afinidad, con un 28,83 %, al compartir algunos taxones de Bacillariofíceas y Charofíceas con 25 morfoespecies, seguidas de Raspadura y Guapando, con el 11,81 % y 12 morfoespecies compartidas.
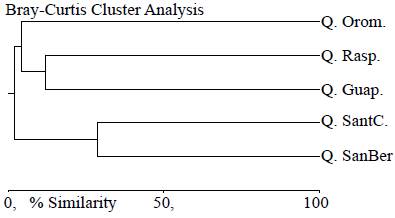
Figura 5 Similitud de la comunidad de algas del perifiton de las quebradas estudiadas mediante el índice de Bray-Curtis. NSanBer: quebrada San Bernabé; SantC: quebrada Santa Catalina; Guap: quebrada Guapandó; Rasp: quebrada Raspadurita; Orom: quebrada Oromenudo
Tabla 3 Composición taxonómica y densidad de la comunidad de algas del perifiton en las quebradas estudiadas
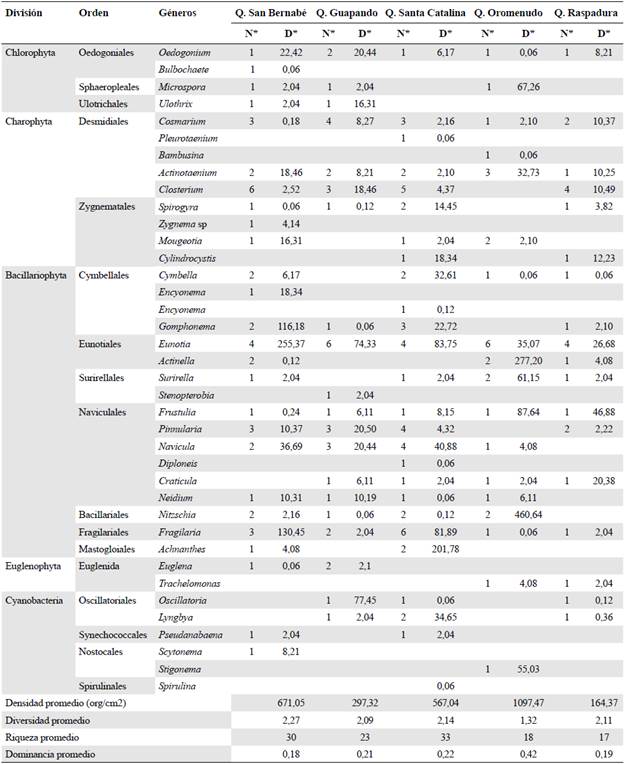
N: No. morfoespecies D: Densidad
El análisis de correlación entre las variables físicas, químicas y la comunidad de algas del perifiton demostró correlaciones significativas: la variable riqueza se relacionó con la conductividad eléctrica; el oxígeno disuelto y el pH lo hicieron con la dominancia y la diversidad; las euglenofíceas se asociaron con el oxígeno disuelto; la densidad con las clorofíceas y las bacillariofíceas; las euglenofíceas lo hicieron con la riqueza, la dominancia y la diversidad, y las charofíceas con los nitratos (Tabla 4).
Tabla 4 Coeficientes de correlación de Pearson para las variables físicas y químicas y los índices ecológicos y grupos perifíticos presentes en las quebradas estudiadas. *p<0,05: significativo; **p<0,01: muy significativo; NS: no significativo
| Parámetros | Densidad | Riqueza | Dominancia | Diversidad | Oxígeno disuelto | Conductividad | Nitratos | |
|---|---|---|---|---|---|---|---|---|
| Densidad | 0,17NS | 0,35NS | -0,29NS | -0,35NS | 0,46NS | -0,05NS | -0,18NS | |
| Riqueza | 0,17NS | -0,35NS | 0,55NS | 0,54NS | 0,04NS | 0,74** | -0,53NS | |
| Dominancia | 0,35NS | -0,35NS | -0,93** | -0,64* | -0,79** | -0,28NS | 0,07NS | |
| Diversidad | -0,29NS | 0,55NS | -0,93** | 0,74** | -0,72** | 0,42NS | 0,15NS | |
| Euglenophyta | 0,15NS | -0,74** | 0,69* | -0,77** | -0,62* | 0,39NS | -0,57NS | 0,04NS |
| Chlorophyta | 0,65* | 0,09NS | 0,48NS | -0,34NS | -0,49NS | 0,33NS | -0,35NS | -0,07NS |
| Bacillariophyta | 0,98** | 0,20NS | 0,32NS | -0,28NS | -0,30NS | 0,49NS | -0,01NS | -0,04NS |
| Charophyta | 0,28NS | 0,04NS | -0,51NS | 0,44NS | 0,13NS | -0,48NS | 0,14NS | 0,64* |
Discusión
Variables físicas y químicas
En las quebradas estudiadas los parámetros medidos se encontraron dentro de los rangos normales para este tipo de ambientes, con valores relativamente altos de oxígeno disuelto (>5,50 mg. l-1), pH ligeramente ácido (<6,60 unidades), así como alta temperatura del agua (>26 °C). Estos valores de oxígeno disuelto y de pH coinciden con los reportados por Mosquera & Córdoba (2015) en quebradas ubicadas en la zona del San Juan en el Chocó. En cuanto a la temperatura del agua, los valores superiores a 26 °C registrados en las quebradas son característicos de los ambientes acuáticos ubicados en regiones tropicales, con valores entre 25 y 30 °C (Roldán & Ramírez, 2008). Asimismo, los valores de alcalinidad fueron bajos (<50 mg. l-1), al igual que los de conductividad (<20 μS/cm), pero se encuentran dentro de los rangos reportados para ecosistemas neotropicales colombianos (Roldán & Ramírez, 2008). En el caso de los nutrientes, solo los ortofosfatos superaron los valores aceptables en agua naturales, que es de 0,05 mg. l-1 (Piedrahita, 1988), lo cual puede estar asociado a la presencia de pequeños poblados en las cercanías de algunos de los ecosistemas acuáticos; sin embargo, fueron similares a los reportados por Mosquera & Córdoba (2015) en quebradas de la misma zona.
Comunidad fitoperifítica
En todas las quebradas estudiadas la comunidad de algas del perifiton estuvo dominada en abundancia y riqueza por la división Bacillariophyta, lo cual coincide con otras investigaciones realizadas en sistemas lóticos como las de Montoya & Ramírez (2007), Bustamante, et al. (2008), Pedraza & Donato (2011), Marín-Villegas, et al. (2011), De la Parra-Guerra, et al. (2017), y Huertas, et al. (2019). Según Ramírez & Plata (2008), los miembros de la división Bacillariophyta suelen ser comunes y abundantes en ecosistemas lóticos gracias a su capacidad de ocupar con rapidez los sustratos y a la presencia de estructuras especializadas que les permiten a los individuos fijarse al sustrato con mayor facilidad y competir con ventaja frente a otros grupos, además de soportar cambios de temperaturas y altos niveles de perturbación ser potencialmente capaces de colonizar diversas zonas de un cuerpo lótico a pesar de su heterogeneidad (Ramírez, et al., 2009). Igualmente, la riqueza exhibida por esta división se atribuye a la capacidad que tiene para desarrollarse en hábitats bentónicos, los cuales le ofrecen una variedad de microhábitats disponibles para su colonización, y variables físicas y químicas que definen el tipo de organismos que crecen en el sustrato, lo que se asocia a las estrategias de crecimiento que estas exhiben (Cavati & De Oliveira, 2008; Flynn, et al., 2013).
Los restantes grupos perifíticos presentaron abundancias muy inferiores, lo que podría asociarse con los requerimientos particulares de estos grupos de algas. En el caso de las divisiones Chlorophyta y Charophyta, su presencia se asocia con aguas ricas en nutrientes y con una relación P:N alta (Pinilla & Duarte, 2006), presentando su mayor desarrollo en medios alcalinos (Ramírez, 2000; Martín, et al., 2004), en tanto que las cianobacterias suelen proliferar en zonas con alta penetración de luz y con alta perturbación (Komarek, 2003); por su parte, las euglenofitas se encuentran de forma ocasional, ya que son características de ambientes con alto contenido de materia orgánica de origen natural, y flujos y ambientes lénticos (Vilches, et al., 2016).
Desde el punto de vista espacial, las variaciones observadas en diversidad y riqueza entre las quebradas pueden atribuirse a su ubicación particular en zonas alejadas de asentamientos urbanos y de perturbaciones de tipo antrópico, como es el caso de las quebradas Santa Catalina y San Bernabé, las cuales exhibieron los mayores valores de riqueza y diversidad, en tanto que una quebrada como Raspadura presentó bajos valores de estas variables por estar sujeta a una mayor actividad antrópica, ya que es un balneario popular en la zona. Según Stevenson, et al. (1996), la distribución de los organismos perifíticos depende significativamente de las características físicas del sustrato y de la dinámica física del entorno, de manera que factores como la geología, la topografía y los usos del suelo en las áreas de influencia directa de los cuerpos de agua tienden a ser factores relevantes a gran escala en la ecología de estos organismos (Stevenson, 1997; Potapova & Donald, 2002).
Un alto porcentaje de morfoespecies fue exclusivo de alguna de las cinco quebradas (Tabla 3) y solo los géneros Oedogonium, Frustulia y Actinotaenium se encontraron presentes en los cinco ecosistemas en estudio. Estos resultados evidencian una variabilidad significativa en la composición de morfoespecies de algas perifíticas en estas quebradas, lo que estaría asociado a las características del sustrato y de la dinámica del entorno en relación con los usos del suelo en sus áreas de influencia directa. Según Felisberto, et al. (2001), el predominio de diferentes grupos de microalgas y cianobacterias en determinados ecosistemas es función, principalmente, de las características predominantes del medio ambiente; asimismo, estos organismos están sujetos a una serie de factores presentes en los ambientes acuáticos (nutrientes, luz, pH, temperatura, sustrato, entre otros), lo que se refleja positiva o negativamente en su dinámica espacial (Lowe, 1996; Reynolds, 2006), y su distribución tiende a ser altamente dependiente de las características del sustrato y de la dinámica física del entorno (Stevenson, et al., 1996).
El género Oedogonium es cosmopolita y habita principalmente en aguas quietas o con poco movimiento en un amplio rango de condiciones ecológicas (Bellinger & Sigee, 2015); por su parte, Frustulia es un género frecuente en agua dulce, capaz de producir matrices mucilaginosas que facilitan su fijación al sustrato y son a menudo dominantes en los ambientes acuáticos, sobre todo los de tipo oligotrófico y pH ácido (Werum & Lange-Bertalot, 2004; Metzeltin & Lange-Bertalot, 2009). Asimismo, el género Actinotaenium es frecuente en ecosistemas oligotróficos de pH ácido (Hall, et al., 2008).
En cuanto a las correlaciones observadas entre las variables físicas, químicas y la comunidad de algas del perifiton, diversos estudios han demostrado la importancia de variables como el pH, la conductividad eléctrica, la temperatura y los nutrientes en la composición, abundancia y riqueza de la comunidad perifítica en ecosistemas acuáticos (Verb & Vis, 2005; Soininen, 2007; Montoya & Ramírez, 2007; Pedraza & Donato, 2011; Rusanov, et al., 2012). Según Hill, et al. (2000), las comunidades fitoperifíticas resultan ser muy dependientes de las condiciones ambientales y en especial de la química del agua, ya que estas variables actúan sobre su desarrollo al afectar su fisiología, influenciado también en sus variaciones espaciales y temporales (Oliveira-Martins, 2006)
Conclusión
La densidad y la dominancia de las comunidades de algas del perifiton en las quebradas estudiadas no presentaron variaciones espaciales importantes; sin embargo, la riqueza y la diversidad evidenciaron cambios significativos asociados con la ubicación específica de las quebradas en zonas alejadas de asentamientos urbanos y de perturbaciones de tipo antrópico, así como a la variación observada en las formas de nitrógeno y ortofosfatos entre las quebradas estudiadas. Las diatomeas fueron el grupo dominante en densidad y riqueza, coincidiendo con lo reportado en otras investigaciones de este tipo en el país, en tanto que grupos como Euglenofíceas y Cianofíceas tuvieron baja representatividad, lo que se asocia con sus requerimientos particulares. Asimismo, se evidenciaron correlaciones significativas entre la comunidad de algas del perifiton y las variables físicas y químicas analizadas. El presente estudio constituye una línea base para el conocimiento de las comunidades perifíticas que se desarrollan en sistemas lóticos de las cuencas del departamento del Chocó.