Introducción
Anualmente se vierten en la naturaleza cerca de 1.500 millones de toneladas de biomasa residual de origen lignocelulósico (Toushik et al., 2017). Parte de estos residuos se produce como resultado de prácticas agrícolas y alcanza cerca de cinco millones de toneladas métricas por año (Bharathiraja et al., 2016). El tratamiento deficiente y el poco aprovechamiento de estos residuos ocasionan problemas de salud pública y medioambientales (Bigdeloo et al., 2021). En los últimos años se ha visto la necesidad de buscar alternativas para valorizar estos residuos utilizándolos como materia prima para la obtención de productos de valor agregado (Bhuyan et al., 2020).
Las alternativas de valorización de residuos agrícolas y agroindustriales más utilizadas son el compostaje, la producción de comida animal, la obtención de biogás (Ravindran et al., 2018; Abdel Shafy & Mansour, 2018; Mengqi et al., 2021) y recientemente se ha generalizado el uso de esta biomasa residual en procesos de obtención de bioetanol, previa hidrólisis enzimática (Sarkar et al., 2012). La valorización de residuos agrícolas como sustratos para la producción de enzimas microbianas ha empezado a ser una práctica común debido a que reduce sus costos de producción y las hace más accesibles a nivel industrial (de Castro & Sato, 2015; Bharathiraja et al., 2016).
Las plazas de mercado en Colombia son grandes generadoras de residuos agrícolas con gran potencial de aprovechamiento (Cardona-lzate et al., 2004; Valderrama-López et al., 2019). Estos residuos están constituidos principalmente por polímeros como la lignina y la celulosa, entre otros compuestos que pueden emplearse como sustratos en fermentaciones microbianas para la obtención de enzimas (Ravindran et al., 2018).
La disminución de los costos durante la producción de enzimas microbianas implica contar con sustratos de fácil acceso y bajo costo y microorganismos con actividad enzimática capaces de hidrolizar dichos sustratos (de Castro & Sato, 2015). Es por ello que la búsqueda de nuevas cepas microbianas nativas con actividad enzimática es una investigación relevante y necesaria que favorece la oferta y la demanda de estos bioproductos de interés industrial (Kirn et al., 2018). En este contexto, el propósito de nuestro estudio fue la evaluación de residuos orgánicos provenientes de las plazas de mercado mediante su caracterización fisicoquímica y microbiológica, para lo cual se determinó la presencia de microorganismos con actividad enzimática y el contenido de grasas y aceites, almidón, pectina, hemicelulosa, celulosa, lignina y proteína, sustratos fundamentales para la producción de lipasas, amilasas, pectinasas, celulasas, ligninasas y proteasas.
Materiales y métodos
Maestreo de los residuos
Los residuos orgánicos se recolectaron de la plaza distrital de mercado de El Restrepo (Bogotá, D.C.) utilizando el método de cuarteo (Alayón, 2020) en tres días diferentes de la semana durante junio de 2021. Los residuos se clasificaron en seis tipos diferentes: R1 (tubérculos), R2 (frutas), R3 (plantas ornamentales y flores), R4 (plantas y hortalizas aromáticas), R5 (ameros de mazorca y vainas de leguminosas) y R6 (verduras y hojas y tallos tiernos). De cada tipo de residuo se tomaron aproximadamente 500 g de muestra y se transportaron refrigerados para su pretratamiento en el laboratorio.
Pretratamiento de los residuos
El análisis microbiológico se hizo en una muestra compuesta de 100 g de los seis tipos de residuos; posteriormente, estos se cortaron manualmente para obtener trozos de aproximadamente 10 mm y se analizaron en las primeras 24 horas posteriores al proceso de recolección.
Para el análisis fisicoquímico las muestras se lavaron con agua desionizada, se cortaron en trozos de 10 mm y se deshidrataron a 90 °C en un horno Binder FED 115 durante 15 horas, aproximadamente, hasta alcanzar un peso constante, y luego se las almacenó a -80 °C hasta su caracterización.
Caracterización fisicoquímica de los residuos
A cada uno de los residuos pretratados (R1 - R6) se le determinó el porcentaje de humedad, nitrógeno, proteínas, carbono orgánico total (COT), azúcares reductores (AR), grasas y aceites (GyA), almidón, hemicelulosa, lignina y celulosa. Para cuantificar su humedad, los residuos se deshidrataron hasta alcanzar el peso constante y el cálculo se hizo por diferencia de pesos. El contenido de nitrógeno se determinó con el método Kjeldahl y el porcentaje de proteínas siguiendo a Gavidia-Valencia et al. (2020). El COT se evaluó mediante un método de adición estándar modificando la técnica de Walkley- Black (1934). Para los AR se utilizó el método del ácido 3,5 dinitroacetilsalicílico (DNS) (Olanbiwoninu & Fasiku, 2015). Las GyA se calcularon por diferencia de pesos después de una extracción Soxhlet (Subramanian et al., 2016) seguida de una destilación.
A partir de la biomasa residual obtenida de la determinación de GyA y previamente deshidratada y tratada en autoclave con una solución de cloruro de calcio ácida, se extrajo el almidón (Englyst et al., 2006) con el método espectrofotométrico y se añadió Lugol para determinar su porcentaje (Ortiz-Sánchez et al., 2015). La mezcla obtenida de dicha extracción se centrifugó y al precipitado resultante se lo sometió a hidrólisis consecutivas para determinar la hemicelulosa, la lignina y la celulosa (Kulic & Radojicic, 2011), en tanto que al sobrenadante se le adicionó etanol al 96 % para precipitar las pectinas que luego fueron cuantificadas gravimétricamente.
Caracterización microbiológica de los residuos
Para el recuento de bacterias totales se preparó agar Plate Count (PC) (Merck®), para las amilolíticas, agar almidón al 1 % (AA), para las celulolíticas, agar carboximetilcelulosa (CMC), para las ligninolíticas, agar salvado de trigo (AS), para las lipolíticas, agar Tween 80 (AT) y para las proteolíticas, agar leche (AL). Por último, se prepararon agar azure B (AZ), agar ABTS (ABTS) y agar lignina alcalina con guayacol (AG) para la selección de microorganismos ligninolíticos. Para el aislamiento de las bacterias totales, las amilo-líticas, las celulolíticas, las ligninolíticas, las lipolíticas y las proteolíticas, se sembraron en superficie las diluciones 10-5 y 10-6 en los agares PC, AA, CMC, AS, AT y AL, respectivamente, y se incubaron a 37 °C durante 48 horas.
Los microorganismos se seleccionaron a partir de colonias con diferentes características morfológicas obtenidas de los aislamientos bacterianos. Para los microorganismos amilolíticos, celulolíticos, proteolíticos y lipolíticos, se verificó la presencia de halos de hidrólisis en los agares AA, CMC, AL y AT, respectivamente. Por último, para los microorganismos lignilolíticos se hicieron siembras en los agares AZ, ABTS y AG y se verificó su crecimiento y sus zonas de aclaramiento.
Los microorganismos seleccionados se aislaron por estría y se preservaron a -80 °C para su uso potencial en procesos de obtención de enzimas bacterianas. Las diferencias significativas de los resultados fisicoquímicos se determinaron mediante un análisis de varianza (ANOVA) de un factor con un nivel de significación de 0,05 (ver el material suplementario, https://www.racceiyn.co/index.php/racceiyn/article/view/1652/3264).
Resultados y discusión
En la tabla 1 se presentan los resultados de los 12 parámetros fisicoquímicos evaluados en los seis tipos de residuos clasificados y recolectados de la plaza distrital de mercado de El Restrepo en Bogotá. Los residuos de tubérculos (R1) registraron el mayor porcentaje de almidón, con 41,9 ± 1,18 %, y diferencias significativas (p=0,02) frente al porcentaje encontrado en los demás residuos, en los que este polímero no superó el 2,5 °% del contenido total. Ello se explica porque el R1 estaba compuesto principalmente por desperdicios de papa y este tubérculo presenta un alto contenido de almidón, entre un 60 y un 80 % (Robertson et al., 2018).
Tabla 1 Caracterización fisicoquímica de residuos agrícolas generados en la plaza distrital de mercado de El Restrepo (Bogotá D.C.)
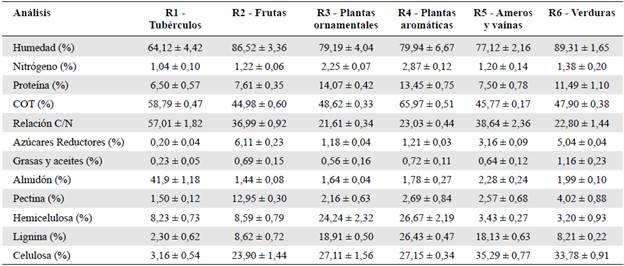
Los residuos de frutas (R2) presentaron el mayor contenido de pectina (12,95 ± 0,30 %), seguido por los R6 (4,02 ± 0,88 %). Aunque en los demás residuos este compuesto no superó el 3 %, no se encontraron diferencias significativas (p=0,12) frente al R2, lo que probablemente se debió a la variabilidad de las frutas presentes en este durante los diferentes muestreos. El contenido de pectina difirió según la clase de fruta caracterizada: por ejemplo, las cáscaras de cítricos registraron los contenidos más altos, desde un 10,6 hasta un 25 % (Müller et al., 2016; Twinomuhwezi et al., 2020), en tanto que en las cáscaras de banano y mango se reportaron porcentajes inferiores, entre 2,8 y 8,8 % (Panchami & Gunasekaran, 2017).
Los residuos de plantas ornamentales y aromáticas (R3 y R4) presentaron la mayor cantidad de proteína, con valores de 13,45 ± 0,75 % y 14,07 ± 0,42 %, respectivamente, aunque sin diferencias significativas (p=0,29). En estos porcentajes también podrían estar incluidos aminoácidos libres, ya que con el método utilizado para la determinación de proteína se cuantificó el nitrógeno total (Mœhre et al., 2018). En este sentido, los porcentajes de proteínas reportados por Pereira et al. (2015) en plantas aromáticas fueron generalmente menores a los determinados en R3 y R4.
En términos generales, R3 y R4 presentaron una caracterización fisicoquímico similar: por ejemplo, el contenido de hemicelulosa estuvo entre 24,24 ± 2,32 % y 26,67 ± 2,19 %, sin diferencias significativas (p=0,63). Sin embargo, sí se evidenciaron diferencias significativas en los resultados de lignina y COT (p<0,001), siendo mayor el porcentaje en las plantas aromáticas. La concentración de estos tres parámetros en R4 fue mayor en comparación con R3 y los demás residuos evaluados (Tabla 1). El alto contenido de COT en R3 y R4 se explica por su composición de lignina, hemicelulosa y celulosa, compuestos de estructura compleja que contienen considerables cantidades de carbono (Xu, 2010; Nair et al., 2017).
Los residuos de ameros de mazorca y vainas de leguminosas (R5) presentaron el mayor porcentaje de celulosa (35,29 ± 0,77 %), seguidos por los residuos de hojas y tallos tiernos de verduras (R6) (33,78 ± 0,91 %), pero sin diferencias significativas entre ellos (p=0,19). Aunque la celulosa se encuentra naturalmente en la pared celular de los vegetales, la mayor concentración de este polímero se da en hojas y tallos (Kulic & Radojičić, 2011; Kögel Knabner & Amelung, 2014), por lo que en R5 y R6 se pudieron encontrar las más altas concentraciones de celulosa, comparables con las reportadas en residuos agrícolas de origen similar, como hojas, tallos y ameros de mazorca (35,6 -41,2 %), residuos herbáceos (29,9 - 45,3 %) y de coliflor (35,0 - 66,97 %) (Toushik et al., 2017; Deshavath et al., 2019).
El contenido de grasas y aceites fue menor en comparación con los otros parámetros evaluados (Tabla 1) y con otros residuos agrícolas como el salvado de trigo, los desperdicios de café y las cáscaras de yuca y de banano caracterizados por otros autores (Ravindran et al., 2018).
Según los resultados de la caracterización fisicoquímica (Tabla 1), los residuos de tubérculos (R1) podrían aprovecharse como sustratos en la producción de amilasas por su contenido de almidón. Otros estudios han demostrado que a partir de residuos de cáscaras de papa se pueden obtener enzimas amilolíticas (Obi et al., 2019; Sánchez & Heredia, 2020). Dado el porcentaje de lignina de los residuos de plantas aromáticas (R4) y ornamentales (R3), estos podrían usarse en la obtención de ligninasas, en tanto que los ameros de mazorca, las vainas de leguminosas (R5) y los residuos de verduras (R6) podrían usarse en la producción de celulasas gracias a su composición celulósica. De hecho, se han evaluado los residuos agroindustriales del maíz y de tallos de flores como sustratos para la producción de enzimas lignocelulolíticas (Amadi et al., 2020; Heredia & Sánchez, 2021).
Para aprovechar los residuos de frutas (R2) de las plazas de mercado, estos deben seleccionarse durante la recolección, de manera que su composición esté representada principalmente por cáscaras de cítricos, ya que tienen la mayor cantidad de este polímero. Asimismo, para producir proteasas a partir de los residuos de plazas de mercado se deberán complementar las plantas ornamentales y aromáticas con otros residuos de cereales como avena o trigo y de leguminosas como frijol, lenteja, garbanzo y arveja, ya que estos presentan mayores contenidos de proteínas que los R3 y R4 (Mohammad & Teow, 2015; Gorissen et al., 2018).
Los residuos recolectados en la plaza distrital de mercado de El Restrepo y evaluados en este estudio contienen porcentajes de grasas y aceites entre 0,23 ± 0,05 % y 1,16 ± 0,23 %, cantidades que no permitirían su aprovechamiento como sustrato en la producción de lipasas. Las semillas de mango y mamey, entre otras, podrían considerarse como posibles sustratos para la producción de lipasas, ya que presentan mayores contenidos de grasas y aceites (Fuentes & Durán, 2005). Sin embargo, además de las posibles dificultades en su pretratamiento para el aprovechamiento en la producción de enzimas, no se las ha encontrado en los residuos recolectados en plazas de mercado.
Aunque el uso de R1 y R6 como sustratos en la obtención de enzimas microbianas puede verse limitado porque el nitrógeno, fundamental para el crecimiento de los microorganismos (Zhang et al., 2019), presentó un bajo porcentaje (1,04 a 2,87 %) en estos residuos. Esto podría subsanarse suplementando los sustratos con fuentes adicionales de nitrógeno. La relación C-N de R3, R4 y R6 estuvo entre 21,61 y 23,03, lo que favorecería el crecimiento microbiano en ellos, pues una relación entre 20 y 30 facilita la disponibilidad de los nutrientes (Brust, 2019). Además, el bajo contenido de azúcares reductores en los residuos evaluados sería una ventaja para que los microorganismos utilicen como fuente de energía polímeros como el almidón, la celulosa y la lignina, disponibles en todos los tipos de residuos estudiados, en lugar de moléculas sencillas como la glucosa.
Es importante mencionar que la clasificación que se hizo para este estudio incluye seis tipos de residuos que, dependiendo del día de la semana y la época del año, podrían variar en su composición, lo cual afecta, a su vez, la reproducibilidad de los resultados de la caracterización fisicoquímica. Esto se evidencia en los resultados de la tabla 1: por ejemplo, en el porcentaje de humedad se presenta una variación entre ± 1,65 y ± 6,67 en las desviaciones estándar de todos los residuos. En los residuos agrícolas evaluados se encontró una población bacteriana con diversa capacidad enzimática (Figura 1). Los microrganismos lipolíticos se caracterizan por metabolizar grasas y aceites, por lo que generalmente se aíslan a partir de residuos con alto contenido de lípidos (Peil et al., 2016; Furini et al., 2018; Rihani et al., 2018). En nuestro estudio, sin embargo, las bacterias lipolíticas presentaron la mayor concentración, a pesar de que el contenido de grasas y aceites en los residuos evaluados estuvo por debajo de 1,16 ± 0,23 % (Tabla 1). Es posible que la elevada población de bacterias lipolíticas en estos residuos haya generado una acelerada degradación de las grasas y aceites presentes, lo que se reflejaría en los resultados determinados para estos compuestos. El recuento de bacterias lipolíticas en residuos agrícolas estuvo dentro del rango (7,00x106 a 6,13x108 CFU/g) reportado para desperdicios de comida recolectados en un restaurante (Tsai et al., 2007).
Las bacterias celulolíticas presentaron el segundo recuento más alto entre los residuos evaluados (Figura 1). Este resultado se debe probablemente al alto contenido de celulosa determinado en R2 a R6 (Tabla 1), lo que demuestra que los residuos agrícolas generados en plazas de mercado son una fuente importante de microorganismos y de sustratos para la producción de celulasas. Si bien es cierto que la mayoría de las celulasas obtenidas a partir de la fermentación de residuos agroindustriales se producen con sustratos como el salvado de trigo y la cascarilla de arroz (Bharti et al., 2018; Soeka & Sulistiani, 2019; Navaneethapandian et al., 2021; Santos et al., 2021; Beladhadi et al., 2022), los residuos de frutas, plantas ornamentales y medicinales, ameros de mazorca, vainas de leguminosas y verduras serían una nueva opción de sustratos de bajo costo para la producción de celulasas debido a su contenido de celulosa.
Los residuos que aportaron una concentración considerable de almidón fueron los de tubérculos (Tabla 1), al parecer en niveles suficientes para permitir el crecimiento de bacterias amilolíticas, con un recuento de 1,7x108 CFU/g, menor al reportado en lagos y suelos de plantaciones de banano (Adriano et al., 2012; Ojovan et al., 2021). En estos estudios las bacterias proteolíticas también fueron las de menor representación, en tanto que en los residuos evaluados aquí, los microorganismos proteolíticos presentaron una mayor cantidad (Figura 1). Las bacterias ligninolíticas, al igual que las proteolíticas, tuvieron poca representación frente a las demás poblaciones evaluadas, con un recuento de 1,5x108 CFU/g, similar al reportado para otros residuos lignocelulósicos (Ventorino et al., 2013; Parillo et al., 2017). La lignina es un polímero más fácilmente degradable por los hongos que por las bacterias, por lo que estas la asimilan más lentamente y su recuperación en medios de cultivo puede ser limitada (Janusz et al., 2017). Los residuos evaluados no estaban constituidos exclusivamente por fuentes proteicas, lo que se evidenció en el bajo porcentaje de proteína determinado (Tabla 1). Además, el método usado en nuestro estudio cuantifica el nitrógeno total sin discriminar el orgánico del inorgánico, por lo que los microorganismos podrían tomar las fuentes inorgánicas de nitrógeno o aminoácidos libres para su metabolismo sin verse obligados a producir proteasas para la obtención de nitrógeno a partir de proteínas, razón por la que posiblemente la proporción de la población proteolítica fue menor que la de las demás poblaciones microbianas determinadas.
A partir de los residuos agrícolas se lograron aislar e identificar 133 colonias bacterianas de morfología diferente que fueron evaluadas cualitativamente en cuanto a su actividad enzimática, obteniéndose un total de 55 cepas preseleccionadas: 17 ligninolíticas, 14 pro-teolíticas, 11 celulolíticas, 9 lipolíticas y 4 amilolíticas.
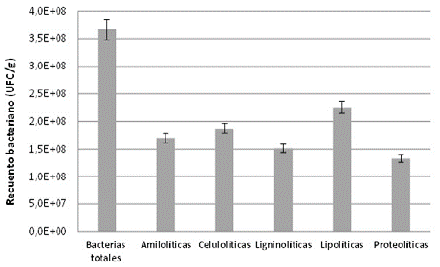
Figura 1 Recuento de bacterias presentes en residuos agrícolas generados en la plaza distrital de mercado de El Restrepo
A pesar de que las bacterias ligninolíticas y proteolíticas tuvieron los menores recuentos (Figura 1), de ellas se preseleccionó el mayor número de cepas. Esto sugiere que en estas dos poblaciones bacterianas se pudieron identificar colonias con mayor diversidad morfológica entre sí, comparadas con las bacterias amilolíticas, que, aunque con un mayor recuento (1,7x108 UFC/g), solamente registraron 24 morfotipos, de los cuales cuatro se seleccionaron por su actividad enzimática. En este caso, el porcentaje de selección de las bacterias amilolíticas fue del 16,7 %, mayor al reportado por Saha et al. (2019), quienes seleccionaron ocho cepas amilolíticas de 100 aisladas del suelo de vertederos de residuos de plazas de mercado.
Las 55 cepas aisladas tienen potencial para la producción de enzimas microbianas utilizando sustratos de bajo costo a partir de los residuos orgánicos generados en plazas de mercado, probablemente con mejores rendimientos debido a que estos microorganismos ya están adaptados a este medio. Sin embargo, es necesario realizar estudios adicionales de selección de cepas basados en métodos cuantitativos, así como ensayos de producción de enzimas a partir de los microorganismos con mayor actividad enzimática, y evaluar la producción de enzimas de las cepas seleccionadas en medios de cultivo elaborados a partir de esta biomasa residual.
Conclusiones
La composición fisicoquímica de los residuos agrícolas generados en plazas de mercado permite su valorización como sustratos para la producción de amilasas, celulasas y ligninasas. El contenido de almidón en los residuos de tubérculos podría aprovecharse en la producción de enzimas amilolíticas, y el porcentaje de celulosa en ameros de mazorca, vainas de leguminosas y residuos de verduras los convierte en un sustrato viable para la obtención de celulasas. Asimismo, las plantas aromáticas y ornamentales podrían utilizarse en procesos fermentativos para producir ligninasas. Aunque los residuos evaluados no son potencialmente utilizables en la producción de lipasas, proteasas y pectinasas, sí se pudieron seleccionar cepas lipolíticas y proteolíticas en ellos. Además, se lograron aislar y seleccionar bacterias amilolíticas, celulolíticas y ligninolíticas que también pueden utilizarse en la producción de enzimas aprovechando la biomasa residual generada en las plazas de mercado.















