Introducción
Potamotrygon magdalenae (Duméril) es una raya de agua dulce categorizada globalmente por la Unión Internacional para la Conservación de la Naturaleza (UICN) (Charvet-Almeida & Pinto, 2009) y nacionalmente por el Libro Rojo de Peces Dulceacuícolas (Mojica et al., 2012) como casi amenazada, aunque recientemente dicha categorización fue actualizada por la UICN como de preocupación menor (Lasso et al., 2016), y se la considera de muy alta prioridad para la investigación en el Plan de Acción Nacional para la Conservación y Manejo de Tiburones, Rayas y Quimeras de Colombia (PAN -Tiburones Colombia) (Caldas et al., 2010). Habita en la cuenca de los ríos Magdalena y Atrato (Araújo et al., 2004; Lasso et al., 2011, 2016) y tiene preferencia por las aguas turbias, de fondos arenosos y fangosos y corrientes lentas (Dahl, 1971; Mejía-Falla et al., 2016). La mayoría de sus presas son larvas del orden Diptera, de preferencia Chironomidae (Villa-Navarro, 1999; Lasso et al., 2011; Mejía-Falla et al., 2016).
Las poblaciones de P. magdalenae se ven amenazadas principalmente por la captura incidental durante las faenas de pesca artesanal y pesca dirigida a la comercialización ornamental (Ramos-Socha & Grijalba-Bendeck, 2011; Mejía-Falla et al., 2016). Aunque es una especie abundante, su extracción con fines ornamentales es muy alta comparada con otras del mismo género, lo que se añade al deterioro de su hábitat debido al vertimiento de químicos, metales pesados, y aguas negras, entre otros (Mejía-Falla et al., 2016). Algunas de las acciones propuestas para su conservación incluyen el fortalecimiento del sistema de registro y seguimiento de las capturas y la explotación de la raya para generar estadísticas fiables (Caldas et al., 2010).
Potamotrygon magdalenae es una especie vivípara aplacentada, con desarrollo de tro-fonemas que generan leche uterina (histótrofo), la cual complementa la nutrición proporcionada al embrión por la yema (Thorson et al., 1983). El tracto reproductivo de la hembra está formado por dos ovarios funcionales (Teshima & Takeshita, 1992; Pedreros-Sierra et al., 2016), con un mayor desarrollo del ovario izquierdo (Pedreros-Sierra et al., 2016); su fecundidad uterina va de tres a cinco embriones (Ramos-Socha & Grijalba-Bendeck, 2011), aunque se han llegado a registrar hasta diez (Lasso et al., 2014). Las tallas de madurez sexual registradas en P. magdalenae fluctúan entre 160 y 202 mm de ancho de disco (AD) en los machos (Ramos-Socha & Grijalba-Benedeck, 2011), con una talla mediana de madurez de 144 mm de AD y de preñez de 170,8 mm de AD en hembras (Pedreros-Sierra et al., 2016).
No se han hecho estudios para determinar y caracterizar morfológicamente los estadios de desarrollo embrionario en esta especie; sin embargo, Ramos-Socha (2010) describieron algunos aspectos de la morfología de los embriones en cuatro estadios de desarrollo de la especie (Lasso et al., 2014). Barbarino & Lasso (2005), por su parte, determinaron cinco estadios embrionarios en la raya dulceacuícola Paratrygon aiereba, perteneciente a la misma familia. Los cinco estadios se clasificaron según el desarrollo morfológico y el contenido de vitelo en el saco de la yema (alto, medio, bajo). Otros investigadores han descrito series parciales de desarrollo en distintas especies de condrictios: en quimeras de Callorhinchus mili (Didier et al., 1998) y en tiburones de Heterodontus portusjacksoni (Rodda & Seymour, 2008) y de Scyliorhinus canicula (Ballard et al., 1993), siendo esta última la más completa. En las especies batoideas, Luer & Walsh (2007) describieron el desarrollo embrionario completo de la raya ovípara Rostroraja eglanteria, en tanto que Ebert & Cowley (2009) describieron seis estadios de desarrollo en la fase final de la gestación en la raya vivípara marina Dasyatis chrysonota. Sin embargo, no existen otras tablas del desarrollo embrionario de batoideos vivíparos, posiblemente debido a las dificultades para obtener el material biológico.
Aquí se describe por primera vez la morfología externa de los embriones y fetos en una serie embrionaria de P. magdalenae para establecer una tabla de desarrollo comparable con la de otros batoideos y condrictios.
Materiales y métodos
Recolección de individuos
Se recolectaron hembras adultas y gestantes de P. magdalenae mediante pesca incidental con los métodos pasivo (trasmallo) y activo (atarraya) propuestos en el libro sobre las rayas dulceacuícolas de Suramérica de Gama et al. (2014). La captura se hizo en tres localidades de la cuenca del río Magdalena: la ciénaga de Paredes, entre Puerto Wilches y Sabana de Torres, en el departamento de Santander (7° 27' 19,7", N 73° 44' 47,7" W); la ciénaga Doña María, en el departamento del Cesar (8° 04' 47,6" N, 73° 41' 41,4" W), y la ciénaga de Zapatosa (9° 14' 56,9" N, 73° 48' 14,7" W). Las hembras gestantes suelen abortar casi inmediatamente después de la captura, por lo que los embriones se recolectaron en estos casos en el momento del aborto. Los embriones y fetos se colocaron en baldes con agua y roxicaina al 1 % para causarles la muerte por sobredosis de anestésico. A algunas hembras que no abortaron y a sus embriones se les aplicó la eutanasia para posteriormente fijarlas y preservarlas. Después, se les hizo la disección del tracto reproductor, se revisó el estado reproductivo y se verificó la presencia de embriones o fetos en los úteros. Los individuos recolectados se fijaron en formol al 10 % y posteriormente se almacenaron en etanol mediante el paso progresivo por un gradiente de etanol (30, 50 y finalmente 70 %). Los ejemplares adultos se incorporaron a la Colección Ictiológica del Museo de Historia Natural de Universidad Industrial de Santander.
Descripción morfológica
A cada hembra grávida capturada se le tomaron los datos morfométricos de ancho de disco (AD), longitud total (LT) y longitud de disco (LD) con una cinta métrica siguiendo los parámetros descritos por Lasso et al. (2014) y a los embriones recolectados utilizando un calibrador Vernier (precisión de 0,02 mm). Se relacionó la talla de las hembras capturadas que fueron disecadas y que no tuvieron abortos espontáneos con la fecundidad (AD con respecto al número de embriones uterinos) mediante una regresión lineal, siguiendo a Walker (2005).
Se establecieron y caracterizaron los estadios embrionarios de acuerdo con el estadio de desarrollo (segmentación, gastrulación, neurulación, crecimiento fetal) y con base en observaciones morfológicas macroscópicas detalladas a partir del AD, la LT y la LD, la distancia pre-cloaca, la de boca a cloaca, la longitud de la espina caudal, la de la cola, el diámetro del ojo, el del espiráculo y la longitud del clásper, la ausencia o presencia de filamentos branquiales, la pigmentación, los dientes, el saco vitelino y otros caracteres macroscópicos importantes descritos en la literatura especializada. Se tomaron fotografías con una cámara Canon PowerShot SX50 HS y los datos fueron tabulados; posteriormente, se hicieron representaciones gráficas resaltando los caracteres morfológicos importantes para la categorización de los estadios. La descripción de dichos estadios de desarrollo se hizo a partir de la comparación con estudios previos en condrictios (Ballard et al., 1993; Didier et al., 1998; Luer & Walsh, 2007; Maxwell et al., 2008; Rodda & Seymour, 2008; Ebert & Cowley, 2009).
Resultados
Estadios de desarrollo
Se obtuvieron 30 individuos en los que se determinaron nueve estadios de desarrollo desde la formación inicial de los arcos branquiales (faríngula) hasta los individuos neonatos que habían perdido el saco vitelino y presentaban cicatriz umbilical. El rango de la LD de los embriones y fetos fluctuó entre 43 y 105 mm y el AD entre los 40 y los 100 mm. En la tabla 1 se presentan los datos morfométricos registrados. El embrión más pequeño se obtuvo a finales de mayo, el feto más grande a mediados de enero, el neonato más pequeño (LT: 165 mm y AD: 75 mm) se capturó a mediados de octubre.
Tabla 1 Morfometría de los estadios de desarrollo ontogenético de Potamotrygon magdalenae (medidas en mm)
| Estadio | N | LT | SD | LD | SD | AD | SD |
|---|---|---|---|---|---|---|---|
| 1 | 1 | 8 | N/A | N/A | N/A | N/A | N/A |
| 2 | 1 | 22,98 | N/A | N/A | N/A | 5 | N/A |
| 3 | 3 | 112,33 | 2,51 | 46 | 3,60 | 42 | 1,73 |
| 4 | 4 | 135,5 | 4,12 | 50,5 | 1 | 45,25 | 1,5 |
| 5 | 5 | 149,8 | 1,09 | 58 | 0,70 | 53 | 0,70 |
| 6 | 6 | 157,33 | 19,96 | 63,5 | 8,66 | 58,66 | 8,40 |
| 7 | 3 | 184,66 | 4,50 | 77,33 | 1,15 | 72,33 | 4,04 |
| 8 | 2 | 200,5 | N/A | 84 | N/A | 79,5 | N/A |
| 9 | 3 | 236,66 | 43,68 | 98,33 | 11,54 | 91,66 | 14,43 |
LT: longitud total; LD: longitud de disco; AD: ancho de disco; SD: desviación estándar; N: número de muestras
Estadio 1
Se registraron dos embriones en estadio de faríngula, con LT de 8 y 9 mm; el primero de ellos se obtuvo mediante la disección de una hembra de 300 mm de AD y el segundo fue producto del aborto de una hembra con un AD de 350 mm, las dos capturadas en mayo. El embrión obtenido mediante disección se alojaba en el útero izquierdo de la hembra, y era el único embrión presente en el tracto reproductor.
En los embriones se observó el desarrollo de los arcos branquiales desde donde emergen tempranamente los filamentos branquiales, así como el de las placas ópticas, ubicadas lateralmente y sin pigmentación. Bajo la placa óptica se observó la cavidad celómica mandibular y en el dorso anterior del embrión la cavidad traslúcida asociada con la formación del cerebro (ventrículo cerebral). En la parte medial del cuerpo se observó la formación de los pliegues laterales que luego derivan en las aletas pectorales, en tanto que el tallo vitelino sobresalía ventralmente del embrión en medio de lo que después son las aletas pectorales, uniendo al embrión con el saco vitelino, el cual en este estadio representa casi tres veces el tamaño del embrión (Figura 1).
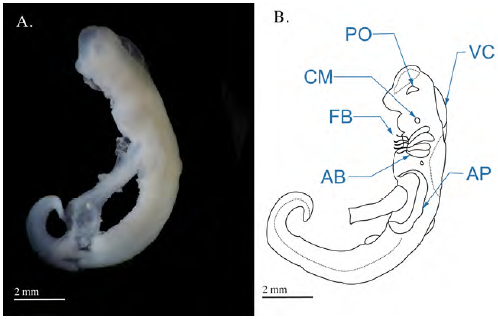
Figura 1 (A) Fotografía del embrión de Potamotrygon magdalenae en estadio 1 (faríngula). Se retiró el saco de la yema para observar mejor el embrión. (B) Detalles morfológicos en el embrión en estado de faríngula de Potamotrygon magdalenae. FB: filamentos branquiales; PO: placa óptica; CM: cavidad celómica mandibular; VC: ventrículo cerebral; AP: aleta pectoral; AB: arcos branquiales
Estadio 2
Se registró un embrión con LT de 22,98 mm en estado de organogénesis obtenido mediante la disección uterina de una hembra capturada en julio, a la cual le hacía falta la porción anterior del cuerpo, lo cual imposibilitó la toma de los datos morfométricos. La hembra tenía un único embrión en su útero derecho de una longitud pre-cloacal de 12,24 mm y una distancia de boca a cloaca de 8,21 mm (Figura 2). En este estadio los cinco arcos branquiales ya se encontraban completamente abiertos y exhibían una gran cantidad de filamentos branquiales de una longitud aproximada de 13 mm, es decir, un poco más de la mitad de la longitud total del cuerpo. La placa óptica comenzaba a tener pigmentación y aún se encontraba en posición lateral; eran visibles los orificios nasales ubicados en una protuberancia del rostro cercana a la apertura bucal. Las aletas pectorales se extendían lateralmente en la región media del embrión, haciendo contacto con las aperturas branquiales. En el tallo vitelino era visible la arteria vitelina, ramificada y formando una red de capilares en el saco vitelino. En este punto del desarrollo se observó claramente la formación de las aletas pélvicas, la apertura cloacal en medio de las aletas pélvicas y la formación de pliegues membranosos en la parte dorsal y ventral de la cola, la cual tenía una longitud de 10,6 mm. La línea lateral se observó en la parte dorsal del embrión y se visualizaban claramente los radios de las aletas pectorales y pélvicas.
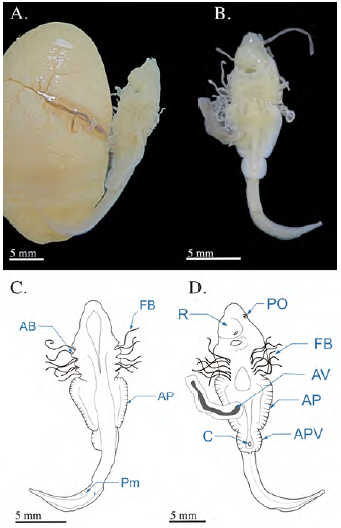
Figura 2 Fotografías del embrión de Potamotrygon magdalenae en estadio 2 (organogénesis). (A) embrión en vista completa unido al saco vitelino altamente vascularizado; (B) vista ventral del embrión separado del saco vitelino. Esquemas de embriones de Potamotrygon magdalenae en el estadio 2 en (C) vista dorsal y (D) ventral. AB: arcos branquiales; PO: placa óptica; FB: filamentos braquiales; APV: aletas pélvicas; C: cloaca; R: rostrum; Pm: pliegues membranosos caudales; AV: arteria vitelina
Estadio 3
Se encontraron tres embriones en organogénesis con un AD de 42 mm (SD ± 1,73), que habían sido abortados en julio; no se pudo registrar el AD de la madre. Como es de rigor en este estadio, las cinco aperturas branquiales continuaban presentando filamentos branquiales con una longitud aproximada de 14 mm. Se evidenció un mayor desarrollo de las placas ópticas, las cuales después pasan a formar las vesículas ópticas, con un diámetro medio de 3 mm; estas presentaban pigmentación negra en los bordes. Como sucede en este estadio, se observó la migración de las vesículas ópticas, las cuales pasan de su posición lateral hacia la región dorsal del cuerpo. En la parte inmediatamente posterior de las vesículas ópticas se observó la formación de los espiráculos, con un diámetro de 4,4 mm, y el desarrollo temprano de la válvula espiracular como una membrana translúcida y delgada al interior de estos. Los orificios nasales ya habían migrado hacia la boca quedando estrechamente unidos con la apertura bucal y la distancia media de boca a cloaca había aumentado a 29,83 mm ± 1,69. Las aletas pectorales se extendían y fusionaban con la región branquial y con el rostrum, completamente extendido en esta etapa, formando el disco corporal. La distancia pre-cloaca había aumentado a 37,8 mm (distancia media ± 1,68). El dorso del embrión continuaba sin pigmentación; las aletas pélvicas estaban completamente desarrolladas, y en los machos se observó la modificación de la aleta pélvica que determina la formación de los clásper. Se evidenció por primera vez la presencia de una mancha caudal de color pardo en la región media de la cola, de 4,83 ± 0,06 mm, zona en la que se forma la espina caudal. La longitud media de la cola era de 69,53 mm ± 3,62 (Figura 3).
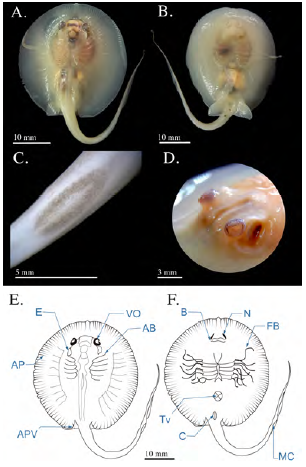
Figura 3 Fotografías estadio 3 (organogénesis) de desarrollo de Potamotrygon magdalenae; (A) vista dorsal del embrión; (B) vista ventral; (C) detalle de la mancha caudal en la región media de la cola; (D) detalle de la vesícula óptica. Esquema de embrión de Potamotrygon magdalenae en estadio 3. (E) vista dorsal; (F) vista ventral. E: espiráculo; VO: vesícula óptica; FB: filamentos branquiales; AP: aleta pectoral; AB: Arcos branquiales; APV: aleta pélvica; MC: mancha caudal; C: cloaca; Tv: tallo vitelino; N: narinas; B: boca
Estadio 4
Se registraron cuatro embriones en organogénesis tardía, con un AD medio de 45 mm (SD±1,5), que habían sido abortados por una hembra con un AD de 340 mm capturada en enero. Se observó en ellos el inicio de la contracción de los filamentos branquiales propio de este estadio, así como la reducción de la longitud y la cantidad de los filamentos de la primera apertura branquial, que disminuyen casi la mitad de su longitud con respecto a los filamentos de las demás aperturas branquiales, los cuales presentaban una longitud aproximada de 16 mm. Se hizo muy evidente el desarrollo del ojo, el cual deja de ser una vesícula óptica para formar un globo ocular con mayor pigmentación y presencia del cristalino, y cuyo diámetro había aumentado hasta 3,27 mm (± 0,05). Los espiráculos ya habían aumentado su diámetro a 4,85 mm (± 0,1); se observó un engrasamiento de la válvula espiracular, la cual cerraba casi la totalidad del espiráculo. La distancia boca-cloaca había continuado aumentando y alcazaba ya los 33,05 mm ± 0,66. La longitud precloaca era de 42,82 mm ± 1,09. La mancha caudal aumentó su longitud y se evidenció una leve queratinización en su zona media indicativa de la formación de la espina caudal; la longitud de la cola había alcanzado los 89,82 mm (± 2,8). El saco vitelino había reducido la cantidad de vitelo a 1/6 del tamaño corporal, aproximadamente (Figura 4).
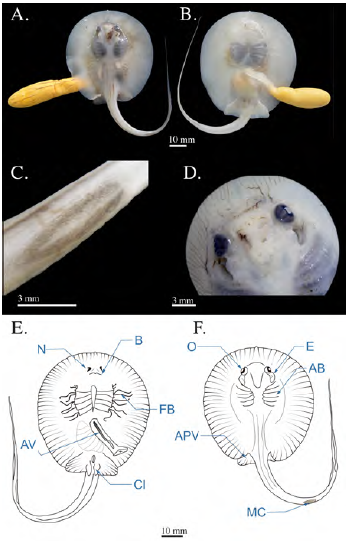
Figura 4 Fotografías del estadio 4 (organogénesis tardía) de Potamotrygon magdalenae. (A) vista dorsal; (B) vista ventral; (C) detalle de leve queratinización de lo que será la espina caudal; (D) detalle del glóbulo ocular. Esquema de embrión de Potamotrygon magdalenae en estadio 4, (E) vista ventral, (F) vista dorsal. O: ojos; E: espiráculo; MC: mancha caudal; FB: filamentos branquiales; APV: aletas pélvicas; AB: arcos branquiales; N: narinas; B: boca; CL: clásper; AV: arteria vitelina
Estadio 5
Se encontraron cinco embriones en el estadio final de organogénesis, con un AD medio de 53 mm ± 0,70, los cuales eran producto del aborto de una hembra de 280 mm de AD capturada en enero. Esta etapa se caracteriza principalmente por el retraimiento total de los filamentos branquiales en todas las aperturas branquiales, con lo que culmina la formación de las branquias. Se observó la formación completa de la válvula espiracular, lo que cierra la totalidad del espiráculo para permitir el bombeo de agua; el diámetro de los espiráculos era de 6,08 mm (± 0,08). Los ojos continuaban aumentando su diámetro y alcanzaron los 3,7 mm (± 0,15). En los fetos se observó el desarrollo de la espina caudal, la cual podía visualizarse fácilmente y presentaba una base ancha y un ápice agudo con una longitud media de 8,18 mm ± 0,30; la longitud de la cola llegaba a los 95,22 mm ± 2,05. Presentaban una distancia pre-cloacal de 49,32 mm ± 0,75 y de boca a cloaca de 37,58 mm ± 0,973. Se observó una ligera reducción del contenido vitelino en el saco de vitelo comparado con el estadio anterior, pero este todavía constituía aproximadamente un 6 % del tamaño del embrión. Los fetos empezaban a mostrar leves signos de pigmentación en algunas partes del dorso, junto a los radios del disco, y dos franjas a lo largo de la cola. Se observó una mayor elongación de los clásper en los individuos machos (5 mm) (Figura 5).
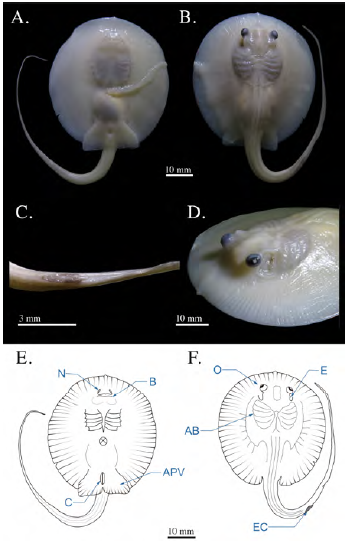
Figura 5 Fotografías del estadio 5 de desarrollo en Potamotrygon magdalenae. (A) vista ventral; (B) vista dorsal; (C) detalle del desarrollo de la espina caudal; (D) detalle del globo ocular y la válvula espiracular. Esquemas de un embrión de Potamotrygon magdalenae en estadio 5, vista ventral (E). APV: aleta pélvica; C: cloaca; B: boca; N: narinas. Vista dorsal (F). O: ojos; EC: espina caudal; AB: arco branquial; E: espiráculo
Estadio 6
Se hallaron siete fetos con un AD medio de 58,66 mm ± 8,40, provenientes de la disección de tres hembras capturadas en mayo, con un AD de 255 a 265 mm, y del aborto de una hembra con un AD de 168 mm capturada en marzo. La primera hembra contenía tres fetos (uno en el útero derecho, dos en el útero izquierdo); la segunda tenía dos fetos, uno en cada útero, y la hembra más pequeña mantenía un solo feto en su útero izquierdo.
Este estadio se caracteriza por la fuerte pigmentación en todo el cuerpo, un patrón moteado en el dorso y la cola de manchas amarillo oliva con fondo marrón oscuro y coloración ventral blanca. Eran fácilmente visibles las placas dentarias superior e inferior; el diámetro del ojo había alcanzado los 4,14 mm ± 0,16 y el diámetro de los espiráculos, los 6,97 mm ± 0,48. La espina caudal tenía una longitud media de 11,87 mm (± 3,03), presentaba bordes lisos y una pequeña esfera en la punta. En los individuos machos los clásper llegaban a alcanzar una longitud media de 7,1 mm ± 0,36 y su tamaño corporal había aumentado: la distancia pre-cloacal llegaba a los 52,67 mm (± 5,89) y la de boca a cloaca, los 38,47 mm ± 2,16; el largo de la cola era de 106,01 mm (± 16,51). En esta etapa los fetos ya habían absorbido el vitelo del saco vitelino, reduciendo su tamaño hasta 4 % del tamaño corporal aproximadamente; se pudo observar el vitelo absorbido a través de la cavidad abdominal, y su presencia en el tracto digestivo (Figura 6).
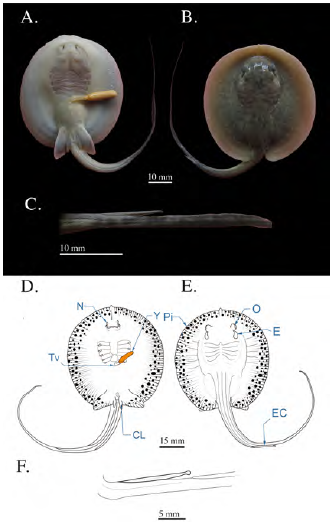
Figura 6 Fotografías del estadio 6 de Potamotrygon magdalenae. (A) Embrión vista ventral; (B) vista dorsal; (C) detalle de la espina caudal (punta redondeada). Esquema del feto en estadio 6 de Potamotrygon magdalenae. Vista dorsal (D); vista ventral (E); esquema del detalle de la espina caudal (F). Pi: pigmentación corporal; Y: yema; CL: clásper; Tv: tallo vitelino; N: narinas; O: ojos; E: espiráculos
Estadio 7
Se registraron tres fetos en estadio de pre-alumbramiento, con un AD medio de 72,33 mm ± 4,04, los cuales habían sido abortados por una hembra con un AD de 235 mm capturada en enero. En este estadio pudo constatarse la pigmentación corporal ligeramente más intensa, con un tono pardo más oscuro (Figura 7a y b). El globo ocular tenía un diámetro de 4,3 mm ± 0,1 y los espiráculos medían 7,53 ±0,5 mm; la distancia pre-cloaca había aumentado hasta los 61,2 mm (± 4,59) y la de boca a cloaca, 44,93 mm (± 3,31). La longitud de la cola ya había alcanzado los 117,16 mm (± 0,55) y la espina caudal había perdido la forma esférica en su ápice, pasando a tener un ápice agudo, sin embargo, la espina caudal mantenía sus bordes lisos (Figura 7c); la longitud de la espina caudal era de 15 mm (± 0,79). En individuos machos, los cláspers ya tenían 8,4 mm de longitud. El contenido de vitelo del saco vitelino se había reducido notablemente, hasta menos del 4 % del tamaño corporal (Figura 7).
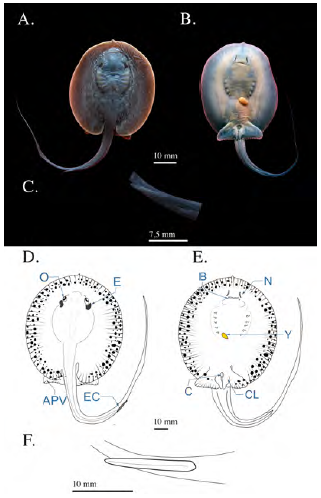
Figura 7 Fotografías de feto en estadio 7 (pre- alumbramiento) de Potamotrygon magdalenae. (A) vista dorsal; (B) vista ventral; (C) detalle de la espina caudal. Esquema general de feto pre-alumbramiento de Potamotrygon magdalenae. (D) Vista dorsal; (E) vista ventral; (F) esquema de detalle de espina caudal. Y: yema; EC: espina caudal; CL: clásper; C: cloaca; E: espiráculos; O: ojos; APV: aletas pélvicas; B: boca; N: narinas
Estadio 8
Se encontraron dos hembras neonatas muy similares en tamaño y forma capturadas con atarraya en octubre, con un AD medio de 79,5 mm. Este estadio corresponde a individuos neonatos recientes en los cuales se observa el rezago del saco vitelino, el cual se encuentra muy reducido, con una longitud de aproximadamente 4,5 mm incluido el tallo vitelino (Figura 8). La pigmentación corporal se mantiene sin presentar grandes cambios con respecto al estadio 7. Las neonatas tenían un diámetro medio ocular de 4,6 mm; sus espiráculos habían alcanzado un diámetro de 7,3 mm; la espina caudal había alcanzado una rigidez total y presentaba bordes ligeramente aserrados, muy similares a los de los individuos adultos; la longitud media de la espina caudal alcanzaba los 14,5 mm. La longitud media de la cola fue de 114 mm, la distancia media pre-cloaca de 66,5 mm y la distancia de boca a cloaca alcanzó una media de 57,93 mm.
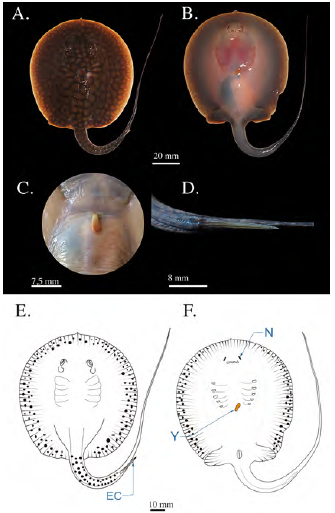
Figura 8 Fotografías de neonato en estadio 8 de Potamotrygon magdalenae. (A) Vista dorsal; (B) vista ventral (C) detalle de rezago del saco vitelino; (D) detalle de espina caudal. Esquema de un neonato de Potamotrygon magdalenae en estadio 8, vista dorsal (E), vista ventral (F). EC: espina caudal; N: narinas; Y: yema
Estadio 9
Se registraron tres individuos juveniles en los que se había absorbido la totalidad del saco vitelino dejando una pequeña ranura en la región medial del disco, la cicatriz umbilical; el AD medio fue de 91,6 mm (± 14,43) y la distancia pre-cloaca de 78,9 mm (± 11,73). El diámetro ocular era de 4,83 mm (± 0,15) y el del espiráculo de 7,43 mm (± 0,57). La espina caudal tenía una longitud de 18,63 mm (± 1,85) y presentaba bordes aserrados iguales a los individuos adultos. Se observaron dos morfotipos diferenciados por el patrón de coloración y la longitud de la cola: uno moteado de manchas amarillo-oliva, irregular, con diámetro superior al del diámetro ocular y de fondo marrón, con una longitud de la cola de 1,8 veces el largo del disco (LD): el otro morfotipo se caracterizaba por ser moteado con manchas de color pardo-oliva, un diámetro inferior o igual al diámetro ocular de fondo marrón oscuro y una longitud de cola de aproximadamente 1,2 veces del LD (Figura 9). La distancia media pre-cloaca y de boca a cloaca fue de 78,9 (± 11,73) y 59,93 mm (± 8,35), respectivamente.
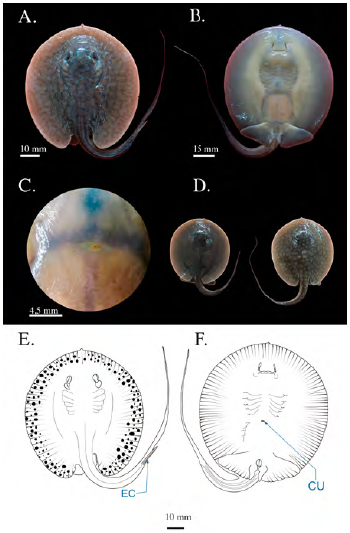
Figura 9 Fotografías del estadio 9 (juveniles) de Potamotrygon magdalenae. (A) vista dorsal; (B) vista ventral; (C) detalle de la cicatriz umbilical; (D) fotografía de los dos patrones de coloración encontrados. Esquema de individuo juvenil de Potamotrygon magdalenae en vista dorsal (E), vista ventral (F). CU: cicatriz umbilical, EC: espina caudal
Fecundidad
Se capturaron nueve hembras grávidas; la más pequeña se encontró en abril (168 mm de AD y 410 mm de LT) y la más grande en mayo (350 mm de AD y 690 mm de LT); la fecundidad máxima fue de 5 embriones y la fecundidad media de 2,34 (± 1,5). El tamaño de las hembras no se relacionó de manera significativa con el número de embriones uterinos (r2=0,06, p=0,51).
Discusión
En este estudio se describe por primera vez el desarrollo embrionario de una raya vivípara aplacentaría perteneciente a la familia Potamotrygonidae. El número de embriones estudiados fue superior a la cantidad de los empleados en un estudio de desarrollo embrionario de batoideos vivíparos en Rhinobatos hynnicephalus (Zheng & Qui, 1993), el cual contó solo con cinco embriones, y similar al número usado en D. chrysonata (27 embriones) (Ebert & Cowley, 2009), lo que evidencia las dificultades para la obtención de embriones de batoideos vivíparos.
Los cuatro estadios de desarrollo de P. magdalenae descritos por Ramos-Socha (2010) y Lasso et al. (2014) serían equivalentes a varios de los estadios descritos aquí. Así, el estadio 1 descrito por Ramos-Socha, en el que el embrión tenía un AD de 30 mm y un cuerpo traslúcido con gran contenido de vitelo y sin desarrollo de dientes ni espina caudal, podría corresponder al estadio 3 aquí descrito. Asimismo, el estadio 2 descrito por Ramos-Socha incluyó caracteres como el cuerpo pigmentado de color café, la presencia del saco vitelino e indicios de la espina caudal, lo que correspondería al estadio 5 en nuestro estudio. El estadio 3 descrito por Ramos-Socha se caracteriza por un cuerpo con manchas circulares notables en la región dorsal, presencia de saco vitelino y una espina caudal más desarrollada, lo que se asemejaría al estadio 6 descrito aquí; por último, el estadio 4 descrito por Ramos-Socha, caracterizado por cuerpo y cola rígidos, color oscuro y manchas diferenciadas, dientes, espina caudal y ausencia de saco vitelino, correspondería al estadio 7 en nuestro estudio, es decir, fetos listos para el nacimiento. Sin embargo, el trabajo de Ramos-Socha (2010) no tenía como objetivo la descripción de la tabla de desarrollo embrionario y, por lo tanto, la precisión relativa de la descripción de los caracteres y la morfometría no permite una mejor comparación y equivalencia entre los estadios de los dos estudios.
En general, el desarrollo embrionario temprano de los condrictios es muy similar (Brant, 2006). Sin embargo, varios aspectos de su plan morfológico corporal (aplanamiento dorso-ventral en las rayas) difieren en el desarrollo de las rayas y los tiburones. Una de las diferencias se refiere a la migración de las vesículas ópticas desde la posición lateral hacia la región dorsal, que en P. magdalenae ocurre entre el estadio 2 y el 3, al igual que el cambio de la posición de los arcos branquiales de su posición lateral hacia la región ventral del embrión. Estas son características generales del desarrollo embrionario en todos los batoideos, así como la reubicación mandibular, la cual está asociada con la depresión corporal y la fusión de las aletas pectorales con el cuerpo propias de la morfología particular de las rayas (Maxwell et al., 2008) y constituyen la principal diferencia en el desarrollo de batoideos y selacios (McEachran & Carvalho, 2002).
En cuanto al desarrollo de las aletas pélvicas en P. magdalenae, estas se hacen visibles por primera vez en el estadio 2 y se mantienen acordes con el desarrollo de otros batoideos, como Leucoraja ocellata (Maxwell et al., 2008), especie en la que éstas se forman después del inicio del desarrollo de las aletas pectorales y se hacen completamente visibles en la organogénesis temprana. De la misma manera ocurre en los tiburones, no así en los holocéfalos, en los que sucede un poco después de la aparición de las aletas pectorales (Didier et al., 1998). También se encuentran diferencias en el desarrollo de las membranas caudales de P. magdalenae comparado con el de los batoideos ovíparos; en la raya ovípara L. ocellata se presenta un desarrollo temprano de esta estructura con un tamaño relativamente mayor que el de P. magdalenae. Esto no es motivo de sorpresa, ya que en L. ocellata el embrión usa la membrana caudal como mecanismo primario para contribuir con la recirculación de agua al interior del huevo y el intercambio gaseoso (Thomason et al., 1996; Maxwell et al., 2008); en situaciones de anoxia estos movimientos caudales aumentan, lo que permite que al interior del huevo las condiciones de oxígeno mejoren considerablemente, como se ha visto en Leucoraja erinacea (Di Santo et al., 2016).
Por otra parte, en P magdalenae los filamentos branquiales sobresalen de todas las aperturas branquiales; no obstante, no se observó la presencia de filamentos sobresalientes de los espiráculos, lo cual concuerda con lo observado en Rostroraja eglanteria (Luer & Walsh, 2007) y Sympterygia acuta (Brant, 2006); sin embargo, en el tiburón Heterodontus portusjacksoni (Rodda & Seymour, 2008) sí se observan filamentos branquiales sobresalientes de los espiráculos. En cuanto al rostrum, en P. magdalenae se observa su extensión en el estadio 3, lo que ocurre de manera simultánea con la fusión de las aletas pectorales y la formación del disco corporal; estos resultados son similares al desarrollo de los demás batoideos vivíparos y ovíparos, como el caso de R. eglanteria (Luer & Walsh, 2007) y D. chrysonota (Brant, 2006), pero difiere del desarrollo del tiburón S. canícula (Ballard, 1993) en el que la extensión del rostrum ocurre en etapas más tardías debido a las claras diferencias del plan corporal entre rayas y tiburones.
Como en otras especies de rayas (L. ocellata) (Maxwell et al., 2008) y R. eglanteria (Luer & Walsh, 2007), la pigmentación corporal inicia con pequeños puntos aislados y, simultáneamente, los filamentos branquiales llegan a su máxima longitud y la pigmentación se completa en el dorso del feto después de la retracción total de los filamentos branquiales. El desarrollo de la espina caudal inicia en el estadio 3, apareciendo como una mancha en la sección media de la cola, la cual posteriormente aumenta su grado de queratinización y longitud; en el estadio 6 aparece una punta esférica, denominada bulbo terminal en Myliobatiformes (Wyffels, 2009), lo que sugiere que esta modificación evita las perforaciones del útero mientras el feto culmina su formación. En el estadio 7 (pre-parto) la punta de la espina adquiere un ángulo agudo, lo que se asocia con la adquisición de un mecanismo de defensa desde el nacimiento.
Existen diferencias en la absorción del vitelo del saco de la yema, pues ocurre de manera más acelerada en los estadios posteriores a la organogénesis en P. magdalenae que en los condrictios ovíparos, los cuales conservan un mayor volumen de vitelo externo. Esta diferencia se explica por la viviparidad matrotrófica de esta especie, evidenciada por la presencia de trofonemata en el útero de las hembras grávidas, y después de la gestación (Pedreros-Sierra et al., 2016). Este modo reproductivo es característico de los potamotrygónidos (Lasso et al., 2010), en los que la producción de un histótrofo a nivel uterino complementa la nutrición embrionaria, por lo que una buena parte del saco vitelino es absorbido y almacenado tempranamente en el hígado (McMillan, 2007). En la familia Myliobatidae, como en Myliobatis goodei (Colonello et al., 2013), los trofonemata ingresan por la boca liberando histótrofo para completar la nutrición embrionaria, como se ha registrado en otros estudios (Babel, 1967; Smith & Merriner, 1986), al igual que a través de los espiráculos (White et al., 2001). En la especie estudiada no se logró, sin embargo, determinar el sitio de ingreso de los trofonemata en el embrión debido a la facilidad con la cual las hembras de P. magdalenae desprenden sus embriones y abortan, lo que imposibilitó una observación detallada de la disposición y relación de los trofonemata con los embriones en desarrollo.
En P. magdalenae se ha registrado una talla de nacimiento entre 87 y 100 mm de AD (Tashima & Takeshita, 1992; Ramos-Socha & Grijalba-Bendeck, 2011). Sin embargo, en nuestro estudio se registraron individuos neonatos de menor talla, con 75 mm en el más pequeño y de 77 mm AD en el más grande.
Potamotrygon magdalenae presentó una fecundidad uterina en este estudio entre 1 y 5 embriones, lo cual concuerda con lo registrado por Ramos-Socha & Grijalba-Benedeck (2011); aun así, otros estudios han encontrado fecundidades más altas, de hasta 10 embriones intrauterinos (Lasso et al., 2014; Pedreros-Sierra et al., 2016). La baja fecundidad en esta especie es similar a las características generales de las rayas y de los demás condrictios, en especial los vivíparos matrotróficos, lo que los hace más susceptibles a los efectos de la sobrepesca y dificulta los esfuerzos de conservación (Bonfil, 1994).
No se encontró una relación significativa entre la talla de las hembras grávidas (AD) y la cantidad de embriones intrauterinos. Sin embargo, el número de hembras obtenidas fue pequeño, así como el rango de tamaños de las hembras madres, por lo que no se obtuvo un espectro de tamaño corporal poblacional amplio, como sí lo obtuvieron Pedreros-Sierra et al. (2016) en una población en una de las localidades en las que trabajamos. Para esta población de P. magdalenae se encontró una relación positiva de la talla de las hembras con la fecundidad uterina; asimismo, se han encontrado correlaciones positivas para otros batoideos, como en las rayas guitarra Pseudobatos leucorhynchus (Payán et al., 2011) y R. hynnicephalus (Kume et al., 2009), tendencia que es común en el grupo.
Dado que los embriones y fetos de P. magdalenae en los diferentes estadios de desarrollo se obtuvieron en distintos meses del año, sin que se aprecie claramente una secuencia de desarrollo a través de los meses, se puede sugerir que la actividad reproductiva en esta especie es continua. Esta continuidad reproductiva ya se había señalado previamente en las hembras de una de nuestras poblaciones en el estudio de Pedreros-Sierra et al. (2016), así como para machos (Pedreros-Sierra & Ramírez-Pinilla, 2015).
La viviparidad aplacentaria, la no estacionalidad en la reproducción y el desarrollo embrionario característico de esta especie imposibilitaron la comparación con tablas temporales para registrar el momento de cada evento o aparición de una característica, dada la dificultad para conocer el tiempo del inicio y el desarrollo de la gestación en las hembras.
Este limitante se ha encontrado en la mayoría de los estudios de desarrollo embrionario en condrictios vivíparos. Aun con esta limitación, los estadios embrionarios permiten establecer estadios de desarrollo equivalentes con otros batoideos y condrictios en general, y demostrar la secuencia de cambios en la morfología externa durante el desarrollo embrionario en P. magdalenae. Cabe resaltar que los fetos avanzados y neonatos se utilizaron aquí para estudiar el desarrollo de la glándula del clásper (Anaya-López & Ramírez-Pinilla, 2017), por lo que a partir de estas series de desarrollo se puede obtener material importante para otros estudios de la biología de esta especie endémica.
Conclusiones
Se describieron nueve estadios de desarrollo embrionario de Potamotrygon magdalenae a partir de las características macroscópicas desde la etapa de faríngula hasta el de neonato; se presentaron, además, los cambios morfológicos entre neonatos e individuos juveniles. El desarrollo de P. magdalenae mantiene la secuencia general de desarrollo de los batoideos y condrictios, con algunas diferencias en la tasa y el momento de absorción del vitelo y la ausencia de filamentos branquiales sobresalientes de los espiráculos, características estas relacionadas con su viviparidad matrotrófica.















