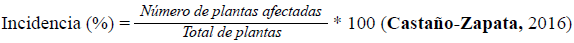Introducción
El tomate (Solanum lycopersicum L.) es una planta dicotiledónea perteneciente a la familia Solanaceae (Ceballos et al., 2017) que se cultiva en todo el mundo (Srinivas et al., 2019) y es considerado uno de los cultivos más importantes en términos de consumo, uso comercial, área cultivada, producción y rendimiento (Hernández-Martínez et al., 2014; Tampoare et al., 2013). En Colombia la producción de tomates frescos en el 2020 fue de 576.733 toneladas (t) en un área aproximada de 8.783 ha y un rendimiento de 65,66 t.ha-1 (FAOSTAT, 2022). Por otra parte, se han registrado más de 200 enfermedades que atacan el cultivo de tomate (Djidonou et al., 2016), entre las que se encuentra el marchitamiento vascular causado por Fusarium oxysporum f. sp. lycopersici (Sacc.) Snyder & Hansen (Singh et al., 2017), el cual es responsable de pérdidas que pueden llegar hasta el 100 % (Agrios, 2005). Debido a su hábitat parasítico en el suelo, es muy difícil de controlar, por consiguiente, la utilización de genotipos resistentes o tolerantes se ha convertido en una opción para combatir el patógeno cuando este ha colonizado el suelo.
Una alternativa biotecnológica para enfrentar el problema que representa el manejo de los patógenos habitantes del suelo es el injerto, técnica centenaria que consiste en la unión física de partes de dos plantas de la misma especie o de especies diferentes que luego crecen como una sola planta (Rouphael et al., 2010; Bletsos & Olympios, 2009). En muchos casos los patrones son materiales vegetales silvestres que históricamente han evolucionado conjuntamente con los patógenos y en los que se han identificado características genotípicas y fenotípicas deseables.
Considerando la importancia que tiene el tomate a nivel nacional, y ante la ausencia de medidas efectivas para el control del hongo, el objetivo del presente estudio fue evaluar la reacción de microinjertos de tomate a la raza 2 de F. oxysporum f. sp. lycopersici (Fol) y su efecto en el rendimiento en condiciones de campo, usando como patrones tres genotipos silvestres del tipo Cherry provenientes del banco de germoplasma de la Universidad Nacional de Colombia, sede Palmira, y dos copas comerciales.
Materiales y métodos
Cultivo in vitro y microinjerto
Los genotipos de tomate se establecieron in vitro y se micropropagaron bajo las condiciones descritas por García et al. (2018). Las plántulas micropropagadas de 30 días de edad se emplearon como fuente para la producción de los patrones y las copas. Como patrones se seleccionaron segmentos internodales de 1,5 a 2,0 cm de longitud y 0,2 a 0,3 cm de diámetro, en promedio. Como copas se emplearon meristemos apicales y axilares con una longitud de 0,5 a 1,0 cm. Los microinjertos se hicieron mediante corte en púa terminal y luego se cultivaron en el medio basal de Murashige & Skoog (1962) suplementado con vitaminas B5 sin reguladores de crecimiento.
Los genotipos promisorios de tomate usados como patrones fueron las accesiones IAC426, IAC391 e IAC412, facilitadas por la Universidad Nacional de Colombia, sede Palmira, las cuales se consideran tolerantes a F. oxysporum f.sp. lycopersici debido a que el hongo expresa un retardo en el periodo de incubación y el marchitamiento vascular se desarrolla más lentamente (Cardona-Piedrahita et al., 2021); el portainjeto comercial denominado Volt (Sakata Seeds®) (PAT) se empleó como control resistente (SAKATA, 2022). Según la ficha técnica comercial, las copas resistentes fueron las variedades de tomate Calima (BHN Seed®) (CAL) y Carguero (Top Seeds®) (CAR); como control susceptible se empleó la variedad de tomate Santa Clara (Saenz Fety®) (SC) (Forero-Reyes et al., 2018). Con estos materiales se realizaron seis combinaciones de microinjertos (tres patrones por dos copas) en el laboratorio de cultivo de tejidos de la Universidad de Caldas, de las cuales se obtuvieron cuatro heteroinjertos y cinco autoinjertos, uno de los cuales correspondió al control resistente (PAT/PAT) y el otro al control susceptible con la variedad Santa Clara (SC/SC). Todos los genotipos empleados se obtuvieron a partir de semilla para un total de 32 tratamientos que incluyeron 18 autoinjertos y heteroinjertos, además de 14 genotipos sin injertar. En cada una de los tratamientos se hizo la inoculación con Fol con sus respectivos testigos (Tabla 1).
Inicialmente, los microinjertos se pasaron a bandejas estériles que contenían turba Sphagnum grado 3 estéril y luego se cubrieron con domos transparentes (cámaras de aclimatación) para mantener la humedad; gradualmente, se les incrementó el intercambio gaseoso mediante el retiro del domo, proceso que se efectuó en el Jardín Botánico de la Universidad de Caldas, desde donde se los trasladó a la granja Montelindo de la misma Universidad y se los mantuvo bajo condiciones de invernadero durante dos semanas para fortalecer su desarrollo antes de trasplantarlos al sitio definitivo en el campo. Esta granja está localizada en la vereda Santágueda, municipio de Palestina (Caldas), a 1.050 m s.n.m., y tiene una temperatura promedio anual de 22,5 oC, una humedad relativa de 76 % y una precipitación anual de 2.100 mm.
La siembra se hizo completamente al azar con seis repeticiones por tratamiento y una planta como unidad experimental; la distancia de siembra fue de 1,50 m entre surcos y 0,50 m entre plantas, y se usó una estructura de semitecho y una canal recubierta con plástico negro sobre la cual se depositó el suelo previamente desinfestado con dazomet (Basamid ® GR) en dosis de 35 g.m2--1 para evitar la posible presencia de Fol en el suelo y su interferencia con los resultados. Durante la fase de campo se hizo el manejo agronómico y se aplicaron las prácticas culturales propias del cultivo para garantizar un óptimo desarrollo de las plantas (Jaramillo-Noreña et al., 2013).
Características del aislamiento de Fusarium oxysporum f. sp. lycopersici
El aislamiento de Fol denominado COMBIA, obtenido por Marín-Serna et al. (2014) y caracterizado molecularmente como raza 2 por Carmona et al. (2020), se obtuvo del laboratorio de fitopatología de la Facultad de Ciencias Agropecuarias de la Universidad de Caldas. Antes de iniciar la investigación se verificaron las características morfológicas macroscópicas y microscópicas del hongo; además, mediante microscopía electrónica de barrido ambiental (ESEM) se observó en detalle la formación de esclerocios del fitopatógeno (Figura 1). Para la multiplicación y el mantenimiento de Fol se utilizó agar papa dextrosa (PDA, Oxoid®) mezclando 0,3 g de macerado de plántulas de tomate sanas obtenidas de cultivo in vitro en cada 100 mL de medio.
Preparación del inóculo e inoculación en el campo
El inóculo de Fol usado se preparó siguiendo la metodología descrita por Mandal et al. (2009) con algunas modificaciones; el hongo se cultivó y se mantuvo durante dos semanas en medio de cultivo PDA y macerado de plántulas de tomate a una temperatura de 28 °C en una incubadora marca Binder®, tras lo cual las cajas de Petri fueron inundadas con agua destilada estéril; con la ayuda de un asa se removió el hongo y se pasó por una gasa doble previamente esterilizada; después se contaron las esporas en un hemacitómetro y se ajustó la concentración a 1x106 conidios.mL-1 de agua destilada estéril. Pasados 15 días de aclimatación, se depositaron en la base del tallo de cada una de las plántulas microinjertadas 75 mL de la suspensión conidial en la concentración indicada.
Para determinar la reacción de los microinjertos a Fol, a partir del momento de la inoculación y durante 14 semanas se evaluó la incidencia de la enfermedad expresada en síntomas como el amarillamiento, el marchitamiento y la muerte de las plantas. Para determinar la incidencia de la enfermedad se usó la siguiente fórmula:
Tabla 1 Descripción de los tratamientos de tomate evaluados en la granja Montelindo de la Universidad de Caldas bajo condiciones semicontroladas
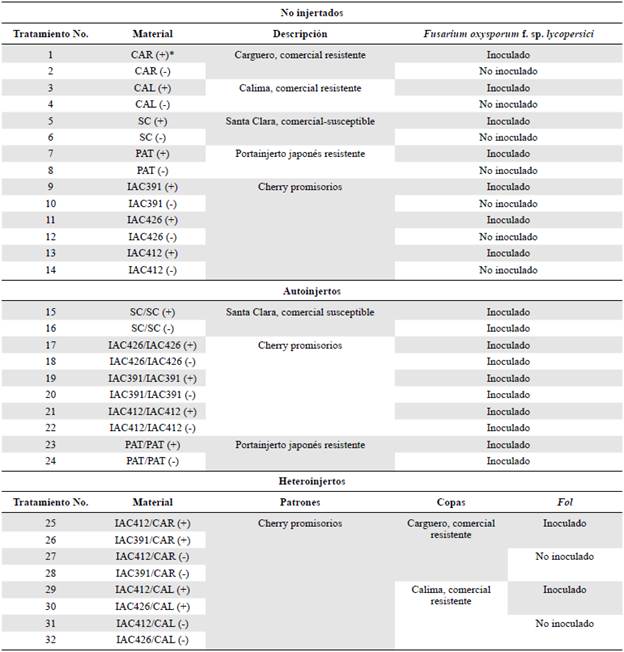
* CAR: Carguero, CAL: Calima, SC: Santa Clara, (+): inoculado con Fol, (-): no inoculado
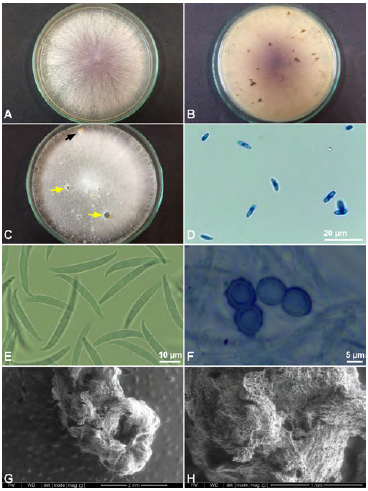
Figura 1 Características macroscópicas y microscópicas de Fusarium oxysporum f. sp. lycopersici raza 2 A. Anverso de la colonia en PDA. B. Reverso de la colonia en PDA. C. Formación de esporodoquio (flecha negra) y esclerocios (flechas amarillas) sobre PDA. D. Microconidios. E. Macroconidios. F. Clamidosporas. G, H. Detalle de la estructura de un esclerocio visualizado a través de ESEM
A partir de los 35 días del trasplante y la inoculación, cuando aparecieron las primeras flores, se comenzó la medición semanal de los caracteres de rendimiento y calidad del fruto utilizando la metodología sugerida por el International Plant Genetic Resources Institute - IPGRI (1996). Los frutos se observaron en el segundo y tercer racimo de cada planta en la etapa de plena madurez. Los datos obtenidos se sometieron a un análisis de varianza para determinar las diferencias significativas entre los tratamientos. Se analizaron tanto las interacciones entre los factores como estos tomados individualmente, es decir, se hicieron los respectivos análisis por genotipo inoculado y no inoculado, con el fin de reducir la influencia de los componentes. Posteriormente, las medias de los tratamientos con diferencias significativas en el análisis de varianza, se compararon con la prueba de Tukey (p<0,05) para diferenciar el comportamiento de cada uno de los tratamientos según la variable evaluada y seleccionar el mejor. Se utilizó el procedimiento GLM del Statistical Analysis System (SAS Institute, 2010).
Resultados y discusión
Desarrollo de síntomas
A los 98 días de la inoculación (DDI) con Fol, las plantas no injertadas de la variedad susceptible Santa Clara y de la resistente Calima eran las únicas con síntomas de amarillamiento, marchitamiento y deterioro vascular, con una incidencia de 70 y 65 %, respectivamente (Figura 2) (Tabla 2). En los genotipos silvestres promisorios IAC 391, IAC412 e IAC 426 no se observaron síntomas externos, como tampoco en los haces vasculares. En general, se observó una disminución en la cantidad de follaje y raíces en los materiales inoculados en comparación con sus respectivos controles (Figura 3). Estos resultados difieren de los de estudios en que las plantas adultas de tomate enfermas presentaron epinastia, enanismo, amarillamiento de las hojas del tercio bajo de la planta, defoliación, necrosis marginal, marchitamiento y, por último, la muerte (Agrios, 2005; Joshi, 2018). Es importante señalar que la información proviene de estudios realizados bajo condiciones controladas y no en campo, como fue nuestro caso, donde las condiciones propias del ambiente no controlado ejercen un impacto diferencial en la interacción planta-patógeno que puede afectar la resistencia (Moore, 1994).

Figura 2 Efecto de Fusarium oxysporum f. sp. lycopersici sobre la variedad Santa Clara susceptible y el genotipo Calima tolerante. SANTA CLARA. A. Plantas con síntomas de Marchitamiento vascular. B. Haces vasculares necrosados. C. Raíces necrosadas. D, E, F. Aspecto de dos plantas de Santa Clara no inoculadas, haces vasculares y raíces, respectivamente. CALIMA. G. Síntomas de ligero marchitamiento vascular y amarillamiento del follaje del tercio bajo del tallo. H. Deterioro vascular. I, J. Aspecto de plantas de Calima no inoculadas y haces vasculares, respectivamente

Figura 3 Cambios en el follaje y densidad de las raíces de los autoinjertos, heteroinjertos y genotipos de tomate no injertados, inoculados con Fusarium oxysporum f. sp. lycopersici y sus respectivos controles no inoculados 98 días después de la inoculación. Obsérvese el aspecto de los injertos inoculados y no inoculados de IAC391 e IAC412 con CAR
Tabla 2 Incidencia del marchitamiento vascular, disminución del follaje y promedio de las variables de producción y rendimiento de materiales de tomate inoculados (+) y no inoculados (-) con Fusarium oxysporum f. sp. lycopersici
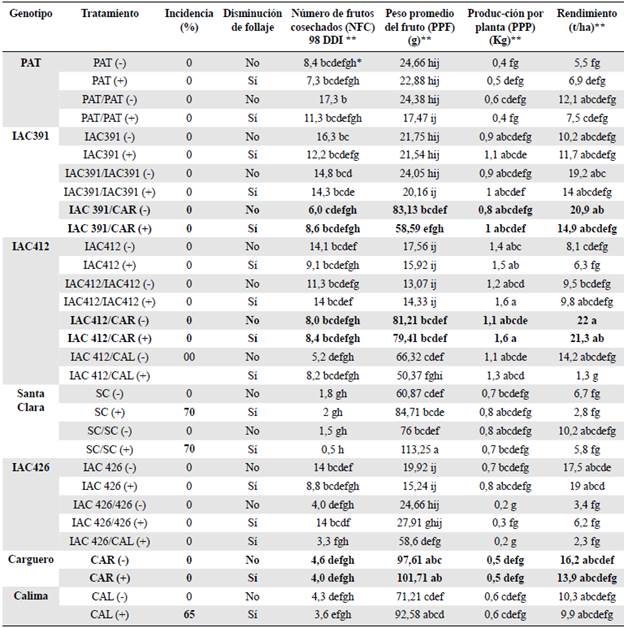
* Letras diferentes indican diferencia estadística según la prueba de Tukey (p<0,05). ** Diferencias estadísticas altamente significativas Los datos en negrillas indican los mejores injertos o tratamientos del estudio
Asimismo, se ha señalado que los portainjertos de tomate con características de resistencia o tolerancia a patógenos pueden suprimir los síntomas característicos de una enfermedad; por ejemplo, los patrones Vigostar, Aloha y RT-160961 inhiben totalmente la expresión de los síntomas de Fol hasta cinco meses después de la siembra y reducen la incidencia de la marchitez vascular hasta en un 94 % y, al igual que los híbridos injertados sobre Multifort, no manifiestan daño externo ni en las raíces hasta el final del ciclo (Baéz-Valdez et al., 2010). En este sentido, Botero et al. (2018), reportan que los síntomas externos de la planta hospedante no siempre son detectables y esta puede permanecer asintomática durante todo el ciclo de desarrollo y actuar como reservorio del patógeno, siendo necesario que el grado de afectación sea alto para que se detecte exclusivamente con base en los síntomas visibles. Los autores mencionan, además, que la resistencia de ciertas variedades de tomate imposibilita la manifestación de síntomas. Asimismo, se ha documentado que la expresión de síntomas varía de acuerdo con el tipo de resistencia que la planta posee; por ejemplo, según Gao et al. (1995), en plantas de tomate con resistencia poligénica a Fol raza 1, la enfermedad se desarrolla en paralelo con el grado de colonización del patógeno, por lo que los síntomas son visibles en los peciolos. Sin embargo, en otras plantas aparentemente sanas el xilema lateral puede estar infectado y el central estar libre de infección. También, en el caso específico de Fusarium oxysporum f. sp. ciceris causante de la marchitez vascular en el garbanzo (Cicer arietiunum L.), se ha comprobado que no todas las plantas presentan el típico marchitamiento e, incluso, la muerte puede darse después de periodos prolongados dependiendo de las razas del patógeno (Jiménez-Fernández et al., 2013).
Otro hecho que puede explicar la ausencia de síntomas visibles son las interacciones incompatibles entre el patógeno y el hospedante, pues usualmente la invasión vascular no se presenta por el tipo de resistencia del genotipo y, aunque se inocule con razas virulentas del patógeno, la colonización puede llegar a ser limitada o incluso nula, pero en ambos casos sin que se desarrollen síntomas visibles, como se ha demostrado con el genotipo WR315 de garbanzo al ser inoculado con la raza 0 de Fusarium oxysporum f. sp. ciceris (Jiménez-Fernández et al., 2013). En el mismo sentido, se ha determinado que también el grado de colonización se ve afectado por la resistencia de los materiales en los que se inocula el patógeno. En el caso particular de Fusarium oxysporum f. sp. Fragarie, se impidió la germinación de las esporas del hongo y este permaneció en las células epidermales de las raíces de la fresa (Fragaria x ananassa Duch.) (Fang et al., 2012), en tanto que F. oxysporum f. sp. pisi se mantuvo en los vasos radicales (Tessier et al., 1990) y con F. oxysporum f. sp. ciceris se reportó la ausencia de síntomas incluso en presencia de daño vascular extendido (Jiménez- Fernández et al., 2013).
En genotipos resistentes se ha demostrado que aún en las etapas prevasculares de la infección se evidencian bajas tasas de colonización, incluso en el xilema, reduciéndose así el movimiento del patógeno (Zvirin et al., 2010); estos resultados explicarían la respuesta del genotipo comercial Calima, el cual tiene la capacidad de reducir cuantitativamente el proceso de colonización patogénica estimada con base en la disminución del crecimiento micelial y la proporción de vasos infectados (Gao et al., 1995), esto desemboca finalmente en una expresión reducida de los síntomas visibles, tal como se observó en nuestro estudio, en el que las plantas mostraron síntomas de ligero marchitamiento vascular y amarillamiento del follaje en el tercio bajo de la planta (Figura 2).
En respuesta a la presencial del patógeno, también se observó en los materiales de tomate PAT, CAL, CAR, IAC391, IAC412 y IAC426 inoculados la disminución del follaje (Figura 3) (Tabla 2), lo que concuerda con el reporte de Garcés et al. (1999), quienes indican que, aparte de una eventual coloración de los haces vasculares, que puede ir de blanquecina a marrón, el diagnóstico de la marchitez vascular causada por Fusarium puede basarse también en la disminución del crecimiento general de la planta y el enanismo de los brotes, comportamiento que también ha sido observado en el banano (Musa spp.) con Fusarium oxysporum f. sp. cubense (Foc), el cual provoca la reducción, el arrugamiento y la distorsión de la lámina foliar, así como el crecimiento lento de las plantas (Pérez et al., 2014). Por otra parte, en el garbanzo F. oxysporum f. sp. pisi (Fop) produce la reducción de la biomasa de las raíces y un follaje clorótico, menos vigoroso y con menor peso fresco (Steinkellner et al., 2008; Curtis et al., 2014), similar a lo observado en nuestro estudio.
Componentes de rendimiento
La cosecha de los frutos se inició a los 70 DDI y se evaluó hasta los 98 días. Se encontraron diferencias muy significativas en la variable del número de frutos cosechados por planta (NFC) a partir de los 77 DDI; esta variable y el peso promedio del fruto (PPF) fueron dependientes de los genotipos evaluados.
A los 98 DDI el mayor NFC se registró en el autoinjerto PAT/PAT no inoculado (-), con 17 frutos, lo que se redujo a 11,3 frutos por efecto de la inoculación con Fol, y, aunque el número siguió siendo superior al NFC en los materiales sin injertar, no se encontraron diferencias estadísticas significativas entre estos últimos y el autoinjerto inoculado.
El genotipo IAC391 (-) fue el segundo material con el mayor NFC a los 98 DDI (16,3 frutos), registrándose una reducción superior a 50 % cuando se injertó con CAR y se inoculó con Fol; la menor reducción en esta variable se presentó en los autoinjertos, con 14,8 frutos en promedio en IAC391/IAC391(-) y 14,3 en IAC391/IAC391 (+), valores superiores a los registrados en el testigo comercial, de 4,0 en el CAR (+) y 4,6 en el CAR (-) (Tabla 2).
El material silvestre IAC412 (-) produjo en promedio 14,1 frutos.planta-1, siendo superior a todas las demás combinaciones realizadas con el genotipo; cuando se lo empleó como patrón de las copas CAL (IAC412/CAL) y CAR(IAC412/CAR) y se inoculó, no se observaron diferencias estadísticas significativas entre estos heteroinjertos, con un promedio de 8,2 y 8,4 frutos, respectivamente.
Al igual que con el IAC391, los heteroinjertos cuyo patrón era el IAC412 aumentaron el NFC en comparación con los materiales del tipo Chonto no injertados, y en el caso específico de IAC412/CAR el aumento fue cercano a 100 %.
No se presentaron diferencias estadísticamente significativas entre IAC426 (-) y el autoinjerto inoculado IAC426/ IAC426 (+), con 14 frutos para cada material, y tampoco difirieron estadísticamente de los promedios obtenidos en IAC412 (-) e IAC412/IAC412 (+); la máxima reducción de frutos se observó en el heteroinjerto IAC426/CAL (+), con 3,3 frutos.planta-1. El testigo susceptible SC y sus combinaciones registraron el menor NFC a los 98 DDI y no se presentaron diferencias estadísticas significativas entre SC (+), SC (-), SC/SC (-), y SC/SC (+) . Sin embargo, se evidenció una tendencia diferencial en los componentes del rendimiento entre los autoinjertos no inoculados (-) y los inoculados (+), pasando de un rendimiento de 10,2 t/ha a 5,8 t/ha, respectivamente, lo que significa una reducción del 43,1 % en el rendimiento por efecto de la enfermedad (Tabla 2). Esto concuerda con otros estrudios en los que se han registrado hasta un 100 % de pérdidas en la producción (Agrios, 2005). En este sentido, y con miras a entender la diferencia en la respuesta genética de los genotipos evaluados, en el estudio de López et al. (2021), se reporta una respuesta transcripcional diferenciada de la interacción entre tomate y Fol asociada con la defensa, lo que puede afectar la producción de tomate.
En cuanto al PPF, el mayor peso se obtuvo al emplear CAR, CAL e IAC426 como copas, con 83,13 g.fruto1 en IAC391/CAR (-), 66,32 g en IAC412/CAL (-) y 27,91 g en IAC426/IAC426 (+); la combinación de IAC391/CAR (-) no presentó diferencias estadísticas significativas frente a IAC412/CAR (+), IAC412/CAR (-) y SC (+). Los autoinjertos PAT/PAT e IAC391/IAC391 no presentaron diferencias estadísticamente significativas por efecto del autoinjerto, únicamente se observó una variación debida a la inoculación con Fol, que redujo el peso del fruto a 17,47g en PAT/PAT (+) y a 20,16 g en IAC391/ IAC391 (+) (Tabla 2). No obstante, el autoinjerto no inoculado de PAT/PAT produjo un promedio de 17,3 frutos con un peso promedio de 24,38 g, lo que no fue estadísticamente diferente de los demás materiales que incluían el testigo resistente. Asimismo, el PPF de los autoinjertos de IAC412/IAC412 no presentó diferencias estadísticas significativas en comparación con los autoinjertos no inoculados; sin embargo, cuando este genotipo sirvió como patrón de CAL y CAR se obtuvieron pesos promedios de 66,32 g para IAC412/CAL (-) y de 81,21 g para IAC412/CAR (-) (Tabla 2).
El autoinjerto IAC426/IAC426 (+) produjo frutos con mayor peso promedio (27,91 g) comparado con los autoinjertos conformados por IAC391/IAC391 (+) e IAC412/IAC412 (+); asimismo, el microinjerto de IAC412 con el tomate de tipo Chonto CAL (-) y el híbrido CAR (-) produjo frutos más pesados (66,32 g y 81,21 g, respectivamente) que los demás materiales que incluían este genotipo; por el contrario, CAL (-) y (+) redujo el PPF cuando se usó como copa de IAC426. Al igual que en los genotipos IAC391 e IAC412, en esta combinación se desarrollaron frutos de diferentes tamaños y pesos con un efecto directo sobre el rendimiento. Fue evidente que los tomates de tipo Chonto redujeron el PPF cuando se microinjertaron con los materiales silvestres y se inocularon con Fol; en estas combinaciones no se encontraron diferencias estadísticas significativas entre los heteroinjertos IAC412/CAR (+) y (-) y IAC391/CAR (-), lo que significa que se puede conservar el PPF de CAR con cualquiera de estos dos patrones, pero cuando se emplea IAC391 como portainjerto y, además, hay presencia de Fol, el peso de los frutos se reduce significativamente. En el testigo susceptible SC, el mayor PPF se registró en el autoinjerto SC/SC (-), con 113,25 g, es decir, 52,38 g más que el PPF del control no injertado SC (-); sin embargo, este peso no se reflejó en la PPP, que fue de 0,7, asociada, a su vez, con un menor NFC de 0,5 (Tabla 2).
En general, la reducción en el NFC y el PPF de todos los materiales inoculados (Tabla 2) coincide con los porcentajes de pérdida reportados en tomate a causa de Fol, los cuales oscilan entre 60 y 70 % (Ravindra et aL, 2015), y pueden llegar a ser del 100 % cuando los cultivos son destruidos por el hongo antes de que puedan ser cosechados (Agrios, 2005). Por el contrario, la variación positiva observada en el PPF de los autoinjertos de los materiales silvestres IAC391/IAC391 (-) y IAC426/IAC426 (+) y (-) demuestra la eficiencia de los microinjertos en esta variable, con resultados comparables a los obtenidos por Herrera et al. (2015), quienes estudiaron las accesiones IAC391, IAC412 y IAC426 sin injertar y obtuvieron pesos promedio de 11,88 g, 11,14 g y 4,53 g, respectivamente, valores inferiores a los obtenidos en nuestro estudio.
Es evidente que Fol afecta el PPF; sin embargo, se destaca la tolerancia de los materiales silvestres IAC391 e IAC412 que, a pesar de la reducción en el peso de los frutos atribuible a factores como la incompatibilidad entre los materiales, la conexión vascular discontinua, la presencia de compuestos fenólicos en el punto de unión, y las alteraciones fisiológicas o bioquímicas, entre otros (Baéz-Valdez et al, 2010), se mantuvieron sanos externa e internamente permitiendo un ciclo productivo más largo y, por consiguiente, mejor rendimiento de los tomates de tipo Chonto. La diferencia en el PPF fue una característica observada en los heteroinjertos IAC391/CAR, IAC412/CAR, IAC412/ CAL e IAC426/CAL, combinaciones de microinjertos con frutos de diferentes tamaños, básicamente de tres categorías: 1) el fruto de tipo Cherry, 2) el genotipo Chonto y, 3) el genotipo combinado (tamaño y forma intermedia entre Cherry y Chonto) (Figura 4).

Figura 4 Caracteristicas morfológicas de los frutos de los heteroinjertos de IAC391 e IAC412 con CAR
La mayor PPP en todos los materiales evaluados se obtuvo en el autoinjerto IAC412/ IAC412 (+) y el heteroinjerto IAC412/CAR (+), con un promedio de 1,6 kg.planta-1; el segundo mejor promedio se obtuvo en IAC412 (+), con 1,5 kg y sin diferencias estadísticas con la producción de IAC412 (-). El IAC391 (+) produjo 1,1 kg. planta-1 y no se observaron diferencias estadísticas significativas entre este genotipo y los heteroinjertos IAC412/CAR e IAC412/CAL sin inocular; el genotipo IAC391 (-) tuvo un promedio de 0,9 kg.planta-1 y no presentó diferencias estadísticas con los autoinjertos IAC391/IAC391 y SC/SC no inoculados, el heteroinjerto IAC391/CAR (-) ni los genotipos SC (+) e IAC426 (+) (Tabla 2).
El autoinjerto IAC391/IAC391 (-), cuya PPP fue de 0,9 kg, no registró diferencias estadísticas frente a IAC391 (-) ni al heteroinjerto IAC391/CAR (-); sin embargo, este último tuvo un rendimiento equivalente a 20,9 t.ha-1, lo que significa una diferencia de 6 t.ha-1 con respecto al mismo heteroinjerto inoculado. Asimismo, si se lo compara con el genotipo CAR (-), la diferencia en el rendimiento fue de 4,7 t.ha-1; por el contrario, al comparar el hetero-injerto IAC391/CAR (+) y el CAR (+) no hubo diferencias estadísticas en la variable. En esta interacción también fue claro el efecto de Fol sobre la producción, la cual se redujo tanto en el heteroinjerto con CAR como en el testigo sin injertar (Tabla 2). Sin embargo, el IAC391 puede considerarse un buen candidato como portainjerto del genotipo comercial CAR.
En el comportamiento de IAC412 y sus combinaciones no se evidenciaron diferencias estadísticas significativas en la variable PPP entre el autoinjerto IAC412/IAC412 (+) y el heteroinjerto IAC412/CAR (+), pero al comparar con el testigo CAR (+) y el CAR (-), la diferencia fue de 1,1 kg.planta-1, lo que demuestra el efecto positivo del injerto en estos materiales. En IAC426 la mayor producción fue para los genotipos no injertados y se not ó una reducción cuando el material se sometió a autoinjerto (IAC426/IAC426) o heteroinjerto con CAL (IAC426/CAL), con una producción que difirió estadísticamente del testigo susceptible SC y, además, fue menor a la reportada para esta última variedad. Los materiales IAC426/CAL (+) e IAC426/IAC426 (-) presentaron la menor PPP de todos los evaluados, aunque el control no injertado e inoculado IAC426 (+) tuvo una producción de 0,8 kg.planta-1, lo cual sugiere un posible efecto del método de injerto (Tabla 2).
El rendimiento asociado al heteroinjerto IAC412/CAR (-) fue el mayor, con una producción promedio de 22 t.ha-1, seguido de IAC412/CAR (+), con 21,3 t.ha-1, en tanto que el genotipo comercial no injertado CAR (-) alcanzó una producción promedio de 16,2 t.ha-1, es decir, el microinjerto tuvo un efecto significativo en el rendimiento, de 5,1 t.ha-1 adicionales frente al heteroinjerto. Asimismo, la inoculación con Fol tuvo un efecto significativo en términos de producción del genotipo CAR, registrándose una diferencia de 2,3 t.ha-1 en relación con el testigo no inoculado. Cuando el mismo material IAC412 se combinó con CAL y se inoculó, se observó una reducción de 20 t.ha-1 comparado con IAC412/CAR (+), comportamiento también observado al comparar los heteroinjertos no inoculados, con una reducción de 7,8 t.ha-1, lo que evidencia que el rendimiento en las combinaciones de CAL y CAR con IAC412 se ve afectado por Fol, siendo mayor la reducción en los heteroinjertos con CAL; sin embargo, el heteroinjerto IAC412/CAL (-) no presentó diferencias estadísticas en el rendimiento comparado con los autoinjertos IAC412/IAC412 (+) e IAC412/IAC412 (-) y con los testigos CAL (+) y CAL (-) (Tabla 2).
El genotipo IAC391 puede considerarse un buen candidato como portainjerto del genotipo comercial CAR. Los genotipos IAC426(+) e IAC426(-) tuvieron el tercer mayor rendimiento entre los genotipos evaluados, observándose diferencias estadísticas significativas por efecto del injerto, el cual lo redujo en 12,8 t.ha-1 en IAC426/IAC426 (+) comparado con su testigo no injertado y con el heteroinjerto de CAL (+) y de CAL (-); sin embargo, cuando IAC426 (+) no se combinó, su producción fue similar a la del autoinjerto IAC391/IAC391 (-), con 19,0 t.ha-1 y 19,2 t.ha-1, respectivamente (Tabla 2).
Los resultados obtenidos en el genotipo IAC412 producto del microinjerto son con-cluyentes y coinciden con otros reportes de estudios efectuados en el patosistema Fusarium oxysporum f. sp. melonis razas 1 y 2 en plantas de melón (Cucumis melo L.), en las que el injerto redujo el daño del hongo y aumentó el rendimiento (Trionfetti et al., 2002). La diferencia en el rendimiento entre el heteroinjerto IAC412/CAR (+) y las plantas sin microinjerto confirma lo reportado por Rouphael et al. (2010), al indicar que el peso y el tamaño promedio de la fruta de las solanáceas y las cucurbitáceas son frecuentemente influenciados por el injerto, por lo que es un componente importante de esta variable; además, se confirmó que el injerto incrementa la producción de tomate incluso por encima del 15 % (Velasco-Alvarado et al., 2016).
En el testigo resistente PAT la mejor respuesta fue la del autoinjerto no inoculado PAT/ PAT (-) con 12,1 t.h-1, lo que representa una diferencia de 4,6 t.ha-1 con respecto a PAT/ PAT (+), pero también significa que, por efecto del autoinjerto y en ausencia del hongo, se obtuvieron 6,6 t.ha-1 adicionales frente al control no inoculado y sin microinjerto PAT (-) (Tabla 2). Estos resultados son promisorios, ya que en estudios previos con los híbridos Multifort y Beaufort como portainjertos de tomate cv. Florida 47, se encontró que las plantas injertadas aumentaron el rendimiento de fruta comercializable hasta en un 41 % (Djidonou et al., 2016); además, cuando la variedad de tomate El Cid se injertó en Multifort el rendimiento en fruta aumentó en 12,9 % (Velasco-Alvarado et al., 2016), valores inferiores a los obtenidos en el presente estudio, pero que ratifican la eficiencia del patrón y su respuesta ante ambientes y copas diferentes. Asimismo, cuando se usaron los híbridos Vigostar y Multifort como patrones del híbrido Imperial, este último tuvo un incremento de aproximadamente 100 t.h-1, lo que demuestra una vez más el efecto que tienen el patrón y el injerto en la producción de tomate (Baéz-Valdez et al., 2010). Asimismo, Di Gioia et al. (2010), reportaron aumentos superiores al 20 % por efecto del microinjerto del tomate Oxheart en las variedades Beaufort F1 y Maxifort F1, aunque no observaron efectos significativos del patrón en el número de frutos por planta ni en su tamaño. Estos resultados difieren en parte de nuestros resultados, pues aunque se aumentó el rendimiento, sí hubo un cambio en el número y el tamaño de los frutos.
En el testigo susceptible SC, el mayor rendimiento se obtuvo en la combinación SC/ SC (-), con 10,2 t.ha-1 frente a las 6,7 t.ha-1 producidas por el control SC (-), es decir, el autoinjerto produjo 3,5 t.ha-1 adicionales de tomate, pero cuando SC/SC (+) se inoculó con Fol se redujo el rendimiento en 4,4 t.ha-1. Por lo general, en los materiales que incluyeron el SC, se confirmó la habilidad de Fol para disminuir la producción en materiales susceptibles, pero también se demostró que con el microinjerto este genotipo aumenta el rendimiento de las plantas incluso en presencia del patógeno y que, cuando los autoinjertos no se inoculan, los rendimientos pueden ser estadísticamente similares a los obtenidos en IAC391(-), IAC391/IAC391 (+), IAC391/CAR (+), IAC412/CAL (-), IAC412/IAC412 (+) y CAL (+) (Tabla 2).
En los genotipos CAL y CAR se ha reportado resistencia a Fol razas 1 y 2 (Jaramillo-Noreña et al., 2013), lo que se confirmó con nuestros resultados, pues, aunque en CAR el rendimiento se redujo en 2,3 t.ha-1 por efecto de la inoculación, dicha reducción no fue estadísticamente significativa y tampoco se observaron síntomas de marchitamiento vascular, en tanto que CAL mostró un amarillamiento leve, marchitez y daño vascular, así como una disminución de 0,4 t.ha-1 en el rendimiento a causa del hongo, diferencia que tampoco fue estadísticamente significativa (Tabla 2).
Conclusiones
Este es el primer estudio en Colombia en el que se evaluaron plantas de tomate injertadas in vitro con patrones silvestres y copas comerciales como estrategia para el manejo del marchitamiento vascular ocasionado por F. oxysporum f. sp. lycopersici, lo que redujo la incidencia de la enfermedad en los microinjertos evaluados.
Los heteroinjertos que incluyeron IAC391 e IAC412 aumentaron los rendimientos hasta en 6 t. ha-1 frente al genotipo comercial CAR manteniendo la dureza y el contenido de sólidos solubles de los frutos.
El uso sostenible de germoplasma de tomate y el método de microinjerto pueden considerarse una alternativa para la producción de plantas tolerantes a F. oxysporum f. sp. lycopersici y una estrategia para el manejo integrado de la enfermedad.
El microinjerto permitió el acople de variedades de tomate comercialmente aceptadas por su rendimiento y características organolépticas con materiales que confieren resistencia al hongo usados como patrón sin afectar la fisiología normal de la planta, lo que demuestra que estas combinaciones son compatibles y propicias a nivel productivo del tomate.