Introducción
Con más de un millón de especies, los insectos son el grupo de animales con la mayor riqueza descrita (Beutel et al., 2017; Mayhew, 2018) y se distribuyen en una gran cantidad de hábitats (Swengel, 2001; Ulrichs & Hopper, 2008), pues se han adaptado para aprovechar los recursos alimenticios (Pearson & Dyer, 2006). Al ser un grupo tan diverso, siempre es posible obtener ejemplares de algunos órdenes en campo, por lo que frecuentemente se los utiliza en estudios de impacto ambiental como bioindicadores de la calidad del agua (Peralta & Huamantinco, 2014), para conocer el grado de conservación de los hábitats (Oroz et al., 2018; Pedraza et al., 2010; Rossi et al., 2018), calcular los patrones de diversidad de las especies (Beck & Kitching, 2007) y estudiar las enfermedades transmitidas por vectores (Barreto et al., 2006; Moreno et al., 2002; Salazar et al., 2006; Villaseca et al., 1999).
Debido a la gran variedad de hábitats en que viven los insectos y los diferentes tipos de comportamiento que presentan, se han desarrollado métodos de recolección específicos que hacen uso de las características más comunes del grupo de interés. Entre ellas pueden mencionarse las trampas activas, que utilizan atrayentes o cebos para capturar a los individuos por su comportamiento o hábitos alimenticios, por ejemplo, las trampas de luz, bandejas o platos de diferentes colores y las trampas de caída con excremento animal (coprófagos) o con materia orgánica en descomposición (necrófagos), y las trampas pasivas, que se ubican en zonas de tránsito natural de los insectos y los capturan, entre ellas, las trampas de caída sin cebo, las trampas Malaise y las trampas de interceptación (Bar et al., 2022; Boito et al., 2009; Missa et al., 2009; Parys & Johnson, 2011; Sabu & Shiju, 2010).
En varios estudios se han empleado diferentes técnicas para comparar la eficacia y el esfuerzo de muestreo, y se señalan las ventajas y las desventajas de unas y otras, además de aportar datos sobre los taxones específicos que pueden recolectarse en determinadas condiciones (Boyer et al., 2020; Buffington et al., 2021; Cheli & Corley, 2010; Hohbein & Conway, 2018; Mena et al., 2016; Rajmohana & Trivedi, 2019; Shweta & Rajmohana, 2018; Siewers et al., 2014; Westerberg et al., 2021; Zaller et al., 2015). En algunos de estos estudios se reconoce la gran capacidad de captura de las bandejas amarillas y las trampas de caída frente a otras técnicas, sin embargo, no se establece una cantidad exacta o recomendada para utilizarlas en el monitoreo ambiental o los inventarios biológicos, porque depende de los grupos de interés y los hábitats a evaluar.
En el presente estudio se comparó la capacidad de captura de las bandejas amarillas y las trampas de caída sin cebo, con el fin de determinar si el empleo de una menor cantidad de bandejas podría considerarse un esfuerzo adecuado frente a la cantidad de trampas de caída utilizadas en una misma estación de muestreo. El estudio se desarrolló en los humedales de Ventanilla, un área de fácil acceso que cuenta con una gran diversidad de insectos, principalmente representados por familias de hábitos fitófagos y depredadores, entre los meses de diciembre y abril, que coinciden con la temporada de menor cantidad de agua (Gobierno Regional del Callao, 2015; Sánchez et al., 2019).
Materiales y métodos
Métodos de muestreo
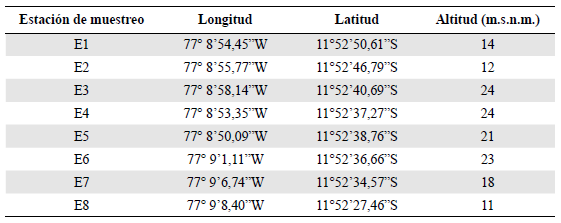
El muestreo se realizó en los humedales del distrito de Ventanilla, ubicado en la provincia constitucional del Callao, departamento de Lima, Perú. Se establecieron ocho estaciones en febrero, julio y diciembre del 2016 (Tabla 1). En cada una se instaló una línea con diez trampas de caída (TC) (Cheli & Corley, 2010) de 12 cm de altura, con circunferencia basal de 29,5 cm y abertura de 36,8 cm, separadas aproximadamente cinco metros una de otra, y cinco bandejas amarillas (BA) (Schauff, 2001) de 28,5 x 22 x 2,5 cm, con diez metros de distancia entre ellas (Figura 1). Estas cantidades, representativas en ambos casos, se establecieron para corroborar la hipótesis de que una menor cantidad de bandejas amarillas que de trampas de caída sin cebo sería suficiente para recolectar una riqueza y diversidad de ejemplares similar o superior a la otra técnica utilizada. Para ello se siguió la metodología descrita por Rossi et al. (2018) en un bosque de Polylepis tomentella. El medio de captura incluyó agua, detergente líquido y sal; se depositó aproximadamente el equivalente a un cuarto del envase en las trampas de caída y 200 ml en las bandejas amarillas, las cuales permanecieron activas durante 48 horas. Las muestras se recolectaron en bolsas de polipropileno con alcohol al 70° y se transportaron al laboratorio de entomología de la Universidad Nacional Mayor de San Marcos, donde se lavaron y separaron con agua en bandejas de plástico para su conteo e identificación hasta el nivel de morfoespecie (Commonwealth Scientific and Industrial Research - CSIRO, 1991; Triplehorn & Johnson, 2005; Zhang, 2011), y luego se depositaron en la colección del Museo de Historia Natural de la Universidad Nacional Mayor de San Marcos en Lima.
Tabla 1 Coordenadas geográficas de las estaciones de muestreo en los humedales de Ventanilla, Callao - Perú
Análisis de datos
Se analizó la riqueza de morfoespecies por cada mes de muestreo y tipo de trampa, indicando los grupos dominantes en cada uno (órdenes y familias). La comunidad de insectos se evaluó con los índices de diversidad de Shannon-Wiener (H'), de dominancia de Simpson (D) y de equidad de Pielou (J') (Magurran & McGill, 2011); todos ellos se sometieron a la prueba de medianas con el test de Kruskal-Wallis para comprobar si hubo diferencias significativas entre los meses y tipos de muestreo. Se utilizaron estimadores no paramétricos (Chao, Jacknife 1 y 2) para calcular la riqueza esperada por mes y tipo de trampa (Chao et al., 2017; Colwell etal., 2004; Gwinn etal., 2016). Mediante el índice de Jaccard se hizo un análisis de similitud entre ambos tipos de trampa para conocer qué tan semejantes eran respecto a la riqueza recolectada. Por último, se elaboraron curvas de acumulación de especies (Jiménez & Hortal, 2003; Ugland et al., 2003) con el paquete iNEXT (Chao et al., 2014; Hsieh et al., 2016, 2022). Los análisis de diversidad y similitud se realizaron con el programa PAST v. 4.0 (Hammer et al., 2001), y el test de medianas y las curvas de acumulación y estimación de riqueza con los paquetes Stats, iNEXT y BiodiversityR (Kindt & Coe, 2005) en Rstudio v. 1.4.1717 (R Core Team, 2022).
Resultados
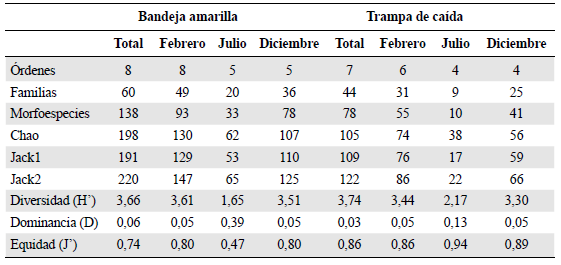
Se recolectaron 160 morfoespecies distribuidas en 68 familias y ocho órdenes taxonómicos. Diptera (65), Hymenoptera (47), Hemiptera (23) y Coleoptera (17) fueron los órdenes de mayor riqueza en los tres meses de muestreo (Figura 2). En febrero, Diptera fue el grupo de mayor riqueza (S), con 47 morfoespecies, de las que 41 se recolectaron en bandejas amarillas y 23 en trampas de caída. Hymenoptera fue el segundo grupo, con S = 29, de las cuales 25 se recolectaron en bandejas amarillas y 11 en trampas de caída. Hemiptera y Coleoptera solo aportaron 13 morfoespecies en conjunto. En julio se observó que la riqueza disminuyó: Diptera presentó 22 morfoespecies (BA = 19, TC = 4), Hymenoptera 10 (BA = 9, TC = 1), Hemiptera 5 (BA = 2, TC = 4) y Coleoptera 3 (BA = 2, TC = 1). En diciembre se observó un incremento similar a febrero: Diptera con S = 40 (BA = 34, TC = 17), Hymenoptera con S = 28 (BA = 27, TC = 5), Hemiptera con S = 18 (BA = 11, TC = 12) y Coleoptera con S = 8 (BA = 5, TC = 7). Hubo diferencias significativas en la riqueza en los meses de febrero y diciembre con ambos métodos. Del total de familias observadas, 28 (17,5 %) se recolectaron exclusivamente en bandejas amarillas, entre ellas Braconidae, Crabronidae (Hymenoptera), Stratiomyidae y Muscidae (Diptera); ocho (5 %) en trampas de caída: Chrysomelidae (Coleoptera), Chrysididae (Hymenoptera), Otitidae, Tabanidae (Diptera), Berytidae, Corixidae, Veliidae (Hemiptera) e Yponomeutidae (Lepidoptera), todas representadas por una morfoespecie, y 32 (20 %) se recolectaron con ambas técnicas, entre las cuales cabe mencionar a Coccinellidae, Hydrophilidae (Coleoptera), Anthomyzidae, Chironomidae, Dolichopodidae, Ephydridae (Diptera), Cicadellidae (Hemiptera), Ichneu-monidae, Pompilidae, Braconidae y Diapriidae (Hymenoptera) (Tabla 2).
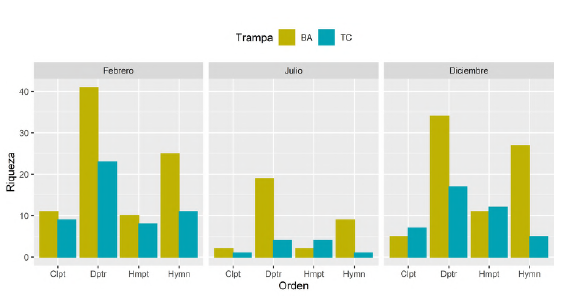
Figura 2 Riqueza de morfoespecies de los órdenes dominantes por tipo de trampa durante todo el periodo de estudio. Clpt: Coleoptera, Dptr: Diptera, Hmpt: Hemiptera, Hymn: Hymenopter
Tabla 2 Riqueza de morfoespecies por familia recolectada y tipo de trampa durante todo el período de muestreo. BA: bandeja amarilla; TC: trampa de caída
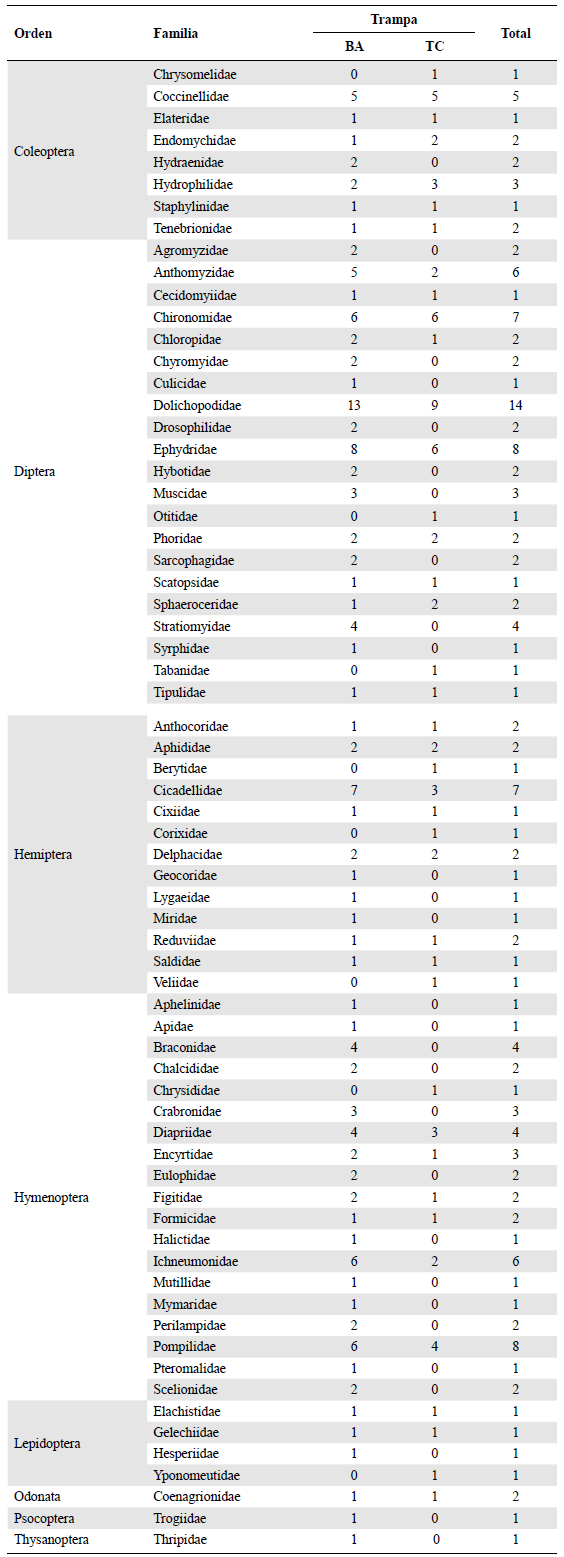
En el orden Diptera, las familias Dolichopodidae y Ephydridae fueron las de mayor aporte de morfoespecies en los tres meses de muestreo, seguidas de Chironomidae y Anthomyzidae. Chironomidae tuvo más registros en trampas de caída solo en febrero; en julio y diciembre las otras familias presentaron mayor cantidad de morfoespecies recolectadas en bandejas amarillas. En Hymenoptera, cuatro familias registraron la mayor riqueza: Pompilidae, Ichneumonidae, Braconidae y Diapriidae. En febrero, Diapriidae y Pompilidae se registraron con cuatro morfoespecies en bandejas amarillas y tres en trampas de caída. En julio, Braconidae se reportó con cuatro morfoespecies, todas recolectadas en bandejas amarillas. En diciembre, Ichneumonidae y Braconidae se recolectaron solo en bandejas amarillas, y de Pompilidae se recolectaron cuatro morfoespecies, una de ellas también recolectada en trampas de caída. Las familias de los órdenes de menor riqueza por lo general se recolectaron en bandejas amarillas (Tabla 2).
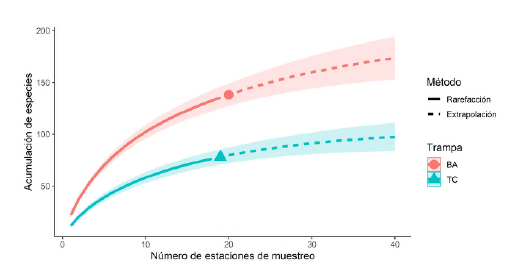
La diversidad (H') fue superior a 3,5 en las bandejas amarillas en febrero y diciembre. En julio, la dominancia fue mayor por la influencia de los registros de Ephydridae. Según el test de Kruskal-Wallis, no hubo diferencia significativa (p<0,05) en la diversidad, excepto en diciembre, y tampoco en la dominancia, pero sí en la equidad total (J') entre los dos tipos de trampa (Tabla 3). Según el índice de Jaccard, la similitud entre los dos métodos fue de 0,31 durante todo el estudio. El esfuerzo de muestreo realizado con las trampas de caída fue de 240 (10 trampas x 8 estaciones x 3 meses) y con las bandejas amarillas de 120 (5 bandejas x 8 estaciones x 3 meses). La riqueza observada en las bandejas amarillas fue de 138, y según los estimadores Chao y Jackniffe 1 y 2, la riqueza esperada se encontraría entre 191 y 220, lo que indica que se logró recolectar entre el 62,7 y el 72,3 % del total de especies. En las trampas de caída se observaron 78 morfoespecies y según los estimadores no paramétricos, la riqueza esperada se encontraría entre 105 y 122, es decir que con esta técnica podría haberse recolectado entre el 63,9 y el 74,3 % de las especies que habitarían el humedal (Tabla 4). En ninguno de los casos llegaron a estabilizarse las curvas de acumulación, sin embargo, se observó un mejor desempeño con las bandejas amarillas (Figura 3).
Tabla 3 Análisis de medianas con la prueba de Kruskal-Wallis y significación de 0,05 para los índices de diversidad de las trampas utilizadas durante todo el muestreo. S: riqueza de morfoespecies, H': diversidad de Shanon-Wiener, D: dominancia de Simpson, J': equidad de Pielou
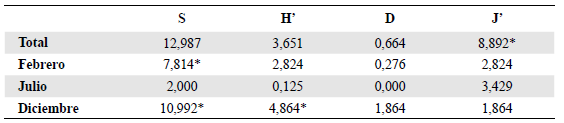
*: p<0,05
Tabla 4 Riqueza observada y estimada con los estimadores no paramétricos e índices de diversidad por cada mes y tipo de trampa
Discusión
La amplia diversidad de insectos y su distribución en los diferentes hábitats requiere el empleo de varias técnicas de muestreo (Missa et al., 2009) que permitan obtener una muestra representativa de la riqueza en el menor tiempo posible para inventarios biológicos y estudios de impacto ambiental, ya sea como línea de base o monitoreos, especialmente cuando se necesita información más precisa sobre grupos hiperdiversos (Donateli & Alves, 2019). Estas metodologías deben enfocarse en el grupo de interés, y para ello es necesario conocer, por lo menos, las características tróficas o de comportamiento que permitan escoger la más adecuada. Las dos técnicas de muestreo analizadas aquí son sencillas, tienen bajo costo y un amplio rango de captura (Jerez, 2000).
Por ser del tipo pasivo, las trampas de caída sin cebo solo capturan individuos que se desplazan preferentemente por el suelo sin ejercer atracción alguna. Por lo general se usan para capturar escarabajos, hormigas y arañas y su eficacia depende de su diseño y de las condiciones del hábitat. En el presente estudio se utilizó un diseño simple, como lo recomiendan Siewers et al. (2014), quienes compararon tres diseños de trampa de caída, dos con cubierta y una abierta, y observaron que la eficacia de captura no fue diferente entre ellas. Aquí se pudieron recolectar grupos que se desplazan exclusivamente entre la vegetación y el suelo, como algunos coleópteros y hemípteros. Este tipo de trampas ha demostrado ser eficaz en una gran variedad de comunidades vegetales: bosques, campos agrícolas, matorrales y pastizales, donde la metodología empleada no varía significativamente (Hohbein & Conway, 2018). Las bandejas o platos de colores son trampas activas que atraen a los insectos; la riqueza, abundancia y diversidad de los ejemplares capturados dependen de los colores empleados (Buffington et al., 2021; Mena et al., 2016). El amarillo se usa para la mayoría de los insectos voladores, sobre todo de las familias del orden Diptera (Santos & Fernandes, 2021; Westerberg et al., 2021), lo que pudo comprobarse en este trabajo. Estas trampas son importantes porque pueden atraer herbívoros y predadores, son fácil de ubicar en campo y muy eficientes en el tiempo (Rajmohana & Trivedi, 2019); en este estudio permitieron recolectar una gran cantidad de familias, incluidas algunas de hábitos parasitoides como Braconidae e Ichneumonidae.
Se tomó como ejemplo un ecosistema de humedales cercano a una zona urbana por su fácil acceso y gran diversidad de insectos (Sánchez et al., 2019). Los cuatro órdenes que registraron la mayor riqueza generalmente se encuentran en casi todos los hábitats por ser grupos hiperdiversos (Fernández et al., 2021). En respuesta al hidroperiodo, la mayor riqueza en las dos trampas se observó en febrero y diciembre, en tanto que julio fue el mes de menor riqueza y diversidad, pues el incremento del tamaño de los cuerpos de agua y las bajas temperaturas no favorecieron la captura de algunos grupos de insectos terrestres, además solo se obtuvieron muestras de pocas estaciones, cuatro con bandejas amarillas y tres con trampas de caída. Al existir mayor área con cobertura vegetal descubierta, en los meses de menor nivel de agua los insectos pueden distribuirse ampliamente y son atraídos en la mayoría de los casos a las bandejas amarillas, que pueden confundirse con pequeños cuerpos de agua (Santos & Fernandes, 2021) o flores, como lo demostraron Westerberg et al. (2021) al evaluar el efecto negativo que tenía la vegetación con flores circundantes sobre el muestreo mediante bandejas de colores en un bosque de coníferas en Suecia, lo que representa un sesgo porque los grupos recolectados serían generalmente fitófagos (Missa et al., 2009).
La riqueza fue diferente en febrero y diciembre con los dos tipos de trampa debido a una mayor presencia de cobertura vegetal y la atracción de grupos específicos (Shweta & Rajmohana, 2018), en tanto que en julio fue menor con ambas técnicas, aunque la recolección se registró principalmente en las bandejas amarillas, resultado que podría explicarse porque el color amarillo atrae a una mayor cantidad de especies dado que la reflectancia es muy similar a la del follaje verde de las plantas, como lo observaron Mena et al. (2016) al comparar la capacidad de captura de bracónidos con platos de diferentes colores. Además, al cubrirse de agua gran parte del humedal, la riqueza se concentró en familias con hábitos generalmente detritívoros. La diversidad fue estadísticamente similar con ambos métodos debido a la proximidad entre las formaciones vegetales, lo que permite un elevado intercambio de especies. Solo hay un trabajo previo sobre diversidad de insectos en los humedales de Ventanilla, el de Sánchez et al. (2019), quienes emplearon cuatro métodos de muestreo: trampas de caída, de Malaise, de recolección manual y red. El muestreo de trampas de caída consistió en dos líneas de 10 trampas, una sin cebo y la otra con carne en descomposición (necrotrampa), una vez al mes entre diciembre de 2010 y abril del 2011. A pesar de que el presente estudio difiere del mencionado, la riqueza recolectada con esas metodologías en los meses de diciembre y febrero, fue similar a la observada con las bandejas amarillas.
El uso de varios estimadores no paramétricos se recomienda para estimar el rango de la riqueza esperada, como lo anotan Donateli & Alves (2019) en su estudio con escarabajos de la familia Cerambycidae en Brasil, y Gonzáles et al. (2010) al evaluar algunos estimadores en un estudio con aves en México. Aquí los indicadores estimaron que la riqueza observada se encontraría entre el 62,1 y el 74,3 % del total esperado con cualquiera de los dos métodos; según esa estimación, se esperaba que en las trampas de caída se recolectaría la mayor riqueza, sin embargo, su capacidad de captura fue menor que el de las bandejas amarillas, pues con un menor esfuerzo, en estas se logró una mayor riqueza de morfoespe-cies, como lo reflejó el mejor desempeño de la curva. Algunos autores recomiendan un esfuerzo de muestreo de siete a diez días con las trampas de caída (Cheli & Corley, 2010; Hohbein & Conway, 2018) para obtener una muestra representativa del hábitat estudiado; aquí solo se emplearon dos días de muestreo durante los cuales se pudo obtener aproximadamente el 70 % de la riqueza estimada con uno u otro de los dos métodos. Considerando que el humedal tiene una gran riqueza y diversidad de insectos, especialmente del orden Diptera, el esfuerzo de muestreo empleado para este hábitat fue suficiente.
Para evitar el sesgo que representa la atracción de grupos específicos a cada tipo de trampa, y que se vio reflejado en la poca similitud de los métodos, es recomendable emplearlos juntos para obtener una muestra representativa en el menor tiempo posible, ya que hay diversos factores que influyen en la diversidad obtenida (Buffington et al., 2021), por ejemplo, la abundancia excesiva de algunos taxones y el comportamiento evasivo de otros (Siewers et al., 2014). Esta información debe interpretarse correctamente para decidir el esfuerzo y las técnicas a emplear en la captura de los grupos de interés a partir de la eficacia y la proporción de trampas empleadas en este estudio.
Conclusiones
Los resultados permiten concluir que en el humedal de Ventanilla se pudo recolectar una muestra superior de insectos con menos bandejas amarillas comparada con la cantidad de trampas de caída, y que su empleo combinado brindó una muestra representativa de la riqueza. Por su rapidez y efectividad, este tipo de muestreo puede replicarse en diferentes hábitats manteniendo la proporción mencionada y dependiendo del área y grupo de interés a evaluar, esto para evitar recolectar una riqueza y abundancia excesivas de algunos taxones, lo que podría resultar en una interpretación equivocada de los datos.