Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Latinoamericana de Bioética
Print version ISSN 1657-4702On-line version ISSN 2462-859X
rev.latinoam.bioet. vol.8 no.1 Bogotá Jan./June 2008
Propuesta para el desarrollo de un sistema de regulación y control técnico-social de la investigación Biomédica y Biotecnológica:
Caso Venezuela
IDEAS FOR THE DEVELOPMENT OF A REGULATION AND SOCIAL TECHNICAL CONTROL SYSTEM OF THE BIOMEDICAL RESEARCH AND BIOTECHNOLOGY :
VENEZUELAN CASE
*Ingeniero electrónico, Especialista en Ingeniería Biomédica y Hospitalaria, Doctor en Ingeniería, Especialidad en Teología, Magister en Teología, en Derechos Humanos y Bioética. Licenciatura en Educación (UCAB, 2007), Profesor de la Universidad Católica Andrés Bello (UCAB). Coordinador del Grupo Trans-disciplinario de Bioética, Director Ejecutivo de FundaCerebro. Vicepresidente del Centro Nacional de Bioética (CENABI). Email: lschmidt01@gmail.com
Fecha Recepción: Abril 20 de 2007
Fecha aceptación: Noviembre 10 de 2007
RESUMEN
El presente artículo tiene como propósito ofrecer los resultados de una investigación que pueda ayudar al mejoramiento del sistema de regulación y control tecno-social de la investigación biomédica y biotecnológica en Venezuela. Ésta, es clave tanto para el sector de Ciencia y Tecnología como para el de Salud nacional. La percepción bioética integral en esta materia, garantiza el incremento de la efectividad y calidad en la investigación con seres humanos, ya que esta interdisciplina busca la protección integral de las personas involucradas.
palabras clave: Investigación, Biotecnológica, Bioética, Regulación, Control, Efectividad.
ABSTRACT
The main purpose of this article is to present the results of research that can contribute to the improvement of the system regulation and control of biomedical and biotechnological research in Venezuela. This is key as for the Science and technology section as for the National Health. The integral bioethics perception, guarantees the increase of the effectiviness and quality in research with human beings, because this inter discipline looks for the integral protection of the involved people.
Key Words: Research, Biotechnology, Bioethics, Regulation, Control, Effectiveness.
INTRODUCCIÓN
El artículo expone los resultados de una Investigación realizada y que podrá ayudar a los responsables de los sectores de Salud y de Ciencia y Tecnología, para desarrollar un sistema de regulación y control de la investigación biomédica y biotecnológica (SRC-IBB) tecno-social en Venezuela. Cada país tiene sus características particulares, pero siempre se puede ofrecer luces a otros especialistas en la materia.
En Venezuela, escenario en el cual se desarrollará el contexto del proyecto, resulta preponderante propiciar el enlace entre el Instituto Nacional de Higiene Rafael Rangel (INH)1 adscrito al Ministerio de Salud (MS) como ente regulador local, la Industria Farmacéutica y los Centros de Investigación Científica, los comités de bioética hospitalarios y de investigación y, la participación de la sociedad venezolana como principal usuario de los protocolos de investigación.
MÉTODO
El enfoque cualitativo-fenomenológico empleado en el estudio, enfatiza la necesidad de una investigación con seres humanos más bioética y centrada en criterios de justicia y protección integral de la vida, de la salud, del ambiente y de la ciencia. Obviamente, desde un paradigma antropo-céntrico (centrado en las personas vulnerables del proceso investigativo), sobre todo cuando se realiza en gran escala.
El trabajo se refiere a un sistema de regulación y control. Luego, cuando se habla de sistemas, uno se refiere generalmente "al conjunto de procesos o elementos interrelacionados con un medio para formar una totalidad encauzada hacia un objetivo común". Ergo, el sistema establece necesariamente la trilogía de una ontología, una teleología y una epistemología propia que la define. En este trabajo, la razón de ser parte de la necesidad de hacer ciencia, en especial, en lo referente a la Salud humana, con el propósito de emplear la investigación médica con seres humanos en la innovación y desarrollo de procedimientos de prevención, diagnóstico y terapéutica que permita la mejor comprensión de la etiología y la patogénesis de las enfermedades, mediante metodologías científicas racionales y ajustadas a criterios bioéticos. Adicionalmente, se establecerá por la bioética un estatuto epistemológico particular y en paralelo al método científico y que parte del estar observando al sujeto de investigación y a todos los demás sujetos involucrados en el estudio experimental, de forma interdisciplinaria y con una perspectiva plural.
Lo técnico se refiere al conjunto de procedimientos que se siguen en la gestión de investigación con seres humanos. Mientras que lo social estará referido a la necesaria garantía de "escucha" y "participación" de las necesidades de los individuos, las comunidades y la sociedad en general, en lo concerniente a la definición de políticas sectoriales. Teniendo en cuenta que éstas, serán formuladas posteriormente, a nivel del ejecutivo por los especialistas y responsables de los servicios y programas de salud, para ser consensuada más tarde, en las comunidades. Dicho en otras palabras, las necesidades y expectativas de las estrategias y políticas parte de la base (la persona y la comunidad, las formulan a nivel sectorial y se presentan para su consenso a la comunidad (Schmidt, 2007). Obviamente, estableciéndose los mecanismos de supervisión y control requeridos para su adecuada ejecución2.
Esta teoría se fundamenta en las tesis de Jünger Haber-mas (1989) de la verdad por consenso intersubjetivo, y su apelación a la «situación ideal de diálogo»3. La comprensión de la naturaleza humana y social requiere de un proceso de reflexión crítica y argumentación. De esa percepción hegeliana de reconocimiento por encontrar los aspectos convergentes y divergentes, la identidad y la mismidad de una dialéctica entre diferentes4. La eticidad parte de este reconocimiento explícito y falible de la coexistencia humana. (Hegel, 1960) La opción de autodeterminación ciudadana, en la que el subjetivismo comunitario permite orientar las acciones de gobierno. Esta autodeterminación ciudadana viene a ser la media de las expectativas del conglomerado social que participa y emite su opinión, muchas veces no detectable en las participaciones individuales, pero que sin embargo subyace en el subjetivismo colectivo5. Pero su aplicación no es sencilla, ya que requiere de saber transmitir información, evitar ciertos prejuicios y controlar posibles manipulaciones.
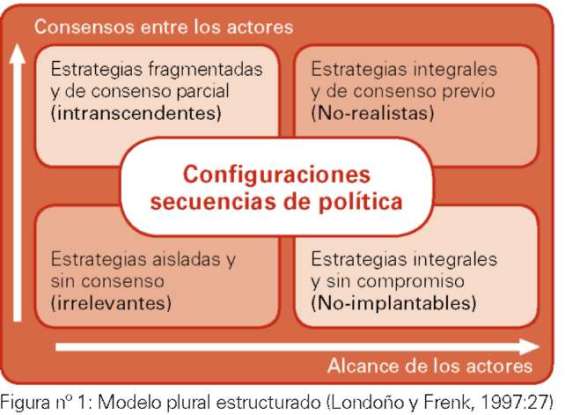
Diversos modelos se vienen empleando para la formulación de las estrategias políticas en diversos sectores de la vida de un país, unos más acertados que otros, pero tendrán más aceptación aquellas políticas que parten del reconocimiento de lo social y de lo individual de la vida, de lo que hacemos y lo que somos, lo que conlleva a vórtices de dilemas y convergencias entre lo político y lo ético. Se mencionará uno de ellos, que en mi criterio se adapta mejor a la complejidad de los problemas biopolíticos, el modelo del pluralismo estructurado (Londoño y Frenk, 1997)6, el cual fue concebido inicialmente para el sector salud y específicamente para abordar problemas de reforma sectorial. Justamente, una reforma que debe tomar en cuenta los diversos contextos en que se aplicarán las políticas sanitarias y se diseñarán investigaciones biomédicas para dar respuesta al mejoramiento de la situación del sector salud nacional.
Julio Frenk y Juan Luis Londoño (1997), establecen una estructura sistémica para el abordaje de estrategias, basado en un levantamiento de necesidades y expectativas a través de una serie de instrumentos predefinidos. De allí, las comunidades y expertos, podrán formular sus estrategias a corto/mediano/largo plazo tratando de configurar la secuencia de objetivos estratégicos y que en principio se consideran prioritarias (fig.n°1).
Lo cierto es, que a medida que más personas participan, más probable es que varíe esta secuencia de objetivos estratégicos. Por experiencia, cuando todas las partes interesadas pueden expresar abiertamente sus posiciones, resulta más fácil obtener un consenso negativo (sobre lo que no quieren) que uno positivo. Pero resulta, que esta secuencia de estrategias integrales y de consenso previo se vuelve poco realista, por la cantidad de objetivos a ser logrados en el tiempo esperado. Conociendo este comportamiento, generalmente los políticos y expertos no proceden de esta manera, sino que se formulan algunas estrategias aisladas, escogidas al azar o por criterios políticos, sin la búsqueda de un consenso con la comunidad, en consecuencia, la estrategia resulta irrelevante. Sin embargo, si se destacan los diversos objetivos estratégicos, priorizados según las necesidades o expectativas de la comunidad, priorizadas previamente con ellos mismos, se puede esperar un mejor resultado en su ejecución, por el involucramiento de todas las partes en la solución de sus problemas (Schmidt, 2007:123-124). Obviamente, de la planificación local hay que llevarla a un macro que sintetiza las líneas regulatorias a nivel nacional. De estas líneas se proponen líneas de investigación a ser realizadas por las diversas universidades y centros de investigación del país. Algunas, se propondrán o serán establecidas a nivel supranacional y de acuerdo con las prioridades nacionales, podrán ser incluidas o no.
LAS INVESTIGACIONES CON SERES HUMANOS
Éstas, difieren de otras investigaciones que se hacen también en la Ciencia, ya que el trabajo con seres humanos añade complejidades en la concepción ético-jurídica del método científico convencional7. Esta postura ha sido comprendida desde los mismos comienzos de la historia de la humanidad por la mayoría de los médicos, basta con leer las bibliografías de los grandes maestros de la medicina como p.ej.: Hipócrates, Galeno, Paracelso, Dioscórides, Avicena, Maimónides, Versalio, Harvey, Bichat, Jenner, Laennec, Pasteur, Koch, Virchow, Lister, Mendel, Ramón y Cajal, Snow, Chadwick, Fleming, Von Pettenkofer, Razetti, Vargas, Watson y Crick. Sin embargo, quisiera destacar la obra científica y epistemológica de Claude Bernard, quien fuera el iniciador de la fisiología científica, y al mismo tiempo de las características del método experimental acucioso, que supo armonizar la filosofía de la medicina y la filosofía de la ciencia8 (Bernard, 1865). Es significativa la máxima que enunciara en su tiempo en torno a esta materia, que él «tenía el derecho de investigar siempre que el resultado de la investigación pudiera producir un beneficio directo para el sujeto de investigación y que ese derecho se perdería siempre que la investigación pudiera provocar algún daño a ese sujeto, aunque el resultado de la misma pudiera ser útil para otros sujetos o para la sociedad»9 (Garrata; lorenzo, 2007).
Este criterio de protección al paciente o sujeto de investigación se ha mantenido y retomó vigencia con el Código de Nüremberg con el consentimiento informado y la Declaración de Helsinki (DH) en su art. 2: «El deber del médico es promover y velar por la salud de las personas. Los conocimientos y la conciencia del médico han de subordinarse al cumplimiento de ese deber».
Independientemente de la nefasta experiencia de médicos nazis (1939-1945), se continúan en la historia reciente los casos funestos, entre los más sonados están:
• El estudio de sífilis de Tuskegee (1932-1973)10: donde más de 400 personas indigentes de raza negra que padecían sífilis, fueron mantenidos, sin tratamiento, desde 1932 en adelante, a fin de obtener un conocimiento más exacto del curso de la enfermedad y tener así un grupo control para evaluar la eficacia de los tratamientos.
• El caso de los experimentos de radiación en humanos (1944-1974): Experiencias diversas que se realizaron durante medio siglo para evaluar los efectos de la radiación en el ser humano y fueron reguladas por el Advisory Committee on Human Radiation.
• El caso del Hospital Judío de enfermedades crónicas (1965): El uso de pacientes geriátricos de este centro oncológico de Brooklyn a los que se les inyectaron células cancerosas para estudiar la respuesta inmunológica a los tumores.
• En 1966 Henry K. Beecher, médico de Harvard, que denunció patrones de conducta poco éticas en investigaciones médicas recientes11 (Beecher, 1966).
• El caso de Milledgeville (1969): El uso de drogas de investigación con niños discapacitados.
• El caso de la Escuela Willow Brook (1963-73): El uso de niños especiales de una institución del Estado de Nueva York que fueron inoculados con virus de la hepatitis para poder disponer de datos comparativos en el ensayo de una vacuna.
• La clonación humana (2003): Un caso fue el engaño manejado por Clonaid una empresa fundada por la secta religiosa Raeliana, que cree que seres extraterrestres crearon la vida en la Tierra a través de la clonación.
• El caso de Hwang Woo-suk (2006): Científico sur-coreano quién paso de ser un honorable genetista internacional a ser un villano, al falsificar sus estudios sobre células madre de embriones humanos clonados y procurarse de fondos de investigación.
En Estados Unidos, por iniciativa de Edward Kennedy, tras observar lo ocurrido en Tuskegee trajo consigo la creación de la Comisión Nacional para la Protección de los Seres Humanos Sujetos de Investigación Biomédica y del Comportamiento (1970)12 Más tarde, en los años 80 se constituyó la Comisión Presidencial para el Estudio de Problemas Éticos en la Investigación Biomédica. Estas comisiones han sido emuladas por muchos países, con el propósito de regular y controlar la investigación con seres humanos.
INTERROGANTES TÉCNICO-ÉTICAS
Ante la realidad internacional, sería conveniente formularnos algunas interrogantes que ofrezcan luces y sombras a ser consideradas en la presente investigación con personas:
• La investigación nacional: ¿Qué proyectos de investigación se están llevando a cabo a nivel nacional? ¿Cómo se investiga en el país? ¿Con qué recursos se cuenta? ¿Cuándo, dónde y hasta qué se investiga? ¿Cuáles son las necesidades y expectativas de investigación en el país? ¿Cuáles son los resultados y cuál es la situación nacional?
• Las políticas sanitarias y de investigación: ¿Cómo se formulan las políticas sanitarias del país? ¿Cómo y cuándo se implantan? ¿Cómo es el resultado? ¿Cómo se registran y cómo se supervisan?
• El enfoque ético a ser aplicado: ¿En qué forma inciden los enfoques ético-utilitaristas y ético-humanistas en la elaboración de las políticas y normas en materia de investigación con seres humanos? ¿Las normas éticas no deben considerar aspectos como la cultura, modus vivendi y contexto en general? ¿Cuáles normativas ético-legales que deben ser consideradas en el país? ¿Se pueden tener normas éticas más recíprocas?
• El placebo y el doble estándar: ¿Se justifica el uso del placebo en las investigaciones con seres humanos? ¿Se justifica hacer en el país investigaciones con el doble estándar? ¿Por qué se establecen diferencias?
• El investigador: ¿Cuáles deberían ser sus credenciales? ¿Cómo se acredita a un investigador? ¿Quiénes le deberían ayudar en la investigación? ¿En qué se debe centrar la responsabilidad del investigador?
Por lo expresado anteriormente, en la formulación de las líneas de investigación a ser observadas per se:
• Marco definitorio de la investigación: ¿Qué investigación se realiza? ¿Quién lo financia? ¿Cuál es el diseño de investigación empleado? ¿El para qué y el por qué de la investigación (fin y justificación)? ¿Cuál es el objeto y destinatario de la investigación? ¿Cuáles son los objetivos de la investigación? ¿Se realiza con seres humanos?
• Fundamentos éticos: ¿Se garantiza el respeto por la dignidad y la libertad del sujeto de investigación? ¿Se garantiza la veracidad en la investigación? ¿Se protegen a las personas más vulnerables? ¿Se garantizan el principio de justicia, igualdad y equidad, autonomía, beneficencia y no maleficencia? ¿Hay discriminación y estigmación? ¿Hay respeto a la diversidad cultural y estigmación? ¿Se aplica el principio de equiponderación, protección de las generaciones futuras? ¿Se contempla la solidaridad y cooperación? ¿Se considera la responsabilidad social y salud? ¿Hay reciprocidad ética entre todas las partes de la investigación (inversión, disponibilidad, beneficios, riesgos, manejo de contingencias, propiedad intelectual)? ¿Existe un aprovechamiento compartido de los beneficios?
• Fundamentos jurídicos: ¿Cómo se garantiza el derecho a-saber y no-saber? ¿Cuál es el consentimiento de información empleado? ¿Se le ofrece la suficiente información a los candidatos de investigación sobre la investigación en la que irían a participar, condiciones, alternativas, riesgos y beneficios, acciones en caso de complicaciones?
• Criterios de evaluación: ¿Cuáles son las guías de elaboración y evaluación de protocolos de investigación? ¿Se garantiza la completitud de la información requerida? ¿Quién(es) y cómo se revisa y aprueba la realización de la investigación? ¿Quién(es) y cómo se supervisa y evalúa los preliminares, puesta en marcha, ejecución y cierre de un estudio? ¿Quién(es) y cómo se garantiza(n) la efectividad y calidad de los procedimientos empleados y del manejo de contingencias que puedan ocurrir?
• Manejo de riesgos: ¿Cuáles son los procedimientos de previsión y minimización de riesgos? ¿Cuándo y cómo se garantiza la rápida y adecuada respuesta ante reacciones adversas en los sujetos de investigación?
• Beneficios: ¿Cuáles son los beneficios actuales y futuros de las personas y comunidades estudiadas?
• Conflictos de interés: ¿Cuáles son los principales conflictos de interés que suceden generalmente en las investigaciones, relativas al centro asistencial o de investigación, al equipo responsable, los sujetos de investigación y las relaciones con los representantes patrocinadores, comités de bioética y del ejecutivo nacional?
A nivel del Estado, Multinacionales y Organismos Internacionales se enunciaron otras líneas a ser observadas para la regulación y control macro de las investigaciones con seres humanos, por ejemplo:
• ¿Si las normativas y disposiciones existentes permiten la reciprocidad ética entre todos los actores de la investigación? ¿Cuáles son sus prioridades y cómo ejercen su autoridad para el logro de las mismas? ¿Cuáles son los principales beneficios que piensan obtenerse de la investigación científica y tecnológica, sobre todo ante eventuales patentes biotecnológicas? ¿Cómo se maneja el tema de la propiedad intelectual entre todos los actores?
• ¿Qué se define y cómo se evalúan los criterios e indicadores de efectividad y calidad de procesos y resultados, la acreditación de los profesionales de investigación, las observaciones de los comités de ética de investigación? ¿Qué medidas y cómo se garantiza la protección de los sujetos vulnerables del proceso investigativo?
A nivel de la sociedad, instituciones gremiales, organizaciones no gubernamentales se introdujeron otras líneas a ser evaluadas, como por ejemplo:
• ¿Qué y cómo participar en el SRC-IBB/social? Obviamente, ¿El por qué, cuándo, con qué medios y hasta-qué, hasta-dónde se define su participación? ¿Cómo se relaciona la comunidad científica para tratar estos aspectos?
• ¿Cómo se difunden los avances y las alertas? Adicionalmente, por las restricciones en el control de divisas y tributarias: ¿Qué y cómo influyen en las investigaciones que se realizan?
• ¿Se indemnizan las personas que hayan sufrido algún daño producto de la investigación, o los familiares en caso de muerte de un sujeto de investigación?
• ¿Se dotarán las farmacias de dicho producto posterior a la conclusión de la investigación, en caso de ser exitosa?
Debido a que la investigación cualitativa, exploratoria y descriptiva, se consideró emplear instrumentos semiestructurados, ya que permiten cierta flexibilidad y la consideración de otros aspectos y criterios en su desarrollo, según las personas entrevistadas o las situaciones observadas. Muchas inquietudes se generan exante, durante y post una investigación, inquietudes que pueden ampliarse o modificarse, criterios que pueden variar según los casos, entre otras situaciones que ocurren durante el sondeo de opiniones y ante personas que puedan colaborar o no al buen resultado de la misma.
LA INVESTIGACIÓN BIOMÉDICA Y BIOTECNOLÓGICA
La Consejo de Organizaciones Internacionales de las Ciencias Médicas (CIOMS) en colaboración con la Organización Mundial de la Salud (CIOMS 2002) plantea en el Preámbulo:
El término "investigación" se refiere a un tipo de actividad diseñada para desarrollar o contribuir al conocimiento generalizable. El conocimiento generalizable consiste en teorías, principios o relaciones, o acumulación de la información sobre la que se basan, que puede ser corroborado por métodos científicos aceptados de observación e inferencia. En el presente contexto, "investigación" incluye los estudios médicos y de comportamiento relativos a la salud humana. Por lo general, el término "investigación" es acompañado por el adjetivo "biomédica" para indicar su relación con la salud.
El progreso en la atención médica y en la prevención de enfermedades depende de la comprensión de procesos fisiológicos y patológicos o de descubrimientos epidemiológicos y, en algún momento, requiere investigación en seres humanos. La obtención, análisis e interpretación de la información surgida de la investigación en seres humanos contribuye de manera significativa a mejorar la salud humana.
La gestión de investigación y desarrollo (lyD), en especial con seres humanos, comprende un conjunto de aspectos que son complejos de regular y controlar per se, debido a su naturaleza: el ser humano en-sí mismo, lo multivariable de los procesos involucrados en un descubrimiento, mejoramiento o innovación científica y tecnológica (Inversión, Legislación, Prestación de Servicios de Salud, IyD propiamente dicha, Producción y Comercialización de Productos, Educación, Propiedad Intelectual, Tributo y Control de Divisas). A su vez, la investigación con seres humanos es una necesidad vital para la supervivencia de la humanidad y tiene que garantizarse por tanto, la efectividad y seguridad de los procesos, el aseguramiento de los sujetos de investigación y la minimización riesgos (daños y pérdida de vidas), obviamente desde un marco ético-jurídico de protección a las partes vulnerables13.
La gestión de lyD requiere en esta materia, de metodologías adecuadas para el registro y control de las diversas alternativas de estudios en los que se involucran seres humanos, debido principalmente a cuestiones de:
• Objetividad: El objetivo de la ciencia es conocer la realidad empírica, observable (directa o indirectamente), de la forma más confiable posible (en base a pruebas), aunque no infalible ni absoluto.
• Observabilidad: Los hechos tienen que ser observados, cuantificados y registrados adecuadamente.
• Previsibilidad: Las ciencias naturales proporcionan la capacidad de prever la evolución de los procesos naturales, la metodología histórica ha sido "científicamente" concebida sólo si y en cuanto habilita abstractamente para "prever" p.ej., el porvenir de la sociedad.
• Predictibilidad: El carácter interdisciplinar de la ciencia actual también fomenta ésta heterodoxia metodológica en busca de "modelos" heurísticos de la realidad. La causa/ efecto es una noción en claro declive en los discursos científicos, donde se busca un discurso representativo de la misma. Se persigue la obtención de una "expresión formal" y conceptual de los fenómenos que permita, por supuesto, el control, la predictibilidad y la reproducibilidad de la experiencia, pero desde visiones mucho más relativistas.
• Eticidad: Reconocer que toda investigación científica que involucre sujetos humanos, debe ser conducida con base en los principios éticos fundamentales de respeto a las personas, protección a los sujetos vulnerables, beneficio individual y colectivo, equidad y justicia. Una investigación que sea justa en términos de justicia distributiva y de justicia como reciprocidad.
• Investigaciones que no tengan el "doble estándar", sino que sean considerados todas las personas o sujetos de investigación equitativamente, sean de un pueblo o de otro. De igual manera que las investigaciones que se realicen acorde al cumplimiento de las normas internacionales14.
• Viabilidad: Las IBB donde el interés del ser humano prevalezca sobre los intereses de la ciencia y la tecnología, en la cual se proponga un avance en el conocimiento científico sobre el ser humano que conduzca al mejoramiento de salud.
• Privacidad: Los sujetos de investigación son reducidos a "números" y en definitiva quedan siendo sólo eso. Son examinados, evaluados, aceptados o descartados, renuncian, son dañados o mueren y así quedan. "Éstos", son sujetos de investigación, a quiénes se les merece por su dignidad, todo el respeto y la autonomía que poseen como personas (en sus contextos, culturas y creencias).
• Verificabilidad: Los protocolos son estandarizados a pesar de que puedan tener deficiencias, no se adapten a todo contexto de evaluación, no sean seguidos y evaluados, se alteren a veces sus procedimientos y/o productos empleados. Pero eso sí, tienen que hacerse como rutina.
• Replicabilidad: La matemáticas, la física y la biología son ciencias cuyas investigaciones son replicables bajo ciertas condiciones. Pero, ¿quién garantiza que dos personas reaccionan de igual manera a un tratamiento? Es bien conocida la multivariedad de sus comportamientos, formas de pensar y manejo de su emotividad, según cómo se alimenten, trabajen y vivan en general?
• Auditabilidad: ¿Quién me garantiza de que en verdad se le hizo el debido seguimiento y auditorias de investigación? Es difícil en general por los miembros del Comité de Bioética, representantes de instituciones del Estado y aún para los mismos delegados de los Laboratorios, por la cantidad de trabajo que de por sí tienen estos actores; por el tiempo que requieren estas actividades; por que son hechas en forma desinteresada se les asigna una segunda prioridad; y por el llenado de formatos complejos y fastidiosos.
• Alternabilidad y manejo de contingencias. ¿Qué hacer si ocurre A ó B o C? ¿Y si no está escrito? ¿Por qué no es admitida la persona en emergencia de su centro asistencial? ¿A quién se llama? ¿Qué ocurre cuando las asignaciones no cubren las necesidades y contingencias previsibles?
• Evaluabilidad. La evaluación del proyecto, generalmente se reduce al lapso de experimentación en voluminosas carpetas con el protocolo, información de los sujetos de investigación y otros de formatos y datos del seguimiento, reacciones adversas. Sin embargo, se deberían considerar los tres momentos diferentes de evaluación de proyectos de lyD: el exante, el en-curso y el expost.
Si bien es cierto, desde el punto de las investigaciones con productos farmacológicos existe desde hace más de un siglo un detallado y estricto control en las investigaciones, así como un apego al cumplimiento de las Normas y Guías de Buenas Prácticas, han proliferado el tipo de productos alternativos que son empleados cuyas investigaciones y autorizaciones se ponen en duda, por la dificultad de cumplir con el método científico y los criterios anteriormente expuestos.
Por otro lado, por las competencias que ocurren en éste ámbito, por sacar al mercado primero que otros un producto, se incurren en ciertos ilícitos que ponen en tela de juicio la idoneidad de un producto y que por los procedimientos de las instituciones responsables de su autorización para su comercialización, detectan tardíamente los riesgos y daños que se han incurrido, tras el surgimiento de múltiples denuncias e incluso fallecimientos de personas que pudieron evitarse.
Los sistemas de fármacovigilancia15 es un buen ejemplo de lo que deberían ser los SRC-IBB/social, ya que ante reacciones adversas detectadas por los equipos de investigación y comités de bioética locales, por profesionales de la salud en sus funciones de diagnóstico o tratamiento de enfermedades, o por personas ante cualquier sospecha sobre el uso y dosis empleadas, reacciones varias que se produzcan, productos que pudieran entran en competencia, alimentos e incompatibilidades. Alertando cualquier sospecha a los patrocinadores para el cambio de dosis, revisión de tratamientos o suspensión de la investigación. En caso de respuestas negativas, solicitar una investigación a los Comités de Seguridad de Medicamentos de uso Humano, para que en caso de ser válida la presunción, se proceda a suspender la investigación. En caso de ser posible, recomendar otros medicamentos ante la disponibilidad de alternativas terapéuticas con mejor perfil de seguridad. Así mismo, recomendar la alerta de dicho producto o principio activo ante el Instituto Nacional de Higiene y la dependencia responsable de la autorización de Medicamentos en el Ministerio de Salud.
La gestión de investigación con seres humanos involucra la necesidad de equipos multidisciplinarios e independientes, que garanticen un manejo plural e interdisciplinario de los proyectos de IyD. Sin embargo, se conforman entre médicos, ocasionalmente una enfermera y algún profesional o miembro de la comunidad. Estos procesos de compleja comprensión no pueden ser evaluados por personas de una misma disciplina, la interdisciplinaridad es fundamental para comenzar a acercarse a la verdad16 y lograr la concepción de "sistema".
Por todo lo expuesto, la dinámica de la gestión de lyD se vuelve cada vez más compleja por sus múltiples actores (participantes, beneficiarios, competidores y el Estado); las interrelaciones que se suceden por conflictos éticos entre los actores, el marco jurídico y las intenciones de la investigación (manifiestas y ocultas); los costos asociados a los procesos de descubrimiento e innovación que se están incrementando gradualmente (p.ej.: materia prima, controles aduanales, seguros de responsabilidad, beneficios adicionales para los sujetos de investigación, equipos de evaluación locales e internacionales). Por si esto fuera poco, las negociaciones internacionales recientes han traído nuevos factores a tomar en cuenta en la evaluación: las preocupaciones ambientales y la búsqueda de los sistemas sustentables. Se está ante un problema multidimensional de complejidad creciente que se entrevera entre sí.
La investigación en seres humanos incluye desde estudios de procesos fisiológicos, bioquímicos o patológicos, o de la respuesta a una intervención específica -física, química o psicológica- en pacientes o sujetos sanos; los ensayos controlados de intervenciones diagnósticas, preventivas o terapéuticas en grandes grupos de personas, diseñados para demostrar una respuesta específica generalizable a esas intervenciones contra un fondo de variación biológica individual; los estudios diseñados para determinar las consecuencias de intervenciones preventivas o terapéuticas específicas para individuos y comunidades; y los estudios sobre el comportamiento humano relacionado con la salud en variadas circunstancias y entornos. Aspectos que pueden ser ubicados en un amplio espectro de investigaciones (a nivel nacional e internacional) y que se puede clasificar de la siguiente manera17 (Penchaszadeh, 2007):
1. Investigaciones epidemiológicas.
2. Investigaciones con vacunas.
3. Investigaciones genéticas, genómicas y proteómicas.
a. Investigaciones de laboratorio.
b. Investigaciones de campo.
4. Investigaciones farmacológicas.
a. Investigaciones clínicas con fármacos.
b. Investigaciones farmacogenéticas y farmacogenómicas.
c. Investigaciones con biofármacos.
5. Investigaciones de bioregeneración.
a. Investigaciones con trasplantes.
b. Investigaciones con células troncales.
c. Investigaciones antienvejecimiento.
d. Investigaciones sobre neuroterapias.
6. Investigaciones en comunidades originarias.
7. Investigaciones de bioingeniería.
a. Investigaciones biónicas.
b. Investigaciones cibernéticas.
c. Investigaciones en nanomedicina.
d. Investigaciones instrumentales o de equipos médicos.
8. Investigaciones de Bioseguridad.
a. Manejo de muestras biológicas y bases de datos genéticos.
b. Manejo de materiales de alto riesgo.
c. Manejo de contingencias de alto riesgo.
d. Manejo de residuos (biológicos, radiológicos)
9. Investigaciones relativas a trastornos mentales y de neuroprogramación
10. Investigaciones biomédicas espaciales.
Brevemente se puede expresar de cada una de estas variantes de las IBB18, en las que se diferencian más por el medio (vacunas, fármacos, ingeniería genética y genómica, células troncales) que por el fin de investigación, el mejoramiento de la salud del sujeto humano y su calidad de vida, en general. Ahora, el cómo se hará, dependerá de qué se quiera hacer.
Investigación epidemiológica: Ésta, es tal vez, la de mayor tradición y cada día, se complejiza más por los procesos de urbanización y globalización que en nuestra aldea global acaecen, generándose nuevos escenarios y problemas de salud. Generalmente se desarrolla con la aplicación de las subsiguientes tipologías (p.ej., vacunas, fármacos, comunidades) en las que se evalúa morbilidad: incidencia y prevalencia de enfermedades, pruebas diagnósticas, tratamientos y calidad de vida.
Si uno va más allá de la tradicional definición de Mac Mahon que se refiere a «la distribución y frecuencia de las enfermedades de la población y factores de riesgo asociados», se podrá incluir las relaciones del hombre y del ambiente, y las necesidades y maneras de satisfacerlas (investigación operativa en salud: matrices de opinión, creencias y valores y, evaluación de la comunicación efectiva). Este tipo de investigaciones cuentan en la actualidad con el apoyo de sistemas de alerta a nivel de toda la cobertura nacional, las estadísticas, la informática y sistemas de información, como el geográfico, el cual constituye una herramienta para el registro y control de investigaciones en específicas enfermedades. La visión global en cada país, permite el desarrollo de políticas de salud más efectivas. Más aún si se interconectan con la de los demás países.
Este tipo de investigación permite el estudio de perfiles epidemiológicos de la población, salud de los migrantes, salud ocupacional, vigilancia epidemiológica, atención primaria de la salud, formación de recursos humanos y sistemas de información epidemiológicos y geográficos.
Investigación con vacunas: Este tipo de investigación está muy vinculada a la epidemiológica, en materia de vacunaciones preventivas, tanto en el ámbito de la investigación básica como aplicada. Dada la necesidad de prevención y control de enfermedades de rápida transmisión, se pone especial énfasis en los aspectos relacionados con la planificación y evaluación (epidemiología de las enfermedades vacunables, desarrollo de programas de vacunaciones, evaluación de la eficacia, efectividad y eficiencia de las vacunaciones).
Marie-Paule Kieny, Directora de la Iniciativa para la Investigación de Vacunas de la Organización Mundial de la Salud (OMS) expresó19.
No obstante, la experiencia ha demostrado que la incorporación de nuevas vacunas es un proceso extremadamente lento. Es urgente que encontremos soluciones para poner a disposición de todas las personas en riesgo estos poderosos instrumentos sanitarios de eficacia demostrada. Los obstáculos para poner las nuevas vacunas a disposición de las personas que las necesitan son de carácter científico, financiero, técnico y de reglamentación. Pero hay problemas adicionales, como la inexistencia de un suministro suficiente de vacunas y la debilidad de los sistemas de salud de muchos países en desarrollo, que condiciona una baja cobertura vacunal.
Es probable que en los próximos diez años se duplique el número de vacunas disponibles (unas veinte en la actualidad). En general, se necesitan unos 12 a 15 años y US $200 a 500 millones para desarrollar una nueva vacuna.
Entre los progresos recientes en este campo destacan: Dos vacunas contra la diarrea por rotavirus.
• Una vacuna tetravalente contra la meningitis meningocócica (aprobada en los Estados Unidos de América) y una vacuna heptavalente que protege contra la meningitis A y C.
• Una vacuna antineumocócica conjugada nonavalente.
• Vacunas bivalentes y tetravalentes contra los papilo-mavirus humanos, que protegen contra el cáncer del cuello uterino.
• Una vacuna antipalúdica.
• Una vacuna oral contra el cólera.
• Una vacuna contra la encefalitis japonesa. Además de las expresadas, hay otra que está siendo investigada, la vacuna contra el VIH20, el VPH entre otras enfermedades de transmisión sexual.
Investigación genética, genómica y proteómica: Si las anteriores son claves en la salud, éste tipo de investigación de la biomedicina molecular, es la que ha tenido mayor expansión en estas últimas décadas, en la búsqueda a descifrar el genoma (secuenciamiento) con el Proyecto Genoma Humano, la identificación de los genes responsables las diversas enfermedades mono y multifactoriales (genoma cromosómico), búsqueda de aplicaciones diagnósticas y terapéuticas más efectivas, la detección de genes asociados con ciertas predisposiciones de contraer ciertas enfermedades (creación de nuevos fármacos contra la anorexia y la bulimia21), detección de factores genéticos asociados a la resistencia o a la susceptibilidad a ciertos agentes infecciosos, el desarrollo de "pruebas genéticas predictivas", investigaciones de nuevas terapias genéticas y genómicas, biochips de cADN, la catalogación de diversos datos genéticos para criminología, patrones hereditarios y étnicos (genoma mitocondrial).
Investigación farmacológica: Este tipo de investigación es el que tiene mayor tradición en la historia de las IBB y posiblemente la más difundida. Cuando se habla de investigaciones farmacológicas, se refiere a las investigaciones clínicas centradas en el empleo de un medicamento22 en cualquiera de sus diferentes formas. Si bien en la tradición farmacológica se buscaron medicamentos dirigidos a mejorar ciertas enfermedades, la experiencia actual se dirige más a una medicina más individualizada, para hacer tratamientos cada vez más efectivos23.
La investigación farmacogenética es debida al desarrollo de la medicina regenerativa y el estudio del cómo los genes influencian la respuesta de un ser a las drogas, conducirá a drogas más específicas a la diversidad humana. Mientras que la farmacogenómica surge de la farmacogenética. Su campo de acción es más amplio. Por ejemplo, la farmacogenómica busca entender no sólo la composición molecular de las variantes genéticas asociadas a la respuesta a las drogas sino también el comportamiento de estas variantes, incluyendo como esos genes afectan a los sitios receptores por drogas24.
Los biofármacos son productos farmacéuticos que ha sido elaborado a partir de materiales de origen biológico, tales como microorganismos, órganos y tejidos de origen vegetal o animal, células o fluidos de origen humano o animal y los diseños celulares (sustratos celulares, sean a no recombinantes, incluidas las células primarias); así como de origen biotecnológico que se obtienen a partir de una proteína o ácido nucleico por tecnología DNA recombinante.
Investigación de bioregeneración: Este tipo de investigación siempre ha estado presente en la medicina y en la ecología, solo que ahora tiene mejores medios para lograrlo con el empleo de otros tejidos, células, biocompo-nentes, así como la debida a células toti y pluripotenciales (llamadas también estaminales, troncales o madre). Sin embargo a la importancia que reviste, trae consigo mucho del pensamiento mágico y espiritualista.
Tal vez el tipo de investigación más significativa es con células tronco-embrionarias; El desarrollo de nuevos sistemas de manipulación y dispositivos para la transferencia, diferenciación y desdiferenciación, así como para la clonación de células individuales. En este campo de actividades se diseñan nuevos enfoques farmacológicos y se desarrollan sistemas de biohíbridos para establecer un nexo de unión entre componentes técnicos y biológicos. El aislamiento, la multiplicación y la crioconservación de células madre aisladas representan una nueva área de investigación y desarrollo. El desarrollo de diagnósticos inmunológicos y celulares y modelos terapéuticos; biomateriales, fabricación de células y control celular, inmunomodulación y terapia celular.
Investigaciones en comunidades indígenas o de poblaciones marginales: En este tipo de investigación que puede ser de tipo antropológico, farmacológica, genética o cualquiera otra mencionada anteriormente. Su aspecto diferencial es en que se centra en la vulnerabilidad de los grupos étnicos de las comunidades indígenas que todavía conservan buena parte de sus condiciones nativas o aborígenes (cultura, modus vivendi, lengua y tradiciones). En este sentido el respeto a sus costumbres en el proceso de consentimiento informado y a quién (o quiénes) se le pide el consentimiento, el tipo de beneficios, entre otras consideraciones que tienen que ser considerados. En el caso de grupos étnicos y comunidades marginales, también hay que tener consideraciones adicionales, diferentes a las de las comunidades aborígenes y relativas a su condición de marginado social25.
Investigaciones de bioingeniería: Las investigaciones en este campo son múltiples, generalmente de soporte a las anteriores investigaciones en materia de observación, controles, registros, instrumentos y equipos diversos en Electromedicina, Biomecánica, Bioimplantes, Cibernética, Fisiología y Biofísica, Bioquímica, Biomateriales, Ingeniería Clínica, Ingeniería de Rehabilitación e investigaciones Neurológicas y Sensoriales, Inteligencia Artificial, Microscopia y Biología Molecular. Por lo tanto, comprende un amplio espectro de desarrollo e innovación tecnológica. Prácticamente comprende desde el producir nuevos dispositivos y sistemas que repercutan en diferentes ámbitos de la biomedicina, entre los que figuran la regeneración de tejidos, el perfeccionamiento de las prótesis e implantes, o la liberación de fármacos de forma prolongada y constante para administrar la dosis precisa.
Investigaciones de bioseguridad: Este tipo de investigación como la anterior, soporta las anteriores tipologías mencionadas. Su razón radica en la toxicidad y peligrosidad que está latente con el manejo de ciertas substancias y microorganismos patógenos, que son empleados en algunas investigaciones médicas (y lamentablemente militares) y que constituyen un riesgo potencial para los seres humanos y el medio ambiente, daño biológico que ocasionan. La bioseguridad implica por tanto, un conjunto de reglas de protección, que se aplicarán en el laboratorio, el centro de investigación y sus alrededores, desde la recepción hasta el desecho de agentes o muestras biológicas, pasando por su manipulación y las cuales
dependerán del tipo y cantidad de éstos y los procedimientos empleados para su manejo. Por la facilidad y costos de generar daño a las personas, han sido empleado estas substancias y microorganismos para prácticas bioterroristas. Teniendo que implantarse medidas que logren contrarrestar la rapidez y cobertura de los químicos y patógenos empleados.
Otro aspecto a ser considerado en materia de seguridad, es el relativo al manejo de muestras biológicas y bases de datos genéticos y genómicos (o biobancos) para asistencia e investigación y las biopatentes. Estas investigaciones son éticamente susceptibles por los aspectos de la identificación, autonomía e integridad de las personas, motivo por lo cual, tienen que cumplirse con ciertas condiciones de confidencialidad, seguridad, registro y control26.
Investigaciones relativas a trastornos mentales y de neuroprogramación: Las prácticas psiquiátricas y psicológicas emplean fármacos y ciertos instrumentos y equipos para inducir a la mejora de ciertas enfermedades mentales. Su uso es altamente cuestionado por la efectividad y seguridad de las mismas, sin embargo aún se emplean para procesos de desaprendizaje o introducción de mensajes subliminales.
Investigaciones biomédicas espaciales: Uno de los campos de investigación que comienza a tener auge es el relativo al de las IBB en el espacio, p.ej. en la Estación Espacial Internacional o futuras bases lunares, por cambiar ciertas condiciones y comportamientos que la falta de gravedad propicia en los organismos y partes del mismo, a nivel celular y molecular. Otro aspecto concierne a los efectos de las radiaciones cósmicas y campos magnéticos.
CUESTIONES BIOÉTICAS A SER CONSIDERADAS EN LAS IBB
Los aspectos éticos, jurídicos, sociales e individuales más frecuentes27 en las investigaciones con seres humanos residen en (Marshall, 2008):
El objeto de la investigación:
El sujeto. El objeto de investigación ya no es objeto si no es sujeto con derechos, un ciudadano y persona en definitiva.
• La unicidad del ser. El objeto ya no es sólo un gen, un genoma, una célula, un tejido, un órgano, es una parte de una persona. Por ello, debería existir un reconocimiento de que se manipulan células de seres humanos, independientemente de su semejanza con la de otros seres vivos.
• Naturaleza ontológica y axiológica del ser. El hecho en sí de que investigar con seres humanos conlleva al respeto de la dignidad humana, de su libertad, responsabilidad y demás derechos fundamentales como ciudadano de un país.
• Una evidencia innovadora. El Proyecto Genoma Humano ha puesto de manifiesto que los genomas de dos personas distintas coinciden en el 99,9% de sus bases. En otras palabras, la variación en el 0,1 % del genoma es lo que diferencia genéticamente a dos personas28. Ergo, queda demostrado que genéticamente los humanos somos más iguales que diferentes, pero lo suficientemente diferentes para ser únicos.
• Un sujeto es un individuo y no un colectivo. El ser humano que participa en una IBB no es sólo una muestra anónima ni una estadística y su comportamiento no depende de los resultados de unos sitios u otros. La variación en las respuestas por ejemplo, a los medicamentos no está limitada a los micropolimorfismos, ya que su cuerpo y sus reacciones dependerán de cuestiones psicológicas y ecosociales antes no consideradas (El ambiente, la dieta, los estilos de vida) pueden afectar la eficacia y seguridad de los tratamientos y medicamentos. Los factores ambientales, tales como la exposición al sol, las interacciones de un fármaco con otras y entre medicamentos y alimentos, también juegan un papel importante en la absorción y metabolización de los medicamentos.
• Secreto profesional. Los riesgos a la invasión de la privacidad médica por la falta de discrecionalidad y divulgación de información de carácter privado. Las nuevas reglamentaciones sobre la privacidad de los datos por parte de médicos e investigadores es cada vez mayor29.
La relación investigador-sujeto de investigación:
• La dimensión humanística del acto médico. Esta dimensión se profundiza especialmente en la experimentación, tiene una especial importancia su dimensión ética, producto de la relación espacio-temporal que se da entre dos seres humanos en la que una de las partes es vulnerable por su condición de salud y ser un sujeto de experimentación que está siendo invadido en su intimidad e individualidad. «En la investigación médica, es deber del médico proteger la vida, la salud, la intimidad y la dignidad del ser humano» (DH, art. 10).
• La relación clínica intersubjetiva y humana. Relación que se establece entre el investigador y el sujeto de investigación no es anónima, independientemente de que lo registre para fines de protección de su identidad y confidencialidad.
• Conditio sui generis. La relación que se establecía tradicionalmente era paternalista o vertical, mientras que a partir de los 70 tiende a ser horizontal, al respetar sus derechos, permitir que tome su decisión personal, una relación que se establece entre sujetos morales que tienen conciencia
y responsabilidad. En cumplimiento del hecho que «La investigación médica está sujeta a normas éticas que sirven para promover el respeto a todos los seres humanos y para proteger su salud y sus derechos individuales. Algunas poblaciones sometidas a la investigación son vulnerables y necesitan protección especial. Se deben reconocer las necesidades particulares de los que tienen desventajas económicas y médicas. También se debe prestar atención especial a los que no pueden otorgar o rechazar el consentimiento por sí mismos, a los que pueden otorgar el consentimiento bajo presión, a los que no se beneficiarán personalmente con la investigación y a los que tienen la investigación combinada con la atención médica» (DH, art.8).
El propósito de la investigación:
• La investigación deberá ser vista desde la búsqueda del mejor bienestar del sujeto de investigación, tal y como versa «En investigación médica en seres humanos, la preocupación por el bienestar de los seres humanos debe tener siempre primacía sobre los intereses de la ciencia y de la sociedad» (DH, art. 5). Por tanto, «El propósito principal de la investigación médica en seres humanos es mejorar los procedimientos preventivos, diagnósticos y terapéuticos, y también comprender la etiología y patogenia de las enfermedades. Incluso, los mejores métodos preventivos, diagnósticos y terapéuticos disponibles deben ponerse a prueba continuamente a través de la investigación para que sean eficaces, efectivos, accesibles y de calidad» (DH, art. 6).
• Lo que se busca de una investigación va más allá de encontrar un conocimiento o mejorar un estado de cosas, incluye la intencionalidad de lo que se piensa hacer con los resultados del proyecto. Se asume que para que se plantee una investigación con seres humanos, sea por alguno de los siguientes motivos:
a. La ampliación del conocimiento científico sobre el ser humano y los medios susceptibles para mejorar su condición de salud y calidad de vida.
b. La presunción de contar con suficientes evidencias clínicas que esté dirigido a mejorar el último estado del conocimiento científico y sobre las bases de una experimentación suficiente, tanto preclínica, de laboratorio o con animales.
c. El riesgo previsible para las personas comprendidas en la investigación, tanto investigados como investigadores, sea proporcionado con el beneficio esperado o con el interés de la investigación.
d. Las condiciones materiales y técnicas en que se desarrollará la investigación sean adecuadas a los imperativos de rigor científico y de seguridad de las personas.
e. La búsqueda de técnicas terapéuticas menos invasivas para las personas a ser tratadas.
f. Los resultados de la investigación sean previsiblemente útiles para los grupos de similares características, edad o enfermedad a que pertenezcan los voluntarios.
g. La investigación no pueda ser realizada por otros medios alternativos.
h. ¿Se tendrá la oportunidad de revitalizar la tecnociencia de ponerla al servicio de las necesidades y expectativas de la humanidad, o se continuará deslizándose por la pendiente del sonambulismo tecnológico?
• El protocolo tiene que ser realizado según ciertas características:
«El proyecto y el método de todo procedimiento experimental en seres humanos debe formularse claramente en un protocolo experimental. Este debe enviarse, para consideración, comentario, consejo, y cuando sea oportuno, aprobación, a un comité de evaluación ética especialmente designado, que debe ser independiente del investigador, del patrocinador o de cualquier otro tipo de influencia indebida. Se sobreentiende que ese comité independiente debe actuar en conformidad con las leyes y reglamentos vigentes en el país donde se realiza la investigación experimental. El comité tiene el derecho de controlar los ensayos en curso. El investigador tiene la obligación de proporcionar información del control al comité, en especial sobre todo incidente adverso grave. El investigador también debe presentar al comité, para que la revise, la información sobre financiamiento, patrocinadores, afiliaciones institucionales, otros posibles conflictos de interés e incentivos para las personas del estudio» (DH, 13).
• Por tanto, las autoridades nacionales en materia de salud deberán aprobar su ejecución bajo la dirección de un médico calificado, quien asumirá la responsabilidad del estudio, previa aprobación de un comité de bioética de investigación. Este comité estará conformado por profesionales de diversas disciplinas afines con la investigación propuesta y que asegure su competencia en los aspectos biomédicos, éticos, sociales, psicológicos y jurídicos de la investigación.
• Los proyectos a gran escala, como los de menor escala tienen que ser formulados con criterios de reciprocidad ética y no desde un punto de vista unilateral o de mezquindad utilitarista. Beneficiándose todos los actores del proceso, así se maximizarían las ventajas de un estudio, sobre todo a la muestra anónima que colaboró con la IBB.
• Se tiene que tener consideración el principio de la equiponderación (equipoise) uno de los principios centrales de la ética de la experimentación en humanos. Introducido para proteger a los pacientes de investigaciones redundantes, en su formulación actual e implica que sólo en presencia de alternativas aparentemente equivalentes, cuando hay incertidumbre sobre el valor de una sobre otra, o cuando la comunidad médica discrepa en la interpretación de la evidencia disponible, se da la situación que, éticamente, justifica un nuevo estudio para decidir la mejor opción médica30 (Freedman, 1987). La equipoise31 (Weijer; Shapiro; Cranley, 2000) debería implicar que los participantes no sufrirán un incremento relativo de daños derivado de la aleatorización a un brazo particular, que los resultados del estudio no pueden ser predichos consistentemente de antemano y que, sobre un conjunto suficiente, el número de ensayos que hayan aceptado o rechazado una hipótesis debe ser similar32 (Fiej; Krishman, 2004).
• Los propósitos de la investigación deberían ser consecuentes con la armonización de expectativas y resultados, de los beneficios alcanzados por los patrocinadores y los aportados a los demás actores del proceso33 (Lezner, 2008). No puede ser visto simplemente como una relación de costo-beneficio. A pesar de que en ciertas ocasiones existen limitaciones, los administradores de la IyD han seguido indicadores cuantitativos para medir sus resultados. Así, se han definido tres grandes grupos de indicadores:
• Número de publicaciones técnicas, patentes, citas a ambos tipos de documentos y otro tipo de elementos tangibles como el número de productos diseñados, tasas de uso de recursos por cantidad de proyectos realizados, etc. o Utilidades, ventas y otros beneficios económicos que se supone emanan de la I&D.
• Una serie de juicios sobre el éxito de proyectos individuales.
El nivel de cuidado con los sujetos de investigación:
• Se parte de que «En la práctica de la medicina y de la investigación médica del presente, la mayoría de los procedimientos preventivos, diagnósticos y terapéuticos implican algunos riesgos y costos» (DH, art. 7).
• En los últimos años se está debatiendo sobre uno de los puntos más cruciales de la ética de la investigación contemporánea: que a priori la inclusión de pacientes en ensayos clínicos controlados y aleatorizados sea justa, es decir que las probabilidades de beneficio y riesgo sean las mismas entre las ramas de tratamiento desde la perspectiva de la comunidad de médicos clínicos (clinical equipoise), o que un paciente en particular sólo se deberá incluir en un protocolo de estas características cuando el clínico responsable tiene una incertidumbre sustancial sobre cual de los tratamientos será el más apropiado para ese paciente en particular (principio de incertidumbre)34 (Weijer; Shapiro; Cranley, 2000).
• La investigación con seres humanos no debe ser excluyente o que se le ocasione daño a unos y a otros no, en una investigación; que el fármaco esté disponible para los que ya no son sujetos de una investigación; que se realicen tratos diferenciales o se establezca el doble estándar a unos sujetos y a otros no, por ser de un país o de una clase social determinada.
• En los países con menos recursos, a veces la atención médica en caso de emergencias no se practica, por no estar prevista en los beneficios de investigación o por no disponer de un sistema de seguridad social adecuado.
• La atención médica de emergencia debe ser realizada en el mismo centro de investigación o un centro asistencial previamente determinado, para que tengan libre acceso y asistencia del investigador principal.
• La práctica inaceptable aún del uso del placebo35, desde mi punto de vista personal con seres humanos, a pesar de los justificativos técnicos que a veces se emiten, sobre todo en las investigaciones que se realizan en ciertos países donde la legislación es más permisiva y se aplica el doble estándar36 (Hawkins, 2006) (Clark, 1988) (Miller; Brody, 2002) con placebo en vez del mejor tratamiento alternativo posible.
Los diversos actores y otras cuestiones éticas:
• Generalmente se establecen como actores los patrocinadores, las instituciones gubernamentales, las agencias internacionales, las universidades, los centros médico asistenciales, los centros de investigación y los sujetos de investigación. No se piensa en todo el entramado institucional que existe para que un proyecto se lleve a cabo37 (Kukla, 2007) (Chiong, 2006) (Miller; Brody, 2002) (London, 2006).
• La distribución no equitativa de los beneficios de las investigaciones. Por ejemplo, en los estudios multicéntricos generalmente no conocen el resultado de las investigaciones hasta que se publican por las transnacionales y producen los nuevos fármacos, siendo injusta la participación de los múltiples centros y de los pacientes que permitieron el avance fármaco-clínico. A su vez, la investigación farmacogenómica es restringida y dirigida a ciertos patrones no estandarizables, si bien genera resultados positivos es restrictiva (ya que se dirige a las personas que pueden pagar por los exámenes).
• El riesgo de discriminación en que se incurre en el manejo de las pruebas genéticas de los seres humanos y eventuales requerimientos que pudieran hacerse por empleadores y empresas de seguro.
• Los múltiples conflictos de interés que surgen entre el sector de IyD, Salud e Industrial38 (Brody; Miller, 2003).
El consentimiento informado:
• Hoy en día, es una exigencia de que toda investigación implique el consentimiento de la persona, de que sus datos e información bioclínica sea empleada en estadísticas y publicaciones científicas, en general. Por ello es imprescindible que todo trabajo que emplee datos de seres humanos, esté avalado por las respectivas aprobaciones para su uso.
• Además, todo sujeto de investigación debe estar adecuadamente informado para que tome una decisión personal. Por tanto, el investigador debería estar pedagógica y didácticamente preparado para tal fin, o disponer de materiales instruccionales pertinentes que le ayuden para tal labor.
• Todo sujeto de investigación debe en forma voluntaria y responsable asumir su papel de sujeto de investigación, y nunca en bajo persuasión, coacción o tomada por terceros.
• Todo consentimiento tiene que ser comprensible en lenguaje, redacción, palabras técnicas y expresiones que se empleen.
• Todo consentimiento informado tiene límites o restricciones, teniendo que ser bien especificados antes de su firma.
Los datos e información:
• La información a ser obtenida y procesada, debería hacerse de forma correcta y legal, con su respectivo consentimiento y mantenerse sólo para las finalidades legales que se solicitan.
• El uso inadecuado y revelación de la información por parte de cualquier persona por la que el expediente pueda circular, atenta contra la confidencialidad de la información y el debido secreto profesional.
• Dicha información no podrá ser suministrada a ninguna entidad gubernamental o laboral o de empresa de seguros que la exijan en forma personalizada. Es más, sólo las partes autorizadas la podrán emplear y para los fines que fue descrito y aceptado por las partes.
• El consentimiento informado debe realizarse en forma adecuada, sin olvidar que su finalidad última que es hacer copartícipe al paciente en las decisiones y responsabilidades que le afectan, y no la de evitar convertirlo en una herramienta para el impulso de una medicina defensiva que disminuya la responsabilidad del profesional al indicar o al actuar.
• Los datos y la información deberá almacenarse adecuada y en sitio seguro, previendo su conservación y evitando que otros individuos tengan acceso a la información y puedan extraerla, corregirla o borrarla.
• Muestras biológicas y biodatos no podrán ser trasladados a ningún otro país o empresa privada. Salvo en ciertas circunstancias en las que exista un contrato que beneficie y sancione a las partes por incumplimiento a nivel internacional.
• Aparte de contener información sobre la enfermedad de un paciente, el registro médico puede tener otros usos, para39:
• El paciente: informar acerca de cómo debe proceder en su cuidado y probar que ha estado enfermo, ya sea para ser reembolsado por un seguro médico o para tomar una acción legal.
• El profesional de la salud: asegurar la calidad del trabajo realizado, probar lo que se ha hecho en el caso de tener que defenderse legalmente, que pueda ser estudiado con propósitos educacionales y traspasar la información a otro centro de salud.
• La investigación: la realización de estudios comparativos de desarrollo del conocimiento y la práctica de intervenciones efectivas en el cuidado del paciente.
• Las instituciones, directores y administrativos: sirve para obtener datos económicos, prueba de lo realizado cuando hay una evaluación externa, análisis de riesgos, propósitos médico legales, para acreditación, para tomar decisiones y planificar, y para programas educacionales.
• La comunidad: propósitos estadísticos, medicina preventiva, salud pública.
Las investigaciones personalizadas y estandarizadas:
• Las tendencias mundiales tienden a individualizar las investigaciones con seres humanos, p.ej., a nivel de farmaco-genómica, las microdosis o medicamentos personalizados, pero industrialmente, esta diversidad de eventuales productos no es viable, por lo que producen medicinas unidosis, pero bien es conocido hoy que las dosis para que sean seguras y efectivas deberán ser determinadas por la edad, el tamaño, el peso y otros factores clínicos de la persona.
• A lo anterior se incorpora el acceso al medicamento por dificultades de distribución y de adquisición.
Las alertas de investigación:
• Las reacciones adversas pueden ser evitadas con adecuadas pruebas previas, conocimiento de medicamentos que regularmente consume, dietas y hábitos de vida de los sujetos de investigación antes de administrarles ciertos medicamentos. En la actualidad se comienzan a realizar con base en ciertas presunciones de riesgo, pero deberá preverse no en forma genérica sino considerando la variabilidad de reacciones ante ciertas moléculas o productos farmacológicos. Por ejemplo, las reacciones adversas a los medicamentos han ocasionado cientos de miles de muertes anuales en pacientes hospitalizados presumiblemente debido a variantes genéticas, pudiendo haberse evitado dichas muertes haciendo pruebas de respuestas adversas a estas drogas antes de ser administradas40.
La tolerancia de dos mundos inconexos y controversiales:
• Si bien en el mundo actual donde se enfatizan los derechos fundamentales de la persona, aún estos no son comprendidos, por la creciente individualización y afán de poder. Mucho puede hablarse de dignidad, de libertad, de derechos, todo queda más en letra muerta en un papel que una necesidad humana.
• Las IBB generan de por sí dos "mundos" que se interconectan de cierta manera, el de la comunidad científica (investigadores) que conforman el mundo práctico de empiria y los sujetos de investigación, los que son considerados vulnerables profanos. Dos mundos que tienen que vincularse para la realización de su trabajo y la obtención de resultados. Esta diferenciación genera situaciones éticas.
• Es importante acotar que en materia bioética se hacen los mayores esfuerzos por anticipar y resolver problemas que ocurrirían con las IBB, pero ello dependerá del estado de conocimientos que se tengan para un momento determinado, ya que pueden sucederse situaciones inesperadas y tendrán que ser abordadas inmediatamente entre los diversos actores de la investigación con seres humanos, sobre todo, por aquellos que ejercen una función contralora.
• Una investigación sin principios y valores deja de ser una investigación para constituirse en una mera forma de lograr la mezquindad del acaparar riqueza, consecuentemente el poder y las consecuencias del éxito.
HACIA UNA VISUALIZACIÓN DEL PROCESO HOLÍSTICO
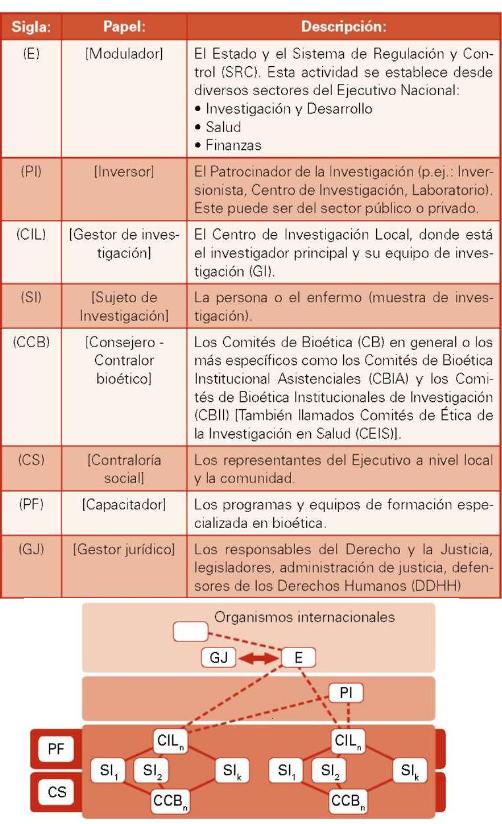
Los actores que intervienen en el SRC son diversos y adoptan papeles diferentes según su función. En primera instancia, está el Estado y el Patrocinador (Centro de Investigación, Industria Farmacéutica). Debido a que ambos son los que tienen el potencial de modular y financiar proyectos en gran escala. En proyectos de menor escala pueden tener diversos patrocinadores. En segunda instancia, están los ejecutadores directos: el centro de investigación, educación o médico-asistencial; el equipo de investigación; los pacientes o sujetos de investigación; y el comité de bioética local. En tercera instancia, están las diversas instituciones alternas: centros de capacitación, legisladores y administradores de justicia, responsables del aseguramiento de las personas, empresas de seguros, proveedores diversos, prestadores de servicios, control de divisas y demás contralores.
La relación de los actores es difícil de representar, ya que se entrecruzan ciertas funciones. Pero en una primera instancia podría ser esquematizada como una serie de planos superpuestos (5 escenarios diferenciados: El de las políticas y regulación social y técnica; el del promotor, sobre todo si es una multinacional; la de los diferentes centros de investigación y sus poblaciones; las de capacitación social y las de los comités de bioética) y que se cruzan por ciertas funciones, tal y como se ilustra en la figura n°2.
Figura n° 2: Relación y escenarios de los diversos actores.
En la actualidad en el país, existe el Reglamento de Investigación en Farmacología Clínica (versión actualizada 2004), desarrollada por el INH, el cual a pesar de los avances internacionales y locales en materia de participación social, no contempla en sus artículos lo referido a la inclusión de grupos de pacientes como protagonistas en la escogencia indirecta de los estudios a realizar en Venezuela. Así mismo la ausencia de promoción de espacios para la participación ciudadana en la obtención de información de protocolos, carencia de regulaciones para los comités de ética, y en la capacitación de los mismos; trayendo por consiguiente fallas importantes en la conducción de protocolos de investigación adaptados a la realidad nacional.
En la Constitución de la República Bolivariana de Venezuela (CRBV, 1999) se establece la participación social como una responsabilidad política del ciudadano:
«La participación del pueblo en la formación, ejecución y control de la gestión pública es el medio necesario para lograr el protagonismo que garantice su completo desarrollo, tanto individual como colectivo. Es obligación del Estado y deber de la sociedad facilitar la generación de las condiciones más favorables para su práctica» (CRBV, 1999: a.62).
A nivel de las comunidades se definen los medios de dicha participación:
«Son medios de participación y protagonismo del pueblo en ejercicio de su soberanía, en lo político: la elección de cargos públicos, el referendo, la consulta popular, la revocatoria del mandato, las iniciativas legislativa, constitucional y constituyente, el cabildo abierto y la asamblea de ciudadanos y ciudadanas cuyas decisiones serán de carácter vinculante, entre otros; y en lo social y económico, las instancias de atención ciudadana, la autogestión, la cogestión, las cooperativas en todas sus formas incluyendo las de carácter financiero, las cajas de ahorro, la empresa comunitaria y demás formas asociativas guiadas por los valores de la mutua cooperación y la solidaridad» (CRBV, 1999: a.70). Específicamente en el sector salud, la Ley Orgánica de Salud (LOS, 1998) expresa:
«Principio de Participación: Los ciudadanos individualmente o en sus organizaciones comunitarias deben preservar su salud, participar en la programación de los servicios de promoción y saneamiento ambiental y en la gestión y financiamiento de los establecimientos de salud a través de aportes voluntarios (LOS, a.3). Al cual se le incluyó otro principio: Principio de Calidad: En los establecimientos de atención médica se desarrollarán mecanismos de control para garantizar a los usuarios la calidad en la prestación de los servicios, la cual deberá observar criterios de integridad, personalización, continuidad, suficiencia, oportunidad y adecuación a las normas, procedimientos administrativos y prácticas profesionales» (LOS, a.3).
Estos principios entre otros señalados en el mismo artículo, ya venían siendo implantados y surgieron de la experiencia que se realizaron en ciertos centros pilotos, donde conjuntamente con la OPS/ OMS (1990-1998), se modelaba sistemas de Atención Primaria de Salud (APS) empleando principios y métodos acordes con la idiosincrasia regional (Kroeger y Luna, 1987). De estas experiencias se publica la Gerencia Participativa: un caso exitoso en el sector salud (Palumbo, 1991), el Proyecto Municipios hacia una salud: La experiencia venezolana (1996) y 20 experiencias exitosas en la Gestión en Salud Pública (Zárraga y Schmidt, 2001).
A nivel de las gobernaciones se estableció un Registro Nacional de Salud, el cual lamentablemente no se llegó a implantar:
«El Ministerio de la Salud por medio del Reglamento de esta Ley establecerá la obligación de los gobernadores y alcaldes de desarrollar el sistema de información del Registro Nacional de Salud, a fin de conocer las condiciones de salud de la población, propiciar la participación ciudadana y orientar los programas de promoción y conservación de la salud» (LOS, 1998: a.26).
La Ley Orgánica de Ciencia, Tecnología e Innovación (LOCTI 2005), promulgada en el 2001, introduce a los Comités de Bioética en la investigación (aa. 6, 7 y 8). Buscando que las actividades de Ciencia y Tecnología se difundan en todos los estratos de la sociedad (a. 16): Adicionalmente, el desarrollo de las leyes en Venezuela en las últimas dos décadas se ha dirigido a fortalecer el empoderamiento del ciudadano y la comunidad como fuerza gestora de las necesidades entre el pueblo y el Estado, en la Ley de Consejos Comunales (LCC, 2006).
Entendiendo la ausencia de conexión entre los instrumentos legales vigentes, y por lo antes expuesto se ha considerado plantear un plan de revisión y mejoramiento de la normativa actualmente vigente en investigación clínica, que se fundamente en las bases de un sistema participativo, incluyente y sustentado en la realidad venezolana en pro de la consolidación de una política de investigación clínica realista, contemporánea ajustada a un contexto nacional e internacional. Por tanto, lo social estará referido a la necesaria garantía de "escucha" y "participación" de las necesidades de los individuos, las comunidades y la sociedad en general, en lo concerniente a la definición de políticas sectoriales. Teniendo esto en cuenta, dichas políticas serán formuladas a nivel del ejecutivo por los especialistas y responsables de los servicios y programas de salud, y posteriormente se presentan para su consenso a la comunidad; Obviamente, estableciéndose los mecanismos de supervisión y control requeridos para su adecuada ejecución41 (Schmidt, 2008).
El proyecto presentado se centra en la persona humana y su dignidad (bienser), en el bienestar que se ofrecerá a los hombres y mujeres de una comunidad (por una atención digna y no como una mera cobertura prevista de servicio) por el bien-hacer del personal de salud, recursos y estructuras previstas con el propósito de minimizar inequidades de atención, de aumentar la accesibilidad a los servicios y la equidad de sus beneficios, de propiciar la eficiencia de su gestión y la efectividad de su servicio, para la satisfacción de las necesidades de salud de dicha población; además de humanizar la investigación clínica minimizando la utilización del hombre por el hombre en donde nuestros ciudadanos constituyan una "muestra" importante para protocolos de investigación que no les garanticen su posterior acceso a las drogas a las cuales son expuestos y que muchas veces constituyen la única opción para la patología que padecen.
OTRA VISUALIZACIÓN
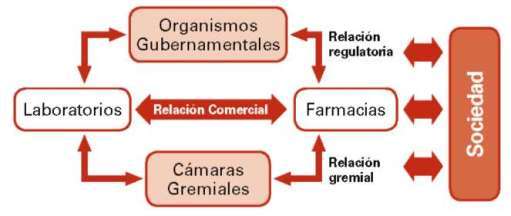
Otra forma de visualizar el proceso, por ejemplo en la investigación clínica donde el patrocinador es un Laboratorio Farmacológico sea nacional o internacional, conlleva una relación de regulación y control previa (p.ej., disponer de los medicamentos, procedimientos de adquisición, convenios asistenciales para diagnósticos y atención de emergencia médica) por parte del Estado en protección de sus ciudadanos, las cámaras gremiales que gestionan la calidad del servicio que prestan sus agremiados: industria, distribución y comercialización. De manera análoga si se refiere a centros médico-asistenciales o centros de investigación privados.
Figura nº 3: Relación de procesos entre los Laboratorios y la comunidad (sociedad).
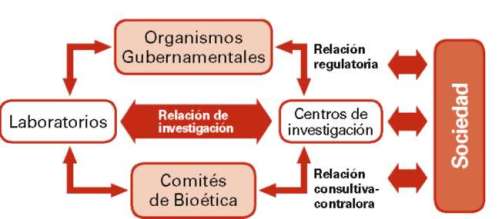
Esta relación cambia en el momento de la investigación, donde el comité de bioética asume su papel de ente consultivo y contralor social del proceso. El ex ante, en el-curso y el ex post debe ser evaluado cuidadosamente, garantizando la idoneidad de los participantes (investigadores-sujetos de investigación-centro de investigación), la seguridad y efectividad de los procedimientos y productos a ser empleados.
EL SISTEMA DE REGULACIÓN Y CONTROL DE LA INVESTIGACIÓN
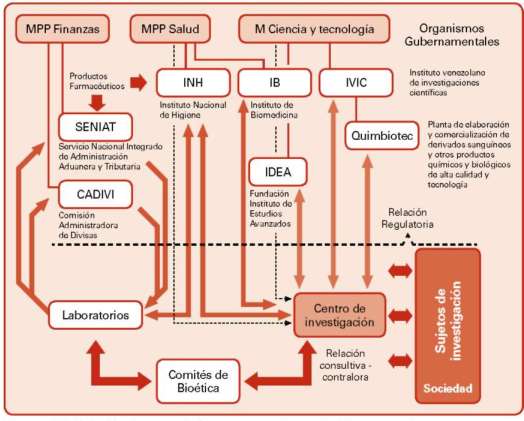
Figura n°4: Relación de procesos entre los Laboratorios y los sujetos de investigación.
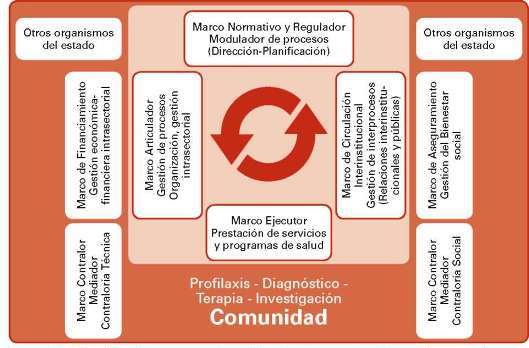
El sector salud está sometido a vertiginosos cambios en materia de descubrimientos e innovaciones biomédicas y biotecnológicas, producto de una demanda de atención cada vez más exigente y corresponsable, una economía inflacionaria y compleja para la asignación de la financiación (y aseguramiento), una presión constante ante el rigor de las políticas gubernamentales y de la contraloría social, una tendencia reorganizativa de las estructuras asistenciales y la gerencia efectiva de los servicios de salud. Por eso, no es la mera consecución de un estudio de factibilidad técnico y económico, ni siquiera la disponibilidad de todos los recursos financieros, sino sus operadores y usuarios, el impacto que dicha prestación de salud ofrezca en su área de influencia, del modelaje a ser replicado en otras instancias, por considerar al ser humano como eje del proceso de salud-enfermedad-atención y que espera alcanzar las mejores condiciones de salud posibles para su autorrealización y el logro de una mayor calidad de vida. El mejoramiento propuesto constituye un proceso orientado a introducir cambios constructivos sustantivos en las diferentes instancias del sector que permitan gestionar los programas y proyectos (prevención, prestación de servicios e investigación) en salud. El éxito de una reforma sectorial en salud, parte de la redefinición de las políticas públicas, la transformación organizativa-institucional y la mejora en los servicios de salud.
El sistema de salud de cualquier país es un sistema complejo que comprende diversos procesos (tal y como se ilustran pero no serán desarrollados en el presente trabajo)42 (Schmidt, 2007). Este proceso debe ser en parte antropoético, centrado en la persona humana (no solo como paciente y nunca como cliente) y su dignidad (bienser), en el bienestar que se ofrecerá a los hombres y mujeres de una comunidad (por una atención digna y no como una mera cobertura prevista de servicio) por el bien-hacer del personal de salud, recursos y estructuras previstas con el propósito de minimizar iniquidades de atención, de aumentar la accesibilidad a los servicios y la equidad de sus beneficios, de propiciar la eficiencia de su gestión y la efectividad de su servicio, para la satisfacción de las necesidades de salud de dicha población.
El SRC se propone que debería estar centrado en primer lugar, en que toda IBB tiene que estar dirigida en beneficio de la humanidad y de la vida. En segundo lugar, ser realizada bajo protocolos técnicos y éticos. En este sentido, éstos deberían ser analizados e interpretados en forma holística, desde el punto de vista científico, bioético, sociocultural e individual. De esta manera, el SRC deberá tener como propósito el contribuir en forma apta, adecuada y oportuna a la efectividad y calidad de las investigaciones, resultados e impacto social. Para ello deberá supervisar a través de los equipos de investigación, comités de bioética (locales, regionales) y denuncias de personas toda sospecha denunciada de potenciales riesgos y daños causados a sujetos de investigación, en forma semejante a la responsabilidad posterior comercialización de los medicamentos que realiza el sistema de farmacovigilancia, p.ej.: de recolectar, procesar y analizar sistemáticamente los datos recibidos en las diferentes etapas de investigación de un fármaco, documentar y evaluar la relación beneficio-riesgo asociada al uso de los medicamentos o procedimientos empleados a la comunidad científica involucrada en la investigación; y así, tomar decisiones destinadas a la preservación de la salud de los sujetos de investigación.
Figura nº 5: Relación de los procesos de gestión del sistema nacional de salud en un país
En la actualidad las observaciones éticas se otorgan por dilemas con la dignidad y la libertad de la persona, la verdad, profesionalidad y conflictos de interés que se generan en IBB en farmacogenómica e investigación con muestras biológicas, en particular en poblaciones vulnerables, así como también a los problemas éticos emergentes de la alta tecnología biomédica: células toncales, investigación con embriones humanos y otros temas de investigación genética.
Además y como plantea Fernando Lolas43 (Lolas; Quezada, 2003): Como proceso social tiene una dimensión cultural que impone mantenerla y financiarla. En sociedades donde no hay investigación "de frontera", realizarla se justifica por su valor cultural y su impacto en la formación de profesionales idóneos. Independientemente del lugar del mundo donde se encuentren, los profesionales deben saber apreciar los resultados de las disciplinas científicas y seguir su desarrollo.
En todo proyecto cabe discernir méritos44 (Lolas, 1994). El primero es el técnico. Puede ser juzgado sólo por los pares en la disciplina. Un estudio está bien o mal planteado, usa o no métodos adecuados, se inserta o no en una tradición legítima de pesquisa. Si una propuesta falla en este aspecto, ya es inmoral proseguirla o apoyarla. Lo ético se manifiesta primero en lo técnico, como ya dice la tradición hipocrática, que recuerda que no se puede ser un médico bueno (o moral) si antes no se es buen médico (o buen técnico).
El segundo mérito es científico. La capacidad de fertilizar disciplinas, ampliar el horizonte de los expertos y de quienes no lo son, de inducir a la reflexión puede ser un producto fundamental de investigaciones cuyos productos no cumplen las expectativas de sus proponentes pero perfeccionan la comunidad científica y el estado del arte.
El tercer mérito, en otros sitios llamado social, se refiere a la legitimidad con que se conduce el proyecto, los efectos saludables que tiene su realización, la justicia que promueve el cultivo de las ciencias y la satisfacción que induce al lograr y perfeccionar metas comunitarias deseables. Este es el imperativo ético a que hacen alusión los textos y normas que regulan la investigación médica.
LOS PATROCINADORES Y CENTROS DE INVESTIGACIÓN
Éstos deberán cumplir con la entrega de un protocolo de investigación que contenga:
1. Una descripción que detalle los antecedentes, resultados y justificación de la investigación.
2. Una exposición de los objetivos con respecto al estado presente de los conocimientos y las razones justificantes que la investigación se realice en seres humanos.
3. Una descripción pormenorizada de todas las intervenciones propuestas y la duración prevista de la investigación.
4. Un plan estadístico que indique el número de personas que se pretende seleccionar y los criterios para concretar el experimento.
5. Las pautas que determinan la admisión y el retiro de las personas sujetas a investigación, con los detalles relativos al consentimiento informado.
6. Valoración detallada de los riesgos previsibles para el participante frente a los beneficios esperados.
7. Detalle de los antecedentes científicos del ente investigador y sus integrantes individuales acordes con la investigación propuesta.
8. Documentación que acredite que el ente investigador cuenta con los recursos humanos, técnicos y económicos para garantizar el bienestar de los participantes en la investigación.
9. La garantía de que se resguardará la identidad de las personas participantes en la investigación, los que sólo podrán ser identificados con su consentimiento expreso.
Obviamente, en todo momento, se deberá asegurar los principios éticos y jurídicos que garanticen la protección a
los sujetos de investigación, así como los relativos al ejercicio profesional de independencia, integralidad, responsabilidad y confidencialidad. Por tal motivo, se considera importante el consentimiento informado, lo cual deberá cumplir con las exigencias aceptadas internacionalmente. Por tanto, no podrán someterse a investigaciones:
• Mujeres embarazadas o que estén amamantando a sus hijos, excepto que dichas investigaciones sean útiles para el conocimiento de fenómenos ligados al embarazo o lactancia, respectivamente, y carezcan de riesgos previsibles para la madre y el hijo. Menores de edad y según la Ley Orgánica para la protección del Niño y del Adolescente45 (LOPNA, 1998).
• En caso de beneficio individual directo para ellos el consentimiento deberá ser otorgado por sus padres, o por su tutor con autorización del juez competente.
• Los enfermos y los discapacitados mentales, excepto cuando la investigación sea especifica para la dolencia del caso. El consentimiento será brindado por el curador con autorización del juez competente.
• En los casos de personas que no sean aptos para expresar su voluntad se requerirá también el asentimiento del mismo y su negativa revocará el consentimiento dado por su representante legal.
PAPEL DE LOS COMITÉS DE ÉTICA DE INVESTIGACIÓN LOCALES
Los Comités de Ética de Investigación locales pueden tener un papel fundamental para cautelar que se resguarden los principios éticos ya mencionados. Sdemás de evaluar que el proceso de obtención del consentimiento informado esté en consonancia con los valores y creencias de la comunidad donde se realizará el proyecto, deberán determinar si existe beneficio para la comunidad, velando, además, por que los miembros de la comunidad participen en el diseño de la investigación. En este sentido, los comités de ética locales cumplen un papel primordial para evaluar las reales necesidades de la comunidad.
En países en vías de desarrollo, sin embargo, es frecuente que no existan estos comités o, de haberlos, suelen ser ineficaces o no cuentan con recursos humanos con la debida preparación. Un aspecto interesante de discutir es si debe existir duplicidad de los comités de ética, que funcionen tanto a nivel local como en el país de origen del patrocinante. Por lo mencionado anteriormente, se desprende que ambos son insustituibles y cumplen funciones que son complementarias. Puesto que es probable que un mismo protocolo sea realizado en distintos sitios, sería conveniente que los respectivos comités de ética se relacionen entre sí de tal modo, para lograr relativa consistencia en las decisiones que se tomen y, de paso, esto permitiría asegurar que las cargas y beneficios ofrecidos a los participantes sean equitativos.
CONCLUSIONES Y RECOMENDACIONES
Como cierre del artículo se expresa la necesidad de un SRC-IBB en Venezuela (o en todo país) como un mecanismo modulador-contralor de la gestión de investigación con seres humanos, de forma que se garantice la efectividad y la calidad de los estudios, la protección de los más vulnerados al minimizarle los efectos adversos e iniquidades que se pueden incurrir en las investigaciones, maximizando la eticidad de la investigación, lo que redundará en el mejoramiento de la salud nacional.
Llama la atención el hecho de que los inconvenientes detectados han sido más motivados a gerencia ya sea del Director de Investigaciones de la Industria Farmacéutica o en la escogencia del personal del equipo de investigación. Pocas han sido las desatenciones a los sujetos de investigación, pero las ha habido y tienen que evitarse.
Un detalle importante y que reduciría los casos adversos, es la más completa evaluación de los candidatos a ser sujetos de investigación y sus revisiones periódicas.
Figura nº 6: Relación de parte de los procesos de regulación y control entre los Laboratorios y los sujetos de investigación en Venezuela.
El Estado a través de los Ministerios de los sectores de Ciencia y Tecnología y de Salud debería:
• Establecer un inventario específico de IBB con seres humanos, no sólo de sus investigadores asociados, sino de todos los que se realizan a nivel nacional.
• Constituir un Centro Nacional de Enfermedades, para que conjuntamente con el INHRR, regulen y planifiquen las necesidades de IBB en Venezuela.
• Promover la puesta en marcha de la Comisión Nacional de Bioética y de Comisiones Regionales de Bioética, con profesionales independientes, multidisciplinarios y formados en Bioética.
• Actualizar el sistema de fármacoseguridad y estar vinculado a los sistemas internacionales.
• Fomentar las reuniones científicas en que se presenten los avances científicos y tecnológicos de las IBB, además de las experiencias locales que se realizan a través de la Asociación Venezolana para el Avance de la Ciencia (ASOVAC)
• Crear un fondo especial para la contraloría del SRC-IBB/social, de manera de garantizar una subvención a los miembros de los CB y personas de las comunidades indígenas y marginales que participen, que compense el tiempo dedicado y los costos incurridos en la formación, supervisión y evaluación de las IBB asignadas.
• Promover una ley de investigación con seres humanos y un reglamento para dicha ley que incluya el SRC-IBB.
El Ministerio de Salud con el apoyo de la OPS/OMS, debería:
• Participar más activamente como "Estado Miembro" en la Plataforma de Registro Internacional de Ensayos Clínicos.
• Participar en el Comité Asesor de Investigaciones en Salud (CAIS).
• Participar en el CIOMS, para la elaboración de Normas Internacionales para las IBB más acordes con nuestros contextos tropicales.
• Participar e integrar nacionalmente a diversos profesionales a la EVidence-Informed Policy Network (EVIPNet) para las Américas a fin de promover la adopción de mejores decisiones en asuntos importantes para la salud, se necesita un esfuerzo colectivo de muchos países con el propósito de mejorar la producción y el uso de la evidencia científica emanados de la investigación. El Estado a través de los diversos CB debería:
• Consolidar una Red Nacional de Bioética, con los representantes de los diversos Comités de Bioéticas Locales.
• Promover la Comisión Nacional de Bioética y las Comisiones Regionales de Bioética, como organismos de consultores técnicos y éticos de las investigaciones con seres humanos; de igual manera, registro y control nacional y regional, respectivamente de las diversas IBB.
• Mantenerse prestos a toda alerta de farmacovigilancia que se dé a nivel mundial.
Los Patrocinadores e Inversionistas de las Investigaciones deberían:
• Diseñar proyectos más acordes con los diversos contextos de las poblaciones de investigación, con objetivos y métodos de investigación acordes con los contextos de experimentación. Especificando además la duración, puntos de control, beneficios, riesgos, procedimientos, confidencialidad, proporción de servicios médicos.
• Diseñar un protocolo principal y eventuales tratamientos alternativos a ser explicados antes de la toma de decisión y firma del consentimiento informado.
• Elaborar materiales instruccionales en diversos idiomas con la pedagogía y didáctica necesaria para que toda persona que los lea, pueda informarse y tomar decisiones adecuadas a sus necesidades.
• Ofrecer una serie de beneficios de prestación de asistencia médica efectiva y justa. Incluyendo el tratamiento gratuito por complicaciones de la investigación; indemnizaciones por causa de daño, discapacidad o muerte.
• Diseñar consentimientos informados claros, precisos, explicitando diversas alternativas, posibilidad de retractarse en cualquier momento sin sanciones ni pérdida de beneficios, seguros e indemnizaciones.
• No obstante, el tema de los cuidados al término del estudio sigue siendo controversial. Esta declaración no define cómo se logrará este requerimiento. Por ejemplo, uno puede preguntarse si esta obligación, eventualmente de por vida, incluye o no la necesidad de proveer de los nuevos tratamientos que a lo largo de los años demuestren ser útiles, aun cuando no sean producidos por el patrocinante del estudio. Otras normas han señalado que sólo se debe entregar tratamiento de por vida si este no es proporcionado por el sistema habitual de salud46. Un ejemplo de las obligaciones de los patrocinantes del estudio al término de este se ilustran con los ensayos de vacuna en contra de
VIH realizados en Sudáfrica. Estos protocolos señalan que, al término del protocolo, aquellos participantes que se infectaron con VIH durante la realización del estudio deben obtener terapia antirretroviral, en la medida que médicamente se requiera, con cargo al patrocinante. Para fines prácticos, lo que se ha hecho es tener un fondo, financiado por las empresas, pero administrado por los servicios de salud locales, para proveer de los tratamientos necesarios. En Brasil, al término del protocolo con un determinado antirretroviral, se logró que al cabo de un tiempo el Estado adquiriera en condiciones ventajosas el medicamento demostrado como eficaz luego de terminado el estudio47
• Un marco de referencia general para la investigación multinacional debe minimizar las posibilidades de explotación, la que se produce cuando existe asimetría en la distribución de los beneficios y o de las cargas que soportan los sujetos que participan de la investigación48 (Emanuel; Wendler; Killen; Grady, 2004).
• Aparece como un aspecto crucial para lograr una efectiva colaboración que el diseño de la investigación contemple que los participantes y la comunidad tengan acceso a los beneficios, tanto médicos como económicos, que resultarán de la investigación.
Los Centros de Investigación y los Comités de Bioética deberían velar por el cumplimiento de una investigación técnica y éticamente adecuadas:
• Considerar en cuanto a la calidad y pedagogía de la comunicación médico-paciente:
- La información debe estar escrita para el sujeto de investigación y en el idioma que ellos comprendan.
- La información debe ser comprensible al participante y asegurarse que este la ha comprendido adecuadamente.
- Las personas y comunidades se les debe comunicar sobre el muestreo a las poblaciones muestreadas.
- Antes de que una población convenga en participar en el Proyecto, deberá recibir toda esta información a través de los métodos y autoridades que considere adecuados, y deberá tener además una oportunidad real de hacer preguntas y obtener información adicional. Los individuos, antes de decidirse a participar, deberán tener la misma información y oportunidad de hacer preguntas.
- Se recomienda cursos de nivelación y actualización para los comités de bioética.
- Se recomienda el establecimiento de controles que explique el procedimiento de lo que se hará con sus muestras.
• La hoja de información impresa debe incluir:
- Protocolo pedagógico: El contenido de los puntos principales del protocolo, simplificados para el paciente y a la población para que pueda entenderlo.
- Invitación: Se debe explicar al paciente la ventaja de participar e intervenir en forma voluntaria en la investigación. Los objetivos y métodos.
• La naturaleza de los procedimientos/tratamientos empleados: Tratamientos propuestos (y placebo si lo hubiera), la duración prevista de la participación; los objetivos a alcanzar con la investigación y los beneficios que pueden preverse a favor del participante y de la sociedad.
• Uso de las muestras: Se debe indicar a donde se llevarán las muestras, lugar donde se las almacenará, analizará y compartirá con otros investigadores (nacionales o del mundo, si ello se acepta). Como parte de esta última información, los investigadores deberán aclarar que las muestras pueden utilizarse para una variedad de proyectos diferentes en el futuro, incluidos proyectos no anticipados actualmente, cuándo serán destruidas.
• Posibles situaciones: La naturaleza y tipo de riesgos, molestias o eventos adversos previsibles que puedan afectar a la persona, asociados con su participación en la investigación.
• Alternativas terapéuticas: Todo otro procedimiento o tratamiento que pudiese ser tan ventajoso para el participante como el procedimiento o tratamiento que se somete a prueba.
• Riesgos y beneficios de la no participación en el estudio: Explicación de los beneficios de su participación y eventuales situaciones en caso contrario.
• Confidencialidad: La medida en que se mantendrá la confidencialidad de los archivos en los que se identifique al participante.
• Límites de la responsabilidad profesional: El grado de responsabilidad que pueda caberle al investigador en cuanto a proporcionar atención médica al participante.
• Reacciones adversas: Se ofrecerá asistencia y terapia gratuita en caso de lesiones de tipo específico relacionadas con la investigación.
• Indemnización: Si se subsanará al participante o a su familia o a personas dependientes del mismo en caso de invalidez o muerte como resultado de dichas lesiones
• Negación a participar en la investigación: Que la persona es libre de negarse a participar y tendrá la libertad de retirarse de la investigación en cualquier momento, sin sanción o pérdida de beneficios a los cuales en otras circunstancias tendría derecho.
• Medicamento: Si tendrá acceso al producto que se prueba desde la finalización de su participación en la investigación, hasta la aprobación del mismo para su distribución general, y si le será entregado gratuitamente o tendrá que pagar por él.
• En caso de emergencia: Nombre de los investigadores responsables, con un teléfono y lugar donde ubicarlos. (Se recomienda incluir el de un miembro del Comité de Bioética).
Venezuela requiere de una Ley de Investigación Biomédica y Biotecnológica, una ley que respete idiosincrasia del venezolano, su cultura y creencias propias, una ley que mejore la calidad y la expectativa de vida de los venezolanos y por ende, del mundo. La realidad nacional no coincide con las realidades de otras latitudes, aunque por ser una "aldea global" se deben tomar ciertas medidas de protección epidemiológica, mejorar los sistemas de bioseguridad, desarrollar tecnología propia, promover la fabricación de medicamentos genéricos con garantizada biocompatibilidad, desarrollar vacunas, mantener sus bancos de sangre y hemoderivados, equipos e instrumentos, e ir mejorando sus protocolos de diagnóstico y terapéutica.
Las experiencias de otros países demuestran que no es necesario ser llamado un país progresista por hacer cualquier tipo de investigación, sobre todo, aquello que atenta contra la ética científica y social: las investigaciones con embriones humanos o la clonación humana. Pero sería mejor enfocarla al mejoramiento de los indicadores de mayor morbilidad nacional, la erradicación de las enfermedades emergentes y reemergentes, las vacunas de mayor uso en el país, el desarrollo de un sistema geográfico epidemiológico y de enfermedades.
Las buenas prácticas de investigación en Venezuela, a lo largo de la historia han evitado ese "sonambulismo" ético que algunos pseudos-investigadores deambulan y pretenden para hacerse famosos haciendo lo que otros no hacen por creerse semidioses y por manipular la naturaleza en beneficio personal sin mirar sus consecuencias. Independientemente que el cumplimiento de todas las políticas y normas aún es una utopía en la actualidad, hay un mínimo que garantiza la eticidad de las investigaciones.
El SRC constituiría una magnífica manera de mejorar la percepción pública nacional en materia de investigaciones con seres humanos, de romper con el mito de Frankestein que aún subsiste en la sociedad por querer hacer seres humanos clonados, fabricar seres humanos híbridos, fabricar cyborgs o hacer realidad las antiutopías de "un mundo feliz".
NOTAS
1 Junta Revisora de Productos Farmacéuticos. Reglamento de Investigación en farmacología Clínica. Version actualizada en Septiembre 2.004. Instituto Nacional de Higiene Rafael Rangel. Caracas.
2 Comprime las tesis escritas en mi articulo SCHMIDT, L. (2007): La Dignidad Humana como fundamento de la Biopolítica y el Derecho. Cap. 13: Consentimiento ciudadano. Mimeo a ser publicado.
3 HABERMAS, J. Soberanía popular como procedimiento. Conferencia dictada en México en el Simposio que se realizó con motivo de su visita en 1989, p.21.
4 Ampliación de lo escrito en el texto: La dialéctica del amo y el esclavo. En HEGEL, W.F.G. La Fenomenología del espíritu. México: FCE, 1960.
5 Oponerse al subjetivismo no implica mantener que, por medio de una facultad especial, o de algún principio racional, o «racionalmente irresistible», hay una, y sólo una, solución posible para todo problema y todo conflicto de índole morales; equivale sólo a admitir que por medio de razonamientos aplicables a situaciones reales, o a posibles situaciones reales, cabe llegar a cierto consenso, siempre en peligro de verse minado, pero siempre dispuesto a escrutar, y reescrutar, las razones y los hechos que se aducen para llegar a él. Ocurre, pues, con todo juicio o norma morales lo que sucede con todo sistema de preferencias del que, en último término, dependen tales juicios y normas. El sistema es debatible, pero no arbitrario o «subjetivo», sea subjetivo-individual o «subjetivo-colectivo». No sólo cabe aducir razones para adoptar el sistema, sino también para sentar los criterios en virtud de los cuales se propone.
6 Confróntese LONDOÑO, J.L. y FRENK, J. Pluralismo estructurador: Hacia un modelo innovador para la Reforma de los Sistemas de Salud en América Latina. Washinton; BID, Doc. Trab. N° 353 1997.
7 http://www.asph.org/UserFiles/Module1.pdf
8 Ampliación en BERNARD, C. Introduction a Létude de la Medicine Expérimentale. JB Bailliére et fils, Paris, 1865. La cita en el texto corresponde a la versión española: Introducción al estudio de la medicina experimental, Buenos Aires, El Ateneo, 1959.; Normandin S.(2007): Claude Bernard and an introduction to the study of experimental medicine: "physical vitalism," dialectic, and epistemology. En J Hist Med Allied Sci. 2007 Oct;62(4):495-528. Epub 2007 Jun 18.
9 Cit. GARRAFA, V.; LORENZO,C. (2007): Ética e investigación clínica en los países en desarrollo: Aspectos conceptuales, técnicos y sociales. Materiales del Programa de Educación Permanente a Distancia. Red Bioética-UNESCO.
10 De los diferentes estudios, les recomiendo la lectura del caso en Parker, Lisa S; Alvarez, Hilary K. The Legacy of the Tuskegee Syphilis Study Disponible en http://www.asph.org/UserFiles/Module2.pdf (12/02/2008).
11 Explorar las investigaciones de Beecher, en: BEECHER, H.K., "Ethics and Clinical Research", New England Medical Journal of Medicine 274, 1966, 1354-1360.
12 Esta comisión trabajó por cuatro años y realizó 125 recomendaciones para mejorar la protección de los derechos y el bienestar de los seres humanos sujetos de investigación. Como también publicó el Belmont Report, en el se identificaron los principios éticos básicos (autonomia, beneficencia, justicia) que dan justificación filosófica al tratamiento humanitario de los seres humanos. Subsecuentemente, el gobierno federal bajo los auspicios del mismo Servicio de Salud Pública continuó poniendo al dia los reglamentos y solicitando su cumplimiento ético por parte de todo grupo que llevara a cabo investigaciones en seres humanos, dentro y fuera de los Estados Unidos.
13 La investigación debe evitar cualquier daño físico o mental a las personas participantes, con particular atención a los grupos de población más vulnerables. No se debe realizar ninguna investigación en la que hay razones a priori para suponer daños serios o irremediables a las personas participantes. Los resultados esperados de la investigación deben beneficiar a la sociedad y el beneficio siempre debe ser mayor al riesgo para aquellas personas sujetas de investigación.
14 A lo largo de la historia, la profesión médica generalmente siempre aceptó la responsabilidad moral de ejercer un poder médico sobre los pacientes. La ética médica expresó esta responsabilidad a través de códigos y tratados médicos. Todo poder profesional socialmente autorizado requiere rendición de cuenta pública, y esto es especialmente cierto para el poder profesional médico. El derecho a practicar la medicina está asociado con restricciones morales en esa práctica, impuestas ya sea por organismos de la misma profesión o por el gobierno. A medida que la práctica médica fue más poderosa, los problemas éticos asociados con la práctica médica proliferaron. El rango de cosas que los médicos podían hacer a los pacientes se expandió, junto con la efectividad y la calidad invasora de sus intervenciones. Con cada intervención, surgieron micro y macro problemas referidos a la relación entre la tecnología y la vida humana que también debieron ser considerados.
15 Farmacovigilancia es una función de la salud pública destinada a la identificación, cuantificación, evaluación y prevención de los riesgos asociados a los medicamentos una vez comercializados.
16 La teoría general de los sistemas generales (TGSG) es una teoría formal de la totalidad y de la complejidad de tipo holístico que tiene por objeto el estudio de las propiedades generales de cualquier clase de sistema. Esta teoría apareció unos diez años antes que la cibernética de Wienner y fue formulada, fundamentalmente, por Ludwig von Bertalanffy (1901-1972). Parte de las insuficiencias de las concepciones «clásicas» de la ciencia, basadas en los paradigmas mecanicistas y positivistas, y establece como objeto central de estudio las nociones de sistema y de isomorfismo. Nació con una clara vocación de interdisciplinaridad y estuvo muy influenciada por planteamientos procedentes de una filosofía organísmica, que toma en consideración las insuficiencias de los modelos causales y deterministas, y pretende formular principios generales válidos para cualquier tipo de sistemas, sea cual fuere la naturaleza de sus elementos o de las relaciones establecidas en ellos.
17 Partió de la idea de PENCHASZADEH, V. (2007): Organización institucional e investigación en genética. Materiales del Programa de Educación Permanente a Distancia. Red Bioética-UNESCO.
18 Cuando se habla de la IBB no se hace por destacar dos tipos de investigaciones con seres humanos, sino para enfatizar la biotecnológica que en el siglo XXI se demarca en forma particular, aunque está imbricada con la biomédica.
19 Sexto Foro Mundial para la Investigación de Vacunas- Disponible en: http://www.who.int/mediacentre/news/releases/2005/pr27/es/index.html (08/02/2008).
20 Por ejemplo, pueden leerse en diversas páginas web, como http://www.biotecnologica.com/inaugurado-el-instituto-suizo-para-investigacion-de-vacunas/; http://books.google.com/books?id=hhsS2KbxpEC&pg=PT20&lpg=PT20&dq=investigaciones+con+vacunas&source=web&ots=c4nXWFQUy9&sig=AwO_4_Q44GrP4AM2saO-5FbfTXs; http://www.advocatesforyouth.org/publications/iag/vaccine_sp.htm; http://msd.com.ve/msdve/corporate/press/corporate/corp_merckyaventis.html
21 Información disponible en http://www.consumer.es/web/es/salud/2004/03/13/97072.php (09/02/2008).
22 Un medicamento es una sustancia con efecto curativo, preventivo y de rehabilitación.
23 Estas investigaciones como las anteriores se clasifican según su conocimiento y riesgo:
Estudios Fase I: Incluye la introducción de una sustancia o medicamento nuevo en el sujeto humano, que proporcionaría información preliminar sobre el efecto y la seguridad del producto en sujetos voluntarios sanos.
Estudios Fase II: Representa el segundo nivel en la evaluación de una nueva sustancia o medicamento en el sujeto humano. Se realiza en sujetos que padecen la enfermedad o la entidad clínica de interés, para demostrar la eficacia y la seguridad relativa. Generalmente, se llevan a cabo en un número limitado de pacientes estrechamente vigilados.
Estudios Fase III: Son investigaciones destinadas a evaluar la eficacia y seguridad de un tratamiento experimental, después de establecerse una probabilidad razonable de eficacia del medicamento. Tienen como objetivo obtener información adicional de su eficacia para aplicaciones específicas y una definición más precisa de los efectos adversos asociados al medicamento. Esta fase incluye estudios controlados y no controlados. Estudios Fase IV: Las investigaciones se realizan con medicamentos que hayan sido aprobados para su distribución o comercialización. Estos ensayos pueden estudiar un efecto farmacológico específico, aspectos aún no valorados, condiciones de uso distintas de las autorizadas, establecer la frecuencia de reacciones adversas o determinar los efectos de la administración a largo plazo de un medicamento. Los ensayos de la fase IV pueden también estar diseñados para evaluar un medicamento en una población que no se ha estudiado adecuadamente en las fases de precomercialización o bien, establecer una nueva indicación clínica para un medicamento.
24 Se recomienda la lectura de VV.AA.; Genomics y Farmacogenómica Fundación José Cáceres Gil (Real Academia de Farmacia) en http://www.ranf.com/pdf/funda/genomica.pdf; http://payala.mayo.uson.mx/QOnline/Genomica_y_Farmacogenomica.htm (08/02/08).
25 Pueden citarse para su consulta en este tipo de investigación: Penchaszadeh, Victor B. Ética de las investigaciones biomédicas en poblaciones humanas. Rev Cubana Salud Pública, jul.-dic. 2002, vol.28, no.2, p.149-156; Brennan, T.A. (1999): Proposed revisions to the Declaration of Helsinski. Will they weaken the ethical principles underlying human research? N Engl J Med;341:527-531; CIOMS (1993). Normas éticas internacionales para las investigaciones biomédicas con sujetos humanos. Publicación Científica 563, Organización Panamericana de la Salud, Washington; Lurie P, Wolfe S.M.(1997): Unethical trials of interventions to reduce perinatal transmission of human immunodeficiency virus in developing countries. N Engl J Med;337:853-856; National Commission for the Protection of Human Subjects of Biomedical and Behavioral Research (1983). Belmont Report: ethical principles and guidelines for the protection of human subjects of research. Washington, DC: Government Printing Office; Pellegrini A, Macklin R (Editores) (1999): Investigación en sujetos humanos: Experiencia internacional. Serie Publicaciones (1999). Organización Panamericana de la Salud, Washington; Rothman, D.J. (1982): Were Tuskegee & Willobrook 'studies in nature? Hastings Cent Rep.;12(2):5-7.
26 Se recomienda la lectura de: en La aplicación de la Investigación Genética Humana de la Federación Europea de Biotecnología: http://files.efbpublic.org/downloads/The_Application_of_Human_Genetic_Research_Spanish.pdf (08/02/2008).
27 Se recomienda la lectura de: Se recomienda la lectura de: MARSHALL P. A.,Public Health Research and Practice in International Settings: Special Ethical Concerns Disponible en http://www.asph.org/UserFiles/Module3.pdf (12/02/2008).
28 De la compar ación de los genomas de diferentes individuos se podrá llegar a establecer la posible relación entre determinadas regiones del genoma y la predisposición genética a ciertas enfermedades, así como identificar mutaciones que puedan explicar las diferencias entre las respuestas individuales ante la enfer medad y los tr atamientos con medicamentos (Furness y Pollock, 2001).
29 Se recomienda la lectura de: El HIPPA (Health Insurance Privacy and Portability Act, Acta de Privacidad y Portabilidad del Seguro Médico) se viene modificando desde el 2001.
30 Se recomienda la lectura de: FREEDMAN B. Equipoise and the ethics of clinical research. En N Engl JMed. 1987. 317:141-5.
31 Se recomienda la lectura de: WEIJER C, SHAPIRO SH, CRANLEY GLASS K. For and against: clinical equipoise and not the uncertainty principle is the moral underpinning of the randomized controlled trial. En Br Med J. 2000;321:756-8.
32 Se recomienda la lectura de: FRIES J.F., KRISHNAN E. Equipoise, design bias, and randomized controlled trials: the elusive ethics of new drug development. En Arthritis Res Ther.2004;6:R250-5.
33 Se recomienda la lectura de: LENZER J. US Congress and European Research Council insist on open access to research results. En BMJ. 2008 Jan 26;336(7637):176-7; LONDON AJ. Two dogmas of research ethics and the integrative approach to human-subjects research. En J Med Philos. 2007 Mar-Apr;32(2):99-116; VARMUS H, SATCHER D. Ethical complexities of conducting research in developing countries. En N Engl J Med. 1997 Oct 2;337(14):1003-5.
34 Se recomienda la lectura de: WEIJER C., SHAPIRO S.H., GLASS K.C., et al. For and Against: Clinical equipoise and not the uncertainty principle is the moral underpinning of the randomized controlled trial for against. BMJ 2000; 321:756-758.
35 La investigación en seres humanos no es ética si los resultados de la experimentación no proporcionan conocimiento útil. La ética de usar placebos en ensayos clínicos ha originado mucha preocupación. Hay tres cuestiones éticas que se necesita responder para evaluar la eticidad del uso de placebo: 1) El uso de placebo, ¿ayudará a responder cuestiones científicas relevantes? 2) ¿Es ético esconder información al paciente? 3) ¿Es ético negar un tratamiento al paciente? Se debe demostrar que el retener la información tiene mérito científico y si el hacerlo no causaría perjuicio al paciente. No se debe interferir, por ejemplo, con otro tratamiento que el paciente esté recibiendo; por ello, se deben establecer restricciones apropiadas de reclutamiento de pacientes y permitir que éstos puedan renunciar a la investigación en cualquier momento por razones médicas. Para que sea ético retener información parcial, generalmente se le dice al paciente que va a participar en un estudio aleatorizado y que podría ser asignado tanto al grupo placebo como al grupo tratado con un medicamento a prueba, y que sabrá a qué grupo fue asignado una vez que el estudio se haya completado. El paciente debe saber que se le está reteniendo información por propósitos del estudio. Se denominan estudios doble ciego cuando ni el sujeto ni el investigador conocen quién está recibiendo tratamiento y quién el placebo, sólo el que diseña el experimento lo conoce. El investigador está obligado a justificar por qué es necesario usar
36 un placebo como control, tanto al sujeto como a los comités de evaluación ética y científica. Se recomienda la lectura de: HAWKINS JS. Justice and placebo controls. En Soc Theory Pract. 2006 Jul;32(3):467-96; CLARK P.A. The ethics of placebo-controlled trials for perinatal transmission of HIV in developing countries. En J Clin Ethics. 1998 Summer;9(2):156-66;
37 MILLER F.G., BRODY H. What makes placebo-controlled trials unethical? En Am J Bioeth. 2002 Spring;2(2):3-9. Se recomienda la lectura de: KUKLA R. Resituating the principle of equipoise: justice and access to care in non-ideal conditions. En Kennedy Inst Ethics J. 2007 Sep;17(3):171-202; CHIONG W. The real problem with equipoise. En Am J Bioeth. 2006 Jul-Aug;6(4):37-47; MILLER FG, Brody H. Clinical equipoise and the incoherence of research ethics. En J Med Philos. 2007 Mar-Apr;32(2):151-65; LONDON A.J. The moral foundations of equipoise and its role in international research. En Am J Bioeth. 2006 Jul-Aug;6(4):48-51; discussion W42-5; London AJ. Equipoise and international human-subjects research. En Bioethics. 2001 Aug;15(4):312-32.
38 BRODY H, MILLER FG. The clinician-investigator: unavoidable but manageable tension. En Kennedy Inst Ethics J. 2003 Dec;13(4):329-46.
39 Health Information and Record Services - Policies and Procedures Duke University Hospital. Disponible en http://hirs.mc.duke.edu/recserv.nsf/web/policies+and+procedures (10/02/2008).
40 Confronte todos con trabajos escritos por:Carol Isaacson Barash, Carol (o.c.)
41 SCHMIDT, L. (2008): La Dignidad Humana como fundamento de la Biopolítica y el Derecho. Cap. 13: Consentimiento ciudadano. Trabajo de ascenso a Profesor Titular. Mimeo a ser publicado.
42 SCHMIDT, L. (2007): La Bioética en la Reforma de los Sistemas de Salud En Memorias del Congreso en Conmemoración de los 50años de FLACSO; FLACSO: Quito, del 29 al 31 de octubre.
43 LOLAS, F. y QUEZADA, A. Pautas éticas de investigación en seres sujetos humanos: Nuevas perspectivas. Programa Regional de Bioética OPS/OMS, 2003.
44 LOLAS F. Medical praxis: an interface between ethics, politics, and technology. En Social science & medicine 1994; 39: 1-5.
45 Ley Orgánica para la protección del Niño y del Adolescente (LOPNA, 1998). Publicada en Gaceta Oficial N° 5.266 (Extraordinaria) de fecha 2 de Octubre de 1998. Disponible en:
http://www.mipunto.com/venezuelavirtual/leyesdevenezuela/leyesorganicas/leyorganicaparalaprotecciondelnino.html (08/02/2008).
46 Nuffield Council on Bioethics. The Ethics of Research Related to Healthcare in Developing Countries. Follow-up paper. Disponible en http://www.nuffieldbioethics.org/go/ourwork/developingcountries/page_246.htm (08/02/2008). Se recomienda la lectura de Dhai A. (2005). Research ethics review-protecting participants in research. .En S Afr Med J 95 pág. 595-597.
47 Mirar los trabajos del Nihield Council on Bioethics.
48 Hay que resaltar la investigación de EMANUEL EJ., Wendler D., Killen J., Grady C. (2004). What makes clinical research in developing countries ethical? The benchmarks of ethical. En J Infect Dis 189 pág. 930-937.
REFERENCIAS
• AMM: Código Internacional de Ética Médica. Adoptado por la 3a Asamblea General de la AMM Londres, Inglaterra, octubre 1949 y enmendado por la 22a Asamblea Médica Mundial Sydney, Australia, agosto 1968 y la 35a Asamblea Médica Mundial Venecia, Italia, octubre 1983 y la Asamblea General de la AMM, Pilanesberg, Sudáfrica, octubre 2006. Disponible en (08/02/2008). [ Links ]
• AMM: Principios éticos para las investigaciones médicas en seres humanos. Adoptada por la 18a Asamblea Médica Mundial Helsinki, Finlandia, Junio 1964 y enmendada por la 29a Asamblea Médica Mundial Tokio, Japón, Octubre 1975; 35a Asamblea Médica Mundial Venecia, Italia, Octubre 1983; 41a Asamblea Médica Mundial Hong Kong, Septiembre 1989; 48a Asamblea General Somerset West, Sudáfrica, Octubre 1996 y la 52a Asamblea General Edimburgo, Escocia, Octubre 2000. Nota de Clarificación del Párrafo 29, agregada por la Asamblea General de la AMM, Washington 2002; Nota de Clarificación del Párrafo 30, agregada por la Asamblea General de la AMM, Tokio 2004. Disponible en http://www.wma.net/s/policy/b3.htm (08/02/2008). En la actualidad continua el proceso de revisión, octubre de 2007 Disponible en http://www.wma.net/s/press/2007_9.htm (08/02/2008). [ Links ]
• BEECHER, H.K. (1966): "Ethics and Clinical Research", New England Medical Journal of Medicine 274, 1354-1360. [ Links ]
• BERNARD, C. (1865): Introduction a Létude de la Médicine Expérimentale. JB Bailliére et fils, Paris. Trad. Introducción al estudio de la medicina experimental, Buenos Aires, El Ateneo, 1959.; Normandin S.(2007): Claude Bernard and an introduction to the study of experimental medicine: "physical vitalism" dialectic, and epistemology. En J Hist Med Allied Sci. 2007 Oct;62(4):495-528. Epub 2007 Jun 18. [ Links ]
• BRENNAN, T. A. (1999): Proposed revisions to the Declaration of Helsinski. Will they weaken the ethical principles underlying human research? N Engl J Med; 341:527-531 [ Links ]
• BRODY H., MILLER F.G. (2003): The clinician-investigator: unavoidable but manageable tension. En Kennedy Inst Ethics J.; 13(4): 329-46. [ Links ]
• CARDONA, R. y POLANCO VILLEGAS, M. (2005): Registro y Control de los Medicamentos en Venezuela.: Una visión histórica. INHRR, vol.36, no.1, p.43-56. [ Links ]
• CARRILLO SALCEDO, J. A. (2001): Soberanía de los Estados y derechos humanos. Madrid: Tecnos. [ Links ]
• CASSESE, A. (1995): Self-Determination of Peoples. A legal reappraisal. Cambridge: Cambridge University Press. [ Links ]
• CHIONG, W. (2006): The real problem with equipoise. En Am J Bioeth. Jul-Aug;6(4):37-47. [ Links ]
• CIOMS (1993): Normas éticas internacionales para las investigaciones biomédicas con sujetos humanos. Publicación Científica 563, Organización Panamericana de la Salud, Washington; [ Links ]
• CIOMS: Council for International Organizations of Medical Sciences. Disponible en http://www.bioetica.org/bioetica/cioms.htm (08/02/2008). [ Links ]
• CLARK, P.A. (1998): The ethics of placebo-controlled trials for perinatal transmission of HIV in developing countries. En J Clin Ethics. 9(2):156-66. [ Links ]
• Código de Deontología Médica (1985): Disponible en http://www.mintra.gov.ve/legal/codigos/deontologiamedica.html (8/02/2008). Aprobado durante la LXXVI reunión extraordinaria de la Asamblea de la Federación Médica Venezolana, realizada en Caracas el 20 de marzo de 1985. [ Links ]
• Constitución República Bolivariana de Venezuela. Publicada en Gaceta Oficial Extraordinaria N° 5.453 de la República Bolivariana de Venezuela. Caracas, viernes 24 de marzo de 2000. Disponible en http://www.tsj.gov.ve/legislacion/constitucion1999.htm (09/08/2008) [ Links ]
• DANILENKO, G. M. (1991): International Jus Cogens: Issues of Law-Making. Disponible en http://www.ejil.org/journal/ Vol2/No1/art3.html#P13_28. [ Links ]
• DHAI, A. (2005): Research ethics review-protecting participants in research. En S Afr Med J 95 pág. 595-597. [ Links ]
• EMANUEL, E.J., Wendler D., Killen J., Grady C. (2004): What makes clinical research in developing countries ethical? The benchmarks of ethical. En J Infect Dis 189. [ Links ]
• Federación Europea de Biotecnología: http://files.efbpublic.org/downloads/The_Application_of_Human_Genetic_Research_Spanish.pdf (08/02/2008). [ Links ]
• FREEDMAN B. (1987): Equipoise and the ethics of clinical research. En N Engl JMed. 317:141-5. [ Links ]
• FRIES J.F., KRISHNAN E. (2004): Equipoise, design bias, and randomized controlled trials: the elusive ethics of new drug development. En Arthritis Res Ther. ;6:R250-5. [ Links ]
• GARRAFA, Volnei; LORENZO,Cláudio (2007): Ética e investigación clínica en los países en desarrollo: Aspectos conceptuales, técnicos y sociales. Materiales del Programa de Educación Permanente a Distancia. Red Bioética-UNESCO. [ Links ]
• HABERMAS, J. (1989): Soberanía popular como procedimiento. Conferencia dictada en México en el Simposio que se realizó con motivo de su visita en 1989, p.21. [ Links ]
• HAWKINS, J.S. (2006): Justice and placebo controls. En Soc Theory Pract. Jul;32(3):467-96; [ Links ]
• Health Information and Record Services - Policies and Procedures Duke University Hospital. Disponible en http://hirs.mc.duke.edu/recserv.nsf/web/policies+and+procedures (10/02/2008). [ Links ]
• Health Insurance Privacy and Portability Act, Acta de Privacidad y Portabilidad del Seguro Médico) se viene modificando desde el 2001. [ Links ]
• HEGEL, W.F.G. (1960): La Fenomenología del espíritu. México: FCE. [ Links ]
• Junta Revisora de Productos Farmacéuticos. Reglamento de Investigación en farmacología Clínica. Version actualizada en Septiembre 2.004. Instituto Nacional de Higiene Rafael Rangel. Caracas. [ Links ]
• KUKLA R. (2007): Resituating the principle of equipoise: justice and access to care in non-ideal conditions. En Kennedy Inst Ethics J. 17(3):171-202; [ Links ]
• LENZER J. (2008): US Congress and European Research Council insist on open access to research results. En BMJ. Jan 26; 336(7637):176-7; Ley de Ejercicio de la Farmacia (LEF, 1928); publicada en Gaceta Oficial de la República de Venezuela N° 16.551 de fecha 07 de julio de 1928. Disponible en http://www.mipunto.com/venezuelavirtual/leyesdevenezuela/ordinarias/leydeejerciciodelafarmacia.html (08/02/2008). [ Links ]
• Ley del Ejercicio de la Medicina (LEM, 1982): Gaceta Oficial de la República de Venezuela n° 3.002 Extraordinario, Caracas, 23 de agosto. Disponible en http://www.gobiernoenlinea.ve/docMgr/sharedfiles/261.pdf (08/02/2008). [ Links ]
• Ley Orgánica de Ciencia, Tecnología e Innovación (LOCTI, 2005): Publicada en Gaceta Oficial N° 38.242 de fecha 03 de agosto del 2005. Disponible en http://www.mipunto.com/venezuelavirtual/leyesdevenezuela/leyesorganicas/leyorganicadecienciatecnologiaeinnovacion.html (08/02/2008). [ Links ]
• Ley Orgánica de Salud (LOS, 1998): Publicada en Gaceta Oficial N° 36.579 de fecha 11 de Noviembre de 1998. Disponible en http://www.mipunto.com/venezuelavirtual/leyesdevenezuela/leyesorganicas/leyorganicadesalud.html (08/02/2008). [ Links ]
• Ley Orgánica del Sistema Venezolano para la Calidad (LOSVC, 2002). Gaceta Oficial de la Republica Bolivariana de Venezuela n° 37555 del 23 de octubre de 2002. [ Links ]
• Ley Orgánica para la protección del Niño y del Adolescente (LOPNA, 1998). Publicada en Gaceta Oficial N° 5.266 (Extraordinaria) de fecha 2 de Octubre de 1998. Disponible en: http://www.mipunto.com/venezuelavirtual/leyesdevenezuela/leyesorganicas/leyorganicaparalaprotecciondelnino.html (08/02/2008). [ Links ]
• LOLAS F. (1994): Medical praxis: an interface between ethics, politics, and technology. En Social science & medicine; 39: 1-5. [ Links ]
• LOLAS, F. Y QUEZADA, A. (2003): Pautas éticas de investigación en seres sujetos humanos: Nuevas perspectivas. Programa Regional de Bioética OPS/OMS. [ Links ]
• LONDON A. J. (2001): Equipoise and international human-subjects research. En Bioethics. Aug;15(4):312-32. [ Links ]
• LONDON A. J. (2006): The moral foundations of equipoise and its role in international research. En Am J Bioeth. 6(4):48-51: discussion W42-5; [ Links ]
• LONDON A. J. (2007): Two dogmas of research ethics and the integrative approach to human-subjects research. En J Med Philos. Mar-Apr; 32(2):99-116; [ Links ]
• LONDOÑO, J. L. y FRENK, J. (1997): Pluralismo estructurador: Hacia un modelo innovador para la Reforma de los Sistemas de Salud en América Latina. Washinton; BID, Doc. Trab. N° 353. [ Links ]
• LURIE P., WOLFE S. M.(1997): Unethical trials of interventions to reduce perinatal transmission of human immunodeficiency virus in developing countries. N Engl J Med;337:853-856; [ Links ]
• MARSHALL P. A.: Public Health Research and Practice in International Settings: Special Ethical Concerns Disponible en http://www.asph.org/UserFiles/Module3.pdf (12/02/2008). [ Links ]
• MILLER F. G., BRODY H. (2007): Clinical equipoise and the incoherence of research ethics. En J Med Philos. Mar-Apr;32(2):151-65; [ Links ]
• MILLER F.G., BRODY H. (2002): What makes placebo-controlled trials unethical? En Am J Bioeth. Spring;2(2):3-9. [ Links ]
• National Commission for the Protection of Human Subjects of Biomedical and Behavioral Research (1983). Belmont Report: ethical principles and guidelines for the protection of human subjects of research. Washington, DC: Government Printing Office; [ Links ]
• Nuffield Council on Bioethics. The Ethics of Research Related to Healthcare in Developing Countries. Follow-up paper. Disponible en http://www.nuffleldbioethics.org/go/ourwork/developingcountries/page_246.htm (08/02/2008). [ Links ]
• Organización Panamericana de la Salud, Washington; Rothman, D.J. (1982): Were Tuskegee & Willobrook 'studies in nature? Hastings Cent Rep.;12(2):5-7. [ Links ]
• PELLEGRINI A, MACKLIN R (Editores) (1999): Investigación en sujetos humanos: Experiencia internacional. Serie Publicaciones (1999). [ Links ]
• PENCHASZADEH, Victor B. (2007): Organización institucional e investigación en genética. Materiales del Programa de Educación Permanente a Distancia. Red Bioética-UNESCO. [ Links ]
• PENCHASZADEH, V. B. (2002): Ética de las investigaciones biomédicas en poblaciones humanas. Rev Cubana Salud Pública, vol.28, no.2, p.149-156. [ Links ]
• SCHMIDT, L. (2007): La Dignidad Humana como fundamento de la Biopolítica y el Derecho. Cap. 13: Consentimiento ciudadano. Mimeo a ser publicado. [ Links ]
• SCHMIDT, L. (2007): La Dignidad Humana como fundamento de la Biopolítica y el Derecho. Cap. 13: Consentimiento ciudadano. Trabajo de ascenso a Profesor Titular. Mimeo a ser publicado. [ Links ]
• SCHMIDT, L. (2007): La Bioética en la Reforma de los Sistemas de Salud En Memorias del Congreso en Conmemoración de los 50 años de FLACSO; FLACSO: Quito, del 29 al 31 de octubre. [ Links ]
• VARMUS H, SATCHER D. (1997): Ethical complexities of conducting research in developing countries. En N Engl J Med. Oct 2; 337(14):1003-5. [ Links ]
• VV.AA.; Genómica y Farmacogenómica Fundación José Cáceres Gil (Real Academia de Farmacia) en http://www.ranf.com/pdf/funda/genomica.pdf; [ Links ]
• WEIJER C., SHAPIRO S. H., GLASS K. C. (2000): For and against: clinical equipoise and not the uncertainty principle is the moral underpinning of the randomized controlled trial. En Br Med J.; 321:756-8. [ Links ]
• WEIJER C., SHAPIRO S. H., GLASS K. C., et al. (2000): For and Against: Clinical equipoise and not the uncertainty principle is the moral underpinning of the randomized controlled trial for against. BMJ; 321: 756-758. [ Links ]
• World Health Organization Siglas en español: OMS (Organización Mundial de la Salud). Disponible en http://www.who.int/tdr/publications/publications/pdf/ethicssp.pdf (08/02/2008). [ Links ]