Introducción
En Colombia, la incidencia del dengue se caracteriza por brotes epidémicos cíclicos en poblaciones urbanas localizadas por debajo de los 2.000 msnm. Al igual que Brasil, Venezuela, Bolivia y Paraguay, las tasas de morbilidad por dengue oscilan entre un 200,01 a 1.078,48/100.000 habitantes, y son las más elevadas de Suramérica, las cuales representan el 50-70 % de los casos de la región. En la mayoría de los países afectados, las áreas geográficas con mayor riesgo presentan problemas de abastecimiento de agua potable, inadecuados sistemas de eliminación de aguas residuales y desechos sólidos, debilidades en el ordenamiento territorial, ambiental y de vivienda, que son determinantes para criaderos de mosquitos 1-7.
Este evento es de gran preocupación para la salud pública por su impacto en la morbilidad y la mortalidad, la amplia distribución en el territorio nacional condicionada por el sistema de salud, y por determinantes ambientales, conductuales y culturales. En estos inciden las actuaciones del equipo de atención de salud, y la debilidad en la calidad y oportunidad de la notificación epidemiológica 1-10.
La Organización Panamericana de la Salud (OPS) y la Organización Mundial de la Salud (OMS) estimaron que del 2000 al 2014 se presentaron 14,2 millones de casos y 7.000 muertes en las Américas; circularon los cuatro serotipos de dengue, con incremento del riesgo de casos de dengue grave 1. Durante el 2016 se redujo a 2’427.290 casos en las Américas; el 67 % lo aportó Brasil, y el 11 % la Región Andina -donde está ubicada Colombia-, que registra el 35 % de los casos, y 8 % el istmo centroamericano 5,11. En Colombia, de acuerdo con el reporte de vigilancia epidemiológica, para la semana 23 de 2015 se registraron 46.538 casos de dengue (98,7 % correspondió a dengue y 1,3 % dengue grave), un incremento de 0,1 % con respecto al 2014. Para el año 2016 se reportaron 103.822 casos, 50 % correspondió a dengue sin signos de alarma, 40 % con signos de alarma y 1 % dengue grave. En este periodo, el dengue afectó preferencialmente a menores de 14 años, varones, del régimen contributivo de salud (personas con capacidad de pago). El dengue grave impactó a personas del régimen subsidiado de salud (personas sin capacidad de pago), lo que supone una diferencia en el comportamiento de la enfermedad y en la atención de salud. De otra parte, el informe de vigilancia epidemiológica nacional ha identificado la circulación de los cuatro serotipos de manera simultánea, con incremento del serotipo 1 12.
La ubicación geográfica de Barranquilla, su topografía y sus condiciones climáticas, en especial la humedad, al igual que los aspectos culturales en la región del Caribe colombiano son favorables para la reproducción del vector transmisor del dengue. Los factores demográficos relacionados con el incremento de la población urbana conllevan su concentración en las grandes ciudades. Por otra parte, esta movilidad no organizada que vive el país, y las condiciones de hábitat no planeadas, propician condiciones favorables para la reproducción del vector 1-6,8,10,13. La Secretaría de Salud Distrital de Barranquilla, en la semana 14 de 2014, estimó una tasa de 79,5/100.000 14. Presumiblemente se notifica un mayor número de casos en la ciudad comparados con otras ciudades de la región que genera una disparidad entre la realidad y la notificación.
Actualmente se han implementado acciones de prevención y control promovidas por la OPS/OMS, tales como el decálogo para la prevención y control del dengue, nueva generación de programas y, a partir del 2003, la Estrategia de Gestión Integrada (EGI) para la Prevención y Control del Dengue, que incluye el desarrollo de planes de comunicación y movilización social para el incremento de factores protectores 8,15-17. De otro lado, en la mayoría de los casos la enfermedad adquiere un comportamiento poco específico, con sintomatología leve, que induce a los sujetos a no buscar ayuda médica, o se puede confundir con otras patologías como influenza, malaria o leptospirosis y ello lleva a que los profesionales de la salud diagnostiquen de manera errónea el caso. Por lo anterior, la vigilancia del dengue de parte de la autoridad sanitaria y de los equipos de atención básica es de especial interés 8,15-17.
Los estudios de seroprevalencia, como actividades de vigilancia epidemiológica, identifican debilidades de los sistemas de salud, fundamentalmente relacionadas con la notificación e información. Además, posibilitan entender la dinámica poblacional de transmisibilidad, el patrón de difusión del dengue a nivel poblacional y el acumulado de antecedente de exposición 2,4,6,7,10,13,18-25.
El Ministerio de Salud de Colombia, junto con la Secretaría Distrital de Salud de Barranquilla, y el grupo de investigación Proyecto UNI de la Universidad del Norte desarrollaron un proyecto de gestión y fortalecimiento del programa de promoción, prevención y control de enfermedades transmitidas por vectores y zoonosis, a fin de prevenir y mitigar los efectos por cambio climático para municipios con alta carga endémica de dengue (Resolución 04485 de 2012). El propósito del presente trabajo fue determinar la seroprevalencia de anticuerpos IgG e IgM para el virus del dengue, e identificar factores asociados en Barranquilla, Colombia, durante el año 2014, que permitan tener un marco de referencia para estudios posteriores y facilitar el direccionamiento de políticas pública 26,27.
Materiales y métodos
El estudio se desarrolló en la ciudad de Barranquilla, Colombia, ubicada a 10° 59’ 16’’ de latitud norte y 74º 47’ 20’’ de longitud oeste, en el vértice nororiental del departamento del Atlántico, a orillas del río Magdalena, sobre la orilla occidental cerca a la desembocadura en el mar Caribe. La ciudad tiene una extensión de 154 kilómetros cuadrados. La temperatura presenta variaciones que oscilan de 24 a 32 ºC, con una mediana de 27,4 ºC, una humedad del 80 % y una precipitación de 821 mm anual. La organización política y administrativa de la municipalidad se distribuye en cinco localidades: Riomar, Norte Centro Histórico, Metropolitana, Sur Occidente y Sur Oriente; estas localidades están conformadas por 188 barrios y 7611 manzanas.
Diseño del estudio y selección de la muestra
Se realizó un estudio transversal, en el cual se estimó la seroprevalencia a partir de la determinación de anticuerpos tipo Elisa dengue IgG indirecto y Elisa dengue IgM de captura, acompañado con la aplicación de una encuesta de conocimiento de la enfermedad, y variables personales y del entorno durante los meses de marzo a mayo de 2014.
La muestra estimada fue de 504 sujetos; se calculó a través del paquete estadístico Epiinfo en Statcal; la población diana tomada como referencia fueron 1’193.667 habitantes de Barranquilla pertenecientes a las cinco localidades. Se consideró una seroprevalencia similar para países con alta endemicidad del 10% 8,9, con un efecto de diseño de 1,62, una confianza del 95% y un máximo de 4, con un ajuste del 10% por no respuesta.
El muestreo fue aleatorio estratificado por localidad y por sexo; el tamaño de la muestra se definió proporcionalmente por localidad y se ajustó por peso proporcional de la población de referencia. La unidad de muestreo fue la vivienda y la unidad de análisis fue el individuo residente en la vivienda seleccionada que representa su localidad o barrio.
El marco muestral se construyó con varias fuentes que permitieron crear clúster: la base de datos de la empresa de energía de la ciudad, los mapas por localidades suministrados por la Secretaría Distrital de Salud, provenientes de Planeación Distrital y del Instituto Geográfico Agustín Codazzi (IGAC), al igual que identificación de zonas obtenidas por gloogle map. Para la selección de los barrios se tuvo en cuenta la tendencia del comportamiento de dengue relacionada con notificación de casos. Se identificaron zonas que permitieron jerarquizar los barrios por el número de casos notificados y se seleccionaron de manera aleatoria los barrios en cada localidad. En la segunda fase del muestreo, luego de identificarse el barrio, se ubicó la zona perteneciente a la localidad. Para la siguiente unidad muestral se definió que ésta siempre fuese una casa o hábitat residencial, y se descartaron áreas comerciales; la unidad de observación final fue el individuo presumiblemente “sano”, una vez preseleccionado el domicilio. Se contó con el apoyo del equipo de técnicos ambientales de la Secretaría de Salud. Para la elección de los sujetos se contactaron en las viviendas personas mayores de 15 años que desearan participar de manera voluntaria. Se excluyeron gestantes, personas con problemas para comunicarse y casos con sospecha de dengue o fiebre.
Los sujetos recibieron información con respecto al estudio. Se les entregó y socializó el consentimiento y asentimiento informado. A los participantes se les extrajeron muestras de sangre de acuerdo con el protocolo establecido (procedimiento de extracción, embalaje, transporte y análisis), y cada participante diligenció la encuesta. La toma de sangre se realizó por profesionales de la salud entrenados (bacteriólogos).
La encuesta indagó datos personales, conocimiento de haber padecido dengue en algún momento de su vida, antecedentes relacionados con presencia de fiebre tres semanas antes de la encuesta, disponibilidad de servicios públicos y conocimiento de dengue relacionado con: síntomas, forma de transmisión, acciones de prevención y conocimiento de señales para acudir a una institución de salud. Las preguntas seleccionadas en el cuestionario hacen parte de instrumentos aplicados para investigación de dengue previamente estandarizados y validados, derivados de estudios realizados en la ciudad y en otras latitudes.
Fundamentación de la utilización de IgG e IgM en el estudio de seroprevalencia
De acuerdo con los requerimientos del Ministerio de Salud de Colombia y los lineamientos de la OMS, se empleó la prueba de Panbio dengue Elisa Duo (Elisa dengue IgG indirecta y Elisa dengue IgM de captura Viircell) teniendo en cuenta los criterios de sensibilidad y especificad de la prueba, al igual que la capacidad de evidenciar probabilidad de aparición de casos de dengue grave en la población, especialmente en áreas de alta intensidad de la transmisión. La prueba determina anticuerpos IgG en un periodo de 10 meses posinfección y, además, favorece identificar los anticuerpos IgM que estén ausentes, bajas concentraciones o dudoso, a menos que haya habido una infección por dengue durante los últimos tres meses 28-33.
El análisis de serología para dengue se realizó en los laboratorios de la Universidad del Norte; se aplicó el protocolo de análisis y tratamiento seguro de las muestras colectadas; además, se realizó control interno de calidad. La encuesta sobre conocimientos de dengue y datos sociodemográficos se realizó por personal previamente entrenado y se asignó un código a la encuesta que se anexó a la toma de muestra de sangre. El equipo de campo, junto con los investigadores, retroalimentaron el proceso y a cada participante le fue entregado su reporte de serología para dengue IgG e IgM, previa aceptación de conocer los resultados.
La interpretación para IgG e IgM de captura de Elisa de Panbio se llevó a cabo de la siguiente manera: por debajo de 9 unidades de Panbio negativo, de 9 a 11 unidades de Panbio “dudoso” y mayores de 11 unidades correspondió a positividad según las especificaciones (PanBio diagnostic®- www.panbio.com ). De acuerdo con la serología, los sujetos se clasificaron en positivos y negativos para ambas pruebas.
Análisis estadístico
Se realizó un análisis descriptivo de las características personales y los aspectos relacionados con el conocimiento y las medidas de prevención del dengue. Se estimaron las prevalencias para IgM e IgG para dengue. A fin de establecer los posibles factores de riesgo con el análisis de las variables epidemiológicas y los resultados de la pruebas serológicas se empleó la razón de probabilidades ((odds ratio - OR) 31. Para el procesamiento y análisis estadístico se utilizó Microsoft Excel® 2010 y IBM-SPSS®, versión 22.
Aspectos éticos
En el proceso de recolección de la información cada uno de los participantes firmó un consentimiento informado y asentimiento en menores de 18 años 22. Esta investigación se clasificó de riesgo mínimo de acuerdo con la Resolución 8430 de 1993 y contó con Aval del Comité de Ética de la Universidad del Norte.
Resultados
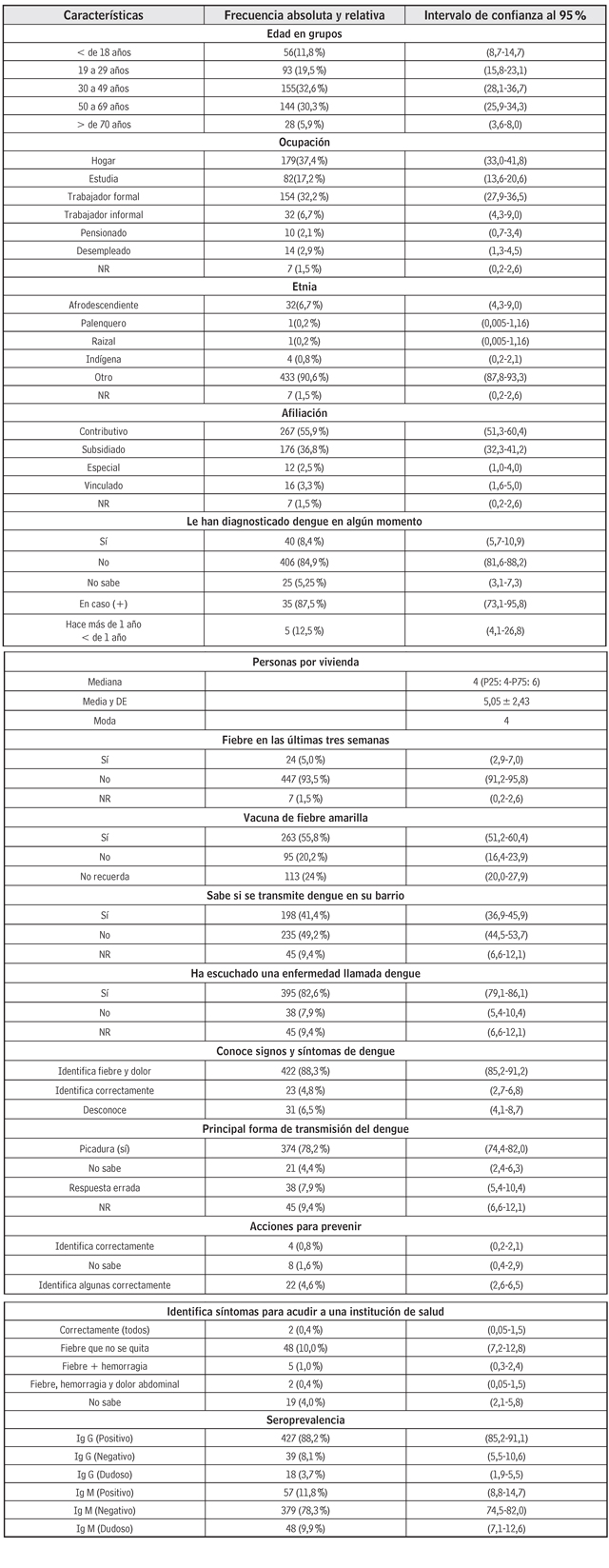
Un total de 478 sujetos respondieron la encuesta de conocimiento de dengue, que corresponde a un 94,8%. En el componente de seroepidemiología se procesaron 484 muestras (96,03% de la muestra estimada). Las muestras faltantes correspondieron a sujetos que no acudieron a la segunda cita o no diligenciaron la encuesta.
La mayor representación de la población corresponde al grupo de 30-49 años (32,6%), seguido del grupo de 50 a 69 años (30,3%), y una menor proporción de mayores de 70 años (5,9%). La mayoría de los sujetos eran empleados formales e informales: 38,9%). El 56% manifestó pertenecer al régimen contributivo. La mayoría 433 (90,6%) de los encuestados se autoidentificó como otros (no indígena, no palenquero o afrodescendientes, no raizal) (tabla 1).
El 8,4% reconoció haber sido diagnosticado o recuerda haber padecido dengue alguna vez en la vida, y en este grupo, el 87,5% 34 refiere haberlo padecido hace más de un año. Al indagar acerca del conocimiento de transmisión de dengue en su barrio, el 41,4% refirió tener conocimiento de transmisión y el 82% reconoce la palabra dengue. El 55,8% reconoce vacunación contra fiebre amarilla. El 93,1% de los participantes reconocen signos y síntomas de dengue (4,8% identificó correctamente los signos y síntomas, y el 88,3% relaciona fiebre y mialgias/dolor). El 78% de los encuestados reconoce que el mecanismo de transmisión es por la picadura del mosquito infectado, y el 4,6% identificó las acciones correctas para prevenir el dengue. Con respecto a la actuación para acudir a una institución de salud a quienes manifestaron que padecieron dengue, el 0,4% identificó de manera correcta todos los síntomas de gravedad, mientras que el 10% reconoce un solo síntoma (fiebre que no se quita) y el 1% fiebre y hemorragia.
La seroprevalencia para IgG positiva fue del 88,2% (IC 95%: 85,2-91,1) e IgG negativa del 8,1% (IC 95%: 5,5-10,6), y el resto se clasificó en dudosa. Con respecto a la infección reciente, 57 sujetos resultaron con IgM positiva, que representan el 11,8% (IC 95%: 8,8-14,7), y dudosa en 48 sujetos 9,9% (IC 95%: 7,1-12,6).
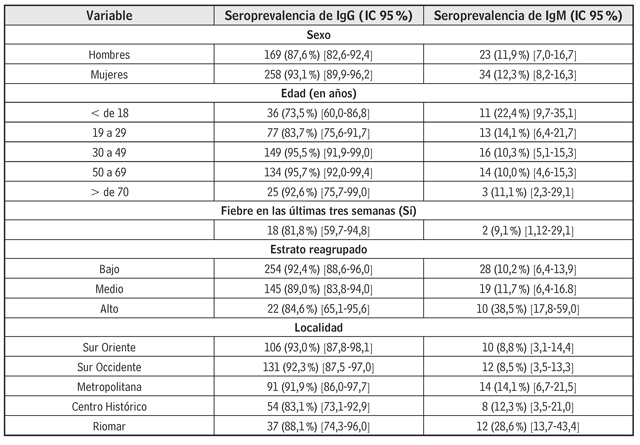
Del total de la población, 258 mujeres fueron seroclasificadas de IgG positivas, lo que representa el 93,1% (IC 95%: 89,9-96,2) (tabla 2). De acuerdo con el grupo de edad, 95,7% (IC 95%: 92,0-99,4) en el grupo de 50 a 69 años, seguido del grupo de 30 a 39 años, 95,5% (IC 95%: 91,9-99,0). Mientras que para la infección reciente, la seropositividad para IgM se detectó en el grupo etario más joven, menores de 18 años, 22,4% (IC 95%: 9,7-35,1), seguido del grupo de 19 a 29 años, 14,1% (IC 95%: 6,4%-21,7) y, en menor proporción, los menores de 70 años, 11,1% (IC 95%: 2,3-29,1). De los 18 que refirieron la presencia de fiebre en las últimas tres semanas antes de la encuesta/extracción de sangre, al 81% (IC 95%: 59,7-94,8) se les detectó positividad contra IgG, mientras que en el 9,1% (IC 95%: 1,1-29,1) para IgM. El 93% de seroprevalencia para IgG reside en la localidad de Sur Oriente, y el 92,3% de seroprevalencia de IgG en Sur Occidente que representan aproximadamente el 48% de la muestra, mientras que para IgM se detectó en el estrato alto (estratos 5 y 6 reagrupados), con el 38,5%, que afecta preferencialmente la localidad de Riomar, 28,6% (IC 95%: 13,7-43,4).
Tabla 2 Seroprevalencia de anticuerpos IgG e IgM para el virus del dengue y algunos factores personales
Al estimar factores asociados a haber tenido dengue (tabla 3) se observó asociación estadística en los grupos etarios a partir de los 30 años comparados con menores de 18. Las estimaciones de interés corresponden a 30-49 años, OR=7,09 (IC 95%: 2,60-19,30), y a los 50-69 años: OR=8,93 (IC 95%: 2,95-27,0). Al introducir la edad como variable continua se estimó un OR=1,04 (IC 95%: 1,02-1,06); por cada año que se avance se incrementa la probabilidad de 1,04 de haber padecido dengue en algún momento de la vida. De igual manera, se encontró asociación estadísticamente significativa para quienes pertenecen al régimen subsidiado: estos presentan dos veces y media riesgo, comparado con el régimen contributivo, OR=2,56 (IC 95%: 1,18-5,53), y se triplica para quienes se encuentran en el hogar, OR=3,38 (IC 95%: 1,31-8,67). Las variables sexo, localidad, estrato y número de convivientes no resultaron significativas.
Discusión
Este estudio identificó una seroprevalencia para dengue en el 88,2% de la muestra, lo que significa una circulación de este virus en gran parte de la población. Este hallazgo debe sugerir una serie de actuaciones por parte del sector salud que deben alertar sobre la probabilidad del incremento de la proporción de dengue grave, como aseguran algunos autores, debido a la exposición de serotipos previos y al hecho de la circulación de los 4 serotipos en la localidad 1,4-7,24,25,29,35-37. Con respecto a quienes padecieron fiebre tres semanas antes de la encuesta, un 83% resultó positivo para las dos pruebas, con el 81,8% de seropositividad para IgG, por tanto, estos sujetos presumiblemente no fueron diagnosticados y, de estos, al 9 % se le informó que padecía actualmente de dengue. Por ello esta presentación, que puede ser presumiblemente asintomática, o el hecho de no acudir a centros de salud, plantean riesgos para la circulación del dengue e impactan la carga de la enfermedad. A partir de estos hallazgos es necesario reforzar mensajes en áreas endémicas para reconocimiento de signos y síntomas, diagnóstico oportuno y reducción de las barreras en la prestación de servicios de salud. De otra parte, la mayor probabilidad de padecer dengue en los sujetos del régimen subsidiado puede indicar que este hallazgo relaciona factores socioeconómicos y de estratificación social, entre ellos características de las viviendas, el entorno ambiental, y se identifica que quienes están en el hogar con mayor permanencia refieren mayor seroprevalencia dada la ecología de vida del mosquito 1,35,38-41.
Los resultados de seroprevalencia reflejan similitudes con los hallazgos en el norte de África 2, Managua 23, México 4,34, Recife 35, Laos 31, Trinidad 33, Puerto Rico 42 y Colombia 38; no obstante, en otras latitudes, en entornos de clima tropical para el caso de Brasil 36, se estimó una seroprevalencia más baja, 11,9% (IC 95%: 9, 7-14, 6) comparado con otras ciudades del mismo territorio para periodos de tiempo similares. Este comportamiento es similar en Sudán 37 y Pakistán 29, en donde se presenta el mismo fenómeno de variación de la seroprevalencia que plantea interrogantes en la dinámica de transmisibilidad y difusión del dengue.
Con respecto a los grupos etarios, a medida que se avanza en edad se incrementa la seroprevalencia, lo que refleja una tendencia lineal 21,30,31,36 que afecta preferencialmente a las mujeres 21,23. Estos hallazgos coinciden con el estudio realizado por Restrepo 38 en el Urabá antioqueño, donde la seroprevalencia para IgG fue del 59,1%, con prevalencias por encima del 50 % para los grupos etarios; se encontraron tasas de 88,9% en mayores de 55 años y tasas más bajas en menores de 5 años.
En Centroamérica 43 se ha identificado que el dengue puede pasar desapercibido para el sujeto y para el equipo de salud por cursar de manera asintomática o por el carácter leve que no amerita la búsqueda de atención médica; sin embargo, esta estimación de seroprevalencia puede estar subestimada o se debe a una reacción cruzada con la vacuna de fiebre amarilla o por el antecedente de encefalitis en sus habitantes. La alta prevalencia influye en la sensibilidad del sistema de vigilancia epidemiológica; la pérdida de la percepción de gravedad, la circulación de eventos no graves y la circulación de distintos serotipos puede ser un fenómeno que favorezca la aparición de casos que adopten un comportamiento más agresivo o presentación de dengue hemorrágico 36.
Los hallazgos relacionados con la identificación de señales de riesgo, conocimiento de los signos y síntomas, y cuándo acudir a la consulta médica no difieren de los hallazgos reportados en el 2007 derivados de la Encuesta Nacional de Salud para el país. En un estudio de Bucaramanga, Cáceres et al. 39 identifican hallazgos similares a los nuestros. Fiebre y dolor son elementos trazadores para dengue, sin embargo el 6,5 % desconoce los signos y síntomas, lo que favorece la consulta médica inoportuna y la forma subclínica de presentación de esta entidad, lo que refleja un pobre conocimiento de la enfermedad y de las medidas de control. Lo anterior lleva a reconocer como fundamental incentivar acciones que movilicen y motiven a la comunidad en mantener y mejorar sus conocimientos y llevarlos a la práctica. Además, se requiere mejorar la participación comunitaria para lograr el empoderamiento y conseguir el éxito de las campañas de actuación frente al dengue 38.
Dado que a la fecha no existe un mecanismo de protección específico en el territorio, las acciones deben estar orientadas a cambios de conductas y comportamientos ecológicos socialmente aceptados que garanticen el control del dengue 22,42,43. Al igual que en Vietnam 21, la presencia de inservibles cercanos o próximos a las viviendas, así como recipientes plásticos u otros objetos receptores de agua influyen negativamente en las acciones de vigilancia si no se incorporan acciones sostenibles.
Es destacable el impacto de acciones educativas acerca del dengue en población escolar, pues favorece la adopción de prácticas saludables y cambios en la actitud y el conocimiento frente al virus 22. Es fácil que la población identifique una simbiosis entre dengue y mosquito, y no posicione al virus en el proceso, especialmente al sujeto infectado que es susceptible de ser picado por el vector, y favorezca la persistencia de la enfermedad. En este mismo sentido, el estudio en Westmoreland, Jamaica 40, a pesar de identificar un adecuado conocimiento acerca del dengue en la comunidad, señala que este no se traduce en implementar actitudes preventivas, lo que sugiere que la autoridad sanitaria debe eliminar barreras y favorecer cambios en la conducta. Asimismo, es interesante la experiencia de las escuelas de Tapachula, en Chiapas, México 44, en donde se entrenaron niños escolarizados para fomentar acciones contra el dengue, enfocadas a un cambio actitudinal sobre esta enfermedad en sus hogares.
Benítez-Leite S. et al. 41 consideran que el “rociado con insecticidas para combatir los mosquitos adultos no ha sido efectivo, al contrario, ha dado una sensación de falsa seguridad”. Esta situación observada en la comunidad de Asunción-Paraguay refleja similitudes con lo observado en nuestra región.
Se recomienda que “las campañas deben estar encaminadas a educar y estimular a individuos y familias a fin de que adopten acciones preventivas simples y económicas, tales como el uso de mosquiteros de cama tratados con insecticida y el uso de mallas de protección en las casas” 40.
Conclusión
Es válido reconocer las intervenciones en programas y proyectos que ha desarrollado el Ministerio de Salud y Protección Social mediante la estrategia EGI, lo que se traduce en que algunos territorios muestren una reducción en la incidencia de casos de dengue. Sin embargo, el nivel de población por debajo de los 2.000 msnm, junto con la franja de población en situación de necesidades básicas insatisfecha plantea retos para la salud pública y la atención de salud.
A partir de estas consideraciones se concluye que se requieren acciones educativas masivas para el público en general a través de medios tales como prensa, radio y televisión, que busquen hacer prioritario el reconocimiento de los signos y síntomas de alarma del dengue, y cuándo consultar, y concientizar al personal de salud, especialmente a los médicos, en la detección oportuna de los sujetos vulnerables: mujeres, adultos medios que no reconocen la enfermedad. Estos hallazgos sugieren que se requiere fortalecer y mantener acciones para la atención oportuna de residentes en las localidades de Sur Oriente, Sur Occidente y Metropolitana dadas sus condiciones de pobreza, vulnerabilidad y riesgo ambiental 41.
En síntesis, los factores responsables de la transmisión endemo-epidémica 13 en aumento del dengue son complejos y están estrechamente asociados a la urbanización, a la que se suman cambios sociales y demográficos que crean las condiciones ideales para el incremento de la población de mosquitos, derivados del impacto de la globalización y la persistencia de la enfermedad. Este estudio se convierte en una herramienta que permite estimar una línea base para la seroprevalencia del dengue y enfermedades conexas (chikungunya y zika).
Se enfatiza que las políticas de salud pública se han estructurado con el objetivo de responder a las epidemias, en vez de implementar acciones de saneamiento ambiental para reducir la población de mosquitos eliminando su hábitat o actuando sobre estadios inmaduros del vector, o transformar prácticas relacionadas con el cuidado del ambiente. Por lo anterior, se requiere integrar actuaciones transectoriales frente al cambio climático de cara a los desafíos de las amenazas y los retos de la globalización.