1. Introducción
Este artículo propone explicar las transformaciones ocurridas en las políticas de fusiones y adquisiciones (Mergers and Acquisitions - M&A, por sus siglas en inglés), Investigación y Desarrollo - I&D y política de patentes, ocurridas en el marco de las más recientes reestructuraciones globales de la industria farmacéutica, inducidas por la emergencia y difusión mundial del SARS-CoV-2.
Se propone como hipótesis mostrar el creciente papel de las tres variables mencionadas, -M&A, I&D y patentes-, en el desarrollo de la industria farmacéutica. Se parte de una metodología de carácter cualitativo que se basa en la revisión documental de bases de datos especializadas en la descripción y análisis de las prácticas adoptadas por las industrias tecnológicas y del conocimiento, asociadas al campo de la farmacéutica y enmarcadas en procesos de desarrollo de Ciencia, Tecnología e Innovación - CT+I. Mientras describe estrategias basadas en la reestructuración de procesos de producción, adoptadas para garantizar su supervivencia frente a las transformaciones recientes en la competencia global interfirmas y que tienen como telón de fondo la pandemia del coronavirus.
Las prácticas mencionadas, que hacen parte del devenir relativamente normal de la industria en mención, se vieron bruscamente alteradas por la aparición y veloz difusión del COVID-19, un virus mortal cuyo foco se identificó en Wuhan, -una importante ciudad de China-, que rápidamente se expandió por todos los países del planeta, y que resulta apenas comparable con la denominada gripe española de 1918 y con las pestes que asolaron a Europa durante el Medioevo.
2. Algunos elementos teóricos
Las últimas décadas del siglo XX presenciaron la emergencia de nuevos tipos de industrias y empresas, basados específicamente en la ciencia y cuya escala y alcance son desconocidos en la historia de la humanidad, dando lugar a dos tipos de empresas: 1) Las basadas en nuevas tecnologías de la información y la comunicación - TIC, que implican aplicación de conocimiento complejo desarrollado en laboratorios de I&D independientes o asociados a universidades de países desarrollados; y 2) Multinacionales farmacéuticas basadas en biotecnología e ingeniería genética, cuya ventaja competitiva se construye a partir del desarrollo de medicamentos y productos farmacéuticos en laboratorios de I&D, y cuyo perfeccionamiento requiere inversiones monetarias extraordinarias.
Los dos campos, situados en la frontera de la ciencia y de la técnica, se asocian a procesos de destrucción creadora, definida por Schumpeter (1984) como una revolución incesante desde dentro, que destruye ininterrumpidamente lo antiguo mientras crea lo nuevo y que constituye el dato esencial del capitalismo.
Las innovaciones técnicas en la industria farmacéutica suelen clasificarse como innovaciones radicales e incrementales. En numerosos escritos, Schumpeter (1978) se ocupó a fondo de los rasgos del cambio tecnológico, pero su análisis del fenómeno de la innovación técnica desestima las llamadas innovaciones incrementales surgidas de las mejoras, modificaciones y adaptaciones de artefactos técnicos producidas en planta. Para Schumpeter (1978), producir significa combinar materiales y fuerzas que se hallan a nuestro alcance. Ello puede hacerse de manera tradicional y conducir a la llamada innovación incremental, o buscando nuevas combinaciones de los mismos materiales y fuerzas en procesos productivos que se denominan innovaciones radicales.
Estas innovaciones, de acuerdo con Schumpeter (1979), aparecen en los siguientes casos: 1) cuando se introduce un nuevo bien o una nueva calidad de un bien; 2) cuando se introduce un nuevo método de producción no probado en las manufacturas existentes; 3) la apertura de un nuevo mercado en el que no haya penetrado la manufactura de la que trate la innovación; 4) la conquista de una nueva fuente de aprovisionamiento de materias primas o de bienes semimanufacturados; y 5) la creación de una nueva organización de cualquier industria, por ejemplo, la creación de una situación de monopolio o la desaparición de una situación monopólica.
Schumpeter (1979) emplea una retórica contundente para defender su posición frente a quienes creen que la acumulación de mejoras técnicas sucesivas, realizadas de forma continua, evolutiva y sin grandes saltos, llevará a la innovación importante. Dirá que la mutación histórica e irreversible que denomina innovación se define como cambios en funciones de producción que no pueden ser descompuestos en pasos infinitesimales. Así, en un sistema de transporte podrán agregarse, unas detrás de otras, las diligencias que se quiera y nunca se obtendrá por ese método un ferrocarril (Rosenberg, 1999).
Los desarrollos de la tecnociencia mencionados parecen inscribirse hoy dentro de lo que Klaus Schwab (2016), fundador del World Economic Forum - WEF, denomina como Cuarta Revolución Industrial que, según afirma, transforma profundamente la humanidad, respecto a las formas de vivir, de trabajar y de relacionarnos con otros. Esto debido a que en ella convergen como protagonistas sistemas digitales, físicos y biológicos, tratándose de una revolución que no se parece a nada que la humanidad haya experimentado antes.
Las mayores innovaciones ocurridas en la industria farmacéutica en las últimas décadas, incluidas las relacionadas con la vacuna contra el COVID-19, se asocian a una revolución científico-técnica ocurrida en los años setenta del siglo XX. Según Chandler (2005), la revolución de la biotecnología desarrollada a partir de la década de 1970, creada por el advenimiento de la biología molecular y la ingeniería genética, resulta tan importante como las ocurridas en química y biología hacia 1880; en antibióticos, petroquímica y polímeros en las décadas de 1940 y 1950; o en informática y telecomunicaciones, transformadas a partir del invento del transistor y del circuito integrado entre 1950 y 1960.
Esta revolución tecnológica evoluciona a partir del descubrimiento pionero de la estructura de doble hélice del ADN por James Watson y Francis Crick en 1953, asistiéndose en años siguientes al desarrollo de técnicas de ingeniería genética, descubrimiento de nuevas proteínas, enzimas y otros componentes básicos y clarificación de ingredientes necesarios para su combinación, mientras paralelamente, a mediados de los años sesenta, algunas universidades ofrecen cursos y crean departamentos de biología molecular (Chandler, 2005).
Como afirma Basil Achilladelis, citado por Chandler (2005),
De particular importancia fue el descubrimiento de los procesos del ADN recombinante (1975-1978), en los que se insertan segmentos del ADN de un organismo (ácidos nucleicos que forman la base molecular de la herencia) en el ADN de otro organismo, lo que hace que este último produzca proteínas idénticas a las del primero. El potencial de estos métodos para diagnosticar y tratar enfermedades y para estudiar procesos biológicos a nivel molecular era incomparable y conduciría a la formación de la industria de la biotecnología (p. 260).
Como antecedente, desde la década de 1920, el conocimiento y los materiales requeridos para esta tecnología brindaron las primeras oportunidades para la entrada de nuevas empresas que tenían el potencial de convertirse en grandes competidores, susceptibles de integrarse a las empresas farmacéuticas centrales existentes (Chandler, 2005).
Orsenigo (1989) señala a 1973 como “la fecha de nacimiento de la biotecnología contemporánea” (p. 37), cuando dos científicos de Stanford y otros dos de la Universidad de California en San Francisco descubrieron las técnicas del ADN recombinante (ADNr). En 1975, los científicos de Cambridge (Reino Unido) “emplearon una tecnología de hibridomas para producir anticuerpos monoclonales, herramientas muy importantes en todos los procesos terapéuticos y de diagnóstico involucrados en el reconocimiento de moléculas particulares” (p. 37). Luego vino el descubrimiento del proceso de ingeniería genética descrito anteriormente por Basil Achilladelis (Chandler, 2005). En 1978, Genentech, la primera empresa dedicada exclusivamente a la ingeniería genética, adquirió su primer edificio y conformó una plantilla inicial de cinco personas (Chandler, 2005).
3. Una primera aproximación a partir de las variables consideradas
Puntualizados los aspectos más generales, respecto a la innovación en un campo en el que la ciencia se interseca con la técnica, que Bruno Latour (1987) denominó tecnociencia, abordamos a continuación las variables planteadas por la investigación, relativas a fusiones y adquisiciones -denominada por diversos autores como “la manía de las fusiones, adquisiciones y agrupamientos de empresas” (Harvey, 1998)-, política de patentes y procesos de Investigación y Desarrollo - I&D.
3.1 Fusiones y adquisiciones - M&A
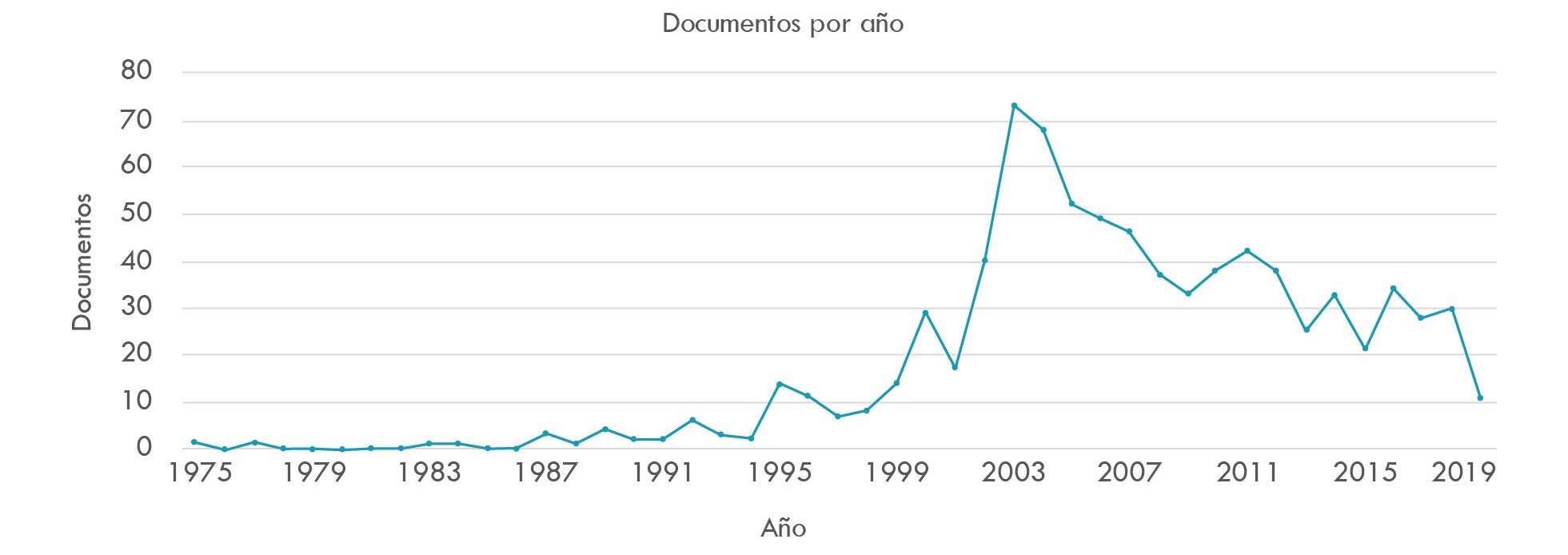
La primera búsqueda2 respecto a este ítem cubre el periodo transcurrido entre los años setenta del siglo XX -comienzo de la revolución tecnológica mencionada- y 2019, obteniendo 825 resultados. Aunque es posible rastrear tendencias a la concentración de la industria farmacéutica desde mediados del siglo XIX, la Figura 1 muestra una creciente actividad de M&A, que se mantiene constante entre 1970 y 1990, e inicia a partir de allí un crecimiento vertiginoso que dura hasta comienzos de la primera década del 2000, cuando empieza un descenso acentuado que se mantiene hasta 2019.
Fuente: elaboración propia basada en consulta de base de datos Scopus.
La Figura 2, que cubre el periodo transcurrido entre 1990 y 2020, obtuvo 766 resultados y registra un comportamiento similar al patrón antes descrito. El comportamiento de las curvas, respecto a crecimientos y descensos durante los años de publicación de las investigaciones, puede deberse a varias razones: 1) la tendencia a la concentración del capital de las firmas; 2) la competencia interfirmas; 3) la necesidad de producir sinergias que impliquen ahorro de costos, aprendizaje cruzado de destrezas, acceso a nuevos mercados y disminución de la fuerza de trabajo por la vía de implementación de reingenierías; 4) el creciente vencimiento de las patentes, que suele precipitar un fenómeno denominado patent cliff, acantilado o abismo de patentes, que significa que una vez vencida la fecha de una patente sobre un medicamento, caen dramáticamente sus ventas (Financial Times, 2012); y 5) crisis de creatividad de la industria, asociada a dificultades en el proceso de inventar y lanzar al mercado nuevos medicamentos. En la Figura 1 y Figura 2, puede constatarse cómo en el lapso transcurrido entre 2002 y 2005, probablemente por las razones anotadas, cae de manera acentuada la actividad de M&A de compañías farmacéuticas.
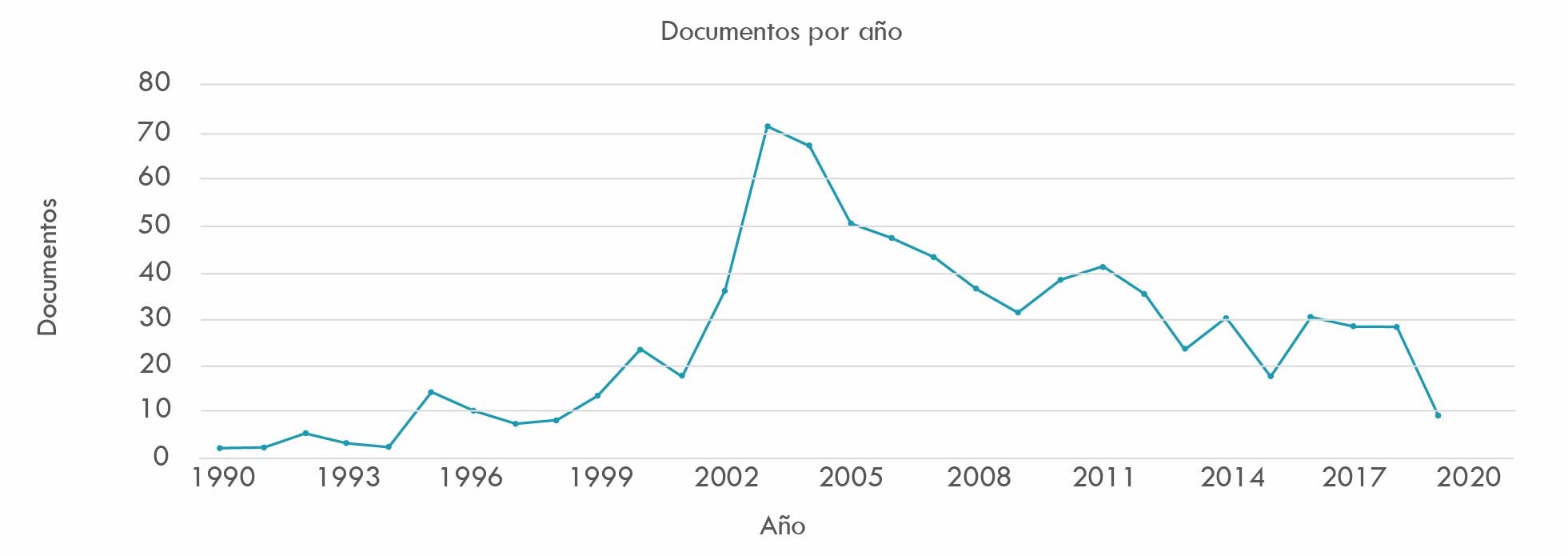
Fuente: elaboración propia basada en consulta de base de datos Scopus
Figura 2 Fusiones y adquisiciones en la industria farmacéutica 1990-2020
La Figura 3 muestra las ramas de actividad científica, técnica o de negocios, en donde se concentra la mayor producción de artículos científicos, registrándose que la producción intelectual se acumula en torno a temas como ingeniería química, farmacología, medicina y gestión y administración de empresas, lo que revela la creciente importancia de la ciencia aplicada a la generación de tecnologías relacionadas con la industria y la empresa, convirtiéndose la ciencia en una fuerza productiva (Marx, 1973). En consonancia con la revolución científica a la que hicimos referencia, es notable el predominio de disciplinas científicas asociadas a la biotecnología y a la ingeniería genética, como indican los porcentajes relativos a ingeniería química, farmacología, medicina, química y bioquímica, que superan a las ciencias de la computación.
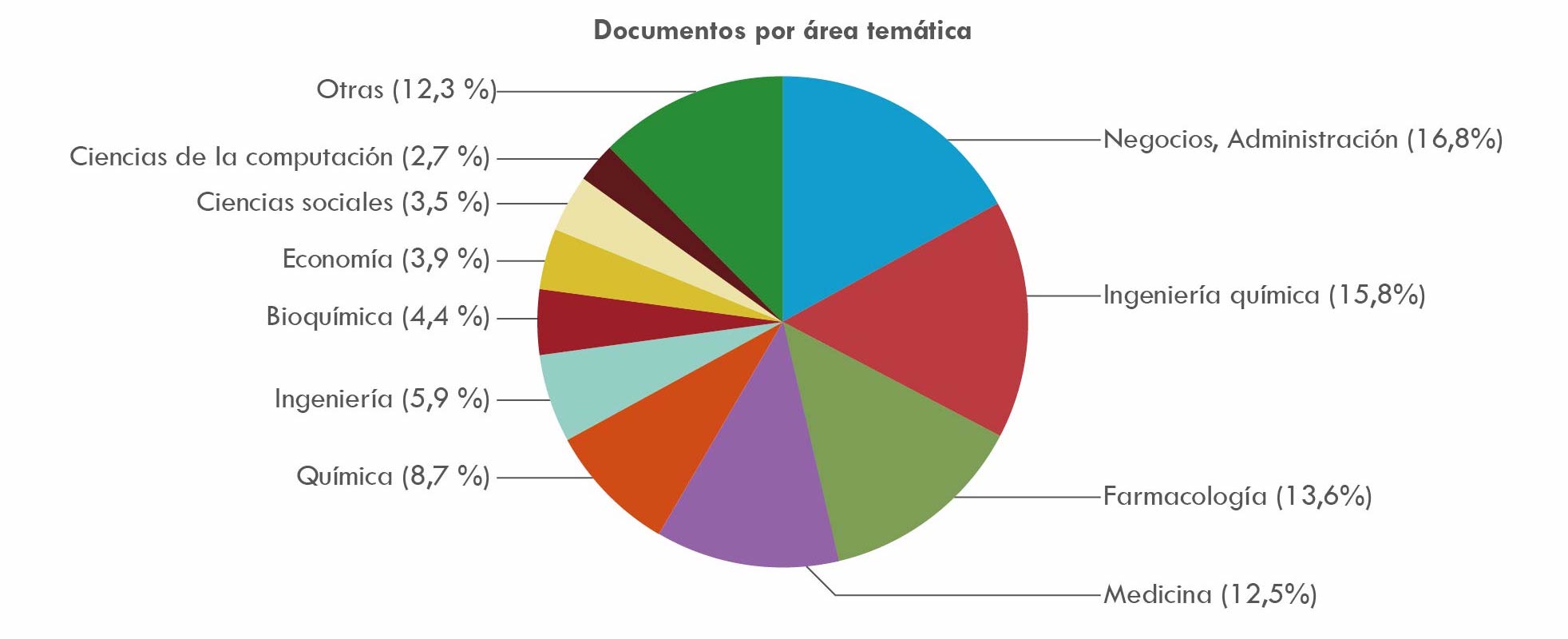
Fuente: elaboración propia basada en consulta de base de datos Scopus
Figura 3 Porcentajes de producción de artículos relacionados con actividad científica, técnica o de negocios
3.1.1 Determinantes de las fusiones y adquisiciones - M&A
Formuladas algunas de las razones que conducen a las compañías farmacéuticas a emprender actividades de M&A, a continuación, examinamos este proceso con mayor detalle. De acuerdo con Gabriel (1997), debido a recientes avances en campos como genómica, biología celular, química, computadoras y comunicaciones, la industria farmacéutica experimenta cambios dinámicos en su estructura y composición, generándose mutaciones en el paradigma de la farmacéutica tradicional.
En este cambio de rumbo, las empresas más pequeñas demuestran gran flexibilidad y compiten con productos cuyo ciclo de vida es más corto, mientras las grandes firmas se deshacen de activos que no hacen parte del corazón del negocio, subcontratando muchas de sus operaciones. De esta manera, convierten la externalización en un mantra de la industria que busca un uso más eficiente del capital y otros recursos utilizados en la producción de medicamentos (Gabriel, 1997).
Según Rios y Contreras (2019), desde comienzos de la década de los noventa, las operaciones de fusiones y adquisiciones crecieron de forma considerable. Así, entre 1993 y 2000, las adquisiciones con montos mayores a mil millones de dólares fueron en promedio tres por año; en el lapso 2001 a 2007, llegaron a siete por año; mientras que de 2008 a 2015 aumentaron a trece por año (Rios y Contreras, 2019).
Comanor y Scherer (2013) coinciden en que la industria farmacéutica atraviesa por un período de dramáticos cambios estructurales, cuya manifestación más importante ha sido lo que denominan productividad en declive o “choque de productividad”, consistente en que el número de moléculas3 o nuevas entidades moleculares aprobadas para su introducción en el mercado de los Estados Unidos entre 1970 y 2010 creció solo levemente, a pesar del enorme aumento en inversiones en I&D. En ese orden de ideas, el costo de producir una molécula nueva pasó de 40 a 280 millones de dólares en el periodo comprendido entre 1980 y 1990 (Comanor y Scherer, 2013).
En Estados Unidos, la Food & Drug Administration - FDA aprobó 35 nuevas entidades moleculares en 1999 (Rogers, 2000). Cifra considerada baja, a pesar de la aparición de métodos radicalmente nuevos para descubrir moléculas candidatas (análisis de ADN combinado con empalme de genes) y del crecimiento de una nueva industria biotecnológica orientada en torno a estas técnicas. Otros factores se relacionan con la expiración de patentes clave. Situación que favorece a los fabricantes de medicamentos genéricos e intensifica la competencia de precios, lo que ha llevado a la industria al eterno dilema de innovar o desaparecer. La ola de fusiones ha provocado la desaparición de muchas empresas, alguna vez a la vanguardia innovadora de la industria, aunque, en lugar de mejorar la productividad de la I&D, esa ola ha generado un impacto negativo en la tasa de innovación del sector (Comanor y Scherer, 2013).
Abordando un análisis crítico de la valoración y orientación estratégica de las operaciones de M&A, Dierks et al. (2018) registran que la industria farmacéutica debe recurrir a este tipo de procesos a causa de los cambios macro y micro que experimenta. Estos se relacionan con el hecho de ser muy intensiva en capital, debido a diversas barreras de entrada como el alto costo de I&D y el proceso de caducidad de las patentes. Así, una parte significativa de la actividad de M&A entre farmacéuticas se explicaba por inminentes expiraciones de patentes en 2012, a las que se enfrentaron medicamentos significativos por las ganancias que generaban como el Lipitor de Pfizer.
Las principales razones que llevan a las compañías a iniciar procesos de M&A en el campo de la farmacéutica se asocian con la creciente demanda de medicamentos y con lo que denominan proceso de transición epidemiológica. Más concretamente, las causas del fenómeno se relacionan con: 1) Reestructuración y venta de activos no estratégicos que no hacen parte del corazón del negocio. 2) Mejoramiento de su oferta mediante acceso rápido a nuevos fármacos que fabrica la compañía con la que se fusionan. De esta manera, se aumenta el valor de las firmas fusionadas, que por este medio acceden a medicamentos innovadores que generan mayores recursos en una industria de costos crecientes enfrentada a regulaciones de agencias nacionales e internacionales y exigencias de los inversores. En síntesis, resulta más barato adquirir un medicamento existente o incluso una empresa entera con una cartera de activos evidentes que desarrollarlo en casa ab initio. 3) Facilidad de cambios de domicilio fiscal con el fin de pagar menores impuestos, por ejemplo, en lugares como Bermudas o Islas Caimán (Dierks et al., 2018).
Con referencia a la industria farmacéutica china, otros autores señalan que el proceso de M&A significa una tendencia a la rápida integración de la industria motivada por la tecnología y las patentes. Esta solo tiene impactos significativos fugaces en el crecimiento de beneficios y no aporta mejoras sostenibles del rendimiento financiero, aunque resulta positiva para quienes adquieran una firma, mejorando el precio de sus acciones en bolsa (Zhu et al., 2017).
La rentabilidad de las farmacéuticas depende de desarrollar y mejorar economías de escala. La práctica más frecuente consiste en diversificar su oferta de productos al intensificar actividades de I&D, ahora relacionadas con fabricación de medicamentos genéricos; los que, si bien requieren menor inversión de capital, generan menores márgenes de beneficio. Las firmas adoptan la novísima estrategia de extender su actividad hacia pequeñas compañías fabricantes de medicamentos genéricos, debido al vencimiento de las patentes y a la consecuente caída de las utilidades por venta de medicamentos cuya patente expira.
Dos ejemplos de acuerdos de M&A por encima de mil millones de dólares, en 2016, son Pfizer, que adquiere Medivation, y Mylan, que adquiere Meda. Coincidiendo parcialmente con las gráficas anteriores, durante 2014 y 2015 hubo una intensa actividad de M&A, tanto en volumen como en valor, observándose signos de fatiga a partir de 2016. Lo que se explicaría por 3 factores: 1) bloqueo de fusiones motivadas por inversiones fiscales en EE. UU., durante el régimen de Obama; 2) había pocos objetivos por alcanzar luego de la gran manía de fusión en 2014/15; y 3) caída de precios debido a lentas tasas de crecimiento de adopción de ciertos productos. Los analistas creen que el proceso continuará en los próximos años (Dierks et al., 2018).
La manía de M&A explica, por ejemplo, que multinacionales como Sanofi - Aventis decidan comprar Genfar, una pequeña firma muy innovadora de la ciudad de Cali y el segundo laboratorio más grande de capital colombiano, convirtiéndola en líder del segmento de medicamentos genéricos en el país y expandiendo su portafolio de medicamentos en América Latina a través de filiales en Ecuador, Perú, Venezuela y distribuidores en países de Suramérica y Centroamérica. Las ventas de Genfar en 2011 sumaron 133 millones de dólares, 84 de ellos correspondientes a Colombia. Mientras Sanofi Aventis Pharma negociaba la compra de Genfar, anunciaba a su vez negociaciones en Vietnam e Indonesia, en tanto que Mauricio Botero, su gerente en Colombia, puntualizaba que el mercado de los medicamentos colombianos, impulsado por los genéricos, representa un tercio del mercado total (Portafolio, 2012).
Genfar elabora medicamentos y productos de uso humano y animal, de venta libre y prescripción médica. A su vez, Sanofi Colombia es un proveedor diversificado de soluciones en salud con unos 200 productos, 420 presentaciones y 21 vacunas. La tendencia a las adquisiciones registró la venta de Lafrancol, otra gran farmacéutica de capital nacional, a la firma chilena Recalcine por un billón de pesos (menos deuda y otros rubros). Lo que representa 2,8 veces los ingresos de la colombiana (Portafolio, 2012).
El caso de la India demuestra que ante los crecientes gastos en I&D, suelen ser comparativamente diferentes las fusiones y adquisiciones orientadas al mercado interno frente a las denominadas transfronterizas, que resultan determinantes, pues aumentan las aprobaciones de medicamentos a corto plazo, aunque el efecto disminuye tres años después de finalizada la etapa de M&A. Sin embargo, se observa que las fusiones transfronterizas producidas entre dos empresas de diferentes países tienen efectos positivos duraderos en nuevas aprobaciones de medicamentos (Banerjee y Nayak, 2015).
Históricamente, las grandes farmacéuticas recurrieron en pocas ocasiones a la compra o asociación con firmas fabricantes de medicamentos genéricos, siendo este un fenómeno novedoso que fortalece procesos de I&D para la producción de nuevos medicamentos destinados a tratar enfermedades raras como el cáncer o las enfermedades huérfanas. Al tiempo que acceden a financiación por parte de los gobiernos y/o colaboran con ellos en el desarrollo de medicamentos como antibióticos. De ahí que la estrategia de diversificación de genéricos y el desarrollo de colaboraciones sean ahora prácticas ampliamente conocidas en la industria. Los planes a 2022 buscan obtener 1,06 trillones de dólares, distribuidos así: 112 billones de dólares por ventas de genéricos, 209 billones por ventas de medicamentos para enfermedades huérfanas y 739 billones para otros medicamentos (Dierks et al., 2018).
Las estrategias de M&A se caracterizan, además, porque las firmas buscan un crecimiento inorgánico antes que orgánico, siendo preferible fusionarse con otras firmas antes que dedicar recursos y esfuerzos al crecimiento interno de cada firma, lo que implica recorte de plantillas de personal. Se debate si estos procesos afectan la dinámica creativa de la industria, pues la concentración del mercado en pocas empresas líderes genera menos innovaciones, disminuye la competencia y, con ello, el estímulo para innovar. En ese orden, un aspecto estratégico se relaciona con la disminución de la productividad de la I&D en una industria no rentable en conjunto y afectada por la incertidumbre respecto a la aceptación en el mercado de los productos asociados a procesos de M&A (Bradfield y El-Sayed, 2009); aunque otros consideren que tales operaciones están cambiando estructuralmente la industria farmacéutica, sin perjudicar procesos de innovación (Dierks et al., 2018).
Karwal (2009) llama la atención sobre un fenómeno nuevo relativo a la emergencia de grandes empresas de medicamentos genéricos, aunado al renovado interés de las grandes farmacéuticas por este mercado altamente fraccionado en pequeñas firmas. Por otro lado, Boekestein (2009) indaga por el capital oculto de las firmas sometidas a procesos de M&A, presente en activos intangibles que se solapan con el capital intelectual de las compañías y que aumentan su valor.
Otros autores destacan que los procesos de M&A generan impactos positivos en el mantenimiento de rutinas de los operarios y funcionarios de las plantas. De esta manera, garantizan la calidad de los productos farmacéuticos y evitan tendencias a la entropía, en términos de decadencia de procesos operativos y rutinas organizativas (Anand et al., 2012), en lo que parece aludir a las denominadas Buenas Prácticas de Manufactura - BPM. Además de las ventajas mencionadas de los procesos de M&A, respecto a reducir costos, las grandes farmacéuticas están adquiriendo pequeñas empresas biotecnológicas enfocadas en objetivos de nicho y dotadas de capacidades ágiles de I+D para responder al mercado (Industrial R&D: Life Sciences, 2010). La industria farmacéutica recurre cada vez más a empresas de biotecnología para impulsar innovaciones de productos, dentro de un paradigma en evolución que mira a las empresas de bioterapia como objetivo cada vez más atractivo, debido a que las bioterapias consiguen altas tasas de reembolso por su alta eficacia, reducción de toxicidad de sus productos y menor vulnerabilidad a la competencia de los medicamentos genéricos (Lloyd y Sowlay, 2010).
Un análisis de 405 fusiones ocurridas en la industria farmacéutica norteamericana, en el período transcurrido entre 1981 y 2004, buscando establecer si los procesos de M&A creaban riqueza para los accionistas, encontró evidencia de rendimientos extraordinarios a corto plazo, efectos contables positivos y mayor eficiencia en los procesos de adquisición, pero no en los de fusión. Sin embargo, esto último no significaba destrucción de valor de las compañías y generaba efectos positivos en la creación de dicha riqueza (Hassan et al., 2007). Otros analistas consideran que si bien estos procesos generan grandes economías de escala, no resulta obvio que mayores niveles de inversión por parte de un número menor de empresas conduzca a un aumento del ritmo de innovaciones genuinas: existen riesgos de conflicto de intereses y búsqueda de ganancias a corto plazo. Estos pueden alentar fusiones no óptimas para la industria y que son susceptibles de conducir a la concentración excesiva y consolidación de poderes monopólicos que reduce el margen de acción de los gobiernos, mientras se genera un estancamiento de la innovación (Po, 1998).
3.1.2 Casos específicos de fusiones y adquisiciones
Aunque fallido, el caso más emblemático de un proceso de M&A en la última década es el de la farmacéutica norteamericana Pfizer, que hizo una oferta de adquisición de la compañía AstraZeneca del Reino Unido, el séptimo laboratorio por ventas en todo el mundo, en lo que algunos llegaron a considerar la mayor fusión en la historia de la industria. La discusión giró en torno a tres temas pertinentes: a) qué esperar de esta adquisición; b) implicaciones para la economía y la base científica del Reino Unido; y c) si ese acuerdo debía seguir adelante. Si bien se consideró que habría una mejora del rendimiento de la empresa y del valor para los accionistas, experiencias anteriores muestran que estos procesos generan efectos neutrales o de disminución de la productividad, del empleo y del gasto en I&D, incluyendo además caídas en las ventas. A ello se sumaba que AstraZeneca resultaba más prometedora en I&D que Pfizer, por ejemplo, en oncología (Kanavos y Angelis, 2014).
Según Vigario (2014), Pfizer llegó a ofrecer 88.000 millones de dólares por su rival inglesa, un 50% más de su valor en bolsa, pero el gobierno británico detuvo a finales de mayo de 2014 la fusión con AstraZeneca por temor a perder su laboratorio estrella. En retrospectiva, puede verse como una decisión correcta, dado que el laboratorio sueco - británico fabricó a mediados de 2020 una de las primeras y más eficaces vacunas contra el COVID-19, lo que significó un enorme crecimiento del capital de marca de la compañía. Es decir, de su capital simbólico o de prestigio, junto con ganancias fabulosas por la venta de su vacuna a nivel mundial.
Los expertos consideran que la injerencia en la operación del gobierno británico liderado por el primer ministro conservador David Cameron determinó la decisión final de AstraZeneca en relación con la pérdida del control de uno de los emblemas de la industria británica y el riesgo de posibles despidos en Reino Unido. A lo que se sumó la oposición del componente sueco de AstraZeneca, pues la firma es la resultante de la fusión hace 15 años entre la sueca Astra AB y la británica Zeneca Group. Así se frustró la que hubiera sido la mayor compañía farmacéutica del mundo, con oficinas en Nueva York, pero basada en el Reino Unido por razones fiscales (Vigario, 2014). Se registra, además, que AstraZeneca se ha asociado con Merck para fortalecer su actividad en el campo de la biotecnología (Sheail, 2007).
En 2004, se produjo la fusión de dos grandes multinacionales farmacéuticas: la francesa Sanofi-Synthelabo y su mayor rival francoalemán, Aventis. En principio, Sanofi-Synthelabo lanzó una OPA4 hostil para adquirir Aventis, buscando mejorar áreas de I&D y de fabricación de vacunas. Tratándose de una fusión transfronteriza, emergieron argumentos relacionados con la tradicional rivalidad entre los dos países, además de narrativas respecto a distintas culturas corporativas en las dos firmas y la manera como serían afectadas las capacidades regionales de la industria farmacéutica francesa (Mittra, 2007; Short, 2004).
El País de España registró así la operación:
Sanofi-Synthélabo ha pagado 54.500 millones de euros para hacerse con su rival Aventis, el grupo farmacéutico franco - alemán nacido en 1999 de la fusión de Rhône-Poulenc y Hoechst. El gigante resultante, que será rebautizado como Sanofi-Aventis, ocupará el tercer puesto en el ranking del sector farmacéutico mundial, empleará a más de 102.000 personas (2.000 en España) y moverá unos 26.000 millones anuales para obtener beneficios de 3.000 millones. La Comisión Europea aprobó ayer la operación, pero condicionada a que la nueva empresa se desprenda de varias licencias de medicamentos. La Bolsa castigó a las dos compañías con fuertes caídas: Aventis retrocedió un 5,51% y Sanofi perdió un 6,97% (Marti, 2004, párr. 7).
Una muestra de cómo las M&A conducen al recorte de plantas de personal se relaciona con la fusión entre Glaxowellcome y Smithkline Beecham del Reino Unido, dando lugar a GlaxoSmithkline (GSK). Esta implicó un recorte de 2.175 puestos de trabajo en todo el mundo, como parte de un proceso de racionalización para hacer más competitiva a la nueva compañía en actividades de I&D (Thomas, 2001). Suele considerarse que los casos más problemáticos tienen relación con las fusiones transfronterizas, en donde se presentan tensiones, problemas de integración y diferencias importantes, relacionadas con la cultura corporativa desarrollada por cada firma y con la cultura del país en donde estas funcionan. Tal es el caso observado por Belcher y Nail (2000) en el examen de la fusión Pharmacia de EE. UU. y Upjohn de Suecia.
3.2 Política de patentes
La Figura 4, referida a política de patentes en la industria farmacéutica, obtiene 782 resultados. Las investigaciones analizadas partiendo de la década de los 70 mantienen una regularidad poco significativa hasta mediados de los 90, iniciándose a partir de allí un ascenso vertiginoso que alcanza los máximos picos en el lapso transcurrido entre 2014 y 2018. Seguido de un agudo descenso en los años posteriores, que parece retornar la tendencia a niveles de finales del siglo XX.
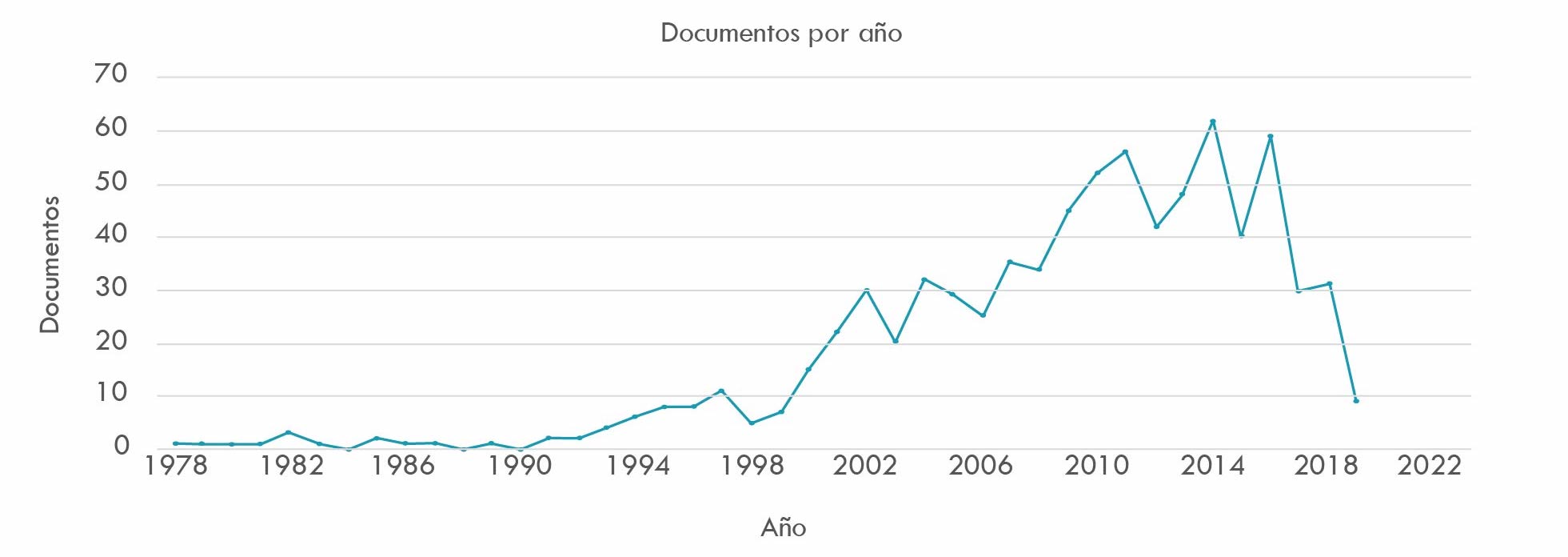
Fuente: elaboración propia basado en consulta de base de datos Scopus.
Figura 4 Publicaciones sobre patentes 1970-2018
Conferir sentido al comportamiento de las publicaciones registrado en la Figura 4 significa referirse a los cambios globales en la política de patentes a partir de los años 80 del siglo XX. La crisis de finales de los años 70 en Estados Unidos y su pérdida de poder en sectores industriales que dominaba tradicionalmente como acero, química y medicamentos renovó radicalmente la política sobre patentes y propiedad intelectual a través de la Ley Bayh-Dole (1980). Esta ley permitió que las universidades asumieran un papel determinante en la recuperación de la competitividad del país, de modo que la investigación y los inventos e innovaciones realizados por laboratorios y universidades públicas, luego de patentados, podían ceder sus derechos de exclusividad a firmas privadas (Angell, 2006). Así, el desarrollo de investigaciones en biotecnología y bioquímica pudo ser adelantado mediante contratos entre el sector público y el sector privado, representado por compañías farmacéuticas (Perelman, 2014).
Los debates sobre patentes en Estados Unidos terminaron por establecer globalmente nuevas normas en la materia, incluyendo la posibilidad de patentar materia viva y conocimiento abstracto, representado en ecuaciones y algoritmos (Coriat, 2002). Si en el pasado algunos países podían no patentar sus innovaciones en la farmacéutica, en el presente tal liberalidad ya no era posible, lo que explica la creciente tendencia a patentar la propiedad intelectual de los medicamentos, expresada en la Figura 4. Al respecto, anota Charles Piketty (2019) que desde el siglo XVIII se inicia un proceso de afirmación y endurecimiento de los derechos de propiedad, que parece consolidarse a finales del siglo XX en relación con las patentes.
La Figura 4 registra un agudo descenso del interés por el tema de las patentes a partir de 2016, que puede relacionarse con el fenómeno del vencimiento de la vigencia de estas y con el consiguiente patent cliff mencionado, quizá asociado con una crisis de creatividad de la industria farmacéutica. Esta será parcialmente resuelta por el proceso de invención de la vacuna contra el COVID-19, a partir de mediados de 2020.
La Figura 5 muestra un interés de los investigadores en el tema de las patentes. Se diferencia por campos de actividad científica y se centra en las publicaciones en áreas como medicina y farmacología. Si a ellas se suman áreas como bioquímica y enfermería, aumentará el peso de la industria farmacéutica y de las ciencias de la salud en la industria global y su interés por garantizar la propiedad intelectual mediante patentes, contrastando con otras ramas de la actividad científica.
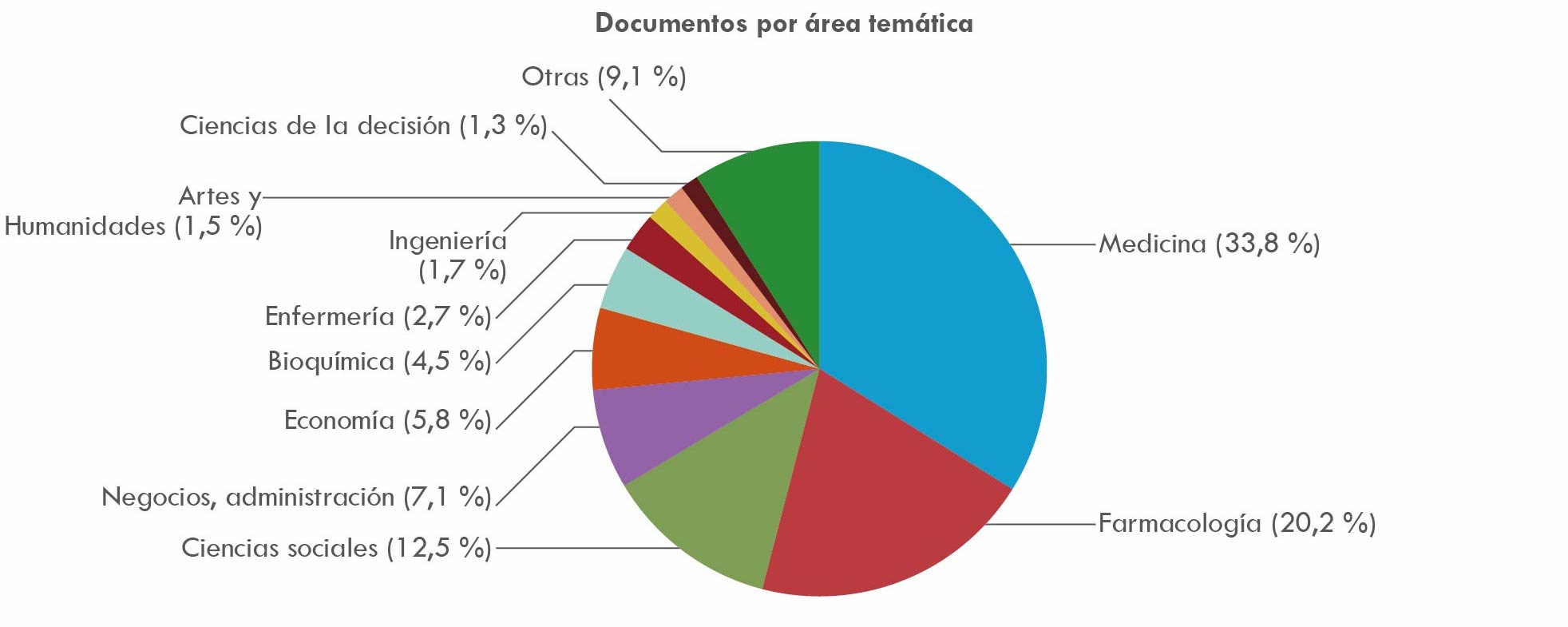
Fuente: elaboración propia basada en consulta de base de datos Scopus.
Figura 5 Artículos sobre patentes 1970-2018
El tema de las patentes y la propiedad intelectual se abordó con algún detalle en Mejía y Martínez (2020), considerándose que la propiedad intelectual implica un monopolio capaz de aumentar el poder de una nación o una empresa dotadas de conocimiento para producir invenciones e innovaciones científicas y técnicas. En la industria farmacéutica, las patentes garantizan la protección de sus invenciones e innovaciones, con el objeto de que esta pueda recuperar costos derivados de enormes inversiones generadas al comienzo de los procesos de I&D. La duración del derecho exclusivo de patente es de 20 años y, en la medida en que este periodo se va venciendo, las compañías utilizan distintas estrategias para lograr su prórroga. Una de ellas consiste en modificar alguno de los componentes que acompañan al principio activo o molécula de un medicamento para patentarlo como uno distinto; la segunda estrategia se vale de un intenso lobby de tipo jurídico que busca prolongar legalmente la vigencia de una patente pues, una vez vencida esta, cualquier laboratorio puede fabricar el medicamento como genérico. La prórroga del plazo de patente es entonces una estrategia clave (Musyuni et al., 2011).
Por otra parte, analizando el denominado patent cliff, o precipicio de patente, los analistas exploran diversas posibilidades de diseño de las firmas con el objeto de hacer frente a los crecientes gastos en I&D y a la disminución de la productividad en términos de producción de nuevo conocimiento patentable, lo que se considera ya un fenómeno corriente de la industria. Junto con las estrategias comunes, en términos de lobby de carácter jurídico, la salida más viable se relaciona con descubrir nuevos principios curativos o moléculas, además del desarrollo de políticas innovadoras en comercialización, tendientes a “prolongar la exclusividad del mercado e identificar lagunas de conocimiento que deben abordarse para mejorar la eficiencia en el diseño de políticas” (Song y Han, 2016, p. 30).
Como se indicó a partir de Coriat (2002), el Congreso de Estados Unidos mantiene especial vigilancia sobre temas de patentes y propiedad intelectual. Busca promover el desarrollo de productos farmacéuticos innovadores que reduzcan costos a los consumidores, ya que esta protección juega un importante papel en el éxito de las empresas del sector. En la legislación norteamericana, existen leyes que regulan la competencia de precios y abogan por la restauración de plazos de las patentes. Tal es el caso de la “Ley Hatch-Waxman”, que según se afirma, favorece la entrada de la competencia de los medicamentos genéricos. No obstante, hacia 2012, un número significativo de patentes de medicamentos denominados “blockbuster”5 había expirado (Schacht, 2012).
Un ejemplo es el medicamento Lipitor, usado para disminuir la cantidad de colesterol en la sangre, prevenir derrames cerebrales, ataques al corazón y anginas o dolor en el pecho. Era el más vendido del mundo hasta que perdió su patente a finales de 2012, enfrentando inmediatamente la competencia de los fabricantes de genéricos. Esto condujo a un evento de patent cliff en el que sus ventas cayeron un 80%, situación de la que resulta difícil recuperarse. Una vez establecida la disminución de la productividad en el sector, en su defensa, las fabricantes de medicamentos de marca aducen que sin la I&D y las pruebas realizadas por ellas, los medicamentos genéricos no existirían (Schacht, 2012).
Otro documento analiza la forma como las farmacéuticas afrontan el desafío de la expiración de patentes. En el caso del Lipitor, Pfizer emprendió estrategias de comercialización directa al consumidor, de fijación de precios para la competencia, retraso legal e I&D de medicamentos. Al expirar la patente, optó por una comercialización continua de la marca, estrategias de reembolso, comercialización de genéricos autorizados y cambio a sin receta. El texto concluye que el “precipicio de patentes” es hoy el mayor riesgo de la industria (Chao et al., 2016).
Marcia Angell (2004) presenta una visión distinta:
La gran mayoría de las nuevas drogas no son nuevas, sino simples variantes de viejas drogas ya presentes en el mercado, a éstas se las denomina medicamentos “Me Too” porque producen el mismo efecto del medicamento original. Por ejemplo, en la actualidad tenemos en el mercado 6 estatinas para bajar el colesterol (Mevacor, Lipitor, Zocor, Pravachol, Lescol y el más nuevo, Crestor), y todos son variantes del primero. Como dice la doctora Sharon Levine, directora ejecutiva asociada del Kaiser Permanente Medical Group: “si soy un fabricante y puedo cambiar una molécula, obtener otros 20 años de derechos de patente y convencer a los médicos de que prescriban y exijan a los consumidores la nueva presentación de Prilosec o del Prozac semanal en lugar del Prozac diario, justo cuando vence mi patente, ¿entonces por qué voy a gastar dinero en investigaciones menos seguras, como la búsqueda de nuevas drogas? (p. 50).
En síntesis, la estrategia más utilizada por las compañías productoras y comercializadoras de medicamentos de marca o de genéricos, se relaciona con un conjunto de prácticas bien conocidas en el campo de la tecnología, consistentes en realizar mejoras, modificaciones y adaptaciones de las tecnologías originales, sean estas referidas a máquinas, medicamentos, productos o procesos técnicos.
La situación de la compañía norteamericana Purdue Pharma -principal vendedora de analgésicos en EE. UU.-, y su producto OxyContin, recomendado para combatir el dolor en enfermos de cáncer por ser mucho más potente que la morfina, da cuenta de la complejidad de los procesos planteados por el vencimiento de las patentes. OxyContin nació por una necesidad financiera originada en el vencimiento de la patente del MS Contin, de modo que sus ejecutivos aceleraron el desarrollo del nuevo medicamento a partir de la oxicodona, principio activo del medicamento que perdía la patente. El OxyContin fue comercializado con gran éxito y, dado su alto efecto adictivo, a la compañía se le acusa de ser una de las mayores responsables de la epidemia de opioides que afecta a la población en Estados Unidos. Por este motivo, debió pactar con el estado de Oklahoma una indemnización por 270 millones de dólares. Según el Centro para el Control de Enfermedades (CDC), más de 47.600 estadounidenses murieron por sobredosis de opiáceos en 2017, mientras por razones similares fueron demandadas Johnson & Johnson, y Teva Pharmaceuticals, la mayor farmacéutica de Israel (Pozzi, 2019).
A cambio de inmunidad judicial, en agosto de 2021, la familia Sackler, propietaria de Purdue Pharma, pactó en tribunales la quiebra y disolución de la empresa, y el pago de una indemnización de 4.500 millones de dólares a más de 3.000 demandantes por los estragos que provocó el fármaco. Estragos que, entre la epidemia del sida y la pandemia del coronavirus, contribuyeron a agravar la peor crisis de salud pública en EE UU., al punto de considerar que los muertos por sobredosis de OxyContin en los últimos 20 años alcanzaron las 500.000 personas (Sánchez-Vallejo, 2021).
3.3 Investigación y Desarrollo - I&D
Con relación a este punto, la búsqueda obtuvo 167 resultados, correspondientes al lapso transcurrido entre 1980 y 2020, registrándose un creciente interés en I&D a partir de los años 90 hasta 2018, cuando se inicia el descenso que registra la Figura 6. Probablemente por razones antes anotadas respecto al vencimiento de patentes y el consiguiente patent cliff y por agotamiento de la creatividad en la industria farmacéutica que, luego de la aparición a fines el siglo XX de las denominadas drogas milagro -Prozac, entre otras-, invertirá más en actividades de marketing que en I&D (Holguín, 2014). El descenso en 2015 y luego, a partir de 2018, corrobora lo anotado.
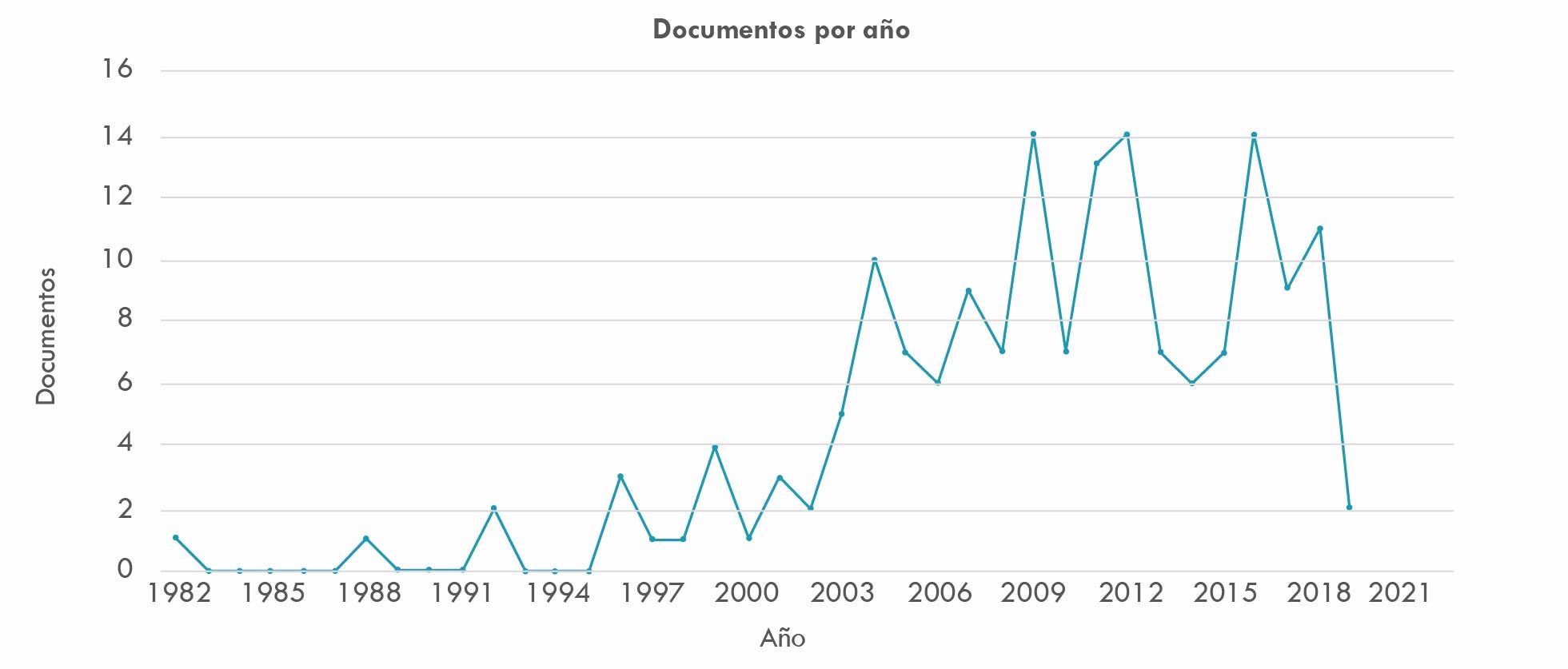
Fuente: elaboración propia basada en consulta de base de datos Scopus.
Figura 6 Investigación y Desarrollo - I&D, 1980-2020
La Figura 7, en la que predominan ítems como farmacología, medicina, bioquímica, ingeniería química y química, revela el creciente dominio de las ciencias exactas, físicas y naturales en sus versiones puras y aplicadas, sobre otras disciplinas.
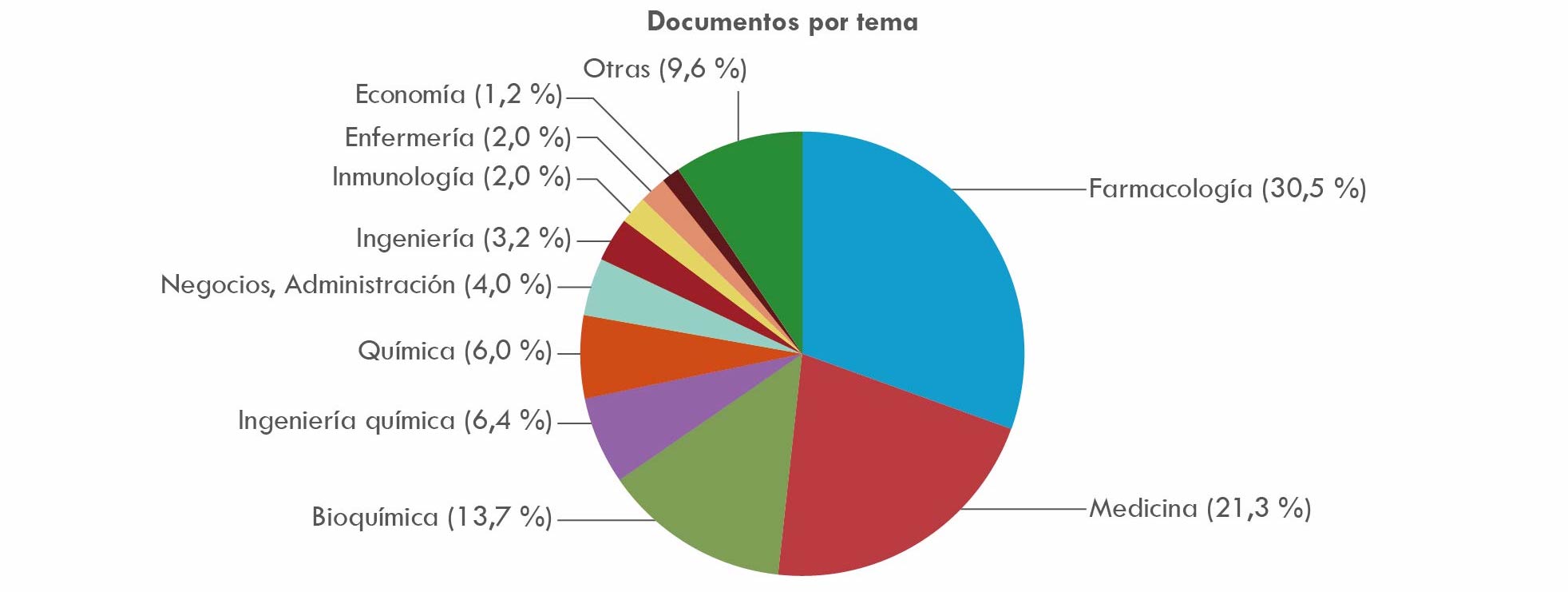
Fuente: elaboración propia basada en consulta de base de datos Scopus.
Figura 7 Artículos sobre investigación y Desarrollo - I&D, 1980-2020
La industria farmacéutica es muy sensible a políticas regulatorias, a presiones de precios y altamente intensiva en capital, siendo su principal barrera de entrada el alto costo de la I&D, que aumentó en Estados Unidos, Japón y Europa cada año: pasó de 29,8 millones de euros en 1995 a 63,14 millones de euros en 2005 (+112% de 1995 a 2005), y a 95,2 millones de euros en 2015 (+51% de 2005 a 2015 y +219% de 1995 a 2015) (Dierks et al., 2018).
Así, ante la creciente dificultad para lanzar al mercado nuevos medicamentos, las farmacéuticas optan por desarrollar los denominados segundos usos, relativos a la comercialización de productos destinados a aliviar o curar una dolencia determinada y que ya estaban en el mercado, pero que pueden ser usados para aliviar una dolencia distinta o para cubrir una necesidad diferente. Esta búsqueda va acompañada del intento exitoso por controlar pequeñas firmas productoras de medicamentos genéricos, en una tendencia a integrar la industria global en dos o tres megacorporaciones.
Por razones de relevancia, buena parte del apartado relativo a I&D se desarrollará en torno a las investigaciones emprendidas para producir una vacuna efectiva contra el COVID-19.
4. La pandemia de COVID-19
A continuación, se presentan varias categorías de análisis del fenómeno.
4.1 La aparición del virus
A partir de las últimas décadas del siglo XX, y favorecidos por la globalización de una economía impulsada en parte por el desarrollo de una industria aeronáutica, que acortó las distancias e intensificó los contactos directos entre los seres humanos, la difusión de virus se ha convertido en un evento de tipo planetario. Pero los virus han hecho parte de anteriores fases de globalización, una vez fue evidente que podían transmitirse de animales a humanos y expandirse rápidamente por vastas zonas del mundo. Tal fue el caso del HIV, que se difundió desde países del centro de África hasta Estados Unidos y Europa, mediando el contacto de humanos con fluidos presentes en la sangre de distintas clases de monos.
La destrucción del hábitat de seres vivos no humanos, causada por la deforestación y el cambio climático, debido principalmente a la cada vez mayor intrusión de seres humanos en la naturaleza, facilitaron que los coronavirus “saltaran” de animales como murciélagos o pangolines a seres humanos, generando la pandemia del COVID-19. Esta pandemia fue antecedida en las últimas décadas por epidemias como la gripe aviar, la gripe porcina, el Zika o el chikunguña, sobre las cuales existe ahora un monitoreo global, como puede verificarse en la reciente serie Pandemic, transmitida por la plataforma Netflix.
Si los virus han acompañado a la humanidad durante toda su historia, algunos de ellos han sido tratados con éxito por lo menos desde 1796 -a finales del siglo XVIII-, cuando el doctor inglés Edward Jenner inventó una vacuna definitiva contra la viruela. Sin embargo, antes de esa fecha se conocieron métodos artesanales de inmunización como la variolización y ya se había experimentado exitosamente con algunas vacunas en Europa. Durante el siglo XIX, científicos como Louis Pasteur en Francia y Edward Koch en Alemania desarrollaron diferentes tipos de vacunas.
Distintos coronavirus se transmiten de animales a humanos desde tiempos inmemoriales, convirtiéndose en diversas épocas de riesgo para la salud de la población mundial. A fines del siglo XX, los científicos desarrollaron vacunas contra este tipo de virus, lo que les permitió contar con plataformas científico-técnicas capaces de brindar respuestas rápidas, una vez se presentó la pandemia del COVID-19. Al comienzo, se pensó en el virus de Wuhan como medianamente contagioso, resultando ser mucho más infeccioso que el virus del SARS y propagándose principalmente por transmisión asintomática (Wright, 2020).
De acuerdo con MacKenzie y Caliskan (2020), los científicos sociales no han logrado establecer cómo se relacionan los virus con las personas, escapando a su visión todo lo que no sea humano, razón que les dificulta integrar en sus análisis a los actores no humanos. Según ellos, mientras nos cubrimos la cara con máscaras respiratorias, en sentido figurado también nos cubrimos los ojos con ciencias sociales incapaces de ver los virus, a pesar de que el trabajo pionero de teóricos sociales como Bruno Latour y Michel Callon demostró la necesidad de incluir plenamente a los actores no humanos en el análisis de sociedades y economías, punto particularmente valioso en los próximos años (MacKenzie y Caliskan, 2020).
Lawrence Wright (2020) presenta una aproximación a los comienzos de la pandemia. De acuerdo con él, el 3 de enero de 2020, Robert Redfield, director del Centers for Disease Control and Prevention de EE. UU., se comunicó con George Fu Gao, director del Chinese Center for Disease Control and Prevention, para preguntarle por la presencia de un nuevo virus en la ciudad de Wuhan, en China. Este confirmó su presencia manifestando que posiblemente el virus circulaba en el país desde noviembre de 2019. Como, según advirtió, no existía evidencia de transmisión de persona a persona, se difundió la teoría más corriente respecto a que probablemente el foco de infección partía de un mercado húmedo de la ciudad, en donde se comerciaba con animales vivos (Wright, 2020). Después circularían versiones respecto a que posiblemente el virus escapó accidentalmente de un laboratorio de China, punto desmentido mediante declaración emitida por una comisión de la Organización Mundial de la Salud - OMS que visitó Wuhan.
El 11 de enero de 2020, el virólogo y biólogo evolutivo de la Universidad de Sydney Edward Holmes anunció que los chinos publicaron en un sitio de acceso abierto denominado virological.org la secuencia del genoma del virus causante de la nueva enfermedad respiratoria, solo 10 días después de reportarse su existencia (Cohen, 2020). A partir de ese momento específico, los investigadores iniciaron una veloz carrera para encontrar una vacuna contra el nuevo virus que, aunque desestimada como competencia por la doctora Gilbert y Green (2021), una de las inventoras de la exitosa vacuna de AstraZeneca contra el COVID-19, corresponde a la dinámica propia de las invenciones e innovaciones en el campo de la ciencia y la tecnología.
4.2 Algunas consecuencias sociales, económicas y políticas del COVID-19
El filósofo británico John Gray (2020) afirma que la crisis por la que atravesamos es un punto de inflexión en la historia, que hace imposible regresar al mundo anterior al COVID-19, puesto que ese mundo representa el status quo causante de la pandemia, y que fenómenos como la globalización y el libre mercado de las últimas décadas crearon las condiciones para su emergencia inevitable.
En ese orden de ideas, la movilidad continua de bienes, capital y seres humanos, facilitada por una industria aeronáutica y de transporte masivo a una escala jamás conocida, se vio interrumpida a causa de la pandemia. Llegó a afrontar su parcial desaparición, seguida de una lenta recuperación que no volverá a alcanzar los picos anteriores a 2019. Un segundo elemento es el fracaso de la tercera o sexta ola de globalización, según se mire (Tilly, 2004; Therborn, 2012), que condujo a la agresiva intervención humana en la naturaleza. Tras señalar que la ortodoxia económica ha fracasado y que los gobiernos intervienen por doquier en la economía, Gray (2020) afirma:
El régimen de la globalización pre pandemia se ha venido abajo, ya se ha desmoronado, ya ha cambiado, en realidad es historia […] es un periodo histórico al que no podemos regresar porque fue el causante de la pandemia, varias señales indican una transformación hacia una clase de sistema o conjunto de sistemas diferentes, la era del apogeo de la globalización ha llegado a su fin. Un sistema económico basado en la producción a escala mundial y en largas cadenas de abastecimiento se está transformando en otro menos interconectado, y un modo de vida impulsado por la movilidad incesante tiembla y se detiene. Nuestra vida va a estar más limitada físicamente y a ser más virtual que antes. Está naciendo un mundo más fragmentado, que, en cierto modo, puede ser más resiliente (p. 43).
La crisis del coronavirus creó condiciones para una creciente intervención del Estado en la economía, llevando a los gobiernos a participar cada vez más en la gestión de sus sistemas de salud descuidados por décadas. Se han centralizado decisiones relacionadas con la vida de sus asociados, como las cuarentenas o las exigencias de pasaportes sanitarios, sin que quede claro hasta qué punto se afectan las libertades civiles, mientras florecen movimientos sociales en todo el planeta. Las cadenas de suministros globales, organizadas bajo el principio del Justo a Tiempo, tienden a colapsar, interrumpiéndose como consecuencia de la escasez de contenedores y de semiconductores o de la especulación con los mismos. A ello se suma la progresiva virtualización de las actividades que lo permiten, como ocurre con la educación en casi todos los niveles, pero también con la comercialización de bienes y servicios que operan con el soporte de plataformas tecnológicas y algoritmos, desde empresas como Amazon o Rappi, que en pandemia han logrado ganancias fabulosas. Como dejamos anotado, la pandemia se enlaza con las tecnologías denominadas de Cuarta Revolución Industrial, profundizando su impacto.
Pero el COVID-19, como todos los fenómenos de gran impacto que involucran a la naturaleza con la sociedad, ha abierto posibilidades de reformas sociales, políticas y económicas de gran calado, tanto en el sentido de profundizar desigualdades sociales y acrecentar formas de acumulación de riqueza y de pobreza en dos polos de la sociedad, como en el de avanzar en la mejora de las condiciones de los asalariados y, en general, de los desfavorecidos por la sociedad. Dada la doble naturaleza de la combinación de fenómenos naturales y sociales asociados al COVID-19, parece haber lugar tanto para la distopía como para la utopía (Celis-Ospina et al., 2021).
Desvanecida la posibilidad de planear el porvenir a largo plazo, alguna evidencia empírica permite pensar el futuro a partir de cierto tipo de analogía con el pasado. Retomando a Walter Scheidel (2019), Celis-Ospina et al. (2021) plantean que los grandes niveladores de la humanidad se relacionan con fenómenos sociales y naturales como la violencia de las revoluciones, la guerra, el colapso de los Estados y las grandes epidemias; de forma específica, la plaga de Justiniano en 541, la peste negra de siglo XIV o la viruela, que arrasó imperios precolombinos, transformaron las estructuras de poder de las sociedades que las padecieron. Las pandemias generaron efectos no esperados relacionados con aumentos de salarios, baja de tasas de interés y reducción del precio de la vivienda en Europa (Scheidel, 2019).
Fenómenos similares ocurren en la sociedad global en el curso de la pandemia, algunos asociados parcialmente con cambios políticos recientes en EE. UU., Chile, Bolivia, Perú, Ecuador, o con el mayor o menor éxito de jefes de Estado de diversas latitudes. En el caso colombiano, resulta difícil disociar la pandemia del levantamiento iniciado el 28 de abril de 2021, que condujo a la caída de una reforma tributaria y del ministro de economía que la promovía. Al tiempo que desataba un conjunto de movilizaciones quizá solo comparable en intensidad, envergadura, duración y violencia a los sucesos del 9 de abril de 1948.
4.3 Pandemias en la historia
Una breve síntesis lleva a considerar las principales pandemias en la historia. Destaca en la antigüedad la Plaga de Justiniano en los años 541-542 de nuestra era, que probablemente cobró la vida de entre 25 y 50 millones de personas: entre el 13 y el 26 % de la población (Scheidel, 2019; Crespo-Garay, 2021). La Peste Negra, ocurrida entre 1347 y 1351, produjo entre 75 y 200 millones de muertos, considerándose la más devastadora de la historia de la humanidad. Inició quizá en Asia Central, se extendió por rutas comerciales hacia Europa, a través de Crimea, Constantinopla y los puertos italianos o provenzales del Adriático y del Golfo de Lion; se presume que el bacilo se transmitió a través de ratas, pulgas, caravaneros y marineros (Le Roy Ladurie, 2017; Crespo-Garay, 2021).
Hacia 1520 la viruela cobró la vida de 56 millones de personas (Crespo-Garay, 2021), mientras la gripe española de 1918-1919 produjo alrededor de 50 millones de muertes y se originó en un cuartel del ejército norteamericano situado en Kansas. El contagio provino de granjas cercanas en donde patronos y trabajadores tenían contacto con animales domésticos (Rhodes, 2021; Crespo-Garay, 2021). Más reciente es la epidemia del VIH/SIDA, detectada en 1981 y causante de la muerte de entre 25 y 35 millones de personas (Crespo-Garay, 2021). Le Roy Ladurie (2017) concluye que los daños de tipo viral o microbiano que engendra, en periodos diversos, la facilidad creciente de contactos y de transportes, han dado más de una vez la vuelta al mundo gracias a pasajeros transportados en jets. El peligro de contagio facilitado por la tecnología supersónica es real.
Cuando aún no se conocía la vacuna contra el COVID-19, las autoridades sanitarias y políticas impusieron severas restricciones que incluyeron cuarentenas, uso de mascarillas, distanciamiento social y lavado frecuente de manos. Michel Foucault (2002) escribió páginas memorables respecto a estas formas de control social, basándose en reglamentos usados en las ciudades europeas durante las emergencias de la peste en el siglo XVIII. Estas incluyen cierre de ciudades, estricta división espacial, control de viviendas y de suministro de alimentos para evitar encuentros físicos, y graves sanciones para quien burla las cuarentenas. Mientras individuos de poca monta trasladan cadáveres a sitios en donde no constituyan peligro. La mirada se convierte en mecanismo de poder para establecer la vigilancia, pues “contra la peste que es mezcla, la disciplina hace valer su poder que es análisis”, penetrando el poder de los reglamentos hasta los últimos detalles de la existencia de los seres humanos (Foucault, 2002, p. 125).
Axel Honneth (2020) ha puesto en duda este biopoder y esta biopolítica, al considerar que la crisis del COVID-19 obligó a los regímenes democráticos a revisar públicamente sus valores morales, culturales y políticos. Estos últimos basados en constituciones escritas o no escritas. Mientras concluye que los gobiernos más eficaces dependen en gran medida de un sistema de salud transparente, bien equipado y financiado con fondos públicos, cuyo objetivo debería ser brindar atención a todos, independientemente de su posición social, orientación sexual o identidad cultural. De modo que realmente ocurre lo contrario de lo augurado por los defensores del paradigma del biopoder foucaultiano (Honneth, 2020) (ver Figura 8).
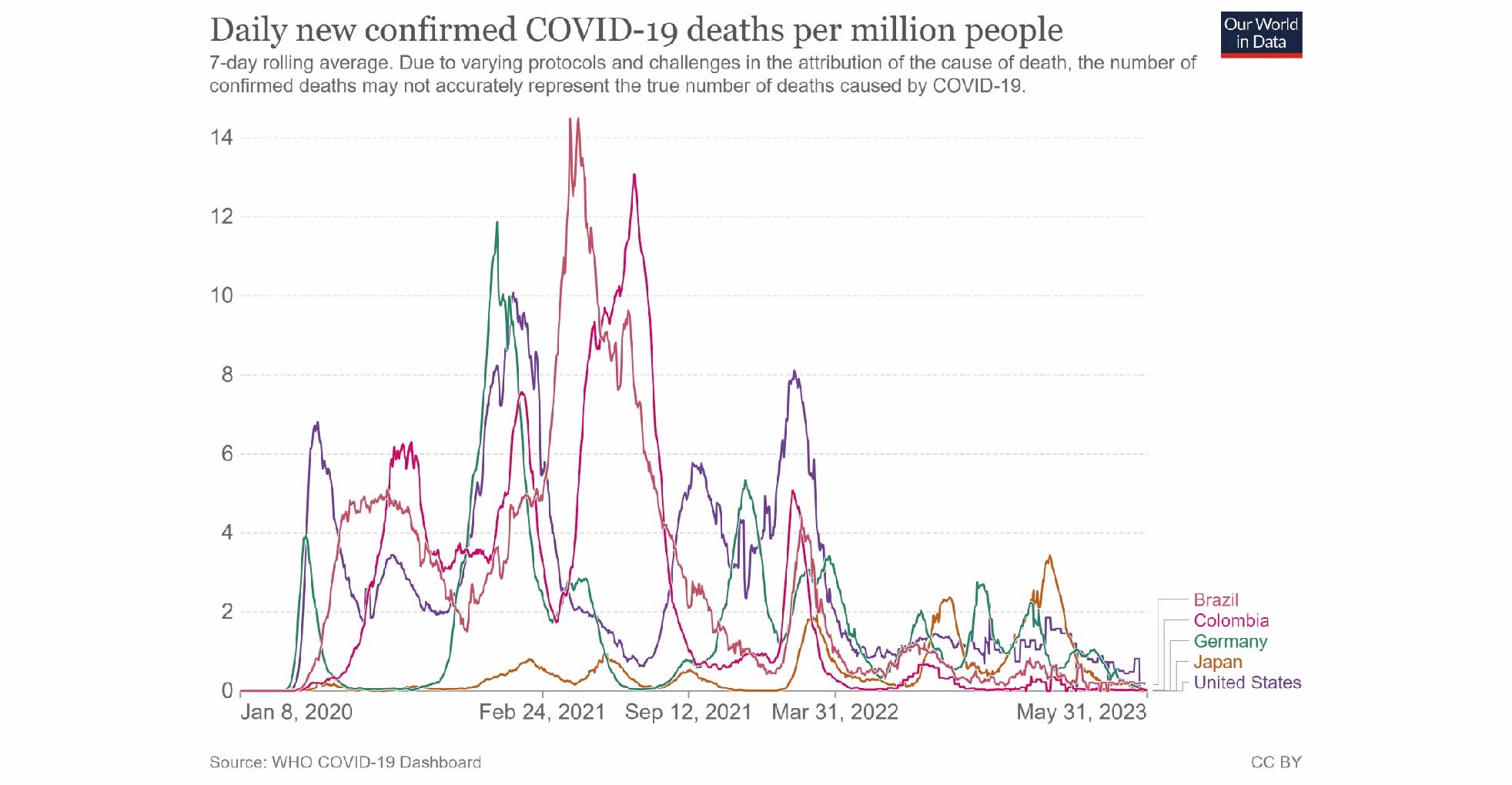
Fuente: tomado de Our World in Data (s. f.).
Figura 8 Infectados y muertos por coronavirus a nivel mundial. Enero de 2020 a agosto de 2021
4.4 I&D y la búsqueda de una vacuna contra el COVID-19
El desarrollo de un medicamento nuevo, como una vacuna contra el COVID-19, comporta un alto grado de complejidad. En el pasado, inventar un medicamento carecía de protocolos específicos, de modo que la experimentación solía ser brutal, como ocurría con innovaciones asociadas al llamado “modelo salvaje” atribuido al médico francés Justin-Besançon. En la actualidad, los procedimientos son cada vez más rigurosos y ajustados a la ética científica y médica (Pignarre, 2005).
Experimentados científicos como John Rhodes (2021) describen el proceso de crear una vacuna como un largo y costoso viaje, plagado de trampas, asociado a fracasos y frustraciones. De acuerdo con él, el desarrollo de una vacuna pasa por 6 fases: en la etapa 1 o exploratoria, intensiva en investigación, se identifican los componentes del patógeno que se incluirán en la vacuna. En el caso del coronavirus, se toma un componente de los picos de la corona que rodea a la estructura genética del virus, otros incluyen una parte mayor del virus o el virus completo inactivado, identificando en él un antígeno. En la etapa 2 o preclínica, se usan técnicas de cultivo de tejidos y estudios en animales para establecer si la vacuna en desarrollo producirá inmunidad, analizando anticuerpos que puedan neutralizar al virus e identificando efectos adversos como inflamación excesiva, siendo corriente la experimentación en pequeños grupos de primates como los macacos rhesus a los que se infecta con el virus vivo (Rhodes, 2021). Este tipo de mono, utilizado porque su código genético es similar al de los seres humanos, está en la base de la invención de la vacuna de Oxford - AstraZeneca en el laboratorio de Oxford dirigido por la doctora Sarah Gilbert (Gilbert y Green, 2021).
La mayor parte de los proyectos no logra rebasar esta etapa crucial en el descubrimiento de vacunas, porque es aquí donde se identifican efectos dañinos o respuestas inmunes insuficientes. En esta fase, los laboratorios envían solicitudes de autorización dirigidas a la FDA en Estados Unidos o a la Agencia Europea de Medicamentos - EMA, en la Unión Europea, que darán un veredicto en un plazo cercano a 30 días. En la etapa 3, comienzan los ensayos de fase I, entonces los investigadores experimentan la vacuna candidata en grupos de menos de 150 personas, tratando de determinar su seguridad. Por vía de ejemplo, un estudio de fase I en China midió la capacidad de los anticuerpos de la vacuna para desactivar o neutralizar el virus presente en la proteína pico del SARS-CoV-2 (Rhodes, 2021).
En la etapa 4, se inician los ensayos de fase II, que implican vacunar a centenares de seres humanos, sujetos de experimentación. Busca establecer seguridad y eficacia, además de medir respuestas inmunes de la vacuna en prueba, dosis óptimas y probables calendarios de vacunación. En la etapa 5, se inician ensayos de fase III, que incluyen a miles de sujetos y prestan especial atención a los efectos secundarios, más fácilmente detectables en grupos de prueba de gran tamaño (Rhodes, 2021). En esta fase, las compañías farmacéuticas muestran interés en financiar determinada vacuna en prueba, lo que según algunos analistas significa que la industria es muy conservadora y no realmente innovadora, aunque proporciona infraestructura, laboratorios e instalaciones para fabricar vacunas a escala industrial, junto con estructuras de comercialización. La etapa 6 implica que se superaron con éxito las tres fases de ensayos clínicos, procediéndose a enviar una solicitud de licencia de productos biológicos a la FDA o a la EMA, máximas autoridades en el mundo de la regulación de medicamentos (Rhodes, 2021).
Como señalamos anteriormente, en referencia a la doctora Gilbert, una vez aparece una epidemia, se inicia una dura competencia para producir un fármaco eficaz en el tratamiento de la enfermedad de que se trate. Pierre Bourdieu (2003) ha explorado en profundidad estas luchas por el control de un campo. En este caso, el campo científico de fabricación de vacunas, de modo que quien logre imponerse se hará acreedor a los beneficios materiales y simbólicos relacionados con la producción de una cura exitosa.
La experiencia china en investigación con virus y el proyecto de producir una vacuna contra el ébola hacían esperar que del laboratorio del ejército de la República Popular China, a cargo de la epidemióloga Chen Wei, vendrían las primeras soluciones. Aunque ese país produjo vacunas muy efectivas como Sinovac y Sinopharm, hoy ampliamente difundidas en los programas de vacunación de buena parte del mundo, las soluciones más efectivas se originaron en laboratorios de países del primer mundo. Particularmente, en EE. UU., con las vacunas Pfizer - BioNTech, Moderna, Janssen de la farmacéutica Johnson & Johnson y Novavax; de Gran Bretaña con Oxford - AstraZeneca; y de Rusia, con Sputnik V del Instituto Gamaleya.
Todas las vacunas desarrolladas hasta el presente han contado con financiación estatal y con el compromiso de compra por parte de los Estados, lo que significa que los laboratorios fabricantes trabajan con recursos anticipados por los gobiernos de Estados Unidos y la Unión Europea. Sin embargo, se han negado a liberar las patentes, de modo que ante la imposibilidad de fabricar libremente la vacuna, se prolonga la pandemia con las consiguientes pérdidas de vidas humanas y daños económicos y sociales globales. Las naciones ricas de Occidente, que representan solo el 14% de la población mundial, han comprado el 53% de todas las vacunas COVID-19 más prometedoras y tendrán muchas veces las vacunas que necesitan para toda su población. Las dos vacunas líderes hasta la fecha, Pfizer y Moderna, vendieron a los países ricos más del 82% y 78%, respectivamente, de las dosis que pueden producir para fines de 2022, contrastando con casi 70 países de ingresos bajos que solo podrán vacunar a una de cada diez personas el próximo año (Dearden, 2021).
El 4 de marzo de 2021 estaban en prueba en Estados Unidos más de 200 vacunas, unas 190 se encontraban en experimentación con animales y en experimentos de laboratorio; 20 se encontraban en fase 1, probándose en un pequeño número de jóvenes sanos para evaluar seguridad y dosis correcta; 22 se encontraban en fase 2, probándose en grupos más grandes de personas, incluyendo aquellos con mayor riesgo de enfermedad; 16 se encontraban en fase 3, probando su eficacia y seguridad en miles de personas; y 3 habían sido autorizadas por la FDA, pues garantizaban beneficios superiores a riesgos conocidos y potenciales (Steckelberg et al., 2021).
La primera vacuna aprobada por FDA fue desarrollada conjuntamente desde enero de 2020 por la farmacéutica norteamericana Pfizer y la pequeña firma alemana BioNTech. En noviembre del mismo año, registraba una efectividad del 90%, obteniendo autorización de emergencia el 11 de diciembre. La segunda vacuna fue desarrollada por Moderna en asociación con The National Institute of Allergy and Infectious Diseases. El 27 de febrero de 2021 fue autorizada la vacuna de inyección única de Johnson & Johnson y el 3 de febrero se autorizó la vacunación con Oxford AstraZeneca. El desarrollo de la primera vacuna, -Pfizer - BioNTech-, tuvo una duración de 11 meses, tiempo récord en un proceso que solía tomar años. Por ejemplo: polio, 7 años; sarampión, 9 años; varicela, 34 años; paperas, 4 años; VPH, 15 años. Por este motivo, se llegó a afirmar que la emergencia había obligado a saltarse etapas, lo que no está corroborado (Steckelberg et al., 2021).
Las vacunas de Pfizer-BioNTech y Moderna significan hasta ahora el mayor avance tecnocientífico en el desarrollo de una vacuna. Son las primeras que utilizan tecnología ARN mensajero o ARNm en humanos, dado que emplean ácido ribonucleico para lograr el desarrollo de una respuesta inmune y, a diferencia de las vacunas normales, en estas no se administran agentes vivos atenuados ni fragmentos de virus, eliminando el riesgo de provocar la enfermedad que se busca prevenir. En términos concretos, el ARNm transporta instrucciones genéticas para construir la proteína de pico basada en la secuencia genética del COVID-19 y, una vez las células se encuentran dentro de una persona vacunada, producen la proteína, provocando una respuesta del sistema inmunológico. La experimentación con ARNm venía siendo desarrollada por Katalin Kariko, científica húngara, y Drew Weissman, de EE. UU, en laboratorios de este país desde los años noventa del siglo XX (Johnson, 2020; Wadman, 2020).
Las tecnologías usadas hasta ahora contra el COVID-19 se basan en vacunas de vector viral, de ARNm, de virus inactivados, registrándose que recientemente una vacuna basada en proteínas recombinantes, «fabricada por células de polilla aprovechadas para producir la proteína de pico del virus, que el patógeno usa para invadir células humanas, la vacuna de Novavax, eclipsó a los principales competidores en medidas clave en las primeras pruebas en humanos y en monos». Así, se convierte en la primera vacuna de su tipo producida por Novavax (Corum y Zimmer, 2021; Cuppini, 2021).
Como síntesis, se registra que, a fines de agosto de 2021, 5 vacunas habían sido terminadas, 223 permanecían en ensayos preclínicos, 30 se encontraban en fase I, 30 en fase I/II, 10 en fase II, 25 en fase III y 8 en fase IV. De estas, 19 se encontraban en uso. En cuanto al método para desarrollarlas, 39 correspondían a ARN, 27 a DNA, 39 a vector no replicating, 25 a vector replicating, 24 a virus inactivado, 3 a virus vivo atenuado, 106 incluían una subunidad de proteína, 25 incluían una partícula del virus y 38 correspondían a metodologías desconocidas (Our World in Data, s.f.). Presumiéndose que dentro de ellas figuraban dos tipos de vacunas cubanas de gran efectividad: Abdala y Mambisa, desarrolladas por el Centro de Ingeniería Genética y Biotecnología (CIGB), y Soberana 01, Soberana 02 y Soberana Plus, a cargo del Instituto Finlay de Vacunas (IFV).
Aunque el COVID-19 presenta bajas tasas de mutación, los científicos han detectado distintas variantes diferentes a la cepa inicial de Wuhan, preocupantes por presentar mayor velocidad de contagio. Algunas de ellas se asocian a mayor mortalidad, mientras las vacunas conocidas presentan menor efectividad para combatirlas; han sido clasificadas en linajes: Variante Alpha B.1.1.7, identificada por primera vez en el Reino Unido; Variante Beta B.1.351, proveniente de Sudáfrica; Variante Gamma B.1.1.28, proveniente de Brasil; Variante Delta, B.1.617.2, detectada en India (Cai et al., 2021). Se han identificado distintas mutaciones asociadas a esas variantes como N501Y, E484K, P681R, L52R, y se ha informado recientemente que una tercera dosis de la vacuna china Sinovac podría presentar una respuesta eficaz a distintas variantes. A las anteriores, se suma la altamente contagiosa Ómicron y la variante Mu, proveniente de Colombia.
5. Conclusiones
La investigación proponía inicialmente indagar acerca de las transformaciones ocurridas en tres firmas farmacéuticas de la región vallecaucana, durante las últimas décadas del siglo XX y las dos primeras del siglo XXI, centrándose en la evolución de tres variables fundamentales: 1) políticas de fusiones y adquisiciones; 2) evolución de políticas de patentes; y 3) procesos de Investigación y Desarrollo - I&D. El curso de las indagaciones se vio interrumpido por la emergencia del COVID-19, situación que obligó a modificar la estrategia metodológica, sustituyendo la observación in situ por investigación documental.
La consulta de la base de datos SCOPUS permitió establecer que los procesos de fusiones y adquisiciones emprendidos a nivel global por la industria farmacéutica tuvieron un desarrollo normal hasta los años noventa del siglo XX. A partir de allí, inició lo que algunos autores denominaron como “la manía de las fusiones y adquisiciones”, que alcanzó especial intensidad a finales de la segunda década del siglo XXI, sobreviniendo luego un agudo descenso. Las fusiones de firmas corresponden a un proceso de concentración global de la industria que permite acceder a la elaboración de nuevo conocimiento y nuevos medicamentos, ahorrar costos en investigación y desarrollo - I&D, recortar plantas de personal y reducir contribuciones fiscales.
Respecto a la política de patentes, el estudio permitió establecer que los cambios en la legislación pertinente en EE. UU. ampliaron el campo de lo patentable, llegando a incluir materia viva, ecuaciones y algoritmos, lo que generó un impacto mundial sobre toda la industria. La investigación en patentes observa un patrón similar al de las fusiones y adquisiciones durante el mismo período, es decir, un notable ascenso en la intensidad del patentamiento, que parte de los años 90 y alcanza niveles máximos en los últimos cinco años, para perder posteriormente impulso e iniciar su descenso. Las razones de tales tendencias parecen obedecer al creciente vencimiento de las patentes, fenómeno que precipita lo que los analistas denominan patent cliff, que genera enormes pérdidas económicas derivadas de la extinción de la patente sobre un medicamento. Situación altamente relacionada con la pérdida de creatividad de la industria, que se evidencia en la dificultad para descubrir nuevos principios activos o moléculas curativas.
La investigación en procesos de Investigación y Desarrollo - I&D presenta un curso normal desde los años setenta hasta los noventa del siglo XX, cuando se intensifica su actividad, coincidiendo con la aparición de las denominadas drogas milagro, el creciente vencimiento de las patentes, la crisis de creatividad del sector y el desarrollo de segundos usos, presentes en medicamentos derivados de otros ya conocidos. En la medida en que la industria requiere altas inversiones en I&D, puesto que se basa en conocimiento científico complejo producido en universidades y laboratorios independientes, los grandes jugadores de la industria, que operan a nivel mundial, establecen barreras de entrada que dificultan la labor de los fabricantes de medicamentos genéricos e intensifican una tendencia a absorberlos dentro de grandes corporaciones.
La emergencia del COVID-19 parece presentar una nueva oportunidad a la industria farmacéutica. La rápida respuesta de los científicos en el desarrollo y fabricación de vacunas contra el virus, que produjo novísimos desarrollos científico-técnicos como las vacunas basadas en ARN mensajero, requirió de enormes inversiones e infraestructuras para fabricar y comercializar masivamente las vacunas. Se observaron fusiones temporales de compañías, acuerdos de financiación estatal de proyectos y contratos para el suministro de vacunas a los gobiernos de todo el mundo. Sin embargo, el endurecimiento de la política de patentes, desarrollado a partir de los años 80 del siglo XX en Estados Unidos, permanece invariable en el escenario de la pandemia, pese a los reclamos de los países de menor desarrollo económico, social y político.