Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Colombia Médica
On-line version ISSN 1657-9534
Colomb. Med. vol.37 no.1 Cali Mar. 2006
Microorganismos inusuales en surcos y bolsas periodontales*
Marisol Betancourth, Bact.1, Roger Arce, O.D.2, Javier Botero, O.D.2, Adriana Jaramillo, O.D., Mag.2, Carlos Cruz, Lic. Mat.2, Adolfo Contreras, O.D., Ph.D.3
* Este estudio fue financiado en parte por COLCIENCIAS (N° 13080413001) y por la Universidad del Valle, Cali, Colombia. e-mail Grupo Medicina Periodontal: inv-odon@univalle.edu.co
1. Profesora Auxiliar, Escuela de Bacteriología, Facultad de Salud, Universidad del Valle, Cali, Colombia. e-mail: maripiri@telesat.com.co
2. Profesor Auxiliar, Escuela de Odontología, Facultad de Salud, Universidad del Valle, Cali, Colombia. e-mail: inv-odon@univalle.edu.co drjavo@yahoo.com
3. Profesor Titular, Escuela de Odontología. Facultad de Salud, Universidad del Valle, Cali, Colombia. e-mail: adolfoco@yahoo.com
Recibido para publicación diciembre 14, 2004 Aceptado para publicación enero 17, 2006
RESUMEN
Introducción: Los microorganismos de la familia Enterobacteriaceae, los bacilos Gram negativos no fermentadores y ciertas especies de Candida se han considerado como inusuales en quienes sufren enfermedad periodontal, y en ellos el tratamiento mecánico o antimicrobiano puede ser poco efectivo para resolver o controlar la progresión de la enfermedad.
Objetivos: Analizar los perfiles microbiológicos en individuos sanos y en pacientes con diagnóstico de periodontitis crónica y periodontitis agresiva, determinar la frecuencia de los microorganismos inusuales y las posibles asociaciones con algunos microorganismos periodontopáticos en la base de datos del laboratorio de microbiología oral y periodontal en Cali.
Materiales y métodos: Se estudiaron los informes microbiológicos de 356 pacientes en un período de 41 meses. Las variables analizadas fueron: diagnóstico periodontal, recuento total de colonias, porcentaje de aislamiento de diez microorganismos periodontopáticos y de otros inusuales como miembros de la familia Enterobacteriaceae, bacilos Gram negativos no fermentadores y levaduras.
Resultados: Se analizaron 202 (56.7%) informes de pacientes con periodontitis crónica, 139 (39.1%) de periodontitis agresiva y 15 (4.2%) de individuos periodontalmente sanos. La presencia de microorganismos inusuales de tipo entérico fue 36% y la prevalencia de levaduras 7% en las personas con periodontitis. No se encontraron diferencias significantes entre los tres diagnósticos clínicos con respecto a la presencia de microorganismos entéricos y levaduras. La mayor prevalencia de organismos entéricos correspondió a los géneros Klebsiella, Enterobacter y a bacilos Gram negativos no fermentadores. Se encontraron asociaciones estadísticamente significativas entre la presencia o ausencia de microorganismos infrecuentes con la de algunos microorganismos periodontopáticos en los individuos con enfermedad periodontal.
Discusión y conclusiones: La microbiota inusuales de los pacientes incluidos en este estudio presentó una mayor proporción de bacilos Gram negativos entéricos. Las bacterias entéricas encontradas se caracterizan por ser agentes oportunistas para el hombre. Se requieren más estudios para determinar el papel que los microorganismos inusuales pueden tener en la patogénesis y/o progresión de la enfermedad periodontal.
Palabras clave: Microorganismos inusuales; Microorganismos periodontopáticos; Microbiota subgingival; Periodontitis crónica; Periodontitis agresiva.
Unusual microorganisms in gingival sulcus and periodontal pockets
SUMMARY
Introduction: Microorganisms of the Enterobacteriaceae family, non-fermentative Gram negative rods and species of Candida (yeast) have been considered as unusual microorganisms in patients with periodontitis, where antimicrobial and mechanical treatment have been often ineffective to solve or control the disease progression.
Objectives: To analyze the microbiological profiles in periodontally healthy individuals, and in chronic and aggressive periodontitis patients; to determine the frequency of detection of unusual microorganisms and the possible associations with some periodontopathic bacteria in an oral microbiology laboratory database in Cali.
Material and methods: Microbiological reports of 356 patients were analyzed in a period of 41 months. The variables were periodontal diagnosis, total colony counts, percentage of isolation of ten periodontal bacteria, Enterobacteriaceae spp; non-fermentative Gram negative rods and yeasts were also included in the analyses.
Results: Reports of 202 (56.7%) patients with chronic periodontitis, 139 (39.1%) of patients with aggressive periodontitis and 15 (4.2%) of periodontally healthy individuals were found. The presence of unusual microorganisms of the Enterobacteriaceae family was 36% and the prevalence of yeast was 7% in the periodontitis patients. Among the three clinical diagnoses no significant differences were found with respect to the presence of enteric organism and yeasts. The greatest prevalence of enteric organisms belonged to Klebsiella spp, Enterobacter and non-fermentative Gram negative rods. Significant associations were found between the presence and absence of unusual microorganisms related to Actinobacillus. actinomycetemcomitans.
Discussion and conclusions: The unusual microbiota in these patients was conformed mostly by Gram negative enteric rods. These microorganisms are characterized by being opportunistic species for humans. More studies are required to establish the role of these unusual microorganisms in the pathogenesis of periodontal disease.
Key words: Unusual microorganisms; Periodontal pathogens; Subgingival microbiota; Chronic periodontitis; Aggressive periodontitis.
La enfermedad periodontal compromete los tejidos de soporte del diente. Comprende la gingivitis que afecta los tejidos superficiales de protección periodontal y la periodontitis que ataca y destruye los elementos de sostén a través de un proceso inflamatorio iniciado por la biopelícula dental. En los Estados Unidos de América (EUA), alrededor de 25% a 30% de los sujetos mayores de 30 años, sufren de algún grado de enfermedad periodontal, desde ligera inflamación con sangrado al sondeo hasta pérdida de inserción severa, incluyendo 3.1% de periodontitis severa1,2. En Centroamérica y Suramérica, faltan estudios detallados sobre la prevalencia de la enfermedad periodontal. Los datos de Brasil, Argentina y Chile muestran cifras de periodontitis severa de 5.5%, 10% a 49% y 50%, respectivamente3. En Colombia, se presenta una pérdida de inserción periodontal de 50.2% que incluye 1.2% de pérdida de inserción severa en sujetos con más de 30 años4. En África, los mayores de 25 años muestran una pérdida de inserción periodontal severa entre 18% y 99%5. Según Albandar2, la enfermedad periodontal también afecta poblaciones en vía de desarrollo, donde hay aspectos genéticos, culturales e individuales que tienen una influencia importante en su desarrollo.
La etiología de la enfermedad periodontal implica la participación de ciertas bacterias facultativas y anaerobias que se localizan junto con otras en el espacio subgingival del diente para conformar la denominada microbiota subgingival. En ella, reconocidos patógenos periodontales como Actinobacillus actinomycetemcomitans, Porphyromonas gingivalis, Tannerella forsythia6 (Bacteroides forsythus), Campylobacter rectus, Eubacterium nodatum, Fusobacterium nucleatum, Peptostreptococcus micros, Prevotella intermedia, Prevotella nigrescens, Dialister pneumosintes y Treponema denticola, actúan en conjunto o independientemente para iniciar el proceso inflamatorio que produce la periodontitis7. Sin embargo, no se conocen todas las especies comprometidas en el desarrollo de la enfermedad periodontal. Así, desde hace algunos años se muestra interés por especies bacterianas poco frecuentes en la microbiota subgingival y que podrían contribuir con la patogenia periodontal en personas que no responden adecuadamente a la terapia convencional8. Dentro de esos microorganismos se citan especies de la familia Enterobacteriaceae, bacilos Gram negativos no fermentadores como especies de Pseudomonas, y también algunos otros como levaduras y estafilococos. La característica que comparten los microorganismos inusuales es la de ser patógenos oportunistas, es decir, que se consideran parte de la microbiota normal en determinados sitios anatómicos y aprovechan las condiciones de inmunodepresión para generar o agravar una enfermedad.
La familia Enterobacteriaceae comprende un amplio grupo de microorganismos que forman parte de la microbiota normal del tracto gastrointestinal en humanos y animales. Poseen diversos factores de virulencia como la cápsula, que impide la unión de los anticuerpos a la bacteria, las fimbrias que promueven la adherencia a las superficies mucosas y diversas enzimas líticas como las hemolisinas que tienen efecto sobre los eritrocitos y los leucocitos9. El lipopolisacárido presente en la pared celular de estos microorganismos, posee un alto grado de antigenicidad por su fracción polisacárida y de toxicidad por la fracción lipídica (lípido A). La mayoría de especies bacterianas pertenecientes a la familia Enterobacteriaceae son patógenos oportunistas de vías urinarias, tracto respiratorio, piel, tejidos blandos y cavidades estériles9,10.
Dentro de la cavidad oral, las enterobacterias permanecen en muy bajas proporciones como microbiota normal11. Se ha descrito el componente bacteriano de diversos sitios de la boca, con 1.2% de Enterobacteriaceae en el fluido gingival crevicular; en la lengua, 3.2%; y en la saliva, 2.3%, mientras que en la placa bacteriana supragingival resultó indetectable11.
Otros organismos que hacen parte del tracto gastrointestinal y que comparten con las Enterobacteriaceae la designación de «bacilos entéricos» comprenden miembros de los géneros Pseudomonas y Acinetobacter9. P. aeruginosa, una de las especies más patógenas en el hombre, posee características invasoras y toxigénicas que le permiten iniciar un proceso infeccioso. La presencia de fimbrias, de un exopolisacárido mucoso (glicocálix) y la secreción de enzimas proteolíticas como elastasas y fosfatasa alcalina le facilitan la adherencia y degradación de diversos tejidos con la subsecuente diseminación a un nuevo sitio en el hospedero. Además, la presencia del lipopolisacárido como en los demás Gram negativos, le permite inducir una respuesta inflamatoria por parte del hospedero12.
Dentro del grupo de las levaduras, el género Candida predomina entre las demás como microbiota normal del tracto gastrointestinal del hombre y con frecuencia se asocia con infecciones en personas inmunodeprimidas. C. albicans puede invadir el tejido conectivo gingival, inhibir la función de los leucocitos polimorfonucleares neutrófilos, producir enzimas como colagenasas, fosfolipasas, proteasas o adherirse a prótesis dentales para establecer un proceso patológico bucal13.
Varios estudios epidemiológicos en algunos países han mostrado diversas prevalencias de organismos inusuales en individuos con periodontitis. La presencia de levaduras como especies de Candida se ha informado en pacientes estadounidenses con periodontitis refractaria (16.8%)14, noruegos con periodontitis (17.5%)15, y en personas bajo terapia mecánica y antimicrobiana donde se elevan hasta 10 veces su valor basal (8.7 x 102 levaduras por ml a 1.5 x 103 levaduras por ml)16.
Los organismos de las familias Enterobacteriaceae y Pseudomonadaceae se definen como superinfectantes en periodontitis, pues parecen estar sobreagregados a la infección producida por los periodontopáticos reconocidos14,16-26. Sin embargo, su prevalencia varía ampliamente entre regiones geográficas y poblaciones estudiadas con rangos desde 14% en los Estados Unidos de América22, 61% en rumanos18, con 67% en pacientes dominicanos23 hasta 92% en sudaneses17. Barbosa et al.27 en el Brasil, mostraron una prevalencia de bacilos entéricos Gram negativos y especies de Pseudomonas de 31.2% en 80 sujetos con periodontitis. En Colombia se han encontrado 39.2% de bacilos entéricos en individuos con enfermedad periodontal severa y de 32% con periodontitis agresiva y crónica28,29.
Los organismos entéricos, no sólo se han descrito en sujetos con compromiso periodontal, sino también en la boca de otros con riesgo de desarrollar infecciones sistémicas, demostrando que algunos pueden ser portadores de organismos potencialmente patógenos30-36. Estas bacterias además se han aislado en personas que usan prótesis removibles o totales, y se ha descrito su posible asociación con la halitosis en seres humanos37.
Los microorganismos inusuales muestran amplia resistencia a los antibióticos que se emplean como coadyuvantes en la terapia periodontal. Existen investigaciones donde se muestra que 10% de los pacientes con periodontitis refractaria poseen organismos de las familias Enterobacteriaceae y Pseudomonadaceae8,14,21,22 con resistencia a los antibióticos usados regularmente para tratar las periodontitis como amoxicilina, doxiciclina, metronidazol y tetraciclinas y una menor susceptibilidad a antimicrobianos como la clorhexidina24,25.
Las variaciones en el número de organismos entéricos entre los diversos estudios también podrían tener relación con los procedimientos microbiológicos. Se ha demostrado que el tiempo transcurrido entre la toma de la muestra y su procesamiento en el laboratorio influye en la proporción de los organismos porque los bacilos entéricos Gram negativos proliferan en los medios de transporte y así su presencia se puede sobreestimar17.
Este artículo presenta la prevalencia de microorganismos inusuales en 356 perfiles microbiológicos de individuos sanos y con enfermedad periodontal en un laboratorio de microbiología oral y periodontal.
METODOLOGÍA
Diseño metodológico y muestra.Se estudiaron los informes microbiológicos de 356 colombianos procedentes del departamento del Valle del Cauca sobre todo de Cali, en el período entre enero, 2001 y mayo, 2004 (41 meses). Se tomaron en cuenta los resultados de cultivo microbiológico de pacientes con diagnóstico de periodontitis crónica (PC), periodontitis agresiva (PA) e individuos periodontalmente sanos, de acuerdo con los criterios de inclusión de la Academia Americana de Periodoncia (AAP)38. El diagnóstico clínico fue establecido por parte de periodoncistas previamente calibrados. Las variables estudiadas fueron: diagnóstico periodontal, recuento total de colonias (TCC), porcentaje de aislamiento de los microorganismos A. actinomycetemcomitans, Porphyromonas gingivalis, Prevotella intermedia/nigrescens, Tannerella forsythia, Campylobacter spp, Eubacterium spp, Fusobacterium spp, Peptostreptococcus micros, Eikenella corrodens, Dialister pneumosintes, y microorganismos inusuales como bacilos Gram negativos pertenecientes a la familia Enterobacteriaceae, especies de Pseudomonas, Acinetobacter, otros bacilos Gram negativos no fermentadores y levaduras.
Aislamiento e identificación de organismos periodontopáticos e inusuales por el laboratorio de microbiología. A partir de las muestras subgingivales se hicieron cultivos microbiológicos en agar TSBV39 y en agar Brucella suplementado con sangre de cordero al 5%, hemina y menadiona40. Las cajas de agar TSBV se incubaron en una atmósfera al 5% de CO2 entre 3 y 5 días (este agar permite la recuperación de A. actinomycetemcomitans y también el crecimiento de bacilos entéricos Gram negativos y levaduras). Las cajas de agar Brucella se incubaron en anaerobiosis por 7 días para la recuperación de los demás patógenos periodontales. La identificación se hizo al tener en cuenta las características morfológicas de las colonias y pruebas bioquímicas adicionales40.
Las colonias presuntivas de microorganismos entéricos en TSBV se subcultivaron en agar sangre y agar Mac-Conkey para obtener colonias puras que permitieran determinar las características morfológicas distintivas de estos microorganismos. En agar Cetrimide, se subcultivaron todas las colonias sospechosas de pertenecer al género Pseudomonas. La identificación primaria de las colonias aisladas se realizó por pruebas bioquímicas manuales como oxidasa, citrato, MIO (Movilidad-Indol-Ornitina), lisina, urea de Christensen, TSI (agar hierro triple azúcar), malonato, DNAsa. En el caso de los microorganismos no fermentadores de la glucosa, se utilizaron pruebas adicionales como la oxidación-fermentación (OF) de glucosa, movilidad en gota pendiente y crecimiento a 42ºC41.
La identificación de la especie bacteriana se efectuó al comparar los resultados de las pruebas bioquímicas de cada microorganismo con los datos suministrados por las tablas de identificación de la Sociedad Americana de Microbiología10. Muchos de los bacilos Gram negativos no fermentadores no se identificaron completamente porque se necesitaban pruebas bioquímicas adicionales no disponibles.
Para identificar las levaduras se subcultivó la colonia presuntiva en agar TSBV al agar sangre, se evaluaron el aspecto de la colonia y la morfología microscópica correspondiente a blastoconidias en la preparación con azul de lactofenol41.
Análisis de datos. Se hizo una estadística descriptiva de los datos mediante el programa SPSS ver 10.0. Se incluyó análisis de frecuencia, análisis de datos cruzados, tablas de contingencia y pruebas dec2 para buscar asociación estadística en los porcentajes de aislamiento estratificados por diagnósticos. También se tuvo en cuenta el parámetro presencia/ausencia del microorganismo, presencia si se encontraba un microorganismo con un porcentaje de aislamiento mayor de 0. Se consideró una diferencia estadísticamente significante cuando p<0.05.
RESULTADOS
De los 356 informes microbiológicos analizados, 204 (57.3%) correspondieron a mujeres y 152 (42.7%) a hombres. La distribución de la muestra según el diagnóstico periodontal se presenta en el Cuadro 1, donde se aprecia un mayor número de pacientes con enfermedad periodontal crónica, seguidos de enfermedad periodontal agresiva e individuos sanos.
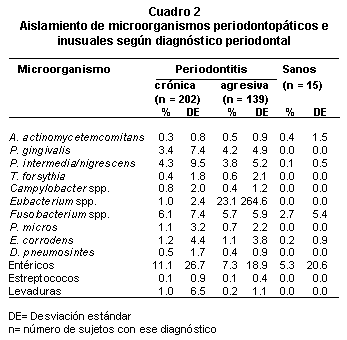
En el Cuadro 2, se presentan los porcentajes de aislamiento promedio de cada uno de los microorganismos periodontopáticos y superinfectantes y su desviación estándar estratificados por diagnóstico periodontal. En los enfermos con compromiso periodontal el porcentaje promedio de colonias aisladas fue similar tanto en periodontitis crónica (X = 262.9 colonias dilución 10-5, rango entre 24 y 600, DE = 143.7) como en periodontitis agresiva (X = 262.2 colonias dilución 10-5, rangos desde 20 hasta 600, DE = 130). En los individuos sanos, el promedio de colonias aisladas fue menor (182.7 colonias dilución 10-5, rango de 80 a 350, DE = 85.6).
Dentro de los microorganismos inusuales, el porcentaje promedio de aislamiento de los entéricos fue más alto que el de las levaduras en los tres tipos de diagnóstico.
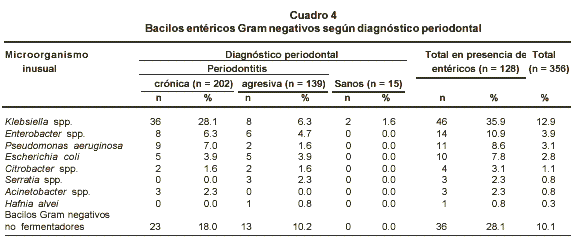
Las prevalencias de los microorganismos inusuales presentes según el diagnóstico periodontal aparecen en el Cuadro 3. En éstas no hubo diferencias significativas para la frecuencia entre los grupos. Como la mayor prevalencia de microorganismos inusuales corresponde a enterobacterias, la distribución de bacilos Gram negativos entéricos se presenta en el Cuadro 4. Organismos pertenecientes a los géneros Klebsiella, Enterobacter y las especies P. aeruginosa y Escherichia coli se mostraron como los más frecuentes entre los pacientes con enfermedad periodontal, mientras que en los sanos hubo dos aislamientos de especies del género Klebsiella. También se encontraron bacilos gramnegativos no fermentadores en una alta proporción en personas con enfermedad periodontal crónica o agresiva, no así en individuos sanos.
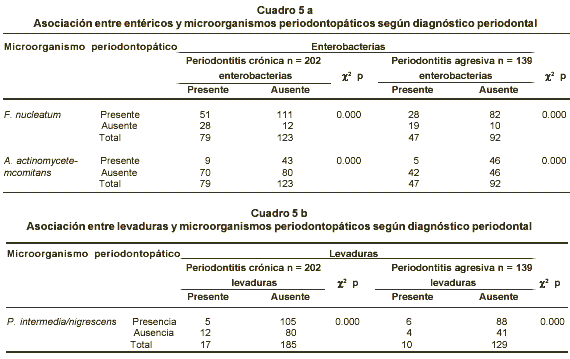
En el Cuadro 5 se presentan las asociaciones entre microorganismos inusuales con algunas bacterias periodontopáticas, en los grupos de pacientes con periodontitis. En ambos, se encontró una relación estadísticamente significativa entre la presencia de enterobacterias y la ausencia de A. actinomycetemcomitans, mientras que en ausencia de entéricos hubo mayor presencia de especies de Fusobacterium. También se encontró en estos grupos una asociación estadísticamente significativa entre la ausencia de levaduras y la presencia de P. intermedia/nigrescens.
DISCUSIÓN
La prevalencia de microorganismos inusuales encontrada en este estudio mostró 36% de microorganismos entéricos y 7% de levaduras en 356 perfiles microbiológicos de personas con diversos grados de enfermedad periodontal. Se han presentado resultados similares con respecto a los microorganismos entéricos en pacientes de Brasil27 con periodontitis crónica (31.2%) y en colombianos28 con periodontitis crónica severa (39.2%).Los microorganismos inusuales tienen bajas proporciones en la cavidad oral11, sin embargo, diversas circunstancias pueden generar cambios en las condiciones del microambiente oral que facilitan el sobrecrecimiento de estos patógenos oportunistas. Dentro de ellas, se mencionan hábitos higiénicos deficientes, enfermedades de base como diabetes, cáncer, factores ambientales (tabaquismo o alcoholismo) y terapias antimicrobianas previas que permitirían el establecimiento de una microbiota oportunista.
Los microorganismos inusuales, al encontrarse junto con los organismos periodontopáticos en el microambiente de la bolsa periodontal pueden aprovecharse de condiciones como nutrientes, protección ante la respuesta inmune y economía en el gasto energético42. Sin embargo, no se han descrito con claridad los tipos de interrelaciones microbianas que pueden existir entre microorganismos periodontopáticos y superinfectantes a nivel de la microbiota subgingival.
En este trabajo se encontraron microorganismos de los géneros Klebsiella en 35.9%, Enterobacter 10.9% y Pseudomonas en 8.6% de 128 pacientes con presencia de entéricos (Cuadro 4). Estos organismos se caracterizan por contar con factores de resistencia a los antibióticos lo cual les da la oportunidad de permanecer por largo tiempo en los tejidos que infectan9,12. Actualmente la epidemiología de la resistencia de los bacilos Gram negativos tiene su más grande implicación a nivel hospitalario; sin embargo, como hipótesis, se puede decir que los microorganismos superinfectantes en personas con enfermedad periodontal pueden compartir factores de resistencia a los antibióticos en el microambiente subgingival.
Hubo 28.1% de bacilos Gram negativos no fermentadores en los 128 pacientes, cifra que fue el segundo porcentaje más alto entre los bacilos entéricos (Cuadro 4).
Los no fermentadores incluyen un amplio grupo de microorganismos que por lo general son saprofitos, pero que en enfermos inmunosuprimidos pueden desempeñar un papel significativo 43. Es importante identificar mediante pruebas bioquímicas adicionales los géneros bacterianos de este grupo y establecer sus frecuencias en individuos periodontalmente comprometidos.
Otros organismos como Candida se han encontrado en personas con periodontitis13,15. Aunque se ha establecido que las especies de Candida son superinfectantes, también se proponen mecanismos patógenos de C. albicans en el proceso destructivo de la enfermedad periodontal13. En el presente estudio la prevalencia de levaduras fue similar entre los grupos de pacientes con periodontitis crónica y agresiva (Cuadro 3) mientras que no se encontraron en los sanos.
El papel que pueden tener los microorganismos inusuales en individuos sanos aún no se ha establecido y en Colombia se desconoce su prevalencia en personas sin compromisos patológicos a nivel de la cavidad oral. En las dos últimas décadas se ha visto que organismos superinfectantes de las familias Enterobacteriaceae y Pseudomonadaceae parecen agravar el pronóstico y los Cuadros clínicos en las periodontitis destructivas. Las bacterias entéricas Gram negativas y Pseudomonas se presentan en la placa subgingival de pacientes con periodontitis crónica en rangos entre 14% y 57% en las diversas poblaciones de Europa, Estados Unidos y China44, pero ningún estudio establece su presencia en personas sanas. Aunque el presente artículo incluye una menor proporción de sanos debido a que no es común la solicitud de un perfil microbiológico en ausencia de alguna enfermedad, es necesario determinar en futuros estudios la microbiota subgingival de estas personas, y establecer qué significa para los individuos sanos ser portadores de esta clase de microorganismos.
El crecimiento de los microorganismos inusuales en los medios de cultivo puede darse con colonias grandes y mucosas en su morfología, que cubren las colonias de periodontopáticos y dificultan su caracterización, como también podrían disminuir los requerimientos nutricionales necesarios para el crecimiento de los anaerobios. Esto podría explicar la asociación estadística que se observó entre la mayor presencia de enterobacterias y la menor presencia de A. actinomycetemcomitans (Cuadro 5). De igual manera el crecimiento de algunos periodontopáticos como Fusobacterium y Prevotella se favorece al no encontrar microorganismos inusuales que compitan con ellos por los factores nutricionales que el medio les brinda. Estos hallazgos in vitro no reflejan las condiciones que ocurren exactamente in vivo en el microambiente subgingival, y por tanto, las asociaciones en este estudio podrían ser un evento casual que no necesariamente implica la ausencia de una de las especies periodontopáticas cuando la microbiota inusual se encuentra presente. Determinar las relaciones entre estos grupos de microorganismos y lo que tienen que ver con los hallazgos clínicos de personas periodontalmente comprometidas, y la comparación con individuos sanos, deben ser puntos que se han de tratar en futuros estudios, que ayuden a comprender la verdadera implicación de la microbiota inusual en la enfermedad periodontal.
CONCLUSIONES
.Este estudio determinó que 36% de los pacientes con periodontitis poseen en su microbiota subgingival microorganismos inusuales tipo bacilos Gram negativos conformados en su gran mayoría por bacterias de las familias Enterobacteriaceae y Pseudomonadaceae. También se aislaron en gran proporción bacilos Gram negativos no fermentadores, agentes que se consideran saprofitos para los pacientes inmunocompetentes pero que podrían comportarse como oportunistas en personas inmunodeprimidas.
.Aunque la prevalencia de levaduras fue 7%, cifra más baja que otros estudios en personas con periodontitis13,15; se ha reconocido que la presencia de especies como C. albicans podría tener un papel patogénico en el desarrollo de la enfermedad periodontal13.
. El tipo de microbiota inusuales presente en individuos sanos aún está por determinarse, pero es importante saber si los mismos organismos que se aíslan en los casos de periodontitis se podrían hallar como microbiota normal en personas periodontalmente sanas.
. Las asociaciones entre los periodontopáticos y los microorganismos inusuales que se vieron en este estudio, pueden ser el reflejo de procesos in vitro en los medios de cultivo, y no necesariamente los que se dan in vivo en la microbiota subgingival, donde otros parámetros, como la interacción con las células del hospedero, podrían determinar la presencia o no de ciertas bacterias. Se deben realizar más estudios para comprender las interacciones entre la microbiota inusuales y los patógenos periodontales.
REFERENCIAS
1. Albandar JM, Brunelle JA, Kingman A. Destructive periodontal disease in adults 30 years of age and older in the United States, 1988-1994. J Periodontol 1999; 70: 13-29. [ Links ]
2. Albandar JM. Periodontal diseases in North America. Periodontol 2000 2002; 29: 31-69. [ Links ]
3. Gjermo P, Rosing CK, Susin C, Oppermann R. Periodontal diseases in Central and South America. Periodontol 2000 2002; 29: 70-78. [ Links ]
4. Ministerio de Salud. Estudio Nacional de Salud Oral ENSAB III. Extensión y severidad de la enfermedad periodontal. Bogotá: Ministerio de Salud; 1999. [ Links ]
5. Baelum V, Scheutz F. Periodontal diseases in Africa. Periodontol 2000 2002; 29: 79-103. [ Links ]
6. Maiden MFJ, Cohee P, Tanner ACR. Proposal to conserve the adjectival form of the specific epithet in the reclassification of Bacteroides forsythus. Tanner et al. 1986 to the genus Tannerella Sakamoto et al. 2002 as Tannerella forsythia corrig., gen. nov., comb. nov. Request for an opinion. Int J Syst Evol Microbiol 2003; 53: 2111-2112. [ Links ]
7. Socransky SS, Haffajee AD. Microbiología de la enfermedad periodontal. In: Lindhe J (ed.). Periodontología clínica e implantología. 3ª ed. Barcelona: Editorial Médica Panamericana; 2001. p. 138-190. [ Links ]
8. Colombo AP, Haffajee AD, Dewhirst FE, Paster BJ, Smith CM, Socransky SS, et al. Clinical and microbiological features of refractory periodontitis subjects. J Clin Periodontol 1998; 25: 169-180. [ Links ]
9. Eisenstein BI, Zaleznik DF. Enterobacteriaceae. In: Mandell G, Bennett JE, Dolin R (ed.). Principles and practice of infectious diseases. 5a ed. Philadelphia: Churchill Livingstone; 2000. p. 2294-2310. [ Links ]
10. Farmer III JJ. Enterobacteriaceae: Introduction and identification. In: Murray P, Baron E, Pfaller M, Tenover F, Yolken R (eds.). Manual of clinical microbiology. 7th ed. Washington: American Society for Microbiology Press; 1999. p. 442-464. [ Links ]
11. Chow AW, Roser SM, Brady FA. Orofacial odontogenic infections. Ann Intern Med 1978; 88: 392-402. [ Links ]
12. Pollack M. Pseudomonas aeruginosa. In: Mandell G, Bennett JE, Dolin R (eds.). Principles and practice of infectious diseases. 5th ed. Philadelphia: Churchill Livingstone; 2000. p. 2311-2338. [ Links ]
13. Järvensivu A, Hietanen J, Rautemaa R, Sorsa T, Richardson M. Candida yeasts in chronic periodontitis tissues and subgingival microbial biofilms in vivo. Oral Dis 2004; 10: 106-112. [ Links ]
14. Slots J, Rams TE, Listgarten MA. Yeasts, enteric rods and pseudomonads in the subgingival flora of severe adult periodontitis. Oral Microbiol Immunol 1988; 3: 47-52. [ Links ]
15. Reynaud AH, Nygaard-Ostby B, Boygard GK, Eribe ER, Olsen I, Gjermo P. Yeasts in periodontal pockets. J Clin Periodontol 2001; 28: 860-864. [ Links ]
16. Rams TE, Babalola OO, Slots J. Subgingival occurrence of enteric rods, yeasts and staphylococci after systemic doxycycline therapy. Oral Microbiol Immunol 1990; 5: 166-168. [ Links ]
17. Ali RW, Bakken V, Nilsen R, Skaug N. Comparative detection frequency of 6 putative periodontal pathogens in Sudanese and Norwegian adult periodontitis patients. J Periodontol 1994; 65: 1046-1052. [ Links ]
18. Ali RW, Velcescu C, Jivanescu MC, Lofthus B, Skaug N. Prevalence of 6 putative periodontal pathogens in subgingival plaque samples from Romanian adult periodontitis patients. J Clin Periodontol 1996; 23: 133-139. [ Links ]
19. Ali RW, Johannessen AC, Dahlen G, Socransky SS, Skaug N. Comparison of the subgingival microbiota of periodontally healthy and diseased adults in northern Cameroon. J Clin Periodontol 1997; 24: 830-835. [ Links ]
20. Slots J, Feik D, Rams TE. Age and sex relationships of superinfecting microorganisms in periodontitis patients. Oral Microbiol Immunol 1990; 5: 305-308. [ Links ]
21. Slots J, Feik D, Rams TE. In vitro antimicrobial sensitivity of enteric rods and pseudomonads from advanced adult periodontitis. Oral Microbiol Immunol 1990; 5: 298-301. [ Links ]
22. Slots J, Feik D, Rams TE. Prevalence and antimicrobial susceptibility of Enterobacteriaceae, Pseudomonadaceae and Acinetobacter in human periodontitis. Oral Microbiol Immunol 1990; 5: 149-154. [ Links ]
23. Slots J, Rams TE, Feik D, Taveras HD, Gillespie GM. Subgingival microflora of advanced periodontitis in the Dominican Republic. J Periodontol 1991; 62: 543-547. [ Links ]
24. Slots J, Rams TE, Schonfeld SE. In vitro activity of chlorhexidine against enteric rods, pseudomonads and acinetobacter from human periodontitis. Oral Microbiol Immunol 1991; 6: 62-64. [ Links ]
25. Slots J, Ting M. Systemic antibiotics in the treatment of periodontal disease. Periodontol 2000 2002; 28: 106-176. [ Links ]
26. Dahlen G, Wikstrom M. Occurrence of enteric rods, staphylococci and Candida in subgingival samples. Oral Microbiol Immunol 1995; 10: 42-46. [ Links ]
27. Barbosa FC, Mayer MP, Saba-Chujfi E, Cai S. Subgingival occurrence and antimicrobial susceptibility of enteric rods and pseudomonads from Brazilian periodontitis patients. Oral Microbiol Immunol 2001; 16: 306-310. [ Links ]
28. Mayorga de Fayad I, Lafaurie G, Hurtado P, et al. Detección de Porphyromonas gingivalis y bacilos entéricos en pacientes con periodontitis crónica severa en una muestra de población de Bogotá, D.C. Rev Cient 2002; 8: 28-37. [ Links ]
29. Jaramillo A, Contreras A, Lafaurie G. Microbiota subgingival en pacientes con enfermedad periodontal agresiva y crónica en Colombia. Memorias Revista ACFO 2002 (Abstract) p. 22. [ Links ]
30. de Campos CM, Zelante F. Human oral microbiota. I. Occurrence of enteric bacteria in saliva, tongue and dental plaque. Rev Fac Odontol São Paulo 1978; 16: 77-86. [ Links ]
31. Scannapieco FA, Papandonatos GD, Dunford RG. Associations between oral conditions and respiratory disease in a national sample survey population. Ann Periodontol 1998; 3: 251-256. [ Links ]
32. Scannapieco FA. Role of oral bacteria in respiratory infection. J Periodontol 1999; 70: 793-802. [ Links ]
33. Scannapieco FA, Bush RB, Paju S. Associations between periodontal disease and risk for nosocomial bacterial pneumonia and chronic obstructive pulmonary disease. A systematic review. Ann Periodontol 2003; 8: 54-69. [ Links ]
34. Scannapieco FA, Rethman MP. The relationship between periodontal diseases and respiratory diseases. Dent Today 2003; 22: 79-83. [ Links ]
35. Scannapieco FA, Ho AW, DiTolla M, Chen C, Dentino AR. Exposure to the dental environment and prevalence of respiratory illness in dental student populations. J Can Dent Assoc 2004; 70: 170-174. [ Links ]
36. Sedgley CM, Samaranayake LP. Oral and oropharyngeal prevalence of Enterobacteriaceae in humans: a review. J Oral Pathol Med 1994; 23: 104-113. [ Links ]
37. Goldberg S, Cardash H, Browning H, Sahly III , Rosenberg M. Isolation of Enterobacteriaceae from the mouth and potential association with malodor. J Dent Res 1997; 76: 1770-1775. [ Links ]
38. 1999 International Workshop for a Classification of Periodontal Diseases and Conditions. Papers. Oak Brook, Illinois October 30-November 2, 1999. Ann Periodontol 1999; 4: 1-112. [ Links ]
39. Slots J. Selective medium for isolation of Actinobacillus actinomycetemcomitans. J Clin Microbiol 1982; 15: 606-609. [ Links ]
40. Slots J. Rapid identification of important periodontal microorganisms by cultivation. Oral Microbiol Immunol 1986; 1: 48-55. [ Links ]
41. Koneman EW. Diagnóstico microbiológico. Texto y Atlas color. 5a ed. Madrid: Editorial Médica Panamericana; 1999. [ Links ]
42. Socransky SS, Haffajee AD. Dental biofilms: difficult therapeutic targets. Periodontol 2000 2002; 28: 12-55. [ Links ]
43. Mandell G, Bennett JE, Dolin R. Principles and practice of infectious diseases. 5th ed. Vol I, II. Philadelphia: Churchill Livingstone; 2000. [ Links ]
44. Sedgley CM, Samaranayake LP, Chan JC, Wei SH. A 4-year longitudinal study of the oral prevalence of enteric Gram negative rods and yeasts in Chinese children. Oral Microbiol Immunol 1997; 12: 183-188. [ Links ]