Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Colombia Médica
On-line version ISSN 1657-9534
Colomb. Med. vol.37 no.2 Cali June 2006
Estudio comparativo, cruzado, doble ciego, al azar para determinar la bioequivalencia entre dos formulaciones de valsartán en tabletas y cápsulas
Milena Pérez, Quim.1, William Cárdenas, M.D.2, Gloria Ramírez, Quim.3, Mauricio Pérez, Estat.4, Piedad Restrepo, Farmacol.5
1. Directora del Laboratorio Biofarmacéutico, CIDEIM, Cali, Colombia. e-mail: milena_perez@cideim.org.co
2. Coordinador de la Unidad de Investigación, CIDEIM, Cali, Colombia. e-mail: cardenasnino@gmail.com
3. Asistente de Investigación, CIDEIM, Cali, Colombia. e-mail: gloriashirley_ramirez@cideim.org.co
4. Estadístico, Unidad de Biometría, CIDEIM, Cali, Colombia. e-mail: mauricioperez@cideim.org.co
5. Coordinadora Unidad de Estudios Biofarmacéuticos, CIDEIM, Cali, Colombia. e-mail: piedad_restrepo@cideim.org.co
Recibido para publicación septiembre 19, 2005 Aceptado para publicación marzo 15, 2006
RESUMEN
Introducción: Los estudios de bioequivalencia o equivalencia comparada se realizan para demostrar que el producto en estudio, conocido como producto genérico, tiene la misma biodisponibilidad del producto de referencia, también conocido como producto innovador o de marca. Si los dos productos son bioequivalentes, se espera que tengan las mismas características de seguridad y eficacia. La bioequivalencia es establecida por la estimación estadística de diferencias significativas o no en los parámetros farmacocinéticos de área bajo la curva (ABC) y concentración máxima (Cmáx). En este caso, se evaluará y se comparará la biodisponibilidad de valsartán, un agente antihipertensivo inhibidor específico del receptor de angiotensina II subtipo AT1, en las membranas celulares del músculo liso vascular.
Objetivo: Evaluar la bioequivalencia de dos productos farmacéuticos cuyo principio activo es valsartán, con base en la comparación de las medidas farmacocinéticas de cantidad y velocidad (en términos de tiempo requerido), con que el valsartán alcanza la circulación sanguínea después de ser administrado por vía oral a 15 voluntarios.
Metodología: Se realizó un estudio aleatorizado, cruzado, a doble ciego, de dosis única en 15 voluntarios sanos con edades entre 19 y 28 años. El estudio se realizó en dos períodos; en cada período de tratamiento se administró una dosis de 320 mg de valsartán, con un período de lavado de 8 días entre el primero y segundo tratamiento. Las concentraciones plasmáticas se evaluaron por HPLC/UV con el método de adición de estándar, empleando losartán como estándar interno.
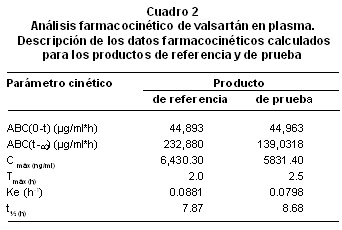
Resultados: Para las tabletas de valsartán se obtuvieron los siguientes parámetros farmacocinéticas: ABC de 44,893 µg/mlxh, Cmáx de 6,430.3 µg/ml y Tmáx de 2 h. Para las cápsulas de valsartán se obtuvieron los siguientes parámetros farmacocinéticas: ABC de 44,963 µg/mlxh, Cmáx de 5,831.4 µg/ml y Tmáx de 2.5 h.
Conclusión: Los resultados del estudio no mostraron diferencias significativas en los niveles de concentraciones plasmáticas después de la administración de las dos formulaciones de valsartán: 80 mg tabletas y 80 mg cápsulas. Por tanto, el diseño del estudio y la aplicación de los protocolos escogidos permitieron demostrar la bioequivalencia entre los productos.
Palabras clave: Valsartán; Biodisponibilidad; Bioequivalencia.
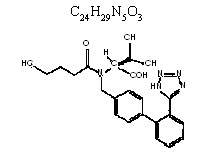
Valsartán, fármaco antagonista específico de la angiotensina II sobre los receptores AT1, es un polvo fino, soluble en etanol y metanol y débilmente soluble en agua. Químicamente se describe como N-(1- oxopentil)-N-{[2-(1H- tetrazol-5-yl)[1,1-bifenil]-4-yl]metil}-L-valina. El peso molecular es de 435.5 y su fórmula empírica corresponde a1:
El valsartán está indicado como antihipertensivo en forma única o en combinación con otros antihipertensivos. Aproximadamente 9% de la dosis de valsartán se convierten en el metabolito valeril-4-hidroxi-valsartán (M1) inactivo farmacológicamente, mediante biotransformación oxidativa probablemente por enzimas del citocromo P450 2C9 y 3A4.
Después de una dosis única, el efecto se inicia en 2 horas y su pico máximo se presenta entre 4 y 6 horas en la mayoría de los pacientes. La administración en dosis adecuadas a individuos con hipertensión esencial resulta en disminución significativa de la presión diastólica y sistólica con muy poco o ningún cambio ortostático. El efecto máximo se estabiliza después de cuatro meses de iniciado el tratamiento, y no se esperan incrementos importantes por dosis mayores de 160 mg, tampoco lo afectan la edad, el género o la raza. Sin embargo, se debe tener precaución durante su uso en hipertensos con bajos niveles de renina circulante, especialmente común en personas de raza negra.
Luego de la administración por vía oral, el valsartán se absorbe en un porcentaje de biodisponibilidad variable, en promedio se informan 23±7% y alcanza la concentración máxima (Cmáx) entre 1.5 y 3.0 horas (2-4 horas). Las concentraciones máximas esperadas después de administrar 80 mg por vía oral son de 1.6±0.6 µg/ml. El modelo cinético de eliminación es lineal bifásico, con un tiempo aproximado de distribución en fase alfa de una hora y de eliminación en fase beta de 9 horas (9.4±3.8 h horas). El metabolismo hepático corresponde a menos de 10% de la dosis suministrada, y el principal metabolito es el valeril-4 hidroxi-valsartán; no se han identificado metabolitos activos. El valsartán se une en más de 94% a la albúmina sérica.
El volumen de distribución es 0.23±0.09 l/kg. El aclaramiento plasmático es aproximadamente de 0.49±0.09 ml/min por kg de peso corporal. Más o menos 86% de la dosis se excretan por las heces y el resto por orina (29.0±5.8%) como fármaco inalterado, lo cual explica la no necesidad de ajustar la dosis en disfunción renal. Los alimentos disminuyen la biodisponibilidad del valsartán hasta en 48%.
En pacientes con cirrosis u obstrucción biliar se ha observado un incremento de casi el doble del valsartán en el área bajo la curva (ABC) de concentración plasmática. En los ancianos tanto la vida media como el área ABC de concentración plasmática y la concentración máxima se pueden aumentar hasta en 50%.
Los estudios para establecer bioequivalencia (BE) se llevan a cabo para identificar diferencias estadísticas significativas durante el comportamiento in vivo de productos equivalentes farmacéuticos, que tienen la misma cantidad de principio activo, se presentan en la misma forma de dosificación y cumplen los requisitos de las farmacopeas oficialmente aceptadas para las pruebas de control de calidad a productos terminados1.
Para muchos productos la comparación se basa en la valoración de parámetros indicativos de la biodisponibilidad, como son, el área bajo la curva (ABC) elaborada con los cambios de concentración en un fluido biológico, detectados durante un tiempo, y la concentración máxima obtenida (Cmáx) para cada producto. Los estudios son aplicados a medicamentos que se administran por vías no parenterales, donde el innovador o producto con el cual se llevaron a cabo las investigaciones de eficacia y seguridad para el fármaco, se considera el de «Referencia» y el nuevo producto a comercializarse se denomina el producto de prueba o «test»2.
La demostración de bioequivalencia entre productos, mediante un diseño de investigación adecuado, permite que la autoridad sanitaria admita la declaración de sustitución e intercambiabilidad entre ellos, durante la dispensación o uso terapéutico3.
El objetivo de este estudio es evaluar la biodisponibilidad relativa de dos formulaciones en tabletas y cápsulas que contienen valsartán como principio activo, a fin de establecer la bioequivalencia entre los dos productos.
MATERIALES Y MÉTODOS
Voluntarios. El estudio se llevó a cabo en 15 sujetos voluntarios sanos de género masculino, con edad entre 19-28 años (peso entre 60 y 79 kg). El Comité de Ética del Centro Internacional de Entrenamiento e Investigaciones Médicas (CIDEIM) revisó el contenido del protocolo de este estudio y del consentimiento informado para los voluntarios en lo correspondiente al cumplimiento de los requisitos de la Organización Mundial de la Salud y de las normas colombianas y aprobó su ejecución. CIDEIM está protegido por una póliza de responsabilidad civil en todos sus procesos de investigación que se adelanten con seres humanos.
Reactivos. Estándar de valsartán obtenido de la USP. El losartán usado como estándar interno se obtuvo de Chemo. Acetonitrilo (Fisher Scientific) y el agua fue grado HPLC. Tanto el ácido fosfórico (Fisher Scientific), el metanol (Panreac), y el fosfato de potasio monobásico (Merck), eran de grado analítico.
Instrumentación y cromatografía. El estudio se efectuó con un equipo de cromatografía líquida LaChrom Elite (Merck-Hitachi) y un detector ultravioleta con arreglo de diodos, Columna Chromolith® Performance RP-18e 100-4.6 mm, 2µm. (Merck), software EZChrom Elite 3.1.3 (Merck), balanza analítica (Ohaus Adventurer), agitador vortex (Fisher Scientific), agitador magnético Multistation (IKA), baño ultrasónico (Fisher Scientific), baño maría (DIES), purificador de agua (Simplicity Millipore), congelador -70ºC (Revco), pH metro (WTW 740 Inolab), cartuchos C8 Sep -Pak (100 mg, 1 ml Waters), centrifuga (Sorvall RC-5B), equipo de extracción en fase sólida (Supelco) y compresor de aire (Atlas Copco).
DISEÑO Y CONDUCCIÓN DEL ESTUDIO
El estudio fue diseñado para evaluar la biodisponibilidad de los productos farmacéuticos identificados como valsartán A en cápsulas de 80 mg, elaborado por el laboratorio farmacéutico A y valsartán B en tabletas de 80 mg, elaborado por el laboratorio farmacéutico B, con base en las medidas farmacocinéticas de cantidad y velocidad (en términos de tiempo requerido), con que el valsartán alcanza la circulación sanguínea después de ser administrado por vía oral a quince voluntarios, en dosis de 320 mg de cada producto, en períodos de tratamiento asignados al azar y separados entre sí por un intervalo de ocho días.
DISEÑO EXPERIMENTAL
Se realizó un estudio de bioequivalencia con base en la biodisponibilidad comparada de dosis únicas de 320 mg de valsartán en tabletas y cápsulas administradas por vía oral, en diseño cruzado al azar de dos vías para el producto de prueba valsartán A del laboratorio farmacéutico A cápsulas de 80 mg vs. el producto de referencia valsartán B del laboratorio farmacéutico B, tabletas de 80 mg, y su dispensación fue en ciego para los evaluadores y sujetos voluntarios participantes. Los productos se administraron por asignación aleatoria a 15 voluntarios sanos de género masculino.
El diseño experimental aplicado correspondió a un estudio comparativo de dos formulaciones, dos períodos, en dos secuencias cruzadas, no replicado, en quince (15) sujetos voluntarios sanos, con asignación al azar en los grupos y períodos de tratamiento, con el fin de establecer la bioequivalencia entre los productos en estudio, por la estimación estadística de diferencias significativas o no en los parámetros farmacocinéticos de ABC y Cmáx, en los resultados correspondientes luego de su transformación .
Los productos fueron codificados por la Unidad de Biometría de CIDEIM como valsartán A (laboratorio farmacéutico A) y valsartán B (laboratorio farmacéutico B) para asegurar el doble ciego en todos los participantes del estudio (investigadores y voluntarios). A cada sujeto voluntario se le asignó un código con el fin de proteger su identidad a lo largo del estudio.
PROCEDIMIENTOS CLÍNICOS
Los productos se administraron por asignación aleatoria a 15 voluntarios sanos de género masculino; el día de la prueba, entre las 6 y 7 horas, a cada uno de los sujetos se le extrajo una muestra de 15 ml de sangre que se marcó como «muestra cero», luego cada uno recibió la dosis del producto de prueba y/o la del producto de referencia (según el orden aleatorio asignado), con 240 ml de agua, y a partir de este momento, se les extrajeron 13 muestras de igual volumen que la cero, en el siguiente horario 0.5, 1, 1.5, 2, 2.5, 3, 3.5, 4, 5, 6, 8, 10 y 12 horas. El período siguiente de tratamiento estuvo separado del primero por un lapso de 8 días calendarios, con el fin de asegurar la depuración suficiente del fármaco que se administró al principio.
PROCEDIMIENTO ANALÍTICO
La técnica analítica se estandarizó, se validó y se aplicó a las muestras de voluntarios de acuerdo con procedimientos operativos estándar. El respaldo bibliográfico básico para el desarrollo de la técnica aparece en González4 y Tatar & Saglik5. El procedimiento y la información técnica relacionados se elaboraron en consonancia con las guías para la industria publicadas por la FDA de los Estados Unidos, entre ellas las descritas en el 21CFR PARTE 58 y 21 CFR 320. 29, las Guías del Ministerio del Salud del Brasil6, y demás información revisada en relación con este propósito (7-10). En los procedimientos seguidos se detalla lo relativo a:
Especificidad y límite mínimo de cuantificación. El criterio acordado de aceptación para especificidad estableció la no presencia de un pico cromatográfico con significancia tal que interfiriera en los tiempos de retención de los analitos valsartán y losartán.
Curva de calibración y linealidad. Analizada en una matriz con estándar interno con concentraciones de valsartán en el rango de 0.050-20.0 µg/ml y adición de estándar de valsartán de 2.5 µg/ml. El coeficiente de correlación fue 0.9977.
Precisión, exactitud y recuperación. La precisión se determinó con tres réplicas para cada concentración y 20 concentraciones en el rango establecido. La recuperación se hizo mediante la comparación entre las medidas del analito en la muestra y las del estándar. El porcentaje de recuperación obtenido fue 90%.
La técnica analítica se fundamenta en la cromatografía líquida de alta eficiencia con detección ultravioleta con arreglo de diodos (HPLV/UV), con losartán como estándar interno. La extracción de los principios activos se realizó mediante el método de extracción en fase sólida con silica gel C8 como material adsorbente. El equipo que se usó fue un cromatógrafo líquido LaChrom Elite®. La validación del analito siguió el procedimiento estandarizado y validado para ello, con absorción ultravioleta a 265 nm, y una columna Chromolith® Performance RP-18e 100-4.6 mm, 2µm; como fase móvil una mezcla de amortiguador de fosfato pH 2.7: acetonitrilo (55:45); el tiempo de retención del valsartán fue 5 min., y 3.2 min para el losartán.
PARÁMETROS CINÉTICOS
La concentración plasmática máxima (Cmáx) y el tiempo máximo (Tmáx) se obtuvieron del gráfico de concentración plasmática de valsartán vs. tiempo. El área bajo la curva (ABCo-t) se calculó en el programa Microsoft Office Excel 2003 por el método de los trapecios y el ABCt-inf también se calculó a partir de la última concentración estimada y la pendiente de la fase de eliminación.
EVALUACIÓN ESTADÍSTICA
La bioequivalencia se estableció por la aplicación del cálculo estadístico, con un intervalo de confianza de 95% para la diferencia entre los valores promedios obtenidos para el producto de prueba valsartán A en este estudio, y el producto de referencia codificado a ciego como valsartán B, en cuanto a las variaciones del ABC de concentración vs. tiempo y de la Cmáx alcanzadas por cada formulación, después de la transformación logarítmica de los datos. Los valores antilogarítmicos de los límites de confianza constituyeron el intervalo de 95% para la razón de las medias geométricas entre los productos A y B, con aceptación de un nivel de confianza de mínimo 80% y no más de 125%, mediante la aplicación de dos pruebas de hipótesis unilaterales, definidas como:
1. Ho: Razón entre los promedios logarítmicos A/B <log (0.8).
2. Ho: Razón entre los promedios logarítmicos A/B <log (1.25).
Con el propósito de rechazar las hipótesis nulas y establecer la bioequivalencia entre los productos, definida como la diferencia entre los promedios comprendida en el intervalo de 0.8 a 1.25 (80% a 125%), con 5% de significancia.
Se describirá la siguiente información requerida para el análisis farmacocinético:
· Concentraciones plasmáticas y puntos de tiempo.
· Sujeto, período, secuencia, tratamiento.
· ABC0-t, ABC0- , Cmax, Tmax, - Ke y t½
· Variabilidad interindividual, intraindividual y/o total, de estar disponible.
Además, se obtendrá la información estadística para ABC0-t, ABC0- y Cmáx, referente a:
· Media geométrica
· Media aritmética
· Relación de medias
· Intervalos de confianza
Se hizo la transformación logarítmica para las medidas utilizadas con el fin de demostrar la bioequivalencia.
RESULTADOS
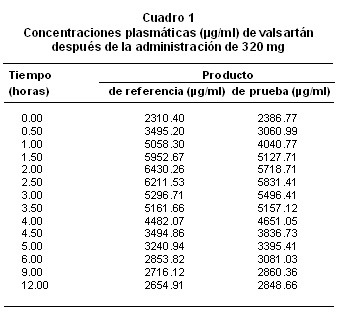
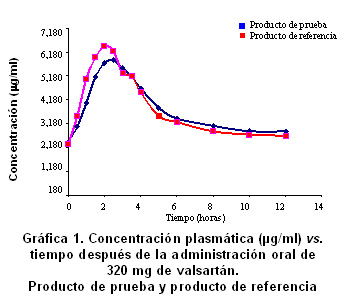
La comparación de la biodisponibilidad del producto de prueba (código A para este estudio) y el producto de referencia (código B para este estudio), se hizo con base en los valores de datos primarios de concentración de valsartán en el tiempo, y de los datos secundarios para el parámetro farmacocinético de ABC de concentración plasmática entre tiempo cero y t. No hubo diferencias estadísticamente significativas entre los 2 productos (A y B), para las variables transformadas ABC (nivel de significancia 0.874), Cmáx (nivel de significancia 0.067) ni para la variable original Tmáx (nivel de significancia 0.688) (Cuadro 1, Gráfica 1).
La comparación de los valores de los parámetros farmacocinéticos o datos secundarios, calculados con base en los datos experimentales para ABC y concentración, por la aplicación del modelo no compartimental y la razón entre los valores obtenidos para ambos productos, muestran la bioequivalencia entre los dos productos, con lo cual se corroboran los resultados ya expuestos (Cuadro 2).
Por medio de la prueba de Shapiro-Wilk se confirma la normalidad de las dos variables. Se utiliza la prueba t de Student pareada. No se encontraron diferencias entre la concentración promedio de los productos A y B (valor p=0.487).
Las diferencias de los valores promedio de Cmáx y ABC, en los datos primarios y con transformación logarítmica, cumplen el criterio de valores de significancia por encima de 0.05, lo que permite establecer la no diferencia significativa entre los productos A y B con un nivel de confianza de 95%.
En las pruebas de hipótesis para la razón de las medias de los datos primarios y con transformación logarítmica de ABC y Cmáx se rechazó la hipótesis nula (Ho), en el límite inferior de la razón entre los promedios de A/B <80% ó 0.8 en datos primarios o transformados respectivamente. Y se aprobó la hipótesis nula en el límite superior de la razón entre los promedios de A/B <120% ó 1.25 en datos primarios o transformados respectivamente.
Los anteriores resultados permiten establecer la no diferencia significativa entre los productos A y B en cuanto a la cantidad de valsartán que alcanza la circulación sanguínea y el nivel de concentración máxima, durante doce horas después de administrar una dosis de 320 mg por vía oral a sujetos sanos, con un nivel de confianza de 95% y significancia mayor de 0.05.
DISCUSIÓN
En vista de los problemas que hubo en décadas anteriores en el mercado de los medicamentos debido a las dudas y preguntas acerca de la seguridad y eficacia de los genéricos en comparación con el medicamento original o innovador, el Ministerio de Salud estableció en el Decreto 677 de 1995, el requisito de presentar la demostración de equivalencia farmacéutica y los resultados de estudios de biodisponibilidad y bioequivalencia en el momento de solicitar el registro sanitario de los medicamentos para su comercialización, pues los estándares de calidad basados en las buenas prácticas de manufactura (BPM), por sí mismos, no son suficientes para garantizar la calidad en términos de equivalencia terapéutica y asegurar la intercambiabilidad del medicamento genérico con el innovador.
En el marco de la política internacional, se acepta como medicamento genérico aquel producto que es comparable con el producto de marca en cuanto a forma de dosificación, seguridad, concentración, ruta de administración, características de calidad y uso indicado.
En este estudio, las muestras de los dos productos administrados a los voluntarios se evaluaron previamente para determinar el cumplimiento de las propiedades fisicoquímicas. El resultado de ambas muestras permitió concluir la conformidad con los métodos aplicados para características organolépticas, dimensiones, peso promedio, dureza, identificación y valoración del principio activo, prueba de disolución y uniformidad de contenido. Los resultados del análisis verificaron el cumplimiento de las especificaciones del fabricante para ambos productos y por tanto, se pudo determinar la equivalencia química entre ellos.
Sin embargo, estos resultados por sí solos no garantizan comportamiento similar de los productos en el organismo, dada la influencia que sobre la calidad pueden tener diversos factores, entre los que se cuentan el origen de las materias primas, las características fisicoquímicas del principio activo, los excipientes empleados en la formulación, el tipo de proceso de fabricación y las variables del proceso inherentes a la tecnología empleada, el sistema envase-empaque, y por último, la estabilidad del producto. Estos factores pueden influir en la absorción del medicamento y causar diferencias en la biodisponibilidad o provocar en el tratamiento efectos, distintos al inicialmente previsto.
Como se tuvo en cuenta lo anterior, se llevó a cabo un estudio de bioequivalencia con el fin de demostrar la falta de diferencias significativas en la velocidad y extensión de la absorción del principio activo presente en el producto genérico (de prueba) y en el de referencia.
La aplicación de los criterios aceptados en la literatura y la reglamentación que se ofrece en este estudio, demostraron al comparar los productos, perfil semejante de concentración plasmática vs. tiempo; de la misma manera, la razón entre el ABC de concentración de valsartán en el tiempo, y la razón entre la Cmáx obtenida con cada producto, estuvieron dentro de los límites de aceptación, tanto para los datos experimentales como para los resultantes de su transformación logarítmica.
Finalmente, los resultados analíticos y su análisis estadístico de los mismos fundamentan la conclusión de bioequivalencia entre el producto genérico (de prueba) Valsartán MK®/Valsartán cápsulas de 80 mg de Tecnoquímicas S.A. y el producto de referencia Diovan®/Valsartán de 80 mg tabletas recubiertas del laboratorio Novartis, para la velocidad y la cantidad de valsartán alcanzadas en el organismo, después de su administración en dosis únicas equimolares a 15 sujetos voluntarios sanos, de acuerdo con el diseño experimental cruzado con asignación al azar de los tratamientos y los períodos.
AGRADECIMIENTOS
Este estudio se realizó en cumplimiento de los objetivos del proyecto financiado por Colciencias «Desarrollo de la capacidad de prestación de servicios tecnológicos a la industria farmacéutica en el Valle del Cauca» Programa de Innovación y Desarrollo Tecnológico, Código 2229-08-14224 318-2003. Los autores agradecen al Instituto Colombiano para el Desarrollo de la Ciencia y la Tecnología (COLCIENCIAS), por el apoyo financiero otorgado al proyecto. A la compañía Tecnoquímicas S.A por el apoyo financiero para el estudio de bioequivalencia y el suministro de estándares de valsartán y losartán. Al doctor Omar Velásquez de Ecoquímica por la asesoría científica y el apoyo técnico en la validación del método analítico para la determinación de valsartán en plasma.
REFERENCIAS
1. Center for Drug Evaluation and Research Department of Health and Human Services. Approval Package for Application Number 21-283/S 002. Printed Labeling. Novartis Pharmaceutical Co. Prescribing Information. Approved 2002. [ Links ]
2. World Health Organization. Manual on marketing authorization of pharmaceutical products. Geneva: WHO; 1998. [ Links ]
3. World Health Organization. Quality assurance of pharmaceuticals. Geneva: WHO; 1997. [ Links ]
4. World Health Organization. Marketing authorization of pharmaceutical products with special reference to multisource (generics) products: a manual for drug regulatory authorities. Geneva: WHO; 1998. [ Links ]
5. González JA, López RM, Alonso, RM. Fast screening method for the determination of angiotensin II receptor antagonists in human plasma by high performance liquid chromatography with fluorimetric detection. J Chromatogr 2002; 949: 49-60. [ Links ]
6. Tatar S, Saglik S. Comparison of UV- and second derivate-spectrophotometric and LC methods for the determination of valsartan in pharmaceutical formulation. J Pharm Biomed Anal 2002; 30: 371-375. [ Links ]
7. Ministerio de Salud. Agencia Nacional de Vigilancia Sanitaria. Manual de buenas prácticas de biodisponibilidad y bioequivalencia. Brasilia: Ministerio de Salud; 2002. [ Links ]
8. Ludwig H. Validation of analytical methods. Review and strategy LC/GC international. Labcompliance 1998; 96-105. [ Links ]
9. Food and Drug Administration. Guidance for industry: Analytical procedures and methods validation. US: Food and Drug Administration; 2000. [ Links ]
10. Shah VP, Midha KK, Findlay JWA, Hill HM, Hulse JD, McGilveray IJ, et al. Bioanalytical method validation. A revisit with a decade of progress. Pharm Res 2000; 17: 1551-1557. [ Links ]
11. Food and Drug Administration. International Conference on Harmonization. Guideline on the validation of analytical procedures. Methodology, availability. US: Food and Drug Administration; 1997. [ Links ]