Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Colombia Médica
versão On-line ISSN 1657-9534
Colomb. Med. v.38 n.4 Cali set./dez. 2007
Las células dendríticas en la infección por el VIH-1
Carlos Julio Montoya, M.D.1, Leidy Diana Piedrahita, Bacteriol.2
1. Profesor Asociado, Grupo de Inmunovirología, Facultad de Medicina, Universidad de Antioquia, Medellín, Colombia.
e-mail: cjmonto@une.net.co
2. Auxiliar de Investigación, Grupo de Inmunovirología, Facultad de Medicina, Universidad de Antioquia, Medellín, Colombia. e-mail: piedritas@gmail.com
Recibido para publicación septiembre 26, 2006 Aceptado para publicación octubre 8, 2007
RESUMEN
Las células dendríticas son un componente de la inmunidad innata que cumple con la función crucial de activar los linfocitos T vírgenes. Son una de las células blanco de la infección por el VIH-1, aunque la replicación de este virus en las células dendríticas es muy inferior a la observada en los linfocitos T CD4+. Sin embargo, las células dendríticas almacenan viriones por largo tiempo, para transmitirlos después a otras células susceptibles, y se convierten en uno de los reservorios más importantes del VIH-1. Durante esta infección, las células dendríticas hacen parte inicialmente de la respuesta inmune contra el VIH-1, pero luego exhiben alteraciones cuantitativas y funcionales que potencian la inmunodeficiencia característica de esa infección. El papel que cumplen las células dendríticas en la inducción de la respuesta inmune innata y adaptativa indica que tienen un potencial terapéutico interesante en el desarrollo de vacunas e inmunoterapia para la infección por el VIH-1.
Palabras clave: VIH-1; Células dendríticas mieloides y plasmacitoides; IFN-α; receptores tipo Toll; receptor DC-SIGN.
Dendritic cells during the HIV-1 infection
SUMMARY
Dendritic cells are components of the innate immunity crucial for activating naïve T cells. They are one of the target cells for HIV-1 infection, but their ability to replicate HIV-1 is much more limited than that exhibited by CD4+ T cells. However, they have the capacity to store the virus for long periods of time which are able to infect susceptible cells later on. Therefore, dendritic cells are considered as one of the most important reservoirs for the HIV-1. At early stages of this infection, dendritic cells also contribute with the anti-HIV-1 immune response, but then they exhibit quantitative and functional alterations enhancing the severe immunodeficiency characteristic of this infection. The important role of dendritic cells in inducing innate and adaptive immune responses indicates that these cells have a promising therapeutic potential for the development of vaccines and immunotherapy for HIV-1 infection.
Keywords: HIV-1; Myeloid and plasmacytoid dendritic cells; IFN-α; Toll-like receptor; DC-SIGN receptor.
La infección por el virus de la inmunodeficiencia humana tipo 1 (VIH-1) y su más grave complicación, el síndrome de inmunodeficiencia adquirida (SIDA), constituyen la pandemia humana más severa de todos los tiempos1. Es bien conocido que en respuesta a las infecciones virales, las células dendríticas (DC) maduran y se activan para promover la activación y función de otras subpoblaciones de leucocitos2; sin embargo, los estudios para evaluar el comportamiento de las DC durante la infección por el VIH-1 sólo cobraron un interés relevante en los últimos 10 años. Hasta el momento se han caracterizado diversas alteraciones cuantitativas y funcionales en las DC de los individuos con infección por el VIH-13,4 y se sugiere que estas anormalidades pueden potenciar la deficiencia inmune ocasionada por la pérdida de los linfocitos T CD4+, contribuyendo a la predisposición que tienen los pacientes infectados por el VIH-1 para desarrollar infecciones oportunistas y tumores. Además, la manipulación artificial de las DC en el desarrollo de estrategias de inmunoterapia y vacunas contra el VIH-1 viene cobrando fuerza en los últimos años. Esta revisión aborda aspectos generales de la ontogenia y fisiología de las DC, para luego dar una visión comprensiva de la compleja interación que existe entre estas células y el VIH-1, y finalmente revisar estrategias terapéuticas que implican la actividad funcional de las DC.
SUBPOBLACIONES Y FENOTIPO DE LAS CÉLULAS DENDRÍTICAS
Las DC corresponden a una subpoblación heterogénea de leucocitos originada en la médula ósea; estas células migran a los tejidos periféricos para ejercer su función de centinelas del organismo, sitios donde detectan la presencia de microorganismos invasores. En general, las DC existen en dos estados funcionales: inmaduras y maduras. Las DC inmaduras, localizadas en el torrente circulatorio y en tejidos como la piel y las mucosas, son células altamente eficientes en la captura de antígenos y expresan receptores de quimocinas que les permiten migrar a los sitos de inflamación. Después del reconocimiento de un microorganismo, estas células se activan, regulan positivamente la expresión de moléculas coestimuladoras y del complejo mayor de histocompatibilidad (CMH) clase I y II, y expresan «de novo» otros receptores de quimiocinas que les permiten migrar a los ganglios linfáticos regionales, donde como DC maduras tienen una inigualable capacidad de presentar péptidos antigénicos a los linfocitos T vírgenes2. Las DC maduras se caracterizan por una potente acción inmunoestimuladora, responsable de inducir la inmunidad adaptativa; para ello, se localizan en el área de las células T de los órganos linfoides secundarios. El fenotipo clásico de las DC maduras incluye una expresión de alta densidad en la superficie de CD40, CD83, moléculas coestimuladoras (CD80 y CD86) y el receptor de quimiocinas CCR75.
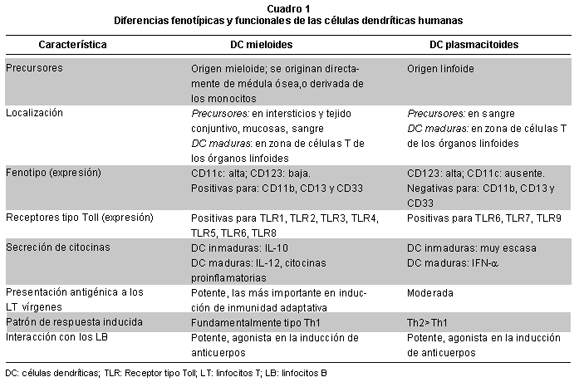
En la sangre periférica, las DC son heterogéneas y comprenden por lo menos dos subpoblaciones de células inmaduras, células dendríticas mieloides (DCM, CD11c+) y células dendríticas plasmacitoides (DCP, CD123+), que difieren en muchos aspectos fenotípicos y funcionales (Cuadro 1); provienen de un linaje distinto, expresan diferentes patrones de receptores tipo Toll (TLR) y de receptores de citocinas, al igual que secretan diferentes citocinas. Por lo anterior, se considera que los dos subtipos de DC circulantes responden a diferentes grupos de microorganismos, y cumplen funciones distintas en la inducción y regulación de la respuesta inmune2,5. Las DCM interceptan los gérmenes invasores en los tejidos periféricos, inician su proceso de maduración y migran a los tejidos linfoides secundarios regionales, donde presentan los péptidos antigénicos derivados de los microorganismos a las células T vírgenes específicas para ese antígeno. Las DCM son mejores presentadoras de antígenos, producen citocinas proinflamatorias e inmunorreguladoras (IL-12), y están comprometidas en la inducción de una respuesta tipo Th1. De otro lado, las DCP se encuentran de preferencia en la circulación, desde donde migran directamente a los órganos linfoides secundarios para ser activadas y producir grandes cantidades de IFN-α; cada DCP produce hasta 1,000 veces más IFN-α que cualquier otra célula en el organismo5,6. Las DCP tienen menor potencial como presentadoras de antígenos, tienen un compromiso mayor en la inducción de las respuestas tipo Th2 y juegan un papel importante en la protección contra las infecciones producidas por virus y gérmenes oportunistas7.
MECANISMOS DE RECONOCIMIENTO Y ACTIVACIÓN DE LAS CÉLULAS DENDRÍTICAS
En lugar de reconocer péptidos antigénicos específicos presentados por moléculas del CMH, las células de la inmunidad innata expresan moléculas denominadas receptores para el reconocimiento de patrones (PRR) y reconocen un amplio número de patrones macromoleculares que se asocian con los gérmenes patógenos (PAMP). El reconocimiento de los PAMP por los PRR es la forma más simple como un número limitado de receptores celulares puede distinguir muchos subgrupos de microorganismos. En respuesta al reconocimiento de estas estructuras microbianas conservadas, se desencadenan respuestas efectoras que están dirigidas a los diferentes subgrupos de microorganismos8.
Los TLR, el subgrupo de PRR que mejor se conoce, se expresan en las células de la inmunidad innata y median la activación de las DC gracias al reconocimiento de PAMP derivados de bacterias, micobacterias, espiroquetas, hongos y virus9. Hasta el presente se ha descrito la expresión de 10 TLR funcionales en los seres humanos (TLR1 al TLR10) y sólo se conocen los ligandos naturales para nueve de ellos; aunque existe un gen para el TRL11 humano, no se ha detectado como proteína10. Los receptores TLR1 y TLR6 forman heterodímeros con TLR2 para el reconocimiento de lipoproteínas y factores solubles derivados de neisserias, micoplasmas y estafilococos. El TLR2 también es receptor para los componentes de la pared de las bacterias grampositivas (peptidoglicano, ácido lipotiecocico), el zimosán de la pared de los hongos y las lipoproteínas de bacterias, micobacterias, espiroquetas y hongos. El TLR3 reconoce el ARN de doble cadena; el TLR4 es el receptor primario para el lipopolisacárido (LPS) de las bacterias gramnegativas, la proteína de fusión del virus respiratorio sincitial y la proteína HSP60 de las clamidias; el TLR5 es el receptor para la flagelina de las bacterias. El TLR7, y aparentemente también el TLR8, median la respuesta al ARN de cadena sencilla y compuestos de la familia de las imidazoquinolinas, que tienen actividad antiviral y antitumoral. El TLR9 es el receptor para el ADN bacteriano y para los oligodeoxirribonucleótidos sintéticos que contengan motivos CpG (CpG ODN)9.
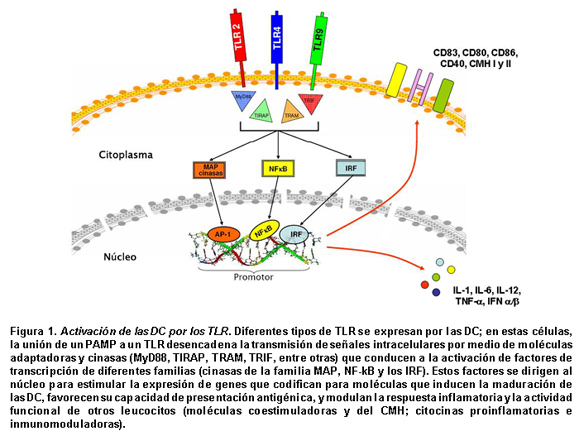
La activación por los TLR genera en las DC señales intracelulares mediadas por moléculas adaptadoras y cinasas que conducen a la activación y translocación al núcleo de factores de transcripción como NF-kB, AP-1 y los elementos de respuesta al interferón (IRF). El estímulo transcripcional de estos factores lleva rápidamente a la maduración de las DC, con aumento significativo en la expresión de moléculas coestimuladoras y del CMH, fenómenos asociados con un incremento en la capacidad de presentación antigénica. Además, estas células activadas secretan una amplia diversidad de citocinas, con propiedades proinflamatorias (TNF-α, IL-1α, IL-6) e inmunomoduladoras (IFN-αa, IFN-β, IL-12), que regulan el desarrollo de la respuesta inmune innata y adaptativa (Figura 1).
CÉLULAS DENDRÍTICAS E INFECCIÓN POR EL VIH-1
Según el estado funcional y de maduración, las DC expresan las moléculas clásicamente necesarias para la unión y fusión del VIH-1, como son las proteínas CD4, CCR5 y CXCR45. Además, las DCM también expresan receptores tipo lectina, como DC-SIGN (CD209), DEC-205 (CD205), los receptores de manosa (CD206) y la langerina (CD207), moléculas implicadas en la unión e internalización del VIH-1 hacia compartimentos endosomales11. La entrada de viriones a través de la molécula DC-SIGN permite almacenar las partículas virales en espacios endosomales no lisosomales, donde mantienen su capacidad infecciosa y quedan protegidos de la exposición a enzimas como la tripsina; desde este compartimento los viriones se pueden transferir a las células T CD4+ aun después de pasados varios días12. Los receptores de manosa son los más importantes para la unión de la gp120 e internalización del VIH-1 a las DC inmaduras de la dermis y de la epidermis13.
Las células de Langerhans fueron las primeras DC que se identificaron como susceptibles a la infección por el VIH-114. Desde entonces, se ha demostrado que los distintos tipos de DC pueden ser infectados in vivo por este virus. Sin embargo, se estima que la frecuencia de DC infectadas in vivo es 10 a 100 veces menor que la observada para las células T CD4+15. Aparentemente, las DCP son más susceptibles a la infección in vivo por el VIH-1 que las DCM, y se ha comprobado que las DCP de sangre periférica de individuos con el VIH-1 tenían mayor número de copias de ADN viral que las DCM16.
In vitro, las DC son sólo moderadamente susceptibles a la infección por el VIH-1, lo que puede depender de múltiples factores como el nivel de expresión de CD4+ y los correceptores, además del estado de actividad metabólica de la célula17. El VIH-1 puede infectar in vitro a casi todos los tipos de DC, incluyendo las DCM y las DCP purificadas de sangre periférica, así como las DCM derivadas de precursores CD34+ o de los monocitos CD14+ de sangre periférica. Sin embargo, el nivel de infección in vitro de las distintas DC por el VIH-1 es también mucho menor que el observado en las células T activadas in vitro. Se sabe que en las DC purificadas de sangre periférica, la replicación de VIH-1 ocurre sobre todo en las células inmaduras18; sin embargo, cuando las DC maduras están co-cultivadas con las células T CD4+, la replicación viral se aumenta sustancialmente en un proceso favorecido por la interacción entre las moléculas CD40 (expresadas por las DC) y CD40L (o CD154, expresada por los linfocitos T). Este hecho hace evidente que la interacción entre estas moléculas es uno de los mecanismos responsables del aumento en la tasa de infección y replicación del VIH-118.
Para generar una infección productiva, el VIH-1 debe integrar su genoma en el de la célula blanco; se ha observado que el genoma del VIH-1 se integra de preferencia en aquellos sitios del genoma del hospedero donde se localizan genes activos, que corresponden a lugares donde el ADN tiene menos condensación19. Esto explica el resultado diferencial de las infecciones por el VIH-1 en diversos subtipos de células y en distintos estados de maduración. Como ejemplo, las DC maduras y diferenciadas por completo son menos activas metabólicamente que las DC inmaduras, que a su vez son menos activas que las células T. La actividad transcripcional del genoma integrado o provirus está bajo la influencia del estado metabólico y de activación de la célula hospedera. En los extremos 5’ y 3’ del genoma viral existen las denominadas repeticiones terminales largas (LTR) que contienen sitios de unión para factores de transcripción de la célula hospedera como el NFAT-2, NF-kB y SP-1, los cuales regulan positivamente la trascripción del VIH-1.
Las DC en el establecimiento, transmisión y diseminación del VIH-1. Las células de Langerhans y las DCM subepiteliales son el blanco inicial del VIH-1 cuando la exposición se da a través de la mucosa del aparato genito-urinario20. Además, las dendritas o prolongaciones de las DC favorecen la captura de viriones presentes en la luz del intestino, pues se pueden extender a través de las células epiteliales de la mucosa intestinal21. La migración fisiológica de las DC favorece la diseminación del VIH-1, sea que estén infectadas productivamente o tan sólo transporten el virus en su superficie o su interior. Numerosas células de Langerhans CD1a+/CD83+/DC-SIGN+ se acumulan con rapidez en los órganos linfoides regionales durante la primera semana de infección22. La acumulación masiva de DC en el tejido linfoide explica el aumento dramático en el número de células T infectadas que se observa en los órganos linfoides durante las primeras semanas después de la transmisión. Las DC en los órganos linfoides también pueden servir como un reservorio del VIH-1, que continuamente contribuye a la infección de las células T vírgenes que fisiológicamente migran por esos tejidos15.
La presentación de péptidos antigénicos por las DC implica una estrecha interacción con las células T específicas de antígeno, mediadas por moléculas como LFA-1 e ICAM-1 que forman un aro alrededor del receptor antigénico de las células T (TCR) y de las moléculas del CMH. A esta interacción con agregación y concentración de receptores en una zona particular de la superficie celular se le llama la sinapsis inmunológica y precede a la activación de las células T. La infección por el VIH-1 se facilita por esa interacción entre las DC y los linfocitos T CD4+, pues en esa sinapsis también se concentran los correceptores CCR5 y CXCR4 y la molécula DC-SIGN, por lo que en este caso esa zona de contacto se denomina sinapsis infecciosa23. Cuando las DC entran en contacto con una célula T CD4+, las vesículas citoplasmáticas de las DC que contienen viriones se localizan y concentran en el área de la sinapsis infecciosa, exponen su contenido en la superficie de la DC y facilitan el paso de los viriones a las células T susceptibles.
Normalmente, las DC se necesitan para activar los linfocitos T CD4+ y CD8+ vírgenes, generar células efectoras y clones de memoria. Sin embargo, la interacción entre las DC y las células T infectadas con el VIH-1 lleva a una fuerte replicación viral y muerte de ambas células, fenómeno observado tanto in vivo como in vitro24. La replicación del VIH-1 en las DC y el efecto regulador negativo de algunas proteínas virales tienen que ver con alteraciones en la captura, procesamiento y presentación de los antígenos del VIH-1, y por ende con una activación deficiente de las células T25,26.
Otras fuentes de antígenos del VIH-1 presentados por las DC. Pese a las alteraciones descritas en la presentación antigénica y activación de los linfocitos T cuando el VIH-1 infecta las DC, se sabe muy bien que desde las etapas iniciales de la infección aparece una potente respuesta inmune contra este virus, mediada por linfocitos T CD4+ y CD8+; esto indica que existen células que hacen una presentación antigénica en condiciones adecuadas. Se postula que durante la respuesta primaria contra el VIH-1, las DC que no se infectaron pueden capturar antígenos y realizar presentación antigénica (presentación cruzada). En este proceso, los antígenos del VIH-1 presentados pueden provenir de células T infectadas que sufren apoptosis27, de complejos inmunes formados por virus y anticuerpos, e incluso de viriones no infecciosos. La presentación de antígenos del VIH-1 derivados de células apoptóticas parece ser más eficiente que la presentación de péptidos virales que se generan a partir de viriones no infecciosos; estos mecanismos de presentación cruzada activan los linfocitos T CD8+ específicos para el VIH-127. La eficiencia de la presentación antigénica que hacen las DC sin infección, se comprendió al observar que en las DC infectadas la proteína viral Tat inhibe la captación de cuerpos apoptóticos, y altera la actividad de la integrinaαvβ3 o reduce la expresión del receptor de manosa, dos moléculas que se relacionan con la captación de los cuerpos apoptóticos28.
El plasma de los pacientes VIH-1+ tiene la capacidad de opsonizar de manera adecuada este virus, ya sea que los viriones formen complejos inmunes con los anticuerpos, o se unan con proteínas derivadas de la activación del complemento o con la lectina fijadora de manosa29. Las DC no infectadas expresan receptores que pueden capturar virus opsonizados, como receptores para la fracción Fc de la inmunoglobulina G de los tipos FcgRI (CD64), FcgRII (CD32) y FcgRIII (CD16), y los receptores del complemento CR3 (CD11b/CD18) y CR4 (CD11c/CD18). Los antígenos opsonizados se pueden capturar y presentar en el contexto de moléculas del CMH-II, o se pueden presentar en forma cruzada por las DC en moléculas del CMH-I.
Asimismo, durante la replicación viral, casi todas las partículas virales producidas in vivo son defectuosas; sólo uno de cada 1,000 a 10,000 viriones es infeccioso. Estas partículas virales defectuosas, así como los virus químicamente inactivados con aldrithiol-2 (AT-2), se unen y fusionan a las DC de igual manera que los virus infecciosos silvestres30. Las DC sin infección presentan antígenos derivados de esos virus en moléculas del CMH-I y CMH-II, y generan linfocitos T CD4+ y CD8+ efectores y de memoria, específicos para el VIH-130. Esta capacidad de las DC para presentar antígenos de las partículas virales no infecciosas puede ser útil para el diseño de vacunas terapéuticas. De hecho, cuando las DC de monos rhesus infectados con el virus de la inmunodeficiencia simiana (VIS) se pulsaron mediante viriones inactivados con AT-2, se amplificó significativamente la respuesta específica de las células T CD4+ y CD8+, lo que llevó a una disminución significativa de la carga viral31. Estos hallazgos sugieren que la presentación por las DC de viriones defectuosos no infecciosos puede ocurrir in vivo, y jugar un papel en la generación de células T efectoras por un mecanismo independiente de la replicación viral.
Alteraciones cuantitativas, fenotípicas y funcionales de las DC durante la infección por el VIH-1. Los informes sobre el comportamiento cuantitativo y funcional de las DC in vivo durante la infección por el VIH-1 no son concluyentes; en particular, se han explorado poco las diferencias cualitativas y cuantitativas entre los distintos estadios clínicos de la infección y cómo influye la terapia antirretroviral altamente activa (TARVAA) en la actividad de estas células3,4,32-35. Los pacientes VIH-1+ presentan defectos en la regulación del sistema inmune en las diversas fases de la infección, y algunas de esas alteraciones ocurren antes que las células T CD4+ circulantes lleguen a un número muy bajo. Una disminución en el número y/o la respuesta funcional de las DC durante la infección por el VIH-1 puede potenciar la deficiencia inmunológica derivada de la pérdida de los linfocitos T CD4+, y aumentar las alteraciones en la respuesta contra el VIH-1, contra otros microorganismos patógenos y en la vigilancia antitumoral.
En la mayoría de las investigaciones con pacientes adultos VIH-1+ se ha identificado una disminución en el número absoluto de DCP en sangre periférica, que se puede observar incluso desde las primeras fases de la infección3,4,33,35, mientras que algunos estudios indican que las DCM se afectan menos34. La deficiencia cuantitativa de las DCP se correlacionó de modo negativo con la carga viral en el plasma y de manera positiva con el recuento de células CD4+ en sangre periférica4,35. En niños entre 10 y 14 años de edad infectados con el VIH-1, el recuento de DCP se encontró bajo en aquellos con replicación viral activa y disminución del porcentaje de linfocitos T CD4+, comparado con los niños con recuento estable de células T CD4+36. El efecto de la TARVAA sobre el número de DC no es claro. De acuerdo con algunos informes, cuando la carga viral se disminuye en forma considerable por la TARVAA se produce una recuperación del número de DCM en todos los pacientes, mientras que las DCP sólo se recuperan en algunos de ellos37. En contra de estos hallazgos, otros estudios informan que el número de DCP no aumenta en los individuos crónicamente infectados con el VIH-1 y tratados con TARVAA, lo que sugiere un efecto irreversible34. Las diferencias en estos estudios se pueden explicar por el uso de métodos distintos para caracterizar las diferentes subpoblaciones de DC y por variaciones en la población analizada de pacientes VIH-1+.
Con respecto al fenotipo, la exposición al VIH-1 induce la expresión de CCR7 tanto en las DCP como en las DCM, lo que puede explicar el incremento de esas DC en los nódulos linfoides durante la infección primaria por el VIH-138. En este tejido, las DC de pacientes VIH-1+ con infección aguda tienen una expresión reducida de las moléculas coestimuladoras CD80 y CD86, a diferencia de lo que se observa en las células de sangre periférica22. En los estadios tardíos de la infección, la maduración y función de las DC de sangre periférica también se ve afectada39. El deterioro observado en la maduración de las DC en los estadios agudos y tardíos de la infección por el VIH-1 puede ser un efecto viral directo o consecuencia de la baja expresión en las células T de las moléculas coestimuladoras CD40L y CD28, esenciales en la interacción entre las DC y las células T40.
Durante la infección por el VIH-1, las alteraciones en la presentación antigénica por las DC ocurren desde fases muy tempranas y se asocian con defectos en el desarrollo de la memoria inmunológica, fenómeno muy importante en la patogénesis de esta infección25,26. Se ha demostrado que las DC de sangre periférica de pacientes en distintos estadios de la infección tienen una disminución en su capacidad de estimular células T alogénicas, cuando se comparan con las DC de controles sanos25. A esta anormalidad funcional le comunica potencia la alta producción de IL-10 por las DC de los pacientes infectados por el VIH-141.
Las proteínas virales Nef, Vpu y Env pueden regular negativamente la expresión del receptor CD4 y de las moléculas del CMH-I en las DC y en las células T, y aumentan la incapacidad de las DC para activar las células T42. La proteína viral Nef aumenta la producción de IL-6, IL-8, MIP-1α y MIP-β por las DCM inmaduras, sin inducir su maduración43; también incrementa la expresión de DC-SIGN en las DC, y favorece el transporte y diseminación del virus44, e induce la expresión de TNF-α, FasL y TRAIL en las DCM, moléculas que favorecen la apoptosis de los linfocitos T por activación de los receptores de muerte celular45. La proteína viral Tat induce un aumento en la expresión de genes inductores del IFN-α como el IRF-7 y STAT1, mientras que regula negativamente genes de citocinas inflamatorias y la expresión del receptor de manosa, molécula comprometida en la endocitosis de antígenos, incluso los del VIH-146,47.
Papel de las DCP y los IFN tipo I en la patogénesis y el control del VIH-1. Estudios in vitro indican que la incubación de las DCP de sujetos sanos con partículas infecciosas o no infecciosas del VIH-1, induce la maduración de las DCP y estimula la producción de grandes cantidades de IFN-α48. Sin embargo, la capacidad de los mononucleares de pacientes VIH-1+ para producir IFN-α in vitro se ha visto notablemente reducida durante la infección primaria, fenómeno que fue parcialmente reversible después de un año de TARVAA49. Se observó que esa reconstitución de la producción de IFN-α posterior al comienzo de TARVAA ocurre antes que tenga lugar la recuperación en el recuento de células T CD4+; este hecho sugiere que la recuperación de la producción de IFN-α puede ser un marcador de reconstitución inmune de aparición más temprana que el recuento de linfocitos T CD4+. Además, en los individuos crónicamente infectados con el VIH-1 la TARVAA muestra resultados variables en cuanto a la recuperación del número de DCP y su capacidad in vitro para producir IFN-α50.
Los IFN tipo I, como el IFN-α y el IFN-β, tienen una potente actividad antiviral que se ha hecho evidente en estudios in vitro con el VIH-1 y en modelos murinos in vivo51,52. Es interesante que algunos enfermos VIH-1+ asintomáticos y que tienen un patrón muy lento de progreso de la infección (pese a no recibir TARVAA) presentan un número significativamente aumentado de DCP en sangre periférica, que tienen una producción normal de IFN-α3. Además, la correlación observada entre una alta producción de IFN tipo I, una carga viral baja y un recuento apropiado de células T CD4+ sugiere el papel potencial de estos IFN en el control de la infección por el VIH-1.
La actividad anti-VIH-1 de los IFN tipo I se puede explicar por varios mecanismos directos e indirectos. El IFN-α producido por las DCP bloquea directamente la replicación viral, y aumenta la supervivencia de las DCP al estimularlas en forma autocrina48. Los IFN tipo I potencian la actividad de las células NK (asesinas naturales), los linfocitos T citotóxicos y las células Th1; adicionalmente, el IFN-α aumenta el reconocimiento del VIH-1 por el sistema inmune adaptativo al aumentar la expresión de moléculas del CMH-I y de la familia B7 en las células presentadoras de antígenos51.
INMUNOTERAPIA Y VACUNACIÓN PARA EL VIH-1 CON CÉLULAS DENDRÍTICAS
La TARVAA ha demostrado su efectividad para reducir la replicación viral hasta niveles prácticamente indescubribles; esto se traduce en una recuperación parcial de la respuesta inmune y una reducción significativa en la incidencia de infecciones oportunistas y la mortalidad relacionada con el VIH-153. Sin embargo, cuando se suspende la TARVAA se presenta un fenómeno de rebote en la carga viral y una nueva caída en el recuento de células T CD4+, hasta niveles similares a los observados antes de iniciar estos medicamentos. Además, se ha observado que la TARVAA, aun administrada por varios años, es incapaz de eliminar con efectividad los reservorios del VIH-154. La capacidad de la TARVAA para reestablecer la inmunocompetencia es incompleta, sobre todo en los pacientes con enfermedad crónica y en estadios avanzados. Además, el uso de la TARVAA se asocia con complicaciones como la aparición de resistencia viral, efectos tóxicos, intolerancia a los medicamentos y la mala adherencia a los esquemas de tratamiento; por todo esto, se requiere desarrollar terapias complementarias, de modo especial las que permitan compensar las limitaciones de la TARVAA. Si se considera el papel básico que tienen las DC en el desarrollo de la respuesta inmune innata y adaptativa para el control de las infecciones de origen viral y por agentes oportunistas, las estrategias de inmunoterapia dirigidas a potenciar la respuesta de las DC son promisorias en la infección por el VIH-1.
Activación de las DC con agonistas de los TLR . La atenuación de la toxicidad del LPS de las bacterias gramnegativas mediante procedimientos químicos permitió producir una molécula conocida como lípido A monofosforilado (MPL), que conserva la actividad inmunoestimuladora del LPS pero pierde su toxicidad. El MPL genera señales de activación por medio del TLR4 y aumenta la función de las DC, y favorece el desarrollo de respuestas adaptativas tanto celulares como humorales55. El MPL se ha administrado sin mayores efectos secundarios a seres humanos en varios ensayos clínicos de vacunas; en particular, se observó que el MPL en combinación con GM-CSF aumenta la inmunogenicidad de una vacuna con subunidades de la envoltura del VIH-156. Sin embargo, el MPL no se evaluó directamente como inmunoterapia única para la reconstitución inmune en individuos infectados con el VIH-1.
Las DCP expresan TLR7 y responden a los compuestos de la familia de las imidazoquinolinas, pues aumentan la expresión de moléculas coestimuladoras y la producción de IFN-α. Asimismo, las DCM expresan TLR8 y en respuesta a estas moléculas maduran y secretan IL-12, sin producción demostrable de IFN-α. Los efectos de los agonistas de TLR7 y TLR8 pueden ser útiles para aumentar la capacidad de las DC de activar las células T específicas contra el VIH-1, lo que apoya el uso clínico experimental de estos agonistas como adyuvantes de vacunas anti-VIH-1 o como terapia inmunomoduladora en esta infección57. Los estudios con DCP y DCM óptimamente estimuladas con agonistas de TLR7/TLR8, y expuestas a citomegalovirus (CMV) o antígenos del VIH-1, mostraron un aumento en la respuesta de las células T de memoria específicas para el VIH-1 y el CMV, fenómeno que se evaluó en términos de la producción de citocinas57. Además, primates no humanos inmunizados con la proteína Gag del VIH-1 y con agonistas de TLR7/TLR8 presentaron un aumento significativo de la repuesta tipo Th1 y de anticuerpos específicos contra Gag59.
Los CpG ODN son moléculas sintéticas de ADN no metilado que imitan el ADN bacteriano y son reconocidas por el TLR960. Las DCP expresan TLR9 y se activan directamente con los CpG ODN, para aumentar la expresión de moléculas del CMH-I y II, las moléculas coestimuladoras CD40, CD80 y CD86, e inducir una potente secreción de citocinas7,61. Las DCP activadas por CpG ODN tienen la capacidad de estimular indirectamente (por medio del IFN-α y otras citocinas) los monocitos, las DCM, las células asesinas naturales (NK) y los linfocitos T CD4+ y CD8+. Por esto se considera que la administración in vivo de los CpG ODN puede potenciar en forma general la respuesta inmune, y sería una excelente estrategia de inmunoterapia para restaurar deficiencias inmunes. Algunos estudios recientes evaluaron la capacidad de los CpG ODN para actuar como adyuvantes; los ratones inmunizados con CpG ODN y la proteína gp120 de VIH-1 desarrollaron anticuerpos y respuestas celulares específicas contra el VIH-1, incluyendo la producción de citocinas Th1 y aumento en la actividad de los linfocitos T citotóxicos.
Inmunoterapia para el VIH-1 con DC autólogas. Aunque la infección por el VIH-1 afecta negativamente la funcionalidad de las DC, es posible aislar estas células de un paciente VIH-1+ y manipularlas ex vivo hasta obtener una población celular funcional y libre de infección62. Con sangre venosa de individuos crónicamente infectados por el VIH-1 (sin TARVAA, con carga viral estable superior a 11,000 copias/ml y un recuento de linfocitos T CD4+ mayor de 300 células/ml), se obtuvieron DC a partir de los monocitos autólogos que se desafiaron posteriormente con virus inactivados con AT-2; la re-infusión de estas células se asoció con una disminución superior a 80% en la carga viral31. El recuento de células T CD4+ se incrementó durante un período, pero retornó a su estado basal de nuevo; sin embargo, se observó un incremento significativo en el número de linfocitos T CD4+ específicos para el VIH-1 que expresan IL-2 e IFN-γ, además de altos niveles de expresión de perforinas por los linfocitos T CD8+ específicos para Gag31. En otro estudio con sujetos crónicamente infectados con el VIH-1 que tenían un recuento de células T CD4+ mayor de 500 células/ml, se retó a las DCM con virus autólogos inactivados por calor y luego se administraron a los pacientes por vía subcutánea63; se observó una disminución significativa de la carga viral y mejoría en la respuesta proliferativa de las células T CD4+ y CD8+. En los órganos linfoides se pudo apreciar un incremento significativo en la frecuencia de los linfocitos T citotóxicos, lo que se correlacionó con un retraso en el efecto rebote de la carga viral después de interrumpir la TARVAA63. Estos trabajos demuestran el potencial de la manipulación ex-vivo de las DC autólogas para inducir una respuesta inmune celular adaptativa que contribuya a controlar la replicación viral.
Vacunas de ADN y las DC . Las vacunas no replicativas inducen una respuesta inmune parcial, pues estos antígenos se captan pobremente para su procesamiento y presentación; por eso, inducen una aceptable respuesta inmune de tipo humoral, pero activan débilmente los linfocitos T citotóxicos. Las vacunas constituidas por ADN donde hay las secuencias que codifican para los antígenos de interés, tienen un mejor efecto inductor de la inmunidad celular debido a que, aunque las células somáticas son las que se infectan mayoritariamente, las DC también se pueden incorporar directamente con ADN viral exógeno y los péptidos de la proteína recién sintetizados en el citosol se pueden presentar a los linfocitos T CD8+ en moléculas del CMH-I; asimismo, la proteína se puede secretar, endocitar, procesar y presentar por las DC en el contexto de las moléculas del CMH-II a los linfocitos T CD4+64,65.
Los estudios con vacunas de ADN para prevenir el VIH-1 se iniciaron en un modelo animal. Varios ratones se vacunaron con plásmidos que contenían las secuencias que codifican para la envoltura del VIH-1 (Env), además de secuencias para MIP-1α (quimiocina capaz de reclutar y activar DC inmaduras) y para el Flt3L, (factor de crecimiento que expande el número de DC en ratones y humanos)65. Esta vacuna indujo el reclutamiento de las DC al sitio de inoculación, las que expresaban marcadores de activación y maduración; esas DC maduras migraron a los órganos linfoides secundarios e indujeron la activación de los centros germinales.
CONCLUSIONES
Las DC ocupan un lugar crítico durante el desarrollo de la respuesta inmune, pues tienen actividad inmunorreguladora y son las células presentadoras de antígenos más potentes, con exclusividad en la activación de los linfocitos T vírgenes. Debido a su ubicación como centinelas en los sitios de exposición antigénica, las DC son las células más importantes en la transmisión y expansión del VIH-1 durante las primeras fases de la infección, sobre todo cuando el virus ingresa por las mucosas. El VIH-1 tiene la capacidad de infectar las diferentes DC humanas, con un resultado variable que va desde un efecto citopático directo hasta alteraciones funcionales severas que impiden una presentación antigénica adecuada y la producción normal de citocinas. También varias proteínas del VIH-1 inducen anormalidades funcionales en las DC, además de un estado de hiperactivación que puede conducir a apoptosis. A pesar de este sombrío panorama, hay evidencias sobre el papel que las DC pueden tener en la protección contra la infección por el VIH-1, tanto en condiciones naturales por la secreción de b quimiocinas y los IFN tipo I, como en condiciones artificiales mediante su manipulación ex vivo o in vivo para el desarrollo de vacunas y otras estrategias de inmunoterapia. Conocer más profundamente el comportamiento de las DC durante la infección por el VIH-1 permitirá en el futuro cercano hacer una prevención temprana de los daños inducidos por el VIH-1 en estas células, a la vez que se podrá aumentar la potencia de sus acciones inmunomoduladoras para controlar con mayor eficiencia esta infección.
REFERENCIAS
1. UNAIDS/WHO. AIDS epidemic update 2005. Geneva: Joint United Nations Programme on HIV/AIDS (UNAIDS) and World Health Organization (WHO); April 2006. [ Links ]
2. Grabbe S, Kampgen E, Schuler G. Dendritic cells: multi-lineal and multi-functional. Immunol Today 2000; 21: 431-433. [ Links ]
3. Soumelis V, Scott I, Gheyas F, Bouhour D, Cozon G, Cotte L, et al. Depletion of circulating natural type I interferon-producing cells in HIV-infected AIDS patients. Blood 2001; 98: 906-912. [ Links ]
4. Donaghy H, Pozniak A, Gazzard B, Qazi N, Gilmour J, Gotch F, et al. Loss of blood CD11c+ myeloid and CD11c- plasmacytoid dendritic cells in patients with HIV-1 infection correlates with HIV-1 RNA virus load. Blood 2001; 98: 2574-2576. [ Links ]
5. Banchereau J, Briere F, Caux C, Davoust J, Lebecque S, Liu YJ, et al. Immunobiology of dendritic cells. Annu Rev Immunol 2000; 18: 767-811. [ Links ]
6. Siegal FP, Kadowaki N, Shodell M, Fitzgerald-Bocarsly PA, Shah K, Ho S, et al. The nature of the principal type 1 interferon-producing cells in human blood. Science 1999; 284: 1835-1837. [ Links ]
7. Rothenfusser S, Tuma E, Endres S, Hartmann G. Plasmacytoid dendritic cells: the key to CpG. Hum Immunol 2002; 63: 1111-1119. [ Links ]
8. Janeway CA, Medzhitov R. Innate immune recognition. Ann Rev Immunol 2002; 20: 197-216. [ Links ]
9. Takeda K, Kaisho T, Akira S. Toll-like receptors. Ann Rev Immunol 2003; 21: 335-376. [ Links ]
10. Lauw FN, Caffrey DR, Golenbock DT. Of mice and man: TLR11 (finally) finds profilin. Trends Immunol 2005; 26: 509-511. [ Links ]
11. Pohlmann S, Baribaud F, Doms RW. DC-SIGN and DC-SIGNR: helping hands for HIV. Trends Immunol 2001; 22: 643-646. [ Links ]
12. Kwon DS, Gregorio G, Bitton N, Hendrickson WA, Littman DR. DC-SIGN-mediated internalization of HIV is required for trans-enhancement of T cell infection. Immunity 2002; 16: 135-144.. [ Links ]
13. Turville S, Wilkinson J, Cameron P, Dable J, Cunningham AL. The role of dendritic cell C-type lectin receptors in HIV pathogenesis. J Leukoc Biol 2003; 74: 710-718.. [ Links ]
14. Niedecken H, Lutz G, Bauer R, Kreysel HW. Langerhans cell as primary target and vehicle for transmission of HIV. Lancet 1987; 2: 519-520[ [ Links ]STANDARDIZEDENDPARAG]
15. McIlroy D, Autran B, Cheynier R, Wain-Hobson S, Clauvel JP, Oksenhendler E, et al. Infection frequency of dendritic cells and CD4+ T lymphocytes in spleens of human immunodeficiency virus-positive patients. J Virol 1995; 69: 4737-4745. [ Links ]
16. Patterson S, Rae A, Hockey N, Gilmour J, Gotch F. Plasmacytoid dendritic cells are highly susceptible to human immunodeficiency virus type 1 infection and release infectious virus. J Virol 2001;75: 6710-6713. [ Links ]
17. Tsunetsugu-Yokota Y, Akagawa K, Kimoto H, Suzuki K, Iwasaki M, Yasuda S, et al. Monocyte-derived cultured dendritic cells are susceptible to human immunodeficiency virus infection and transmit virus to resting T cells in the process of nominal antigen presentation. J Virol 1995;69: 4544-4547. [ Links ]
18. Weissman D, Li Y, Orenstein JM, Fauci AS. Both a precursor and a mature population of dendritic cells can bind HIV. However, only the mature population that expresses CD80 can pass infection to unstimulated CD4+ T cells. J Immunol 1995; 155: 4111-4117. [ Links ]
19. Schroder AR, Shinn P, Chen H, Berry C, Ecker JR, Bushman F. HIV-1 integration in the human genome favors active genes and local hotspots. Cell 2002; 110: 521-529. [ Links ]
20. Spira AI, Marx PA, Patterson BK, Mahoney J, Koup RA, Wolinsky SM, et al. Cellular targets of infection and route of viral dissemination after an intravaginal inoculation of simian immunodeficiency virus into rhesus macaques. J Exp Med 1996; 183: 215-225. [ Links ]
21. Rescigno M, Urbano M, Valzasina B, Francolini M, Rotta G, Bonasio R, et al. Dendritic cells express tight junction proteins and penetrate gut epithelial monolayers to sample bacteria. Nat Immunol 2001; 2: 361-367. [ Links ]
22. Lore K, Sonnerborg A, Brostrom C, Goh LE, Perrin L, McDade H, et al. Accumulation of DC-SIGN+CD40+ dendritic cells with reduced CD80 and CD86 expression in lymphoid tissue during acute HIV-1 infection. AIDS 2002; 16: 683-692. [ Links ]
23. Arrighi JF, Pion M, Garcia E, Escola JM, van Kooyk Y, Geijtenbeek TB, et al. DC-SIGN-mediated infectious synapse formation enhances X4 HIV-1 transmission from dendritic cells to T cells. J Exp Med 2004; 200: 1279-1288. [ Links ]
24. Pope M, Betjes MG, Romani N, Hirmand H, Cameron PU, Hoffman L, et al. Conjugates of dendritic cells and memory T lymphocytes from skin facilitate productive infection with HIV-1. Cell 1994; 78: 389-398. [ Links ]
25. Donaghy H, Gazzard B, Gotch F, Patterson S. Dysfunction and infection of freshly isolated blood myeloid and plasmacytoid dendritic cells in patients infected with HIV-1. Blood 2003; 101: 4505-4511. [ Links ]
26. Macatonia SE, Patterson S, Knight SC. Suppression of immune responses by dendritic cells infected with HIV. Immunology 1989; 67: 285-289. [ Links ]
27. Zhao XQ, Huang XL, Gupta P, Borowski L, Fan Z, Watkins SC, et al. Induction of anti-human immunodeficiency virus type 1 (HIV-1) CD8(+) and CD4(+) T-cell reactivity by dendritic cells loaded with HIV-1 X4-infected apoptotic cells. J Virol 2002; 76: 3007-3014. [ Links ]
28. Zocchi MR, Poggi A, Rubartelli A. The RGD-containing domain of exogenous HIV-1 Tat inhibits the engulfment of apoptotic bodies by dendritic cells. AIDS 1997; 11: 1227-1235. [ Links ]
29. Stoiber H, Speth C, Dierich MP. Role of complement in the control of HIV dynamics and pathogenesis. Vaccine 2003; 21(Suppl 2): 77-82. [ Links ]
30. Larsson M, Fonteneau JF, Lirvall M, Haslett P, Lifson JD, Bhardwaj N. Activation of HIV-1 specific CD4 and CD8 T cells by human dendritic cells: roles for cross-presentation and non-infectious HIV-1 virus. AIDS 2002; 16: 1319-1329. [ Links ]
31. Lu W, Arraes LC, Ferreira WT, Andrieu JM. Therapeutic dendritic-cell vaccine for chronic HIV-1 infection. Nat Med 2004; 10: 1359-1365. [ Links ]
32. Grassi F, Hosmalin A, McIIroy D, Calvez V, Debre P, Autran B. Depletion in blood CD11c-positive dendritic cells from HIV-infected patients. AIDS 1999; 13: 759-766. [ Links ]
33. Feldman S, Stein D, Amrute S, Denny T, Garcia Z, Kloser P, et al. Decreased interferon-alpha production in HIV-infected patients correlates with numerical and functional deficiencies en circulating type 2 dendritic cells precursors. Clin Immunol 2001; 101: 201-210. [ Links ]
34. Chehimi J, Campbell DE, Azzoni L, Bacheller D, Papasavvas E, Jerandi G, et al. Persistent decreases in blood plasmacytoid dendritic cell number and function despite effective highly active antiretroviral therapy and increased blood myeloid dendritic cells in HIV-infected individuals. J Immunol 2002; 168: 4796-4801. [ Links ]
35. Barron MA, Blyveis N, Palmer BE, MaWhinney S, Wilson CC. Influence of plasma viremia on defects in number and immunophenotype of blood dendritic cell subsets in human immunodeficiency virus 1-infected individuals. J Infect Dis 2003; 187: 26-37. [ Links ]
36. Azzoni L, Rutstein RM, Chehimi J, Farabaugh MA, Nowmos A, Montaner LJ. Dendritic and natural killer cell subsets associated with stable or declining CD4+ cell counts in treated HIV-1-infected children. J Infect Dis 2005; 191: 1451-1459. [ Links ]
37. Gompels M, Patterson S, Roberts MS, Macatonia SE, Pinching AJ, Knight SC. Increase in dendritic cell numbers, their function and the proportion uninfected during AZT therapy. Clin Exp Immunol 1998; 112: 347-353. [ Links ]
38. Choi YK, Fallert BA, Murphey-Corb MA, Reinhart TA. Simian immunodeficiency virus dramatically alters expression of homeostatic chemokines and dendritic cell markers during infection in vivo. Blood 2003; 101: 1684-1691. [ Links ]
39. Hsieh SM, Pan SC, Hung CC, Chen MY, Chang SC. Differential impact of late-stage HIV-1 infection on in vitro and in vivo maturation of myeloid dendritic cells. J Acquir Immune Defic Syndr 2003; 33: 413-419. [ Links ]
40. Vanham G, Penne L, Devalck J, Kestens L, Colebunders R, Bosmans E, et al. Decreased CD40 ligand induction in CD4 T cells and dysregulated IL-12 production during HIV infection. Clin Exp Immunol 1999; 117: 335-342. [ Links ]
41. Carbonneil C, Donkova-Petrini V, Aouba A, Weiss L. Defective dendritic cell function in HIV-infected patients receiving effective highly active antiretroviral therapy: neutralization of IL-10 production and depletion of CD4+CD25+ T cells restore high levels of HIV-specific CD4+ T cell responses induced by dendritic cells generated in the presence of IFN-alpha. J Immunol 2004; 17: 7832-7840. [ Links ]
42. Seelamgari A, Maddukuri A, Berro R, de la Fuente C, Kehn K, Deng L, et al. Role of viral regulatory and accessory proteins in HIV-1 replication. Front Biosci 2004; 9: 2388-2413. [ Links ]
43. Messmer D, Jacque JM, Santisteban C, Bristow C, Han SY, Villamide-Herrera L, et al. Endogenously expressed nef uncouples cytokine and chemokine production from membrane phenotypic maturation in dendritic cells. J Immunol 2002; 169: 4172-4182. [ Links ]
44. Sol-Foulon N, Moris A, Nobile C, Boccaccio C, Engering A, Abastado JP, et al. HIV-1 Nef-induced upregulation of DC-SIGN in dendritic cells promotes lymphocyte clustering and viral spread. Immunity 2002;16: 145-155. [ Links ]
45. Lichtner M, Maranon C, Azocar O, Hanau D, Lebon P, Burgard M, et al. HIV type 1-infected dendritic cells induce apoptotic death in infected and uninfected primary CD4 T lymphocytes. AIDS Res Hum Retroviruses 2004; 20:175-182. [ Links ]
46. Izmailova E, Bertley FM, Huang Q, Makori N, Miller CJ, Young RA, et al. HIV-1 Tat reprograms immature dendritic cells to express chemoattractants for activated T cells and macrophages. Nat Med 2003; 9: 191-197. [ Links ]
47. Caldwell RL, Egan BS, Shepherd VL. HIV-1 Tat represses transcription from the mannose receptor promoter. J Immunol 2000; 165: 7035-7041. [ Links ]
48. Fonteneau JF, Larsson M, Beignon AS, McKenna K, Dasilva I, Amara A, et al. Human immunodeficiency virus type 1 activates plasmacytoid dendritic cells and concomitantly induces the bystander maturation of myeloid dendritic cells. J Virol 2004; 78: 5223-5232. [ Links ]
49. Piasecki E, Knysz B, Gasiorowski J, Gladysz A. Decrease of enhanced interferon alpha levels in sera of HIV-infected and AIDS patients receiving combined antiretroviral therapy. Arch Immunol Ther Exp 1999; 47: 37-44. [ Links ]
50. Soumelis V, Scott I, Liu YJ, Levy JA. Natural type I interferon producing cells in HIV infection. Hum Immunol 2002; 63: 1206-1212. [ Links ]
51. Bogdan C. The function of type I interferons in antimicrobial immunity. Curr Opin Immunol 2000; 12: 419-424. [ Links ]
52. Lapenta C, Santini SM, Proietti E, Rizza P, Logozzi M, Spada M, et al. Type I interferon is a powerful inhibitor of in vivo HIV-1 infection and preserves human CD4(+) T cells from virus-induced depletion in SCID mice transplanted with human cells. Virology 1999; 263: 78-88. [ Links ]
53. Palella FJ, Delaney KM, Moorman AC, Loveless MO, Fuhrer J, Satten GA, et al. Declining morbidity and mortality among patients with advanced human immunodeficiency virus infection. N Engl J Med 1998; 338: 853-860. [ Links ]
54. Finzi D, Blankson J, Siliciano JD, Margolick JB, Chadwick K, Pierson T, et al. Latent infection of CD4+ T cells provides a mechanism for lifelong persistence of HIV-1, even in patients on effective combination therapy. Nat Med 1999; 5: 512-517. [ Links ]
55. De Becker G, Moulin V, Pajak B, Bruck C, Francotte M, Thiriart C, et al. The adjuvant monophosphoryl lipid A increases the function of antigen-presenting cells. International Immunol 2000; 12: 807-815. [ Links ]
56. Liao HX, Cianciolo GJ, Staats HF, Scearce RM, Lapple DM, Stauffer SH, et al. Increased immunogenicity of HIV envelope subunit complexed with alpha2-macroglobulin when combined with monophosphoryl lipid A and GM-CSF. Vaccine 2002; 20: 2396-2403. [ Links ]
57. Schlaepfer E, Audigé A, Joller H, Speck RF. TLR7/8 triggering exerts opposing effects in acute versus latent HIV infection. J Immunol 2006; 176: 2888-2895. [ Links ]
58. Lore K, Betts MR, Brenchley JM, Kuruppu J, Khojasteh S, Perfetto S, et al. Toll-like receptors ligands modulate dendritic cells to augment cytomegalovirus- and HIV-1-specific T cell responses. J Immunol 2003; 171: 4320-4328. [ Links ]
59. Wille-Reece U, Flynn BJ, Lore K, Koup RA, Kedl RM, Mattapallil JJ, et al. HIV Gag protein conjugated to a Toll-like receptor 7/8 agonist improves the magnitude and quality of Th1 and CD8+ T cell responses in nonhuman primates. Proc Natl Acad Sci USA 2005; 102: 15190-15194. [ Links ]
60. Krug A, Rothenfusser S, Hornung V, Jahrsdorfer B, Blackwell S, Ballas ZK, et al. Identification of CpG oligonucleotide sequences with high induction of IFN-alpha/beta in plasmacytoid dendritic cells. Eur J Immunol 2001; 31: 2154-2163. [ Links ]
61. Kranzer K, Bauer M, Lipford GB, Heeg K, Wagner H, Lang R. CpG-oligodeoxynucleotides enhance T-cell receptor-triggered interferon-gamma production and up-regulation of CD69 via induction of antigen-presenting cell-derived interferon type I and interleukin-12. Immunology 2000; 99: 170-178. [ Links ]
62. Chougnet C, Cohen SS, Kawamura T, Landay AL, Kessler HA, Thomas E, et al. Normal immune function of monocyte-derived dendritic cells from HIV-infected individuals: implications for immunotherapy. J Immunol 1999; 163: 1666-1673. [ Links ]
63. Garcia F, Lejeune M, Climent N, Gil C, Alcami J, Morente V, et al. Therapeutic immunization with dendritic cells loaded with heat-inactivated autologous HIV-1 in patients with chronic HIV-1 infection. J Infect Dis 2005; 191: 1680-1685. [ Links ]
64. Shedlock DJ, Weiner DB. ADN vaccination: antigen presentation and the induction of immunity. J Leukoc Biol 2000; 68: 793-806. [ Links ]
65. Kutzler MA, Weiner DB. Developing DNA vaccines that call to dendritic cells. J Clin Invest 2004; 114: 1241-1244. [ Links ]