Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Colombia Médica
On-line version ISSN 1657-9534
Colomb. Med. vol.39 suppl.2 Cali June 2008
Análisis de la inestabilidad de microsatélites mediante el marcador BAT-26 en una muestra de pacientes del Hospital Universitario de Santander con diagnóstico de cáncer gástrico o colorrectal
Wilmer Cárdenas, BsC1, Adriana Castillo, MSc2, Clara Vargas, MSc3, Olga Moreno, MSc4, Jesús Insuasti, MD5
1. Biólogo, Laboratorio de Genética, Facultad de Salud, Universidad Industrial de Santander, Bucaramanga, Colombia. e-mail: wcardenas@ciencias.uis.edu.co drerus@msn.com
2. Coordinadora, Laboratorio de Genética, Facultad de Salud, Universidad Industrial de Santander, Bucaramanga, Colombia. e-mail: castillo@uis.edu.co
3. Directora, Laboratorio de Genética, Facultad de Salud, Universidad Industrial de Santander, Bucaramanga, Colombia. e-mail: cvargas@uis.edu.co
4. Citogenetista, Laboratorio de Genética, Facultad de Salud, Universidad Industrial de Santander, Bucaramanga, Colombia. e-mail: olmoni@uis.edu.co
5. Oncólogo clínico, Departamento de Oncología, Hospital Universitario de Santander, Bucaramanga, Colombia. e-mail: jesusinsuastyasco@hotmail.com
Recibido para publicación agosto 27, 2007 Aceptado para publicación abril 18, 2008
RESUMEN
Introducción: La vía de inestabilidad de microsatélites se ha encontrado sobre todo en cánceres de vías digestivas, de los cuales 90% de los casos pertenecen a pacientes con cáncer hereditario y 15% con cáncer esporádico. De ella se deriva un fenotipo denominado de inestabilidad de microsatélites (IMI+) o fenotipo de error de la replicación (RER+) que induce a la acumulación de mutaciones en tasas más elevadas a las normales.
Objetivos: Identificar la presencia del fenotipo IMI+ en los pacientes analizados y evaluar su relación con la diferenciación histopatológica del tumor porque en conjunto han sido asociados con un mejor pronóstico y una mejor respuesta al tratamiento dado.
Metodología: Se extrajo ADN de las muestras de sangre (células normales) y las biopsias de tumor (células tumorales) de los 23 pacientes que se pudieron incluir para el estudio y mediante la amplificación por PCR y posterior electroforesis capilar; se tipificó el microsatélite mononucleotídico BAT-26, empleado por su sensibilidad para descubrir el fenotipo IMI+. Finalmente se hizo una correlación estadística según la presencia (IMI+) o ausencia (IMI-) del fenotipo, con los hallazgos histopatológicos utilizando la prueba exacta de Fisher.
Resultados: Del total de pacientes, 4 (17%) presentaron IMI+: 3 de ellos con cáncer colorrectal (2 casos posiblemente con cáncer hereditario) y uno con cáncer gástrico. No se encontró ninguna asociación entre el fenotipo IMI+ con el diagnostico patológico, la edad, el sexo y la diferenciación histopatológica del tumor.
Conclusión: Se encontró el fenotipo IMI+ en 17% de los casos, sin asociación con el grado de diferenciación histopatológica del tumor, posiblemente por el reducido número de muestras tipificadas, por lo cual es indispensable revisar los métodos de fijación, parafinación y almacenamiento de tejidos, pues las técnicas actuales dificultan la digestión de la proteinaza k y la PCR.
Palabras clave: Cáncer gástrico; Cáncer colorrectal; Inestabilidad de microsatélites; Biopsias de tumor; Sangre; Extracción de ADN; Grado de diferenciación histopatológica.
Microsatellite instability analysis using BAT-26 marker in patients with gastric or colorectal cancer diagnosed at Hospital Universitario de Santander
SUMMARY
Introduction: The path of microsatellite instability has mainly been found in cancers of digestive tracts, of which 90% of cases are hereditary cancer patients and 15% are patients with sporadic cancer. That instability produces a phenotype called Microsatellite instability (IMI+) or phenotype by replication mistake (RER+) that leads to the accumulation of mutations in higher rates to normal.
Objectives: To identify the presence of IMI+ phenotype in patients analyzed and evaluated its relationship with the differentiation histopathologic tumor, because which together have been associated with a better prognosis and improved response to treatment given to the patient.
Methodology: DNA was extracted from blood samples (normal cells) and biopsy of the tumor (tumor cells) of the 23 patients who were included in the study and through the amplification by PCR and subsequent capillary electrophoresis was typified the microsatellite mononucleotidic BAT-26, who was employed by his sensitivity to detect IMI+ phenotype (95%). Finally, we made a statistical correlation between the microsatellite instability phenotype, the presence (IMI+) or the absence (IMI-), with histopathological findings using Fisher’s exact test.
Results: In 17% of cases (4 patients) had IMI+: 3 of them with colorectal cancer (CRC) -2 cases possibly with hereditary cancer- and one with gastric cancer (GC). There was no association between phenotype IMI+ with the pathological diagnosis, age, sex and differentiation histopathologic tumor.
Conclusion: We found the phenotype IMI + in 17% of cases without association with the degree of differentiation histopathologic tumor, possibly by the reduced number of samples analyzed, making it essential to review the methods of fixation, paraffin and storage tissue because current techniques hinder digestion of proteinase k and PCR.
Keywords: Gastric cancer; Colorectal cancer; Tumor biopsy; Microsatellites instability; Blood; DNA extraction; Differentiation histopathologic tumor.
Se han descrito varias causas que inducen la carcinogénesis, las cuales llevan a mutaciones en genes esenciales para el mantenimiento de la fidelidad genética y el control del ciclo celular. La mayor causa de mutación en estos genes, está relacionada con el estilo de vida de los individuos; condiciones como alimentación, consumo de tabaco y alcohol entre otros, que alteran el comportamiento hormonal e influyen en la proliferación cancerígena de algunos Tipos de cáncer. También se han encontrado involucrados factores genéticos primarios (hereditarios) y la hipermetilación; en esta última posiblemente está involucrada la ADN metiltransferasa que se encarga de metilar las citosinas en la región promotora de los genes1-4. La alta prevalencia de cáncer a nivel mundial, ha generado que una gran cantidad de investigaciones se orienten a tratar de dilucidar su origen y como producto de éstas se han logrado diferenciar dos vías de formación del cáncer conocidas como la vía de inestabilidad cromosómica o supresora (IC) a la cual pertenecen entre 80% y 85% de los cánceres conocidos y la vía de inestabilidad de microsatélites o mutadora (IMI) a la cual pertenece el restante 15% y 20% de los tumores malignos. En la vía supresora los genes implicados son los protooncogenes y genes supresores de tumor encargados de regular el crecimiento y proliferación celular y en donde es característico que el tumor presente una marcada pérdida de heterocigosidad (LOH), aneuploidia y una gran asociación con un comportamiento bastante agresivo, reduciendo la expectativa de vida del paciente a menos de 74% a 80%. En la vía mutadora por el contrario, se encuentran involucrados aquellos genes que codifican para las enzimas que conforman el sistema de reparación de errores de la replicación, el cual al presentar alguna de las enzimas mutadas origina la acumulación de mutaciones, producto de deslizamientos de la ADN polimerasa. La IMI está asociada con un mejor pronóstico por el aumento de la expectativa de vida del paciente entre 94% y 100% en el mejor de los casos, gracias a la respuesta más efectiva al tratamiento dado. La alteración de las enzimas implicadas en la reparación de errores posteriores a la replicación, permite que no se corrijan los errores generados en las secuencias de ADN altamente repetitivo llamadas microsatélites, lo cual origina su nombre (vía de inestabilidad de microsatélites)5-9.
El cáncer colorrectal (CCR) y el cáncer gástrico (CG) están entre los de mayor mortalidad en la población, con una alta frecuencia en países desarrollados como Japón y China. En algunos países como Ecuador, Chile, Perú, Costa Rica y Colombia también son importantes causas de muerte. En Colombia las tasas de mortalidad, tasas ajustadas por edad (TAE), oscilan entre 15.9 y 27.7 para CG y 7.1 y 7.2 para CCR10, 11. Tanto CCR como CG pueden ser originados por cualquiera de las dos vías de formación del cáncer. Sin embargo, en Colombia como en muchos otros países, todavía se hace el diagnóstico dependiendo de las características histopatológicas que tenga el tumor, definidas con base en la diferenciación del tejido tumoral con el tejido normal tanto en CCR como en CG (en cáncer colorrectal se encuentra el de variedad clásica sub-clasificado en bien diferenciado, mal diferenciado y pobremente diferenciado, y el de variedad mucinosa. En cáncer gástrico se encontraron los de variedad intestinal subdivididos en bien diferenciados, mal diferenciados y pobremente diferenciados, y el de variedad difusa), sin tener en cuenta las características moleculares del mismo. Además, algunos informes han encontrado que personas con CCR o CG producto del fenotipo IMI+ y con un grado de diferenciación histopatológico pobremente diferenciado, tiene mejores pronósticos y mejor respuesta al tratamiento dado. De ahí la importancia de conocer la relación entre el fenotipo de inestabilidad de microsatélites con el grado de diferenciación histopatológica12-16. El análisis microscópico no permite diferenciar la vía genética que originó el cáncer, y es importante conocerla, para prever el pronóstico del paciente, que se podría realizar mediante la evaluación de la inestabilidad de microsatélites o STR’s (secuencias repetidas en tandem) que se encuentran distribuidos a través del genoma y que permiten identificar el fenotipo mutador de microsatélites (MMP) o fenotipo de error de la replicación (RER) como también se conoce al fenotipo IMI+; los microsatélites por su carácter repetitivo son más propensos a los errores de la ADN polimerasa o «polymerase slippage» y es más fácil identificar un cambio en uno de los alelos correspondientes para el marcador. Se ha visto que aquellos microsatélites cuya repetición es de simplemente un nucleótido son indicadores más sensibles en la identificación de este fenotipo, por tal motivo, se seleccionó el microsatélite BAT-26 para ser evaluado. Sumado a esto, su carácter monomórfico (su variación de tamaño en una población y de un alelo a otro es de sólo unos pares de nucleótidos) y el hecho que se ha encontrado hasta en 95% de los casos con IMI+ los postulan como el más sensible para identificar este fenotipo17-23.
MATERIALES Y MÉTODOS
Recolección de las muestras. Durante un período de tres años y después de la aprobación del proyecto por parte del Comité de Ética, Facultad de Salud, Universidad Industrial de Santander (UIS), la Unidad de Oncología del Hospital Universitario de Santander, remitió al Laboratorio de Genética de la Facultad de Salud de la UIS, 86 personas con diagnóstico de CG o CCR. A los pacientes se les informó del proyecto mediante una explicación verbal acompañada de un resumen escrito; una vez leído y comprendido, su aceptación se dio mediante la firma del consentimiento informado que una vez firmado, accedieron a donar una muestra de sangre y a permitir el análisis de las biopsias de tumor tomadas para hacer el diagnóstico de patología. Después de la autorización de los pacientes para estudiar sus muestras, las biopsias de tumor (células tumorales) se solicitaron al Departamento de Patología de la UIS y a otros laboratorios de patología particulares donde se había realizado el estudio histopatológico. De los 86 pacientes inicialmente reclutados sólo de 43 (50%) se hallaron las biopsias de tumor; de ellos, 19 tenían diagnóstico de CG (44.2%) y 24 diagnóstico de CCR (55.8%). La muestra sanguínea (células normales) se obtuvo sangrando el paciente y almacenando la muestra en un tubo vacutainer con anticoagulante EDTA. Tanto las muestras de sangre como las de biopsias de tumor, se procesaron para el análisis de inestabilidad de microsatélites.
Desparafinación. A las muestras de tumor embebidas en parafina se les retiró mecánicamente la mayor parte de la parafina y se realizaron cortes de 8 µm, que luego se fijaron en placas de vidrio para su desparafinación. Esto se llevó a cabo siguiendo el protocolo utilizado en el Departamento de Patología de la UIS: se inició con el calentamiento de las placas en un horno a una temperatura de 75ºC por 25 min, luego se hicieron 3 lavados en xilol durante tres minutos cada uno, después se realizaron tres lavados consecutivos en etanol de 60%, 80% y 100 % respectivamente, finalmente se lavó el exceso de etanol con agua destilada. El tejido fijado en las placas fue raspado y depositado en tubos eppendorff de 1.5 ml. A las muestras que no se les pudo extraer ADN del tejido de los cortes histológicos, se les realizaron extracciones a porciones mayores de tejido obtenido por disección de los bloques, se desparafinaron siguiendo el método descrito antes y se picaron con un bisturí dejándolas del menor tamaño posible; luego se maceraron para facilitar el trabajo de la proteinasa K en el momento de la digestión.
Digestión. Al raspado de las placas y al triturado de muestras se adicionaron 500 µl de buffer DBL (10 ml Tris/HCl 1M pH 7.4, 2 ml NaCl 5M, 20 ml EDTA 0.5M pH 8.0 y 968 ml de H2O destilada), 50 µl de SDS al 10% y 5 µl de proteinasa K (20 mg/ml); para el caso de los raspados de las biopsias se dejaron en digestión entre 12 y 18 horas; a las muestras trituradas que contenían mayor cantidad de tejido se adicionaron 10 µl de proteinasa K y se dejaron entre 24 a 36 horas, en un baño María a 56ºC con agitación de suave.
Extracción de ADN. Después de la confirmación visual de la digestión del tejido tumoral, se adicionaron 20 µl de NaCl 5M, más 585 µl de fenol/cloroformo/alcohol-isoamilico (25:24:1) se mezclaron bien por inmersión y se centrifugaron por 3 minutos a 6,000 rpm. Se recuperó el sobrenadante en un tubo de eppendorff nuevo de 1.5 ml y se adicionó 585 µl de cloroformo/alcohol-isoamilico (24:1) y se repite el procedimiento como en el paso anterior. Se recuperó el sobrenadante en un tubo nuevo y se le adicionó etanol al 96% frío, se mezcló suavemente y se refrigeraron por dos horas a -20ºC. Se centrifugaron por 30 minutos y se descartó el exceso de alcohol hasta que el precipitado (ADN) quedara bien seco. Se resuspendió el ADN es un volumen de 25 µl de Buffer TE y se almacenó a 4ºC para su posterior análisis. A las muestras de las cuales no se logró amplificar el fragmento del marcador BAT-26, se hizo el intento de extracción de ADN por el método de Chelex-100, sin ningún resultado positivo. La extracción de ADN de células normales se hizo por el método de Salting Out. Se removió la punta con el ADN y se lavó con 450 µl de etanol al 70% frío y se resuspendió finalmente en 300 µl de buffer TE para conservarlo a -20ºC hasta su uso en la PCR.
Amplificación por PCR. Previo a la PCR, la cantidad de ADN obtenido de los dos Tipos de muestras fue cuantificado mediante espectrofotometría a 260 nm en un espectrofotómetro Spectronic Genesys II. La amplificación por PCR se hizo de acuerdo con el protocolo descrito por Morifuji et al.20 con una modificación en la cantidad de Taq polimerasa y la utilización de buffer 10X, en lugar de la adición de KCL y Tris-HCl pH 8.3 por separado como lo describe el protocolo. Se montó una PCR con un volumen final de 15 µl que contenían 1.5 µl de Buffer 10X, 250 µM de cada uno de los deoxinucleótidos trifosfatados (dNTPs), 0.5 µM de cada primer: (5’-6FAMTGACTACTTTTGACTTCAGCC-3’ 3’-AACCATTCAACATTTTTAA CC-5’), 2.5 mM MgCl2 y 1 unidad de Taq polimerasa (PROMEGA), se adicionaron 50-100 ng de ADN genómico. La amplificación por PCR se llevó a cabo en un termociclador PERKIN-ELMER 2400 siguiendo las siguientes condiciones: un paso inicial de 95ºC por 12 min, 10 ciclos (94ºC 15 seg, 55ºC 15 seg, y 72ºC 30 seg) y 20 ciclos (89ºC 15 seg, 55ºC 15 seg y 72ºC 30 seg) seguido por una extensión final de 72ºC 10 min. Los amplificados se refrigeraron a 4ºC hasta el momento de montar las muestras en la electroforesis capilar.
Electrofóresis capilar. Los métodos actuales basados en la fluorescencia para visualizar amplificados de ADN utilizando primers marcados con fluorocromos y equipos automatizados (secuenciadores automáticos de ADN) permiten visualizar los fragmentos de ADN marcados. Los amplificados se corrieron en una electroforesis capilar en el equipo ABI-PRISM 310 de PERKIN-ELMER; en ella los fragmentos marcados con el fluorocromo 6FAM fueron detectados de acuerdo con su separación por su carga y tamaño en pares de bases (bp). Los electroferogramas resultantes de la electroforesis capilar en el cual se observaron cada uno de los alelos tipificados de la muestra así como el marcador interno de peso molecular (GS TAMRA 500) fueron analizados con el sofware Genescan. Las muestras de los 43 pacientes de los cuales se pudo obtener una muestra de referencia (sanguínea) como la muestra de tumor (biopsia), se analizaron para obtener el perfil genético del microsatélite BAT-26, tanto en sangre como en tumor, e identificar la presencia del fenotipo IMI+ dada como la diferencia en el tamaño de los alelos detectados tanto en sangre como en la muestra tumoral para el marcador. El fenotipo IMI+ se determinó cuando la modificación del alelo en la muestra tumoral con respecto a la muestra normal, presentó una variación en tamaño de más de 4 pares de bases. Previo a esto se tuvieron en cuenta ciertos criterios, entre los cuales estuvo la verificación de la corrida del marcador de peso interno y de los resultados de los dos controles (positivo y negativo).
Análisis estadístico. Se tuvieron en cuenta las siguientes variables: la edad (establecida en rangos de 10 años, para identificar aquellas personas con diagnóstico en edades jóvenes, menores a 40 años), el diagnóstico patológico, el género de los pacientes, el grado de diferenciación histopatológica del tumor y la presencia o ausencia del fenotipo de IMI. Luego se realizó el análisis estadístico, corriendo estas bases de datos en el programa SPSS 10 (SPSS Inc, Chicago, IL). La prueba exacta de Fisher se utilizó para la hipótesis nula de no asociación entre la edad y el sexo del paciente con el diagnóstico patológico. Se utilizó la misma prueba para evaluar la hipótesis nula de no asociación entre el fenotipo de inestabilidad de microsatélites con el sexo, y la edad del paciente y el grado de diferenciación histopatológica en cada uno de los Tipos de cáncer.
RESULTADOS
Características demográficas del grupo. A partir de la muestra de sangre, se obtuvieron mayores concentraciones de ADN (de 0.63 µg/µl a 1.32 µg/µl) y la amplificación de BAT-26 se logró en 100% de ellas, mientras que la cantidad de ADN en las muestras de tumor fue menor (de 0.58 µg/µl a 1.04 µg/µl) y la amplificación se logró sólo en 23 (53.5%) casos de los 43 finalmente incluidos en el proyecto. De estos 23 casos 11 (47.8%) tuvieron diagnóstico de CCR y el diagnóstico de los 12 (52.2%) restantes era CG.
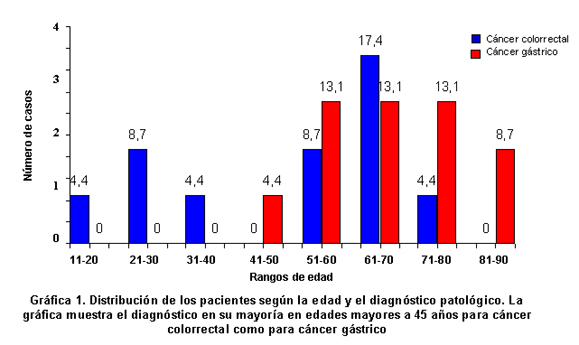
Los 4 casos de cáncer diagnosticados en edades jóvenes (<45 años) pertenecen a cáncer colorrectal, mientras que ningún caso con cáncer gástrico se diagnosticó en pacientes jóvenes. Como se observa en la Gráfica 1 y según los resultados de la prueba exacta de Fisher, se encontró evidencia significativa de asociación entre una edad avanzada de los pacientes y el desarrollo de cáncer (p=0.037). Según el sexo los casos estaban distribuidos homogéneamente 12 (51.2%) mujeres y 11 (48.8%) hombres. De ellas, 6 (50%) padecían cáncer colorrectal y las otras 6 (50%) cáncer gástrico; de ellos, 5 (52.4%) con diagnóstico de cáncer colorrectal y 6 (47.6%) cáncer gástrico. No se encontró asociación alguna entre el desarrollo de cáncer y el sexo de los pacientes según la prueba exacta de Fisher (p=0.579).
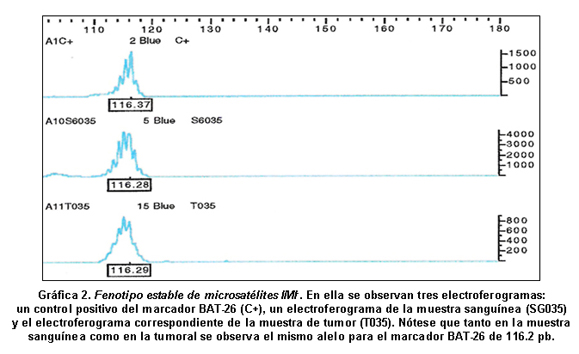
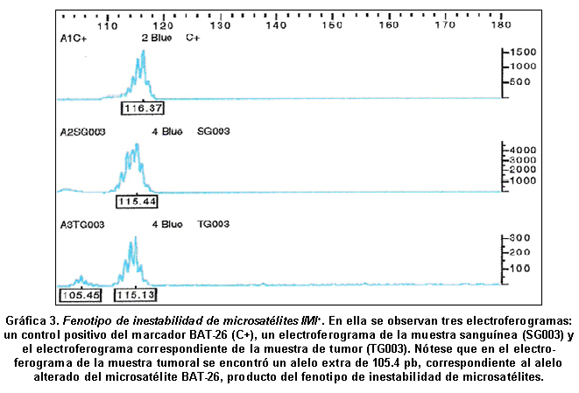
Resultados del análisis de ADN. El tamaño del marcador microsatélite BAT-26 en las muestras de sangre fue 116.2 pares de bases, con la amplificación del microsatélite en la totalidad de ellas (100%). Como ya se mencionó, el fenotipo IMI+ se caracteriza por la variación del tamaño del STR, por lo cual se puede encontrar un alelo alterado, con respecto al alelo normal que se encuentra en las células sanguíneas. En 19 de las muestras tumorales se observó soló el alelo normal de 116 pb (Fenotipo estable, IMI-, Gráfica 2), mientras que en 4 muestras de tumor (4, 17% casos) se pudo ver el fenotipo IMI+ en el marcador BAT-26 con una variación del tamaño entre el alelo normal y el alelo mutado de 11 pb a 14 pb, uno de los casos IMI+ (Gráfica 3).
En la distribución por edades de los pacientes se observan 2 casos IMI+ en edades jóvenes (<40 años), estos según el examen histopatológico, pertenecen a pacientes con diagnóstico de CCR, y puede existir una asociación entre alguno de ellos con el síndrome de Lynch o HNPCC, el cual se manifiesta en edades tempranas y se relaciona con esta vía de formación de cáncer. En edades más avanzadas 2 pacientes presentaron el fenotipo IMI+ uno de ellos con diagnóstico de cáncer gástrico y el otro con diagnóstico de cáncer colorrectal; los dos se encontraban dentro del rango de los 61 a 70 años de edad. Después de realizada la prueba exacta de Fisher no se encontró evidencia de asociación entre la edad de los pacientes y el fenotipo de inestabilidad de microsatélites (p=0.295).
El fenotipo IMI+ se observó en un mayor número de casos con CCR que con CG. En CCR 3 (28%) individuos presentaron el fenotipo de inestabilidad de microsatélites, mientras que en CG sólo 1 (9%) lo presentó. Sin embargo, según la prueba exacta de Fisher no se encontró asociación entre el fenotipo IMI+ y ninguno de los dos Tipos de cáncer estudiados (p=0.261). Según el género de los pacientes el sexo femenino tuvo un número más alto con inestabilidad de microsatélites con 3 (25%) individuos afectados que el sexo masculino donde solamente se observó 1 (9.1%) caso del fenotipo. No hubo asociación entre el sexo y el fenotipo de inestabilidad de microsatélites según la prueba exacta de Fisher (p=0.329).
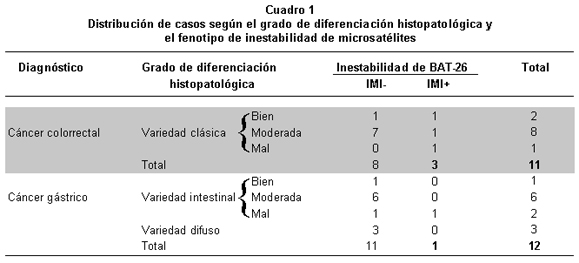
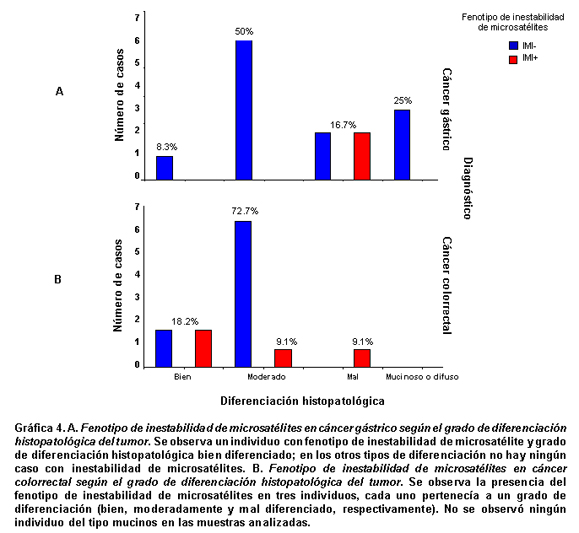
Resultados del análisis histopatológico. En los casos diagnóstico de CG se observaron todos los Tipos de diferenciación histopatológica, 50% moderadamente diferenciados, 16.7% pobremente diferenciados, 1 (8.3%) bien diferenciado y 3 (25%) de variedad mucinosa. Sólo se observó un (8.3%) caso con el fenotipo IMI+ y perteneció al tipo pobremente diferenciado. Por otra parte los casos diagnosticados con CCR pertenecían a la variedad clásica, 72.7% de tipo moderadamente diferenciado, 18.2% bien diferenciado y 1 (9.1%) mal diferenciado; 27.3% de los casos diagnosticados con este tipo de cáncer presentaron el fenotipo IMI+, uno para cada tipo de diferenciación histopatológica (bien diferenciado, moderadamente diferenciado y mal diferenciado). Ninguna muestra de tumor con CCR de variedad mucinoso se encontró en los casos analizados (Cuadro 1, Gráfica 4). En ninguno de los dos Tipos de cáncer (gástrico y colorrectal) se encontró una asociación entre el fenotipo de inestabilidad de microsatélites y el grado de diferenciación histopatológica, según la prueba exacta de Fisher (p=0.152 para cáncer colorrectal y p=0.250 para cáncer gástrico).
DISCUSIÓN
Por dificultades técnicas ya sea por el deterioro de las muestras o la pérdida de información de los pacientes, se redujo el número inicial de casos vinculados con el proyecto; esto afecta la sensibilidad de la pruebas estadísticas, otorgando resultados tal vez poco confiables. Sin embargo, este estudio representa un trabajo preliminar en la evaluación del fenotipo IMI+ o de fenotipo de error de la replicación (RER+) en pacientes de Santander con diagnóstico de cáncer. Y aunque el nú-mero de muestra es muy pequeño, hay coincidencia con algunos autores que obtuvieron resultados similares.
En el presente estudio, el grupo de pacientes se encontraba homogéneamente distribuido entre los dos sexos para los dos Tipos de cáncer, sin encontrar ninguna asociación entre el tipo de cáncer y el género. En otros estudios, los hombres se han encontrado más afectados por este tipo de enfermedades (43.4% para mujeres y 56.6% para hombres). En ellos se indica que existe un riesgo más alto de desarrollar cáncer en los hombres1, 10. Los casos analizados muestran un diagnóstico de cáncer gástrico y de cáncer colorrectal en personas con edades avanzadas y aunque, algunos individuos presentaron un diagnóstico de cáncer colorrectal en edades menores a los 45 años, el desarrollo de cáncer está asociado con edades tardías (>45 años) tal como lo indican otras investigaciones (Fisher p=0.037)2-5, 7, 8, 14, 19, 21.
Con respecto al marcador BAT-26, el cual es altamente sensible para encontrar inestabilidad de microsatélites gracias a su carácter monomórfico, presentó un tamaño de 116.2 pb y aunque algunos autores informan alelos diferentes para dicho marcador poniendo en duda el carácter monomórfico del mismo22, todos los pacientes presentaron un pico principal de este tamaño en las muestras de sangre; la presencia de un solo alelo para el marcador en todos los pacientes confirma el carácter monomórfico del microsatélite. Se observaron algunos picos extras alrededor del pico principal debido al deslizamiento normal de la ADN polimerasa en el momento de la amplificación, por la naturaleza mononucleotídica del marcador, el cual está constituido por 26 repeticiones de adenina.
En 4 de las muestras de biopsia analizadas se observó una variación del alelo encontrado en células sanguíneas de 116.2 pb a 102 y 105 pb. Estos 4 casos corresponderían a una frecuencia para el fenotipo de inestabilidad de microsatélites de 0.17 (17%) en el grupo de pacientes diagnosticado con cáncer de vías digestivas (gástrico o colorrectal) en donde es más frecuente encontrar este fenotipo. De los 4 casos con fenotipo de inestabilidad de microsatélites, 3 eran de pacientes con CCR y 1 con CG y no se encontró ninguna asociación entre el tipo de cáncer e IMI+ (Fisher p=0.261). En cáncer colorrectal la presencia del fenotipo de inestabilidad de microsatélites se encontró en 28% de los casos, lo cual está de acuerdo con lo encontrado en otras investigaciones (12% a 31% de los pacientes diagnosticados con cáncer colorrectal). Esta prevalecía superior al 15% ha sido asociada en otras investigaciones a la inclusión de pacientes con un diagnóstico en edades tempranas2, 5, 7, 8, 21 lo cual está de acuerdo con lo encontrado en el presente trabajo en donde 2 de los 3 pacientes con cáncer colorrectal e IMI+ tenían una edad menor de 45 años y muy probablemente correspondían a casos de cáncer colorrectal heredado, porque, tenían antecedentes familiares de cáncer en vías digestivas y una edad temprana de aparición de la malignidad.
Por otra parte en cáncer gástrico todos los individuos fueron diagnosticados en edades avanzadas, tal como ha sido hallado en muchos estudios que verifican que el diagnóstico de pacientes con este tipo de enfermedades generalmente se presenta en edades superiores a los 45 años de edad. El fenotipo IMI+ en personas jóvenes con CG, tal como lo indican otras investigaciones, está poco relacionado con esta vía como causa del desarrollo de CG, pues en su mayoría, este tipo de cáncer desarrollado en jóvenes son causados por hipermetilación en el promotor del gen hMLH1 en la vía supresora de formación del cáncer. Los individuos con CG participantes en el trabajo, fueron diagnosticados con más de 50 años de edad y un solo individuo (9%) presentó el fenotipo IMI+. Otros autores han observado este mismo fenotipo con más frecuencia (32.1%-34.4%); esta discrepancia puede ser atribuida al número reducido de muestras analizadas en el estudio actual3, 5, 6.
Al igual que en otras investigaciones, en este trabajo no se encontró ninguna asociación entre el fenotipo IMI+ y la edad de los pacientes (p=0.295). En cuanto al sexo no encontramos ninguna asociación con el fenotipo IMI+ (p=0.329); esto corrobora que el fenotipo se pre-senta de igual forma en personas de todas las edades y de ambos sexos2, 8, 17.
En los últimos años se ha intentado buscar una asociación entre el grado de diferenciación histopatológico de la biopsia del tumor y la presencia IMI+. La mayoría de las investigaciones encuentran asociación entre cánceres de tipo pobremente diferenciados e IMI+, entre 26% y 38%15, 16, 21; otros por el contrario han encontrado asociación en tumores bien diferenciados, y unos más no encuentran ninguna asociación con el grado de diferenciación histopatológica8 y el fenotipo IMI+. En CG 1 (8.3%) de los 11 casos presentó un grado de diferenciación mal o pobremente diferenciado y de igual manera no se encontró ninguna asociación entre el fenotipo IMI+ y el grado de diferenciación del tumor (p=0.250) confirmando lo observado por algunos autores en cuyas investigaciones la probabilidad ha sido aún más baja (p=0.151). En CCR los 3 pacientes con el fenotipo IMI+ pertenecían a la variedad clásica de cáncer colorrectal distribuidos en cada uno de los Tipos de diferenciación histopatológica (bien, mal y pobremente diferenciados), con lo cual, para el grado de diferenciación pobremente diferenciados sólo se observó 1 (9.1%) caso y no se encontró asociación entre el fenotipo y el grado de diferenciación del tumor p=0.15223.
Algunos de los resultados de esta investigación coinciden con los de otras; sin embargo, es necesario aumentar el número de muestras para tener resultados más confiables estadísticamente, y es indispensable buscar nuevas herramientas para mejorar la calidad del ADN de este tipo de tejidos. Aunque muchos intentos se han hecho para mejorar las técnicas de extracción de ADN a partir de tejidos embebidos en parafina, los resultados siguen siendo poco óptimos para la evaluación molecular de muestras potencialmente importantes para observar alteraciones provocadas en los ácidos nucleicos y proteínas24, 25. Es mucho más efectivo obtener por parte del Departamento de Gastroenterología muestras frescas embebidas en solución salina las cuales se utilizarían sólo para las evaluaciones moleculares, almacenando una gran cantidad de muestra de ADN geonómico que servirán para posteriores investigaciones.
CONCLUSIONES
El fenotipo de inestabilidad de microsatélites se encontró en 4 casos de 23 (17%) analizados. No se halló asociación entre el fenotipo de inestabilidad de microsatélites con respecto al grado de diferenciación histopatológica del tumor, el sexo de los pacientes, la edad y el tipo de cáncer en las muestras analizadas.
El fenotipo de inestabilidad de microsatélites o RER+ se observó en dos de los pacientes cuya edad de diagnóstico fue menor a 45 años, uno de 40 años y otro de 13 años, los cuales poseen antecedentes familiares de cáncer de vías digestivas, uno de ellos en primer grado de consanguinidad cumpliendo con los criterios para asociarlo con el síndrome de Lynch, por lo cual posiblemente corresponden a personas con cáncer heredado.
RECOMENDACIONES
El maltrato del tejido en el proceso de fijación y almacenamiento de las muestras, dificulta los procesos de digestión y de extracción de ADN. Por ello se recomienda elaborar métodos que afecten menos las propiedades de los ácidos nucleicos, como la utilización de formalina bufferizada en los procesos de fijación de las muestras, o realizar recolecciones en solución salina en el momento de las tomas de las biopsias previas al diagnóstico por parte del Departamento de Patología, con el fin de utilizarlas sólo para la recuperación de una buena cantidad de ADN que se puede almacenar y utilizar en investigaciones posteriores.
Aunque este es un análisis descriptivo, es recomendable continuar con nuevas investigaciones de esta misma índole con el fin de aumentar el número de muestras analizadas y sacar conclusiones que puedan ser representativas para la población santandereana con el fin de conocer mejor esta enfermedad, que en Colombia no se hace diagnosticar desde el punto de vista molecular, sino simplemente según la historia clínica del paciente. En las historias clínicas la información errada suministrada por parte de los pacientes que acuden al servicio de oncología del HUS, impiden un seguimiento continuo de la evolución de los mismos después del diagnóstico de cáncer y de la implementación del tratamiento, es indispensable hacer caer en cuenta a los pacientes de la importancia de conocer sus datos reales, para poder ubicarlos en el transcurso de su enfermedad y de ese modo evitar la perdida de los mismos.
AGRADECIMIENTOS
Los autores de este trabajo agradecen a las bacteriólogas Adriana Pico y Adriana Gil del Laboratorio de Genética, al doctor Jorge Echeverri, a la doctora Olga Álvarez y técnicos del Departamento de Patología de la UIS y a los funcionarios del Departamento de Gastroenterología del Hospital Universitario de Santander, por la colaboración prestada a lo largo del desarrollo del proyecto.
REFERENCIAS
1. Lichtenstein P, Holm N, Verkasalo P, Iliadou A, Kaprio J, Koskenvuo M, et al. Environmental and heritable factors in the causation of cancer. N Engl J Med. 2000; 343: 78-84. [ Links ]
2. Lynch H, De La Chapelle A. Genetic susceptibility to non-polyposis colorectal cancer. J Med Genet. 1999; 36: 801-18. [ Links ]
3. Fleisher AS, Esteller M, Wang S, Tamura G, Suzuki H, Yin J, et al. Hypermethylation of the hMLH1 gene promoter in human gastric cancers with microsateliite instability. Cancer Res. 1999; 59: 1090-5. [ Links ]
4. Cunningham J, Kim CY, Christensen E, Tester D, Parc Y, Burgart L, et al. The frequency of hereditary defective mismatch repair in a prospective series of unselected colorectal carcinomas. Am J Hum Genet. 2001; 69: 780-90. [ Links ]
5. Keller G, Rudelius M, Vogelsang H, Grimm V, Wilhelm M, Mueller J, et al. Microsatellite instability and loss of heterozygosity in gastric carcinoma in comparison to family history. Am J Pathol. 1998; 152: 1281-9. [ Links ]
6. Liu Edison T. Tumor-suppressor genes: changing concepts. American Society of Clinical Oncology (ASCO). Annual Meeting; 1999. [ Links ]
7. Gryfe R, Kim H, Hsieh E, Aranson M, Holowaty E, Bull S, et al. Tumor microsatellite instability and clinical outcome in young patients with colorectal cancer. N Engl J Med. 2000; 342: 69-77. [ Links ]
8. Hemminki A, Mecklin JP, Järvinen H, Aaltonen L, Joensuu H. Microsatellite instability is a favorable prognostic indicator in patients with colorectal cancer receiving chemotherapy. Gastroenterology 2000; 119: 921-8. [ Links ]
9. Robbins D, Itzkowitz S. The molecular and genetics basis of colon cancer. Med Clin North Am. 2002; 86: 1467-95. [ Links ]
10. Jemal A, Tiwari RC, Murray T, Ghafoor A, Samuels A, Ward E, et al. Cancer statistics. CA Cancer J Clin. 2004; 54: 8-29. [ Links ]
11. Piñeros M, Ferlay J, Murillo R. Incidencia estimada y mortalidad por cáncer en Colombia, 1995-1999. Bogotá: Instituto Nacional de Cancerología; 2005. [ Links ]
12. Shibata D, Meltzer S. The impact of microsatellite instability on the molecular phenotype of colorectal tumors. Cancer Res. 2003; 63: 4577-82. [ Links ]
13. Lynch H, Kaul K. Microsatellite instability, clinical implications, and new methodologies. J Natl Cancer Inst. 2000; 92: 511-2. [ Links ]
14. Kim HS, Lee BL, Woo DK, Bae SI, Kim WH. Assessment of markers for the identification of microsatellite instability phenotype in gastric neoplasms. Cancer Lett. 2001; 164: 61-8. [ Links ]
15. Alexander J, Watanabe T, Wu T-T, Rashid A, Li S, Hamilton S. Histopathological identification of colon cancer with microsatellite instability. Am J Pathol. 2001; 158: 527-35. [ Links ]
16. Mori Y, Selaru F, Sato F, Yin J, Simms L, Xu Y, et al. The impact of microsatellite instability on molecular phenotype of colorectal tumors. Cancer Res 2003; 63: 4577-4582[ [ Links ]STANDARDIZEDENDPARAG]
17. Hoang JM, Cottu PH, Thuille B, Salmon RJ, Thomas G, Hamelin R. BAT-26, an indicator of the replication error phenotype in colorectal cancers and cell lines. Cancer Res. 1997; 57: 300-3. [ Links ]
18. Zhang L, Yu J, Willson J, Markowitz S, Kinzler K, Vogelstein B. Short mononucleotidic repeat sequence variability in mismatch repair-deficient cancers. Cancer Res. 2001; 61: 3801-5. [ Links ]
19. Laukola A, Eklin K, Laiho P, Salovaara R, Kristo P, Järvinen H, et al. Microsatellite marker analysis in screening for hereditary nonpolyposis colorectal cancer (HNPCC). Cancer Res. 2001; 61: 4545-9. [ Links ]
20. Morifuji M, Hiyama E, Murakami Y, Imamura Y, Sueda T, Yokoyama T. Fluorescent-based BAT-26 analysis for distinct screening of microsatellite instability in colorectal cancers. Int J Oncol. 2003; 22: 807-13. [ Links ]
21. Chang E, Dorsey P, Johnson N, Lee R, Walts D, Johnson W, et al. A prospective analysis of microsatellite instability as a molecular marker in colorectal cancer. Am J Surg. 2006; 191: 646-51. [ Links ]
22. Pyatt R, Chadwich R, Jhonson C, Adebamowo C, De La Chapelle A, Prior T. Polymorphic variation at the BAT-25 and BAT-26 loci in individuals of African origin: implications for microsatellite instability testing. Am J Pathol. 1999; 155: 349-53. [ Links ]
23. Musulén E, Moreno V, Reyes G, Sancho J, Peinado M, Esteller M, et al. Standardized approach for microsatellite instability detection in gastric carcinomas. Hum Pathol. 2004; 35: 335-42. [ Links ]
24. Jalouli J, Sand L, Gustavsson B, Hirsch J, Larsson PA. High-throughput DNA extraction from old paraffin-embedded biopsies. Bio Techniques. 1999; 27: 334-8. [ Links ]
25. Monskaluk C, Kern S. Microdissection and polymerase chain reaction amplification of genomic DNA from histological tissue sections. Am J Pathol. 1997; 150: 1547-52. [ Links ]