Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Colombia Médica
On-line version ISSN 1657-9534
Colomb. Med. vol.39 suppl.3 Cali Sept. 2008
Efectividad de la ivermectina en un modelo de disquinesia tardía inducida por haloperidol en ratas
Mauricio Palacios, MD, MSc.1, Hernán Pimienta, MSc2
1. Profesor Asistente, Sección de Farmacología, Escuela de Ciencias Básicas, Facultad de Salud, Universidad del Valle, Cali, Colombia. e-mail: maopalacios@yahoo.com
2. Profesor Distinguido, Director Centro de Estudios Cerebrales, Facultad de Salud, Universidad del Valle, Cali, Colombia. e-mail: hernpim@yahoo.com
Recibido para publicación diciembre 20, 2007 Aceptado para publicación junio 26, 2008
RESUMEN
Introducción: Los síntomas extrapiramidales y en especial las disquinesias tardías, son la mayor limitante de la terapia con antipsicóticos, debido a la frecuencia de aparición durante el tratamiento y la falta de recursos para controlar estas reacciones adversas, por lo cual es necesario investigar nuevos recursos para el manejo de las disquinesias tardías.
Objetivo: Evaluar el efecto de la ivermectina sobre las disquinesias tardías inducidas por haloperidol en ratas.
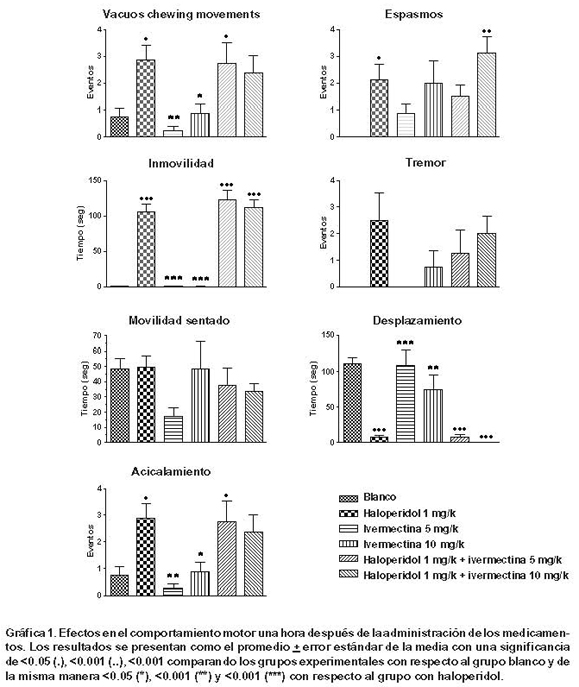
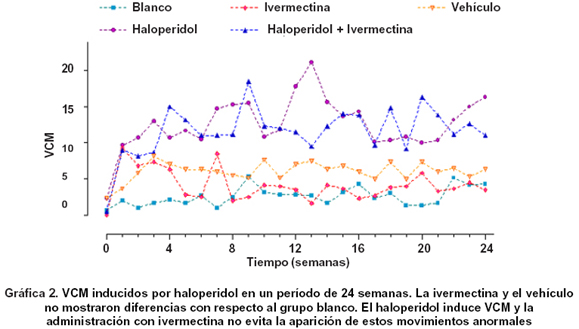
Métodos: En un modelo de dosis única de haloperidol con ratas Sprague Dawley, se evalúo la capacidad de la ivermectina para evitar cambios en la conducta motora y la aparición de movimientos anormales. Adicionalmente, se implementó un modelo animal crónico conocido como VCM (vacuous chewing movements), donde se evaluó la frecuencia de movimientos orofaciales durante seis meses, al recibir simultáneamente haloperidol e ivermectina a dosis diferentes, comparándolo con un grupo control y otro grupo al que se le administró haloperidol.
Resultados: La ivermectina no evitó los cambios inducidos por haloperidol en el comportamiento motor, ni la aparición de movimientos anormales en el modelo agudo. Tampoco modificó la frecuencia de movimientos orofaciales en el modelo de administración crónica de haloperidol. La ivermectina no indujo cambios en la conducta motora, ni la aparición de movimientos anormales en los modelos agudo y crónico.
Conclusiones: Los hallazgos de este trabajo descartan a la ivermectina como candidata para el manejo de las disquinesias tardías y no permite aportar argumentos a la hipótesis GABAérgica en la fisiopatología de las disquinesias tardías. Adicionalmente, la ivermectina no induce movimientos anormales.
Palabras clave: Haloperidol; Ivermectina; Discinesia inducida por drogas; Agentes antipsicóticos.
Effectiveness of ivermectin in rats with haloperidol induced tardive dyskinesia
SUMMARY
Introduction: Extrapiramidal symptoms and tardive dyskinesia are common problems associated with antypsychotic therapy. Basic and clinical research is warranted due to the lack of effective therapies aimed to the prevention and treatment of antipsychotic side effects.
Objective: To evaluate the effect of ivermectin in rats with haloperidol induced tardive dyskinesia.
Methods: The effect of ivermectin on motor behavior and abnormal movements was tested in Sprague-Dawley rats treated with a single dose of haloperidol. In addition, a chronic animal model known as VCM (vacuous chewing movements) was implemented with the objective to evaluate the effect of ivermectin on the frequency of orofacial movements during a period of six months.
Results: Ivermectin does not prevent the motor behavior and frequency of abnormal movements induced by haloperidol in the acute model. Orofacial movements were not reduced with ivermectin in the chronic model. In addition, ivermectin was not associated with changes in motor behavior and abnormal movements in the acute and chronic model.
Conclusions: Ivermectin is not a good candidate for the treatment of tardive dyskinesia and the results of this study do not support the GABAergic hypothesis in the physiopathology of tardive dyskinesia. Additionally, ivermectin does not induce abnormal movements.
Keywords: Haloperidol; Ivermectin; Dyskinesia drug induced; Antipsychotic agents.
Los neurolépticos son utilizados en el manejo de varias entidades psiquiátricas, tales como la esquizofrenia y los estados psicóticos. Sin embargo, la mejoría clínica observada en los pacientes con el uso de estos medicamentos se acompaña de la aparición aguda, subaguda y crónica de efectos colaterales de características extrapiramidales. Estos efectos adversos se creían superados con la introducción de los antipsicóticos de segunda generación, que mostraron un mejor perfil en este aspecto; sin embargo, continúan siendo muy altos los porcentajes de aparición de estos efectos en la población con esquizofrenia1.
Entre todos los efectos extrapiramidales, la discinesia tardía es la más complicada e importante por su frecuencia, dificultad de manejo y la repercusión en tratamientos prolongados. Se caracteriza por la presencia de movimientos anormales de tipo hiperquinético que comprometen la región perioral, los labios y la lengua; su comienzo es muy posterior con respecto al uso del medicamento y los síntomas persisten al menos, un mes después de suspenderlo2. La incidencia anual se encuentra entre el 5% (en personas jóvenes) y el 12% (en pacientes ancianos), con una prevalencia del 20% en los pacientes que son tratados con neurolépticos3, lo que constituye la mayor limitante de la terapia antipsicótica.
La fisiopatología de la discinesia tardía se conoce parcialmente; se consideran cuatro posibles teorías para explicar los mecanismos de generación y persistencia del cuadro:
1. Hipersensibilidad de los receptores D2 dopaminérgicos de la vía nigro estriatal.
2. Disminución de la función GABAérgica en la sustancia negra compacta y en la región ventrolateral del estriado.
3. Excitotoxicidad mediada por glutamato en la vía cortico estriatal.
4. Generación de radicales libres en el catabolismo de la dopamina4.
De acuerdo con lo anterior, las posibles estrategias terapéuticas para prevenir o disminuir las discinesias tardías son múltiples, involucrando diversos grupos farmacológicos. Sin embargo, al ser evaluados, no han podido mejorar el pronóstico que le espera a quienes la padecen. La ivermectina, un antiparasitario que mantiene abierto el canal de cloro del receptor de GABA-A en mamíferos de manera diferente a las benzodiacepinas y a los barbitúricos5 es un candidato terapéutico, por lo cual, mediante un modelo animal validado para la investigación preclínica en disquinesia tardía, conocido como VCM (vacuous chewing movements, por sus sigla en inglés) inducido por haloperidol en ratas6, se ensayó su efecto para determinar su potencial terapéutico en este síndrome.
MATERIALES Y MÉTODOS
Se utilizaron 81 ratas Sprague Dawley, cepa Instituto Nacional de Salud, machos de seis semanas de edad con un peso inicial de 140 a 200 g. Los animales se mantuvieron en jaulas en grupos de seis, en condiciones de 25°C de temperatura promedio ambiental, humedad relativa 75% y ciclos de luz/oscuridad de 12 horas. Se les administró una dieta con un contenido mínimo de 21% de proteínas y restricción de 15 g al día para controlar la ganancia de peso y agua ad libitum. El manejo de los animales se realizó de acuerdo con el protocolo aprobado por el Comité de Ética en Experimentación Animal de la Facultad de Salud de la Universidad del Valle.
Los fármacos utilizados fueron haloperidol (Halopidol, Jannsen®), haloperidol decaonato (Halopidol Decanoato, Jannsen®) e ivermectina (Ivomec, Merck®), los cuales correspondieron al mismo lote para todos los experimentos. Como disolvente de la ivermectina se utilizó dimetil sulfóxido (DMSO, Merck®).
Experimento agudo. Inicialmente a 48 animales se les realizaron observaciones de tres minutos para comprobar que carecían de movimientos anormales; luego, se separaron en seis grupos iguales de manera aleatoria:
i) ivermectina (5 mg/kg) + solución salina (1 ml/kg)
ii) ivermectina (10 mg/kg) + solución salina (1 ml/kg)
iii) ivermectina (5 mg/kg) + haloperidol (1 mg/kg)
iv) ivermectina(10 mg/kg) + haloperidol (1 mg/kg)
v) solución salina (1 ml/kg) + haloperidol (1 mg/kg)
vi) solución salina (1 ml/kg), este último como grupo control.
El primer medicamento se administró 24 horas antes de la observación y el segundo, una hora antes, todos por vía intraperitoneal (ip).
Experimento crónico. Previa observación de tres minutos para comprobar que carecían de movimientos anormales, se seleccionaron 33 animales, conformando cinco grupos experimentales de seis animales y un sexto grupo de tres animales (control del vehículo de la ivermectina):
i) haloperidol decaonato (38 mg/kg) + ivermectina (0.4 mg/kg)
ii) haloperidol decaonato (38 mg/kg) + solución salina (1 ml/kg)
iii) solución salina (1 ml/kg) a + ivermectina (0.4 mg/kg)
iv) solución salina (1 ml/kg)
v) solución salina (1 ml/kg) + DMSO (1 ml/kg)
El primer medicamento se administró cada cuatro semanas por vía intramuscular (im) y el segundo, cada semana por vía subcutánea (sc). Las observaciones se realizaron entre las 19 horas y las 23 horas, una hora antes de la administración de los medicamentos.
Evaluación de los movimientos masticatorios. Después de tres minutos de colocar al animal en la jaula para que se habituara, se comenzó la medición de los VCM. Los movimientos de las fauces se contaron en cuatro períodos de 30 segundos, no se tuvieron en cuenta los movimientos de acicalamiento y aseo (se detuvo el conteo mientras tanto). Se evaluaron dos tipos de movimientos: los movimientos masticatorios (movimiento de apertura de laboca en el plano vertical con o sin protrusión de la lengua) y los episodios de tremor de las fauces (fasciculacionesde los músculos de la boca o de las fauces). Para el cálculo de los VCM, a cada episodio de tremor de las fauces se le asignó puntaje de dos y a los movimientos masticatorios,un puntaje de uno7.
Evaluación de la función motora (experimento agudo). Previo al acostumbramiento descrito antes, se observaron los animales individualmente durante un período de tres minutos continuos y se registraron las siguientes características del comportamiento motor animal: VCM, espasmos musculares (contracciones musculares súbitas de cualquier segmento corporal del animal), tremor, enderezamiento (apoyo en la parte posterior del cuerpo, incluyendo el vientre bajo manteniéndose erguido el tronco), desplazamiento (movimientos laterales del tronco u otra parte del cuerpo que realiza el animal partiendo de la posición anterior) y acicalamiento (movimiento de aseo por frotación de las partes de su cuerpo con la lengua o la región superior del hocico). Todas las observaciones fueron realizadas por la misma persona. El análisis del experimento agudo se hizo mediante ANOVA de una vía y los datos del expe-rimento crónico se procesaron con ANOVA de dos vías (tratamiento vs. tiempo), utilizando el programa GraphPad Prism® versión 4.01.
RESULTADOS
Una hora después de aplicado el haloperidol, el comportamiento de los animales se alteró significativamente. El haloperidol aumentó la frecuencia de movimientos anormales con respecto a los controles: los VCM fueron 2.88 ± 1.55 SEM con haloperidol y 0.75 ± 0.88 en el grupo blanco; los espasmos fueron 2.13 ± 1.64 SEM y no se presentaron en el grupo blanco. Se disminuyó la movilidad general del animal (haloperidol: 74.2 seg ± 30.9 SEM y blanco: 179.13 seg ± 1.36 SEM) y los desplazamientos laterales (haloperidol: 7.13 seg ± 3.3 SEM y blanco: 111 seg ± 8.69 SEM). Estos efectos no se evidenciaron en los grupos tratados con ivermectina a 5 y 10 mg y tampoco fueron evitados por el tratamiento conjunto con ivermectina a las dosis utilizadas en este experimento. No se evidenció cambios en el acicalamiento en ninguno de los grupos con respecto al grupo blanco (Gráfica 1).
En el experimento crónico se reprodujeron los VCM con el tratamiento a largo plazo del haloperidol, que aumentó la expresión de este fenómeno desde la segunda semana de exposición al fármaco y se mantuvo durante todo el experimento. La ivermectina no indujo la aparición de VCM después de una exposición prolongada y tampoco mostró capacidad de evitar la aparición de VCM cuando se suministró concomitantemente con el haloperidol (Gráfica 2).
DISCUSIÓN
Los modelos animales para el estudio de la disquinesia tardía se clasifican en homólogos, análogos y correlacionados; los primeros requieren que todos los factores críticos de la disquinesia tardía tengan gran similitud con el síndrome clínico, incluyendo la etiología, bases biológicas, síntomas, respuesta al tratamiento, curso y rasgos únicos como la vulnerabilidad individual. Este modelo se representa mejor en los tratamientos prolongados con neuroléptico en primates no humanos; pero, son muy ineficientes y costosos debido al gran número de animales que se necesita tratar durante varios años para que un subgrupo presente los síntomas esperados8. Los modelos análogos requieren que algunas de las características críticas sean similares al síndrome clínico aunque, otros rasgos puede no serlo.
El modelo de VCM en roedores se clasifica como análogo debido a sus limitaciones, entre las cuales está la variación del resultado de acuerdo con la cepa utilizada (la cepa Sprague Dawley es la que más síntomas de disquinesia presenta)9. Este modelo tiene la ventaja de ser relativamente eficiente y de bajo costo, porque en el presente experimento sólo tomó seis meses producir los síntomas y desarrollarlo completamente. Las similitudes más importantes del modelo con las disquinesias tardías son los movimientos de baja frecuencia orofaciales (1-3 Hz), la gran variabilidad de respuesta interindividual de los sujetos con susceptibilidad en sus poblaciones, el aumento de los síntomas con la exposición acumulativa del antipsicótico, que la influencia de la edad y del antipsicótico utilizado concuerdan con la frecuencia de riesgo de desarrollar disquinesias y las exacerbaciones de los síntomas relacionadas con el estrés y con la suspensión abrupta del medicamento, que mejora con el reinicio del antipsicótico10.
La complejidad de la disquinesia tardía indica que el modelo en ratas no refleja muchos de los aspectos del síndrome; sin embargo, los VCM inducidos por tratamientos prolongados con haloperidol son vistos como un buen candidato a modelo de la disquinesia tardía en humanos, por tanto han sido aceptados como un heurístico modelo animal por su similitud fenomenológica y farmacológica11. Los modelos correlacionados reproducen una o algunas características de la disquinesia tardía, y su utilidad es en la tamización de moléculas candidatas a fármacos en la entidad. El modelo de administración única de haloperidol corresponde a esta categoría y evalúa los efectos extrapiramidales agudos asociados con fármacos; aunque no reemplaza la necesidad del modelo VCM porque el enfoque es diferente, si lo complementa. El modelo agudo permite orientar la dosis del modelo VCM, y las características de la conducta motora con el fármaco candidato.
La administración crónica de haloperidol disminuye las concentraciones de dopamina extracelular12, resultando en una disminución de la función de GABA y de la enzima descarboxilasa del ácido glutámico en la sustancia negra, en la porción medial del globo pálido y en los núcleos subtalámicos13. Con base en lo anterior, se probaron diferentes medicamentos con efectos sobre el receptor de GABA-A o el metabolismo de GABA, incluyendo benzodiacepinas, etanol14, baclofeno, valproato15 y progabide, que mostraron algún grado de eficacia en el modelo VCM, pero con resultados clínicos inciertos16.
Las características farmacológicas de la ivermectina tales como el aumento de liberación de GABA en las terminales presinápticas, sin aumentar la liberación de glutamato17, la estimulación del receptor de GABA-A en el sitio de las benzodiacepinas18 y una vida media prolongada lo proponían como candidato para el manejo de la disquinesia tardía.
En el presente trabajo se muestra que la ivermectina no mejora ni detiene la aparición de VCM inducidos por haloperidol y a la vez este medicamento no induce nuevos VCM. Estos hallazgos se pueden explicar por un pobre efecto del medicamento sobre el receptor de GABA-A, respecto a otros agonistas, o por una limitada concentración de ivermectina en el sistema nervioso central, atribuida a las proteínas transportadoras de membrana en la barrera hematoencefálica. El hecho de aumentar la dosis de ivermectina para alcanzar mayores concentraciones en el cerebro, no se considera una opción consecuente a estos resultados, debido a que se utilizaron dosis cercanas a la dosis letal 50 subcrónica y alcanzar esta dosis significa una toxicidad inaceptable para este tipo de experimentos.
La ivermectina administrada de manera aguda no se asocia con alteraciones del comportamiento motor que sugieran efectos extrapiramidales en seres humanos y la administración crónica no generó VCM, por lo que tampoco se espera aparición de disquinesia tardía asociadas con este medicamento.
Un punto final en consideración, es la respuesta experimental al DMSO. Este solvente ha generado alguna controversia por su capacidad intrínseca de generar una respuesta farmacológica en el sistema nervioso central, o como modificador de la respuesta de la ivermectina por el aumento en la penetración de la barrera hematoencefálica de otros fármacos; sin embargo, estudios previos no han demostrado que mejoren la concentraciones de fármacos hidrosolubles en el cerebro19 y se ha utilizado en estudios con modelos de disquinesia como vehículo del fármaco en prueba20. En el experimento crónico no se encontró diferencias estadísticas con respecto a los grupos que no recibieron haloperidol.
En conclusión, los resultados experimentales demuestran que la ivermectina no tiene efectos en la discinesia tardía por haloperidol en ratas. Siendo este modelo predictivo de resultados en seres humanos, no se recomienda para el tratamiento de disquinesias tardías u otros efectos extrapiramidales agudos. Además, los resultados no permiten apoyar la teoría GABAérgica sobre la fisiopatología de la disquinesia tardía.
REFERENCIAS
1. Yang SY, Kao Yang YH, Chong MY, Yang YH, Chang WH, Lai CS. Risk of extrapyramidal syndrome in schizophrenic patients treated with antipsychotics: a population-based study. Clin Pharmacol Ther. 2007; 81: 586-94. [ Links ]
2. Fernández HH, Friedman JH. Classification and treatment of tardive syndromes. Neurologist. 2003; 9: 16-27. [ Links ]
3. Kane JM, Woerner M, Lieberman J. Tardive dyskinesia: prevalence, incidence, and risk factors. J Clin Psycho- pharmacol. 1988; 8: 525-65. [ Links ]
4. Seeman P, Van Tol HH. Dopamine receptor pharmacology. Trends Pharmacol Sci. 1994; 15: 264-70. [ Links ]
5. Dawson GR, Wafford KA, Smith A, Marshall GR, Bayley PJ, Schaeffer JM, et al. Anticonvulsant and adverse effects of avermectin analogs in mice are mediated through the gamma-aminobutyric acid(A) receptor. J Pharmacol Exp Ther. 2000; 295: 1051-60. [ Links ]
6. Turrone P, Remington G, Nobrega JN. The vacuous chewing movement (VCM) model of tardive dyskinesia revisited: is there a relationship to dopamine D(2) receptor occupancy? Neurosci Biobehav Rev. 2002; 26: 361-80. [ Links ]
7. Gunne LM, Growdon JH. A model for oral dyskinesia in rats. J Clin Psychopharmacol. 1982; 2: 308-11. [ Links ]
8. Casey DE. Tardive dyskinesia: pathophysiology and animal models. J Clin Psychiatry. 2000; 61 (Suppl 4): 5-9. [ Links ]
9. Tamminga CA, Dale JM, Goodman L, Kaneda H, Kaneda N. Neuroleptic-induced vacuous chewing movements as an animal model of tardive dyskinesia: a study in three rat strains. Psychopharmacology. (Berl) 1990; 102: 474-8. [ Links ]
10. Turrone P, Remington G, Nobrega JN. The vacuous chewing movement (VCM) model of tardive dyskinesia revisited: is there a relationship to dopamine D(2) receptor occupancy? Neurosci Biobehav Rev. 2002; 26: 361-80. [ Links ]
11. Andreassen OA, Jorgensen HA. Neurotoxicity associated with neuroleptic-induced oral dyskinesias in rats. Implications for tardive dyskinesia? Prog Neurobiol. 2000; 61: 525-41. [ Links ]
12. Bishnoi M, Kumar A, Chopra K, Kulkarni SK. Comparative neurochemical changes associated with chronic administration of typical and atypical neuroleptics: implications in tardive dyskinesia. Indian J Exp Biol. 2007; 45: 175-9. [ Links ]
13. Gunne LM, Haggestrom JE, Sjokvist B. Association with persistent neuroleptic induced dyskinesia of regional changes in the brain GABA synthesis. Nature. 1984; 309: 347-9. [ Links ]
14. Stoessl AJ. Effects of ethanol in a putative rodent model of tardive dyskinesia. Pharmacol Biochem Behav. 1996; 54: 541-6. [ Links ]
15. Peixoto MF, Abílio VC, Silva RH, Frussa-Filho R. Effects of valproic acid on an animal model of tardive dyskinesia. Behav Brain Res. 2003; 142: 229-33. [ Links ]
16. Soares K, Rathbone J, Deeks J. Gamma-aminobutyric acid agonists for neuroleptic-induced tardive dyskinesia. Cochrane Database Syst Rev. 2004: CD000203. [ Links ]
17. Pong SS, Wang CC, Fritz LC. Studies on the mechanism of action of avermectin B1a: stimulation of release of gamma-aminobutyric acid from brain synaptosomes. J Neurochem. 1980; 34: 351-8. [ Links ]
18. Pong SS, Wang CC. Avermectin B1a modulation of gamma-aminobutyric acid receptors in rat brain membranes. J Neurochem. 1982; 38: 375-9. [ Links ]
19. Greig NH, Sweeney DJ, Rapoport SI. Inability of dimethyl sulfoxide to increase brain uptake of water-soluble compounds: Implications to chemotherapy for brain tumors. Cancer Treat Rep. 1985; 69: 305-12. [ Links ]
20. McCormick SE, Stoessl AJ Central administration of the neurotensin receptor antagonist SR48692 attenuates vacuous chewing movements in a rodent model of tardive dyskinesia. Neuroscience. 2003; 119: 547-55. [ Links ]