Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Colombia Médica
On-line version ISSN 1657-9534
Colomb. Med. vol.40 no.1 Cali Jan./Mar. 2009
Malaria: eficacia de amodiaquina-sulfadoxina-pirimetamina, estado nutricional y variantes alélicas del gen CYP2C8*
Jaime Carmona-Fonseca, MD1, Valentina Guzmán-Pérez, Nutr2, Amanda Maestre-Buitrago, PhD3
* Investigación financiada por Colciencias (código 1115-04-16497; contrato RC-253-20043), la Dirección Seccional de Salud de Antioquia y la Universidad de Antioquia, Medellín, Colombia.
1. Profesor Titular, Facultad de Medicina, Grupo Salud y Comunidad, Universidad de Antioquia, Medellín, Colombia.
e-mail: jaimecarmonaf@hotmail.com
2. Profesora Asistente, Grupo Relación Estructura-Función de Biomoléculas en la Fisiopatología de Enfermedades no Transmisibles, Universidad Javeriana, Bogotá, Colombia. e-mail: vguzman@javeriana.edu.co
3. Profesora Asociada, Facultad de Medicina, Grupo Salud y Comunidad, Universidad de Antioquia, Medellín, Colombia.
e-mail: aemaestre@quimbaya.udea.edu.co
Recibido para publicación noviembre 19, 2007 Aceptado para publicación enero 15, 2009
RESUMEN
Problema: La respuesta terapéutica antimalárica depende de múltiples determinantes asociados con el plasmodio (especie, mutaciones, cantidad, etc.) y al hospedero (nutrición, genes, metabolismo, etc.), pero los últimos son poco conocidos.
Objetivos: Evaluar en pacientes con malaria falciparum no complicada, tratados con amodiaquina-sulfadoxina-pirimetamina (AQ-SP), algunas relaciones entre la respuesta terapéutica (RTA), el estado nutricional y las variaciones alélicas del gen CYP2C8.
Metodología: Estudio clínico controlado, con asignación aleatoria, balanceado, no ciego. La RTA se evaluó según la Organización Mundial de la Salud. Se hizo análisis antropométrico, se midieron las concentraciones plasmáticas de retinol, ferritina y selenio; se analizaron las variantes 2C8*1 (silvestre), 2C8*2 (Il29F) y 2C8*3 (R139K y K399R) del gen CYP2C8.
Resultados: Se evaluaron 33 pacientes, todos con respuesta terapéutica adecuada con AQ-SP; 10% presentó deficiencia de retinol, 25% de selenio y 40% de ferritina. Sólo un paciente presentó la variante CYP2C8*2 en forma heterozigótica y el resto fueron homocigóticos para el alelo silvestre de este gen. Ninguno presentó la mutación R139K en CYP2C8*3. Del alelo K339R de CYP2C8*3 no se pudieron obtener fragmentos aptos de digerir, aún haciendo adaptaciones del método y no fue posible conocer la razón de este hecho. Estos datos concuerdan con los resultados de otro análisis similar en 23 pacientes, tratados solo con amodiaquina: 22% presentaron alguna variante (5 con CYP2C8*2 y 2 con CYP2C8*3). En el gen CYP2C8*3 se identificó sólo la mutación R139K, presente en 2 individuos.
Conclusión: Sólo uno de los 33 pacientes (3%) presentó la variante CYP2C8*2, en forma heterozigótica; el resto fueron homocigóticos para el alelo silvestre de esta variante. Ninguno presentó la mutación R139K de la variante CYP2C8*3. Es el primer informe para Latinoamérica.
Palabras clave: Citocromo P-450; Amodiaquina; Malaria; Desnutrición; Selenio; Ferritina; Retinol.
Malaria: efficacy of amodiaquine-sulfadoxine-pyrimethamine, nutritional status and alellic variaton of CYP2C8 gen
SUMMARY
Problem: Therapeutic response to antimalarials depends on multiple determinants associated with the parasite (species, mutations, parasitaemia, etc.) and the host (nutrition, genes, metabolism, etc.), but little is known about the host factors.
Objectives: To evaluate in non-complicated falciparum malaria patients undergoing treatment with amodiaquine-sulfadoxine-pyrimethamine (AQ-SP), some relationships between treatment response, nutritional status and characteristics of the gen CYP2C8.
Methodology: A randomly assigned, balanced, non blind, controlled clinical design. Treatment response was assessed according to WHO 1998 criteria. Analysis included anthropometry, plasma levels of retinol, ferritin and selenium, and assessment of 2C8*1 (wild), 2C8*2 (Il29F) and 2C8*3 variants of CYP2C8 (R139K y K399R).
Results: 33 patients were studied, all of them evidenced adequate treatment response, 10% had retinol deficiency, 25% selenium deficiency and 40% low ferritine levels. One patient exhibited the variant Il29F of CYP2C8*2 in a heterozygous fashion, the remaining individuals were homozygous for the wild form of this gene. The mutant R139K of CYP2C8*3 was absent in all individuals. Amplification fragments obtained of K339R (CYP2C8*3 gen) were not suitable for digestion, regardless of the modifications performed. These results confirm previous findings made in 22% of 23 patients in whom some variation was observed (5 in CYP2C8*2 and 2 in CYP2C8*3). For CYP2C8*3 the mutant R139K, was observed in 2 individuals.
Conclusion: only one of the 33 patients (3%) had CYP2C8*2 in a heterozygous fashion, the remaining were homozygous for the wild allele of this variant. None of the patients had the mutation R139K of the CYP2C8*3 variant. This is a novel report for Latin America.
Keywords: Cytochrome P-450; Amodiaquine; Malaria; Malnutrition; Selenium; Ferritin; Retinol.
¿Cuánta de la falla terapéutica antimalárica se debe a factores del hospedero como su constitución genética del CYP450 y el funcionamiento de las enzimas que él controla? ¿Interviene en la respuesta al tratamiento antimalárico el estado nutricional del paciente?
La medición de la eficacia terapéutica antipalúdica cuenta con protocolos estandarizados1. La resistencia genética parasitaria es el rasgo más conocido de causa de falla del tratamiento. En cuanto al hospedero, además de sus estados nutricional e inmune, una pobre absorción, un metabolismo alterado, hipoproteinemia, acelerado metabolismo del compuesto, pueden afectar la respuesta terapéutica2.
El metabolismo de la gran mayoría de los medicamentos antipalúdicos depende básicamente del sistema de oxidasas de función mixta, sistema microsomal o citocromo P-450 (CYP450), compuesto por 30 familias de enzimas (citocromos)2-4. El CYP450 humano tiene gran variación genética5,6 que involucra más de 57 genes del sistema7,8. Esa gran variación genética permite clasificar a las personas en metabolizadoras lentas, extensas y ultrarrápidas8 según la expresión fenotípica, es decir, de la actividad funcional de sus enzimas. La identificación de las enzimas CYP450 aporta una base para saber cómo se espera que se comporten farmacocinéticamente esos medicamentos administrados individualmente o en combinación y para ayudar a predecir interacciones medicamento-medicamento in vivo9.
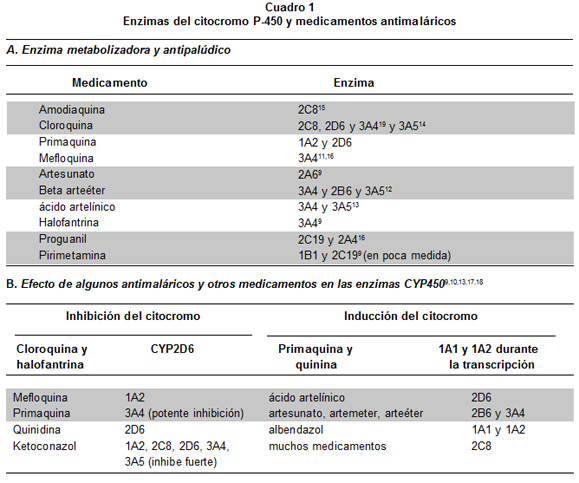
El Cuadro 1 resume información básica sobre relaciones entre enzimas del citocromo P-450 y medicamentos antimaláricos9-19. La AQ se elimina activamente en el hígado (>70%), mientras que la quinina y el artesunato (metabolizado éste por esterasas y enzimas hepáticas, pero no CYP45020) son de eliminación intermedia (30%-70%), y la cloroquina (CQ), la pirimetamina y la dapsona se eliminan todavía más lentamente por esa vía hepática (<30%)9. La transformación de AQ a N-desetilamodiaquina (DEAQ) es la principal ruta de disposición en los humanos y la enzima CYP2C8es la isoforma hepática que contribuye 100% a la conversión de AQ en DEAQ9. Las enzimas extrahepáticas CYP1A1 y 1B1 también eliminan AQ y catalizan la formación de un metabolito que no ha sido identificado9.
La subfamilia CYP2C representa aproximadamente 20% del total del contenido hepático de CYP450 y, dentro de ella, el más abundante es 2C9, seguido de 2C8 y 2C1921. La enzima CYP2C8 tiene una estructura molecular conocida22 y es el miembro más fuertemente inducible de la subfamilia CYP2C23.
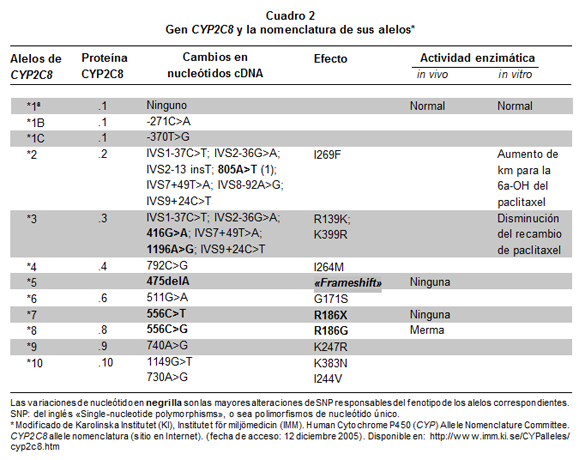
El gen CYP2C8 codifica la enzima que metaboliza parcialmente la CQ y totalmente la AQ; este gen tiene al menos diez variantes alélicas24, como 2C8*2 y 2C8*3 (ésta tiene dos mutaciones); esas variantes están asociadas con el metabolismo incompleto de medicamentos, así cuantificado al comparar su actividad con la de la variante 2C8*1, que es el tipo silvestre («normal»)25 (Cuadro 2). En España, la variante más frecuente de CYP2C8 es 2C8*326 (30%); existe asociación en la aparición de los alelos CYP2C8*3 y CYP2C9*226. En personas caucásicas, afroamericanas y asiáticas hay relativamente poca diferencia étnica en el polimorfismo de once genes pertenecientes a tres subfamilias (CYP1, 2 y 3) que intervienen en el metabolismo de medicamentos, entre ellos CYP2C8, pero hay gran diferencia entre los genes y entre las tres subfamilias genéticas; además, de las tres subfamilias, la 2 presenta los mayores niveles de diversidad genética27.
La farmacogenética es el estudio de las respuestas con base genética que se presentan frente a los xenobióticos, incluidas las drogas28,29. La mayoría de los medicamentos son efectivos apenas entre 25%-60% de los pacientes, por causa multifactorial30. La evaluación fenotípica (medición de la actividad de la enzima sobre un sustrato conocido) ha avanzado bastante. En el año 2004 se informó sobre el desarrollo y validación de doce pruebas semiautomáticas para medir la actividad de sustratos marcadores de CYP450 humano, donde se incluyó la amodiaquina como sustrato31.
La relación entre la eficacia terapéutica y, por otra parte, la actividad y la estructura genética del CYP450 ha sido poco estudiada. Una reciente revisión sistemática sobre el tema2, apenas halló un artículo, el estudio de Kaneko et al.32, hecho en Vanuatu, Melanesia, con 95 pacientes con malaria que recibieron tratamiento con proguanil, un profármaco que se convierte a cicloguanil, el metabolito activo contra Plasmodium. Un metabolismo lento de la AQ podría representar un riesgo potencial de efectos adversos porque el medicamento permanece más tiempo en los tejidos33.
Las infecciones o el estímulo inflamatorio generan cambios en la actividad y expresión de varias formas del CYP450 hepáticas y extrahepáticas (cerebro, riñón)2. La dieta y el estado nutricional pueden modificar la farmacocinética o metabolismo de medicamentos mediados por el CYP450; la primera representa probablemente la vía más significativa para la exposición a compuestos químicos; por su parte, el estado nutricional, el estado de salud, las restricciones dietéticas o la corrección de la desnutrición con suplementos nutricionales deben ser considerados en el momento de analizar el comportamiento de un medicamento y la evaluación de su ruta terapéutica2.
La inflamación causada por las infecciones, como la malaria, reduce la actividad del complejo enzimático del CYP-4502, que es activado o inducido por las dietas hiperproteicas y el consumo de ácidos grasos (CYP3A y CYP2A1), mientras que es inhibido por el kwashiorkor, dietas deficientes en carbohidratos, o en ácidos grasos, o en vitaminas A, E, C, B2, niacina, o en Fe, Zn, Ca2. El paludismo, la desnutrición y los parásitos intestinales afectan intensamente a los niños (3 a 11 años) de Turbo (Urabá) y El Bagre y Zaragoza (Bajo Cauca)34-36. Parece lógico pensar que todas estas condiciones influyan en el metabolismo de los antimaláricos y otros medicamentos2.
Los autores del presente artículo han estudiado la eficacia terapéutica de varios antipalúdicos en el departamento de Antioquia (Colombia)37-39. En Colombia, entre1961 y2003, la falla terapéutica de la AQ fue de 22% en promedio; por otra parte, la falla terapéutica de la combinación AQ con sulfadoxina-pirimetamina (AQ-SP) fue 11% en Tadó (Chocó) y 2% en Turbo y El Bagre (Antioquia)40,41.
En el caso del paludismo, es poco lo que se conoce sobre las relaciones entre la respuesta al tratamiento antipalúdico (en particular con AQ), el estado nutricional del paciente y el genotipo del CYP2C8. Este informe presenta los resultados de una investigación efectuada en pacientes con malaria por Plasmodium falciparum no complicada, tratados con AQ-SP, en quienes se evaluaron la respuesta terapéutica, el estado nutricional y las variaciones alélicas del gen CYP2C8.
METODOLOGÍA
Clase de estudio y tamaño de la muestra. Los pacientes de este estudio hacen parte de una investigación más amplia, encaminada a evaluar la respuesta terapéutica ante varios tratamientos, en los municipios de Turbo y El Bagre y Zaragoza, en el departamento de Antioquia, Colombia40,41. Esa investigación siguió un diseño clínico controlado, balanceado, no ciego, donde los grupos se evaluaron en forma secuencial y el orden fue definido en forma aleatoria; los pacientes se captaron a medida que llegaban al puesto de malaria. La respuesta terapéutica se evaluó según el protocolo OMS-19981. En esa investigación se trabajó en general, con muestras de tamaño 50 en cada municipio (100 pacientes por tratamiento), con seguimiento por 21 (AQ, SP) ó 28 días (AQ-SP).
Los 33 pacientes de este informe hacen parte del grupo de 90 personas evaluadas con el esquema AQ-SP41 en Turbo y El Bagre, en 2003; de esos 33 enfermos se tiene información de las variables respuesta terapéutica, índice de masa corporal, concentración en sangre de ferritina, selenio y retinol y genotipo CYP2C8. Esos 33 pacientes fueron tomados al azar entre los 90 del estudio completo. El procedimiento de muestreo se hizo con una lista de números aleatorios generada por computador (programa Epidat 3.1). El tamaño de la submuestra (n=33) se determinó por conveniencia, considerando dos aspectos: el costo de estudiar cada paciente (exámenes de ferritina, selenio y retinol, y genotipo CYP2C8) y la idea de que se trataba de una aproximación inicial al asunto de la relación CYP450-respuesta terapéutica. Este informe corresponde a un análisis descriptivo y prospectivo.
Población de referencia. Las regiones de Urabá y Bajo Cauca aportan 90% de los casos de paludismo del departamento de Antioquia y fueron recientemente descritas por los autores34-36. Turbo (Urabá) está situado en un lugar cuyas coordenadas son 8° 05´ 42´´ N, 76° 44´ 123´´; El Bagre (Bajo Cauca) está en 7° 35´25´´ N, 74° 48´ 27´´.
La población de referencia para este estudio son hombres y mujeres mayores de un año, residentes en áreas urbana o rural de los municipios de Turbo y El Bagre, atendidos de forma ambulatoria en los puestos de malaria de dichos municipios, con malaria no complicada y debida exclusivamente a P. falciparum.
Criterios de inclusión. Todos los pacientes de este trabajo fueron captados según el orden de llegada, siempre y cuando cumplieran los criterios de inclusión, sin que ninguna otra condición interviniera; tales criterios los fija el protocolo OMS-1998 y son:
· Tener malaria no complicada, debida sólo a P. falciparum, tratada con AQ-SP y haber sido seguido con controles parasitológico y clínico durante 28 días.
· No estar en embarazo.
· No presentar procesos infecciosos diferentes a malaria.
· No presentar enfermedad cardíaca congestiva ni falla renal o hepática.
· No tener antecedentes de intolerancia a los medicamentos antimaláricos.
· No haber ingerido suplementos de vitaminas y minerales en las últimas dos semanas.
Tratamiento de los pacientes y evaluación de la respuesta terapéutica. La AQ se administró en dosis de 25 mg/kg distribuida en tres fracciones de 10, 7.5 y 7.5 mg/kg/día durante tres días consecutivos. La sulfadoxina se administró en dosis de 25 mg/kg y la pirimetamina 1.25 mg/kg, ambas en dosis única. Todo medicamento se administró bajo supervisión directa del médico tratante.
La respuesta terapéutica se clasificó así:
a. Falla temprana: indica presencia de signos de malaria grave en el día 1 ó 2 del seguimiento o cuando existe una mayor parasitemia el día 2 ó 3 con respecto al recuento del día de ingreso del paciente.
b. Falla tardía indica presencia de signos de malaria grave con parasitemia (de la misma especie que el día 0) después del tercer día de iniciado el seguimiento o cuando el paciente consulta los días 1, 2, 3, 4, 7, 14, 21 ó 28 del seguimiento debido a un deterioro clínico en presencia de parasitemia (de la misma especie que el día 0).
c. Respuesta clínica adecuada es definida como la ausencia de signos de malaria grave y eliminación de la parasitemia después de administrado el tratamiento antimalárico.
Evaluaciones practicadas al paciente:
- Antropometría: En el momento del ingreso del paciente al estudio se evaluaron el peso en kilogramos (kg) y la estatura en metros cuadrados (m2), con báscula electrónica (sensibilidad de 100 g) y estadiómetro. En el laboratorio se determinó el índice de masa corporal (IMC) (peso kg/estatura m2) y se emplearon estos puntos de corte: déficit, menos de 18.5; normal, entre 18.5 y 24.9; exceso de peso, entre 25 y 29.9; obesidad, valores superiores a 29.942.
- Micronutrientes en plasma o suero: El último día del seguimiento para medir la respuesta terapéutica (día 28), los investigadores del Grupo Malaria tomaron muestras de sangre venosa anticoagulada con EDTA para la medición de retinol, ferritina y selenio en plasma, el cual fue protegido del aire, la luz y el contacto directo con hielo para evitar la oxidación del retinol. Estas fueron las mediciones:
- Vitamina A (plasma). La medición del retinol plasmático se hizo en el Instituto Nacional de Salud (INS), Bogotá (es el laboratorio nacional de referencia) por el método HPLC (cromatógrafo líquido Water 600 E con detector UV). El plasma se diluyó con una solución de acetato de retinol en etanol, se extrajo con hexano y se evaporó con nitrógeno; el residuo se resuspendió en metanol y luego fue inyectado al cromatógrafo. La concentración de retinol se leyó en el detector a 325 nm relacionando el área del pico del retinol con la del acetato. Se tomaron como deficientes aquellos valores inferiores a 20 µg/dl43.
- Ferritina (plasma). La cuantificación de ferritina se hizo en el INS con inmunoensayo enzimático de micropartículas (MEIA), un montajeprueba-electrodo que mezcla la muestra, el diluyente de la muestra, el conjugado fosfatasa alcalina-antiferritina y las micropartículas cubiertas con un anticuerpo contra ferritina, con posterior incubación en la celda de reacción43. Los puntos de corte empleados para la determinación de deficiencia fueron: 18-23 µg/dl leve; 12-17.9 µg/dl moderada y <12 µg/dl grave43.
- Selenio (suero). La medición de selenio se realizó en el laboratorio de análisis industriales de la Universidad del Valle (Cali). El selenio fue determinado directamente, sin tratamiento previo, por espectrofotometría de absorción atómica con horno de grafito. En este método el suero se inyecta en una cubeta de grafito, la cual se calienta gradualmente, secando, calcinando la materia orgánica presente y finalmente atomizando el selenio que se encuentra en la matriz, el cual, mediante absorción de radicación se determina cuantitativamente en la muestra. Se consideraron como deficientes aquellos valores por debajo de 4 µg/l y como valores tóxicos los superiores a 10 µg/dl.
Genotipificación de CYP2C8. Las muestras de sangre total se depositaron en papel filtro Wathman N° 3 y se almacenaron a -20°C. La extracción del ADN se realizó con la técnica estándar de Chelex. Mediante una reacción en cadena de la polimerasa (PCR) y el polimorfismo de la longitud de los fragmentos de restricción (PCR-RFLP), se analizó el gen CYP2C8. Las condiciones de las PCR y de las restricciones realizadas, así como todas las modificaciones realizadas se detallan en el Cuadro 3.
Las variantes CYP2C8*2 (Il29F) y 2C8*3 (R139K y K399R) se determinaron con los cebadores y enzimas descritas por otros autores26, con modificaciones (Cuadro 3). Los productos de amplificación (5 µl) para la variante 2C8*2 (312 pb) se incubaron con 1U de la endonucleasa BclI (Fermentas®) y se analizaron en geles de agarosa al 4%. La digestión en fragmentos de 214 y 98 pb se observó en la forma silvestre del gen. La variante CYP2C*3 se evaluó mediante protocolo ya descrito26: El primer par de cebadores identificó la mutación R139K en el exón 2 del gen; el producto de esta PCR (347 pb) fue incubado con la endonucleasa Bse RI, la cual digirió el producto silvestre (CYP2C8*1) en fragmentos de 310 y 37 pb.
Las confirmación de patrones heterozigóticos se realizó mediante secuenciación de los productos purificados (Macrogen®)45. Las secuencias resultantes fueron editadas con el programa Bio edit 7.0.
Análisis estadístico de los datos. La información obtenida se procesó con los programas EpiInfo versión 6.04 y SPSS versión 10.0. En todos los análisis se consideró estadísticamente significativa una probabilidad menor de 0.05 (5%). El análisis de los datos siguió esta estrategia:
· Análisis de normalidad: cada variable se analizó con la prueba de Kolmogorov-Smirnov, con el programa EpiInfo.
· Comparación de variables nominales: se usó una prueba chi cuadrado (c2) para examinar la distribución de frecuencias de las variables.
· Comparación de variables métricas: se calcularon medidas estadísticas de resumen (promedio, mediana, desviación estándar), cuyos valores se informan como promedio + desviación estándar. Se compararon medianas mediante la prueba de Kruskal-Wallis. Se midieron correlaciones lineales simples entre las variables nutricionales (ferritina, selenio, retinol, IMC).
Aspectos éticos. El proyecto fue aprobado por el Comité de Ética del Centro de Investigaciones Médicas de la Facultad de Medicina de la Universidad de Antioquia. De cada paciente se obtuvo su consentimiento informado escrito antes de ingresar al estudio.
RESULTADOS
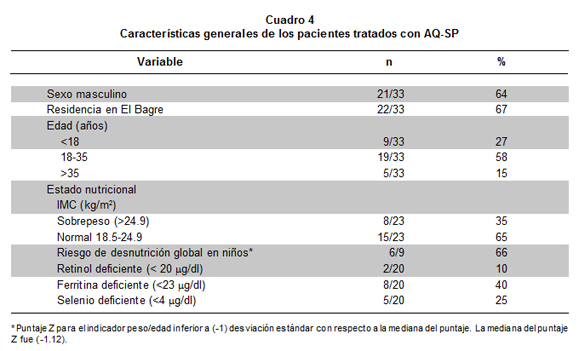
Se evaluaron 33 pacientes con paludismo por P. falciparum, 64% de ellos de sexo masculino; su edad osciló entre 7 y 60 años (27% menores de 18 años) (Cuadro 4). La parasitemia asexual presentó un promedio de 8,096 parásitos/ml (media geométrica 4,501) y una desviación estándar de 8,810 parásitos/ml. Del total de pacientes 25% presentó hasta 2,140 parásitos/ml, 50% hasta 4,640 y 75% hasta 11,760. La parasitemia fue mucho mayor en los grupos de edad menores a 18 años, con respecto a los mayores de edad, pero la diferencia no fue significativa.
Las tres «variables» que se evaluaron en función del objetivo de este trabajo presentaron estos resultados: la respuesta terapéutica fue adecuada (exitosa) en todos los 33 pacientes, lo que concuerda con el resultado en la totalidad de 90 pacientes, en quienes hubo éxito terapéutico en 98%40,41.
El estado nutricional en los niños correspondió a «riesgo de desnutrición global» (según el indicador peso para la edad) en 66% de ellos. En los adultos, se halló 35% con sobrepeso. Las medianas de las concentraciones de los micronutrientes fueron: retinol 40 µg/dl, ferritina 32.3 µg/dl y selenio 4.28 µg/dl (Cuadros 4 y 5). De los 33 pacientes, 10% presentó deficiencia de retinol (<20 µg/dl) y 25% de selenio (<4 µg/dl); en la ferritina, 15% mostró menos de 12 µg/dl (deficiencia grave), 20% tienen menos de 18 (moderada) y 40% tienen menos de 23 (leve). Ningún paciente presentó concentraciones sanguíneas superiores al rango establecido como normal para estos micronutrientes. La correlación lineal simple de la concentración de micronutriente contra la edad o la parasitemia fue muy baja y no significativa. La correlación (coeficiente r) entre los valores de micronutrientes también fue muy baja (retinol-ferritina r= 0.194; retinol-selenio r= 0.244; ferritina-selenio r= -0.043) y no significativa (siempre p>0.10).
La genotipificación de las variantes 2C8*2 y 2C8*3 se hizo en 69 muestras de los 33 pacientes tratados con AQ-SP, con estos resultados:
. Variante 2C8*2: se amplificó un fragmento de 312 pb; en 65 muestras se encontró digestión de los dos alelos del gen (esto indica genotipo silvestre homocigótico). Únicamente un paciente presentó la variante CYP2C8*2 y lo fue en forma heterozigótica; el resto fueron homocigóticos para el alelo silvestre de esta variante.
. Variante CYP2C8*3: ninguno de los pacientes presentó la mutación R139K de ella y de la otra (K399R) no se pudieron obtener fragmentos aptos para digerir, aún haciendo adaptaciones del método, sin que pudiéramos establecer la causa de esto.
En forma resumida puede afirmarse que:
a. todos los pacientes tratados con AQ-SP presentaron respuesta terapéutica exitosa;
b. el estado nutricional fue deficiente sólo en los niños;
c. la deficiencia de micronutrientes varió de 10% a 40%;
d. un paciente, entre 33, presentó la variante CYP2C8*2.
Como no hubo pacientes con falla terapéutica, no se pudo avanzar en la exploración de las relaciones entre respuesta terapéutica-estado nutricional-variación genética de CYP2C8.
DISCUSIÓN
El hallazgo más notorio en los individuos tratados con AQ-SP fue la presencia de polimorfismos genéticos en CYP2C8, en forma heterocigótica, en 3% (1/32) de los pacientes; esta frecuencia es superior a la encontrada en Papua Nueva Guinea, donde no se hubo variación del gen CYP2C8 (todos los niños examinados fueron homocigotos)44 y es menor que la informada en: Zanzíbar (África oriental) en 2005 (13.9%)33; en el norte de Ghana (África), entre 200 escolares tomados al azar (2C8*2: 16,75%; ausencia total de 2C8*3 y 2C8*4)45; en Burkina Faso (África occidental) (en 275 pacientes con paludismo: 15% CYP2C8*2, 0.03% CYP2C8*3)46. En los pacientes con malaria de Burkina Faso no se halló evidencia de la influencia de esos dos polimorfismos sobre la eficacia o la toxicidad de la AQ, pero el tamaño de la muestra (n=275) limitó esas conclusiones46, por lo que persiste la pregunta sobre la influencia del polimorfismo de CYP2C8 en el metabolismo de la amodiaquina47. La escasa frecuencia de polimorfismo del gen CYP2C8 en la población del presente estudio facilita el uso de AQ para tratar la malaria falciparum, porque, desde el punto de vista genético, la población responderá adecuadamente al medicamento.
La evaluación de los polimorfismos genéticos del CYP2C8 se hizo con la técnica RFLP modificando el protocolo descrito por Dai et al.25 que mostró excelentes resultados para la identificación de la variante 2C8*2 (Il29F), pero no para la variante 2C8*3, la cual comprende dos mutaciones (R139K y K399R), pues sólo se pudo evaluar la primera. Algunas posibles razones para este tropiezo son:
a. escasa cantidad de ADN en la muestra de sangre almacenada en el papel filtro;
b. calidad deficiente del ADN, quizás por deficiencia en las condiciones de almacenamiento.
Las dos explicaciones previas no concuerdan con el hecho de que fue posible amplificar la otra variante; quizás los cebadores usados no eran apropiados para detectar la segunda variante.
Estos resultados concuerdan con los obtenidos en un grupo de Tumaco (Nariño, Colombia), tratados con monoterapia con AQ. Sus muestras de sangre habían sido recolectadas meses antes por investigadores del CIDEIM (Cali, Colombia), entidad que nos facilitó muestras en papel de filtro. Se trató de 23 pacientes (13 hombres y 10 mujeres), en 12 de los cuales hubo falla terapéutica. El análisis genético lo hicimos exactamente como se procedió con los del presente informe. Todas las 23 muestras amplificaron y se incluyeron en el análisis. Se identificó la variante R139K de CYP2C8*3 y no el alelo K399R. Tres de los 23 pacientes presentaron la variante CYP2C8*2 en forma heterozigótica y dos de los tres mostraron falla del tratamiento. Dos de los 23 pacientes presentaron la variante R139K de CYP2C8*3 y ambos presentaron falla terapéutica con la AQ. No se encontró asociación estadísticamente significativa entre la respuesta terapéutica y el genotipo de 2C8 (p>0,05) (datos sin publicar).
En el años 2005 se informó sobre la validación de una técnica de genotipificación para las variantes del CYP2C8 que permite, por medio de múltiples PCR, la identificación de tres polimorfismos incluyendo los evaluados en el presente estudio48, lo que permite reducir el tiempo y el costo del procesamiento de las muestras en los estudios poblacionales.
Pocos estudios han evaluado la presencia de estas variantes alélicas en pacientes con malaria. Se ha demostrado que el CYP2C8 es bastante polimórfico, factor que puede ser responsable de la variación de los parámetros farmacocinéticos informada en otros trabajos15. Este informe es el primero en dar cuenta en pacientes maláricos de Latinoamérica sobre la variabilidad genética de este gen, lo cual se debería relacionar en futuros estudios con los parámetros farmacocinéticos de la AQ y con el fenotipo de la enzima.
Se sabe que la presencia de estas variantes alélicas reduce el metabolismo del plaquitaxel, medicamento anticanceroso y, por tanto, no se debe descartar que estas variantes sean responsables en este caso del metabolismo inadecuado del antimalárico o de los efectos citotóxicos relacionados con la quinoneimina, compuesto formado en el metabolismo de la AQ capaz de unirse irreversiblemente a proteínas celulares49.
La ausencia de falla terapéutica en este grupo de pacientes tratados con AQ-SP no permitió el análisis de relación entre RTA, estado nutricional y polimorfismos del gen CYP2C8. Es notorio el elevado porcentaje de pacientes con deficiencia de selenio o de ferritina (20% cada uno). No hay estudios en Colombia que evalúen el estado del selenio en suero o plasma. El selenio es crítico para la actividad del CYP450 tanto intestinal como hepático; el intestinal debe ser abastecido por la alimentación, puesto que su ausencia tiene graves repercusiones en el contenido total y la actividad de las enzimas en la vellosidad intestinal; el hepático, por su parte, puede obtenerse a partir de las reservas corporales del micronutriente50,51.
AGRADECIMIENTOS
A los pacientes por aceptar participar en la investigación.
REFERENCIAS
1. OMS-OPS. Organización Mundial de la Salud, Organización Panamericana de la Salud. Evaluación de la eficacia terapéutica de los medicamentos para el tratamiento del paludismo por Plasmodium falciparum sin complicaciones en las Américas. OPS/HCP/HCT/113/98. Washington: OPS; 1998. [ Links ]
2. Guzmán V, Carmona-Fonseca J. El citocromo P-450 y la respuesta terapéutica antimalárica. Rev Panam Salud Publica. 2006; 19: 9-22. [ Links ]
3. Giao PT, de Vries PJ. Pharmacokinetic interactions of antimalarial agents. Clin Pharmacokinet. 2001; 40: 343-73. [ Links ]
4. Guengerich FP. Cytochrome P450: Structure, mechanism and biochemistry. In: Ortiz de Montellano PR, ed. Human Cytochrome P450 Enzymes. New York: Plenum Press; 1995. p. 473-535. [ Links ]
5. Daly AK. Pharmacogenetics of the major polymorphic metabolizing enzymes. Fundam Clin Pharmacol. 2003; 17: 27-41. [ Links ]
6. Meyer UA. Pharmacogenetics and adverse drug reactions. Lancet 2000; 356: 1667-71. [ Links ]
7. Ingelman-Sundberg M, Daly AK, Nebert DW. Nomenclature files for human cytochrome P450 alleles [sitio en internet]. Page of the Human Cytochrome P450 (CYP) Allele Nomenclature Committee. (fecha de acceso: 13 diciembre 2005). Disponible en: http://www.imm.ki.se/CYPalleles/ [ Links ]
8. Wormhoudt LW, Commandeur JN, Vermeulen NP. Genetic polymorphisms of human N-acetyltransferase, cytochrome P450, glutathione-S-transferase, and epoxide hydrolase enzymes: relevance to xenobiotic metabolism and toxicity. Crit Rev Toxicol. 1999; 29: 59-124. [ Links ]
9. Li XQ, Bjorkman A, Andersson TB, Gustafsson LL, Masimirembwa CM. Identification of human cytochrome P(450)s that metabolise anti-parasitic drugs and predictions of in vivo drug hepatic clearance from in vitro data. Eur J Clin Pharmacol. 2003; 59: 429-42. [ Links ]
10. Burk O, Arnold KA, Nussler AK, Schaeffeler E, Efimova E, Avery BA, et al. Antimalarial artemisinin drugs induce cytochrome P450 and MDR1 expression by activation of xenosensors pregnane X receptor and constitutive androstane receptor. Mol Pharmacol. 2005; 67: 1954-65. [ Links ]
11. Fontaine F, de Sousa G, Burcham PC, Duchene P, Rahmani R. Role of cytochrome P450 3A in the metabolism of mefloquine in human and animal hepatocytes. Life Sci. 2000; 66: 2193-212. [ Links ]
12. Grace JM, Aguilar AJ, Trotman KM, Peggins JO, Brewer TG. Metabolism of beta-arteether to dihydroqinghaosu by human liver microsomes and recombinant cytochrome P450. Drug Metab Dispos. 1998; 26: 313-7. Erratum: Drug Metab Dispos. 1998; 26: 704. Drug Metab Dispos. 1998; 26: 313-7. Erratum: Drug Metab Dispos. 1998; 26: 704. [ Links ]
13. Grace JM, Skanchy DJ, Aguilar AJ. Metabolism of artelinic acid to dihydroqinqhaosu by human liver cytochrome P4503A. Xenobiotica. 1999; 29: 703-17. [ Links ]
14. Kim KA, Park JY, Lee JS, Lim S. Cytochrome P450 2C8 and CYP3A4/5 are involved in chloroquine metabolism in human liver microsomes. Arch Pharm Res. 2003; 26: 631-7. [ Links ]
15. Li XQ, Bjorkman A, Andersson TB, Ridderstrom M, Masimirembwa CM. Amodiaquine clearance and its metabolism to N-desethylamodiaquine is mediated by CYP2C8: a new high affinity and turnover enzyme-specific probe substrate. J Pharmacol Exp Ther 2002;300:399-407. [ Links ]
16. Lu AH, Shu Y, Huang SL, Wang W, Ou-Yang DS, Zhou HH. in vitro proguanil activation to cycloguanil is mediated by CYP2C19 and CYP3A4 in adult Chinese liver microsomes. Acta Pharmacol Sin. 2000; 21: 747-52. [ Links ]
17. Ndifor AM, Howells RE, Bray PG, Ngu JL, Ward SA. Enhancement of drug susceptibility in Plasmodium falciparum in vitro and Plasmodium berghei in vivo by mixed-function oxidase inhibitors. Antimicrob Agents Chemother. 1993; 13: 18-23. [ Links ]
18. Polasek TM, Elliot DJ, Lewis BC, Miners JO. Mechanism-based inactivation of human cytochrome P4502C8 by drugs in vitro. J Pharmacol Exp Ther. 2004; 311: 996-1007. [ Links ]
19. Projean D, Baune B, Farinotti R, Flinois J, Beaune P, Taburet AM, et al. in vitro metabolism of chloroquine: identification of CYP2C8, CYP3A4, and CYP2D6 as the main isoforms catalyzing N-desethylchloroquine formation. Drug Metab Dispos. 2003; 31: 748-54. [ Links ]
20. Ilett KF, Ethell BT, Maggs JL, Davis TM, Batty KT, Burchell B, et al. Glucuronidation of dihydroartemisinin in vivo and by human liver microsomes and expressed UDP-glucuronosyltransferases. Drug Metab Dispos. 2002; 30: 1005-12. [ Links ]
21. Santiago C, Bandrés F, Gómez-Gallego F. Polimorfismos de citocromo p450: papel como marcador biológico. Med Trabajo 2002; 11: 130-40. [ Links ]
22. Schoch GA, Yano JK, Wester MR, Griffin KJ, Stout CD, Johnson EF. Structure of Human Microsomal Cytochrome P450 2C8. Evidence for a peripheral fatty acid binding site. J Biological Chemistry. 2004; 279: 9497-503. [ Links ]
23. Ferguson SS, Chen Y, Lecluyse EL, Negishi M, Goldstein JA. Human CYP2C8 is transcriptionally regulated by the nuclear receptors constitutive androstane receptor, pregnane X receptor, glucocorticoid receptor, and hepatic nuclear factor 4alpha. Mol Pharmacol. 2005; 68: 747-57. [ Links ]
24. KI-IMM. Karolinska Institutet (KI), Institutet för Miljömedicin (IMM). Human Cytochrome P450 (CYP) Allele Nomenclature Committee. CYP2C8 allele nomenclatura (sitio en Internet). (fecha de acceso: 13 diciembre 2005). Disponible en: http://www.imm.ki.se/CYPalleles/cyp2c8.htm [ Links ]
25. Dai D, Zeldin DC, Blaisdell JA, Chanas B, Coulter SJ, Ghanayem BI, et al. Polymorphisms in human CYP2C8 decrease metabolism of the anticancer drug paclitaxel and arachidonic acid. Pharmacogenetics. 2001; 11: 597-607. [ Links ]
26. Martínez C, García-Martín E, Blanco G, Gamito FJ, Ladero JM, Agúndez JA. The effect of the cytochrome P450 CYP2C8 polymorphism on the disposition of (R)-ibuprofen enantiomer in healthy subjects. Br J Clin Pharmacol. 2005; 59: 62-8. [ Links ]
27. Solus JF, Arietta BJ, Harris JR, Sexton DP, Steward JQ, McMunn C, et al. Genetic variation in eleven phase I drug metabolism genes in an ethnically diverse population. Pharmacogenomics. 2004; 5: 895-931. [ Links ]
28. Kalow W. Pensylvania State University College of Medicine. 1990 Bernard B. Brodie Lecture. Pharmacogenetics: past and future. Life Sci. 1990; 47: 1385-97. [ Links ]
29. Kalow W. Pharmacogenetics in biological perspective. Pharmacol Rev. 1997; 49: 369-79. [ Links ]
30. Wilkinson GR. Drug metabolism and variability among patients in drug response. N Engl J Med. 2005; 352: 2211-21. [ Links ]
31. Walsky RL, Obach RS. Validated assays for human cytochrome P450 activities. Drug Metab Dispos. 2004; 32: 647-60. [ Links ]
32. Kaneko A, Bergqvist Y, Takechi M, Kalkoa M, Kaneko O, Kobayakawa T, et al. Intrinsic efficacy of proguanil against falciparum and vivax malaria independent of the metabolite cycloguanil. J Infect Dis. 1999; 179: 974-9. [ Links ]
33. Cavaco I, Stromberg-Norklit J, Kaneko A, Msellem MI, Dahoma M, Ribeiro VL, et al. CYP2C8 polymorphism frequencies among malaria patients in Zanzibar. Eur J Clin Pharmacol. 2005; 61: 15-8. [ Links ]
34. Carmona-Fonseca J. La malaria en Colombia, Antioquia y las zonas de Urabá y Bajo Cauca: panorama para interpretar la falla terapéutica antimalárica. Parte 1. Iatreia. 2003; 16: 299-318. [ Links ]
35. Carmona-Fonseca J. La malaria en Colombia, Antioquia y las zonas de Urabá y Bajo Cauca: panorama para interpretar la falla terapéutica antimalárica. Parte 2. Iatreia. 2004; 17: 34-53. [ Links ]
36. Carmona-Fonseca J. Malaria, desnutrición y parasitosis intestinal en los niños colombianos: interrelaciones. Iatreia. 2004; 17: 354-9. [ Links ]
37. Blair-Trujillo S, Lacharme-Lora L, Carmona-Fonseca J. Resistance of Plamodium falciparum to antimalarial drugs in Zaragoza (Antioquia, Colombia), 1998. Mem Inst Oswaldo Cruz. (Rio de Janeiro) 2002; 97: 401-6. [ Links ]
38. Blair S, Lacharme LL, Carmona-Fonseca J, Tobón A. Resistencia de Plasmodium falciparum a tres fármacos antimaláricos en Turbo (Antioquia, Colombia), 1998. Rev Panam Salud Publica. 2001; 9: 23-9. [ Links ]
39. López YL, Arroyave A, Salazar A. Evaluación de la resistencia in vivo a los medicamentos antimaláricos. El Bagre, Antioquia, 1998. Rev Epidemiol Antioquia. 1999; 24: 181-94. [ Links ]
40. Blair S, Carmona-Fonseca J, Piñeros JG, Ríos A, Álvarez T, Álvarez G, et al. Therapeutic efficacy test in malaria falciparum in Antioquia, Colombia. Malaria J. 2006; 5: [ Links ]
41. Carmona-Fonseca J, Tobón A, Álvarez G, Blair S. El tratamiento amodiaquina-sulfadoxina-pirimetamina tiene eficacia del 98% para la malaria falciparum no complicada (Antioquia, Colombia; 2003). Iatreia. 2005; 18: 5-27. [ Links ]
42. Restrepo CM. Estado nutricional y crecimiento fisico. Medellín: Editorial Universidad de Antioquia; 2000. [ Links ]
43. Castro L, Nicholls RS. Deficiencia de hierro, vitamina A y prevalencia de parasitismo intestinal en la población infantil y anemia nutricional en mujeres de edad fértil, Colombia 1995-1996. Bogotá: Instituto Nacional de Salud; 1998. [ Links ]
44. Hombhanje FW, Hwaihwanje I, Tsukahara T, Saruwatari J, Nakagawa M, Osawa H, et al. The disposition of oral amodiaquine in Papua New Guinean children with falciparum malaria. Br J Clin Pharmacol. 2005; 59: 298-301. [ Links ]
45. Röwer S, Bienzle U, Weise A, Lambertz U, Forst T, Otchwemah RN, et al. Short communication: high prevalence of the cytochrome P450 2C8*2 mutation in Northern Ghana. Trop Med Int Health. 2005; 10: 1271-3. [ Links ]
46. Parikh S, Ouedraogo JB, Goldstein JA, Rosenthal PJ, Kroetz DL. Amodiaquine metabolism is impaired by common polymorphisms in CYP2C8: implications for malaria treatment in Africa. Clin Pharmacol Ther. 2007; 82: 197-203. [ Links ]
47. Gil J, Gil Berglund E. CYP2C8 and antimalaria drug efficacy. Pharmacogenomics. 2007; 8: 187-98. [ Links ]
48. Muthiah YD, Lee WL, Teh LK, Ong CE, Ismail R. Genetic polymorphism of CYP2C8 in three Malaysian ethnics: CYP2C8*2 and CYP2C8*3 are found in Malaysian Indians. J Clin Pharm Ther. 2005; 30: 487-90. [ Links ]
49. Jewell H, Maggs JL, Harrison AC, O'Neill PM, Ruscoe JE, Park BK. Role of hepatic metabolism in the bioactivation and detoxication of amodiaquine. Xenobiotica. 1995; 25: 199-217. [ Links ]
50. Murray M, Sefton RM, Croft KD, Butler AM. Differential regulation of endobiotic-oxidizing cytochromes P450 in vitamin A-deficient male rat liver. Br J Pharmacol. 2001; 134: 1487-97. [ Links ]
51. Pascoe GA, Sakai-Wong J, Soliven E, Correia MA. Regulation of intestinal cytochrome P-450 and heme by dietary nutrients. Critical role of selenium. Biochem Pharmacol. 1983; 32: 3027-35. [ Links ]