Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Colombia Médica
On-line version ISSN 1657-9534
Colomb. Med. vol.42 no.2 Cali Apr./June 2010
Revisión documental de los productos naturales legalmente autorizados para su mercadeo en Colombia
Hellen Astrid Guevara1, Pilar Ester Luengas, PhD2, Giovanny Garavito, PhD3
1. Estudiante Carrera de Farmacia, Departamento de Farmacia, Facultad de Ciencias, Universidad Nacional de Colombia, Bogotá, DC, Colombia. e-mail: haguevarah@unal.edu.co
2. Profesora Asistente, Departamento de Farmacia, Facultad de Ciencias, Universidad Nacional de Colombia, Bogotá, DC, Colombia. e-mail: peluengasc@unal.edu.co
3. Profesor Asociado, Departamento de Farmacia, Facultad de Ciencias, Universidad Nacional de Colombia, Bogotá, DC, Colombia. e-mail: ggaravitoc@unal.edu.co
Recibido para publicación febrero 19, 2009 Aceptado para publicación enero 12, 2010
RESUMEN
Introducción: El grupo de los productos naturales ha cobrado gran interés en los últimos años debido a la creencia popular que son eficaces y más seguros que los medicamentos de síntesis o por recientes tendencias en salud que buscan suplementar la alimentación.
Objetivo: Describir el grupo de los productos naturales desde el punto de vista de la autoridad sanitaria.
Metodología: Estudio observacional descriptivo de corte transversal a partir del universo de los Registros Sanitarios de Productos Naturales que presenta la base de datos del Instituto Nacional de Vigilancia de Medicamentos y Alimentos (Autoridad Sanitaria Colombiana).
Resultados: Aproximadamente la mitad de los productos naturales legalmente aceptados para su mercadeo son productos fitoterapéuticos y la otra mitad la componen los suplementos dietarios junto con los productos de uso específico. La especie vegetal con mayor número de autorizaciones de comercialización es la alcachofa (Cynara scolymus), seguida de caléndula (Calendula officinalis), valeriana (Valeriana officinalis), ajo (Allium sativum) y ginkgo (Ginkgo biloba). Hay un predominio del empleo de especies foráneas en los productos fitoterapéuticos comercializados. Se propone una clasificación novedosa del órgano de la planta o droga empleado en la producción con la cual es evidente el mayor uso de las hojas respecto a cualquier otro órgano. Cápsulas, tabletas y soluciones son las formas farmacéuticas predominantes.
Conclusiones: El grupo de productos naturales ha presentado una evolución creciente en registro durante los últimos años; en el subgrupo de los productos fitoterapéuticos predomina la fabricación nacional aun cuando es mínimo el empleo de especies nativas, mientras que para los suplementos dietarios y productos de uso específico es mayor la importación, lo que evidencia la necesidad de una política nacional que articule la generación de normatividad con las necesidades colombianas y logre estimular la valorización y uso sostenible de nuestros recursos naturales con un retorno adecuado a las comunidades que se refleje en una mayor producción local y el empleo de recursos en los que hay ventajas competitivas.
Palabras clave: Productos naturales; Productos fitoterapéuticos; Suplementos dietarios; Registro sanitario.
Documental revision of the natural products authorized for marketing in Colombia
SUMMARY
Introduction: The group of natural products has gained much interest in recent years because of the popular belief that they are effective and more secure than synthetic medications, or because of recent health tendencies seeking to supplement nutrition.
Objective: To describe the group of natural products from a sanitary authority point of view.
Methodology: Observational, descriptive, cross-sectional study from the universe of Drug approvals of Natural Products presented by a database from the Instituto Nacional de Vigilancia de Medicamentos y Alimentos (Colombian Sanitary Authority).
Results: Nearly half of the natural products legally accepted for marketing are herbal medicines and the other half are dietary supplements, along with specific-use products. The vegetable species with the greatest number of commercialization authorizations is artichoke Cynara scolymus (alcachofa), followed by calendula (Calendula officinalis), valerian (Valeriana officinalis), garlic (Allium sativum), and ginkgo (Ginkgo biloba). Foreign species predominate in the fabrication of commercialized herbal medicines. A novel classification is proposed of the plant organ or drug employed in the production with which it is evident that leaves are used more with respect to any other plant organ. Capsules, tablets, and solutions are the predominant pharmaceutical forms.
Conclusions: The group of natural products has demonstrated growing evolution in drug approvals in these last years; for the herbal medicines subgroup, national production predominates even though there is a minimum use of native species; while for dietary supplements and specific use products subgroups importation is predominant, evidencing the necessity for national policies to articulate the norms with Colombian needs and to stimulate the valorisation and sustainable use of our natural resources with adequate profit for the communities that will be reflected in greater national production using resources in which Colombia has competitive advantages.
Keywords: Natural products; Phytotherapeutic products; Dietary supplements; Drug approval.
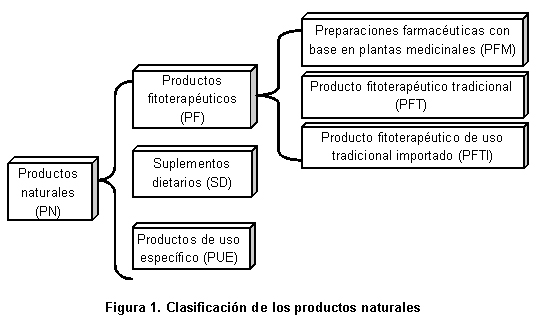
El Instituto Nacional de Vigilancia de Medicamentos y Alimentos (INVIMA) se creó mediante el Artículo 245 de la Ley 100 de 19931 y se apoya en la Comisión Revisora (CR) como su máximo órgano consultor; ésta es la encargada de estudiar y conceptuar acerca de los aspectos científicos y tecnológicos de los medicamentos y demás productos que puedan tener impacto en la salud individual y colectiva, de acuerdo con este Artículo 245. La CR actúa y cumple sus funciones a través de seis salas especializadas; una de ellas es la Sala Especializada de Productos Naturales, que conceptúa respecto a productos fitoterapéuticos (PF), suplementos dietarios (SD) y productos de uso específico (PUE); éstos son el objeto de estudio del presente trabajo (Figura 1). Colombia es uno de los países con mayor biodiversidad del mundo gracias, entre otros factores, a su gran variedad de ecosistemas; a pesar del potencial que posee el país en materia de plantas medicinales, tan sólo unas pocas especies nativas se informan en el listado de «Plantas medicinales aceptadas con fines terapéuticos» de las Normas Farmacológicas del INVIMA2 (listado de referencia para las preparaciones farmacéuticas con base en plantas medicinales) o en el Vademécum Colombiano de Plantas Medicinales3 (documento de referencia para los productos fitoterapéuticos tradicionales) lo que no refleja esta condición favorable que a priori tendría el país en este tipo de mercado.
El tamaño de mercado de los productos naturales (PN) es difícil de cuantificar dada la gran variedad de productos que lo componen, pero sobre todo porque es un sector que se caracteriza por la elevada informalidad (presencia de pequeños locales que fabrican este tipo de productos de una manera irregular, sin autorización de la autoridad sanitaria y los sacan al mercado sin Registro Sanitario)4. La principal causa de la elevada presencia de empresas informales está en el hecho que muchos fabricantes de PN optan por no acogerse a la normatividad, y en cambio elaboran y comercializan los productos de forma fraudulenta, pues aprovechan la baja capacidad del INVIMA para ejercer su función de vigilancia y control.
Hitos en el desarrollo de la legislación sanitaria de PN. Aun cuando escapa al alcance de este trabajo una revisión minuciosa de la legislación sanitaria colombiana, como base de la discusión, se presentan algunos aspectos relevantes en su devenir.
Productos fitoterapéuticos. La creación del INVIMA a partir de la Ley 100 de 19931 y la posterior expedición del Decreto 1290 de 19945 (Decreto-Ley por el cual se precisan las funciones del INVIMA y se establece su organización básica), unido a la expedición del Decreto 677 de 19956 (por el cual se reglamenta el Régimen de Registros y Licencias, el Control de Calidad y el Régimen de Vigilancia Sanitaria de Medicamentos y otros productos farmacéuticos) transformaron radicalmente el régimen de Registro Sanitario de productos farmacéuticos en Colombia y generaron el marco legal necesario para que este proceso comprometa una importante evaluación técnico-científica, más allá de la tradicional evaluación legal. El Decreto 677 en su Capítulo II abordó los PN como «Preparaciones farmacéuticas a base de recursos naturales» y aunque su nombre no lo dejaba explícito, a partir del análisis de las definiciones y de la reglamentación para solicitar el registro sanitario de estos productos, se puede inferir que se reconocían por primera vez como medicamentos. Posteriormente, diversas regulaciones han tratado sobre los PN, entre ellas se destacan el Decreto 377 de 19987 que, entre otros aspectos, amplió la regulación sobre la producción, envase, expendio, importación, exportación y comercialización de los PN, en ese momento llamados «productos farmacéuticos con base en recursos naturales» y, conformó un Comité Asesor del Ministerio de Salud, encargado de formular recomendaciones sobre la inclusión o exclusión de recursos naturales en la Lista Básica Aceptada (esta tarea sería luego asumida por la Comisión Revisora de Medicamentos encargada del actual listado de «Plantas medicinales aceptadas con fines terapéuticos», de las Normas Farmacológicas). El Decreto 377 de 1998 enfatiza que las preparaciones farmacéuticas con base en recursos naturales se catalogan como medicamentos y crea dentro de los alimentos la categoría de «alimentos con base en recursos naturales presentados en formas farmacéuticas», primera aproximación a la reglamentación de suplementos nutricionales. A finales de ese mismo año, la Resolución 31318 adopta el manual de buenas prácticas de manufactura de productos farmacéuticos con base en recursos naturales; en varias ocasiones, mediante reglamentaciones posteriores se modificaron los plazos para el cumplimiento de este requisito para el otorgamiento del RS.
El año 2004 marcó una etapa decisiva en el desarrollo de la legislación específica de PN en el país. A mediados de ese año entró en vigor el Decreto 22669 que reglamentó el régimen de registro sanitario, vigilancia y publicidad de los en ese momento llamados «productos fitoterapéuticos». Esta norma delinea inicialmente la actual clasificación de este grupo de PN al separar las preparaciones farmacéuticas con base en plantas medicinales (PFM) de los productos fitoterapéuticos y dar origen a los productos fitoterapéuticos tradicionales (PFT). Constituye un importante esfuerzo del legislador para, en consonancia con políticas sobre evaluación y conservación de la medicina tradicional de la Organización Mundial de la Salud10, ofrecer un marco regulador que favorezca la conservación de ese conocimiento en peligro y su uso en el país. Bajo esos preceptos los PFT deberían ser de fabricación nacional y elaborados a partir de material de plantas medicinales o sus asociaciones, cultivadas en el país. Toda vez que estos medicamentos estarían destinados al alivio de manifestaciones sintomáticas de una enfermedad, su eficacia y seguridad se podían justificar a partir de la experiencia generada por su uso a lo largo del tiempo mediante «pruebas documentales que demuestran que las sustancias activas presentes en las plantas medicinales se han utilizado durante tres o más generaciones para un uso medicinal o relacionado con la salud. En los casos en que el uso sea registrado como tradición oral y no escrita, las pruebas se obtendrán recurriendo a un profesional competente o a grupos indígenas o comunidades afrocolombianas que mantengan dicha historia». Adicionalmente, esta norma dio origen al Vademécum Colombiano de Plantas Medicinales, documento de referencia obligatoria para expedir el registro sanitario de los PFT.
El final del año 2004 estuvo marcado por la aparición del Decreto 355311 que modificó la norma anterior de ese año (Decreto 2266) y, entre otras disposiciones, abrió la puerta a un nuevo grupo de productos, los «productos fitoterapéuticos de uso tradicional importados», con lo cual se completa la clasificación de los productos fitoterapéuticos (Figura 1). En este mismo año se puso en ejercicio la Resolución 432012 que reglamentó la publicidad de los medicamentos y productos fitoterapéuticos de venta sin prescripción facultativa o de venta libre.
Luego, en julio de 2008, mediante la Resolución 283413 del Ministerio de la Protección Social se adoptó el Vademécum Colombiano de Plantas Medicinales y se dejó su actualización en manos de la Sala Especializada de Productos Naturales de la CR.
La última década (1998-2008) ha marcado sin lugar a dudas un hito en el devenir de la regulación de los PN en Colombia, con aciertos y medidas de difícil comprensión, cuyo impacto apenas se comienza a ver en el mercado de los PN.
Suplementos dietarios y productos de uso específico. El Decreto 3636 del 200514 definió los productos de uso específico como: «Es aquel producto que sin satisfacer o reunir los requisitos establecidos para ser alimento convencional, medicamento, producto fitoterapéutico o preparación farmacéutica a base de recursos naturales o bebidas alcohólicas, aporta elementos o compuestos que pueden ser coadyuvantes al mantenimiento de los procesos metabólicos del organismo y que contiene ingredientes como vitaminas, proteínas, fibra, minerales, productos naturales, carbohidratos, aminoácidos, ácidos grasos, plantas, hierbas o algas, entre otros. Su finalidad es complementar la ingesta de estos nutrientes a partir de la alimentación diaria» y dar marco legal a la comercialización de un grupo diverso de productos que han tomado auge en el mundo en los últimos años, denominados de diversas maneras: nutracéuticos, suplementos dietarios, complementos alimenticios, etc. La aparición de este tipo de productos implica un enorme desafío para las autoridades sanitarias a nivel mundial, desafío que incluso hoy en día no se supera por completo como lo evidencian las distintas posiciones respecto a su vigilancia y control, que van desde el mínimo nivel de exigencia, al asumir su seguridad derivada que en la mayoría de los casos están compuestos por sustancias nutricionales y deja en manos del consumidor la decisión y responsabilidad de su empleo, hasta la implementación de mecanismos de control estrictos representativos de una etapa intermedia entre los alimentos y los medicamentos donde la autoridad sanitaria asume una mayor responsabilidad y por ende es más exigente respecto de sus condiciones de comercialización. El acaecer histórico y las presiones del mercado han llevado a que estos productos, en algunos casos, incluyan sustancias con demostrada actividad farmacológica o plantas medicinales.
El 18 de septiembre de 2006 entró en vigencia el Decreto 324915 que establece y define el grupo específico de los suplementos dietarios SD, y además complementa la actual clasificación de los PN (Figura 1). Entre otros aspectos esta norma, en el Anexo 1, establece el nivel de ingesta máximo tolerable (UL) para vitaminas, minerales y oligoelementos, así como la necesidad de un listado de declaraciones de propiedades aceptadas en Colombia; listado que debería desarrollar el Ministerio de la Protección Social conjuntamente con el INVIMA. Un aspecto de gran relevancia establecido en el Decreto 3249 tiene que ver con las leyendas obligatorias para las etiquetas de este tipo de productos; siguiendo el ejemplo de otras autoridades sanitarias se estableció la siguiente leyenda: «Este producto no sirve para el diagnóstico, tratamiento, cura o prevención de alguna enfermedad y no suple una alimentación equilibrada», posición prudente y acertada del legislador frente a un grupo especial de productos cuyas características pueden llevar a que se genere desinformación en el consumidor.
A finales de 2006, la Dirección del INVIMA generó la Circular Externa DG 100-00352-0616 que aclaró aspectos de la transición al Decreto 3249 por parte de los suplementos dietarios importados.
Mediante la Resolución N° 3096 el 5 de septiembre de 200717 el Ministerio de la Protección Social reglamentó las condiciones y requisitos de las declaraciones que se pueden hacer en las etiquetas de los SD, y estableció las siguientes clases: declaración de nutrientes, declaración de propiedades nutricionales y declaración de propiedades en salud. La norma, en su espíritu, busca dar claridad en este tema; sin embargo, es compleja en su interpretación y en algunos aspectos contradictoria. A finales de ese mismo año aparece el Decreto 485718 para establecer que los productos que se ajusten a la definición de SD y hayan sido registrados como alimentos o medicamentos, deberían ajustar su registro dentro de un plazo establecido. Operativamente esta norma lleva a que productos registrados inicialmente como alimentos con un bajo nivel de exigencia (registro automático) sean sometidos a una nueva evaluación bajo criterios más estrictos que pueden llevar a que no logren cumplir con los requisitos para continuar en el mercado, aspecto que sin lugar a dudas señala un mercado más seguro pero genera importantes inconvenientes a la autoridad sanitaria en su ejecución.
El año 2008 estuvo marcado por la aparición en el mes de octubre del Decreto 386319 que ajusta algunos aspectos en cuanto a las características de los SD y a las condiciones de su fabricación; de esta norma se destaca el cambio en la leyenda obligatoria comentada antes por la siguiente: «Este producto es un suplemento dietario, no es un medicamento y no suple una alimentación equilibrada», en un giro infortunado por parte del legislador que sin lugar a dudas llevará a generar desinformación en el consumidor y favorecerá estrategias de mercadeo no ajustadas a la moderación científica en este grupo especial de productos, pues con dificultad se puede considerar que el consumidor final conozca la definición legal de medicamento («Medicamento es aquél preparado farmacéutico obtenido a partir de principios activos, con o sin sustancias auxiliares, presentado bajo forma farmacéutica, que se utiliza para la prevención, alivio, diagnóstico, tratamiento, curación o rehabilitación de la enfermedad. Los envases, rótulos, etiquetas y empaques hacen parte integral del medicamento, por cuanto éstos garantizan su calidad, estabilidad y uso adecuado»)6.
Tomando como base las diferentes categorías de productos establecidas en los últimos años por la reglamentación de RS, el presente trabajo hace un estudio observacional descriptivo de corte transversal de los PN legalmente autorizados para su mercadeo en Colombia, para lo cual se generó una base de datos donde se colectó la información proveniente del universo de Registros Sanitarios de Productos Naturales en Colombia; el análisis de la información tuvo en cuenta además el devenir histórico de la legislación que corresponde a estos productos.
MÉTODOS
El INVIMA posee una base de datos de libre acceso a través de Internet en la que se presentan los PN junto con los demás productos de su competencia, y se convierte en una herramienta que permite la búsqueda especializada y el desarrollo de estudios desde la perspectiva de la Autoridad Sanitaria. Se hizo una búsqueda exhaustiva en la base de datos www.invima.gov.co; servicio de consultas públicas-información de registros sanitarios, entre los meses de febrero a mayo de 2009. Debido a la complejidad de este grupo de productos, el estudio los dividió para su análisis en dos grandes agrupaciones: por un lado los productos fitoterapéuticos y por otro los suplementos dietarios junto con los productos de uso específico (Figura 1).
Estrategia de búsqueda. La base de datos de INVIMA se indagó con los siguientes descriptores: Para el campo «grupo» se empleó «Naturales», «Suplemento dietario», «Medicamentos» y «Alimentos». Para el campo «producto» se emplearon los prefijos PFM (Preparación Farmacéutica con Base en Plantas Medicinales), PFT (Producto Fitoterapéutico Tradicional)9, PFTI (Producto Fitoterapéutico de uso Tradicional Importado)11, SD (Suplemento Dietario)15 y PUE (Producto de Uso Específico)14. Luego, para los productos fitoterapéuticos, se adelantó una nueva búsqueda y se tuvieron como descriptores cada una de las especies vegetales que aparecen en el listado de «Plantas medicinales aceptadas con fines terapéuticos»2 y se interrogó la base de datos: «por nombre del producto» y «por principio activo».
Criterios de inclusión. Los registros sanitarios de PN informados en la base de datos del INVIMA.
Criterios de exclusión. Los registros sanitarios que presentaron reseña incompleta en el informe de la base de datos de INVIMA y registros sanitarios para los que la base de datos comunicó: «Los datos de interés del producto no están disponibles, comuníquese con la Subdirección de Registros Sanitarios para obtenerlos» o «Los datos del producto no están disponibles, comuníquese con la Subdirección de Registros Sanitarios para obtener la información».
Parámetros estudiados. La base de datos generada implica los siguientes parámetros: tipo de producto (Figura 1), número del registro sanitario, año de registro, modalidad de registro sanitario, estado del registro sanitario, especie vegetal (sola o en asociación con otras plantas), parte usada de la planta (droga) y forma farmacéutica.
RESULTADOS Y DISCUSIÓN
Del universo de registros sanitarios revisados en la base de datos del INVIMA (1535 RS); 85% (1311 RS) se tuvieron en cuenta para el estudio después de aplicar los criterios de exclusión.
El grupo de los PN legalmente autorizados para su comercialización en Colombia está compuesto principalmente por los grupos productos fitoterapéuticos con 47% (610 RS) y suplementos dietarios con 52% (679 RS) que presentan participación muy similar en cuanto al número de registros sanitarios; el grupo de PUE con 2% (22 RS) es de lejos minoritario. Es de resaltar que los SD se desprendieron de los PUE en 2006; estos dos grupos combinados representan algo más de la mitad de los PN, en tanto que la otra mitad la componen los productos fitoterapéuticos.
Productos fitoterapéuticos
Clasificación. Este grupo de productos está compuesto principalmente por preparaciones farmacéuticas con base en plantas medicinales (PFM) en 55% (334 RS); solamente se encontraron dos RS de producto fito-terapéutico tradicional (PFT), uno para Achyrocline bogotensis (vira vira) y el otro para Salix humboldtiana (sauce), correspondientes a 0.3%. La búsqueda no informó ningún RS correspondiente a producto fitoterapéutico de uso tradicional importado (PFTI). Teniendo en cuenta que para el 45% de los RS la base de datos de INVIMA no comunica el tipo de producto, no es posible establecer una categorización confiable en este sentido.
Especies con mayor prevalencia. El estudio muestra que la especie vegetal con mayor número de autorizaciones de comercialización es la alcachofa Cynara scolymus (52 RS), seguida de caléndula Calendula officinalis (51 RS), valeriana Valeriana officinalis (33 RS), ajo Allium sativum (32 RS), ginkgo Ginkgo biloba (29 RS), cáscara sagrada Rhamnus prushiana (24 RS), boldo Peumus boldus (23 RS), psyllium Plantago psyllium (21 RS), castaño de indias Aesculus hippocastanum (20 RS) y diente de león Taraxacum officinale (20 RS), corresponden a las diez especies más empleadas en productos fitoterapéuticos legalmente autorizados para su mercadeo; estas especies constituyen 50% de los registros sanitarios de productos fitoterapéuticos otorgados en Colombia.
De las 10 especies más empleadas para comercialización nueve son foráneas y tan sólo una es considerada naturalizada (diente de león). En general se encontró que de 76 especies vegetales halladas en este estudio sólo 24% (18 especies) son nativas, en contraposición a 57% (43 especies) foráneas y 14% (11 especies) naturalizadas; el restante 5% corresponde a algas marinas (2 RS), levaduras cosmo-politas (1 RS) y polen (1 RS) que no se pueden considerar un ejemplar botánico único20-22.
Diversos autores reportan el alto potencial de Colombia en plantas medicinales y aromáticas nativas, estimadas en 600023, que reflejan nuestra megadiversidad; asimismo se considera que el presente siglo marcará a nivel mundial el retorno a los productos naturales, eso sí tras una validación de su empleo bajo los parámetros de seguridad y eficacia de la medicina occidental y empleando materia prima que cumpla las exigencias de calidad de la industria farmacéutica. Es necesaria una política nacional que permita aprovechar esta potencialidad y evitar que, como con otros recursos naturales, el país se convierta en exportador de materia prima sin valor agregado y a bajos precios e importador de material procesado (extractos estandarizados) o producto terminado a altos costos.
La Figura 2 resume la distribución porcentual de los RS para las especies que se informan en ellos. Su análisis permite concluir que dos especies, alcachofa y caléndula, tienen cada una más de 8% de los RS (más de 50 RS), tres especies (valeriana, ajo y gingko) aparecen entre 4% y 6% de los registros (29-33 RS), diez especies entre 2% y 4% (13-24 RS) y las 61 restantes figuran con menos de 2% de los registros, es decir en menos de 12 RS.>
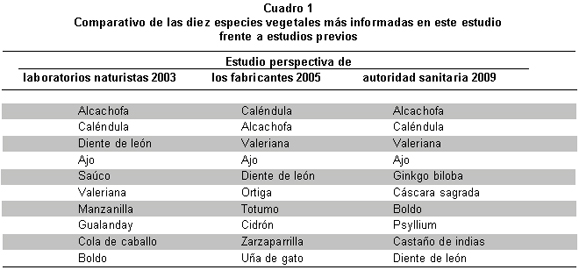
Los anteriores resultados coinciden con lo reportado anteriormente (Cuadro 1): en el año 2003 el Instituto Alexander von Humboldt y el Ministerio de Ambiente Vivienda y Desarrollo Territorial (MAVDT), contactaron 90 laboratorios del sector naturista, de los cuales respondieron la encuesta 11; este estudio24 informó a la alcachofa como la especie más utilizada. En 2005 el Instituto Alexander von Humboldt, el (MAVDT) y la Federación Naturista Colombiana (FENAT) dedujeron, a partir de la encuesta a 11 laboratorios fabricantes de productos fitoterapéuticos, que la especie con mayor volumen de comercialización en el país era la caléndula, seguida de la alcachofa y la valeriana4.
Los tres estudios coinciden en cuanto a las dos especies más reportadas, el presente estudio concuerda con el de 2005 en la tercera especie y con los dos estudios en el cuarto lugar; a partir del quinto lugar los tres trabajos muestran resultados poco coincidentes (Cuadro 1); se debe tener en cuenta que los dos estudios previos escrutan el mercado de productos naturales desde la perspectiva de la industria, en tanto que el trabajo actual se desarrolla desde la perspectiva de la autoridad sanitaria, INVIMA. Los estudios anteriores mostraron algunas limitaciones debido al bajo tamaño de las muestras mientras que el estudio que aquí se ofrece escrutó el universo de los productos legalmente autorizados para su mercadeo en el país.
Número de RS por año. Como el número de RS de productos fitoterapéuticos constituye un indicador indirecto del crecimiento de su mercado, se analizó el crecimiento en el número de registros desde el año 1999 hasta el año 2009. Para establecer el año de radicación del RS se contaron diez años atrás desde la fecha de vencimiento de cada registro sanitario estudiado.
A partir del año 1999 (61 RS) y hasta el año 2001 el registro de Productos Fitorerapéuticos descendió marcadamente, con reducciones del 42% y 44% para los años 2000 (33 RS) y 2001 (19 RS) (en relación con el año inmediatamente anterior). En 2002 se encuentra un pico en la cantidad de productos registrados (95 RS, aumento del 400%) manteniendo luego un descenso poco marcado hasta el año 2004 cuando descendió en 28% (2003, 88 RS y 2004, 63 RS), a partir de ese momento y hasta el año 2008 el registro de estos productos no ha presentado grandes variaciones manteniéndose entre 48 y 70 registros por año (2005, 70 RS; 2006, 48 RS; 2007, 50 RS; y 2008, 54 RS), al mes de mayo de 2009 se detectaron 16 RS. Estos resultados no reflejan éxito en la intención del legislador en 2004 al dar origen a los «Productos fitoterapéuticos tradicionales» (no se presentó el aumento esperado en el registro), resalta que el presente estudio sólo pudo encontrar dos productos de este grupo, aspecto que lleva a revaluar el impacto de estas normas y deja ver la urgente necesidad de políticas nacionales que logren estimular el desarrollo y puesta en el mercado de estos productos y permitan preservar y utilizar, de manera sostenible y con un adecuado retorno a las comunidades poseedoras, el conocimiento en medicina tradicional y popular del país.
La dinámica de registro de estos productos en la última década refleja la tendencia del mercado hacia su empleo, debido a la creencia del consumidor que tienen mejores beneficios que las sustancias de síntesis y menores reacciones adversas, creencia que en todos los casos no se sustenta científicamente y en cambio puede llevar al error de suponer que no se necesitan los estudios de eficacia, seguridad y vigilancia post-mercadeo de los PN.
Modalidades y vigencia de los RS. La modalidad del RS que predomina para los Productos Fitoterapéuticos es «fabricar y vender» seguida de lejos por «importar y vender».
Se evaluó la fabricación nacional de estos productos frente a su importación; para ello se tuvieron en cuenta como productos nacionales aquellos con registros bajo las modalidades «Fabricar y Vender» (511 RS) y «Fabricar y Exportar» (3 RS) y como productos importados aquellos con RS bajo las modalidades «Importar y Vender» (69 RS) e «Importar, Envasar y Vender» (27 RS). Resalta que para el grupo de los productos fitoterapéuticos es mayor la fabricación nacional (84% de los registros) que la importación (16% de los registros), esto desde el punto de vista del número de RS.
En Colombia, un RS tiene una vigencia de 10 años desde la fecha de expedición6,9. A partir de esta información se evaluó el estado de los RS, y se les clasificó como vigente, vencido (si no inicia su trámite de renovación tres meses antes de su fecha de vencimiento), vigente embargado (se refiere a que todo RS es un bien o valor personal que en cualquier momento se puede embargar) y en trámite de renovación. A la fecha de corte de este estudio (mayo de 2009), 92% de los RS de productos fitoterapéuticos (559 RS) se encuentran vigentes, 4% (24 RS) se encuentran vencidos, 4% (25 RS) vigentes-embargados y 0.3% (2 RS) en trámite de renovación.
Tipo de ingrediente activo y forma farmacéutica. La composición de la formulación de los productos fitoterapéuticos, se evaluó el uso de una sola es-pecie frente al empleo de asociaciones, y se vio que un gran porcentaje (89%) presenta una sola planta, mientras que muy pocos (11%) muestran asociaciones de plantas en un producto específico.
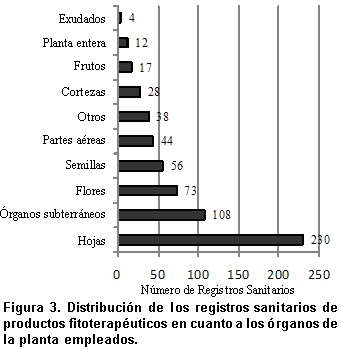
Si se tiene en cuenta que el órgano de la planta empleado en la fabricación de productos fitoterapéuticos presenta gran diversidad, debido en parte a múltiples denominaciones de las porciones de la planta (Ej. frutos, pulpa) y al empleo de varias combinaciones de partes de las especies vegetales (Ej. hojas y flores, hojas, tallos y frutos), el presente estudio propone una clasificación novedosa que ilustra en la Figura 3.
El órgano más usado son las hojas con 38% de los RS, seguidas de los órganos subterráneos (18%) que incluyen bulbos, rizomas y raíces de los cuales los que más aportan a esa cantidad son rizomas y raíces mientras que los bulbos tienen un porcentaje más bajo (que corresponde específicamente a la especie vegetal ajo); en segundo lugar se encuentran las flores (12%), seguidas de las semillas (9%). La única especie para la que aparece como parte utilizada las semillas es Plantago spp. (Psyllium) y en los RS aparece el uso de su cáscara (o cascarilla), entendida como la parte externa de la semilla. Con menos participación en los productos fitoterapéuticos están las drogas constituidas por partes aéreas (7%), categoría que incluyó hojas y flores, además de las sumidades floridas; bajo la categoría «otros», con 6% de los RS, se agrupan las drogas que no corresponden a órganos de una planta, como polvo, alga entera y polen; las cortezas (5%) incluyeron, entre otras, a las astillas de canela; posteriormente se tiene los frutos (3%) dentro de los cuales se consideraron los registros de «pulpa»; en orden decreciente sigue la categoría «planta entera» (2%) y en ella se consideraron «hojas y raíces» y «raíces y frutos»; por último, con 1% aparecen los exudados.
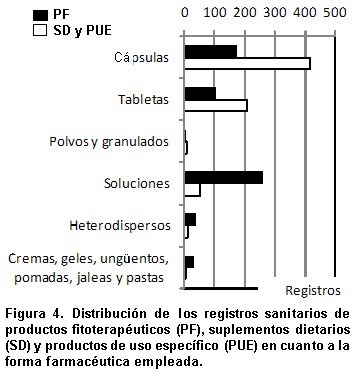
La forma farmacéutica empleada en la elaboración de productos fitoterapéuticos, varía de manera importante, razón por la cual para este estudio se agruparon según las recomendaciones de las Normas Técnicas de Calidad del INVIMA en conjunto con el Ministerio de Salud (2002)25; la clasificación inicial en términos de su estado físico muestra un predominio de las formas líquidas (49%) seguidas de cerca por las formas sólidas (46%) y un pequeño grupo de formas semisólidas (5%). Una descripción más detallada permite evidenciar que las formas sólidas incluyen: tabletas, cápsulas, polvos y granulados; las formas líquidas: soluciones y heterodispersos (emulsiones y suspensiones) y finalmente entre los semisólidos están cremas, geles, pastas, ungüentos y jaleas (Figura 4).
Dentro de las formas farmacéuticas líquidas predominan las soluciones (42%), en tanto que las heterodispersas son tan sólo 7%; en relación con las formas farmacéuticas sólidas las más empleadas son las cápsulas (29%), las tabletas representan 17% y los polvos y granulados tan sólo 1%; finalmente dentro de las formas farmacéuticas semisólidas (5%) las más usadas son las cremas tópicas.
El predominio de cápsulas, sobre todo de gelatina dura, (176 RS) y la presencia de formas farmacéuticas semisólidas en las que tradicionalmente se utiliza material vegetal en polvo, genera inquietud si se tiene en cuenta que las autoridades sanitarias a nivel nacional e internacional buscan evitar el empleo de polvos de drogas en la preparación de productos fitoterapéuticos, y dar prioridad el empleo de extractos y/o tinturas, pues hay evidencia científica en el sentido que al ingerir las drogas en polvo, la absorción de sus principios activos es limitada frente a cuando se suministran los extractos elaborados26.
Suplementos dietarios y productos de uso específico. Estas dos agrupaciones en conjunto representan 54% de los PN, entre ellas es marcado el predominio de los SD con 679 registros frente a tan sólo 22 registros de PUE. Esta diferencia tan marcada se justifica porque la categoría PUE sólo tuvo vigencia de algunos meses, pues la reglamentación que le dio vigencia (Decreto 3636 del 11 de octubre de 2005) fue derogada por la creación de los SD (Decreto 3249 del 18 de septiembre de 2006). Además, cabe aclarar que para el presente estudio se incluyeron sólo los RS que presentaban las denominaciones SD y PUE en su número de registro sanitario; para suplementos dietarios la base de datos del INVIMA ofrece adicionalmente RS de tipo RSAD (34 registros), RSAE (5 registros), RSAR (1 registro) y RSAK (2 registros); éstos se excluyeron del estudio por ajustarse más a la definición de alimentos, que a la de SD propiamente dichos.
El registro de productos tipo SD y PUE presenta del año 2006 (46 RS) al 2007 (350 RS) un crecimiento superior al 700%; para analizar este crecimiento se debe tener en cuenta, como se comentó antes, la evolución de la legislación sanitaria, si bien desde 2005 se definió el grupo de los PUE, el establecimiento de los SD se dio en 2006 y es a partir de ese momento que se presenta un marcado incremento en el número de RS de estos productos, el cual es sostenido hasta la fecha. De los 46 registros que se presentaban para el año 2006, 54% corresponden a SD y 46% a PUE. Para los años 2007 a 2009 (2008 253 RS, 2009 52 RS a mes de mayo), el 100% de los RS corresponden a SD.
La dinámica de crecimiento abrupto en el registro de este tipo de productos en años recientes es también reflejo de la tendencia mundial por el uso de los llamados nutracéuticos, suplementos dietarios, complementos alimenticios, etc., que en Colombia se han incluido en la legislación sanitaria inicialmente como PUE y luego como SD.
La modalidad del RS que predomina para este grupo es Importar y vender, SD 66% (448 RS) y PUE 77% (17 RS), que conjuntamente con Importar, empacar y vender SD 13% (90 RS) y PUE 9% (2 RS) evidencian el marcado predominio, en cuanto al registro, de la importación de estos productos frente a la producción nacional que representa tan sólo 21% para los SD (141 RS) y 14% para los PUE (3 RS) (modalidad Fabricar y vender).
El presente estudio encontró registros con las modalidades: importar, acondicionar y vender (2 RS), importar, envasar y vender (2 RS) y envasar y vender (1 RS); estas modalidades no se incluyen en la legislación específica vigente para este tipo de productos, por lo que posiblemente se trate de inconsistencias originadas de la inclusión de estas modalidades en el Decreto 677 de 1995 y reglamentaciones posteriores (actualmente no vigentes) y que en realidad correspondan a la modalidad importar, empacar y vender que contempla operaciones como envase y empaque de producto a granel y empaque de producto antes envasado (acondicionamiento)19. Para el análisis estos RS se incluyeron en importar, empacar y vender. En cuanto a la vigencia del RS de SD y PUE la totalidad de los registros estudiados estaban vigentes.
Las formas farmacéuticas sólidas predominan en este grupo de productos (90%) e incluyen: cápsulas duras, cápsulas blandas, tabletas, tabletas masticables, tabletas recubiertas, tabletas efervescentes, polvos y granulados. Las formas farmacéuticas líquidas (10%) incluyen: soluciones orales, jarabes, suspensiones orales, emulsiones orales y aerosoles, en tanto que las cremas, geles, ungüentos, jaleas y pastas representan menos de 1% con dos RS (Figura 4).
CONCLUSIONES
La estrategia de búsqueda detectó inconsistencias en la base de datos del INVIMA las cuales llevaron a que únicamente 85% del universo de registros se incluyera en este estudio.
Aproximadamente la mitad de los PN legalmente aceptados para su mercadeo en Colombia son productos fitoterapéuticos, los restantes corresponden a los suplementos dietarios junto con los productos de uso específico.
La especie vegetal con mayor número de autorizaciones de comercialización es la alcachofa, seguida de caléndula, valeriana, ajo, ginkgo, cáscara sagrada, boldo, psyllium, castaño de indias y diente de león; estas especies constituyen 50% de los RS de productos fitoterapéuticos otorgados en Colombia.
Hay un predominio del empleo de especies foráneas en la fabricación de productos fitoterapéuticos, resaltando la necesidad de investigación y desarrollo de productos naturales con especies nativas donde el país tiene una ventaja competitiva y con lo cual se aportaría a la valoración de la biodiversidad.
Los resultados del presente estudio, desde la perspectiva de la autoridad sanitaria, son comparables con otros estudios realizados desde la perspectiva de la industria fabricante.
Se encontraron variaciones en el crecimiento de las autorizaciones de mercadeo coincidentes con la aparición de normas sanitarias. Sin embargo, no se evidencia éxito en el establecimiento de la normatividad para los «productos fitoterapéuticos tradicionales», aspecto que refuerza la urgente necesidad de políticas de país, que logren estimular el desarrollo y puesta en el mercado de estos productos y permitan preservar y utilizar de manera sostenible y con un adecuado retorno a las comunidades poseedoras, el conocimiento en medicina tradicional y popular de Colombia.
En la formulación de productos fitoterapéuticos es minoritario el empleo de combinaciones de plantas frente al uso de una sola especie vegetal.
Se propone una clasificación del órgano/droga/parte de la planta empleado en la elaboración de productos fitoterapéuticos, que será de utilidad para la autoridad sanitaria a fin de organizar la diversidad existente al respecto. Es evidente el mayor uso de las hojas respecto a cualquier otro órgano de las plantas.
El predominio de cápsulas y la presencia de formas farmacéuticas semisólidas en las que tradicionalmente se utiliza material vegetal en polvo hacen necesaria una reevaluación de su conveniencia, si se tiene en cuenta que al ingerir drogas en polvo la absorción de sus principios activos es limitada frente al empleo de extractos elaborados.
En el subgrupo de los productos fitoterapéuticos predomina la fabricación nacional mientras que para los suplementos dietarios y productos de uso específico es mayor la importación.
Conflicto de intereses. Los autores declaran que no hay conflicto de intereses en el presente manuscrito.
AGRADECIMIENTOS
Los autores expresan sus agradecimientos a Norberto Camacho por la ayuda técnica recibida y a Jorge Díaz (Profesor Departamento de Farmacia Universidad Nacional de Colombia) por la lectura crítica de este manuscrito. El presente trabajo se adelantó dentro de las actividades de los grupos de investigación: Farmacología de la Medicina Tradicional y Popular (FaMeTra) y Principios Bioactivos en Plantas Medicinales, del Departamento de Farmacia, Facultad de Ciencias, Universidad Nacional de Colombia.
REFERENCIAS
1. Ley 100 del 23 de diciembre de 1993. Por la cual se crea el sistema de seguridad social integral y se dictan otras disposiciones. Congreso de la República de Colombia. (Diario Oficial N° 41148.23. [ Links ]
2. Ministerio de la Protección Social e INVIMA. Normas farmacológicas 2002. Capítulo 23. 2002; p. 207-19. [ Links ]
3. Ministerio de la Protección Social y Departamento de Farmacia, Universidad Nacional de Colombia. Vademécum colombiano de plantas medicinales. Bogotá, DC: MinProtección Social, Universidad Nacional de Colombia; 2008. [ Links ]
4. Oficina Económica y Comercial de la Embajada de España en Bogotá. El sector de productos naturales en Colombia. Bogotá, DC: Embajada de España; 2005. [ Links ]
5. Decreto-Ley 1290 del 24 de junio de 1994. Por el cual se precisan las funciones del Instituto Nacional de Vigilancia de Medicamentos y Alimentos (INVIMA) y se establece su organización básica. Presidencia de la República. (Diario Oficial N° 41.406. [ Links ]
6. Decreto 677 del 28 de abril de 1995. Por el cual se reglamenta parcialmente el régimen de registros y licencias, el control de calidad, así como el régimen de vigilancia sanitaria de medicamentos, cosméticos, preparaciones farmacéuticas a base de recursos naturales, productos de aseo, higiene y limpieza y otros productos de uso doméstico y se dictan otras disposiciones sobre la materia. (Diario Oficial N° 41.827. [ Links ]
7. Decreto 377 del 17 de febrero de 1998. Por el cual se dictan disposiciones sobre recursos naturales utilizados en preparaciones farmacéuticas, y se amplía el plazo establecido en el Artículo 1º del Decreto 341 de 1997. Ministerio de Salud de Colombia. [ Links ]
8. Resolución 03131 del 6 de agosto de 1998. Adopta el Manual de Buenas Prácticas de Manufactura de Productos Farmacéuticos con base en Recursos Naturales Vigentes. Ministerio de Salud de Colombia. [ Links ]
9. Decreto 2266 del 15 de julio de 2004, por el cual se reglamentan los regímenes de registros sanitarios y de vigilancia y control sanitario y publicidad de los productos fitoterapéuticos. (Diario Oficial N° 45.610. [ Links ]
10. Organización Mundial de la Salud. Pautas generales para las metodologías de investigación y evaluación de la medicina tradicional. Ginebra; 2002. Documento WHO/EDM/TRM/2000.1. [ Links ]
11. Decreto 3553 del 28 de octubre de 2004, por el cual se modifica el Decreto 2266 de 2004 y se dictan otras disposiciones. Ministerio de la Protección Social de Colombia. [ Links ]
12. Resolución 004320 del 10 de diciembre de 2004. Por la cual se reglamenta la publicidad de los medicamentos y productos fitoterapéuticos de venta sin prescripción facultativa o de venta libre. Ministerio de la Protección Social de Colombia. [ Links ]
13. Resolución 2834 del 30 de julio de 2008. Por la cual se adopta el Vademécum de Plantas Medicinales Colombiano y se establecen los lineamientos para su actualización. Ministerio de la Protección Social de Colombia. [ Links ]
14. Decreto 3636 del 11 de octubre de 2005. Por el cual se reglamenta la fabricación, comercialización, envase, rotulado o etiquetado, régimen de registro sanitario, de control de calidad, de vigilancia sanitaria y control sanitario de los productos de uso específico y se dictan otras disposiciones. (Diario Oficial N° 46.059). [ Links ]
15. Decreto 3249 del 18 de septiembre de 2006. Por el cual se reglamenta la fabricación, comercialización, envase, rotulado o etiquetado, régimen de registro sanitario, de control de calidad, de vigilancia sanitaria y control sanitario de los suplementos dietarios, se dictan otras disposiciones y se deroga el Decreto 3636 de 2005. (Diario Oficial N° 46.395). [ Links ]
16. Circular Externa DG 100-00352-06 del 10 de octubre de 2006. Aclara el plazo de ingreso al territorio nacional de los suplementos dietarios, que presenten la solicitud de registro sanitario. Sin embargo, la comercialización de dichos productos, estará sujeta a la aprobación del registro sanitario. Dirección General INVIMA. [ Links ]
17. Resolución 3096 del 5 de septiembre de 2007. Por la cual se establece el reglamento técnico sobre las condiciones y requisitos que deben cumplir los suplementos dietarios que declaren o no información nutricional, propiedades nutricionales, propiedades de salud o cuando su descripción produzca el mismo efecto de las declaraciones de propiedades nutricionales o de las declaraciones de propiedades en salud. Ministerio de Salud de Colombia. (Diario oficial). [ Links ]
18. Decreto 4857 del 18 de diciembre de 2007. Por el cual se modifica el Artículo 52 del Decreto 3249 de 2006. Ministerio de la Protección Social de Colombia. [ Links ]
19. Decreto 3863 del 2 de octubre de 2008. Por el cual se modifica el Decreto 3249 de 2006 y se dictan otras disposiciones. Ministerio de la Protección Social de Colombia. [ Links ]
20. Instituto de Investigación de Recursos Biológicos Alexander Von Humboldt, biocomercio sostenible. Encuesta nacional de plantas medicinales y aromáticas una aproximación al mercado de las PM y A en Colombia. Bogotá, DC: 2005; p. 7-11. [ Links ]
21. Pérez-Arbeláez E. Plantas útiles de Colombia. 5ª ed. Bogotá: Fondo Fen Colombia; 1996. [ Links ]
22. Proexport. Estudio de oferta y demanda del sector de productos naturales. Informe Técnico. Bogotá: Proexport; 2003. [ Links ]
23. Ramírez H, Caetano CM, Rodríguez HJ, González RT. Recursos genéticos de plantas de uso medicinal y afines, actualidad y prospectiva. En: II Congreso Internacional de Plantas Medicinales y Aromáticas. Universidad Nacional de Colombia, Sede Palmira, Colombia, octubre 19-21 de 2006. [ Links ]
24. Díaz JA. Caracterización del mercado colombiano de plantas medicinales y aromáticas. Informe Técnico. Bogotá: Instituto Alexander Von Humboldt, Ministerio de Ambiente, Vivienda y Desarrollo territorial; 2003, p. 15-18, 22, 30. [ Links ]
25. Ministerio de Salud, INVIMA. Manual de normas técnicas de calidad. Guía técnica de análisis. Bogotá, DC: MinSalud, INVIMA; 2002. p 16-23. [ Links ]
26. Acta 08 del 11 de Junio de 2009. Comisión Revisora de Medicamentos de Colombia, Sala Especializada de Productos Naturales. [ Links ]