Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Colombia Médica
versão On-line ISSN 1657-9534
Colomb. Med. vol.49 no.3 Cali jul./set. 2018
https://doi.org/10.25100/cm.v49i3.3774
Articulo original
Análisis de concordancia de diferentes metodologías para la identificación de aislamientos orales de especies de Candida
1 Unidad de Micología Médica y Experimental, Corporación para Investigaciones Biológicas (CIB), Medellín, Colombia.
2 ORISE Fellow with the Mycotic Diseases Branch, Centers for Disease Control and Prevention (CDC), Atlanta, USA.
3 Unidad de Investigación en Proteómica y Micosis Humanas, Grupo de Enfermedades Infecciosas, Departamento de Microbiología, Facultad de Ciencias, Pontificia Universidad Javeriana, Bogotá, Colombia.
4 Escuela de Medicina y Ciencias de la Salud, Universidad del Rosario, Bogotá, Colombia.
5 Laboratorio Médico de Referencia S.A.S, Grupo GERMEN, Medellín, Colombia.
6 Escuela de Microbiología, Universidad de Antioquia, Medellín, Colombia.
7 Programa de Odontología, Universidad Antonio Nariño, Armenia - Quindío, Colombia.
Introducción:
La clasificación a nivel de especies de las levaduras del género Candida de origen clínico es fundamental para el diagnóstico y la instauración de un adecuado tratamiento para el paciente. Se realizó un estudio de concordancia de cinco metodologías usadas para la identificación de aislamientos orales de Candida spp en Colombia.
Métodos:
Sesenta y siete aislamientos de Candida spp fueron identificados a nivel de especie utilizando; API® 20 C AUX‚ Vitek® 2 Compact, MALDI TOF (Vitek® MS y Microflex®) y una prueba molecular, PCR Panfungal y secuenciación. Un análisis del costo comercial y tiempo de procesamiento de las muestras por cada método fue realizado mediante el análisis gráfico de ambas variables.
Resultados:
La PCR Panfungal y secuenciación diferenció 12 especies de Candida‚ los métodos Vitek® MS y Microflex® identificaron 9 especies y los métodos API® 20 C AUX y Vitek® 2 Compact identificaron 8 especies. El análisis de Kappa ponderado (wK) demostró una concordancia alta entre los métodos PCR Panfungal y secuenciación‚ Vitek® MS‚ Microflex® y API® 20 C AUX‚ concordancias agrupadas en las categorías buena y muy buena (wK 0.62 - 0.93); los Kp que involucraron el método Vitek® 2 Compact presentaron concordancias moderadas o buenas frente a los otros métodos (wK 0.56 - 0.73). Las metodologías basadas en MALDI TOF MS requirieron 4 minutos para generar un resultado y el método Microflex® fue el método que en nuestro medio presentó el menor precio de venta del servicio.
Conclusión:
Los métodos evaluados presentaron una alta concordancia en sus resultados‚ siendo más alta para los métodos moleculares y las metodologías basadas en MALDI TOF MS; estas últimas son metodologías más rápidas, económicas y precisas, las cuales se presentan como alternativas prometedoras para la identificación rutinaria de especies de levaduras del género Candida.
Palabras clave: Candida; mucosa bucal; diagnóstico; reacción en cadena de la polimerasa,espectrometría; masas; matrix asistida por láser de desorción-ionización; Colombia
Background:
The yeasts species determination is fundamental not only for an accurate diagnosis but also for establishing a suitable patient treatment. We performed a concordance study of five methodologies for the species identification of oral isolates of Candida in Colombia.
Methods:
Sixty-seven Candida isolates were tested by; API® 20C-AUX, Vitek®2 Compact, Vitek®MS, Microflex® and a molecular test (panfungal PCR and sequencing). The commercial cost and processing time of the samples was done by graphical analysis.
Results:
Panfungal PCR differentiated 12 species of Candida, Vitek®MS and Microflex® methods identified 9 species, and API® 20C-AUX and Vitek®2 Compact methods identified 8 species each. Weighted Kappa (wK) showed a high agreement between Panfungal PCR, Vitek®MS, Microflex® and API® 20C-AUX (wK 0.62-0.93). The wK that involved the Vitek®2 Compact method presented moderate or good concordances compared with the other methods (wK 0.56-0.73). Methodologies based on MALDI TOF MS required 4 minutes to generate results and the Microflex® method had the lowest selling price.
Conclusion:
The methods evaluated showed high concordance in their results, being higher for the molecular methods and the methodologies based on MALDI TOF. The latter are faster and cheaper, presenting as promising alternatives for the routine identification of yeast species of the genus Candida.
Key words: Candida; mouth mucosa; diagnosis; Polymerase Chain Reaction; Spectrometry; Mass; Matrix-Assisted Laser Desorption-Ionization; Colombia
Introducción
Los hongos del género Candida son un grupo de levaduras ubicuas y con características muy diversas. Una de las especies más conocida es Candida albicans ya que es la principal especie relacionada en la mayoría de infecciones causadas por levaduras, sin embargo, actualmente se ha observado un incremento de las infecciones causadas por especies diferentes, anteriormente menos comunes, pero que hoy en día han adquirido mayor importancia, ya que algunas presentan perfiles de sensibilidad disminuida y resistencia a los antimicóticos de uso habitual, en especial a los azoles y equinocandinas 1. Con base en lo anterior, la correcta identificación de levaduras del género Candida es uno de los retos más grandes existentes en la actualidad, en especial, porque esto pudiera retrasar la instauración de un adecuado tratamiento en el paciente, particularmente, en el manejo de las infecciones fúngicas invasoras. Para esto, se hace necesario contar con pruebas que sean rápidas y precisas para la identificación oportuna de levaduras de interés clínico 2.
Actualmente, existen diversas metodologías para la identificación de levaduras, algunas emplean medios cromogénicos como el CHROMagarTM Candida que permiten tener una identificación presuntiva de una manera rápida, logrando identificar especies de importancia clínica como C. albicans, C. tropicalis y C. krusei, sin embargo, muchos autores resaltan la importancia de complementar esta identificación con otras pruebas fenotípicas que permitan la confirmación a especie 3. De igual manera, existen sistemas comerciales como el API® 20 C AUX o el sistema Vitek® 2 Compact utilizados para la identificación de estas levaduras, los cuales están basados en pruebas bioquímicas. Tienen la desventaja que pueden proporcionar identificaciones erróneas por la falta de experiencia del laboratorista al interpretar los resultados y, con alguna frecuencia estos sistemas no son capaces de diferenciar especies con perfiles bioquímicos similares y existe la limitante de la inclusión oportuna de especies emergentes en sus bases de datos 4. La espectrometría de masas, basada en la metodología MALDI TOF (de sus siglas del inglés: matrix-assisted laser desorption ionization time-of-flight), ha surgido como un método valioso para la identificación de microorganismos en general, y con un buen desempeño para la identificación de levaduras, por su rapidez, precisión y bajo precio de venta de servicio 5,6. Por tales motivos, esta tecnología ha comenzado a emplearse con mayor frecuencia en nuestro medio, siendo los sistemas comerciales Microflex® (Bruker Daltonics GMBH, Leipzig, Alemania) y Vitek® MS (bioMérieux, Marcy, L’Etoile, Francia) los más populares 6,7.
Otras de las metodologías utilizadas son las técnicas moleculares basadas en la secuenciación de ácidos nucléicos, las cuales han sido empleadas como método de referencia para hacer comparaciones frente a otras pruebas de identificación debido a que proporcionan una identificación más precisa 8,9. Adicionalmente, las técnicas de secuenciación permiten identificar especies crípticas como C. metapsilosis, C. orthopsilosis, C. nivariensis, C. bracarensis, que exhiben frecuentemente resistencia a los antifúngicos que comúnmente son empleados contra estos patógenos 9. La PCR panfungal y secuenciación tiene como limitante la complejidad para ser implementadas en un laboratorio ya que requiere espacios físicos, equipamiento especial y personal altamente entrenado 10.
Con todo lo expuesto anteriormente, y teniendo en cuenta que son escasos los estudios que analizan la concordancia de los métodos empleados para la identificación de levaduras y la importancia médica que tiene conocer los agentes causales de las diferentes infecciones causadas por Candida spp, el objetivo de este estudio fue evaluar la concordancia entre cinco diferentes métodos, tanto convencionales como moleculares y de espectrometría de masas, empleados para la identificación de levaduras del género Candida.
Materiales y Métodos
Población y sitio de estudio
Se incluyeron muestras de enjuague bucal que se obtuvieron a partir de 98 individuos adultos sanos durante el año 2014 que asistieron a las clínicas odontológicas de la Universidad Antonio Nariño, ubicadas en 9 ciudades colombianas (Armenia, Bogotá, Bucaramanga, Cúcuta, Ibagué, Neiva, Palmira, Popayán y Villavicencio). Estos individuos no tenían enfermedad sistémica conocida aunque, algunos tenían procesos patológicos localizados que no produjeron alteración sistémica.
Las muestras provenientes de pacientes con enfermedad sistémica y de aquellos que estuvieron recibiendo tratamiento farmacológico con antibióticos, antifúngicos o corticoesteroides en los últimos 6 meses se excluyeron de los análisis.
Aislamientos
Los enjuagues bucales se remitieron de manera inmediata al Laboratorio de la Unidad de Micología Médica y Experimental de la Corporación para Investigaciones Biológicas (CIB) en Medellín, Colombia. Las muestras se sembraron en agar Sabouraud Dextrosa™ con antibióticos (BD™, referencia 210950) 11 y en medio CHROMagarTM Candida (CHOMagar Microbiology, Paris, Francia) 12, lo que permitió verificar desde los cultivos primarios, la posibilidad de tener infecciones mixtas por varias especies de Candida. Los cultivos fueron incubados a 25° C por 20 días, con lecturas semanales para evaluar la positividad de los mismos. Los aislamientos recuperados (n= 67) fueron almacenados en agua destilada estéril a 4° C y en medio de congelación en leche “Skim milk” (BD™, referencia 232100) a -20° C.
Identificación de las levaduras
La identificación del género y la especie de los aislamientos fue realizada utilizando las siguientes metodologías: 1) CHROMagarTM Candida (CHOMagar Microbiology, París, Francia). 2) API® 20 C AUX (bioMérieux, Marcy, L’Etoile, Francia). 3) Sistema automatizado Vitek® 2 Compact (bioMérieux, Inc., Hazelwood, MO, USA). 4) y 5) Espectrometría de masas basada en la técnica de MALDI TOF MS (desorción/ionización láser asistida por matriz) en los equipos Vitek® MS (bioMérieux, Marcy, L’Etoile, Francia) y Microflex® (Bruker Daltonics GMBH, Leipzig, Alemania). 6) Reacción en Cadena de Polimerasa (PCR) Panfungal y secuenciación.
Metodologías empleadas para la identificación de las levaduras
1. CHROMagarTM Candida: Después del crecimiento en este medio se verificó el color de cada una de las colonias para clasificarlas de acuerdo a las siguientes características: las colonias del complejo C. albicans/dubliniensis presentaron un color de verde claro a mediano, las de C. tropicalis, de azul verdoso a azul metálico y las demás especies presentaron un color de rosado pálido o lila claro a oscuro, o bien su color crema natural en este medio 12,13.
2. API® 20 C AUX: La prueba se realizó siguiendo las recomendaciones del fabricante (bioMérieux, Marcy, L’Etoile, Francia) 14. Despúés del período de incubación (48 horas a 25° C) los paneles se inspeccionaron visualmente. El perfil numérico obtenido para cada aislamiento se interpretó utilizando el software Apiweb TM (bioMérieux, referencia: 40 011).
3. Vitek® 2 Compact: el inóculo de trabajo fue preparado en 3 mL de solución salina al 0,45% a partir de un cultivo puro de no más de 24 h de crecimiento. La suspensión se ajustó a una escala de turbidez de McFarland entre 1,8 - 2,2, empleando el equipo DensiCheck®. El inóculo final fue dispensado automáticamente en las tarjetas de identificación del kit (YST, referencia: 21343), y se incubó utilizando el equipo Vitek® 2 Compact (bioMérieux, Durham, NC). La identificación final fue clasificada de la siguiente manera: “excelente”, “muy bueno”, “bueno”, “aceptable” o “con baja discriminación”, según el nivel de confianza y el porcentaje de discriminación para cada identificación proporcionada por el software del equipo 15.
4. MALDI TOF: Se realizó utilizando dos plataformas comerciales en los equipos Vitek® MS (bioMérieux, Marcy, L’Etoile, Francia) y Microflex® (Bruker Daltonics GMBH, Leipzig, Alemania). Los detalles metodológicos de cada método comercial se describen a continuación:
4.1 Vitek® MS: Una sola colonia pura (crecimiento entre 24-72 h) se depositó en un solo pocillo de la placa del Vitek® MS. Las células se lisaron con 0,5 μL de ácido fórmico al 25% (Referencia: 411072) y se dejarón secar a temperatura ambiente (1-2 min). Después del secado, se adicionó 1 μL de la matriz CHCA (bioMérieux, Marcy, L’Etoile, Francia, Referencia: 411071). Las pruebas se realizaron después de que la mezcla final estaba completamente seca. El listado de picos resultantes de la adquisición se analizó utilizando el servidor MS-ID, en el que se compararon los picos de la muestra con los espectros contenidos en la base de datos MS-ID (CE/IVD) incluido en MylaTM16.
4.2 Microflex®: Partiendo de cultivos con no más de 24 h de crecimiento a 37º C, se realizó la identificación mediante la metodología de transferencia con extracción directa extendida en placa o mediante extracción con ácido fórmico. Para la extracción directa, se tomó una sola colonia y se realizó una capa muy delgada del microorganismo en la placa de acero MALDI, se dejó secar a temperatura ambiente, se adicionó 1 μL de ácido fórmico al 100% y se cubrió con 1 μL de matriz HCAA (α-cyano-4 hydroxycinnamic acid - HCCA) dejando secar a temperatura ambiente. Para aquellas cepas que presentaron un score bajo en la identificación, o en las cuales no fue posible una identificación, se les realizó extracción con ácido fórmico, la cual se hizo siguiendo las instrucciones del fabricante (Bruker Daltonik GmbH, Bremen, Alemania) con algunas modificaciones. Cada muestra fue servida por duplicado con el fin de verificar la reproducibilidad. Los perfiles fueron visualizados con el software FlexControl (versión 3.0) y el MALDI Biotyper RTC 17.
5. PCR Panfungal y secuenciación: La región D1/D2 de la subunidad del complejo de genes rRNA 28S se amplificó siguiendo directrices internacionales para la identificación molecular de hongos 18. También se amplificó la región ITS 1-4 (Internal Transcribed Spacer) para la identificación de especies crípticas en aislamientos de Candida parapsilosis y Candida glabrata13. El DNA genómico se extrajo de colonias aisladas cultivadas en agar Sabouraud usando el mini kit QIAamp DNA (QIAGEN, Germantown, MD), siguiendo las recomendaciones del fabricante. Los marcadores moleculares fueron amplificados utilizando los cebadores y protocolos previamente descritos para las regiones D1/D2 y la ITS 1-4 19, 20.
Los productos amplificados de la región D1/D2 (~ 600 pb) y de la región ITS 1-4 (600 - 900 pb) fueron enviados a Macrogen (Maryland, EE.UU.) para la secuenciación bidireccional de Sanger. El software Sequencher 5.0 (Gene Code Corporation) se usó para editar y alinear las secuencias. Se realizó una búsqueda para establecer similitud/homología en dos bases de datos: el NCBI (BLAST) (Centro Nacional de Información de Biotecnología, Washington, DC) y el CBS-KNAW (Centro de Diversidad Fúngica).
Diseño metodológico y análisis estadístico
Las variables analizadas en este trabajo fueron resumidas mediante el cálculo de frecuencias absolutas y relativas. Los diferentes métodos para la identificación de levaduras evaluados fueron comparados mediante un análisis de concordancia, con el cálculo del índice de Kappa ponderado (Kp) y sus respectivos intervalos de confianza del 95% (IC 95%). El análisis de concordancia fue realizado de dos formas: la primera fue reagrupando los resultados de los métodos API® 20 C AUX‚ Vitek® 2 Compact‚ Vitek® MS y Microflex® y PCR Panfungal y secuenciación en las siguientes tres categorías de resultados: C. albicans/dubliniensis, C. tropicalis y Candida diferente a Candida albicans/dubliniensis/tropicalis, lo anterior se hizo con el objetivo de comparar las metodologías de identificación con el método de tamizaje CHROMagarTM Candida. El segundo análisis comparó los resultados finales de los métodos API® 20 C AUX‚ Vitek® 2 Compact‚ Vitek® MS y Microflex® y PCR panfungal y secuenciación, donde se tomó como método de referencia la PCR panfungal y secuenciación. Adicionalmente, fue realizado un análisis local de costos y tiempos necesario para el reporte de resultados, en el cual se analizaron las variables de precio de venta del servicio al público y el tiempo de procesamiento de la prueba para la entrega de resultados (excluyendo los tiempos de la fase pre-analítica y pos-analítica), la información analizada fue recolectada mediante contacto telefónico o vía correo electrónico con las diferentes instituciones que realizan alguna de estas metodologías en la ciudad de Medellín, Colombia. La interpretación se realizó mediante el análisis gráfico de las dos variables (costos y tiempo). Los análisis estadísticos fueron realizados utilizando el paquete estadístico STATA 8.0® y los gráficos mediante el Software Microsoft Excel 2010®.
Resultados
Sesenta y siete aislamientos del género Candida spp recuperados a partir de 98 enjuagues bucales fueron analizadas en el laboratorio (68% de positividad). Al realizar el análisis inicial utilizando el medio CHROMagarTM Candida, los 67 aislamientos se clasificaron como: 39 (58%) aislamientos de C. albicans/dubliniensis, 4 (6%) aislamientos de C. tropicalis y 24 (36%) aislamientos como Candida diferente a Candida albicans/dubliniensis/tropicalis. El primer análisis de concordancia comparando el CHROMagarTM Candida con las otras cinco metodologías (resultados reagrupados), arrojaron los siguientes resultados del Kappa ponderado (Kp): vs API® 20 C AUX = 1.00 (IC 95% = 1.00 - 1.00); vs Vitek® 2 Compact = 0.87 (IC 95% = 0.75 - 0.96); vs Vitek® MS = 0.92 (IC 95% = 0.80 - 0.99); vs Microflex® = 0.97 (IC 95% = 0.94 - 1.00) y vs la PCR panfungal y secuenciación = 0.98 (IC 95% = 0.95 - 1.00).
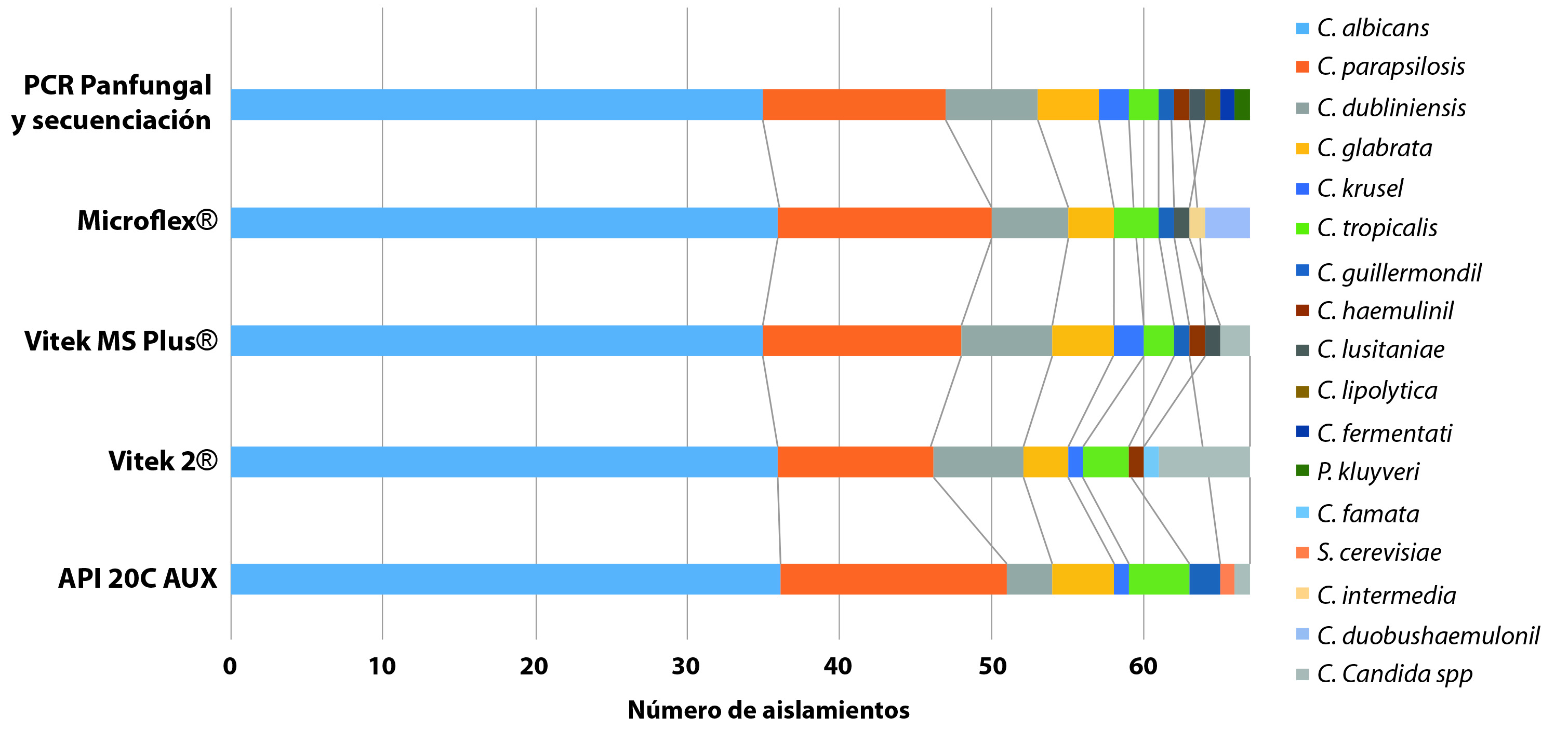
Al analizar los resultados teniendo en cuenta cada una de las metodologías utilizadas para la identificación de levaduras (excepto el CHROMagarTM Candida), se observó que la PCR panfungal y secuenciación, fue el método que logró diferenciar el mayor número de especies (n=12). Los métodos basados en espectometria de masas, Vitek® MS y Microflex®, identificaron nueve especies diferentes de Candida y finalmente, los métodos bioquímicos API® 20 C AUX y Vitek® 2 Compact, lograron identificar ocho especies diferentes de Candida cada uno. La descripción de las especies identificadas por metodología, se resumen en la Figura 1.
El segundo estudio de concordancia mostró una concordancia alta entre los resultados obtenidos con los métodos PCR panfungal y secuenciación, Vitek® MS, Microflex® y API® 20 C AUX, concordancias agrupadas en las categorías buena y muy buena. Los Kp que involucraron el método Vitek® 2 Compact, presentaron concordancias moderadas o buenas frente a los otros métodos (PCR panfungal y secuenciación, Vitek® MS, Microflex® y API® 20 C AUX). El análisis de las concordancias y discordancias comparando todos los métodos se encuentran resumidas en la Tabla 1. Los valores de Kp observados y sus respectivos IC del 95%, se encuentran resumidos en la Figura 2.
Tabla 1 Comparación de concordancias y discordancias de los métodos API® 20 C AUX, Vitek® 2 Compact, Vitek® MS y Microflex® con el método de referencia PCR panfungal y secuenciación.
| Método de referencia | API® 20 C AUX | Vitek ® 2 Compact | Vitek ® MS | Microflex ® | |||||
|---|---|---|---|---|---|---|---|---|---|
| PCR panfungal y secuenciación (n) | C (n) | D (n) | C (n) | D (n) | C (n) | D (n) | C (n) | D (n) | |
| C. albicans | 35 | 33 | 2 | 34 | 1 | 33 | 2 | 35 | 0 |
| C. parapsilosis | 12 | 12 | 0 | 10 | 2 | 12 | 0 | 12 | 0 |
| C. dubliniensis | 6 | 2 | 4 | 6 | 0 | 5 | 1 | 5 | 1 |
| C. glabrata | 4 | 4 | 0 | 2 | 2 | 4 | 0 | 3 | 1 |
| C. tropicalis | 2 | 2 | 0 | 2 | 0 | 2 | 0 | 2 | 0 |
| C. intermedia | 2 | 0 | 2 | 0 | 2 | 2 | 0 | 1 | 1 |
| C. guilliermondii | 1 | 1 | 0 | 0 | 1 | 1 | 0 | 1 | 0 |
| C. lusitaniae | 1 | 0 | 1 | 1 | 0 | 1 | 0 | 1 | 0 |
| C. haemulonii | 1 | 0 | 1 | 1 | 0 | 1 | 0 | 1 | 0 |
| C. lipolytica | 1 | 0 | 1 | 0 | 1 | 0 | 1 | 0 | 1 |
| C. fermentati | 1 | 0 | 1 | 0 | 1 | 0 | 1 | 0 | 1 |
| Pichia kluyveri | 1 | 0 | 1 | 0 | 1 | 0 | 1 | 0 | 1 |
| Total | 67 | 54 | 13 | 56 | 11 | 61 | 6 | 61 | 6 |
n: número
C: concordancias,
D: discrepancias
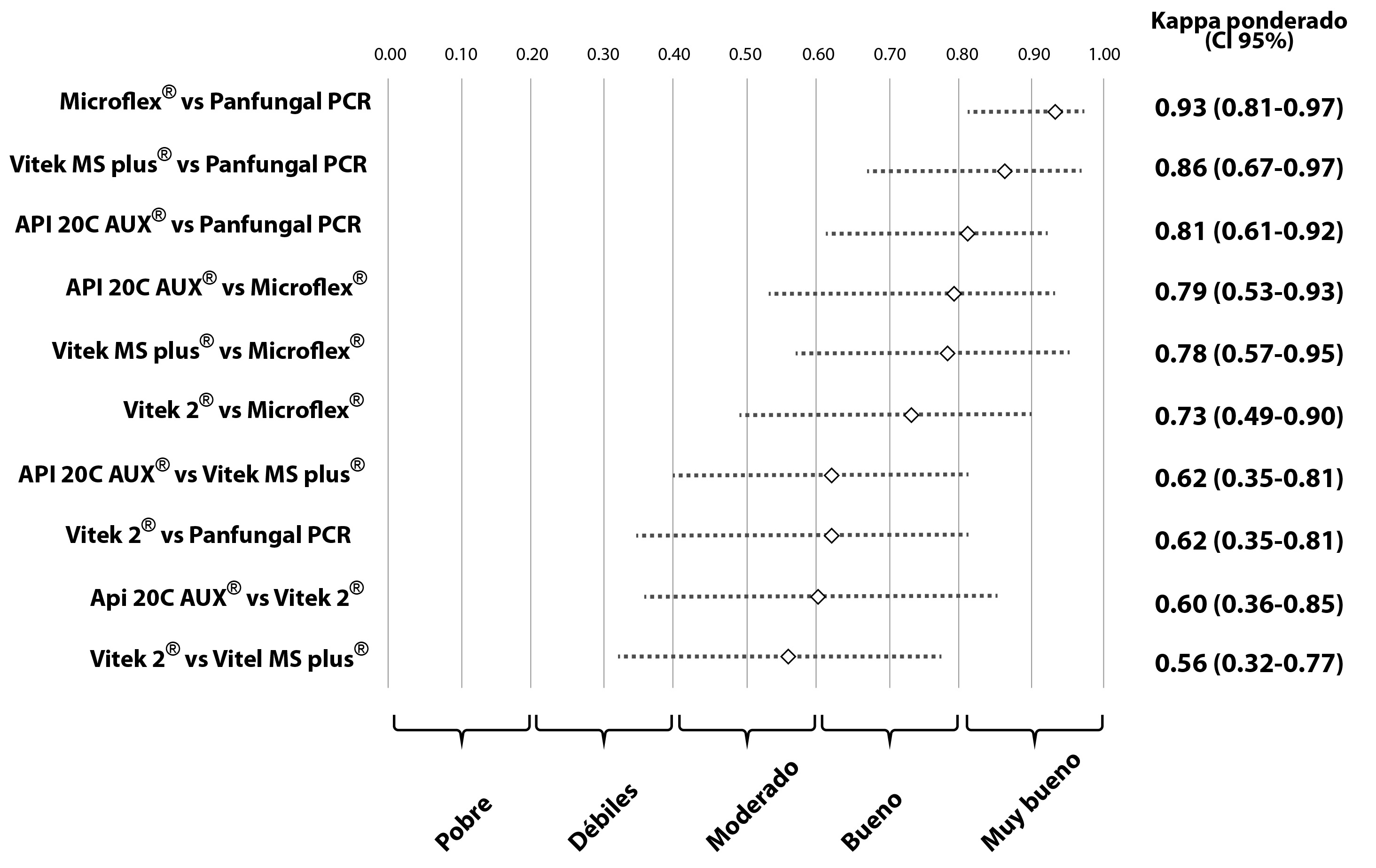
Figura 2 Análisis de concordancia de cinco metodologías para la identificación de aislamientos orales de especies de Candida.
Para corroborar que los métodos anteriores no dejaron de detectar especies de los complejos Candida parapsilosis y Candida glabrata, se complementó con una PCR y secuenciación de la región ITS 1-4, determinando que, en los complejos de Candida parapsilosis (n=12) y Candida glabrata (n=4), no se identificaron especies crípticas.
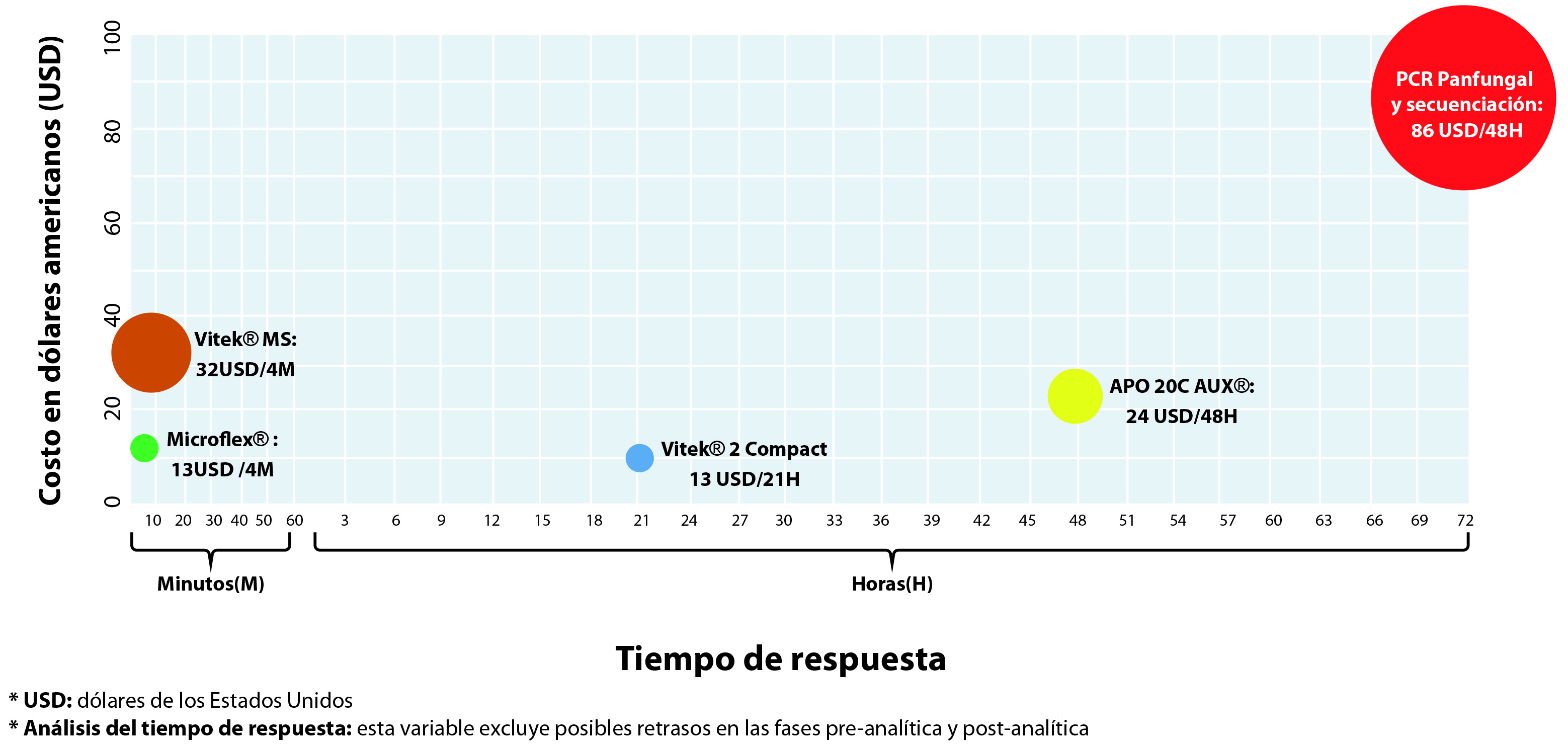
El análisis de costos y tiempo de procesamiento de la pruebas para generar resultados, demostró que los métodos basados en la tecnología MALDI TOF (Microflex® y Vitek® MS) requirieron menos tiempo para la generación de resultados (4 minutos), además, el método Microflex® presentó menor valor comercial (13 Dólares Americanos). La PCR panfungal y secuenciación, fue el método que requirió más tiempo para la entrega de resultados (3 días) y presentó el mayor valor comercial (86 USD). El análisis que compara las metodologías diagnósticas con base en los costos comerciales y el tiempo de procesamiento hasta la obtención de resultados, se resume en la Figura 3.
Discusión
Este estudio evaluó cinco metodologías diferentes para la identificación de aislamientos clínicos del género Candida obtenidos de enjuagues bucales. En general, observamos una buena concordancia entre CHROMagar ™ Candida y las otras cinco metodologías evaluadas en este estudio. El método Vitek® 2 Compact tuvo la concordancia más baja y la mayor fue observada con el API® 20 C AUX. Es importante mencionar que el uso de CHROMagar ™ Candida permite la identificación de la presencia de múltiples especies en la misma muestra clínica y proporciona una identificación presuntiva de las especies de Candida asociadas 21,22.
La mayoría de los cinco métodos analizados demostraron concordancias altas agrupadas en las categorías buena y muy buena. Estudios previos han demostrado que los métodos fenotípicos, basados en pruebas bioquímicas como el API® 20 C AUX y el sistema Vitek® 2 Compact, son los más empleados en los laboratorios clínicos 23,24. En este trabajo se observó que estos dos métodos fueron los que presentaron menor capacidad para diferenciar especies del género Candida y también presentaron menores valores de Kp, en especial, cuando se comparó el método Vitek® 2 Compact con las otras metodologías evaluadas. Otros autores han reportado que estos métodos pueden presentar discrepancias para identificar especies del género Candida menos comunes y aquellas especies estrechamente relacionadas 23,25. Por otra parte, la exactitud de estos métodos se reduce en gran medida si los laboratorios no realizan las pruebas adicionales requeridas para la identificación de perfiles fenotípicos que ayuden a discernir entre las especies con discriminaciones bajas o que presenten dificultades en la identificación.
En nuestro estudio se identificaron por PCR panfungal y secuenciación, especies como Candida fermentati y Candida haemulonii, que son especies emergentes, clasificadas recientemente dentro de complejos de especies que tienen dificultad de identificarse por los métodos convencionales y cuya identificación se puede convertir en un gran desafío cuando estas cepas no han sido incluidas en las bases de datos de los diferentes sistemas de identificación 26,27. Además, algunas de estas especies emergentes han mostrado una disminución de la sensibilidad a los agentes antifúngicos, y en consecuencia, esto aumenta la dificultad en el tratamiento de los pacientes con infecciones invasivas por Candida. 26,28. En nuestro trabajo, ninguna de las metodologías analizadas, con excepción de la PCR panfungal y secuenciación, tuvo la capacidad de diferenciar las especies de Candida lipolytica (n= 1), Candida fermentati (n= 1) y Pichia kluyveri (n= 1), especies que si bien han sido reportadas principalmente para el uso a nivel industrial, también tienen la capacidad de comportarse como verdaderos patógenos en humanos de acuerdo con las condiciones del hospedero 26,29-32.
Las metodologías basadas en MALDI TOF (Microflex® y Vitek® MS) presentaron una alta concordancia en comparación con el método de referencia, PCR panfungal y secuenciación. El análisis de concordancia entre estas dos tecnologías mostraron una concordancia muy buena, debido a que ambos sistemas fueron capaces de identificar el mismo número de especies pero no todas correspondieron a las mismas especies, ya que se obtuvieron incongruencias en las identificaciones en 6 de los 67 aislamientos analizados. Existen varias plataformas de MALDI TOF, las cuales presentan diferencias que van a depender de las bibliotecas de espectros de masas y de los algoritmos de identificación que tenga cada casa comercial 33,34. En nuestro estudio el Microflex® fue capaz de identificar todos los aislamientos a nivel de especie. Cuando se empleó el espectómetro Vitek® MS, se observaron tres discordancias mayores (esta plataforma no fue capaz de determinar la identificación final a nivel de especie en tres aislamientos), cuando se comparó con el método de referencia, lo cual afecto su valor de Kp. Muchos estudios han permitido determinar que estas técnicas son más rápidas y más precisas en la identificación de las diferentes levaduras a partir de cultivos, lo que tiene una alta relevancia a nivel de tiempo y costos de procesamiento 7,35,36.
La ventaja de la PCR panfungal y secuenciación radica en que esta técnica permite identificar especies crípticas o complejos de especies, pero se recomienda combinar la amplificación de la región D1/D2 con otros blancos en la región ITS 24-26. En este trabajo, aunque no se observó la presencia de especies crípticas de Candida parapsilosis y Candida glabrata, es importante tener en cuenta la importancia de emplear metodologías que sean capaces de detectarlas, debido principalmente a la emergencia de especies con perfiles de sensibilidad de difícil manejo 9,37,38. Además, sería la mejor opción, a pesar de su costo, para aquellas identificaciones que por otras metodologías generen identificaciones dudosas o con bajas discriminaciones.
Al realizar el análisis referente a los costos y al tiempo para la generación de resultados a nivel local, se pudo determinar que los métodos basados en la tecnología MALDI TOF (Microflex y Vitek® MS) fueron los que ofrecieron menores tiempos para la identificación de levaduras, como ha sido reportado en estudios previos, y al comparar esta metodología con los métodos convencionales, nuestros resultados reflejaron un costo muy razonable y competitivo en nuestro medio comparado con las demás técnicas 39. Cabe resaltar que esta tecnología permite resultados precisos, superando a las técnicas de identificación convencionales 40,41. Esta tecnología ha demostrado un gran potencial para una identificación rápida y precisa, y este hallazgo demuestra la necesidad de hacer que sus metodologías estén más disponibles.
Es importante mencionar que pueden ocurrir retrasos en la generación de resultados, debido a factores que no son inherentes al proceso, sino que dependen en gran parte de factores externos, como el día que llegue el aislamiento para su proceso, la viabilidad de los aislamientos, el requerimiento o no de un paso adicional de extracción, los días designados para el procesamiento de muestras, la disponibilidad de personal del laboratorio o el tiempo de respuesta para el análisis de las secuencias. Cambios en algunos de estos factores y conductas pueden marcar una gran diferencia a la hora de la entrega de un resultado oportuno y ayudarían a generar cambios a nivel de los laboratorios para mejorar los diferentes procesos.
El presente estudio se limitó a evaluar especies de Candida aisladas de mucosa oral y aunque se pudo evidenciar una gran variedad de especies identificadas entre los diferentes métodos, sería pertinente para futuras investigaciones realizar la misma evaluación de métodos en otras muestras clínicas. Adicionalmente, el análisis de costos y tiempos solo fue realizado en la ciudad de Medellín, Colombia. En Colombia, es limitado el número de laboratorio que ofrecen como servicio diagnóstico métodos moleculares y por tecnología MALDI TOF, lo cual puede incrementar de forma significativa los costos de estas pruebas, debido principalmente a la exclusividad del servicio.
Conclusión
Es necesario implementar métodos de identificación que faciliten el acceso a resultados rápidos y confiables, pero que, a su vez ayuden a optimizar el recurso económico una vez sean implementadas en la rutina diaria. En este trabajo se evidenció que los sistemas basados en tecnología MALDI TOF, a pesar de ser metodologías que inicialmente requerían una inversión económica sustancial, demostraron ser rápidos, económicos (valor comercial de la prueba) y precisos, que se presentan como alternativas prometedoras para la identificación rutinaria de levaduras del género Candida. Para aquellos laboratorios que no pueden acceder a pruebas moleculares o de espectrometría de masas, el uso de pruebas automatizadas podrían ser una buena alternativa si el analista del laboratorio sigue las especificaciones proporcionadas por el fabricante y presta especial atención a los resultados que involucran especies poco comunes o características discrepantes en el aislamiento (morfología, patrón de susceptibilidad y otras claves taxonómicas adicionales).
Agradecimientos:
Los miembros de la Unidad de Micología Médica y Experimental de la Corporación para Investigaciones Biológicas (CIB) expresan su agradecimiento a las siguientes personas e instituciones: la Universidad Antonio Nariño, Quindío, Colombia, la Unidad de Investigación en Proteómica y Micosis Humanas, Grupo de Enfermedades Infecciosas, Pontificia Universidad Javeriana, Bogotá, Colombia, la Universidad de Antioquia, Medellín, Colombia, al Laboratorio Médico de Referencia S.A.S, al Comité para el Desarrollo de la Investigación (CODI), y al Sr.Mark Mezzullo y la Dra. Angela Restrepo por la edición del manuscrito.
REFERENCIAS
1. McCarty TP, Pappas PG. Invasive candidiasis. Infect Dis Clin North Am. 2016; 30(1):103-24. [ Links ]
2. Albataineh MT, Sutton DA, Fothergill AW, Wiederhold NP. Update from the laboratory: clinical identification and susceptibility testing of fungi and trends in antifungal resistance. Infect Dis Clin North Am. 2016; 30 (1): 13-35. [ Links ]
3. Estrada-Barraza D, Dávalos A, Flores-Padilla L, Mendoza-De Elias R, Sánchez-Vargas LO. Comparación entre métodos convencionales, CHROMagarTM Candida y el método de la PCR para la identificación de especies de Candida en aislamientos clínicos. Rev Iberoam Micol. 2011; 28 (1): 36-42. [ Links ]
4. Ochiuzzi ME, Cataldi S, Guelfand L, Maldonado I, Arechavala A, Red de Micología CABA, Argentina. Evaluación del sistema Vitek(r) 2 para la identificación de las principales especies de levaduras del género Candida. Rev Argent Microbiol. 2014; 46(2): 107-110. [ Links ]
5. Panda A, Ghosh AK, Mirdha BR, et al. MALDI TOF mass spectrometry for rapid identification of clinical fungal isolates based on ribosomal protein biomarkers. J Microbiol Methods. 2015; 109: 93-105. [ Links ]
6. Jordana-Lluch E, Martró Català E, Ausina Ruiz V. La espectrometría de masas en el laboratorio de microbiología clínica. Enferm Infecc Microbiol Clin. 2012; 30 (10): 635 - 644. [ Links ]
7. Lima-Neto R, Santos C, Lima N, Sampaio P, Pais C, Neves RP. Application of MALDI TOF MS for requalification of a Candida clinical isolates culture collection. Braz J Microbiol. 2014; 45 (2): 515-522. [ Links ]
8. Kathuria S, Singh PK, Sharma C, et al. Multidrug-resistant Candida auris misidentified as Candida haemulonii: characterization by Matrix-Assisted Laser Desorption Ionization-Time of Flight Mass Spectrometry and DNA sequencing and its antifungal susceptibility profile variability by Vitek(r) 2, CLSI Broth Microdilution, and Etest Method. J Clin Microbiol. 2015; 53(6): 1823-1830. [ Links ]
9. Criseo G, Scordino F, Romeo O. Current methods for identifying clinically important cryptic Candida species. J Microbiol Methods. 2015; 111: 50-56. [ Links ]
10. Vijayakumar R, Giri S, Kindo AJ. Molecular species identification of Candida from blood samples of intensive care unit patients by Polymerase Chain Reaction - Restricted Fragment Length Polymorphism. J Lab Physicians. 2012; 4 (1): 1- 4. [ Links ]
11. Becton, Dickinson and Company. Regulatory Documents. EP/USP TSM Media - Test for Candida albican. Sabouraud Dextrosa. Becton, Dickinson and Company. Switzerland Sàrl. Available from: http://www.bd.com/europe/regulatory/documents.asp?i=506. [ Links ]
12. Becton, Dickinson and Company. BBL CHROMagar Candida Médium. Instrucciones de uso - medios en placa listos para usar. 2014. PA 257480.05. Available from: http://www.bd.com/resource.aspx?IDX=8810 [ Links ]
13. Howell SA, Hazen KC, Brandt ME. Candida, Cryptococcus, and other yeast of medical importance. Manual of clinical microbiology. Eleven Edition. Washington, DC: ASM Press; 2015. p. 1984-2014. [ Links ]
14. bioMérieux. API 20 C AUX. Yeast Identification System. bioMérieux, Marcy-l'Etoile: France. Available from: http://www.biomerieux.com.co/diagnostico-clinico/apir. Cited: 01/07/2018 [ Links ]
15. bioMérieux. VITEK 2 Compact. Yeast Identification System. bioMérieux, Marcy-l'Etoile: France. Available from: http://www.biomerieux.com.co/diagnostico-clinico/vitekr-2-compact. Cited: 01/07/2018 [ Links ]
16. bioMérieux. VITEK MS. bioMérieux, Marcy-l'Etoile: France. Available from: http://www.biomerieux.com.co/diagnostico-clinico/vitekr-ms. Cited: 01/07/2018 [ Links ]
17. Bruker. MALDI-TOF Microflex. Bruker Daltonik GmbH, Bremen, Germany. Available from: https://www.bruker.com/products/mass-spectrometry-and-separations/maldi-toftof/microflex/overview.html. Cited: 01/07/2018 [ Links ]
18. Clinical and Laboratory Standards Institute. Interpretive criteria for identification of bacteria and fungi by DNA target sequencing: approved guideline. MM18-A. Clinical and Laboratory Standards Institute: Wayne, PA. 2008. [ Links ]
19. Voigt K, Cigelnik E, O'Donnell K. Phylogeny and PCR identification of clinically important zygomycetes based on Nuclear Ribosomal-DNA sequence data. J Clin Microbiol. 1999; 37(12): 3957-64. [ Links ]
20. White TM, Bruns T, Lee S, Taylor J. Amplification and direct sequencing of fungal ribosomal RNA for phylogenetics. In: Innis MA, Gelfand DH, Sninsky JJ, White TJ. (Eds.). PCR protocols: a guide to methods and applications. Academic Press: San Diego, CA; 1990. pp. 315-21. [ Links ]
21. Stefaniuk E, Baraniak A, Fortuna M, Hryniewick W. Usefulness of CHROMagar Candida medium, biochemical methods - API(r) ID32C and Vitek 2 Compact and two MALDI TOF MS systems for Candida spp identification. Pol J Microbiol. 2016; 65 (1): 111 - 4. [ Links ]
22. Ballesté R, Arteta Z, Fernández N, Mier C, Mousqués N, Xavier B, et al. Evaluación del medio cromógeno CHROMagar Candida TM para la identificación de levaduras de interés médico. Rev Med Uruguay. 2005; 21: 186-93. [ Links ]
23. Linton CJ, Borman AM, Cheung G, Holmes AD, Szekely A, Palmer MD, et al. Molecular identification of unusual pathogenic yeast isolates by large ribosomal subunit gene sequencing: 2 years of experience at the UK Mycology Reference Laboratory. J Clin Microbiol. 2007; 45(4): 1152-8. [ Links ]
24. Meletiadis J, Arabatzis M, Bompola M, Tsiveriotis K, Hini S, Petinaki E, et al. Comparative evaluation of three commercial identification systems using common and rare bloodstream yeast isolates. J Clin Microbiol. 2011; 49(7): 2722-7. [ Links ]
25. Borman AM, Szekely A, Palmer MD, Elizabeth M, Jonson EM. Assessment of accuracy of identification of pathogenic yeasts in microbiology laboratories in the United Kingdom. J Clin Microbiol. 2012; 50(8): 2639-44. [ Links ]
26. Romi W, Keisam S, Ahmed G, Jeyaram K. Reliable differentiation of Meyerozyma guilliermondii from Meyerozyma caribbica by internal transcribed spacer restriction fingerprinting. BMC Microbiol. 2014; 14: 52. [ Links ]
27. Cendejas-Bueno E, Kolecka A, Alastruey-Izquierdo A, Theelen B, Groenewald M, Kostrzewa M, et al. Reclassification of the Candida haemulonii complex as Candida haemulonii (C. haemulonii group I), C. duobushaemulonii sp. nov.(C. haemulonii group II), and C. haemulonii var. vulnera var. nov.: three multiresistant human pathogenic yeasts. J Clin Microbiol. 2012; 50(11): 3641-51. [ Links ]
28. Arendrup MC, Boekhout T, Akova M, Meis JF, Cornely OA, Lortholary O, et al. ESCMID and ECMM joint clinical guidelines for the diagnosis and management of rare invasive yeast infections. Clin Microbiol Infect. 2014; 20(Suppl 3): 76-98. [ Links ]
29. Crolla A, Kennedy K J. Fed-batch production of citric acid by Candida lipolytica grown on n-paraffins. J Biotechnol. 2004; 110(1): 73-84. [ Links ]
30. Amaya-Delgado L, Herrera-López EJ, Arrizon J, Arellano-Plaza M, Gschaedler A. Performance evaluation of Pichia kluyveri, Kluyveromyces marxianus and Saccharomyces cerevisiae in industrial tequila fermentation. World J Microbiol Biotechnol. 2013; 29(5): 875-81. [ Links ]
31. Lockhart SR, Messer SA, Pfaller MA, Diekema DJ. Identification and susceptibility profile of Candida fermentati from a worldwide collection of Candida guilliermondii clinical isolates. J Clin Microbiol. 2009; 47(1): 242-4. [ Links ]
32. Liu WC, Chan MC, Lin TY, Hsu CH, Chiu SK. Candida lipolytica candidemia as a rare infectious complication of acute pancreatitis: a case report and literature review. J Microbiol Immunol Infect. 2013; 46(5): 393-6. [ Links ]
33. Mancini N, De Carolis E, Infurnari L, Vella A, Clementia N, Vaccaro L, et al. Comparative evaluation of the Bruker Biotyper and Vitek(r) MS Matrix-Assisted Laser Desorption Ionization-Time of Flight (MALDI TOF) Mass Spectrometry Systems for identification of yeasts of medical importance. J Clin Microbiol. 2013; 51(7): 2453-57. [ Links ]
34. Lohmann C, Sabou M, Moussaoui W, Prévost G, Delarbre JM, Candolfi E, et al. Comparison between the Biflex III-Biotyper and theAxima-SARAMIS Systems for Yeast Identification by Matrix-Assisted Laser Desorption Ionization-Time of Flight Mass Spectrometry. J Clin Microbiol. 2013; 51(4): 1231-6. [ Links ]
35. Pinto A, Halliday C, Zahra M, van Hal S, Olma T, Maszewska K, et al. Matrix-assisted laser desorption ionization-time of flight mass spectrometry identification of yeasts is contingent on robust reference spectra. PLoS One. 2011; 6(10): e25712. [ Links ]
36. Spanu T, Posteraro B, Fiori B, D'Inzeo T, Campoli S, Ruggeri A, et al. Direct MALDI TOF mass spectrometry assay of blood culture broths for rapid identification of Candida species causing bloodstream infections: an observational study in two large microbiology laboratories. J Clin Microbiol. 2012; 50(1): 176-9. [ Links ]
37. Brandt ME, Lockhart SR. Recent taxonomic developments with Candida and other opportunistic yeasts. Curr Fungal Infect Rep. 2012; 6 (3):170-7. [ Links ]
38. Tay ST, Lotfalikhani A, Sabet NS, Ponnampalavanar S, Sulaiman S, Na SL, et al. Occurrence and characterization of Candida nivariensis from a culture collection of Candida glabrata clinical isolates in Malaysia. Mycopathologia. 2014;178(3): 307-14. [ Links ]
39. Tan KE, Ellis BC, Lee R, Stamper PD, Zhang SX, Carrolla KC. Prospective evaluation of a matrix-assisted laser desorption ionization-time of flight mass spectrometry system in a hospital clinical microbiology laboratory for identification of bacteria and yeasts: a bench-by-bench study for assessing the impact on time to identification and cost-effectiveness. J Clin Microbiol. 2012; 50(10): 3301-8. [ Links ]
40. Iriart X, Lavergne RA, Fillaux J, Valentin A, Magnaval JF, Berry A, e t al. Routine identification of medical fungi by the new Vitek(r) MS matrix-assisted laser desorption ionization-time of flight system with a new time-effective strategy. J Clin Microbiol. 2012; 50(6): 2107-10. [ Links ]
41. Arvanitis M, Anagnostou T, Fuchs BB, Caliendo AM, Mylonakis E. Molecular and nonmolecular diagnostic methods for invasive fungal infections. Clin Microbiol Rev. 2014; 27(3): 490-526. [ Links ]
Recibido: 24 de Febrero de 2018; Revisado: 05 de Julio de 2018; Aprobado: 23 de Julio de 2018











 texto em
texto em