Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Colombia Médica
versión On-line ISSN 1657-9534
Colomb. Med. vol.50 no.4 Cali oct./dic. 2019
https://doi.org/10.25100/cm.v50i4.2833
Articulo original
Asociación entre el síndrome metabólico y el bocio nodular eutiroideo: un estudio de casos y controles
1 Universidad Peruana de Ciencias Aplicadas, Faculty of Health Sciences, Lima, Peru.
2 Beaumont Hospital, Dearborn, USA
3 SANNA Clínica El Golf, Lima, Peru
4 Hospital Guillermo Kaelin de la Fuente, EsSalud - Gastroenterology service, Lima, Peru.
5 Universidad Peruana de Ciencias Aplicadas, Faculty of Health Sciences, Research and Innovation Centre, Lima, Peru.
6 Ministerio de Salud del Perú, Centro de Salud Las Palmas, Tingo Maria, Huánuco, Peru.
Antecedentes:
el síndrome metabólico es un conjunto de anormalidades metabólicas y obesidad abdominal; Se ha demostrado que su base fisiopatológica, la resistencia a la insulina, actúa como agente en la proliferación de las células tiroideas. Pocos estudios analizan la relación entre el síndrome metabólico y la enfermedad nodular tiroidea, con una brecha de conocimiento sustancial.
Objetivo:
determinar la asociación entre el síndrome metabólico y la enfermedad tiroidea nodular en una región con una ingesta adecuada de yodo.
Métodos:
estudio de casos y controles. Un total de 182 pacientes remitidos a radiología para someterse a una ecografía tiroidea debido a la sospecha de enfermedad tiroidea. Los casos tenían al menos un nódulo tiroideo mayor de 3 mm (n = 91). Los controles no tenían evidencia de nódulos tiroideos (n = 91).
Resultados:
El análisis bivariado mostró una asociación significativa entre el síndrome metabólico y la presencia de nódulo tiroideo (OR 2.56, IC 95%: 1.41-4.66, p <0.05). Los niveles bajos de HDL (OR 2.81, IC 95%: 1.54-5.12, p <0.05) y glucosa en ayunas alterada (OR 2.05, IC 95% 1.10 a 3.78, p <0.05) se asociaron significativamente con la presencia de nódulo tiroideo, independiente de la presencia de síndrome metabólico. El análisis multivariado mantuvo la asociación entre el síndrome metabólico y el nódulo tiroideo con un OR de 2.96 (IC 95% 1.47 a 5.95, p <0.05); de manera similar, las asociaciones de niveles bajos de HDL (OR 2.77, IC 95% 1.44 a 5.3, p <0.05) y glucosa en ayunas alterada (OR 2.23, IC 95% 1.14 a 4.34, p <0.05) con nódulo tiroideo permanecieron significativas.
Conclusión:
la enfermedad nodular tiroidea se asocia con un mayor riesgo de síndrome metabólico, específicamente la disminución de HDL y los niveles de glucosa en ayunas alterados fueron los factores que aumentaron la asociación.
Palabras claves: nódulo tiroideo; síndrome metabólico; resistencia a la insulina; estudios de casos y controles.; Proteína IGF1, humana; Factor de crecimiento similar a la insulina I; Proteína IGF2, humana; Factor de crecimiento similar a la insulina II; Insulina; Colesterol, HDL; Obesidad, abdominal; Yodo
Background:
Metabolic syndrome is a cluster of metabolic abnormalities and abdominal obesity; its pathophysiologic basis, insulin resistance, has been shown to act as agent in thyroid cell proliferation. Few studies analyze the relationship between metabolic syndrome and thyroid nodular disease, with a substantial knowledge gap.
Objective:
Determine the association between metabolic syndrome and nodular thyroid disease in a region with adequate iodine intake.
Methods:
Case-control study. A total of 182 patients referred to radiology to undergo thyroid ultrasonography due to suspicion of thyroid disease. Cases had at least one thyroid nodule greater than 3 mm (n= 91). Controls did not have evidence of thyroid nodules (n= 91).
Results:
Bivariate analysis showed a significant association between metabolic syndrome and the presence of thyroid nodule (OR 2.56, 95% CI: 1.41-4.66, p <0.05). Low levels of HDL (OR 2.81, 95% CI: 1.54-5.12, p <0.05) and impaired fasting glucose (OR 2.05, 95%CI 1.10 to 3.78, p <0.05) were significantly associated with the presence of thyroid nodule, independent of the presence of metabolic syndrome. Multivariate analysis maintained the association between metabolic syndrome and thyroid nodule with an OR of 2.96 (95%CI 1.47 to 5.95, p <0.05); similarly, the associations of low levels of HDL (OR 2.77, 95%CI 1.44 to 5.3, p <0.05) and impaired fasting glucose (OR 2.23, 95%CI 1.14 to 4.34, p<0.05) with thyroid nodule remained significant.
Conclusion:
The thyroid nodular disease is associated with increased risk of metabolic syndrome, specifically decreased HDL and impaired fasting glucose levels were the factors that increased association was found.
Keywords: Thyroid nodule; metabolic syndrome; insulin resistance; case-control studies; IGF1 protein, human; Insulin-Like Growth Factor I; IGF2 protein, human; Insulin-Like Growth Factor II; Insulin; Cholesterol, HDL; Obesity, Abdominal; Iodine
Remark
| 1) ¿Por qué se realizó este estudio? |
| Este estudio se realizó porque existe la necesidad de conocer la relación que existe entre la presencia de enfermedad nodular tiroidea y el síndrome metabólico en pacientes que padecen estas patologías en nuestra región. |
| 2) ¿Cuáles fueron los resultados más relevantes del estudio? |
| En el análisis multivariado, la asociación entre la presencia de nódulo tiroideo con el síndrome metabólico OR de 2.96 (IC 95%: 1.47-5.95, p <0.05), también con niveles bajos de HDL OR 2.77 (IC 95%: 1.44-), estaba determinado. 5.3, p <0.05) y con la glucemia basal alterada OR de 2.23 (IC 95%: 1.14-4.34, p <0.05). |
| 3) ¿Qué aportan estos resultados? |
| Estos resultados proporcionan evidencia para el enfoque y manejo de pacientes con enfermedad tiroidea nodular y síndrome metabólico como enfermedades asociadas. |
Introducción
El síndrome metabólico es una agrupación de trastornos metabólicos y obesidad abdominal asociada con un mayor riesgo de desarrollar diabetes, enfermedades cardiovasculares y mortalidad prematura 1,2). Los factores definidos por Alberti et al. 3 son obesidad abdominal, presión arterial alta, triglicéridos séricos altos, niveles bajos de lipoproteína de alta densidad (HDL) e hiperglucemia en ayunas 1,3,4. Cada uno de estos componentes es un criterio para el diagnóstico 3,4,5. La literatura describe una alta prevalencia mundial de este síndrome, estimado entre el 20 y el 25% de la población adulta 1. Sin embargo, la prevalencia depende del país y los criterios de diagnóstico utilizados para su detección 6. De acuerdo con los criterios para la identificación del síndrome metabólico establecidos por la Federación Internacional de Diabetes, la prevalencia entre la población peruana es del 32.8% 7.
El síndrome metabólico está fuertemente asociado con la resistencia a la insulina. Durante dos décadas, los estudios han informado que la resistencia a la insulina podría ser el factor central para desarrollar este síndrome 5,8. Es importante señalar que el páncreas endocrino aumenta la producción de esta hormona debido a la resistencia de los tejidos a la acción de la insulina asociada con el síndrome metabólico, generando así un estado hiperinsulinémico en el cuerpo. La insulina tiene la capacidad de actuar como un factor de proliferación de las células tiroideas, un hecho que se ha demostrado en el cultivo celular 9, que puede conducir al crecimiento de la glándula tiroides y, por lo tanto, en ciertas condiciones desencadenar una enfermedad tiroidea nodular.
En este contexto, se sabe que los receptores para los factores de crecimiento de insulina 1 y 2 (IGF-1, IGF-2) se sobreexpresan en las líneas celulares del cáncer de tiroides, actuando como los principales factores mitogénicos y antiapoptóticos del cáncer de células 9,10,11.
La información mencionada anteriormente establece que el desarrollo del síndrome metabólico podría provocar el desarrollo de nódulos tiroideos, que aparecen en un amplio espectro clínico que incluye pequeños nódulos asintomáticos, en los que la principal preocupación es la exclusión de tumores malignos, a nódulos grandes con porciones intratorácicas. causando síntomas de compresión 12.
La prevalencia de la enfermedad nodular tiroidea en los Estados Unidos es del 7% si se detecta mediante palpación bimanual de la glándula tiroides y del 50% si se detecta mediante ecografía 12.
Debido a la diferencia entre las dos técnicas en la detección temprana de estos nódulos, el cribado ecográfico de pacientes con factores de riesgo es importante, considerando que el 5% de los nódulos tiroideos se detectan como carcinomas malignos 12.
Pocos estudios y ninguno en Perú han analizado la relación entre el síndrome metabólico y la enfermedad tiroidea nodular y han revelado una asociación entre estas dos entidades. Es por eso que el objetivo de nuestro estudio es determinar la asociación entre el síndrome metabólico y la enfermedad tiroidea nodular en una región con una ingesta adecuada de yodo.
Debido a que el síndrome metabólico puede diagnosticarse fácilmente mediante criterios establecidos para su identificación, la presencia de la asociación entre este síndrome y la enfermedad tiroidea nodular puede llevar a los médicos a sospechar una enfermedad tiroidea nodular en pacientes con síndrome metabólico durante la práctica médica diaria.
Materiales y métodos
Diseño del estudio y definición de casos y controles
Realizamos un estudio transversal de casos y controles en el "Hospital Nacional Edgardo Rebagliati Martins", que es un hospital de referencia nacional que cuenta con 1,289 camas de hospitalización y realiza un promedio de 179,881 atenciones/año 13 en Lima, Perú, durante 2014. Todos los pacientes evaluados eran residentes de áreas con niveles adecuados de yodo (más de 100 μg/L de yodo urinario). Todos los pacientes eutiroideos (definidos como valores de TSH de 0.4 a 4.0 mlU/L y T4 libre de 0.9 a 1.8 ng/dL) determinados por un ensayo de quimioluminiscencia inmune con un analizador automático, los que tenían un ultrasonido de tiroides que mostraba la presencia de una tiroides nódulo al menos mayor de 3 mm, se denominó caso.
Los pacientes eutiroideos mayores de 18 años, que habrían descartado la presencia de nódulo tiroideo por ecografía, fueron tomados como controles. Pacientes con alguna afección que podría causar la presencia secundaria de nódulos tiroideos o una medida errónea de cualquiera de los criterios diagnósticos metabólicos, como el diagnóstico de cáncer de tiroides metastásico, sin antecedentes de enfermedad tiroidea nodular, cirugía bariátrica previa, ascitis, pacientes postrados en cama, embarazadas o pacientes de enfermería, pacientes con criterios de síndrome metabólico con una diferencia de tres meses o más en su registro y la falta de al menos uno de los siguientes datos en la historia clínica: se excluyeron los triglicéridos, el colesterol HDL y la glucosa en ayunas.
Tamaño de la muestra
Para el cálculo del tamaño de la muestra, se utilizó EPIDAT 4.0 suponiendo un nivel de confianza del 95%, una potencia del 80% y una relación de síndrome metabólico en la población con nódulo tiroideo del 78.6% 2, lo que requeriría 91 casos y 91 controles para encontrar un OR de 2.5 o más 2. Debido a los criterios de inclusión y exclusión sugeridos, se evaluaron 475 pacientes para lograr el tamaño de muestra propuesto (Fig. 1).
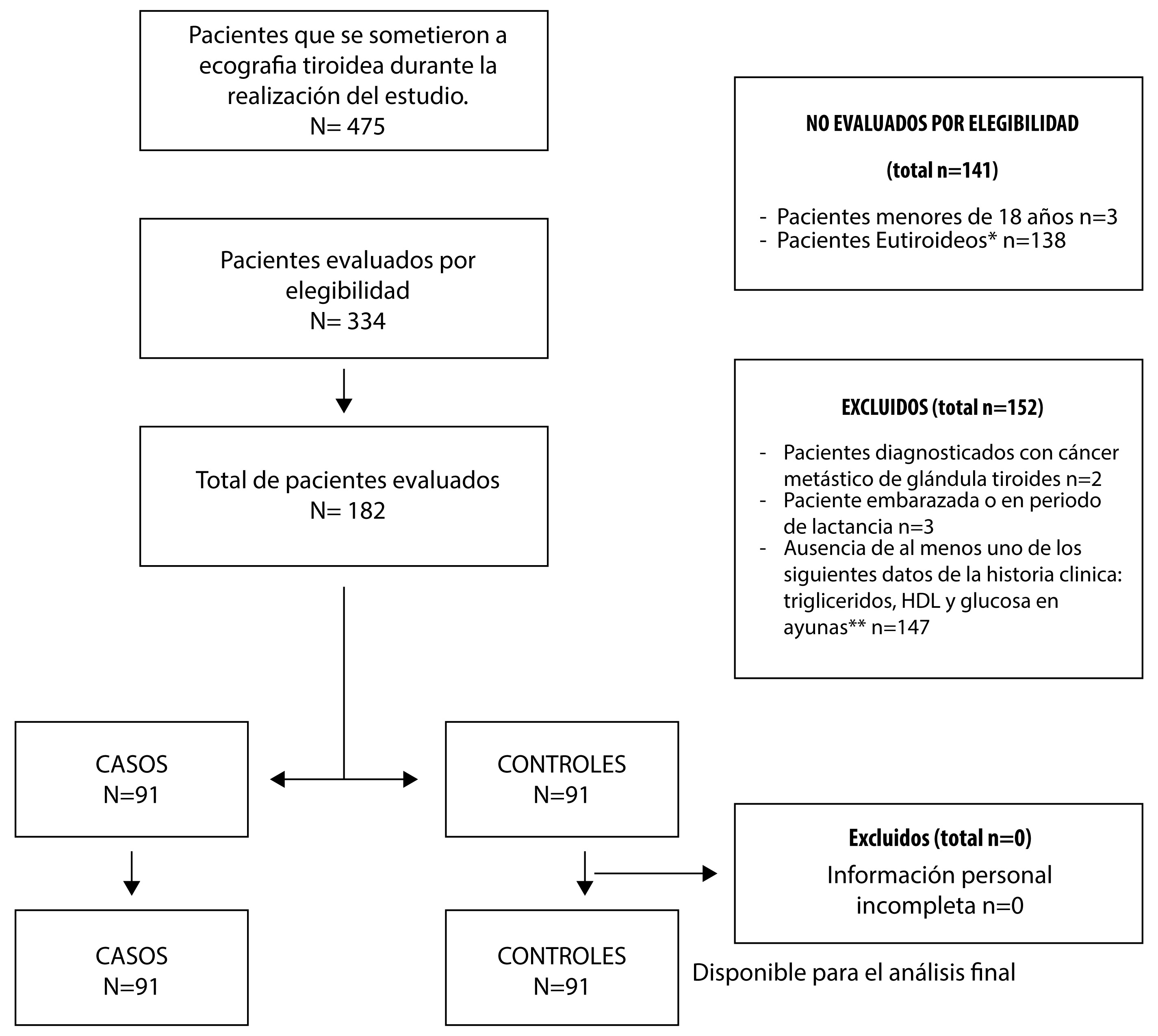
Figura 1 Diagrama de flujo de selección de pacientes. * Pacientes con TSH y T4 libre fuera de los rangos normales propuestos (TSH 0.4 a 4 mLU/L T4 libre y 0.9 a 1.8 ng/dL). ** Pacientes que no contaron con los resultados de una o más pruebas de laboratorio (triglicéridos séricos, glucosa en ayunas o colesterol HDL) y/o que tuvieron una antigüedad mayor de tres meses entre sí o con otros criterios de síndrome metabólico (presión arterial medida y/o medir la circunferencia abdominal).
Medida de resultado
Se usó un transductor lineal de 7.5 MHz. para buscar la presencia de nódulos tiroideos en ambos grupos de pacientes, la búsqueda fue realizada por dos expertos en el campo de la radiología diagnóstica.
Para definir la presencia de un nódulo como tal, el estudio consideró todas las lesiones de aumento focal de volumen o consistencia localizadas dentro de la tiroides. Podrían diferenciarse del resto del parénquima en un diámetro mayor de 3 mm 14. La escala TIRADS 15, que agrupa los nódulos tiroideos en seis tipos (TIRADS I, II, III, IV, V y VI) se utilizó de acuerdo con sus características ecográficas.
Definición de variables
La presencia del síndrome metabólico definido por los criterios diagnósticos establecidos por Alberti et al3 (Tabla 1) se determinó como variables de asociación. Esta definición se utilizó porque estos criterios son el producto de un consenso entre diversas organizaciones como la Federación Internacional de Diabetes, la Asociación Americana del Corazón, la Asociación Internacional para el Estudio de la Obesidad, entre otras; se usan en la mayoría de los estudios para mostrar la asociación propuesta en este estudio y porque consideran las variaciones étnicas para la obesidad abdominal. Para obtener estos datos, se revisaron las mediciones respectivas y se revisaron los historiales clínicos de casos y controles a partir de los cuales se obtuvieron datos de laboratorio como triglicéridos, colesterol HDL y glucosa sérica.
Tabla 1 Criterios diagnósticos de Sindrome metabólico*3
| Obesidad abdominal | Hombre≥90 cm | Mujer≥80 cm |
|---|---|---|
| Colesterol HDL en sueroa | Hombre<40 mg/dL | Mujer<50 mg/dL |
| Presion sanguíneab | PS ≥130 mmHg | PD ≥85 mmHg |
| Triglicéridos en sueroc | ≥150 mg/dL | |
| Glucosa en ayunasd | ≥110 mg/dL |
* Para el diagnóstico del síndrome se deben cumplir tres o más criterios.
a y / o uso actual de terapia farmacológica para el colesterol HDL bajo
b y / o uso actual de medicamentos antihipertensivos
c y / o uso actual de tratamiento farmacológico para triglicéridos elevados
d y / o uso actual de medicamentos antidiabéticos. (Agentes orales o insulina)
Valores obtenidos de la declaración provisional conjunta de Working Group of the International Diabetes Federation on Epidemiology and Prevention; National Heart, Lung and Blood Institute; American Heart Association; World Heart Federation; International Society of Atherosclerois; and International Association for the Study of Obesity
Dichos datos no superaron los tres meses de diferencia en comparación con el resultado de la medición; y datos clínicos como el uso de tratamiento antihipertensivo y antidiabético o con agentes hipolipemiantes. Además, se obtuvieron datos demográficos como género, edad y lugar de origen.
Medida de covariables
La presión sanguínea se midió dos veces utilizando un esfigmomanómetro de mercurio calibrado con un intervalo de al menos 2 a 3 min. Se calculó un valor medio para un resultado final. La medición se realizó con el paciente sentado (ambos pies en contacto con el suelo) y en reposo durante un mínimo de cinco minutos. Ambos brazos estaban por encima del nivel del corazón y la presión arterial en el brazo derecho tomada con un estetoscopio. El manguito se infló 30 mmHg adicionales cuando se detuvieron las palpitaciones y se desinfló a aproximadamente 2 mmHg por segundo. El valor de la presión arterial sistólica consideró el nivel al que apareció el primer sonido de Korotkoff y el nivel al que desapareció, se registró como presión arterial diastólica. El paciente no tomó bebidas con cafeína ni realizó ejercicio durante un período de 30 minutos antes de tomar la presión arterial. El aumento de la presión arterial se consideró si la presión arterial sistólica era ≥140 y/o la presión arterial diastólica ≥90 mm Hg, o el diagnóstico médico autoinformado y el uso de medicamentos antihipertensivos 16,17.
La circunferencia de la cintura se midió según las indicaciones de la Organización Mundial de la Salud (OMS), con una cinta métrica inelástica a la altura del punto medio entre la última costilla palpable y la cresta ilíaca. El paciente se colocó de pie, con los pies juntos y los brazos sueltos a los lados. La medición se realizó paralela al suelo, sin comprimir las estructuras abdominales y al final de la espiración 18. La obesidad abdominal consideró si la circunferencia de la cintura ≥90 cm era (hombres) o ≥80 cm (mujeres) 1,3.
La medición de los criterios de laboratorio se realizó en el laboratorio del hospital, para medir los niveles de glucosa en suero se usó el kit comercial de laboratorio Wiener (enzima líquida de glucosa AA). Para medir los niveles séricos de HDL y triglicéridos se utilizó un kit comercial del mismo laboratorio (colesterol enzimático líquido AA). El aumento en los niveles de triglicéridos en suero se observó cuando se encontraron niveles ≥150 mg/dL o estaba actualmente en tratamiento con medicamentos para niveles elevados de triglicéridos 3; los niveles bajos de colesterol HDL se consideraron criterio de diagnóstico cuando se encontraron valores <40 mg/dL en hombres y <50 mg/dL en mujeres o cuando se usó terapia farmacológica para el colesterol HDL bajo. Finalmente, el criterio para glucosa alterada en ayunas se consideró cuando se encontró glucosa en ayunas ≥100 mg/dL o durante el uso actual de medicamentos antidiabéticos (orales o insulina).
Se utilizó una metodología estandarizada para medir la altura y el peso 19. Para la medición de la altura se utilizó un estadiómetro de madera, validado, perpendicular al suelo, dividido en centímetros, con un cabezal deslizante paralelo al suelo. Se colocó al paciente con los brazos sueltos a los lados y los brazos y los pies descalzos juntos y los talones en contacto con la tabla y las caderas, la espalda y la cabeza. En el momento de la medición, el paciente miró un punto fijo y colocó la cabeza asegurándose de que la línea de visión formara un ángulo de 90 grados con el cuerpo. Con el paciente en la posición correcta, la cabeza se deslizó hacia el cabello del paciente hasta que presionó contra su cabeza 20. Para registrar el peso, se utilizó una balanza digital calibrada, el paciente se encontraba descalzo en el centro de la plataforma, con el peso distribuido uniformemente en ambos pies, sin usar ningún soporte y brazos sueltos en ambos lados. Se realizaron las aproximaciones correspondientes según la ropa usada 20.
El índice de masa corporal (IMC) se estimó dividiendo el peso de la persona por la altura al cuadrado. Según la OMS, un IMC de 18.5 a 24.9 kg/m2 define el peso normal, de 25 a 29.9 kg/m2 define el sobrepeso y obesidad mayor o igual a 30 20.
Análisis estadístico
Se desarrolló una base de datos con información obtenida debidamente codificada en el programa Microsoft EXCEL con doble entrada y posterior control de calidad. Más tarde, esta base de datos se transfirió a STATA 11.2 para su análisis estadístico.
Se utilizaron medias y desviaciones estándar para la descripción de variables numéricas (edad, altura, peso, circunferencia de la cintura, niveles de TSH, niveles de T4, HDL, triglicéridos, presión arterial sistólica y diastólica) y para variables categóricas, frecuencias absolutas y relativas (género), Se utilizaron IMC y antecedentes de diabetes, hipertensión, triglicéridos y dislipidemia HDL.
La prueba de Shapiro Wilk se usó para evaluar la normalidad de las variables numéricas. Para comparar las variables numéricas entre los dos grupos, en caso de distribución normal, se utilizó la prueba "Student T". Si no tenía una distribución normal, se utilizó la suma de rango de prueba de Wilcoxon. La prueba de chi cuadrado se utilizó para variables categóricas para comparar las características de la población entre casos y controles. Finalmente, se utilizó la regresión logística para calcular los odds ratios (OR) y los intervalos de confianza al 95% ajustando los posibles factores de confusión como la edad, el sexo y el estado nutricional según el índice de masa corporal (IMC).
Aspectos éticos
Este estudio ha sido revisado y aprobado por los Comités de Ética de la Universidad Peruana de Ciencias Aplicadas (UPC) y el Hospital Nacional Edgardo Rebagliati Martins. El consentimiento informado se aplicó a todos los pacientes que participaron en el estudio antes de comenzar cualquier actividad de investigación se estableció información clara sobre lo que se haría y garantizaría una confidencialidad absoluta.
Resultados
Características de la población
El número de participantes potencialmente elegibles para el estudio fue de 475. De estos 141 no se consideraron elegibles, 3 eran menores de 18 años y 138 porque no tenían el estado de eutiroideo. De los elegibles confirmados (n= 334), 152 participantes fueron excluidos aplicando los criterios de exclusión. El número total de pacientes evaluados fue de 182 divididos en 91 casos y 91 controles, todos ellos incluidos en el estudio y analizados sus resultados.
El estudio incluyó un número total de 182 pacientes, 91 de ellos tenían al menos un nódulo tiroideo y 91 eran el grupo de control (Tabla 2). El grupo de pacientes con nódulo tiroideo 91.2% (n = 83) eran mujeres, mientras que en el grupo control 82.4%. La mediana de edad en el grupo control fue de 51 (rango intercuartil o IR: 27) y en el grupo de casos fue de 50 (IR 21). El estado nutricional más prevalente en ambos grupos fue sobrepeso, siendo el 40% de los controles y el 34% de los casos, seguido de bajo peso, obesidad y peso normal para ambos grupos. En el grupo de casos, el tamaño medio de los nódulos tiroideos fue de 12.6 mm (IR: 11.9).
Tabla 2 Características generales de los pacientes con y sin nódulo tiroideo de un hospital nacional de Lima
| Variables | Pacientes con Nódulo | Pacientes sin Nódulo | ||
|---|---|---|---|---|
| n= 91 (%) | n= 91 (%) | |||
| Género | ||||
| Varón | 8 | 8.8 | 16 | 17.6 |
| Mujer | 83 | 91.2 | 75 | 82.4 |
| Edad (años) | ||||
| <40 | 23 | 25.3 | 28 | 30.8 |
| 40 a 59 | 45 | 49.5 | 38 | 41.8 |
| ≥60 | 23 | 25.3 | 25 | 27.5 |
| IMC | ||||
| Bajo peso | 33 | 36.3 | 27 | 29.7 |
| Normo peso | 1 | 1.1 | 2 | 2.2 |
| Sobrepeso | 34 | 37.4 | 40 | 44.0 |
| Obeso | 23 | 25.3 | 22 | 24.2 |
| Mediciones | ||||
| IMC* (kg/m2) | 26.92 | 4.36 | 26.62 | 4.42 |
| Talla* (m) | 1.56 | 0.08 | 1.57 | 0.08 |
| Peso**(kg) | 64 | 17 | 64 | 15 |
| Perímetro abdominal** (cm) | ||||
| Varón | 91.5 | 25.3 | 93 | 18.5 |
| Mujer | 90 | 23.9 | 89 | 12.5 |
| TSH**(mlU/L) | 2.71 | 2.07 | 2.5 | 1.18 |
| T4** (ng/dL) | 1.33 | 0.28 | 1 | 0.17 |
| HDL** (mg/dL) | ||||
| Varón | 49 | 12.35 | 54 | 8.5 |
| Mujer*** | 45 | 12.40 | 52 | 17.0 |
| Glucosa**(mg/dL) | 95 | 35.0 | 90 | 26.4 |
| Triglicéridos** (mg/dL) | 121 | 68.0 | 115 | 69.5 |
| Presión sistólica**(mmHg) | 120 | 20 | 115 | 20 |
| Presión diastólica** (mmHg) | 70 | 10 | 70 | 11 |
| Tamaño de nódulo** (mm) | 12.6 | 11.9 | - | - |
| Antecedentes | ||||
| Diabetes | 20 | 21.98 | 11 | 12.09 |
| Hipertensión arterial | 26 | 28.57 | 22 | 24.17 |
| Dislipidemia TG | 10 | 10.99 | 15 | 16.48 |
| Dislipidemia HDL | 9 | 6.59 | 4 | 4.39 |
*Se describe la media y desviación estándar.
**Se describe la mediana y el rango intercuartílico.
***p= 0.035 diferencia significativa entre los valores de HDL en mujeres en el grupo de casos comparados con el grupo de control.
Diferencia significativa entre los valores de HDL en mujeres en el grupo de casos en comparación con el grupo control (p <0.05). No se encontraron variaciones significativas para el IMC, altura, peso, circunferencia de la cintura, glucosa, triglicéridos, presión sistólica y diastólica para ambos grupos.
Characterización del syndrome metabólico en la población
La presencia de síndrome metabólico se asoció con el 59.4% (n = 54) de los pacientes con nódulo tiroideo, mientras que en el grupo de controles dicha entidad se encontró en el 36.3% (n = 33) de los pacientes (p <0.005) (Tabla 3) . Se reveló que los cinco componentes del síndrome metabólico están presentes con mayor frecuencia en el grupo de pacientes con nódulo tiroideo, siendo la obesidad abdominal (76.9%) el componente más frecuente en dicho grupo, seguido de un nivel bajo de HDL (63.7%), sangre alta presión (58.3%), nivel alto de triglicéridos (48.4%) y aumento de glucosa basal (45.1%); mientras que el grupo de control encontró que el factor más común era la obesidad abdominal (76.9%) seguida de presión arterial alta (43.0%), nivel alto de triglicéridos (42.9%), niveles bajos de HDL (38.5%) y glucosa basal alterada (28.6%) . Sin embargo, solo se encontraron diferencias significativas en los valores de HDL bajo y glucosa basal entre los dos grupos.
Tabla 3 Diferencias entre el síndrome metabólico y sus componentes en pacientes con y sin nódulo tiroideo
| Variables | Con Nódulo | Sin Nódulo | ||
|---|---|---|---|---|
| n= 91 (%) | n= 91 (%) | |||
| Síndrome metabólico* | ||||
| Si | 58 | 63.7 | 37 | 40.7 |
| No | 33 | 36.3 | 54 | 59.3 |
| Obesidad abdominal | ||||
| Sí | 70 | 76.9 | 70 | 76.9 |
| No | 21 | 23.1 | 21 | 23.1 |
| HDL bajo* | ||||
| Sí | 58 | 63.7 | 35 | 38.5 |
| No | 33 | 36.3 | 56 | 61.5 |
| Triglicéridos altos | ||||
| Sí | 44 | 48.4 | 39 | 42.9 |
| No | 47 | 51.6 | 52 | 57.1 |
| Presión elevada | ||||
| Sí | 53 | 58.2 | 40 | 44.0 |
| No | 38 | 41.8 | 51 | 56.0 |
| Glicemia basal alterada | ||||
| Sí | 41 | 45.1 | 26 | 28.6 |
| No | 50 | 54.9 | 65 | 71.4 |
*p < 0.005
Análisis bivariado y multivariado
En el análisis bivariado, la asociación significativa entre la presencia de nódulo tiroideo y el síndrome metabólico es evidente con un OR de 2.56 (IC 95:% 1.41-4.66, p <0.05). Además, se demostró específicamente que los niveles bajos de HDL y la glucemia en ayunas alterada están significativamente asociados con la presencia de nódulo tiroideo con un OR de 2.81 (IC 95%: 1.54-5.12, p <0.05) y 2.05 (IC 95%: 1.10- 3.78, p <0.05) respectivamente.
En el análisis multivariado, la asociación entre la presencia de nódulo tiroideo se mantuvo con el síndrome metabólico con un OR de 2.96 (IC 95%: 1.47-5.95, p <0.05), con niveles bajos de HDL con OR 2.77 (IC 95%: 1.44- 5.3, p <0.05) y la glucemia basal se alteró con un 5OR de 2.23 (IC 95%: 1.14-4.34, p <0.05). (Tabla 4).
Tabla 4 Análisis bivariado y multivariado entre síndrome metabólico y nódulo tiroideo
| Modelo bivariado | Modelo bivariado | Modelo multivariado | ||
|---|---|---|---|---|
| OR (IC 95%) | OR (IC 95%) | |||
| Síndrome metabólico | ||||
| Sí** | 2.56 | 1.41-4.66 | 2.96 | 1.47-5.95 |
| No | 1 | Referencia | 1 | Referencia |
| >Componentes individuales | ||||
| Obesidad abdominal | 1 | 0.5-1.99 | 0.68 | 0.27-1.67 |
| HDL bajo** | 2.81 | 1.54-5.12 | 2.77 | 1.44-5.3 |
| Triglicéridos altos | 1.24 | 0.69-2.23 | 1.29 | 0.66-2.51 |
| Presión elevada | 1.77 | 0.98-3.19 | 1.76 | 0.92-3.38 |
| Glicemia basal alterada** | 2.05 | 1.10-9.78 | 2.23 | 1.14-4.34 |
*Ajustado por edad, género y estado nutricional (IMC )
**p < 0.05
Considerando el síndrome metabólico como una variable dicotómica, se evaluó la asociación con el número de nódulos tiroideos presentes en el paciente. Como resultado, no se encontró asociación para realizar el análisis.
Discusión
Este estudio reveló que la frecuencia del síndrome metabólico era mayor en pacientes con enfermedad nodular tiroidea, aproximadamente tres veces más probable que en ausencia de esta. Además, al analizar cada componente individual del síndrome, se encontró asociación independiente en dos criterios: la presencia de niveles bajos de HDL en suero y la alteración de la glucemia basal. El grupo de pacientes con nódulos tiroideos tiene casi tres veces más probabilidades de tener niveles bajos de HDL además del doble de probabilidades de tener niveles de glucosa alterados en comparación con los pacientes que no tienen nódulos tiroideos.
Actualmente, no hay muchos estudios de investigación para revelar la asociación propuesta. Sin embargo, hay una investigación de Ayrturk et al 2, quienes realizaron un tipo de estudio de casos y controles en un área de deficiencia de yodo leve a moderada, que incluyó a 539 pacientes y tomó el síndrome metabólico como una variable dependiente (278 pacientes en el grupo de casos y 261 en el grupo de control). Estos resultados mostraron que los pacientes que padecían síndrome metabólico tenían un mayor porcentaje de nódulos tiroideos en comparación con los del grupo control (50.4 frente a 14.6%, p <0.0001) además de un aumento del volumen tiroideo (17.5 ± 5.5 frente a 12.2 ± 4.2 mL, p <0.0001 ) Además, demostraron la asociación entre la formación de nódulos tiroideos y la presencia de resistencia a la insulina obteniendo un OR de 3.2 con un intervalo de confianza del 95% para esta asociación. Yin et al. (21, Llevaron a cabo otro estudio que prueba la asociación propuesta en esta investigación, que en 2014 realizó un estudio de tipo cohorte en China que incluyó un total de 1061 pacientes seguidos durante tres años. En sus hallazgos, los investigadores describen que la prevalencia del nódulo tiroideo fue mayor en el grupo de pacientes con síndrome metabólico (Ji2 = 69.63, p <0.001), después de completar el análisis de cada componente del síndrome con la presencia de nódulos tiroideos, el resultado fue que la obesidad abdominal y el aumento de los triglicéridos en suero se asociaron con el desarrollo de nódulos tiroideos con RR 1.434 y 1.001 respectivamente, que difieren con nuestros resultados en los que encontramos que los componentes asociados son los valores de bajo nivel de HDL en suero y glucosa en ayunas alterada. Blanc et al, publicaron un estudio transversal, con 77 pacientes mayores de 65 años con síndrome metabólico. Los resultados de este estudio indican que el control metabólico deficiente en pacientes de edad avanzada con síndrome metabólico, reflejado por altos niveles de HbA1c, está asociado con una morfología tiroidea deteriorada y es un factor de riesgo para la formación de nódulos y el crecimiento de la tiroides en esta población. Además, los pacientes con diabetes mellitus tipo 2 establecida identificada dentro de esta población tienen volúmenes tiroideos más grandes que sus contrapartes que no padecen esta patología 22. Estos estudios concluyen que existe una asociación entre el síndrome metabólico y la presencia de nódulos tiroideos, lo que refuerza las conclusiones de nuestra investigación.
Otros estudios buscan demostrar asociaciones entre la resistencia a la insulina y la aparición de nódulos tiroideos. Por lo tanto, la importancia de estos estudios es clara considerando que esta es la base fisiopatológica del síndrome metabólico; incluyen estudios de investigación de Rezzonico et al.9 afirmando que los pacientes con resistencia a la insulina tenían un mayor porcentaje de enfermedad tiroidea nodular y un mayor volumen de tiroides en comparación con los pacientes sin resistencia a la insulina, concluyendo que a niveles más altos de insulina circulante, se desarrolla una mayor proliferación tiroidea que se traduce clínicamente como formación de nódulos tiroideos ; tales nódulos son más grandes que los presentes en pacientes sin resistencia a esta hormona. Yasar et al. 11 realizaron un estudio de tipo caso control con 146 pacientes (63 casos y 83 controles) para investigar dicha asociación, los resultados mostraron que el índice HOMA tomado como medida para determinar la resistencia a la insulina fue significativamente mayor en el grupo de pacientes con tiroides nódulos (15.87%) en comparación con el grupo control (10.84%).
Otra asociación interesante mostrada en la literatura es la resistencia a la insulina en el desarrollo del cáncer de tiroides, investigada por Rezzonico et al23, quienes en 2009 realizaron una investigación de 20 pacientes con cáncer de tiroides diferenciado (DTC) y 20 pacientes en el control grupo, el resultado reveló que el 50% de los pacientes presentaron resistencia a la insulina DTC, mientras que la diferencia estadísticamente significativa de solo el 10% en el grupo control. Además, afirman que en el grupo de pacientes con DTC, la resistencia a la insulina apareció en el 56.3% de los pacientes con cáncer de tiroides papilar y en el 25% en cáncer de tiroides folicular. A partir de estos resultados, podemos inferir que la resistencia a la insulina, además de ser un factor de riesgo para el origen de los nódulos tiroideos, podría ser un indicador importante de la presencia de células neoplásicas en los nódulos tiroideos secundarios.
Al analizar cada componente del síndrome metabólico de forma independiente con la presencia de enfermedad nodular tiroidea en este estudio, se demostró que existe una asociación entre la disminución de los niveles séricos de HDL y la aparición de nódulos tiroideos. Esto puede deberse a la disminución de los niveles séricos de HDL, que es uno de los componentes más prevalentes en la población de mujeres peruanas que padecen este síndrome, presentando 71.2% 7 a 86.8% 24. Además, se ha demostrado en múltiples estudios que la resistencia a la insulina está asociada con niveles reducidos de HDL 1,3-5,25. Aunque no se ha establecido una relación causal de dicho fenómeno, se sabe que esta resistencia hormonal genera un aumento en el catabolismo de la apolipoproteína A1 26-29, el componente principal de HDL, que conduce a su disminución. Otro componente del síndrome metabólico asociado con la aparición de nódulos tiroideos es la glucosa alterada en ayunas, que según algunos estudios es uno de los factores con mayor impacto en la aparición de nódulos tiroideos 2. Es bien sabido que la presencia del síndrome metabólico determina un estado de hiperinsulinismo en el cuerpo donde los niveles circulantes más altos de insulina causan una mayor proliferación de las células tiroideas. Pimenta et al. 9, revelan que la insulina y las hormonas tiroideas están íntimamente involucradas en el metabolismo celular y, por lo tanto, el exceso o la deficiencia de cualquiera de estas hormonas conducen al deterioro funcional de la otra. Se ha registrado la correlación fisiológica y bioquímica entre los niveles de insulina y la influencia de la insulina y las yodotironinas en el metabolismo de los carbohidratos y las proteínas. Las manifestaciones clínicas incluyen un aumento del volumen tiroideo y la formación de nódulos acompañados de niveles alterados de glucosa en suero 9.
Un estudio publicado en 2018 encontró que la glucosa plasmática en ayunas fue mayor en el grupo con bocio nodular. También hubo diferencias entre los grupos en términos de HOMA-IR y nivel de insulina. HOMA-IR no se correlacionó con el volumen tiroideo, el volumen del nódulo y el recuento de nódulos 30. Si bien un estudio prospectivo realizado por Kir et al., No encontró diferencias en el volumen tiroideo o la presencia de enfermedades tiroideas nodulares entre los grupos con presencia o ausencia de resistencia a la insulina. Sin embargo, el volumen tiroideo se asoció significativamente con el Síndrome Metabólico, estos resultados sugieren que los componentes individuales del Síndrome Metabólico pueden influir en la nodularidad tiroidea en cierta medida y que juntos ejercen un efecto acumulativo sobre la glándula tiroides, como se describe en nuestros resultados 31. Otro estudio informa que en los participantes con presencia o ausencia de nódulos tiroideos, el volumen tiroideo se correlaciona significativamente con los componentes del síndrome metabólico (circunferencia de la cintura, presión arterial, glucosa en plasma en ayunas y perfiles de lípidos en suero), en el grupo tiroides no nodular, El volumen tiroideo también se relacionó positivamente con la insulina sérica y los niveles de HOMA-IR, a diferencia de los resultados de otros estudios 32.
Las asociaciones que se muestran en este estudio nos permiten aumentar la conciencia sobre el riesgo de desarrollar enfermedad nodular tiroidea en pacientes con síndrome metabólico y promover un mayor énfasis en el control y manejo de los componentes que han demostrado una mayor asociación para prevenir la aparición de dichos nódulos. También hay estudios en los que se ha demostrado que el uso de metformina en pacientes con pequeños nódulos tiroideos y resistencia a la insulina reduce significativamente su tamaño 33.
En nuestro estudio, encontramos las siguientes restricciones: ultrasonografía, una prueba de diagnóstico para la detección del nódulo tiroideo, a pesar de ser la más sensible, es dependiente del operador, suponiendo un sesgo de medición (para lo cual se limitó a solo dos operadores y utilizó una validada escala); la población del estudio se encontraba en un entorno hospitalario y no se eligió al azar, por lo que los resultados de este estudio no pueden extrapolarse a la población general.
A partir de este estudio, se puede concluir que la presencia de enfermedad nodular tiroidea se asocia con un mayor riesgo de síndrome metabólico, específicamente la disminución del HDL y la disminución de los niveles de glucosa en ayunas fueron los factores que aumentaron la asociación.
Se recomienda realizar estudios prospectivos en el futuro, aleatorizados con una población mayor para poder analizar la relación entre la cantidad de ganglios tiroideos y el síndrome metabólico.
References
1. International Diabetes Federation. The International Diabetes Federation consensus worldwide definition of the metabolic syndrome. Lisbon: IDF; 2006. [ Links ]
2. Ayturk S, Gursoy A, Kut A, Anil C, Nar A, Tutuncu NB. Metabolic syndrome and its components are associated with increased thyroid volume and nodule prevalence in a mild-to-moderate iodine-deficient area. Eur J Endocrinol. 2009;161(4):599-605. doi: 10.1530/EJE-09-0410. [ Links ]
3. Alberti K, Eckel R, Grundy S, Zimmet P, Cleeman J. Harmonizing the metabolic syndrome: a joint interim statement of the International Diabetes Federation Task Force on Epidemiology and Prevention; National Heart, Lung, and Blood Institute; American Heart Association; World Heart Federation; International Atherosclerosis Society; and International Association for the Study of Obesity. Circulation. 2009;120(16):1640-5. doi: 10.1161/CIRCULATIONAHA.109.192644. [ Links ]
4. Grundy S, Brewer H, Cleeman J, Smith S, Lenfant C. Definition of metabolic syndrome: report of the National Heart, Lung, and Blood Institute/American Heart Association Conference on Scientific Issues Related to Definition. Circulation. 2004;109(3):433-8. doi: 10.1161/01.ATV.0000111245.75752.C6 [ Links ]
5. Grundy S. Metabolic syndrome pandemic. Arterioscler Thromb Vasc Biol. 2008; 28(4):629-36. doi: 10.1161/ATVBAHA.107 [ Links ]
6. Zimmet P, Magliano D, Matsuzawa Y, Alberti G, Shaw J. The metabolic syndrome: A global public health problem and a new definition. J Atheroscler Thromb. 2005;12(6):295-300. doi: 10.5551/jat.12.295 [ Links ]
7. Bernabe-Ortiz A, Pastorius-Benziger C, Gilman R, Smeeth L. Sex differences in risk factors for cardiovascular disease: The PERU MIGRANT Study. PLoS One. 2012;7(4):e35127. doi: 10.5551/jat.12.295 [ Links ]
8. Haas JT, Biddinger SB. Dissecting the role of insulin resistance in the metabolic syndrome. Curr Opin Lipidol. 2009;20(3):206-10. doi: 10.1097/MOL.0b013e32832b2024. [ Links ]
9. Rezzonico J, Rezzonico M, Pusiol E, Pitoia F, Niepomniszcze H. Introducing the thyroid gland as another victim of the insulin resistance syndrome. Thyroid. 2008;18(4):461-4. doi: 10.1089/thy.2007.0223 [ Links ]
10. Frittitta L, Sciacca L, Catalfamo R, Ippolito A, Gangemi P, Pezzino V, et al. Functional insulin receptors are overexpressed in thyroid tumors: is this an early event in thyroid tumorigenesis? Cancer. 1999;85(2):492-8. doi: 10.1002/(sici)1097-0142(19990115)85:2<492::aid-cncr30>3.0.co;2-i [ Links ]
11. Yasar HY, Ertugrul O, Ertugrul B, Ertugrul D, Sahin M. Insulin resistance in nodular thyroid disease. Endocr Res. 2011;36(4):167-74. doi: 10.3109/07435800.2011.593011. [ Links ]
12. Hegedüs L. The thyroid nodule. N Engl J Med. 2004; 351(17):1764-71. doi: 10.1056/NEJMcp031436 [ Links ]
13. EsSalud. Sistema Estadístico de Salud (SES). Lima: EsSalud; 2015. [ Links ]
14. Rivera-Moscoso R, Hernández-Jiménez S, Ochoa-Sosa A, Rodríguez-Carramza S, Torres-Ambriz P. Diagnóstico y tratamiento del nódulo tiroideo: posición de la Sociedad Mexicana de Nutrición y Endocrinología. Rev Endocrinol Nutrición. 2010; 18(1): 34-50. [ Links ]
15. Moifo B, Oben TE, Tambe J, Blanc F, Gonsu FJ. Reliability of thyroid imaging reporting and data system (TIRADS) classification in differentiating benign from malignant thyroid nodules. OJRad. 2013;3:103-7. doi: 10.4236/ojrad.2013.33016 [ Links ]
16. James PA, Oparil S, Carter BL, Cushman WC, Dennison-Himmelfarb C, Handler J, et al. 2014 evidence-based guideline for the management of high blood pressure in adults: report from the panel members appointed to the Eighth Joint National Committee (JNC 8). JAMA. 2014;311(5):507-20. doi: 10.1001/jama.2013.284427 [ Links ]
17. Mancia G, Fagard R, Narkiewicz K, Redon J, Zanchetti A, Böhm M, et al. 2013 ESH/ESC guidelines for the management of arterial hypertension: the Task Force for the Management of Arterial Hypertension of the European Society of Hypertension (ESH) and of the European Society of Cardiology (ESC). Eur Heart J. 2013;34(28):2159-219. doi: 10.1001/jama.2013.284427 [ Links ]
18. World Health Organization. Waist circumference and waist-hip ratio: report of a WHO expert consultation. Geneva: WHO; 2011. [ Links ]
19. Lohman T, Roche A, Martorell R. Anthropometric standardization reference manual. Champagne, Illinois, Human Kinetic Books, 1988. [ Links ]
20. Bastemir M, Akin F, Alkis E, Kaptanoglu B. Obesity is associated with increased serum TSH level, independent of thyroid function. Swiss Med Wkly. 2007;137(29-30):431-4. [ Links ]
21. Yin J, Wang C, Shao Q, Qu D, Song Z, Shan P, et al. Relationship between the Prevalence of thyroid nodules and metabolic syndrome in the iodine-adequate area of Hangzhou, China: a cross-sectional and cohort study. Int J Endocrinol. 2014;2014:675796. doi: 10.1155/2014/675796. [ Links ]
22. Blanc E, Ponce C, Brodschi D, Nepote A, Barreto A, Schnitman M, et al. Association between worse metabolic control and increased thyroid volume and nodular disease in elderly adults with metabolic syndrome. Metab Syndr Relat Disord. 2015;13(5):221-6. doi: 10.1089/met.2014.0158 [ Links ]
23. Rezzónico JN, Rezzónico M, Pusiol E, Niepomniszcze H. Increased prevalence of insulin resistance in patients with differentiated thyroid carcinoma. Metab Syndr Relat Disord. 2009;7(4):375-80. doi: 10.1089/met.2008.0062 [ Links ]
24. Pajuelo J, Sánchez J. El síndrome metabólico en adultos, en el Perú. An Fac Med (Lima). 2007; 68(1):38-46. doi: 10.15381/anales.v68i1.1237 [ Links ]
25. Mottillo S, Filion KB, Genest J, Joseph L, Pilote L, Poirier P, et al. The metabolic syndrome and cardiovascular risk a systematic review and meta-analysis. J Am Coll Cardiol. 2010;56(14):1113-32. doi: 10.1016/j.jacc.2010.05.034 [ Links ]
26. Robins SJ, Rubins HB, Faas FH, Schaefer EJ, Elam MB, Anderson JW, et al. Insulin resistance and cardiovascular events with low HDL cholesterol: the Veterans Affairs HDL Intervention Trial (VA-HIT). Diabetes Care. 2003;26(5):1513-7. doi: 10.2337/diacare.26.5.1513 [ Links ]
27. Laws A, Reaven GM. Evidence for an independent relationship between insulin resistance and fasting plasma HDL-cholesterol, triglyceride and insulin concentrations. J Intern Med. 1992;231(1):25-30. doi: 10.1111/j.1365-2796.1992.tb00494.x [ Links ]
28. Golay A, Zech L, Shi MZ, Jeng CY, Chiou YA, Reaven GM, et al. Role of insulin in regulation of high density lipoprotein metabolism. J Lipid Res. 1987;28(1):10-8. [ Links ]
29. Stalder M, Suenram P, Suenram A. Relationship Between plasma insulin levels and high-density lipoprotein colesterol levels in healthy men. Diabetologia. 1981;21(6):544-8. doi: 10.1007/bf00281546 [ Links ]
30. Aydogan Y, Altay M, Ünsal O, Kaplanoglu V, Çagir Y, Yildiz C, et al. An assessment of the relationship between thyroid nodule characteristics, insulin resistance and arterial stiffness in euthyroid nodular goiter. Endocrine. 2018;62(2):440-447. doi: 10.1007/s12020-018-1701-6 [ Links ]
31. Kir S, Aydin Y, Coskun H. Relationship between metabolic syndrome and nodular thyroid diseases. Scand J Clin Lab Invest. 2018;78(1-2):6-10. doi: 10.1080/00365513.2017.1402363 [ Links ]
32. Dauksiene D, Petkeviciene J, Klumbiene J, Verkauskiene R, Vainikonyte-Kristapone J, Seibokaite A, et al. Factors associated with the prevalence of thyroid nodules and goiter in middle-aged euthyroid subjects. Int J Endocrinol. 2017; 2017:8401518. doi: 10.1155/2017/8401518. [ Links ]
33. Rezzónico J, Rezzónico M, Pusiol E, Pitoia F, Niepomniszcze H. Metformin treatment for small benign thyroid nodules in patients with insulin resistance. Metab Syndr Relat Disord. 2011;9(1):69-75. doi: 10.1089/met.2010.0026 [ Links ]
Recibido: 03 de Enero de 2017; Revisado: 03 de Mayo de 2019; Aprobado: 30 de Noviembre de 2019











 texto en
texto en 



