Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Colombia Médica
On-line version ISSN 1657-9534
Colomb. Med. vol.51 no.2 Cali Apr./June 2020 Epub May 11, 2020
https://doi.org/10.25100/cm.v51i2.4272
Articulo de revisión
Alternativas diagnósticas para SARS-CoV-2 para América Latina
1 Universidad del Valle; Escuela de Salud Pública, Facultad de Salud. Cali, Colombia
2 Pontificia Universidad Javeriana, Maestría en Epidemiología Clínica, Cali, Colombia
En los últimos cuatro meses, el virus SARS-CoV-2 ha llegado a la mayoría de países en el mundo. Las estrategias de salud pública basadas en la realización masiva de pruebas diagnósticas y el aislamiento focalizado de casos positivos han demostrado ser útiles para la reducción de la transmisión de SARS-CoV-2. Las pruebas confirmatorias, que identifican el ARN viral, y las pruebas serológicas que identifican antígenos virales o anticuerpos contra las proteínas virales del huésped son herramientas que las naciones pueden usar para combatir las epidemias producidas por agentes infecciosos. El comprender cómo funcionan estas pruebas puede ayudar a entender sus características y cómo pueden ser usadas para diferentes objetivos clínicos y de salud pública. Las pruebas diagnósticas son herramientas clave para reducir la transmisión viral, no solo en esta epidemia, sino para otras por venir.
Palabras clave: Infección por Coronavirus; SARS-CoV-2; Prueba diagnóstica COVID-19; Reacción en cadena de la polimerasa; sensibilidad y especificidad
In the past four months SARS-CoV-2 has reached most countries in the world. Public health strategies based on widespread testing and proper isolation of positive cases have shown to be helpful to reduce local transmission of SARS-CoV-2. Confirmatory tests, that identify viral RNA, and screening serological tests that identify viral antigens or host antibodies against viral proteins are part of the tools that nations can use to fight infectious disease epidemics. Understanding how each test works can provide insights about their test characteristics and how they can be used for different clinical and public health goals. Testing is a key strategy to reduce viral transmission, not only for this epidemic, but also for others to come.
Keywords: Coronavirus infections; SARS-CoV-2; COVID-19 diagnostic testing; Polymerase Chain Reaction; sensitivity and specificity
Contribución del estudio
| 1) ¿Porqué se realizó este estudio? |
| Para proporcionar una descripción de las pruebas de diagnóstico disponibles para SARS-CoV-2 que permita comprender como funcionan y para qué son útiles estas pruebas |
| 2) ¿Cuáles fueron los resultados más relevantes de este estudio? |
| Se describen las diferentes pruebas que identifican el ARN viral, antígenos virales y anticuer pos del huésped contra los antígenos virales; para qué son útiles estas pruebas y sus caracter ísticas |
| 3) ¿Cuál es la contribución de estos resultados? |
| Este es un resumen acerca de las pruebas de diagnóstico para SARS-CoV-2 que se puede utilizar para comprender mejor las diferentes pruebas y protocolos disponibles para SARS-CoV-2. |
Introducción
En los últimos cuatro meses, la infección por SARS-CoV-2 se ha presentado en la mayoría de países del mundo. Los gobiernos han intentado frenar su transmisión con el objetivo común de evitar la saturación de los sistemas de salud y reducir el impacto económico de las cuarentenas y otras medidas de aislamiento. En este sentido, las pruebas de diagnóstico para el virus se presentan como un importante componente de las estrategias para reducir su transmisión 1. El mundo ha reconocido que las estrategias de Singapur, Taiwán, Hong Kong y Corea del Sur, de realizar tempranamente pruebas diagnósticas en la población general puede ayudar a controlar la transmisión. La identificación temprana de casos positivos puede conducir a un aislamiento oportuno y adecuado, a realizar cuarentenas y monitoreo de los contactos de casos confirmados, y a la implementación de estrategias para reducir la transmisión en los centros de salud donde los casos se concentran (por ejemplo, cierre y descontaminación de áreas de alto riesgo) 2.
Pruebas confirmatorias
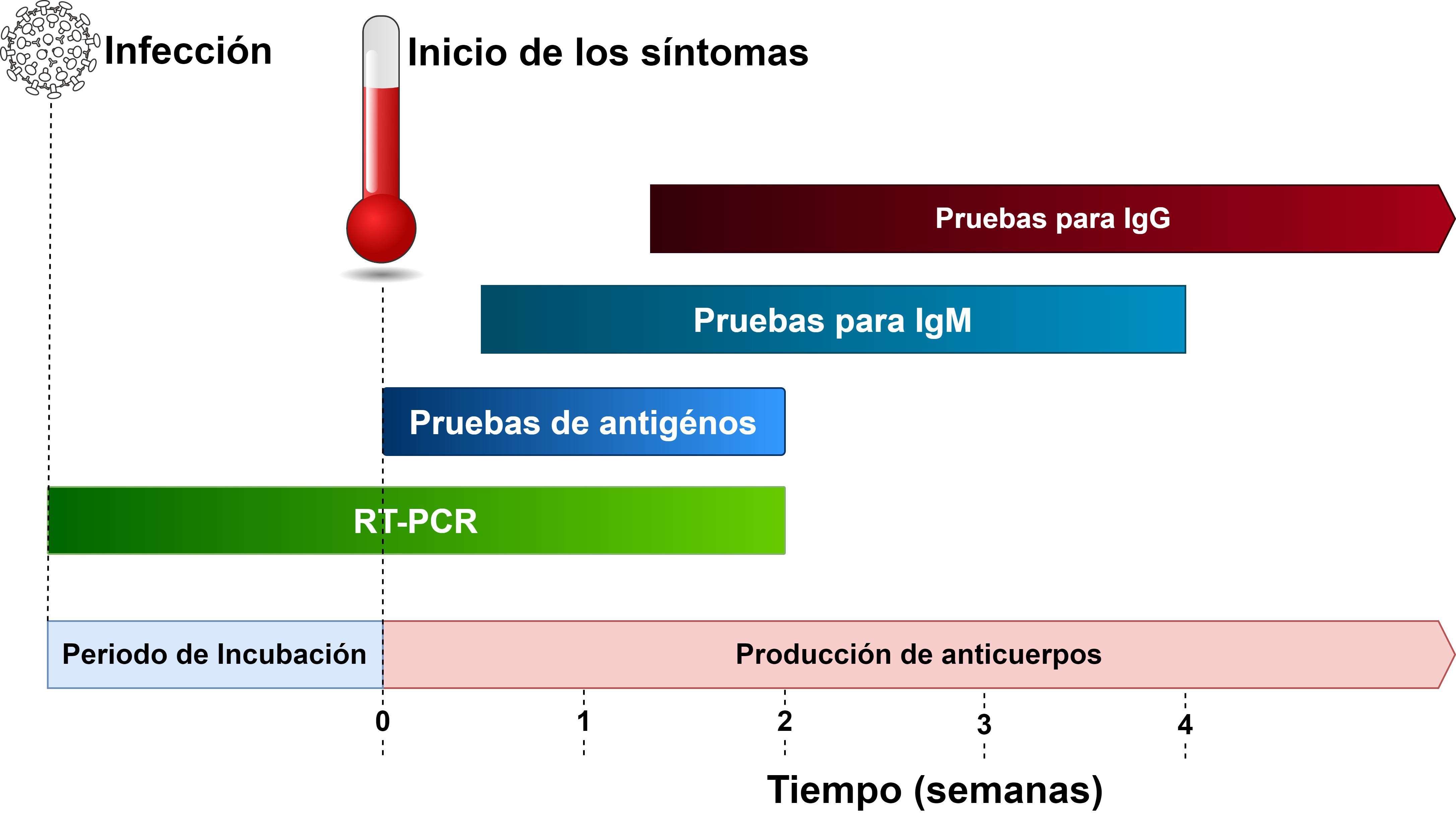
El diagnóstico confirmatorio de infección por SARS-CoV-2 se basa en pruebas de reacción en cadena de la polimerasa (PCR) que amplifican e identifican secuencias de ARN virales. En algunos casos, la PCR puede no detectar ARN viral debido a la aparición temprana de síntomas, problemas con el muestreo y manejo de muestras, la calidad del kit o el rendimiento general de la prueba 3. En estos casos, la tomografía computarizada de tórax se ha sugerido como una herramienta de diagnóstico complementaria 4,5. En enero de 2020, la OMS diseñó y comenzó a distribuir una prueba cuantitativa de PCR basada en transcriptasa inversa (RT-PCR) para detectar la infección por SARS-CoV2 1. A la fecha, están disponibles diferentes protocolos de RT-PCR, así como otras pruebas de diagnóstico para SARS-CoV-2 6,7.
Aunque las pruebas de RT-PCR son rápidas, generalmente el proceso dura de 4 a 6 horas, estas tienen un alto grado de complejidad y se requiere un alto nivel de entrenamiento en laboratorio. Además, la RT-PCR es costosa (en comparación con las pruebas serológicas) y requiere capacitación de personal de alto nivel para obtener y procesar muestras de pacientes, generalmente muestras del tracto respiratorio inferior con niveles más altos y prolongados de ARN viral, que son más difíciles de obtener 8. Debido a esto, las pruebas de RT-PCR generalmente se encuentran centralizadas en laboratorios especializados. Sin embargo, la centralización de las pruebas reduce la velocidad de identificación de casos, debido al tiempo que toma el envío de muestras clínicas desde las regiones a los laboratorios de las grandes ciudades. Por ejemplo, en Colombia, la centralización de estas pruebas en el Instituto Nacional de Salud en Bogotá durante las primeras semanas de transmisión del SARS-CoV-2 en el país produjo retrasos importantes (hasta de 11 días) en la identificación de casos 9. Esto generó demoras en los tiempos de reacción y de implementación de medidas de salud pública en las regiones.
Como alternativa, existen nuevos desarrollos de pruebas automatizadas de RT-PCR para los puntos de atención de salud, que aunque más costosos debido a la necesidad de equipos y reactivos, pueden proporcionar resultados en minutos. Por ejemplo, la prueba Xpert® Xpress SARS-CoV-2 (Cepheid) 10, la cual se puede usar con el equipo GenXpert, identifica múltiples regiones del genoma viral y puede proporcionar resultados en 45 minutos. Adicionalmente, el reciente desarrollo de Abbott, el ID NowTM COVID-19, utiliza tecnología de amplificación de ácido nucleico isotérmico y proporciona resultados en 5 minutos 11. Este desarrollo se puede usar con el equipo ID NOW, una plataforma pequeña, ligera y portátil que se puede utilizar en puntos de atención de salud. Hasta la fecha, la prueba Abbott ID NowTM COVID-19 solo está disponible en los Estados Unidos (se producen alrededor de 50,000 por día), pero se espera que pronto esté disponible en otros países.
Inmunoensayos para detección de antígenos
Los anticuerpos monoclonales contra antígenos del SARS-CoV-2, por ejemplo la proteína de nucleocápside (N) y los dominios S1 o S2 de la proteína espiga (S), se pueden usar para detectar infección viral 12. La prueba de antígeno se realiza en inmunoensayos de flujo lateral utilizando muestras de material nasofaríngeo u orofaríngeo 2. Una de las ventajas de las pruebas de antígeno es que están disponibles en kits rápidos que son fáciles de usar y pueden proporcionar resultados en 20-60 minutos. Sin embargo, dado que no replican secuencias de ARN virales, existe preocupación por una posible baja sensibilidad 2 de la prueba (la sensibilidad es la capacidad de una prueba para identificar correctamente a aquellos con la infección, comparada contra una prueba reina o “gold standard”, como el RT-PCR) (Anexo 1) 13. Adicionalmente, el desarrollo de anticuerpos monoclonales requiere más tiempo que otras pruebas (por ejemplo, pruebas de detección de anticuerpos) y, aunque prometedoras, aún no se dispone de pruebas validadas para identificar antígenos de SARS-CoV-2 2,14.
Inmunoensayos para detección de anticuerpos
Los inmunoensayos serológicos son una alternativa de bajo costo que puede ser ampliamente utilizada a nivel poblacional y que puede proporcionar resultados en 15 a 20 minutos. Estos inmunoensayos (incluyendo los de flujo lateral rápido, inmunoensayo de quimioluminiscencia automatizado y ELISA manual) 15 utilizan proteínas virales recombinantes / dominios de proteínas virales a las que se unen los anticuerpos humanos, en el caso que estén presentes en la sangre. Una prueba positiva indica que la persona tiene anticuerpos contra el virus, lo que ofrece una medida indirecta de infección previa o activa en la persona 1. Debido a que solo se necesita una pequeña muestra de sangre en estas pruebas y se cuenta con dispositivos de fácil identificación de resultados, no es necesario un alto nivel de entrenamiento para obtener y procesar las muestras, ni tampoco para interpretar los resultados. A la fecha, varios dispositivos serológicos, para inmunoglobulina M (IgM) y G (IgG), están disponibles en el mercado (muchos más están en proceso de desarrollo / certificación) y están siendo aprobadas para su uso en diferentes países 1,2,16.
Los inmunoensayos serológicos se consideran pruebas de tamizaje, más que en pruebas confirmatorias. Debido a que identifican anticuerpos en sangre, plasma o suero de personas, su sensibilidad puede variar según los estadios de la enfermedad. Se conoce que la producción de anticuerpos puede tomar varios días 17, por ejemplo, la IgM contra SARS-CoV-2 puede detectarse, en promedio de 5 a 10 días después del inicio de los síntomas, y la IgG alrededor de 10 días después del inicio de los síntomas (Figura 1) 17. Esto hace que la sensibilidad de las pruebas serológicas sea menor en las etapas iniciales de la enfermedad, y que algunas personas infectadas con el virus puedan tener un resultado negativo (falsos negativos). Sin embargo, la sensibilidad de la prueba aumenta a medida que el cuerpo produce anticuerpos contra el virus, lo que lleva a una reducción de los falsos negativos.
Adicionalmente, las personas que han tenido infecciones previas con otros coronavirus, pero no con SARS-CoV-2, pueden tener un resultado positivo en pruebas serológicas diseñadas para SARS-CoV-2 (falsos positivos). Esto ocurre porque los anticuerpos producidos por la persona contra proteínas virales de los otros coronavirus también pueden unirse a las proteínas del SARS-CoV-2 utilizadas en las pruebas para este virus.
La sensibilidad y especificidad de los inmunoensayos serológicos varían según los kits disponibles en el mercado. Por ejemplo, un estudio muestra que la sensibilidad de la prueba rápida COVID-19 IgM / IgG 18, que identifica simultáneamente IgM / IgG, es del 88,66% y la especificidad del 90,63%, estimadas en un estudio con 397 casos confirmados por PCR y 128 pacientes si infección 18. Los kits de inmunoensayo de flujo lateral rápido desarrollados recientemente también muestran tener alta sensibilidad (97.2%-100%) y especificidad (98-100%) para IgG, pero menor sensibilidad (85-91.8%) y alta especificidad (96% -100%) para IgM 19,21; sin embargo esta información no está respaldada por estudios publicados. Un estudio realizado en Estados Unidos ofrece evidencia de la sensibilidad y especificidad de diferentes kits comerciales22. La información detallada sobre los inmunoensayos serológicos para SARS-CoV-2 puede encontrarse en diferentes repositorios disponibles en internet 1,2 ,16.
A pesar de las limitaciones descritas para los inmunoensayos serológicos, incluir estas pruebas en el arsenal para enfrentar la epidemia, junto con y no en lugar de RT-PCR, es clave y oportuno, especialmente teniendo en cuenta la complejidad de los procedimientos y las limitaciones en el suministro de reactivos para las pruebas de PCR 2. Las pruebas serológicas pueden ayudar a identificar posibles casos de infección para facilitar el aislamiento focalizado preventivo, así como identificar personas con anticuerpos que pueden volver a trabajar o a cuidar / ayudar a otros que necesitan cuidados especiales. Los inmunoensayos serológicos también pueden ser útiles para la vigilancia continua y para hacer estudios sobre la efectividad de vacunas 7. Las personas que son inmunes al virus, que tienen anticuerpos contra el SARS-CoV-2, también podrían proporcionar plasma para tratar a pacientes con sintomatología severa, un tratamiento que puede mejorar los resultados de salud en estos pacientes 23,24.
En conclusión, los protocolos y pruebas diagnósticas proporcionan soluciones para diagnosticar la infección con SARS-CoV-2. Las pruebas diagnósticas son una estrategia clave para reducir la transmisión del virus, no solo en esta pandemia, sino también en las siguientes que puedan originarse. Los países pueden estar mejor preparados para combatir nuevas epidemias si diseñan / obtienen las herramientas adecuadas para la rápida identificación de casos de infección, y para la implementación de acciones de salud pública que puedan minimizar el impacto de estos agentes, altamente transmisibles y letales, en las poblaciones humanas.
REFERENCIAS
1. World Health Organization. Coronavirus disease (COVID-19) technical guidance: Laboratory testing for 2019-nCoV in humans. Available from: https://www.who.int/emergencies/diseases/novel-coronavirus-2019/technical-guidance/laboratory-guidance. 2020. Accessed April 6, 2020. [ Links ]
2. NUS Saw Swee Hock School of Public Health. COVID-19 Science Report: Diagnostics. 2020. Doi: 10.25540/e3y2-aqye. Available from: https://sph.nus.edu.sg/wp-content/uploads/2020/03/COVID-19-Science-Report-Diagnostics-30-Mar.pdf Accessed April 6, 2020. [ Links ]
3. Bai Y, Yao L, Wei T, Tian F, Jin DY, Chen L, et al. Presumed Asymptomatic Carrier Transmission of COVID-19. JAMA. 2020;323(14):1406-1407. doi:10.1001/jama.2020.2565 [ Links ]
4. Huang P, Liu T, Huang L, Liu H, Lei M, Xu W, et al. Use of Chest CT in Combination with Negative RT-PCR Assay for the 2019 Novel Coronavirus but High Clinical Suspicion. Radiology. 2020;295(1):22-23. [ Links ]
5. Xie X, Zhong Z, Zhao W, Zheng C, Wang F, Liu J. Chest CT for Typical 2019-nCoV Pneumonia: Relationship to Negative RT-PCR Testing. Radiology. 2020:200343. [ Links ]
6. Foundation for Innovative New Diagnostics (FIND). SARS-COV-2 diagnostic pipeline. 2020. Available from : https://www.finddx.org/covid-19/pipeline/. Accessed April 06, 2020. [ Links ]
7. Cheng MP, Papenburg J, Desjardins M, Kanjilal S, Quach C, Libman M, et al. Diagnostic Testing for Severe Acute Respiratory Syndrome-Related Coronavirus-2: A Narrative Review. Ann Intern Med. 2020; doi: 10.7326/M20-1301 [ Links ]
8. Kelly-Cirino C, Mazzola LT, Chua A, Oxenford CJ, Van Kerkhove MD. An updated roadmap for MERS-CoV research and product development: focus on diagnostics. BMJ Glob Health. 2019;4(Suppl 2):e001105. [ Links ]
9. Ospina A. Qué pasa con las pruebas del coronavirus en Colombia?. Caracol Radio. 27/03/2020 19:07 COT. Available from: https://caracol.com.co/radio/2020/03/28/salud/1585353870_152960.html Accessed April 4, 2020. [ Links ]
10. Cepheid. Xpert® Xpress SARS-CoV-2. has received FDA Emergency Use Authorization. 2020. Available at: https://www.cepheid.com/coronavirus Accessed April 06, 2020. [ Links ]
11. Abbott press releases. Abbott launches molecular point-of-care test to detect novel coronavirus in as little as five minutes. Available from: https://abbott.mediaroom.com/2020-03-27-Abbott-Launches-Molecular-Point-of-Care-Test-to-Detect-Novel-Coronavirus-in-as-Little-as-Five-Minutes. 2020. Accessed April 06, 2020. [ Links ]
12. Sheridan, C. Fast, portable tests come online to curb coronavirus pandemic. Nature Biotechnology. March 23, 2020. Updated April 7, 2020. Available from: https://www.nature.com/articles/d41587-020-00010-2 Accessed April 13, 2020. [ Links ]
13. Gordis L. Epidemology. Fifth ed. Canada: Elsevier Saunders; 2014. [ Links ]
14. Newsfile. Sona Nanotech Provides a Progress Update on its Covid-19 Antigen Test. Available from: https://www.newsfilecorp.com/release/54361/Sona-Nanotech-Provides-a-Progress-Update-on-its-Covid19-Antigen-Test Accessed: April 13, 2020. [ Links ]
15. Kumar VS. In Vitro Diagnostic Assays for COVID-19: Recent Advances and Emerging Trends. Diagnostics. 2020;10(202):1-7. [ Links ]
16. Australian Government Department of Health; Therapeutic COVID-19 test kits included on the ARTG for legal supply in Australia. Available from: https://www.tga.gov.au/covid-19-test-kits-included-artg-legal-supply-australia Accessed April 07, 2020. [ Links ]
17. Tan W, Lu Y, Zhang J, Wang J, Dan Y, Tan Z, et al. Viral kinetics and antibody responses in patients with COVID-19. Medrxiv. 2020; Preprint. Doi: 10.1101/2020.03.24.20042382. [ Links ]
18. Li Z, Yi Y, Luo X, Xiong N, Liu Y, Li S, et al. Development and clinical application of A rapid IgM-IgG combined antibody test for SARS-CoV-2 infection diagnosis. J Med Virol. 2020; 1-7 doi: 10.1002/jmv.25727. [ Links ]
19. Package Insert. ALLTEST 2019-nCoV IgG/IgM rapid test cassette. Hangzhou, China: Hangzhou ALLTEST Biotech Co., Ltd.; 2020. [ Links ]
20. Aytu BioScience Secures Exclusive U.S. Distribution Agreement for Coronavirus 2019 (COVID-19) Point-of-Care Rapid Test. Available from: https://www.accesswire.com/579898/Aytu-BioScience-Secures-Exclusive-US-Distribution-Agreement-for-Coronavirus-2019-COVID-19-Point-of-Care-Rapid-Test Accessed April 5, 2020. [ Links ]
21. Accu-Tell. COVID-19 IgG/IgM Rapid Test Cassette. Available from: https://www.accubiotech.com/product-covid-19-igg-igm-rapid-test-cassette-(whole-blood-serum-plasma).html Accessed April 06, 2020. [ Links ]
22. Whitman JD, Hiatt J, Mowery CT, Shy BR, Yu R, Yamamoto TN, et al. Test performance evaluation of SARS-CoV-2 serological assays. medRxiv. 2020; 2020.04.25.20074856. doi: 10.1101/2020.04.25.20074856 [ Links ]
23. Shen C, Wang Z, Zhao F, et al. Treatment of 5 Critically Ill Patients With COVID-19 With Convalescent Plasma. JAMA. 2020; 323(16):1582-1589. doi:10.1001/jama.2020.4783 [ Links ]
24. Chen L, Xiong J, Bao L, Shi Y. Convalescent plasma as a potential therapy for COVID-19. Lancet Infect Dis. 2020;20(4):398-400. [ Links ]
Anexo
Anexo 1 Características de una prueba diagnóstica: en este ejemplo, las pruebas serológicas se comparan con PCR, la prueba reina (gold standard).
| PCR | |||
| Positivo | Negativo | ||
| Inmunoensayo serológico | Positivo | a | b |
| Negativo | c | d | |
Sensibilidad: es la capacidad de la prueba para identificar correctamente a aquellos que tienen la enfermedad / infectados. La sensibilidad varía según la etapa de la enfermedad: por ejemplo, puede tardar varios días, después de la infección, el desarrollar anticuerpos contra el virus, por lo tanto, en las primeras etapas de la enfermedad los individuos pueden tener resultados negativos en las pruebas serológicas (falsos negativos). = a/(a+c)
Especificidad: es la capacidad de la prueba para identificar correctamente a aquellos que no tienen la enfermedad / no están infectados. La especificidad se ve afectada por la presencia, en muestras de sangre, de anticuerpos contra proteínas de otros virus que reaccionan de forma cruzada en inmunoensayos serológicos para SARS-CoV-2. = d/(b+d)
Valor predictivo positivo: es la proporción de pacientes con la enfermedad / infectados entre aquellos con un resultado positivo en la prueba. El valor predictivo positivo se ve afectado por la prevalencia de enfermedad / infección en la población. = a/(a+b)
Valor predictivo negativo: es la proporción de pacientes sin enfermedad / no infectados entre aquellos con un resultado negativo en la prueba. El valor predictivo negativo se ve afectado por la prevalencia de enfermedad / infección en la población. = d/(c+d)











 text in
text in