Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Colombia Médica
On-line version ISSN 1657-9534
Colomb. Med. vol.51 no.4 Cali Oct./Dec. 2020 Epub Dec 07, 2020
https://doi.org/10.25100/cm.v51i4.4353
Articulo de revisión
Resucitación en control de daños: REBOA, el cuarto pilar
1 Fundación Valle del Lili. Division of Trauma and Acute Care Surgery, Department of Surgery. Cali, Colombia.
2 Universidad del Valle, Facultad de Salud, Escuela de Medicina. Cali, Colombia.
3 Universidad Icesi, Cali, Colombia.
4 Broward General Level I Trauma Center, Department of Trauma Critical Care, Fort Lauderdale, FL - USA
5 Hospital Universitario del Valle, Division of Trauma and Acute Care Surgery, Department of Surgery. Cali, Colombia.
6 Fundación Valle del Lili, Centro de Investigaciones Clínicas (CIC), Cali, Colombia
7 Centro Médico Imbanaco, Cali, Colombia.
8 Fundación Valle del Lili, Division of Transplant Surgery, Department of Surgery, Cali, Colombia
9 University of California, Department of Surgery Riverside University Health Systems . Riverside , CA , USA
10 Uniformed Services University, F. Edward Hebert School of Medicine, Department of Surgery, Bethesda, Maryland. USA
11 University of Maryland, Department of Surgery, School of Medicine, Baltimore, MD USA.
12 Professor Emeritus Virginia Commonwealth University, Richmond, VA, USA
13 University of Alabama Center for Injury Science, Department of Surgery, Birmingham. AL, USA
La resucitación en control de daños busca combatir la descompensación metabólica del paciente severamente traumatizado mediante tres ejes: la hipotensión permisiva, la resucitación hemostática y la cirugía de control de daños. El objetivo de este artículo es hacer una revisión de la historia de la resucitación en control de daños y la cirugía de control de daños proponiendo un nuevo paradigma basado en los recientes avances de la tecnología endovascular. Un puente ha sido creado entre el manejo prehospitalario y el control del sangrado, descrito antes de la etapa I de la cirugía de control de daños, que es la inclusión y colocación de un REBOA. Esta es una herramienta adicional en el control de la hemorragia y de soporte en la resucitación hemodinámica de los pacientes con trauma severo de tipo cerrado y/o penetrante. Por lo que se propone un nuevo paradigma “El cuarto pilar”: Hipotensión permisiva, resucitación hemostática, cirugía de control de daños y REBOA.
Palabras clave: Cirugía de control de daños; REBOA; resucitación en control de daños; rombo de la muerte
Damage Control Resuscitation (DCR) seeks to combat metabolic decompensation of the severely injured trauma patient by battling on three major fronts: Permissive Hypotension, Hemostatic Resuscitation, and Damage Control Surgery (DCS). The aim of this article is to perform a review of the history of DCR/DCS and to propose a new paradigm that has emerged from the recent advancements in endovascular technology: The Resuscitative Balloon Occlusion of the Aorta (REBOA). Thanks to the advances in technology, a bridge has been created between Pre-hospital Management and the Control of Bleeding described in Stage I of DCS which is the inclusion and placement of a REBOA. We have been able to show that REBOA is not only a tool that aids in the control of hemorrhage, it is also a vital tool in the hemodynamic resuscitation of a severely injured blunt and/or penetrating trauma patient. That is why we propose a new paradigm “The Fourth Pillar”: Permissive Hypotension, Hemostatic Resuscitation, Damage Control Surgery and REBOA.
Keywords: Hemorrhage; Shock; Damage Control Resuscitation; REBOA
Introducción
La cirugía de control de daños es una estrategia en el manejo del paciente con trauma severo que se enfrenta a un desafío metabólico debido a la gravedad de la lesión y la pérdida sanguínea. El principal objetivo quirúrgico de la cirugía de control de daños es ser un puente entre el control de la hemorragia y la recuperación del paciente. El objetivo de este artículo es elaborar un recuento de la historia de la cirugía de control de daños y proponer un nuevo paradigma que surge de los recientes avances en la tecnología endovascular: el balón de resucitación de oclusión aortica (REBOA). El presente artículo es un consenso del grupo de cirugía de Trauma y Emergencias (CTE) de Cali, Colombia conformado por expertos de Hospital Universitario Fundación Valle del Lili y el Hospital Universitario del Valle “Evaristo García”, con la Universidad del Valle y la Universidad Icesi, en colaboración con la Asociación Colombiana de Cirugía y la Sociedad Panamericana de Trauma, en conjunto con especialistas internacionales de EE.UU, que reúne la experiencia de los últimos 30 años en el manejo del trauma, cirugía general y cuidado crítico.
Historia
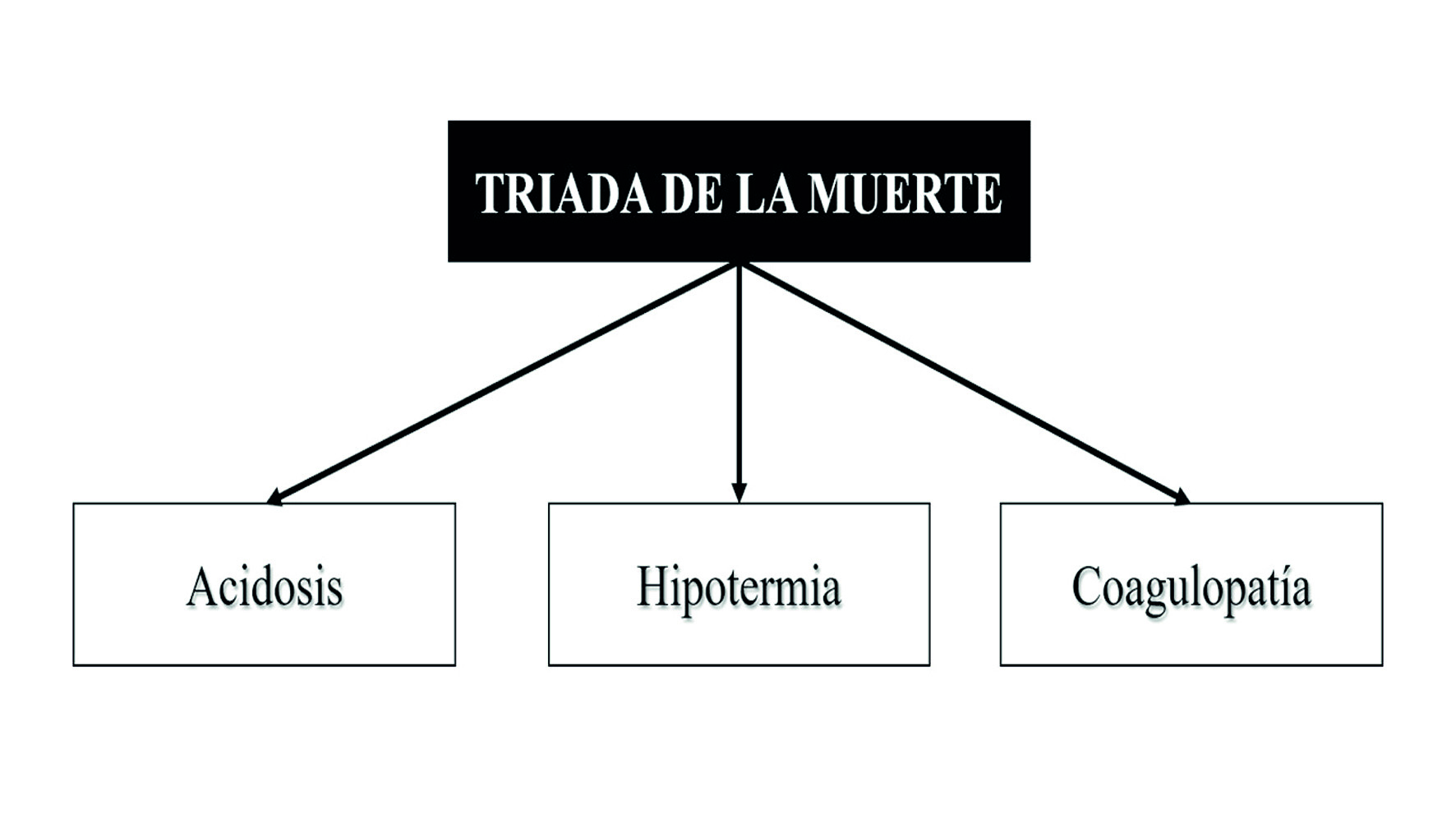
Durante la segunda mitad del siglo XX los cirujanos expuestos al trauma realizaban un manejo agresivo y definitivo que demandaban cirugías largas y reparos anatómicos complejos. Las grandes pérdidas sanguíneas, la reanimación volumétrica masiva y la respuesta inflamatoria desencadenaba una falla metabólica que actualmente se conoce como triada de la muerte: acidosis, hipotermia y coagulopatía (Figura 1).
Sin embargo, experiencias contrarias a esta postura en la década de los años 80’s se implementaron, como lo fue la “laparotomía abreviada” descrita por Stone y colaboradores. Esta consistía en la finalización temprana de la cirugía abdominal y que posteriormente se integró al concepto del “manejo por etapas” 1. El empaquetamiento abdominal y la posibilidad de completar el esfuerzo quirúrgico después de la corrección de la coagulopatía fueron revolucionarios y controversiales a pesar de reportar tasas de supervivencia mayores al 50% 2-6. Rotondo en 1993 acuñó el término “control de daños”, expresión proveniente de la Armada de los EEUU que consiste en la habilidad de absorber y reparar daños en el barco sin interrumpir la misión para luego en puerto realizar las reparaciones definitivas 5. Él aplicó este concepto a un grupo de pacientes con pérdida volumétrica masiva en tres etapas 7:
Etapa I: Control de hemorragia y/o contaminación, empaquetamiento abdominal y cierre temporal rápido
Etapa II: Reanimación y restauración fisiológica.
Etapa III: Reexploración, tratamiento y cierre definitivo.
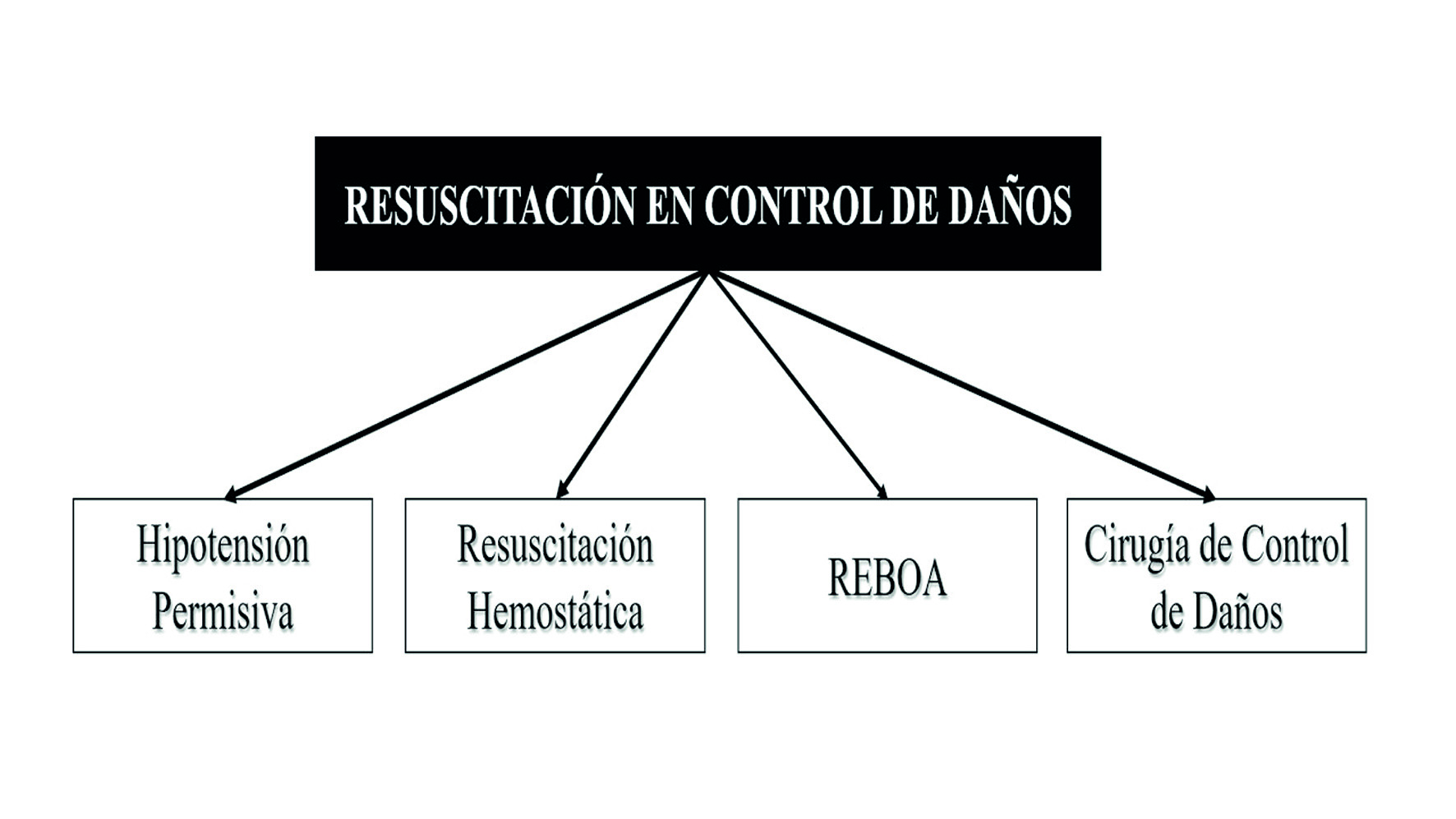
La tasa de supervivencia reportada inicial fue del 58% que permitió una reflexión conceptual de esta aproximación quirúrgica incipiente. Johnson y colaboradores, adicionaron la Etapa 0, también conocida como Ground Zero, donde se incluyó el manejo prehospitalario, la admisión y la decisión temprana de que pacientes requieren control de daños en salas de emergencia 6,8. El abordaje diferido inició una revolución en la cirugía de trauma y se reconoció la importancia del uso equilibrado de la reanimación. Se denominó “Resucitación en Control de Daños” (Damage Control Resuscitation), al cuidado y manejo del paciente que requiere intervención quirúrgica de control de daños previniendo el desarrollo de la triada de la muerte 9,11. La resucitación en control de daños busca combatir la descompensación metabólica desde tres frentes de batalla tradicionalmente descritos: Hipotensión permisiva, Resucitación hemostática y Cirugía de control de daños (Figura 2).
Resucitación en control de daños
Hipotensión permisiva
Consiste en mantener la presión arterial tan baja que minimice la pérdida sanguínea y la remoción de coágulos en el sitio de la hemorragia traumática; pero, lo suficiente para continuar la perfusión de órganos vitales. Cannom y Fraser en 1918 afirmaron que si la presión arterial aumenta antes de que el cirujano esté preparado para controlar la fuente de sangrado, la sangre que es imprescindible puede perderse 10. Este concepto fue practicado y reforzado por Beecher durante la II Guerra Mundial, denominándola “resucitación hipotensiva” con la recomendación de mantener la presión sistólica entre 70 y 80 mmHg antes del reparo quirúrgico 9. Bickel y Mattox describieron en 1994 que la resucitación con bajos volúmenes de cristaloides en combinación con la hipotensión permisiva (presión arterial sistólica entre 70-90 mm Hg) se asoció con una disminución en la mortalidad y en la tasa de complicaciones 12.
Resucitación hemostática
Se ha descubierto que la administración deliberada de cristaloides y paquetes globulares exacerba la coagulopatía en los pacientes con trauma severo y promueve la persistencia del sangrado 13. Actualmente, se recomienda que la restauración volumétrica de la perdida sanguínea debe lograrse por medio de una relación de hemocomponentes 1:1:1:1 de glóbulos rojos, plasma fresco congelado, plaquetas y crioprecipitados 14,15. Esta estrategia ha demostrado disminuir la mortalidad de un 65% a un 19% y de complicaciones como resangrado y sepsis 16,17. Las metas de la resucitación hemostatica son:
Hemoglobina de ≥8g/dL.
Conteo de plaquetas ≥100,000/dL.
Normalización en los tiempos de coagulación (Tromboelastografía / Tromboelastometría rotacional).
Fibrinógeno por encima de 100 mg/dL en sangre circulante.
El concepto militar de la transfusión de sangre total se ha retomado por las Fuerzas Armadas de EEUU en los conflictos en Iraq y Afganistán. A pesar de que en centros de trauma civil ha tenido obstáculos en su implementación debido a dificultades técnicas, logísticas y económicas que este concepto implica para los bancos de sangre civiles 18,19. El grupo de cirugía de trauma y emergencias de Cali - Colombia ha sido pionero para liderar la cruzada en América Latina y en el mundo de que la sangre total contiene los componentes esenciales incluyendo glóbulos rojos, factores de coagulación y plaquetas, que podrían brindar una capacidad hemostática efectiva para suplir las necesidades transfusionales de un paciente con traumatismo severo, disminuir las demandas de hemocomponentes y complicaciones relacionadas a la transfusión masiva 20,21.
El 55% de los pacientes con trauma que llegan al área de urgencias antes de la administración de hemocomponentes presentan hipocalcemia 22. Los hemocomponentes para transfundir se almacenan en los bancos de sangre usando Citrato-Fosfato-Dextrosa-Adenina como anticoagulante. El citrato actúa como quelante del calcio en la unidad transfusional que junto a la respuesta metabólica al trauma puede agravar la hipocalcemia.
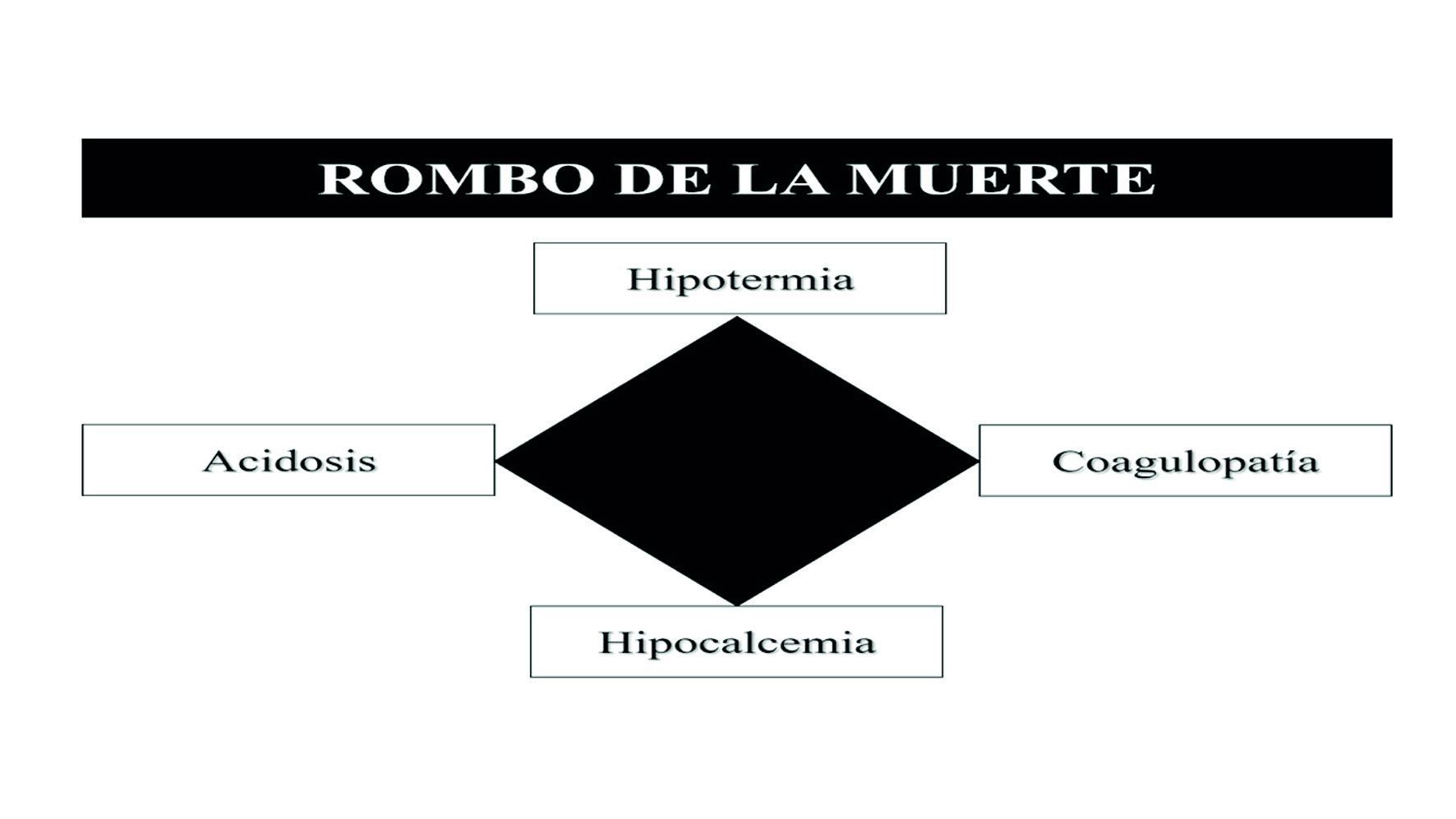
El manejo temprano de la hipocalcemia podría ser de mayor valor de lo que se creía previamente ya que al disminuir los niveles séricos de calcio, la coagulopatía se presenta, persistiendo la hemorragia y conduciendo posiblemente a la muerte. Ditzel y Anderson 23 recientemente han incluido el concepto de la hipocalcemia como un nuevo componente de la clásica triada de la muerte y han propuesto el “Rombo de la muerte” (Figura 3).
Cirugía de control de daños
Principios
La cirugía de control de daños es una estrategia que permite salvaguardar la economía metabólica, pero puede ser perjudicial en aquellos que no cuentan con indicaciones para su desarrollo 24-26. Esta puede ser aplicada en cualquier cavidad del cuerpo comprometida incluyendo tórax, abdomen, pelvis y extremidades. Esta estrategia no es una decisión clínica intraoperatoria, se debe iniciar con una serie de intervenciones simultáneas desde la identificación del paciente en la escena del trauma. Algunos de los criterios de inclusión para realizar control de daños son:
Trauma abdominal penetrante o cerrado con presión arterial sistólica de ingreso menor a 90 mm Hg.
Trauma mayor con una perdida sanguínea estimada superior a 1,200 mL
Incapacidad de controlar el sangrado por presión directa, empaquetamiento de la herida y/o torniquete (Stop the Bleed ®)
Progresión de la acidosis, hipotermia, hipocalcemia y/o coagulopatía.
Estos criterios no son exclusivos del escenario prehospitalario, sino que también puede ser aplicado en la sala de urgencias/trauma y sala de cirugía. Una vez el paciente está bajo el manejo del equipo de trauma, los criterios que pueden indicar la implementación de la cirugía de control de daños son:
Filosofía
La cirugía de control de daños demanda no sólo una articulación de diversos actores en pro de contener la lesión y evitar el avance del rombo de la muerte (acidosis, hipotermia, coagulopatía e hipocalcemia), sino que requiere un completo replanteamiento de todas las partes involucradas. Los cirujanos deben constantemente anticipar las potenciales lesiones por la reperfusión y al mismo tiempo reconocer la demanda metabólica de la víctima de trauma que está luchando por su vida 27. Este cambio de pensamiento es una visión holística hacia el problema que incluye:
Indagar por ayuda cuando lo requiera que indica el buen juicio del cirujano
El manejo quirúrgico definitivo en la primera cirugía no debe ser el objetivo principal. La meta debe ser controlar todas las fuentes de sangrado, la contaminación intestinal y restaurar la fisiología normal.
La cirugía en cuatro etapas debe tener como objetivo prevenir los eventos metabólicos que podrían conducir al paciente a la muerte.
Las Cuatro Etapas de la Cirugía de Control de Daños
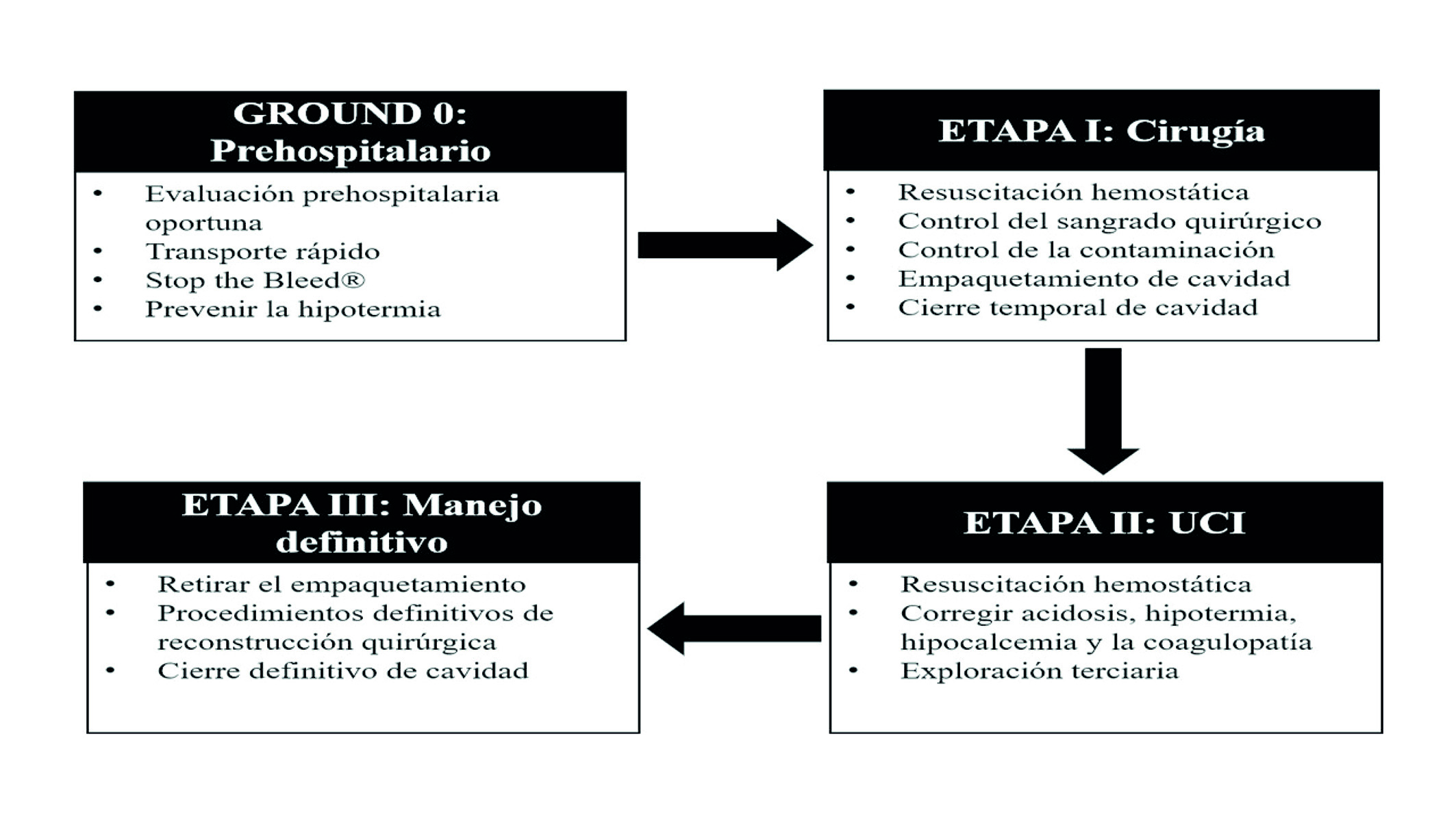
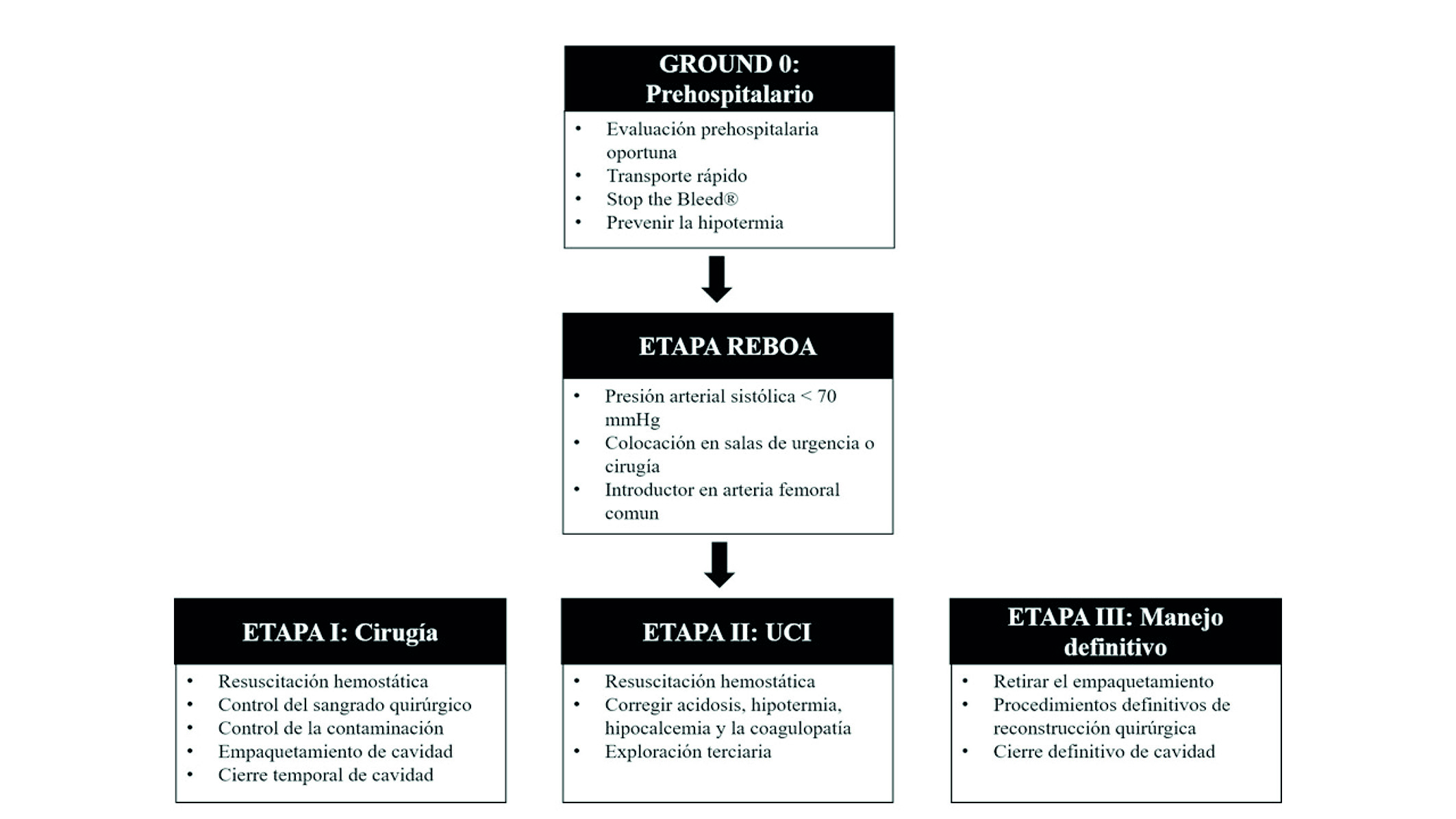
GROUND 0: Manejo prehospitalario
En la escena del trauma se inicia con la evaluación ABCDE propuesta por el American College of Surgeons en el ATLS, reconociendo oportunamente situaciones graves y aplicando el concepto “recoge y corre” que busca lograr un tiempo óptimo de traslado. Se deben aplicar los principios del “Stop the bleed ®” que es una estrategia que ha sido creada por el American College of Surgeons y el Committee on Trauma, que describe el reconocimiento y el control de la hemorragia que amenaza la vida mediante presión directa, empaquetamiento de la herida y/o aplicación de un torniquete. Al ingreso de la sala de urgencias o centro de trauma, un equipo multidisciplinario corrobora la evaluación, establece los pasos a seguir y define si el paciente es candidato para cirugía de control de daños 6. Si es así, la resucitación hemostática se inicia y el paciente es trasladado inmediatamente a salas de cirugía (Figura 4).
ETAPA I: Control del sangrado y la contaminación
En salas de cirugía se inicia un proceso para el control de la lesión. El objetivo de este primer tiempo quirúrgico es controlar las fuentes del sangrado y realizar acciones como el empaquetamiento del lecho cruento, ligadura de vasos, derivaciones temporales y taponamiento con sondas por balón 28-30. Las lesiones de vísceras huecas son manejadas durante la primera intervención quirúrgica y reparadas por medio de procedimientos simples como resección y ligadura de la boca proximal y distal. El cirujano debe ser consciente de que está llevando una carrera contra el tiempo debido al inminente avance del rombo de la muerte sobre el paciente, esto limitará el tiempo quirúrgico entre 60 y 120 minutos 31,32. Un cierre temporal de la cavidad lesionada debe complementarse con un sistema de presión negativa y el paciente debe ser trasladado inmediatamente a Unidad de Cuidado Intensivo (UCI) para recuperación térmica, corrección de la coagulopatía, la hipocalcemia y la acidosis 33.
ETAPA II: Manejo en cuidados intensivos
La recuperación hemodinámica del paciente severamente traumatizado requiere varias medidas que se inician en la sala de urgencias o la sala de cirugía y que son continuadas en la UCI. Estas incluyen la implementación de la resucitación en control de daños con una relación de los hemocomponentes 1:1:1:1 más la adición de ácido tranexámico, calcio, prevención de la hipotermia y un estricto monitoreo hemodinámico 34. Una revisión terciaria del paciente es completada con estudios imagenológicos si se requiere para descartar o asistir el control de lesiones críticas persistentes. Un monitoreo continuo de la presión intraabdominal en la UCI es necesario para evitar el desarrollo de hipertensión abdominal y síndrome compartimental abdominal, inclusive en el paciente con abdomen abierto. Estas medidas contingentes incrementan la supervivencia de los pacientes después de la cirugía de control de daños 35.
ETAPA III: Manejo quirúrgico definitivo
El paciente debe ser llevado de nuevo a salas de cirugía, cuando se han logrado las metas de la resucitación en control de daños. Se realiza el retiro del empaquetamiento, lavado de cavidad, reparo definitivo vascular, de órganos o de vísceras huecas, y el cierre permanente de pared 36. Sin embargo, el regreso a salas de cirugía se puede presentar bajo una situación planeada o por un escenario no esperado, en el cual la inestabilidad hemodinámica persiste debido a un sangrado quirúrgico no controlado, omisión de alguna lesión intestinal o el desarrollo de un síndrome compartimental. El escenario ideal es regresar a la sala de cirugía en un contexto controlado que ocurra entre las primeras 24 a 48 horas, una vez los esfuerzos de resucitación realizados en la UCI hayan restaurado la homeostasis del paciente 31,37.
ETAPA: Balón de resucitación de oclusión aortica (REBOA)
Hasta el momento se ha descrito las clásicas etapas que están asociadas al concepto de cirugía y resucitación en control de daños. Sin embargo, gracias a los avances en la tecnología, un puente ha sido creado entre el manejo prehospitalario y el control del sangrado descrito antes de la etapa I de la cirugía de control de daños, que es la inclusión y colocación de un REBOA 38,39 (Figura 5).
Esta técnica de control endovascular no es reciente, los primeros reportes datan del año de 1954 durante la guerra de Corea 40,41. Pero, el desarrollo de un catéter con balón específico para el control de la hemorragia en escenarios de trauma solo ha ocurrido recientemente, siendo el grupo de cirugía de trauma y emergencias de Cali pionero a nivel internacional en su implementación clínica y fuente de evidencia científica que ha contribuido a su consolidación en el campo de la cirugía de trauma 42,43. A partir de esta experiencia se presentan varias observaciones sobre el uso del REBOA:
1) El REBOA es una herramienta vital en la resucitación hemodinámica, que permite mantener el contenido intravascular volumétrico y que se dirija hacia los órganos vitales como el cerebro y corazón. No es tan solo una herramienta para el control del sangrado 44,45
2) El REBOA es una herramienta dinámica que requiere que su colocación y monitoreo deba ser realizado por un cirujano entrenado 46-48.
3) El REBOA plantea un nuevo cambio de paradigma, en el que después de la evaluación inicial ABCDE propuesta por el ATLS, un introductor debe ser posicionado en la arteria femoral común en la sala de cirugía o el área de trauma. Esto permite realizar un monitoreo en tiempo real de la presión arterial sistólica de un paciente hemodinámicamente inestable y con trauma severo. La indicación de colocar el REBOA (presión arterial sistólica <70 mmHg) es con el objetivo de reducir la lesión celular y la descompensación hemodinámica, por medio, del control de la fuente del sangrado tanto en el trauma cerrado como el penetrante 42,46,49,50.
Así, la descripción clásica de la resucitación de control de daños se le podría adicionar otro componente crucial que interactúa positivamente con los otros tres. Nosotros proponemos un nuevo paradigma “El cuarto pilar”: Hipotensión permisiva, resucitación hemostática, cirugía de control de daños y REBOA (Figura 6). A este punto, nosotros hemos extendido las indicaciones del uso de REBOA y lo hemos aplicado para salvar pacientes con trauma penetrante y cerrado de abdomen y pelvis 40,44, inclusive de tórax que se habia considerado como una contraindicación. Recientes investigaciones han demostrado el éxito del REBOA en el manejo de este tipo de trauma 42,46,51-53. Sin embargo, la implementación del REBOA debe ser en escenarios específicos de pacientes con inestabilidad hemodinámica asociada a una hemorragia persistente no compresible del torso para impedir el arresto cardiaco. No se está promoviendo su uso para todos los pacientes con trauma 54.
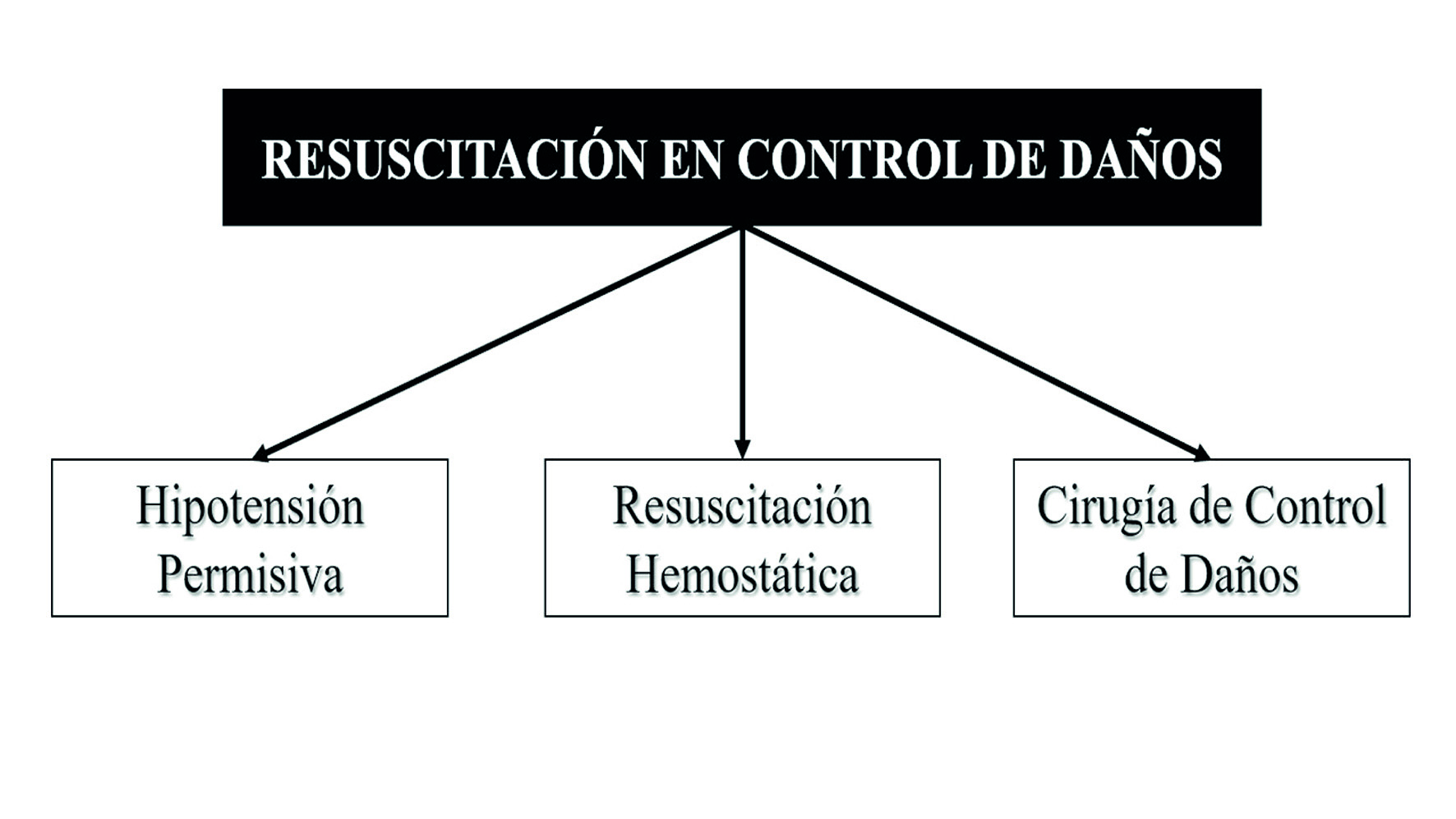
Figura 6 REBOA como un componente integral de resucitación de control de daños /cirugía del control de daños
Finalmente, nosotros somos conscientes que la inclusión de un programa de REBOA como parte de la indumentaria de los equipos de trauma es costoso y requiere una significativa inversión que podría ser excesiva para muchos centros en América Latina y otras partes del mundo, pero creemos que cuando esta tecnología sea accesible para todos, podrían beneficiarse de su uso.
Conclusiones
El desarrollo de los conceptos de la resucitación y la cirugía de control de daños han sido uno de los más importantes avances en la cirugía de trauma. Estos conceptos han sido clásicamente basados en tres pilares fundamentales: hipotensión permisiva, resucitación hemostática y cirugía de control de daños. Nosotros hemos introducido un nuevo cuarto pilar que es la inclusión del balón de resucitación de oclusión aortica (REBOA)
“No hay nada más difícil de emprender, ni más peligrosa conducta, ni incierto en su éxito, que tomar la iniciativa en la introducción de un nuevo orden de las cosas, para el innovador tiene por enemigos a todos aquellos que han hecho bien en el pasado, y los defensores tibios en todos aquellos que pueden hacerlo bien en el futuro”.
Nicolas Maquiavelo, tomado de Kenneth L. Mattox
References
1. Stone HH, Strom PR, Mullins RJ. Management of the major coagulopathy with onset during laparotomy. Ann Surg. 1983; 197:532-5. Doi: 10.1097/00000658-198305000-00005. [ Links ]
2. Carmona RH, Lim RC, Lim RC. The role of packing and planned reoperation in severe hepatic trauma. J Trauma. 1984;24:779-84. Doi: 10.1097/00005373-198409000-00001. [ Links ]
3. Feliciano DV, Mattox KL, Burch JM, Bitondo CG, Jordan GL. Packing for control of hepatic hemorrhage. J Trauma. 1986;26:738-43. doi: 10.1097/00005373-198608000-00010. [ Links ]
4. Krige JEJ, Bornman PC, Terblanche J. Therapeutic perihepatic packing in complex liver trauma. Br J Surg. 1992;79:43-6. doi: 10.1002/bjs.1800790114. [ Links ]
5. Rotondo MF, Zonies DH. The damage control sequence and underlying logic. Surg Clin North Am. 1997;77:761-77. [ Links ]
6. Johnson JW, Gracias VH, Schwab CW, Reilly PM, Kauder DR, Shapiro MB, et al. Evolution in damage control for exsanguinating penetrating abdominal injury. J Trauma. 2001;51:261-71. doi: 10.1097/00005373-200108000-00007. [ Links ]
7. Ferrara A, MacArthur JD, Wright HK, Modlin IM, McMillen MA. Hypothermia and acidosis worsen coagulopathy in the patient requiring massive transfusion. Am J Surg. 1990;160:515-8. doi: 10.1016/S0002-9610(05)81018-9. [ Links ]
8. Timmermans J, Nicol A, Kairinos N, Teijink J, Prins M, Navsaria P. Predicting mortality in damage control surgery for major abdominal trauma. S Afr J Surg. 2010;48:6-9. [ Links ]
9. Beecher H. Preparation of battle casualties for Surgery. Ann Surg. 1945;121:769-92. doi: 10.1097/00000658-194506000-00001. [ Links ]
10. Cannon E. Nature and treatment of wound shock and allied conditions. JAMA. 1918;70:520. doi: 10.1001/jama.1918.02600080022008. [ Links ]
11. Holcomb JB, Jenkins D, Rhee P, Johannigman J, Mahoney P, Mehta S, et al. Damage control resuscitation: Directly addressing the early coagulopathy of trauma. J Trauma. 2007;62:307-10. doi: 10.1097/TA.0b013e3180324124. [ Links ]
12. Bickell WH, Wall MJ, Pepe PE, Martin RR, Ginger VF, Allen MK, et al. Immediate versus Delayed Fluid Resuscitation for Hypotensive Patients with Penetrating Torso Injuries. N Engl J Med. 1994;331:1105-9. doi: 10.1056/NEJM199410273311701. [ Links ]
13. Fox CJ, Gillespie DL, Cox ED, Kragh JF, Mehta SG, Salinas J, et al. Damage control resuscitation for vascular surgery in a combat support hospital. J Trauma. 2008;65:1-9. doi: 10.1097/TA.0b013e318176c533. [ Links ]
14. Cannon JW, Khan MA, Raja AS, Cohen MJ, Como JJ, Cotton BA, et al. Damage control resuscitation in patients with severe traumatic hemorrhage: A practice management guideline from the Eastern Association for the Surgery of Trauma. J Trauma Acute Care Surg. 2017; 82: 605-17. doi: 10.1097/TA.0000000000001333. [ Links ]
15. Holcomb JB, Tilley BC, Baraniuk S, Fox EE, Wade CE, Podbielski JM, et al. Transfusion of plasma, platelets, and red blood cells in a 1:1:1 vs a 1:1:2 ratio and mortality in patients with severe trauma: The PROPPR randomized clinical trial. JAMA. 2015;313:471-82. doi: 10.1001/jama.2015.12. [ Links ]
16. Borgman MA, Spinella PC, Perkins JG, Grathwohl KW, Repine T, Beekley AC, et al. The ratio of blood products transfused affects mortality in patients receiving massive transfusions at a combat support hospital. J Trauma. 2007;63:805-13. doi: 10.1097/TA.0b013e3181271ba3. [ Links ]
17. Sperry JL, Ochoa JB, Gunn SR, Alarcon LH, Minei JP, Cuschieri J, et al. An FFP:PRBC transfusion ratio >/=1:1.5 is associated with a lower risk of mortality after massive transfusion. J Trauma. 2008;65:986-93. doi: 10.1097/TA.0b013e3181878028. [ Links ]
18. Rhee P, Koustova E, Alam HB. Searching for the optimal resuscitation method: Recommendations for the initial fluid resuscitation of combat casualties. J. Trauma. 2003; 54: S52-62. doi: 10.1097/01.TA.0000064507.80390.10. [ Links ]
19. Holcomb JB. Transport time and preoperating room hemostatic interventions are important: Improving outcomes after severe truncal injury. Crit Care Med. 2018;46:447-53. doi: 10.1097/CCM.0000000000002915. [ Links ]
20. Holcomb JB, Jenkins DH. Get ready: whole blood is back and it's good for patients. Transfusion. 2018;58:1821-3. doi: 10.1111/trf.14818. [ Links ]
21. Pivalizza EG, Stephens CT, Sridhar S, Gumbert SD, Rossmann S, Bertholf MF, et al. Whole blood for resuscitation in adult civilian trauma in 2017: A narrative review. Anesth Analg. 2018;127:157-62. doi: 10.1213/ANE.0000000000003427. [ Links ]
22. Giancarelli A, Birrer KL, Alban RF, Hobbs BP, Liu-Deryke X. Hypocalcemia in trauma patients receiving massive transfusion. J Surg Res. 2016;202:182-7. doi: 10.1016/j.jss.2015.12.036. [ Links ]
23. Ditzel RM, Anderson JL, Eisenhart WJ, Rankin CJ, DeFeo DR, Oak S, et al. A review of transfusion- And trauma-induced hypocalcemia: Is it time to change the lethal triad to the lethal diamond? J Trauma Acute Care Surg. 2020;88:434-9. doi: 10.1097/TA.0000000000002570. [ Links ]
24. Asensio JA, Petrone P, Roldán G, Kuncir E, Ramicone E, Chan L. Has evolution in awareness of guidelines for institution of damage control improved outcome in the management of the posttraumatic open abdomen? Arch Surg. 2004;139:209-14; discussion 215. doi: 10.1001/archsurg.139.2.209. [ Links ]
25. Arthurs Z, Kjorstad R, Mullenix P, Rush RM, Sebesta J, Beekley A. The use of damage-control principles for penetrating pelvic battlefield trauma. Am J Surg. 2006;191:604-9. doi: 10.1016/j.amjsurg.2006.02.009. [ Links ]
26. Ferrada R, Birolini D. New concepts in the management of patients with penetrating abdominal wounds. Surg Clin North Am. 1999;79:1331-56. doi: 10.1016/s0039-6109(05)70081-5. [ Links ]
27. Hirshberg A, Mattox KL. Top Knife. Springer; 2011. doi: 10.1007/978-88-470-1741-2. [ Links ]
28. Digiacomo JC, Rotondo MF, Schwab CW. Transcutaneous balloon catheter tamponade for definitive control of subclavian venous injuries. J Trauma. 1994;37:111-3. doi: 10.1097/00005373-199407000-00018. [ Links ]
29. McAnena OJ, Moore EE, Moore FA. Insertion of a retrohepatic vena cava balloon shunt through the saphenofemoral junction. Am J Surg. 1989;158:463-6. doi: 10.1016/0002-9610(89)90288-2. [ Links ]
30. Thomas S V., Dulchavsky SA, Diebel LN. Balloon tamponade for liver injuries: Case report. J Trauma. 1993;34:448-9. doi: 10.1097/00005373-199303000-00026. [ Links ]
31. Sugrue M, Jones F, Janjua KJ, Deane SA, Bristow P, Hillman K. Temporary abdominal closure: a prospective evaluation of its effects on renal and respiratory physiology. J Trauma. 1998;45:914-21. doi: 10.1097/00005373-199811000-00013. [ Links ]
32. Degiannis E, Levy RD, Velmahos GC, Mokoena T, Daponte A, Saadia R. Gunshot injuries of the liver: The Baragwanath experience. Surgery. 1995;117:359-64. doi: 10.1016/S0039-6060(05)80053-4. [ Links ]
33. Allen R, Sarani B. Evaluation and management of intraabdominal hypertension. Curr Opin Crit Care. 2020;26:192-6. doi: 10.1097/MCC.0000000000000701. [ Links ]
34. Abramson D, Scalea TM, Hitchcock R, Trooskin SZ, Henry SM, Greenspan J. Lactate clearance and survival following injury. J Trauma. 1993;35:584-9. doi: 10.1097/00005373-199310000-00014. [ Links ]
35. Maluso P, Olson J, Sarani B. Abdominal Compartment Hypertension and Abdominal Compartment Syndrome. Crit Care Clin. 2016;32:213-22. doi: 10.1016/j.ccc.2015.12.001. [ Links ]
36. Hirshberg A, Mattox KL. Planned reoperation for severe trauma. Ann Surg. 1995;222:3-8. doi: 10.1097/00000658-199507000-00002. [ Links ]
37. Morris JA, Eddy VA, Rutherford EJ. The trauma celiotomy: The evolving concepts of damage control. Curr Probl Surg. 1996;33:609-700. doi: 10.1016/s0011-3840(96)80010-4. [ Links ]
38. Butler FK, Holcomb JB, Shackelford S, Barbabella S, Bailey JA, Baker JB, et al. Advanced Resuscitative Care in Tactical Combat Casualty Care: TCCC Guidelines Change 18-01:14 October 2018. J Spec Oper Med. 2018;18:37-55. [ Links ]
39. Biffl WL, Fox CJ, Moore EE. The role of REBOA in the control of exsanguinating torso hemorrhage. J Trauma Acute Care Surg. 2015;78:1054-8. doi: 10.1097/TA.0000000000000609. [ Links ]
40. Hughes CW. Use of an intra-aortic balloon catheter tamponade for controlling intra-abdominal hemorrhage in man. Surgery. 1954;36:65-8. doi: 10.1097/TA.0000000000000770. [ Links ]
41. Belenkiy SM, Batchinsky AI, Rasmussen TE, Cancio LC. Resuscitative endovascular balloon occlusion of the aorta for hemorrhage control: Past, present, and future. J Trauma Acute Care Surg. 2015;79:S236-42. doi: 10.5555/uri:pii:0039606054902664. [ Links ]
42. Ordoñez CA, Manzano-Nunez R, Rodriguez F, Burbano P, García AF, Naranjo MP, et al. Current use of resuscitative endovascular balloon occlusion of the aorta (REBOA) in trauma. Rev Colomb Anestesiol. 2017;45:30-8. doi: 10.1016/j.rca.2017.07.012. [ Links ]
43. Brenner ML, Moore LJ, DuBose JJ, Tyson GH, McNutt MK, Albarado RP, et al. A clinical series of resuscitative endovascular balloon occlusion of the aorta for hemorrhage control and resuscitation. J Trauma Acute Care Surg. 2013;75:506-11. doi: 10.1097/ta.0b013e31829e5416. [ Links ]
44. Beyer CA, Hoareau GL, Kashtan HW, Wishy AM, Caples C, Spruce M, et al. Resuscitative endovascular balloon occlusion of the aorta (REBOA) in a swine model of hemorrhagic shock and blunt thoracic injury. Eur J Trauma Emerg Surg. 2020; 46(6):1357-1366. doi: 10.1007/s00068-019-01185-3. [ Links ]
45. Beyer CA, Johnson MA, Galante JM, DuBose JJ. Zones matter: Hemodynamic effects of zone 1 vs zone 3 resuscitative endovascular balloon occlusion of the aorta placement in trauma patients. Injury. 2019;50:855-8. doi: 10.1016/j.injury.2019.03.013. [ Links ]
46. Ordoñez CA, Khan M, Cotton B, Perreira B, Brenner M, Ferrada P, et al. The Colombian Experience in Resuscitative Endovascular Balloon Occlusion of the Aorta (REBOA): The Progression from a Large Caliber to a Low-Profile Device at a Level I Trauma Center. Shock. 2020. doi: 10.1097/SHK.0000000000001515. [ Links ]
47. Manzano-Nunez R, Herrera-Escobar JP, DuBose J, Hörer T, Galvagno S, Orlas CP, et al. Could resuscitative endovascular balloon occlusion of the aorta improve survival among severely injured patients with post-intubation hypotension? Eur J Trauma Emerg Surg. 2018;44:527-33. doi: 10.1007/s00068-018-0947-2. [ Links ]
48. Parra MW, Ordoñez CA, Herrera-Escobar JP, Gonzalez-Garcia A, Guben J. Resuscitative endovascular balloon occlusion of the aorta for placenta percreta/previa. J Trauma Acute Care Surg. 2018;84:403-5. doi: 10.1097/TA.0000000000001659. [ Links ]
49. McGreevy DT, Abu-Zidan FM, Sadeghi M, Pirouzram A, Toivola A, Skoog P, et al. Feasibility and Clinical Outcome of Reboa in Patients with Impending Traumatic Cardiac Arrest. Shock. 2019; 54(2):218-223. doi: 10.1097/SHK.0000000000001500. [ Links ]
50. Ordoñez CA, Herrera-Escobar JP, Parra MW, Rodriguez-Ossa PA, Puyana JC, Brenner M. A severe traumatic juxtahepatic blunt venous injury. J Trauma Acute Care Surg. 2016;80:674-6. doi: 10.1097/TA.0000000000000979. [ Links ]
51. García AF, Manzano-Nunez R, Orlas CP, Ruiz-Yucuma J, Londoño A, Salazar C, et al. Association of resuscitative endovascular balloon occlusion of the aorta (REBOA) and mortality in penetrating trauma patients. Eur J Trauma Emerg Surg. 2020. doi: 10.1007/s00068-020-01370-9. [ Links ]
52. Meléndez JJ, Ordóñez CA, Parra M, Orlas CP, Manzano-Núñez R, García AF, et al. Balón de reanimación endovascular de aorta para pacientes en riesgo o en choque hemorrágico: experiencia en un centro de trauma de Latinoamérica. Rev Colomb Cir. 2019:124-31. [ Links ]
53. Ordoñez CA, Rodríguez F, Parra M, Herrera JP, Guzmán-Rodríguez M, Orlas C, et al. Resuscitative endovascular balloon of the aorta is feasible in penetrating chest trauma with major hemorrhage: Proposal of a new institutional deployment algorithm. J Trauma Acute Care Surg. 2020;89:311-9. doi: 10.1097/ta.0000000000002773.. [ Links ]
54. Bulger EM, Perina DG, Qasim Z, Beldowicz B, Brenner M, Guyette F, et al. Clinical use of resuscitative endovascular balloon occlusion of the aorta (REBOA) in civilian trauma systems in the USA, 2019: a joint statement from the American College of Surgeons Committee on Trauma, the American College of Emergency Physicians, the National Association of Emergency Medical Services Physicians and the National Association of Emergency Medical Technicians. Trauma Surg Acute Care Open. 2019;4:e000376. doi: 10.1136/tsaco-2019-000376. [ Links ]











 text in
text in