Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Colombia Médica
On-line version ISSN 1657-9534
Colomb. Med. vol.52 no.1 Cali Jan./Mar. 2021 Epub Feb 15, 2021
https://doi.org/10.25100/cm.v52i1.4542
Articulo original
Evaluación de la cardiotoxicidad temprana asociada al tratamiento con antraciclinas en niños con Leucemia. Estudio prospectivo
1 Universidad Nacional de Colombia, Facultad de Medicina, Departamento de Pediatría, Bogotá, Colombia
2 Fundación Hospital Pediátrico de la Misericordia-HOMI, Oncohematología pediátrica, Bogotá Colombia
3 Fundación Hospital Pediátrico de la Misericordia-HOMI, Cardiología pediátrica, Bogotá Colombia
4 Fundación Hospital Pediátrico de la Misericordia-HOMI, Unidad Cuidado Intensivo pediátrico, Bogotá Colombia
Antecedentes:
Las leucemias son la principal causa de cáncer infantil. Los avances en el tratamiento han llevado a los pacientes a una supervivencia global hasta del 80%. Cerca del 10% de los niños con cáncer tienen toxicidad cardiovascular sintomática, la dosis acumulada de antraciclinas es un factor de riesgo para afección cardíaca.
Objetivo:
Describir la frecuencia de afectación cardíaca temprana en niños con leucemias agudas que recibieron tratamiento antineoplásico.
Métodos:
Estudio prospectivo observacional, de pacientes <18 años con diagnóstico confirmado de leucemia aguda. Fueron evaluados con electrocardiograma, ecocardiograma bidimensional y biomarcadores séricos en diferentes momentos durante el tratamiento.
Resultados:
Se evaluaron 94 pacientes con leucemia linfoide aguda y 18 con leucemia mieloide aguda. 20 pacientes (17.9%) tuvieron disfunción cardiaca de inicio temprano. Se observaron diferencias estadísticamente significativas, después de recibir 150 mg/m2 de antraciclinas, entre la evaluación del ecocardiograma basal y evaluaciones posteriores de la fracción de eyección ventricular izquierda por Teicholz p 0.05, fracción de eyección ventricular izquierda por Simpson p 0.018 y la deformación longitudinal global p 0.004. No se encontraron alteraciones en los niveles séricos de las troponinas y péptido natriurético cerebral.
Conclusiones:
La disfunción cardíaca relacionada con quimioterapia estuvo directamente relacionada con las dosis acumuladas de antraciclinas. En este estudio el uso del ecocardiograma como método de seguimiento permitió identificar factores predictores de riesgo para disfunción cardiaca temprana.
Palabras clave: niño; quimioterapia; toxicidad; biomarcadores; leucemia; ecocardiografía; antraciclinas; disfunción ventricular
Background:
Acute leukemias are the most frequent malignancies in children. Advances in treatment have improved the overall survival to 80%. Almost 10% of children with cancer develop clinical cardiac toxicity. Total anthracycline cumulative dose is a risk factor for early-onset cardiotoxicity.
Objective:
To describe the incidence of early-onset cardiotoxicity in children with acute leukemia treated with chemotherapy.
Methods:
A prospective descriptive study of patients >1 y and <18 years diagnosed with acute leukemia. Assessed with electrocardiograma, echocardiography, and blood biomarkers at diagnosis and during the follow-up.
Results:
94 patients with acute lymphoblastic leukemia and 18 with acute myeloid leukemia were included. 20 patients (17.9%) developed early-onset cardiotoxicity. Statistically significant data was seen after anthracycline dose >150 mg/m2, between the first echocardiographic evaluation and posterior analyses in the left ventricular fraction ejection with Teicholz p 0.05, Simpson p 0.018 and GLS p 0.004. In this study, there was no relation between blood biomarkers and cardiotoxicity.
Conclusions:
Cancer therapeutic-related cardiac dysfunction is related to anthracycline cumulative dose. In this study, echocardiographic follow-up was useful to predict risk factors for early cardiac dysfunction.
Keywords: child; leukemia; anthracyclines; antineoplastic agents; ventricular dysfunction; echocardiography; drug therapy
Contribución del estudio
| 1) ¿Por qué se realizó este estudio? |
| Hay pocos estudios prospectivos sobre la frecuencia de toxicidad cardiaca temprana en niños que reciben quimioterapia y sobre los posibles predictores de esta toxicidad en niños que reciben tratamiento para leucemia aguda. |
| 2) ¿Cuáles fueron los resultados más relevantes del estudio? |
| Motivar la identificación del compromiso cardiovascular como efecto adverso de la quimioterapia en los niños durante el tratamiento de cáncer y promover medidas para mitigarla como el uso de estrategias de protección cardiaca. Es necesario seguir a largo plazo a los supervivientes de leucemias para identificar los efectos cardiovasculares crónicos tardíos. |
| 3¿Qué aportan estos resultados? |
| Motivar la identificación del compromiso cardiovascular como efecto adverso de la quimioterapia en los niños durante el tratamiento de cáncer y promover medidas para mitigarla como el uso de estrategias de protección cardiaca. Es necesario seguir a largo plazo a los supervivientes de leucemias para identificar los efectos cardiovasculares crónicos tardíos. |
Introducción
Las neoplasias hematolinfoides son la principal causa de cáncer infantil en el mundo 1. Los avances en la terapéutica del cáncer pediátrico han llevado a los pacientes a mayor sobrevida global, pero también a un aumento en los efectos adversos derivados de su terapia (2. El porcentaje de niños con cáncer con toxicidad cardiovascular sintomática oscila entre 7-10% (3. El daño celular producido por los antineoplásicos en el músculo cardíaco es bien conocido (4, se estima que los supervivientes de cáncer infantil tienen ocho veces más de riesgo de presentar enfermedades cardiovasculares a lo largo de la vida (5. Altas dosis acumuladas de antraciclinas y la exposición a radioterapia torácica, son los principales factores de riesgo de falla cardíaca, aunque también se han descrito otros desencadenantes como dosis altas de alquilantes, el género femenino, edad inferior a 4 años, tener síndrome de Down y la raza afrodescendiente (6. La toxicidad cardíaca derivada de la terapia contra el cáncer se puede clasificar según el tiempo de aparición en aguda, sí ocurre en la primera semana después de la exposición al agente neoplásico; de inicio temprano, la que se presenta entre una semana y hasta un año después de finalizado el tratamiento antineoplásico y de inicio tardío, aquella que se presenta después de un año de haber terminado el tratamiento (7,8. A pesar de la existencia de guías para la detección y monitorización de enfermedades cardiovasculares en la población adulta (9, para los pacientes con cáncer infantil existen pocos consensos basados en la evidencia o revisiones que den recomendaciones para el diagnóstico y seguimiento de las complicaciones cardiovasculares (10. La ecocardiografía es la principal técnica diagnóstica, para evaluar el desempeño sistólico del ventrículo izquierdo a través de la estimación de su fracción de eyección (FEVI). Otras herramientas utilizadas en la evaluación cardiovascular son los biomarcadores séricos como troponina T, troponina I, péptido natriurético cerebral y el electrocardiograma (7.
En un estudio de supervivencia de una cohorte de niños con leucemia linfoblástica aguda en un centro de referencia de cáncer infantil de Bogotá, se encontró una frecuencia de toxicidad cardíaca grado 3-4 del 26.9% (11. En Colombia existen muy pocos datos acerca de la frecuencia de complicaciones cardiovasculares derivadas de la terapia antineoplásica en niños.
El objetivo principal de este estudio es describir la frecuencia de afectación cardíaca temprana en los niños con leucemias agudas que recibieron tratamiento antineoplásico en un centro de referencia de cáncer infantil. Como objetivos secundarios se busca describir los hallazgos ecocardiográficos y electrocardiográficos y describir el comportamiento de los biomarcadores séricos en el grupo de estudio.
Materiales y Métodos
Estudio prospectivo descriptivo, anidado en una cohorte de pacientes con diagnóstico confirmado de leucemias agudas: leucemia linfoide aguda y leucemia mieloide aguda, mayores de 1 año y menores de 18 años, en el período entre 1 de octubre del 2017 hasta el 31 de marzo del 2019. La selección de los participantes se realizó por muestreo no probabilístico secuencial por conveniencia de pacientes con diagnóstico nuevo de leucemia linfoblástica aguda y leucemia mieloide aguda.
Criterios de inclusión
pacientes mayores de 12 meses y menores de 18 años con diagnóstico nuevo de leucemia linfoblástica aguda y leucemia mieloide aguda realizado en HOMI Fundación Hospital de la Misericordia.
Criterios de exclusión
Pacientes que no iniciaron el tratamiento en HOMI Fundación Hospital Pediátrico de la Misericordia.
Pacientes con diagnóstico de recaída de leucemia linfoblástica aguda o de leucemia mieloide aguda. Paciente con diagnóstico de cardiopatía previo al inicio del tratamiento oncológico. Pacientes quienes no completaran al menos dos evaluaciones. Pacientes cuyos padres no autorizaron su inclusión en el estudio.
Definiciones
Los pacientes, con leucemia linfoblástica aguda fueron clasificados de acuerdo al riesgo en estándar, intermedio y alto. La clasificación de riesgo de leucemia linfoide aguda está basada en el protocolo ALLIC del grupo BFM (Anexo 1) (12.
Disfunción cardiaca relacionada con la terapia para el cáncer: es el descenso de la FEVI por debajo del 53%, mediante la estimación del método de Simpson biplano (13,14.
Deformación longitudinal global (strain): teniendo en cuenta el fabricante del equipo de ecocardiografía utilizado y la literatura disponible se consideró como un valor absoluto normal para todos los grupos de edad una deformación mayor a -20.1% (13,14.
Una disminución del porcentaje de deformación mayor al 15% con respecto al valor basal en el seguimiento se consideró significativa (delta del deformación longitudinal global) (15.
Otras alteraciones cardiovasculares asociadas: enfermedad coronaria, arritmias, derrame pericárdico, insuficiencias valvulares (diferentes a insuficiencia tricuspídea o mitral leves y consideradas como fisiológicas), enfermedad trombo-embólica, hipertensión arterial sistémica (definida como una presión arterial sistólica o diastólica mayor al percentil 95 para la edad, el género y la talla) e hipertensión pulmonar 8 (definida como una estimación ecocardiográfica de una presión sistólica pulmonar mayor o igual a 40 mmHg a partir de la velocidad de regurgitación tricuspide y estimación de presión a nivel de la aurícula derecha en relación al porcentaje de colapso de la vena cava inferior) .
Toxicidad aguda: manifestaciones cardiovasculares que aparecen en la primera semana del tratamiento antineoplásico (7,8.
Toxicidad de inicio temprano: aparición de las manifestaciones cardiovasculares después de la primera semana y hasta el primer año de terminado el tratamiento (7,8.
Alteraciones de los biomarcadores séricos: elevación significativa del BNP por encima de 100 pg/mL, de la TnI con valor superior a 0.05 en ng/L y en la TnT valor por encima de 40 ng/L (16.
Alteraciones en el electrocardiograma: identificar alteraciones en la generación del impulso, en la conducción AV (aurículo-ventricular), en la conducción IV (interventricular) y los trastornos de repolarización (8.
Evaluación de ecocardiografía: la toma y el análisis de los estudios ecocardiográficos fue realizada por dos cardiólogos pediatras con más de 5 años de experiencia en evaluación de pacientes con cáncer infantil realizando adquisiciones sincronizadas con electrocardiograma (5 latidos) para las imágenes en movimiento. Los tres métodos utilizados para evaluar el desempeño sistólico del ventrículo izquierdo fueron la fracción de eyección (FEVI) estimada por el método de Simpson biplano (FEVI(S)), la FEVI estimada por el método de Teicholz (FEVI(T)) y la fracción de acortamiento. Se realizó un análisis de la deformación longitudinal global mediante la técnica de seguimiento de partículas (Speckle tracking).
Para la cuantificación de la fracción de eyección mediante el método de Simpson biplano y el análisis de la deformación longitudinal global se obtuvieron los fotogramas desde la ventana apical en ejes de 4 cámaras, 2 cámaras y tres cámaras. El análisis de las adquisiciones fue realizado con el software del equipo de ecocardiografía Phillips Affinity 70C software versión 1.7.1. Para todos los casos los operadores localizaron en las tres vistas definidas, los puntos basales y el punto apical a analizar permitiendo el reconocimiento automático del endocardio en primera instancia y corrigiendo manualmente la localización del mismo en caso de ser necesario mediante la función de edición.
Para la cuantificación de las fracciones de eyección por el método de Teicholz y fracción de acortamiento se utilizó una imagen estática adquirida desde el eje corto de los ventrículos.
A todos los pacientes se les realizaron evaluaciones de electrocardiograma de 12 derivaciones y ecocardiograma realizado con técnica bidimensional (2D) con equipo Phillips Affinity 70C, transductores 5-1 y 8-3 MHz.
Se realizaron evaluaciones con biomarcadores séricos medidos en sangre venosa periférica o central procesados por inmuno-cromatografía de prueba rápida. Los biomarcadores séricos evaluados fueron péptido natriurético cerebral (BNP), troponina I (TnI) y troponina T (TnT). Los valores de referencia corresponden a la técnica utilizada.
Todas las evaluaciones previamente mencionadas (ecocardiograma, electrocardiograma y biomarcadores) se realizaron previo al inicio de tratamiento y en determinados momentos del tratamiento de leucemia linfoblástica aguda y leucemia mieloide aguda (Figura 1). Para los pacientes con leucemia linfoblástica aguda de alto riesgo el fin de tratamiento se consideraba como la última evaluación al final de la reinducción o la última evaluación antes de ir a trasplante de progenitores hematopoyéticos (TPH); y para los pacientes con leucemia mieloide aguda el fin de tratamiento se consideraba como la última evaluación antes de TPH o la evaluación posterior a tres ciclos de consolidación.
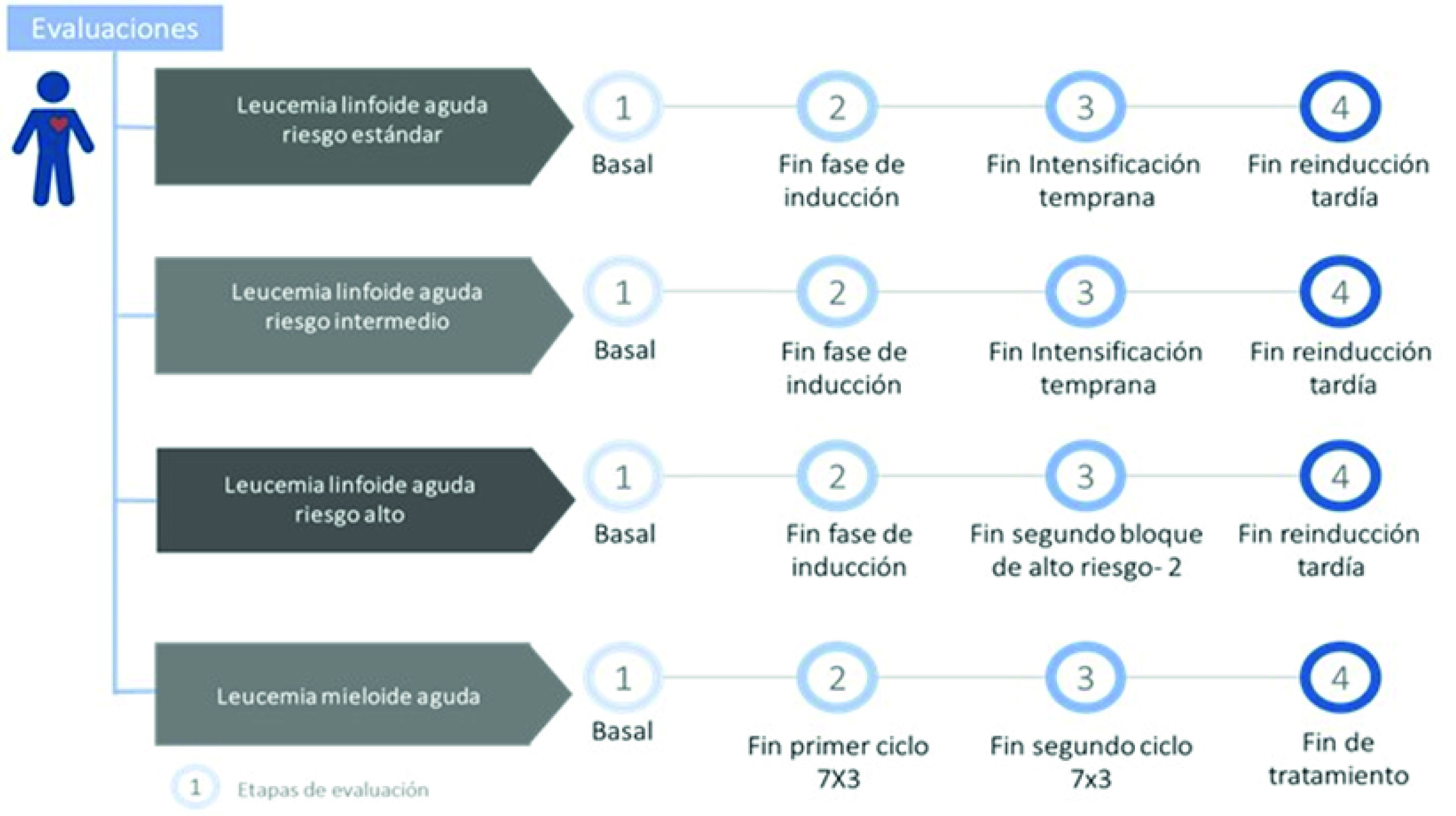
Figura 1 Momentos de evaluaciones con medidas ecocardiográficas, electrocardiograma de 12 derivaciones y con biomarcadores, según patología.
Las dosis acumuladas de antraciclinas por patología fueron convertidas a dosis equivalentes de doxorrubicina, 1 mg de daunorrubicina equivale a 0.833 mg de doxorrubicina (17.
Análisis estadístico
los análisis estadísticos de las variables cuantitativas se realizaron con medidas de tendencia central y de dispersión, medias, desviación estándar o medianas y rangos, según la distribución previo análisis con pruebas de normalidad (Kolmogorov-Smirnov o Shapiro Wilk) para establecer el comportamiento de los datos como paramétricos o no paramétricos; las variables cualitativas se analizaron con la prueba de Chi cuadrado de Pearson y Prueba exacta de Fisher. Los datos de ecocardiografía se analizaron según la dosis acumulada de antraciclinas, en cada grupo de tratamiento se utilizó el test de Wilcoxon para muestras emparejadas no paramétricas. Para el análisis de los marcadores bioquímicos como el BNP, se dividieron los pacientes en dos grupos según la presencia o ausencia de cardiotoxicidad y se analizaron con la prueba de U de Mann-Whitney para muestras independientes no paramétricas. El análisis estadístico fue realizado utilizando el paquete estadístico para ciencias sociales (SPSS) para Windows, versión 25.0. Un valor de p <0.05 fue considerado como significativo.
Aspectos éticos
Este estudio fue catalogado como un proyecto de riesgo mínimo. Se obtuvo consentimiento informado de los padres y asentimiento de cada uno de los pacientes o del responsable legal del paciente si ese fuese el caso. Este protocolo de investigación fue aprobado por el comité de ética institucional, acta 4848 CEI-11-17.
Resultados
Ingresaron 113 pacientes: 94 con leucemia linfoide aguda y 19 con leucemia mieloide aguda. Un paciente con leucemia mieloide aguda fue excluido del estudio porque no tuvo datos de la segunda evaluacion, los resultados corresponden a 112 pacientes. Se analizaron 38 pacientes (33.9%) con leucemia linfoblástica aguda de riesgo alto, 42 (37.5%) de riesgo intermedio, 14 (12.5%) riesgo estándar y 18 pacientes con leucemia mieloide aguda (16.0%). 13 pacientes murieron durante el seguimiento, se tomaron los datos hasta la evaluación previa a la muerte. En la Tabla 1 se describen características demográficas de la población a estudio.
Tabla 1 Características demográficas de la población a estudio.
| VARIABLES | LLA RE | LLA RI | LLA RA | LMA | TOTAL |
|---|---|---|---|---|---|
| Número de pacientes (%) | 14 (12.5%) | 42 (27.5%) | 38 (33.9%) | 18 (16%) | 112 (100%) |
| Edad en años Mediana (rango) | 3.4 (1-6) | 6.6 (1.7-17.2) | 9.4 (1.5-17.7) | 9.0 (1.5-17.0) | 6.35 (1.0- 17.7) |
| Mujeres | 8 (57.1%) | 17 (40.5%) | 13 (34.3%) | 7 (38.9%) | 45 (40.2%) |
| Peso en kilos Mediana (rango) | 12.8 (10.9-25.0) | 20 (10.4-74.0) | 19 (10-73) | 31.5 (10-69) | 20 (10-74) |
| Talla en cm Mediana (rango) | 97 (86-118) | 118.5 (75-180) | 122.5 (83-181) | 129 (70-167) | 114 (70-181) |
| Dosis acumulada de antraciclina mg/m2 | 170 | 220 | 270 | 298 | NA |
LLA: leucemia linfoblástica aguda, RE: riesgo estándar, RI: riesgo intermedio, RA: riesgo alto.
Se presentó una disfunción cardiaca relacionada con la terapia para el cáncer de inicio temprano en 20 pacientes (17.9%), ningún paciente tuvo afección cardiaca aguda.
En los pacientes con leucemia linfoblástica aguda de alto riesgo se presentó toxicidad de inicio temprano con una mediana de 30 días en 4 pacientes, y con 120 mg/m2 acumulados de antraciclinas. Para la tercera evaluación, (final de la intensificación) 8 pacientes tenían cardiotoxicidad temprana, con dosis acumuladas de 150 mg/m2 de antraciclinas. En la última evaluación (final de la reinducción), un acumulado de 11 pacientes tuvieron afección cardíaca con dosis acumuladas de antraciclinas de 270 mg/m2.
Se encontró una disfunción cardiaca relacionada con la terapia para el cáncer en dos pacientes de riesgo intermedio con dosis acumuladas de 220 mg/m2 de doxorrubicina, al final de la reinducción. En el grupo de riesgo estándar ningún paciente tuvo disfunción cardiaca relacionada con la terapia para el cáncer.
En los niños con leucemia mieloide aguda, 7 pacientes tuvieron cardiotoxicidad temprana, 1 de ellos después de 180 mg/m2 acumulados de antraciclinas y 4 pacientes después de 298 mg/m2 de antraciclinas. Para el final del tratamiento 2 pacientes adicionales tuvieron afección cardíaca temprana. El descenso de la FEVI(S) durante el seguimiento, mayor a 10 puntos porcentuales con respecto a la FEVI (S) anterior fue un predictor para cardiotoxicidad en los pacientes con leucemia mieloide aguda con un OR de 42.42 (IC 95%: 4.6-391.0).
Se presentaron hallazgos anormales en el ecocardiograma en 65 pacientes (Tablas 2 y 3).
Tabla 2 Alteraciones cardiovasculares de inicio temprano de acuerdo al tipo de leucemia.
| Descripción de la afección cardíaca | leucemia linfoblástica aguda | leucemia mieloide aguda | TOTAL | ||
|---|---|---|---|---|---|
| Riesgo estándar n: 14 | Riesgo intermedio n: 42 | Riesgo Alto n: 38 | n: 18 | n: 112 | |
| DCRTC (FEVI <53%) | 0 (0%) | 2(1.8%) | 11(9.8%) | 7(6.3%) | 20(17.9%) |
| Alteraciones en el ECG | 1(0.9%) | 16(14.3%) | 9(8.0%) | *5(4.4%) | 31(27.6%) |
| Derrame pericárdico | 2 (1.8%) | 0 | 7(6.3%) | *5(4.5%) | 14(12.5%) |
| Insuficiencia valvular | 0 | 0 | 2(1.8%) | *5(4.5%) | 7 (6.2%) |
| Hipertensión arterial | 2 (1.8%) | 5(4.5%) | 7(6.3%) | 0 | 14 (12.5%) |
| Hipertensión pulmonar | 1 (1.8%) | 5(4.5%) | 9 (8.0%) | 2(1.8%) | 17 (15.1%) |
| Sin hallazgos cardiovasculares anormales | 8 (57.1%) | 9 (21.4%) | 5 (13.1%) | 5(27.7%) | 27 (24.1%) |
* Pueden tener alteraciones electrocardiográficas y ecocardiográficas combinadas o pueden tener alteraciones electrocardiográficas en más de una evaluación. DCRTC: Disfunción cardiaca relacionada con la terapia para el cáncer. ECG: electrocardiograma
Tabla 3 Descripción de los valores de ecocardiografía por tipo de leucemia y momento de evaluación.
| Leucemia linfoblástica aguda de riesgo alto | ||||
|---|---|---|---|---|
| Al diagnóstico (n=38) | Al final de la inducción (n=38) | Al final consolidación (n=30) | Al final de reinducción (n=17) | |
| FEVI (T) mediana (rango) | 66.0 (48-77) | 65.5 (37-73) | 70.5 (65-76) | 64.5 (50-75) |
| FEVI (S) mediana (rango) | 63.5 (46-70) | 54.0 (42-73) | 62.5 (60-65) | 64.7 (53-67) |
| FA mediana (rango) | 36.0 (23-46) | 35.0 (17-41) | 39.0 (34-44) | 34.5 (25-43) |
| TAPSE mediana (rango) | 23 (14-31) | 19 (12-25) | 20 (18-22) | 21 (13-25) |
| GLS mediana (rango) | -22.0 (-30 -18) | -16.6 (-22 -15) | -22.5 (-23 -22) | -24.2 (-26.3,-18.2) |
| Leucemia linfoblástica aguda de riesgo intermedio | ||||
| Al diagnóstico (n=42) | Al final de la inducción (n=41) | Al final consolidación (n=40) | Al final de reinducción (n=36) | |
| FEVI (T) mediana (rango) | 68.5 (54-78) | 68.5 (48-79) | 66.0 (56-74) | 64.5 (46-74) |
| FEVI (S) mediana (rango) | 62.9 (53.8-74.0) | 62.1 (54-71) | 63.0 (54.8-76.0) | 62.1 (48-75) |
| FA mediana (rango) | 37.0 (27-46) | 37.3 (24-46) | 36.0 (29-43) | 34.1 (22-42) |
| TAPSE mediana (rango) | 22.0 (14-33) | 20.0 (13.5-26.0) | 22.0 (15-32) | 21.5 (14-27) |
| GLS mediana (rango) | -24.4 (-30 -18) | -22.5 (-27.5,-17.2) | -23.3 (-31.0 -19.6) | -22.7 (-28.0 ,-17.4) |
| Leucemia linfoblástica aguda de riesgo estándar | ||||
| Al diagnóstico (n=14) | Al final de la inducción (n=14) | Al final consolidación (n=14) | Al final de reinducción (n= 14) | |
| FEVI (T) mediana (rango) | 65.5 (40-74) | 70.0 (57-77) | 65.0 (58-72) | 63.0 (60-72) |
| FEVI (S) mediana (rango) | 60.2 (38-65) | 58.6 (55-63,3) | 60.0 (54.7-67.7) | 59.0 (55.7-67.2) |
| FA mediana (rango) | 34.5 (19-43) | 38.5 (29-44) | 35.0 (30-40) | 33.0 (31-40) |
| TAPSE mediana (rango) | 19.5 (16-23) | 19.0 (16-25) | 20.0 (16-27) | 18.0 (12-23) |
| GLS mediana (rango) | -23.4 (-26.6,-16.8) | -21.3 (-25.9,-16.3) | -24.1 (-26.7,-20.0) | -23.2 (-31,-19) |
| Leucemia mieloide aguda | ||||
| Al diagnóstico n= 18 | Al finalizar 7+3 (1er ciclo) n=18 | Al finalizar 7+3 (2º ciclo) n=18 | Al fin de tratamiento n=16 | |
| FEVI (T) mediana (rango) | 68.0 (64-77) | 68.0 (54-76) | 64.0 (38-70) | 63.0 (43-73) |
| FEVI (S) mediana (rango) | 62.2 (55,5-74,3) | 63.0 (52.2-69.8) | 58.8 (32-71) | 59.9 (41.0-64.4) |
| FA mediana (rango) | 37.0 (34-48) | 38.0 (27-42) | 33.0 (18-38) | 34.0 (21-42) |
| TAPSE mediana (rango) | 22.0 (13-32) | 21.0 (13-31) | 22.0 (14-31) | 21.0 (12-30) |
| GLS mediana (rango) | -21 (-30 -15) | -21.2 (-26.8, -17.4 ) | -21.5 (-27.0,-15.8) | -22.6 (-26.1,-16.1) |
Fuente: tabla de creación propia. FEVI (T): fracción de eyección ventricular izquierda por método Teicholz, FEVI (S): fracción de eyección ventricular izquierda por método Simpson, FA: fracción de acortamiento, TAPSE: desplazamiento sistólico del plano del anillo tricuspídeo, GLS: deformidad longitudinal global.
Las alteraciones más frecuentes del electrocardiograma fueron alteración de la generación de impulso y los trastornos de repolarización (Anexo 2). No se presentaron eventos de tromboembolismo, enfermedad vascular periférica, enfermedad coronaria ni ataque cerebrovascular.
Puede observarse en la Figura 2 cómo la FEVI evaluada con método Simpson, disminuye desde el inicio de tratamiento a medida que se van dando las dosis de acumuladas de antraciclinas. Es significativo con valores >150 mg/m2 acumulado de antraciclinas (Figura 2).
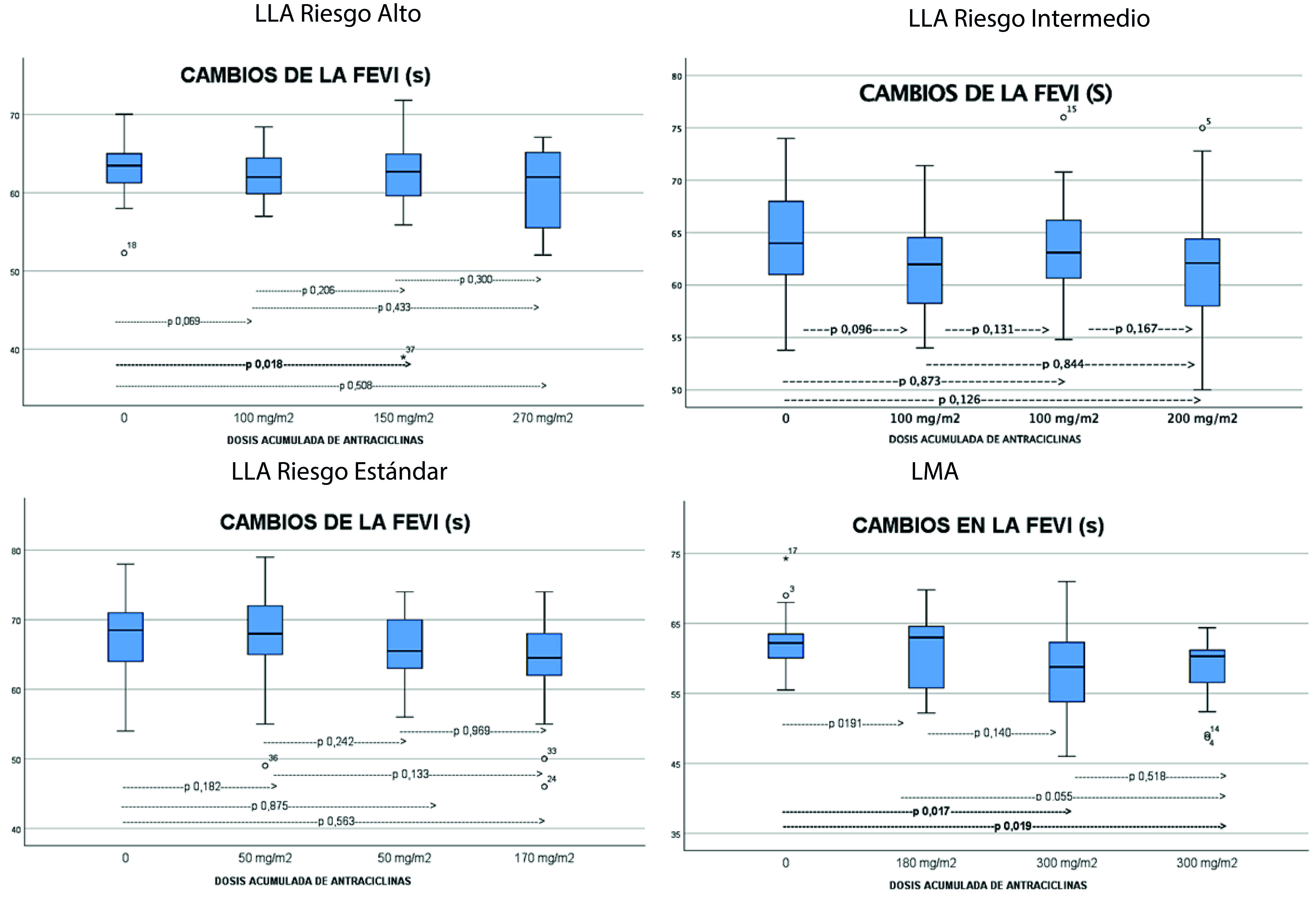
Figura 2 Cambios en la fracción de eyección del ventrículo izquierdo por método de Simpson por tipo de leucemia (evaluada con test de Wilcoxon, diferencias estadísticamente significativas p <0.05). FEVI(s): fracción de eyección ventricular izquierda por método Simpson; LLA: leucemia linfoblástica aguda, LMA: leucemia mieloide aguda
En los pacientes con leucemia de alto riesgo, los factores relacionados con cardiotoxicidad fueron la presencia de hipertensión arterial sistémica en cualquier momento del tratamiento con un OR: 8.57 (IC 95%: 1.35-54.35) p: 0,022, hipertensión pulmonar con un OR: 4.11 (IC 95%: 1.12-15.05) p: 0.038, el delta de la deformación longitudinal global (diferencia de la deformación longitudinal global mayor del 15%) con un OR: 19.5 (IC 95%: 4.57-83.09) p <0.000 y la disminución de la FEVI(S) en más de 10 puntos porcentuales respecto a la evaluación basal por ecocardiograma, con un OR: 56 (IC 95%: 6.31-496) p < 0.000.
Al realizar el análisis por test de Wilcoxon para muestras emparejadas, se observó una diferencia estadísticamente significativa para la FEVI (S) p: 0.018 y para la deformación longitudinal global p: 0.004 entre la evaluación del ecocardiograma basal y la evaluación después de recibir 150 mg/m2 de doxorrubicina.
Análisis de biomarcadores séricos
No se observó relación entre la presencia de compromiso cardiaco y alteración en la TnI ni en la TnT (Anexo 3).
Para la leucemia linfoblástica aguda:
Riesgo estándar: ningún paciente presentó elevación en biomarcadores séricos a lo largo de todas las evaluaciones.
Riesgo intermedio: el 69% de los pacientes con leucemia linfoblástica aguda de riesgo intermedio no tuvieron anormalidad en los biomarcadores séricos. En 12 pacientes (29.3%) se presentó elevación del BNP, 11 posterior a la intensificación y 1 paciente en la evaluación de fin de tratamiento.
En dos pacientes con alteración de los biomarcadores se encontró trastorno de la repolarización asociada, sin manifestaciones ecocardiográficas. En un paciente se encontró elevación en la TnT, en la última evaluación, esta paciente presentó FEVI <53% asintomática.
Riesgo alto: No hubo alteración en TnT o TnI. En 8 pacientes (24.2%) se encontró elevación del BNP >100 pg/mL durante el estudio. Un paciente con elevación de BNP al final de la inducción tenía asociada una infección severa. En el momento de la tercera evaluación (al final del segundo bloque de alto riesgo 2), 3 pacientes presentaron elevación de BNP secundario a miocardiopatía en el contexto clínico de infección, en 2 pacientes se encontró elevación no relacionada a infección. En la última evaluación 2 pacientes tuvieron elevación del BNP, ninguno relacionado con infección o sepsis.
Leucemia mieloide aguda: ningún paciente presentó alteración en la troponina T ni en la Troponina I. En cuanto el BNP, 1 paciente presentó elevación al diagnóstico con recuperación a valores normales durante el seguimiento, 2 presentaron elevación en la tercera evaluación (después del segundo ciclo 7+3) y 3 al finalizar el tratamiento, 1 de ellos persistió con el valor anormal desde la medición anterior.
Discusión
El compromiso cardiovascular es el efecto adverso más frecuente, con deterioro de la calidad y expectativa de vida de los niños que se curan de leucemias agudas 18,19. La metodología prospectiva de este estudio permitió la evaluación en tiempo real de la identificación del compromiso cardiovascular de aparición temprana, existen pocos estudios prospectivos que evalúen esta complicación, un aspecto importante para identificar e informar la toxicidad temprana es la diferencia de tiempos utilizados por los diferentes autores 19,20.
En 13.5% de los pacientes con leucemia linfoblástica aguda de alto riesgo se encontró toxicidad de inicio temprano21, muy similar a lo hallado por Lipschultz et al. (19, quienes encontraron 10% dentro del primer año de exposición a antraciclinas. En este estudio los pacientes con leucemia linfoblástica aguda de alto riesgo tuvieron cardiotoxicidad con dosis acumuladas de 150 mg/m2 de antraciclinas, a una mediana de 99 días, una frecuencia menor a un plazo similar a la informada por Militaru et al. (22, en un estudio prospectivo encontraron caída de la FEVI por debajo de 50% en 28.5% de los niños con leucemia linfoblástica aguda a los tres meses de tratamiento. No es claro porque la diferencia en incidencia de esta afección con un período de evaluación similar. Hay asociación entre la dosis acumulada de antraciclina y cardiomiopatía, se informa mayor probabilidad con dosis acumulada >250 mg/m2, sin embargo, hay evidencia de toxicidad con dosis desde 45 mg/m2 (23,24, durante el seguimiento de esta cohorte ningún paciente presentó toxicidad con dosis menores de 50 mg/m2, por ello la vigilancia ecocardiográfica de los pacientes con mayores dosis de antraciclinas debe ser realizada de forma a lo largo del tratamiento.
En el seguimiento de los supervivientes de cáncer infantil expuestos a antraciclinas, la estimación de la deformación miocárdica y sus cambios a lo largo del tiempo expuestos a quimioterapia, pueden predecir la aparición de disfunción cardiaca relacionada con la terapia para el cáncer 14,25,26. A pesar de la heterogeneidad en los datos con respecto a la edad del paciente, el tipo de cáncer y las técnicas de evaluación utilizadas, un meta-análisis, encontró como los cambios en la deformación miocárdica preceden a los cambios en la FEVI en pacientes expuestos a antraciclinas, incluso con dosis inferiores a las que históricamente se pensaba que eran cardiotóxicas (27. Oikonomou et al. (28, definieron un valor absoluto anormal de la deformación longitudinal global entre -18 y -19% (con plataformas General Electric), punto de corte asociado a Disfunción cardiaca relacionada con la terapia para el cáncer con un OR: 12.27 (IC 95%: 7.73-19.47), esto es similar a lo encontrado en la cohorte de nuestro estudio. La evidencia de las alteraciones en la deformación longitudinal global es fuerte a favor de predecir la disminución posterior de la FEVI a valores diagnósticos de disfunción cardiaca relacionada con la terapia para el cáncer (menor de 53%) y es por esto que guías internacionales han adoptado el concepto de disfunción subclínica del ventrículo izquierdo en aquellos pacientes con una FEVI mayor al 53% pero con un descenso de la deformación longitudinal global (delta del deformación longitudinal global) mayor al 15% con respecto a la evaluación basal 8,14, en nuestro trabajo se encontró que en pacientes con leucemia linfoblástica aguda de riesgo alto con delta de la deformación longitudinal global > 15% tuvieron disfunción cardiaca relacionada con la terapia para el cáncer.
La caída de la FEVI(S) en más de 10 puntos porcentuales, sin que fuera menor de 53%, constituyó el principal factor de riesgo para la disfunción cardiaca relacionada con la terapia para el cáncer en la población aquí analizada, la gran mayoría de los consensos consideran que una reducción de la FEVI entre el 10% al 20% en pacientes asintomáticos, no es un parámetro lo suficientemente sensible para definir disfunción cardiaca (27-29. La identificación temprana de las anormalidades ecocardiográficas descritas (definidas en forma de predictores de disfunción cardiaca relacionada con la terapia para el cáncer), permiten en forma potencial identificar pacientes con mayor riesgo de desarrollar en el tiempo insuficiencia cardiaca. Se podría plantear el uso de medicamentos como los inhibidores de enzima convertidora de angiotensina (IECA), betabloqueadores (30,31 y el uso de cardioprotección (32) en aquellos pacientes con éstos hallazgos ecocardiográficos. En este estudio se comparó la medición la fracción de eyección del ventrículo izquierdo por el método de Teicholz contra el método de Simpson biplano, hallándose que el método de Teicholz sobrestimó la FEVI basal comparado con el método de Simpson biplano, esto se explica por sus asunciones geométricas y su carácter regional y no global en la evaluación de la FEVI (17,30. La mayoría de los consensos recomiendan en ecocardiografía 2D la utilización del método de Simpson biplano, ya que tiene una mejor correlación con el método de elección para la estimación de la FEVI en la actualidad, que es la ecocardiografía 3D (17. Desafortunadamente la utilización del método de Simpson biplano en los centros de oncología pediátrica del país es poca.
No se encontró relación entre los hallazgos de ecocardiograma y electrocardiograma en los pacientes con disfunción cardíaca, similar a lo descrito por Pourier et al. (33, quienes no encontraron asociación entre estas dos pruebas diagnósticas en niños supervivientes de cáncer infantil en un seguimiento a 5 años. Son pocos los estudios en niños que definen las alteraciones electrocardiográficas relacionadas a disfunción cardiaca de inicio temprano; la mayoría de las publicaciones describen los efectos tardíos asociados al uso de antraciclinas (34. Las arritmias son mas frecuentes en adultos sometidos a antineoplásicos con enfermedades cardiovasculares preexistentes, a diferencia de los niños que tienen alteraciones del ritmo transitorias (35.
En este estudio, no se encontró relación con el género femenino y la edad al diagnóstico menor de 4 años, referenciados en la literatura como factores de riesgo para toxicidad cardíaca asociada al uso de antineoplásicos 36-38.
En el grupo de los pacientes con leucemia linfoblástica aguda en quienes se documentó hipertensión arterial sistémica o hipertensión pulmonar en el seguimiento y en los del grupo de leucemia linfoblástica aguda en quienes se encontró hipertensión pulmonar, se registró una incidencia mas alta de toxicidad cardíaca comparado con los pacientes sin estos hallazgos, esta diferencia fue estadísticamente significativa, a diferencia de los informado la literatura sobre la baja asociación de HTA e HTP con toxicidad cardíaca en la población pediátrica (6.
En este estudio no se documentó una diferencia significativa entre alteraciones de los biomarcadores cardiacos evaluados y la aparición de disfunción cardiaca relacionada con la terapia para el cáncer o como predictores de esta, esto contrasta con los hallazgos de la revisión sistemática de la literatura de Dolci et al. (39, quienes encontraron que la elevación de la troponina T podría predecir la aparición disfunción del ventrículo izquierdo hasta tres meses antes de la aparición de manifestaciones clínicas de cardiomiopatía.
No se encontró asociación entre la elevación del BNP y la dosis acumulada de antraciclinas ni con cardiotoxicidad en pacientes con la leucemia linfoblástica aguda; Armenian et al. (40, sugieren el uso del BNP y troponinas en los pacientes sintomáticos y no como predictores de toxicidad.
Una limitante de este estudio es que no todos los pacientes completaron el seguimiento por circunstancias propias de la enfermedad, también la variabilidad entre los equipos y software de ecocardiografía hacen que los resultados encontrados se aplican a los pacientes evaluados con la tecnología y metodología descrita.
Conclusiones
La evaluación y seguimiento cardiovascular integral de los pacientes con leucemias agudas es fundamental, teniendo en cuenta la alta incidencia de alteraciones en este sistema que al corto y largo plazo pueden afectar la calidad de vida y la sobrevida de estos pacientes. En este estudio los principales predictores de riesgo para disfunción cardiaca relacionada con la terapia para el cáncer fueron la caída de la FEVI de 10 puntos porcentuales (a valores no menores de 53%), alteración de la deformación longitudinal global (valor absoluto y delta de la deformación longitudinal global), y la presencia de hipertensión pulmonar y arterial. La identificación oportuna de predictores de disfunción cardiaca en la población pediátrica sometida a terapia contra el cáncer, permite prevenir complicaciones y secuelas.
REFERENCIAS
1. Steliarova-Foucher E, Colombet M, Ries LAG, Moreno F, Dolya A, Bray F, et al. International incidence of childhood cancer, 2001-10: a population-based registry study. Lancet Oncol. 2017;18(6):719-31.Doi: 10.1016/S1470-2045(17)30186-9. [ Links ]
2. Lancellotti P, Nkomo VT, Badano LP, Bergler-Klein J, Bergler J, Bogaert J, et al. Expert consensus for multi-modality imaging evaluation of cardiovascular complications of radiotherapy in adults: a report from the European Association of Cardiovascular Imaging and the American Society of Echocardiography. J Am Soc Echocardiogr. 2013;26(9):1013-32. Doi: 10.1016/j.echo.2013.07.005 [ Links ]
3. Pignatelli RH, Ghazi P, Reddy SC-B, Thompson P, Cui Q, Castro J, et al. Abnormal myocardial strain indices in children receiving anthracycline chemotherapy. Pediatr Cardiol. 2015;36(8):1610-6. Doi: 10.1007/s00246-015-1203-8 [ Links ]
4. Kim H, Kang HJ, Park KD, Koh K-N, Im HJ, Seo JJ, et al. Risk factor analysis for secondary malignancy in dexrazoxane-treated pediatric cancer patients. Cancer Res Treat Off J Korean Cancer Assoc. 2019;51(1):357-67. Doi: 10.4143/crt.2017.457 [ Links ]
5. Tukenova M, Guibout C, Oberlin O, Doyon F, Mousannif A, Haddy N, et al. Role of cancer treatment in long-term overall and cardiovascular mortality after childhood cancer. J Clin Oncol. 2010;28(8):1308-15. Doi: 10.1200/JCO.2008.20.2267 [ Links ]
6. Chow EJ, Chen Y, Kremer LC, Breslow NE, Hudson MM, Armstrong GT, et al. Individual prediction of heart failure among childhood cancer survivors. J Clin Oncol. 2015;33(5):394-402. Doi: 10.1200/JCO.2014.56.1373 [ Links ]
7. Harake D, Franco VI, Henkel JM, Miller TL, Lipshultz SE. Cardiotoxicity in childhood cancer survivors: strategies for prevention and management. Future Cardiol. 2012;8(4):647-70. Doi: 10.2217/fca.12.44 [ Links ]
8. Zamorano JL, Lancellotti P, Rodriguez Muñoz D, Aboyans V, Asteggiano R, Galderisi M, et al. 2016 ESC Position Paper on cancer treatments and cardiovascular toxicity developed under the auspices of the ESC Committee for Practice Guidelines: The Task Force for cancer treatments and cardiovascular toxicity of the European Society of Cardiology (ESC). Eur Heart J. 2016;37(36):2768-801. Doi: 10.1093/eurheartj/ehw211 [ Links ]
9. Yancy CW, Jessup M, Bozkurt B, Butler J, Casey DE, Colvin MM, et al. 2017 ACC/AHA/HFSA focused update of the 2013 ACCF/AHA guideline for the management of heart failure: a report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines and the Heart Failure Society of America. Circulation. 2017;136(6):e137-61. Doi: 10.1161/CIR.0000000000000509 [ Links ]
10. Sieswerda E, Postma A, van Dalen EC, van der Pal HJH, Tissing WJE, Rammeloo LAJ, et al. Late effects of childhood cancer task force of the Dutch Childhood Oncology Group (DCOG LATER). The Dutch Childhood Oncology Group guideline for follow-up of asymptomatic cardiac dysfunction in childhood cancer survivors. Ann Oncol. 2012; 23(8): 2191-2198. Doi: 10.1093/annonc/mdr595 [ Links ]
11. Trujillo ÁM, Linares A, Sarmiento IC, Trujillo ÁM, Linares A, Sarmiento IC. Intensive chemotherapy in children with acute lymphoblastic leukemia. Interim analysis in a referral center in Colombia. Rev Fac Med. 2016;64(3):417-25. Doi: 10.15446/revfacmed.v64n3.53961 [ Links ]
12. Stary J, Zimmermann M, Campbell M, Castillo L, Dibar E, Donska S, et al. Intensive chemotherapy for childhood acute lymphoblastic leukemia: results of the randomized intercontinental trial ALL IC-BFM 2002. J Clin Oncol. 2014;32(3):174-84. [ Links ]
13. Perez IE, Alam CT, Hernandez GA and Sanchassani R. Cancer therapy-related cardiac dysfunction: an overview for the clinician. Clin Med Insights Cardiol. 2019; 13: 1-11. Doi: 10.1177/1179546819866445 [ Links ]
14. Plana JC, Galderisi M, Barac A, Ewer MS, Ky B, Scherrer-Crosbie M, et al. Expert consensus for multimodality imaging evaluation of adult patients during and after cancer therapy: a report from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. J Am Soc Echocardiogr. 2014;27(9):911-39 Doi: 10.1016/j.echo.2014.07.012 [ Links ]
15. Levy PT, Machefsky A, Sanchez AA, Patel MD, Rogal S, Fowler S, et al. Reference ranges of left ventricular strain measures by two-dimensional speckle-tracking echocardiography in children: a systematic review and meta-analysis. J Am Soc Echocardiogr. 2016;29(3):209-225.e6. Doi: 10.1016/j.echo.2015.11.016 [ Links ]
16. Santaló Bel M, Guindo Soldevila J, Ordóñez Llanos J. Marcadores biológicos de necrosis miocárdica. Rev Esp Cardiol. 2003;56(7):703-20. Doi: 10.1016/S0300-8932(03)76942-5 [ Links ]
17. Feijen EAM, Leisenring WM, Stratton KL, Ness KK, van der Pal HJH, van Dalen EC, et al. Derivation of Anthracycline and Anthraquinone equivalence ratios to Doxorubicin for late-onset cardiotoxicity. JAMA Oncol. 2019;5(6):864-71. Doi: 10.1001/jamaoncol.2018.6634 [ Links ]
18. Bansal N, Amdani SM, Hutchins KK, Lipshultz SE. Cardiovascular disease in survivors of childhood cancer. Curr Opin Pediatr. 2018;30(5):628-38. Doi: 10.1097/MOP.0000000000000675 [ Links ]
19. Lipshultz SE, Colan SD, Gelber RD, et al. Late cardiac effects of doxorubicin therapy for acute lymphoblastic leukemia i childhood. N Engl J Med. 1991; 324: 808-815. Doi: 10.1056/NEJM199103213241205 [ Links ]
20. Mavinkurve-Groothuis AM, Marcus KA, Pourier M, Loonen J, Feuth T, Hoogerbrugge PM, et al. Myocardial 2D strain echocardiography and cardiac biomarkers in children during and shortly after anthracycline therapy for acute lymphoblastic leukaemia (ALL): a prospective study. Eur Heart J Cardiovasc Imaging. 2013;14(6):562-9. Doi: 10.1093/ehjci/jes217 [ Links ]
21. Giantris A, Lipshultz S, Abdurrahman L, Hinkle A, Asselin B. Anthracycline-induced cardiotoxicity in children and young adults. Crit Rev Oncol Hematol. 1998;27(1):53-68. Doi: 10.1016/S1040-8428(97)10007-5 [ Links ]
22. Militaru A, Zus S, Cimpean AM, Iurciuc S, Matusz P, Iurciuc M, et al. Early diagnosis of cardiotoxicity in patients undergoing chemotherapy for acute lymphoblastic leukemia. Anticancer Res. 2019;39(6):3255-64. Doi: 10.21873/anticanres.13467 [ Links ]
23. Lipshultz SE, Lipsitz SR, Sallan SE, Dalton VM, Mone SM, Gelber RD, et al. Chronic progressive cardiac dysfunction years after doxorubicin therapy for childhood acute lymphoblastic leukemia. J Clin Oncol Off J Am Soc Clin Oncol. 2005;23(12):2629-36. Doi: 10.1200/JCO.2005.12.121 [ Links ]
24. Leger K, Slone T, Lemler M, Leonard D, Cochran C, Bowman WP, et al. Subclinical cardiotoxicity in childhood cancer survivors exposed to very low dose anthracycline therapy. Pediatr Blood Cancer. 2015;62(1):123-7. Doi: 10.1002/pbc.25206 [ Links ]
25. Mavinkurve-Groothuis AMC, Groot-Loonen J, Marcus KA, Bellersen L, Feuth T, Bökkerink JPM, et al. Myocardial strain and strain rate in monitoring subclinical heart failure in asymptomatic long-term survivors of childhood cancer. Ultrasound Med Biol. 2010;36(11):1783-91. Doi: 10.1016/j.ultrasmedbio.2010.08.001 [ Links ]
26. Motoki H, Koyama J, Nakazawa H, Aizawa K, Kasai H, Izawa A, et al. Torsion analysis in the early detection of anthracycline-mediated cardiomyopathy. Eur Heart J Cardiovasc Imaging. 2012;13(1):95-103. Doi: 10.1093/ejechocard/jer172 [ Links ]
27. Thavendiranathan P, Poulin F, Lim K-D, Plana JC, Woo A, Marwick TH. Use of myocardial strain imaging by echocardiography for the early detection of cardiotoxicity in patients during and after cancer chemotherapy: a systematic review. J Am Coll Cardiol. 2014;63(25 Pt A):2751-68. Doi: 10.1016/j.jacc.2014.01.073 [ Links ]
28. Oikonomou EK, Kokkinidis DG, Kampaktsis PN, Amir EA, Marwick TH, Gupta D, et al. Assessment of prognostic value of left ventricular global longitudinal strain for early prediction of chemotherapy-induced cardiotoxicity: a systematic review and meta-analysis. JAMA Cardiol. 2019;4(10):1007-18. Doi: 10.1001/jamacardio.2019.2952 [ Links ]
29. Curigliano G, Lenihan D, Fradley M, Ganatra S, Barac A, Blaes A, et al. Management of cardiac disease in cancer patients throughout oncological treatment: ESMO consensus recommendations. Ann Oncol Off J Eur Soc Med Oncol. 2020;31(2):171-90 Doi: 10.1016/j.annonc.2019.10.023 [ Links ]
30. Avila MS, Ayub-Ferreira SM, de Barros Wanderley MR, das Dores Cruz F, Gonçalves Brandão SM, Rigaud VOC, et al. Carvedilol for prevention of chemotherapy-related cardiotoxicity: The CECCY Trial. J Am Coll Cardiol. 2018;71(20):2281-90. Doi: 10.1016/j.jacc.2018.02.049 [ Links ]
31. Cardinale D, Colombo A, Sandri MT, Lamantia G, Colombo N, Civelli M, et al. Prevention of high-dose chemotherapy-induced cardiotoxicity in high-risk patients by angiotensin-converting enzyme inhibition. Circulation. 2006;114(23):2474-81. Doi: 10.1161/CIRCULATIONAHA.106.635144 [ Links ]
32. Reichardt P, Tabone M-D, Mora J, Morland B, Jones RL. Risk-benefit of dexrazoxane for preventing anthracycline-related cardiotoxicity: re-evaluating the European labeling. Future Oncol Lond Engl. 2018;14(25):2663-76. Doi: 10.2217/fon-2018-0210 [ Links ]
33. Pourier MS, Mavinkurve-Groothuis AMC, Loonen J, Bökkerink JPM, Roeleveld N, Beer G, et al. Is screening for abnormal ECG patterns justified in long-term follow-up of childhood cancer survivors treated with anthracyclines?. Pediatr Blood Cancer. 2017;64(3). Doi: 10.1002/pbc.26243 [ Links ]
34. Kocabas A, Kardelen F, Ertug H, Aldemir-Kocabas B, Tosun Ö, Yesilipek A, et al. Assessment of early-onset chronic progressive anthracycline cardiotoxicity in children: different response patterns of right and left ventricles. Pediatr Cardiol. 2014;35(1):82-8. Doi: 10.1007/s00246-013-0745-x [ Links ]
35. Bansal N, Blanco JG, Sharma UC, Pokharel S, Shisler S, Lipshultz SE. Cardiovascular diseases in survivors of childhood cancer. Cancer Metastasis Rev. 2020;39(1):55-68. Doi: 10.1007/s10555-020-09859-w [ Links ]
36. Lipshultz SE, Lipsitz SR, Mone SM, Goorin AM, Sallan SE, Sanders SP, et al. Female sex and higher drug dose as risk factors for late cardiotoxic effects of doxorubicin therapy for childhood cancer. N Engl J Med. 1995; 332(26):1738-43. Doi: 10.1056/NEJM199506293322602 [ Links ]
37. Bansal N, Amdani S, Lipshultz ER, Lipshultz SE. Chemotherapy-induced cardiotoxicity in children. Expert Opin Drug Metab Toxicol. 2017;13(8):817-32. Doi: 10.1080/17425255.2017.1351547 [ Links ]
38. Hildebrandt MAT, Reyes M, Wu X, Pu X, Thompson KA, Ma J, et al. Hypertension Susceptibility Loci are Associated with Anthracycline-related Cardiotoxicity in Long-term Childhood Cancer Survivors. Sci Rep. 2017;7(1):9698. Doi: 10.1038/s41598-017-09517-2 [ Links ]
39. Dolci A, Dominici R, Cardinale D, Sandri MT, Panteghini M. Biochemical markers for predicting chemotherapy-induced cardiotoxicity: systematic review of the literature and recommendations for use. G Ital Cardiol. 2006. 2006;7(9):604-11. [ Links ]
40. Armenian SH, Hudson MM, Mulder RL, Chen MH, Constine LS, Dwyer M, et al. Recommendations for cardiomyopathy surveillance for survivors of childhood cancer: a report from the International Late Effects of Childhood Cancer Guideline Harmonization Group. Lancet Oncol. 2015; 16(3): e123-136. Doi: 10.1016/S1470-2045(14)70409-7 [ Links ]
Notas:
Financiación: Este estudio fue financiado con recursos de la Universidad Nacional de Colombia-División de Investigaciones de Bogotá, proyecto Hermes # 37523 y de la Oficina de Investigaciones de la Fundación Hospital de La Misericordia, Bogotá-Colombia.
ANEXOS
Anexo 1 Clasificación de riesgo de pacientes con leucemia linfoide aguda.
| Características | Riesgo estándar | Riesgo intermedio | Riesgo alto |
|---|---|---|---|
| Edad al diagnóstico | >1 año y <6 años | >1 año y <6 años | Cualquier edad |
| Leucocitos al diagnóstico | <20,000/(L | >20,000/(L | Cualquier recuento de leucocitos |
| Respuesta a esteroides al día 15 | Blastos <1,000 /(L | Blastos <1,000 /(L | Blastos >1,000 /(L |
| Enfermedad mínima residual en médula ósea al día 15 | <0.1% | <10% | >10% |
| Médula ósea al día 15 | M1 o M2 | M1 o M2 | M3 |
| Médula ósea al día 33 | M1 | M1 | M2 o M3 |
| Biología molecular | Negativo para t(9:22) (BCR/ABL) ó t(4:11) (MLL/AF4) | Negativo para t(9:22) (BCR/ABL) ó t(4:11) (MLL/AF4) | Positivo para t(9:22) (BCR/ABL) ó t(4:11) (MLL/AF4) ó hipodiploidía < 45 cromosomas |
Fuente: tabla de elaboración propia. M1=<5% blastos por morfología, M2 ≥5% y <25% blastos por morfología, M3 ≥25% blastos por morfología.
Anexo 2 Alteraciones electrocardiográficas encontradas en pacientes con afección de inicio temprano, por tipo de leucemia y etapa de evaluación.
| Al diagnóstico | Al final de la inducción DAA 100 mg/m2 | Final intensificación DAA 150 mg/m2 | Al final de reinducción DAA270 mg/m2 | |
|---|---|---|---|---|
| Leucemia linfoblástica aguda riesgo alto | ||||
| n= 38 | n= 37 | n= 27 | n= 17 | |
| Alteraciones Electrocardiográficas | ||||
| Generación de impulsos | 2 | 1 | 1 | 0 |
| Conducción Intraventricular | 0 | 2 | 2 | 0 |
| Trastornos de repolarización | 2 | 0 | 0 | 3 |
| Arritmias | 0 | S1, Q3, T3. bloqueo AV grado 1 | 0 | 0 |
| Leucemia linfoblástica aguda riesgo intermedio | ||||
| n= 42 | n= 41 | n= 40 | n= 36 | |
| Alteraciones Electrocardiográficas | ||||
| Generación de impulso | 2 | 2 | 1 | 0 |
| Conducción Intraventricular | 2 | 0 | 3 | 4 |
| Trastornos de repolarización | 1 | 0 | 3 | 3 |
| Arritmias | 0 | 2 arritmias: ritmo auricular bajo | 1 bloqueo AV grado 1. 1 sin dato | 1 bloqueo rama derecha. 1 TSV*. 1 trastorno de repolarización |
| Leucemia linfoblástica aguda riesgo estándar | ||||
| n= 14 | n= 14 | n= 13 | n= 13 | |
| Alteraciones Electrocardiográficas | ||||
| Generación de impulsos | 1 | 0 | 0 | 0 |
| Conducción Intraventricular | 0 | 0 | 0 | 0 |
| Trastornos de repolarización | 0 | 1 | 0 | 0 |
| Arritmias | 0 | 1 sin dato | 1 sin dato | 0 |
| Leucemia mieloide aguda | ||||
| n= 18 | Al final 7+3 (1) DAA 149 mg/m2 | Al final 7+3 (2) DAA 149 mg/m2 | Al final de tratamiento DAA 298 mg/m2 | |
| Alteraciones Electrocardiográficas | ||||
| Generación de impulsos | 0 | 1 | 2 | 0 |
| Trastornos de repolarización | 1 | 2 | 0 | 3 |
| Arritmias | 0 | 1 paciente con bloqueo rama derecha | 1 paciente con ritmo auricular bajo | 1 paciente con ritmo auricular bajo |
AV: auriculo ventricular, TSV*: taquicardia supraventricular. DAA: dosis acumuladas de antraciclinas.
Anexo 3 Tabla de resultados de troponinas por tipo de leucemia y etapa de evaluación.
| Al diagnóstico | Al final de la inducción | Al final consolidación | Al final de reinducción | |
|---|---|---|---|---|
| Leucemia linfoblástica aguda riesgo alto | ||||
| n= 38 | n= 37 | n= 27 | n= 17 | |
| Troponina T | ||||
| Menor de 40 | 38 | 37 | 26, 1 paciente 47 | 17 |
| Troponina I | ||||
| Menor de 0,05 | 38 | 37 | 27 | 17 |
| Leucemia linfoblástica aguda riesgo intermedio | ||||
| n= 42 | n= 41 | n= 40 | n= 36 | |
| Troponina T | ||||
| Menor de 40 | 42 | 41 | 40 | 35 1 valor de 200 |
| Troponina I | ||||
| Menor de 0,05 | 42 | 41 | 40 | 36 |
| Leucemia linfoblástica aguda riesgo bajo | ||||
| n= 14 | n= 14 | n= 13 | n= 13 | |
| Troponina T | ||||
| Menor de 40 | 14 | 14 | 13 | 13 |
| Troponina I | ||||
| Menor de 0,05 | 14 | 14 | 13 | 13 |
| Leucemia mieloide aguda | ||||
| Al diagnostico | Al final 7x3 (1) | Al final 7x3 (2) | Al final de tto | |
| Troponina T | ||||
| Menor de 40 | 18 | 18 | 17 | 17 |
| 1 paciente 116 | ||||
| Troponina I | ||||
| >0.05 | 18 | 18 | 17 | 17 |
Recibido: 08 de Septiembre de 2020; Revisado: 22 de Enero de 2021; Aprobado: 10 de Febrero de 2021











 text in
text in 



