Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Colombia Médica
versão On-line ISSN 1657-9534
Colomb. Med. vol.52 no.3 Cali jul./set. 2021 Epub 09-Jun-2021
https://doi.org/10.25100/cm.v52i3.4567
Articulo original
Radiocirugía con arcoterapia volumétrica modulada para el tratamiento de metástasis cerebrales de cáncer de mama: Un estudio monocéntrico.
1 University of Murcia, Faculty of Medicine/Dentistry, Department of Radiology and Physical Medicine, Biomedical Research Institute of Murcia (IMIB-Arrixaca), Murcia, Spain.
2 University Hospital Complex of Cartagena (Santa Lucia University Hospital - Santa María del Rosell University Hospital), Department of Neurology, Murcia, Spain.
3 University Hospital Complex of Cartagena (Santa Lucia University Hospital - Santa María del Rosell University Hospital), Department of Medical Physics and Radiation Protection, Murcia, Spain.
4 University Hospital Complex of Cartagena (Santa Lucia University Hospital - Santa María del Rosell University Hospital), Department of Radiation Oncology, Murcia, Spain.
5 University of Murcia, Faculty of Medicine/Dentistry, Department of Cell Biology and Histology, Biomedical Research Institute of Murcia, Murcia, Spain.
6 Ghana Atomic Energy Commission, Radiological and Medical Sciences Research Institute, Applied Radiation Biology Centre, Legon-Accra, Ghana.
Antecedentes:
La radioterapia holocraneal (WBRT) y la radiocirugía estereotáctica (SRS) son dos modalidades de tratamiento comúnmente empleados para el tratamiento de las metástasis cerebrales (BMs).
Objetivo:
El propósito de este estudio es analizar de forma retrospectiva el control local y la supervivencia de los pacientes con BMs de cáncer de mama (BC) tratados mediante radiocirugía empleando arcoterapia volumétrica modulada (VMAT-RS).
Métodos:
Se analizaron 18 pacientes con 41 BMs de BC tratados mediante VMAT-RS. Se clasificaron según el subtipo molecular de BC y el GPA (Graded Prognostic Assessment) modificado de cáncer de mama. Los pacientes presentaron de 1-4 BMs, las cuales fueron tratadas con 5 arcos VMAT no coplanares. Se analizó la distribución espacial de las BMs, la influencia del status del receptor en la localización de las lesiones y la supervivencia evaluada mediante el modelo de Kaplan-Meier.
Resultados:
La mediana del tiempo de supervivencia (MST) fue de 19.7 meses. Se hallaron diferencias estadísticamente significativas en el MST según el índice de Karnofsky (p= 0.02) y el status de HER2 (p= 0.004), siendo más prolongado en las pacientes HER2+. Por último, nuestros resultados mostraron que el cerebelo es el lugar predominante de las BMs de cáncer de mama, y también sugirieron que las BMs HER2+ presentaban una predilección por algunas estructuras de la circulación posterior, como el cerebelo, el tronco cerebral y los lóbulos occipitales (p= 0.048).
Conclusiones:
VMAT-RS es una técnica con una supervivencia global comparable a otras técnicas de radiocirugía. La situación basal en el momento del tratamiento, el GPA modificado de cáncer de mama así como los subtipos moleculares de cáncer de mama, son factores que influyen de forma significativa en la supervivencia de los pacientes.
Palabras clave: VMAT; radiocirugía estereotáctica; metástasis cerebrales; cáncer de mama; subtipos moleculares; sobrevivencia promedio
Background:
Whole-brain radiation therapy (WBRT) and stereotactic radiosurgery (SRS) are two treatment modalities commonly utilized to treat brain metastases (BMs).
Aim:
The purpose of this study is to analyse retrospectively the local control and survival of patients with BMs of breast cancer (BC) treated via radiosurgery using Volumetric Modulated Arc Therapy (VMAT-RS).
Methods:
18 patients with 41 BMs of BC and treated by VMAT-RS were studied. They were classified according to the molecular subtype of BC and the modified breast graded prognostic assessment -GPA- index. Patients presented 1-4 BMs, which were treated with 5 non-coplanar VMAT arcs. The spatial distribution of BMs, the influence of receptor status on the location of the lesions and survival assessed via the Kaplan-Meier model were analyzed.
Results:
The median survival time (MST) was 19.7 months. Statistically significant differences were determined in the MST according to the Karnofsky performance status (p= 0.02) and the HER2 status (p= 0.004), being more prolonged in the HER2+ patients. Finally, our results showed that the cerebellum is the predominant site of breast cancer BMs, and also suggested that HER2+BMs had a predilection for some structures of the posterior circulation, such as the cerebellum, brainstem and occipital lobes (p= 0.048).
Conclusions:
The VMAT-RS is a technique with an overall survival comparable to other radiosurgery techniques. The baseline situation at the time of treatment, the modified breast-GPA and the molecular subtypes, are factors that significantly influence patient survival.
Keywords: VMAT; stereotactic radiosurgery; brain metastases; breast cancer; molecular subtypes; overall survival
Contribución del estudio
| 1) ¿Por qué se realizó este estudio? |
| Para analizar el control local y la supervivencia de los pacientes con metástasis cerebrales de cáncer de mama tratados con arcoterapia volumétrica modulada, así como los principales factores que influyen en ello (por ejemplo, los subtipos moleculares de cáncer de mama, la situación basal de los pacientes y la localización de las BMs). |
| 2) ¿Cuáles fueron los resultados más relevantes del estudio? |
| Por un lado, nuestros resultados sugieren que la supervivencia de los pacientes con metástasis cerebrales de cáncer de mama tratados con VMAT-RS, es comparable a la de otras técnicas de radiocirugía. Por otro lado, mostraron que el cerebelo es la localización predominante de las metástasis cerebrales de cáncer de mama, y sugirieron que las HER2+ BMs presentan una predilección por algunas estructuras de la circulación posterior, como el cerebelo, el tronco cerebral y los lóbulos occipitales. |
| 3¿Qué aportan estos resultados? |
| Nuestros resultados sugieren que la distribución espacial de las BMs en el sistema nervioso central podrían diferir de acuerdo a la composición genética (subtipo molecular) del cáncer de mama primario, lo cual podría ser de relevancia para la planificación de las diferentes estrategias de tratamiento en el futuro. |
Introducción
En la actualidad, las metástasis cerebrales (BMs) son los tumores intracraneales más frecuentes, presentándose en alrededor del 20-40% de los pacientes con cáncer 1,2. Las BMs en los pacientes suponen un incremento significativo de la morbilidad y la mortalidad 3. Su incidencia ha aumentado en los últimos años debido a la mejora de la calidad de las técnicas de diagnóstico por imagen (por ejemplo, la resonancia magnética -MRI-) y a la mayor eficacia de los regímenes de tratamiento 4-7. El cáncer de mama (BC) representa la segunda causa más común de BMs en pacientes adultos (15-25%) 1,8. Hasta la fecha, se han descrito varios subtipos moleculares de BC con diferencias pronósticas y terapéuticas. Así, sabemos que los pacientes con cáncer de mama con receptor del factor de crecimiento epidérmico humano (HER)2 positivo y con cáncer de mama triple negativo (TNBC) tienen un mayor riesgo de desarrollar BMs en comparación con los subtipos de BC luminal 6,9-11. Según Witzel et al., la frecuencia de metástasis cerebrales entre los pacientes con cáncer de mama metastásico sería HER2-positivo (11-20%), TNBC (25-27%), luminal B (11%) y luminal A (8-15%) 6.
La radioterapia holocraneal (WBRT) y la radiocirugía estereotáctica (SRS) son dos modalidades de tratamiento utilizadas habitualmente para tratar las BMs. Tradicionalmente, el tratamiento radioterapéutico se ha llevado a cabo mediante WBRT, sin embargo, la evidencia reciente ha demostrado el desarrollo potencial de deterioro cognitivo y su impacto en la calidad de vida de algunos de los pacientes tratados 12-14. En este contexto, la SRS ha cobrado una importancia creciente, ya que permite la administración de dosis elevadas de radiación sobre la lesión tumoral con un gradiente de dosis elevado, minimizando los efectos adversos sobre el tejido cerebral sano 15. Actualmente, el uso de la SRS en pacientes con 1-4 BMs está ampliamente aceptado como tratamiento estándar 3, e incluso algunos autores lo extienden como tratamiento alternativo en pacientes con 5-10 BMs 16. Estudios recientes no han encontrado una disminución de la supervivencia global de los pacientes tratados con SRS sola frente a los tratados con SRS más WBRT 11,13,14,17. Entre las modalidades de radiocirugía, Gamma knife (GK-RS) ha sido la más utilizada 18; sin embargo, en la actualidad existen otras modalidades de tratamiento que ofrecen ventajas procedimentales, como, la radiocirugía mediante arcoterapia volumétrica modulada (VMAT-RS).
En este estudio analizamos, por un lado, la respuesta al tratamiento de radiocirugía VMAT en términos de supervivencia global y control local en pacientes con BMs de BC. Por otro lado, analizamos la distribución de las metástasis cerebrales en el sistema nervioso central y la posible influencia del biotipo molecular.
Materiales and Métodos
Cohorte de estudio
Estudio observacional, descriptivo y retrospectivo de serie de casos que incluye todos los pacientes con metástasis cerebrales de cáncer de mama que fueron tratados con VMAT-RS desde octubre de 2012 hasta julio de 2018. Los pacientes fueron tratados en el Departamento de Oncología Radioterápica del Hospital Universitario Santa Lucía (Cartagena, España). Se incluyeron en el estudio los pacientes tratados con SRS en fracción única (single-fraction SRS), así como, los tratados mediante radioterapia estereotáctica fraccionada (fSRS) 11,19. El protocolo experimental fue aprobado por el Comité Ético de Investigación Clínica del Servicio Murciano de Salud de la Comunidad Autónoma de la Región de Murcia (España).
De cada paciente se recogieron datos relativos a la edad, sexo, número de BMs, presencia de metástasis fuera del sistema nervioso central (SNC), terapia local previa y/o posterior de las BMs, tratamientos sistemáticos tras el diagnóstico de metástasis cerebral y características del tumor primario, como el subtipo histológico, el estatus del receptor hormonal (HR) y HER2. El estatus del HR hace referencia a la presencia o ausencia de positividad de los receptores de estrógenos o progesterona. Se recogieron el Karnofsky Performance Status (KPS) y el Eastern Cooperative Oncology Group Performance Status (ECOG score) y se calcularon las puntuaciones modificadas del Breast-Graded Prognostic Assessment 20 para cada paciente (Tabla 1), excepto para una paciente con sarcoma de mama, en la que se calculó el DS-GPA para cáncer de mama 21. El tiempo de supervivencia de cada paciente se calculó desde la fecha de la radiocirugía hasta la fecha de la muerte o del último seguimiento clínico.
Tabla 1 Breast-GPA Score modificado.
| Factor | 0 | 0.5 | 1.0 | 1.5 | 2.0 |
|---|---|---|---|---|---|
| KPS | ≤50 | 60 | 70-80 | 90-100 | - |
| Subtipo BC | TNBC | HR+/HER2- | HR-/HER+ | HR+/HER+ | - |
| Edad, años | >50 | ≤50 | - | - | - |
| Nº of BMs | >3 | 1 a 3 | - | - | - |
BC: cancer de mama, BM: metastasis en cerebro, GPA: Graded prognostic assessment, HER2: human epidermal growth factor receptor 2, HR: hormone receptor, KPS: Karnofsky Performance Status, TNBC: triple-negative breast cancer. Categorías pronósticas: 0-1.0; 1.5-2.0; 2.5-3.0; 3.5-4.0 20,22.
Los pacientes fueron clasificados según el análisis mediante inmunohistoquímica e hibridación fluorescente in situ realizados en el tumor primario, en cuatro subtipos de BC 22: a) HR-/HER2- (cáncer de mama triple negativo, TNBC), b) HR+/HER2-, c) HR+/HER2+ y d) HR-/HER2+. El resumen de las características clínicas, así como, el subtipo molecular del tumor primario de cada paciente se muestra en las Tablas 2 y 3.
Tabla 2 Características clínicas y terapéuticas de los pacientes.
| Características | N. de pacientes | % | |
|---|---|---|---|
| Sexo | Mujer | 18 | 100 |
| Edad en momento de la radiocirugía | ≤50 años | 6 | 33.30 |
| >50 años | 12 | 66.70 | |
| Histología del tumor | Carcinoma ductal | 14 | 77.80 |
| Carcinoma lobulillar | 3 | 16.70 | |
| Sarcoma | 1 | 5.50 | |
| Subtipo molecular | TNBC | 3 | 17.70 |
| HR+/HER2- | 3 | 17.70 | |
| HR-/HER2+ | 4 | 23.50 | |
| HR+/HER2+ | 7 | 41.10 | |
| Número de BMs | 1 | 8 | 44.40 |
| 2 | 6 | 33.30 | |
| 3 | 3 | 16.70 | |
| >3 | 1 | 5.60 | |
| Modified Breast-GPA | 3.5-4 | 4 | 22.20 |
| 2.5-3 | 7 | 38.90 | |
| 1.5-2 | 5 | 27.80 | |
| 0-1 | 2 | 11.10 | |
| KPS | 90-100 | 3 | 16.70 |
| 70-80 | 11 | 61.10 | |
| 60-50 | 4 | 22.20 | |
| Metástasis extracraneales | Sí | 14 | 77.80 |
| No | 4 | 22.20 | |
| Tratamiento previo | Ninguno | 9 | 50 |
| Cirugía | 1 | 5.60 | |
| WBRT | 7 | 38.90 | |
| Ambos | 1 | 5.60 | |
| Tratamiento posterior | Ninguno | 11 | 61.10 |
| Radiocirugía | 3 | 16.70 | |
| WBRT | 1 | 5.60 | |
| Ambos | 3 | 16.70 | |
| Terapia sistémica después de BM | Sí | 17 | 94.4 |
| No | 1 | 5.6 | |
| Tipo de terapia sistémica | Quimioterapia | 16 | 88.9 |
| Terapia hormonal | 6 | 33.3 | |
| Terapia dirigida HER2 | 10 | 55.6 |
Tabla 3 Características clínicas y terapéuticas de las metástasis cerebrales.
| Variable | Parámetro | n | % |
|---|---|---|---|
| Fraccionamiento de tratamiento | SRS en fracción única | 33 | 80.5% |
| SRS fraccionada (fSRS) | 8 | 19.5% | |
| Variable | Parámetro | cc | Cc |
| PTV | Mediana (IQR) | 2.45 | (4.6) |
| Media (SD) | 4.31 | (4.99) | |
| GTV | Mediana (IQR) | 0.6 | (2.3) |
| (BMs de todos los subtipos de BC) | Media (SD) | 1.51 | (2.0) |
| Volumen tumoral total | Mediana (IQR) | 3.15 | (4.1) |
| (SGTV de BMs de BC) | |||
| SGTVHER2+ | Mediana (IQR) | 4.2 | (3.9) |
| SGTVHER2- | Mediana (IQR) | 2.8 | (4.35) |
| Variable | Parámetro | mm | mm |
| Diámetro (F) de la mayor BM | Mediana (IQR) | 16 | (7.7) |
| FHER2+ | Mediana (IQR) | 20 | (10) |
| FHER2- | Mediana (IQR) | 16 | (12) |
| Variable | Parámetro | Gy | Gy |
| Dosis | SRS fracción única Mediana (IQR) | 18 | (4) |
| SRS fraccionada Mediana (IQR) | 30 | (0) | |
| Variable | Parámetro | min | min |
| Tiempo de procedimiento | Global Mediana (IQR) | 26 | (14) |
| Un isocentro Mediana (IQR) | 24.5 | (7) | |
| Dos isocentros Mediana (rango) | 48 | (13) | |
GTV: gross tumour volume, PTV: planning target volume.
Características clínicas y radioterapéuticas de las metástasis cerebrales
Para cada metástasis se analizaron la localización anatómica en el SNC, el diámetro pret-ratamiento, el diámetro post-tratamiento (tanto en el primer como en el segundo control de neuroimagen), el GTV (gross tumour volume), el PTV (planning target volume), la dosis planificada, el esquema de fraccionamiento de la dosis, el tiempo hasta el control de neuroimagen y la respuesta al tratamiento. Las dosis prescritas de los tratamientos fueron de 12-20 Gy para las BMs tratadas mediante SRS; 30-35 Gy para las tratadas mediante fSRS y administrados con esquemas de 5-6 fracciones. La dosis de tratamiento prescrita para la WBRT fue de 30 Gy en 10 fracciones. Como regla general, para los pacientes que recibieron previamente WBRT, la dosis prescrita fue de 12 a 15 Gy, mientras que para el resto, la dosis prescrita estuvo entre 16 y 20 Gy (Tabla 2). No obstante, la fSRS se realizó en las metástasis localizadas cerca del tronco cerebral o de los nervios ópticos, o en aquellas de más de 35-40 mm de diámetro.
La evaluación de la respuesta tumoral fue realizada mediante RM con contraste (secuencias T1) de acuerdo a los criterios mRECIST 23,24. El grosor del corte de las imágenes fue de 1 mm. Los pacientes se clasificaron según las cuatro posibilidades siguientes: respuesta completa (CR), respuesta parcial (PR), progresión de enfermedad (PE) y enfermedad estable (SD). En los pacientes con más de una BM, el control local se evaluó de forma individual.
Características de la técnica de tratamiento.
Todos los pacientes fueron tratados con una técnica VMAT consistente en 5 arcos no coplanares y rayos-X de 6 MV, empleando una técnica rotacional optimizada (rotaciones del gantry y de la camilla) para evitar la colisión entre el gantry y el paciente y, al mismo tiempo, minimizar el tiempo de tratamiento, según un estudio previo 15 (Figura 1). También se incluyeron pacientes tratados con esquemas de tratamiento fraccionado (fSRS). Así, mientras que la planificación tenía como objetivo una isodosis del 100% de la dosis prescrita para cubrir al menos el 99% del PTV y el 100% del GTV para los tratamientos mediante SRS en fracción única, los pacientes tratados con fSRS recibieron una dosis del 98% del PTV y del 98% del GTV. Se analizó la duración de cada procedimiento de SRS en fracción única. Se anotó el número de pacientes que requirieron una tomografía computarizada de haz cónico (CBCT, por sus siglas en inglés) adicional y el número de isocentros utilizados en cada tratamiento.

Figura 1 Ejemplo de planificación de un paciente con dos metástasis cerebrales, tratado con 18 Gy. Las imágenes B, C y D, representan las rotaciones del plano axial, coronal y sagital respectivamente. Contorno del PTV en rojo, isodosis de 12 Gy en verde, isodosis de 9 Gy en azul claro y 4.5 Gy en azul oscuro. La isodosis de 18 Gy no se muestra porque prácticamente coincide con el contorno del PTV y, de lo contrario, dificultaría la visualización.
Análisis estadístico
El análisis estadístico fue realizado mediante IBM SPSS versión 25 (IBM, Nueva York, USA) para Mac. Las curvas de supervivencia fueron realizadas empleando el modelo de Kaplan-Meier. La supervivencia global fue calculad desde la primera SRS. El test no paramétrico log-rank fue aplicado para determinar si existían diferencias en la supervivencia entre los subgrupos de pacientes en función de las siguientes variables: grupos KPS, ECOG, clase de GPA modificado de mama, subtipos moleculares de cáncer de mama, número de BMs, presencia de alguna metástasis cerebral infratentorial y volumen lesional total. El test U de Mann-Whitney fue empleado para comparar los diámetros de las BMs de mayor tamaño y el GTV total de acuerdo a los diferentes subtipos moleculares de cáncer de mama. El test de la chi-cuadrado y el test exacto de Fisher fueron empleados para comparar los datos de las variables categóricas. Las diferencias significativas fueron alcanzadas cuando el valor de p fuera menor que 0.05 (p <0.05).
Resultados
Pacientes
Los 18 pacientes estudiados eran todos mujeres con BMs de BC y tratadas mediante VMAT-RS. El total de metástasis tratadas fue de 41, y la mediana del número de BMs por paciente fue de 2 (rango: 1 - 4 BMs). Los pacientes tenían una mediana de edad de 53 años (rango: 34 - 81 años). En las Tablas 2-3 se resumen las principales características clínicas y el tratamiento local de las BMs que recibieron los pacientes.
Distribución de las metástasis cerebrales en el sistema nervioso central
En cuanto a la distribución en el SNC de las BMs tratadas por nuestro grupo de estudio, observamos una localización prevalente de las mismas en el cerebelo (Figura 2), de acuerdo a lo evidenciado en estudios previos (25,26. Por un lado, el análisis de los subtipos moleculares muestra que la región infratentorial es la localización más frecuente de las BMs de los pacientes HR-/HER2+, aunque no se encontraron diferencias significativas entre los subgrupos. Por otro lado, al analizar la distribución de las metástasis cerebrales en función únicamente del biomarcador HER2, y agruparlas en BMs HER2+ y HER2-, se encontró una mayor frecuencia de BMs HER2+ en el tronco cerebral, el cerebelo o los lóbulos occipitales en comparación con las BMs HER2- (p= 0.048).
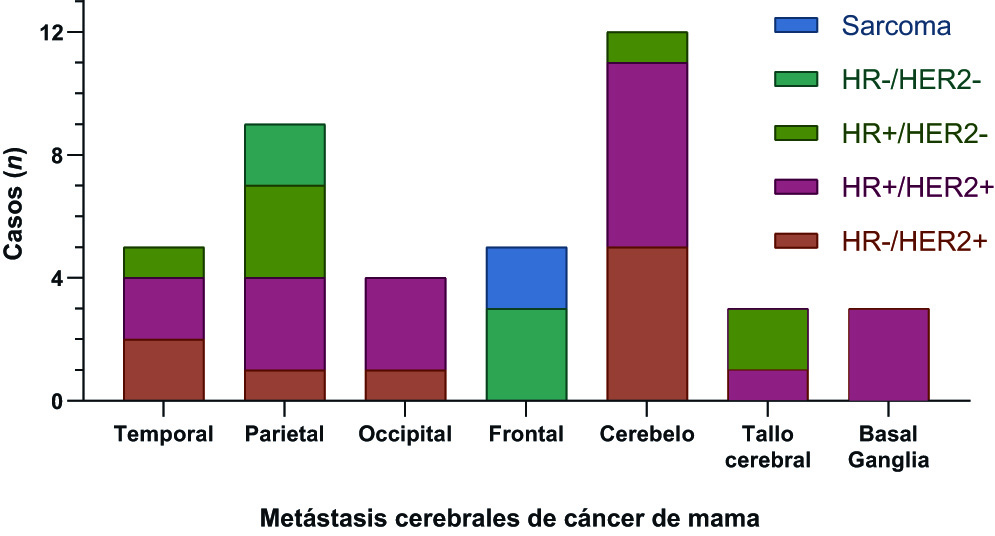
Figura 2 Distribución de BMs de BC tratadas mediante radiocirugía VMAT. A) Distribución de BMs de BC en las diferentes regiones del cerebro. B) Estratificación de las BMs según la histología y los subtipos moleculares del cáncer de mama.
Tanto el volumen tumoral total como el diámetro de la BM de mayor tamaño sugieren mayores tamaños para las HER2+ que para las HER2- (Tabla 3), aunque no se alcanzaron diferencias estadísticamente significativas en nuestro estudio.
Análisis de supervivencia
El análisis de supervivencia según el modelo de Kaplan-Meier se muestra en la Figura 3. La mediana del tiempo de supervivencia (MST, por sus siglas en inglés) desde la fecha de la radiocirugía fue de 19.7 meses (intervalo de confianza del 95%: 14.9-24.5 meses). Las tasas de supervivencia global fueron del 83.3% a los 6 meses, del 65.5% a los 12 meses y del 44.9% a los 24 meses. Se determinaron diferencias significativas en la supervivencia global de los pacientes en las siguientes variables: en primer lugar, entre los pacientes con KPS ˂70 frente a los que tenían KPS ≥70 (p= 0.02). Los pacientes con KPS ≥70 tuvieron un MST de 31.7 meses (IC 95%: 10.8 - 52.7 meses), mientras que aquellos con KPS ˂ 70 tuvieron un MST de 6.3 meses (IC 95%: 4.4-8.1 meses). En segundo lugar, se obtuvieron diferencias significativas según el estado de HER2 (p= 0.004). (Fig. 3). Así, los pacientes HER2 + tuvieron una MST de 43 meses (IC 95%: 20.8-65.2), mientras que los pacientes HER2 - tuvieron una MST de 5.1 meses (IC 95%: 2.3-7.9). Por otro lado, analizando ambos biomarcadores (HER2 y HR), también se determinaron diferencias significativas entre los cuatro subtipos moleculares de cáncer de mama (p= 0.042). Los pacientes con el subtipo molecular HR+/HER2+ y TNBC presentaron los MST mayores y menores, respectivamente. En tercer lugar, también se obtuvieron diferencias significativas según la clase del GPA modificado de mama (p= 0.004). Sin embargo, dado el pequeño tamaño de la muestra, estos últimos resultados deben tomarse con cautela. Por último, no se encontraron diferencias estadísticamente significativas en el número de BMs (metástasis única frente a múltiples), en el volumen total de la lesión (<2 versus (2 cc), ni en la presencia de alguna BM en la región infratentorial (Tabla 4).

Figura 3 Curvas Kaplan-Meier para: a) Probabilidad global de supervivencia post-SRS/fSRS, b) supervivencia de acuerdo al status HER2.
Tabla 4 Resultados del test log-rank (Mantel-Cox) para el modelo de Kaplan-Meier.
| Log-rank test (Mantel-Cox) results for the Kaplan-Meier model. | |
|---|---|
| Variable | p-value |
| KPS: <70 versus ≥70 | 0.02 |
| Subtipos Moleculares de Cáncer de Mama (HER2+ versus HER2-) | 0.004 |
| Número: única versus múltiples metástasis | 0.222 |
| Volumen lesional total: <2 versus = or > 2 cc | 0.11 |
| Presencia de algunas metástasis cerebrales infratentoriales | 0.924 |
GPA: Graded prognostic assessment, HER2: human epidermal growth factor receptor 2, KPS: Karnofsky Performance Status.
Control local de las metástasis cerebrales
Se analizó el control de las BMs de forma individual, para cada BM. El primer control de neuroimagen (RM) se realizó en una mediana de tiempo de 3 meses (IQR: 1 mes). La respuesta local no se conoció en el 13.6% de las BMs, ya que no llegaron a realizarse el primer control por RM. El resto presentó un porcentaje de control local del 90.9%, cumpliendo cada BM individualmente los criterios de: PD 9.1%, SD 48.5%, PR 27.8% y CR 15.2%. El segundo control por RM se realizó en una mediana de tiempo de 5 meses (IQR: 2 meses). La respuesta local de las BMs fue desconocida en el 24% de los casos. En el resto, se alcanzó un 88.5% de control local individual.
Discusión
El tratamiento con radiocirugía de las BMs en pacientes con BC con hasta 4 BMs 3, así como, en pacientes seleccionados con de 5-10 BMs 16, se ha convertido en una modalidad de tratamiento actual de elección, ya que proporciona ventajas sobre la WBRT convencional, especialmente debido a sus menores efectos neurocognitivos 1,11-14,27. Esto es de especial importancia dado el incremento en la supervivencia de estos pacientes 28. En nuestro estudio, empleamos la radiocirugía VMAT, que cada vez goza de mayor aceptación y uso 29. Entre sus ventajas respecto a otras técnicas de radiocirugía (como la radiocirugía gamma-knife) se encuentran las siguientes: menor tiempo de tratamiento 30, uso de un único isocentro para casos con múltiples metástasis (siempre que la localización de las metástasis cerebrales y su tamaño lo permitan) (Fig.1) 31, y no necesitar un sistema de fijación invasivo (frameless). Esto reduce las molestias al paciente y permite una mejor integración en los departamentos de Oncología Radioterápica.
El objetivo principal del presente estudio fue analizar la respuesta al tratamiento de radiocirugía VMAT en términos de supervivencia global y control local en pacientes con metástasis cerebrales de cáncer de mama. Aunque no hemos evaluado la toxicidad específica del tratamiento, hemos utilizado tanto la supervivencia como el control local como sustitutos de la eficiencia del tratamiento para poder compararlo con otras técnicas radioquirúrgicas.
En primer lugar, en lo que respecta a la supervivencia global, se obtuvo un MST de 19.7 meses, que es comparable con lo que se muestra en diferentes estudios de tratamiento de radiocirugía con GK-RS: Jo et al (MST 18.2 meses) 32, Matsunaga et al (MST 13 meses) 33 o Abu-Khalaf (13.1 meses) 34, aunque el tamaño muestral de nuestro estudio es menor. Entre las variables que determinamos como significativas para la supervivencia global de las pacientes de nuestro estudio se encuentran el KPS, el subtipo molecular y el GPA modificado de cáncer de mama. El KPS ha demostrado ser una variable significativa para evaluar la supervivencia de los pacientes con metástasis cerebrales, utilizando diferentes técnicas de tratamiento 15,35-37. En nuestro estudio, determinamos las diferencias entre ambos subgrupos estableciendo un punto de corte de KPS de 70 (KPS <70 versus KPS (70).
En cuanto a los biomarcadores del cáncer de mama, determinamos diferencias significativas según el estatus de HER2. Así, al igual que en estudios anteriores 38, la supervivencia global (OS) de los pacientes HER2+ fue mayor que la de los pacientes HER2-. También determinamos diferencias significativas entre los subtipos moleculares de BC (en función del estado del HR y del HER2), siendo el TNBC y el HR+/HER2+ los que tuvieron la mediana de supervivencia menor y mayor, respectivamente. Estas diferencias significativas entre los distintos subtipos moleculares de BC también se han descrito en estudios anteriores, como los realizados por Sperduto et al.21, y Griguolo et al.22. Sin embargo, dado el pequeño tamaño de la muestra, estos resultados deben tomarse con cautela.
No encontramos diferencias entre los subgrupos de pacientes en función del volumen total de la lesión, el número de BMs o la presencia de BMs infratentoriales en los pacientes. Mientras que estudios anteriores han señalado que el número de BMs no es un factor predictivo de supervivencia, el volumen tumoral craneal sí parece serlo 39. Yamamoto et al.16, describieron que el volumen tumoral total ((1.9 cc) y el diámetro de la BM de mayor tamaño ((16 m) influyen en la supervivencia de los pacientes; mientras que el número de BMs (>4) no es significativo. Bhatnagar et al. 40, en el tratamiento con SRS de pacientes con múltiples BMs (4-18 BMs), demostraron que un menor volumen tumoral craneal se asociaba con una mejor supervivencia independientemente del número de BMs.
En segundo lugar, para la evaluación de la respuesta local de las BMs al tratamiento mediante radiocirugía, se utilizaron los criterios mRECIST 23,24, que representan una modificación institucional de los criterios estándar RECIST 1.1 41. La principal diferencia entre ambos criterios, como se concluye en el estudio de Qian et al.24, radica en la definición de las lesiones medibles. Así, con los criterios mRECIST se pueden incluir lesiones con un diámetro mínimo de 5 mm en lugar de 10 mm como se postula en los criterios RECIST 1.1. 41. Esto permite incluir más BMs en el estudio. Además, podría ser más sensible para detectar la progresión local de la enfermedad, ya que no requiere un aumento absoluto mínimo de 5 mm (como los criterios RECIST 1.1), sino sólo un aumento ≥20% en la suma de los diámetros más largos en comparación con el nadir 24. En nuestro estudio, el porcentaje de control local utilizando los criterios mRECIST, que se aplicaron de forma individual para cada BM, fue del 90.9% en el primer control por RM (3 meses), y del 88.5% en el segundo control por RM (5 meses), lo que resulta superior a lo descrito en un estudio previo de nuestro grupo 15 donde se empleó VMAT-RS en fracción única, en el cual el control local fue del 80% a los 3 meses. Becker et al.42, empleando radiocirugía LINAC con marco, encontraron porcentajes de control local de las metástasis cerebrales del 74% a los 6 meses y del 61% a los 12 meses. Esta cifra es algo inferior a la reportada por Bilger et al.43, que utilizando un sistema de SRS sin marco, estimaron un control local del 83% a los 12 meses. Además de los criterios RECIST, existen otros criterios para evaluar la respuesta al tratamiento, como los criterios MacDonald (históricamente utilizados para la evaluación de los gliomas de alto grado), y los criterios de respuesta estandarizados propuestos por el “Response Assessment in Neuro-Oncology Working Group” (BM-RANO) 44. Entre otras diferencias, estos dos últimos también consideran el estado clínico y el uso de corticosteroides entre los criterios de respuesta. Algunos estudios recientes, como el de Qian et al., han observado un alto grado de concordancia entre algunos de estos criterios (mRECIST, RECIST 1.1 y BM-RANO) 24. No obstante, sería recomendable considerar la evaluación mediante los criterios MacDonald, BM-RANO y mRECIST como apoyo y de forma complementaria, ya que su evaluación aislada presenta limitaciones y esto podría afectar a una evaluación adecuada.
Como objetivo secundario, se analizó la distribución de las metástasis cerebrales en el sistema nervioso central y la posible influencia del subtipo molecular.
En relación con la distribución de las BMs, Kyeong et al. (26, encontraron que las BMs del TNBC se extienden uniformemente en el cerebro, mientras que en el caso de los subtipos HER2+ y HR+/HER2-, las BMs se concentran en los territorios de la circulación posterior, como los lóbulos occipitales y el cerebelo. En nuestro estudio, determinamos que las metástasis de las pacientes HER2+ son más frecuentes en la región comprendida por el tronco cerebral, el cerebelo y los lóbulos occipitales (circulación posterior), a diferencia de las BMs HER2-. Sin embargo, a diferencia de este estudio, las BMs del subtipo HR+/HER2- se localizan con mayor frecuencia fuera de esta región, aunque en este último caso no se alcanzó significación estadística, posiblemente debido al pequeño tamaño de la muestra. En este sentido, de acuerdo con Kyeong et al.26, parece que la distribución espacial de las BMs en el SNC podría diferir en función de la composición genética (subtipo molecular) del cáncer de mama primario, lo que podría ser de importancia para la planificación de las diferentes estrategias de tratamiento en el futuro.
Conclusión
Nuestros resultados sugieren que tanto la supervivencia como el control local de los pacientes con metástasis cerebrales de cáncer de mama tratados con VMAT son comparables a los de otras técnicas de radiocirugía. Entre los factores que influyen en la supervivencia global de los pacientes, cabe destacar la situación basal en el momento del tratamiento (KPS, ECOG) y el subtipo molecular del cáncer de mama. Por último, nuestros resultados muestran que el cerebelo es el lugar predominante de las BMs de cáncer de mama, y también sugieren que las BMs HER2+ tienen una predilección por algunas estructuras de la circulación posterior, como el cerebelo, el tronco cerebral y los lóbulos occipitales. Estos hallazgos podrían ser importantes para la planificación de diferentes estrategias de tratamiento en el futuro, aunque más trabajos con tamaños muestrales mayores son necesarios.
REFERENCIAS
1. Franchino F, Rudà R, Soffietti R. Mechanisms and therapy for cancer metastasis to the brain. Front Oncol. 2018;8:161. Doi: 10.3389/fonc.2018.00161. [ Links ]
2. Linskey ME, Andrews DW, Asher AL, Burri SH, Kondziolka D, Robinson PD, et al. The role of stereotactic radiosurgery in the management of patients with newly diagnosed brain metastases: a systematic review and evidence-based clinical practice guideline. J Neurooncol. 2010;96(1):45-68. Doi: 10.1007/s11060-009-0073-4. [ Links ]
3. Mehta MP, Tsao MN, Whelan TJ, Morris DE, Hayman JA, Flickinger JC, et al. The American Society for Therapeutic Radiology and Oncology (ASTRO) evidence-based review of the role of radiosurgery for brain metastases. Int J Radiat Oncol Biol Phys. 2005;63(1):37-46. Doi: 10.1016/j.ijrobp.2005.05.023. [ Links ]
4. Davis FG, Dolecek TA, McCarthy BJ, Villano JL. Toward determining the lifetime occurrence of metastatic brain tumors estimated from 2007 United States cancer incidence data. Neuro Oncol. 2012;14(9):1171-7. Doi: 10.1093/neuonc/nos152. [ Links ]
5. Tabouret E, Bauchet L, Carpentier AF. Brain metastases epidemiology and biology. Bull Cancer. 2013;100(1):57-62. Doi: 10.1684/bdc.2012.1681. [ Links ]
6. Witzel I, Oliveira-Ferrer L, Pantel K, Müller V, Wikman H. Breast cancer brain metastases: biology and new clinical perspectives. Breast Cancer Res. 2016;18(1):8. Doi: 10.1186/s13058-015-0665-1. [ Links ]
7. Kotecki N, Lefranc F, Devriendt D, Awada A. Therapy of breast cancer brain metastases: challenges, emerging treatments and perspectives. Ther Adv Med Oncol. 2018;10:1-10. Doi: 10.1177/1758835918780312. [ Links ]
8. Lin NU, Bellon JR, Winer EP. CNS Metastases in Breast Cancer. J Clin Oncol. 2004;22(17):3608-17. Doi: 10.1200/JCO.2004.01.175. [ Links ]
9. Yau T, Swanton C, Chua S, Sue A, Walsh G, Rostom A, et al. Incidence, pattern and timing of brain metastases among patients with advanced breast cancer treated with trastuzumab. Acta Oncol (Madr). 2006;45(2):196-201. Doi: 10.1080/02841860500486630. [ Links ]
10. Kaplan MA, Arslan UY, Isikdogan A, Dane F, Oksuzoglu B, Inanc M, et al. Biological subtypes and distant relapse pattern in breast cancer patients after curative surgery (study of Anatolian Society of Medical Oncology). breast care (Basel). 2016;11(4):248-52. Doi: 10.1159/000448186. [ Links ]
11. Mainwaring W, Bowers J, Pham N, Pezzi T, Shukla M, Bonnen M, et al. Stereotactic radiosurgery versus whole brain radiation therapy: a propensity score analysis and predictors of care for patients with brain metastases from breast cancer. Clin Breast Cancer. 2019;19(2):e343-51. Doi: 10.1016/j.clbc.2018.11.001. [ Links ]
12. Chang EL, Wefel JS, Hess KR, Allen PK, Lang FF, Kornguth DG, et al. Neurocognition in patients with brain metastases treated with radiosurgery or radiosurgery plus whole-brain irradiation: a randomised controlled trial. Lancet Oncol. 2009;10(11):1037-44. Doi: 10.1016/S1470-2045(09)70263-3. [ Links ]
13. Brown PD, Asher AL, Ballman K V., Farace E, Cerhan JH, Anderson SK, et al. NCCTG N0574 (Alliance): A phase III randomized trial of whole brain radiation therapy (WBRT) in addition to radiosurgery (SRS) in patients with 1 to 3 brain metastases. J Clin Oncol. 2015;33(18_suppl):LBA4-LBA4. Doi: 10.1200/jco.2015.33.18_suppl.lba4. [ Links ]
14. Brown PD, Jaeckle K, Ballman K V., Farace E, Cerhan JH, Anderson SK, et al. Effect of radiosurgery alone vs radiosurgery with whole brain radiation therapy on cognitive function in patients with 1 to 3 brain metastases. JAMA. 2016;316(4):401-9. Doi: 10.1001/jama.2016.9839. [ Links ]
15. Serna A, Escolar PP, Puchades V, Mata F, Ramos D, Gómez MA, et al. Single fraction volumetric modulated arc radiosurgery of brain metastases. Clin Transl Oncol. 2015;17(8):596-603. Doi: 10.1007/s12094-015-1282-2. [ Links ]
16. Yamamoto M, Serizawa T, Shuto T, Akabane A, Higuchi Y, Kawagishi J, et al. Stereotactic radiosurgery for patients with multiple brain metastases (JLGK0901): a multi-institutional prospective observational study. Lancet Oncol. 2014;15(4):387-95. Doi: 10.1016/S1470-2045(14)70061-0. [ Links ]
17. Kocher M, Soffietti R, Abacioglu U, Villà S, Fauchon F, Baumert BG, et al. Adjuvant whole-brain radiotherapy versus observation after radiosurgery or surgical resection of one to three cerebral metastases: results of the EORTC 22952-26001 Study. J Clin Oncol. 2011;29(2):134-41. Doi: 10.1200/JCO.2010.30.1655. [ Links ]
18. Leksell L. Stereotactic radiosurgery. J Neurol Neurosurg Psychiatry. 1983;46(9):797-803. [ Links ]
19. Marcrom SR, McDonald AM, Thompson JW, Popple RA, Riley KO, Markert JM, et al. Adv Radiat Oncol. 2017;2(4):564-71. Doi: 10.1016/J.ADRO.2017.07.006. [ Links ]
20. Subbiah IM, Lei X, Weinberg JS, Sulman EP, Chavez-MacGregor M, Tripathy D, et al. Validation and development of a modified breast graded prognostic assessment as a tool for survival in patients with breast cancer and brain metastases. J Clin Oncol. 2015;33(20):2239-45. Doi: 10.1200/JCO.2014.58.8517. [ Links ]
21. Sperduto PW, Kased N, Roberge D, Xu Z, Shanley R, Luo X, et al. Summary report on the graded prognostic assessment: an accurate and facile diagnosis-specific tool to estimate survival for patients with brain metastases. J Clin Oncol. 2012;30(4):419-25. Doi: 10.1200/JCO.2011.38.0527. [ Links ]
22. Griguolo G, Jacot W, Kantelhardt E, Dieci MV, Bourgier C, Thomssen C, et al. External validation of modified breast graded prognostic assessment for breast cancer patients with brain metastases: a multicentric european experience. The Breast. 2018;37:36-41. Doi: 10.1016/j.breast.2017.10.006. [ Links ]
23. Goldberg SB, Gettinger SN, Mahajan A, Chiang AC, Herbst RS, Sznol M, et al. A Phase II trial of pembrolizumab for patients with melanoma or non-small cell lung cancer and untreated brain metastases. Lancet Oncol. 2016;17(7):976-83. Doi: 10.1016/S1470-2045(16)30053-5. [ Links ]
24. Qian JM, Mahajan A, Yu JB, Tsiouris AJ, Goldberg SB, Kluger HM, et al. Comparing available criteria for measuring brain metastasis response to immunotherapy. J Neurooncol. 2017;132(3):479-85. Doi: 10.1007/s11060-017-2398-8. [ Links ]
25. Bender ET, Tomé WA. Distribution of brain metastases: implications for non-uniform dose prescriptions. Br J Radiol. 2011;84(1003):649-58. Doi: 10.1259/bjr/30173406. [ Links ]
26. Kyeong S, Cha YJ, Ahn SG, Suh SH, Son EJ, Ahn SJ. Subtypes of breast cancer show different spatial distributions of brain metastases. PLoS One. 2017;12(11):e0188542. Doi: 10.1371/journal.pone.0188542. [ Links ]
27. Brown PD, Ballman K V, Cerhan JH, Anderson SK, Carrero XW, Whitton AC, et al. Postoperative stereotactic radiosurgery compared with whole brain radiotherapy for resected metastatic brain disease (NCCTG N107C/CEC·3): a multicentre, randomised, controlled, phase 3 trial. Lancet Oncol. 2017;18(8):1049-60. Doi: 10.1016/S1470-2045(17)30441-2. [ Links ]
28. Perez JL, Ozpinar A, Kano H, Phan B, Niranjan A, Lunsford LD. Salvage stereotactic radiosurgery in breast cancer patients with multiple brain metastases. World Neurosurg. 2019;125:e479-86. Doi: 10.1016/j.wneu.2019.01.108. [ Links ]
29. Quan EM, Li X, Li Y, Wang X, Kudchadker RJ, Johnson JL, et al. A Comprehensive comparison of IMRT and VMAT plan quality for prostate cancer treatment. Int J Radiat Oncol. 2012;83(4):1169-78. Doi: 10.1016/j.ijrobp.2011.09.015. [ Links ]
30. Thomas EM, Popple RA, Wu X, Clark GM, Markert JM, Guthrie BL, et al. Comparison of plan quality and delivery time between volumetric arc therapy (RapidArc) and gamma knife radiosurgery for multiple cranial metastases. Neurosurgery. 2014;75(4):409-18. Doi: 10.1227/NEU.0000000000000448. [ Links ]
31. Clark GM, Popple RA, Prendergast BM, Spencer SA, Thomas EM, Stewart JG, et al. Plan quality and treatment planning technique for single isocenter cranial radiosurgery with volumetric modulated arc therapy. Pract Radiat Oncol. 2012;2(4):306-13. Doi: 10.1016/j.prro.2011.12.003. [ Links ]
32. Jo K Il, Im Y-H, Kong DS, Seol HJ, Nam D-H, Lee J-I. Gamma knife radiosurgery for brain metastases from breast cancer. J Korean Neurosurg Soc. 2013;54(5):399-404. Doi: 10.3340/jkns.2013.54.5.399. [ Links ]
33. Matsunaga S, Shuto T, Kawahara N, Suenaga J, Inomori S, Fujino H. Gamma Knife surgery for metastatic brain tumors from primary breast cancer: treatment indication based on number of tumors and breast cancer phenotype. J Neurosurg. 2010;113(Special_Supplement):65-72. Doi: 10.3171/2010.8.GKS10932. [ Links ]
34. Abu-Khalaf M, Muralikrishnan S, Hatzis C, Canchi D, Yu JB, Chiang V. Breast cancer patients with brain metastasis undergoing GKRS. Breast Cancer. 2019;26(2):147-53. Doi: 10.1007/s12282-018-0903-3. [ Links ]
35. Wegner RE, Olson AC, Kondziolka D, Niranjan A, Lundsford LD, Flickinger JC. Stereotactic radiosurgery for patients with brain metastases from small cell lung cancer. Int J Radiat Oncol. 2011;81(3):e21-7. Doi: 10.1016/j.ijrobp.2011.01.001. [ Links ]
36. Bashir A, Hodge CJ, Dababneh H, Hussain M, Hahn S, Canute GW. Impact of the number of metastatic brain lesions on survival after Gamma Knife radiosurgery. J Clin Neurosci. 2014;21(11):1928-33. Doi: 10.1016/j.jocn.2014.03.026. [ Links ]
37. Jeon W, Jang B-S, Jeon SH, Kim JH, Kim YJ, Kim SH, et al. Analysis of survival outcomes based on molecular subtypes in breast cancer brain metastases: A single institutional cohort. Breast J. 2018;24(6):920-6. Doi: 10.1111/tbj.13111. [ Links ]
38. Yomo S, Hayashi M, Cho N. Impacts of HER2-overexpression and molecular targeting therapy on the efficacy of stereotactic radiosurgery for brain metastases from breast cancer. J Neurooncol. 2013;112(2):199-207. Doi: 10.1007/s11060-013-1046-1. [ Links ]
39. Limon D, McSherry F, Herndon J, Sampson J, Fecci P, Adamson J, et al. Single fraction stereotactic radiosurgery for multiple brain metastases. Adv Radiat Oncol. 2017;2(4):555-63. Doi: 10.1016/j.adro.2017.09.002. [ Links ]
40. Bhatnagar AK, Flickinger JC, Kondziolka D, Lunsford LD. Stereotactic radiosurgery for four or more intracranial metastases. Int J Radiat Oncol. 2006;64(3):898-903. Doi: 10.1016/j.ijrobp.2005.08.035. [ Links ]
41. Eisenhauer EA, Therasse P, Bogaerts J, Schwartz LH, Sargent D, Ford R, et al. New response evaluation criteria in solid tumours: Revised RECIST guideline (version 1.1). Eur J Cancer. 2009;45(2):228-47. Doi: 10.1016/j.ejca.2008.10.026. [ Links ]
42. Becker G, Jeremic B, Engel C, Buchgeister M, Paulsen F, Duffner F, et al. Radiosurgery for brain metastases: the Tuebingen experience. Radiother Oncol. 2002;62(2):233-7. [ Links ]
43. Bilger A, Frenzel F, Oehlke O, Wiehle R, Milanovic D, Prokic V, et al. Local control and overall survival after frameless radiosurgery: A single center experience. Clin Transl Radiat Oncol. 2017;7:55-61. Doi: 10.1016/J.CTRO.2017.09.007. [ Links ]
44. Chukwueke UN, Wen PY. Use of the response assessment in neuro-oncology (RANO) criteria in clinical trials and clinical practice. CNS Oncol. 2019;8(1): CNS28. Doi: 10.2217/cns-2018-0007. [ Links ]
Notes:
Recibido: 24 de Septiembre de 2020; Revisado: 03 de Noviembre de 2020; Aprobado: 05 de Mayo de 2021











 texto em
texto em 



