Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Colombia Médica
On-line version ISSN 1657-9534
Colomb. Med. vol.52 no.3 Cali July/Sept. 2021 Epub Sep 30, 2021
https://doi.org/10.25100/cm.v52i3.5051
Articulo original
Efectos de la terapia periodontal no quirúrgica en pacientes con artritis reumatoide: estudio prospectivo de antes y después
1 Universidad de Antioquia, Facultad de Odontología, Medellín-Colombia.
2 Artmédica, IPS, Grupo de información clínica, Medellín-Colombia.
Antecedentes:
se ha sugerido que la terapia periodontal tiene efectos sistémicos. Sin embargo, los estudios de la terapia periodontal en pacientes con artritis reumatoide han producido resultados controvertidos.
Objetivo:
comparar los efectos de la terapia periodontal no quirúrgica sobre los marcadores bioquímicos de la artritis reumatoide y los parámetros periodontales en pacientes con y sin artritis reumatoide.
Métodos:
se realizó un estudio prospectivo de antes y después que incluyó a 21 participantes sin artritis reumatoide y 29 participantes con artritis reumatoide. Se midieron los parámetros periodontales, detección de Porphyromonas gingivalis, proteína C reactiva, factor reumatoide y anticuerpos anti-proteína citrulinada al inicio del estudio y tres meses después de la terapia periodontal no quirúrgica y los cambios se evaluaron estadísticamente.
Resultados:
En general, ambos grupos presentaron mejoría estadísticamente significativa en los parámetros periodontales (p <0.05). Hubo un aumento en los recuentos de P. gingivalis en ambos grupos a los tres meses. Además, hubo una reducción en los niveles de anticuerpos anti-proteína citrulinada y factor reumatoide en participantes con artritis reumatoide. Por el contrario, los niveles de proteína C reactiva aumentaron en ambos grupos, pero fueron más altos en el grupo de artritis reumatoide. Los parámetros periodontales en los participantes con artritis reumatoide bajo fármacos antirreumáticos modificadores de la enfermedad presentaron una mejoría ligeramente mayor (p <0.05).
Conclusiones:
La terapia periodontal no quirúrgica tiene mejoras similares en los parámetros periodontales en pacientes con y sin artritis reumatoide. Además, la terapia periodontal no quirúrgica puede beneficiar los niveles séricos de anticuerpos anti-proteína citrulinada y factor reumatoide en pacientes con artritis reumatoide. NCT04658615.
Palabras clave: artritis reumatoide; periodontitis; proteína C reactiva; factor reumatoide; anticuerpos anti-proteína citrulinada; debridamiento periodontal; disbiosis
Background:
periodontal therapy has been suggested to have systemic effects. However, studies of periodontal therapy in rheumatoid arthritis patients have produced controversial results.
Aim:
To compare the effects of nonsurgical periodontal therapy on biochemical markers of rheumatoid arthritis and periodontal parameters in patients with and without rheumatoid arthritis.
Methods:
a prospective before-and-after study was conducted that included 21 participants without and 29 participants with rheumatoid arthritis. Periodontal parameters, Porphyromonas gingivalis detection, C-reactive protein, rheumatoid factor and anti-citrullinated protein antibodies were measured at baseline and three months after nonsurgical periodontal therapy and the changes were statistically assessed.
Results:
In general, both groups presented statistically significant improvement in periodontal parameters (p<0.05). There was an increase in the counts of P. gingivalis in both groups at three months. In addition, there was a reduction in levels of anti-citrullinated protein antibodies and rheumatoid factor in participants with rheumatoid arthritis. In contrast, C-reactive protein levels increased in both groups but were higher in the rheumatoid arthritis group. Periodontal parameters in rheumatoid arthritis participants under disease-modifying antirheumatic drugs presented a slightly higher improvement (p <0.05).
Conclusions:
Nonsurgical periodontal therapy has similar improvements in periodontal parameters in patients with and without rheumatoid arthritis. In addition, nonsurgical periodontal therapy may benefit serum levels of anti-citrullinated protein antibodies and rheumatoid factors in patients with rheumatoid arthritis. NCT04658615.
Keywords: rheumatoid arthritis; periodontitis; C-reactive protein; rheumatoid factor; anti-citrullinated protein antibodies; periodontal debridement; dysbiosis
Contribución del estudio
| 1) ¿Por qué se realizó este estudio? |
| Se ha sugerido que la periodontitis y la artritis reumatoide son bidireccionales y que la terapia periodontal tiene efectos sistémicos. Por lo tanto, este estudio se llevó a cabo para comparar los efectos de la terapia periodontal sobre los parámetros bioquímicos y clínicos en pacientes con y sin artritis reumatoide. |
| 2) ¿Cuáles fueron los resultados más relevantes del estudio? |
| Los parámetros periodontales mejoraron independientemente de la condición sistémica. Sin embargo, hubo una reducción en los niveles de anticuerpos anti-proteína citrulinada y factor reumatoide en participantes con artritis reumatoide después del tratamiento periodontal. |
| 3) ¿Qué aportan estos resultados? |
| La terapia periodontal puede afectar positivamente los niveles séricos de anticuerpos anti-proteína citrulinada y factor reumatoide en pacientes con artritis reumatoide y, en consecuencia, ayudar a mejorar la actividad de la enfermedad. |
Introducción
La periodontitis y la artritis reumatoide (AR) son enfermedades inflamatorias que conducen a la destrucción del tejido conectivo y de los huesos. La prevalencia de periodontitis grave a nivel mundial se ha estimado en alrededor del 11%, pero con la suma adicional de periodontitis moderada y leve, la prevalencia podría aumentar a casi el 50% 1,2. En Colombia, alrededor del 60% de la población tiene periodontitis 3. En contraste, datos recientes indican que la prevalencia global de AR se encuentra entre 0.40-1%, con una prevalencia similar en Colombia (0.52%) 4,5. Ambas enfermedades son de gran interés ya que se ha encontrado que afectan negativamente la calidad de vida de las personas 6,7. En la última década, ha surgido evidencia que sugiere una asociación entre las dos condiciones 8-10.
Si bien la periodontitis tiene una fuerte etiología microbiana, la AR es el resultado de una respuesta autoinmune. La acumulación de una biopelícula disbiótica alrededor de los dientes conduce a la inflamación de los tejidos gingivales que, sin un control adecuado, continúan desarrollando periodontitis en la que se reabsorben los tejidos de inserción periodontal y el hueso circundante al diente. Por otro lado, la AR es el resultado de la acumulación de un infiltrado inflamatorio autoinmune en la membrana sinovial que conduce a la destrucción continua de los tejidos conectivo y óseo de las articulaciones. La etiología de la AR se desconoce, pero los factores genéticos, ambientales y el tabaquismo se han reconocido como factores de riesgo importantes y, más recientemente, la disbiosis del microbioma intestinal se ha asociado como un factor que contribuye a enfermedades autoinmunes, incluida la AR 11-13. Además, la AR afecta las articulaciones y contribuye a la inflamación sistémica crónica y, por tanto, compromete múltiples órganos y tejidos del cuerpo 14.
Los estudios han sugerido que ambas condiciones comparten algunos mecanismos patogénicos. Se caracterizan por el aumento de la producción local de metaloproteinasas de matriz (MMPS) y citocinas proinflamatorias como IL-1, TNFα, IL-6 e IL-17, que son importantes inductores de la resorción ósea y del tejido conjuntivo. La proteína C reactiva (PCR), una proteína pentamérica producida en el hígado como resultado de una inflamación e infección crónica, está elevada en la periodontitis y la AR 12,13,15. La disbiosis, definida como el desequilibrio en la comunidad microbiana normal, es una característica importante en la periodontitis y los estudios sugieren que también juega un papel en la AR contribuyendo al inicio de la inflamación crónica 11. Estos mecanismos moleculares y biológicos compartidos crean una reacción inflamatoria desregulada responsable para la destrucción de tejidos conectivos y hueso alrededor de dientes y articulaciones.
Se ha propuesto que la periodontitis puede contribuir a los efectos patógenos de la artritis. El vínculo se estableció a través de Porphymonas gingivalis, un patógeno importante en la biopelícula disbiótica en periodontitis. P. gingivalis sintetiza una peptidil arginina deiminasa (PAD) que media la citrulinación de varias proteínas como vimentina, fibrina y α-enolasa. Las proteínas citrulinadas son reconocidas por anticuerpos anti-proteína citrulinados (ACPA), que es una característica relevante de la AR 13,16,17. Los estudios han encontrado que los ACPA aumentan en sujetos positivos para P. gingivalis con y sin AR 18,19. Sin embargo, P. gingivalis afecta la producción de ACPA e induce NET (trampas extracelulares de neutrófilos), osteoclastogénesis (prostaglandina E2) y respuesta proinflamatoria Th17 que, en un consorcio, contribuyen al daño óseo y la inflamación sistémica 20. Se sospecha que estos mecanismos actúan de forma bidireccional, lo que significa que la AR puede ser un factor de riesgo de periodontitis y viceversa.
Se ha sugerido que la terapia periodontal no quirúrgica (TPNQ) tiene efectos sistémicos. Gaudilliere et al, 21. mostró que los pacientes con periodontitis tienen una reacción proinflamatoria exagerada a P. gingivalis y una respuesta inmune sistémica disfuncional. Pero lo más interesante fue que la disfunción inmunológica sistémica fue revertida temporalmente por la TPNQ 21. Los estudios en pacientes con AR sugieren que la TPNQ mejora la condición periodontal y de la AR 22. Otros no encontraron beneficio en los parámetros clínicos de la AR y los efectos de la TPNQ en los marcadores bioquímicos de la AR sigue siendo controvertido 23,24. Además, no se han abordado las diferencias en la respuesta clínica después de TPNQ en pacientes con y sin AR. Por tanto, el objetivo de este estudio fue comparar los efectos de la terapia periodontal no quirúrgica sobre los marcadores bioquímicos de la AR y los parámetros periodontales en pacientes con y sin AR.
Materiales and Metodos
Este protocolo de estudio prospectivo de antes y después fue revisado y aprobado por el comite de etica institucional (Universidad de Antioquia 05-2016) y realizado de acuerdo con la Declaración de Helsinki de 1975, revisada en 2013. Todos los participantes debían firmar un consentimiento escrito informado para su participación en el estudio. Además, el protocolo del estudio se registró en Clinical Trials (NCT04658615).
Participantes y criterios de selección
Los pacientes con y sin AR fueron reclutados entre marzo de 2019 y marzo de 2020 de las clínicas dentales de la Universidad de Antioquia y Artmédica, respectivamente. Los individuos fueron incluidos de acuerdo con los siguientes criterios: edad ≥18 años; diagnóstico de AR según el American College of Rheumatology con una puntuación de actividad de la enfermedad-28 (DAS28-CRP) ≥3.2 y sin cambios en la medicación para la AR en los tres meses previos y durante el seguimiento; al menos 15 dientes excluyendo terceros molares; sitios interdentales con pérdida del nivel de inserción periodontal (PAL) en ≥2 dientes no adyacentes 25. Los pacientes sin AR cumplieron los mismos criterios excepto para el diagnóstico de AR. Además, se excluyó a las personas que informaron sobre tratamiento periodontal o uso de antibióticos en los tres meses anteriores, diabetes, VIH, enfermedad hepática, radioterapia de cabeza y cuello, embarazo y uso de ciclosporina. El tabaquismo, la hipertensión y la hiperlipidemia no fueron criterios de exclusión y se registraron en consecuencia.
Los participantes con AR estaban bajo medicación, incluidos fármacos antiinflamatorios no esteroides (AINEs), fármacos antirreumáticos modificadores de la enfermedad no biológicos y biológicos (FARME) y corticosteroides. Los FARME no biológicos incluyeron hidroxicloroquina, metotrexato, sulfasalazina y leflunomida. Los FARME biológicos incluyeron adalimumab, etanercept, abatacept, golimumab, infliximab, rituximab y tocilizumab. No se realizaron cambios en la medicación durante el período de seguimiento para analizar los efectos del tratamiento periodontal. Sin embargo, una vez finalizado el seguimiento, el médico tratante ajustó o modificó la terapia farmacológica según cada caso.
Examen clinico, microbiologico y muestras de sangre
Después de que los participantes fueron seleccionados para su inclusión, se recolectaron muestras de sangre para el análisis de proteína C reactiva de alta sensibilidad (hs-PCR; mg/L), factor reumatoide (RF; U/mL) y anticuerpos anti-proteína citrulinada (ACPA; U/mL) en un laboratorio de referencia. Un solo periodoncista experimentado completó la ficha periodontal completa en seis sitios por diente, excluidos los terceros molares, utilizando una sonda calibrada (UNC-15, Hu-Friedy Mfg. Co.). Un reumatólogo experimentado examinó a los pacientes con AR para determinar su puntuación DAS28-CRP. Se recolectaron y combinaron muestras de placa subgingival de los cinco sitios periodontales más profundos. La detección de P. gingivalis se realizó de inmediato mediante técnicas de cultivo y se expresó como unidades formadoras de colonias por mL (UFC/mL) y detección de frecuencia 26. Todos los exámenes se realizaron al inicio del estudio y se repitieron tres meses después de la intervención.
Intervención
La terapia periodontal no quirúrgica (TPNQ) se administró en los siguientes 5 días de inclusión. Se llevó a cabo una sola sesión de 1 hora de desbridamiento de boca completa con un dispositivo ultrasónico y curetas en cada participante bajo anestesia local por un periodoncista experimentado. Una vez completado el TPNQ, cada paciente recibió instrucciones de higiene bucal y un paquete de cuidado oral que incluía un cepillo y crema de dientes (cepillo de dientes Vitis Encias Medium; crema de dientes Vitis Encias; Dentaid, Colombia).
Resultados de interes
El resultado primario de interes fue el cambio en los niveles de proteína C reactiva medido como la diferencia entre el examen inicial y los tres meses. Los resultados secundarios de interes incluyeron cambios en RF y ACPA, así como cambios en el nivel de inserción periodontal (PAL), profundidad de sondaje (PD) y sangrado al sondaje (BOP).
Recoleccion de datos
Se recopilaron datos demográficos, de historia clínica y de medicación de todos los participantes. Los parámetros clínicos periodontales de PD (mm), PAL (mm) y BOP (%) se registraron en cada visita. La etapa de periodontitis se estableció de acuerdo con la clasificación actual de enfermedades periodontales 25. El clinico que registró los datos no estaba cegado al estado de los pacientes.
Analisis estadistico
El tamaño de la muestra se calculó para detectar un cambio del 50% en la PCR con una potencia de >80% (alfa 0.05), lo que resultó en 15 participantes por grupo 22. Teniendo en cuenta los posibles abandonos, se incluyeron 20 participantes por grupo. No se realizó aleatorización ya que el propósito era comparar los efectos de la TPNQ en pacientes con y sin AR. El periodoncista que registró los parámetros periodontales fue calibrado para mediciones repetidas antes de la inclusión del paciente (el valor de Kappa fue ≥0.80 para PAL y PD).
Se realizó un análisis por protocolo para analizar los cambios en las variables clínicas. Las variables categóricas se presentan como frecuencias (%) y se analizan en tablas de contingencia y Ji 2 . Se aplicó la prueba de Kolmogorov-Smirnov para evaluar la normalidad. Las variables continuas se presentan como la media y el intervalo de confianza (IC) del 95%. Los cambios en los marcadores bioquímicos (PCR, RF, ACPA) y los parámetros periodontales (PAL, PD, BOP) se expresan como delta (∆) desde el inicio hasta 3 meses después de la intervención. Las diferencias se determinaron mediante la prueba de Wilcoxon para muestras apareadas y la prueba de Mann Whitney para muestras no apareadas. Considerando que el objetivo principal de la TPNQ es reducir la inflamación periodontal y, en consecuencia, mejorar la condición sistémica, el resultado de interés se definió como la reducción de los marcadores bioquímicos de la AR. Esta ocurrencia se tabuló en forma cruzada con el tipo de grupo de estudio y se calculó el riesgo relativo (RR). El nivel de significancia estadística fue del 5% (p ≤0.05).
Resultados
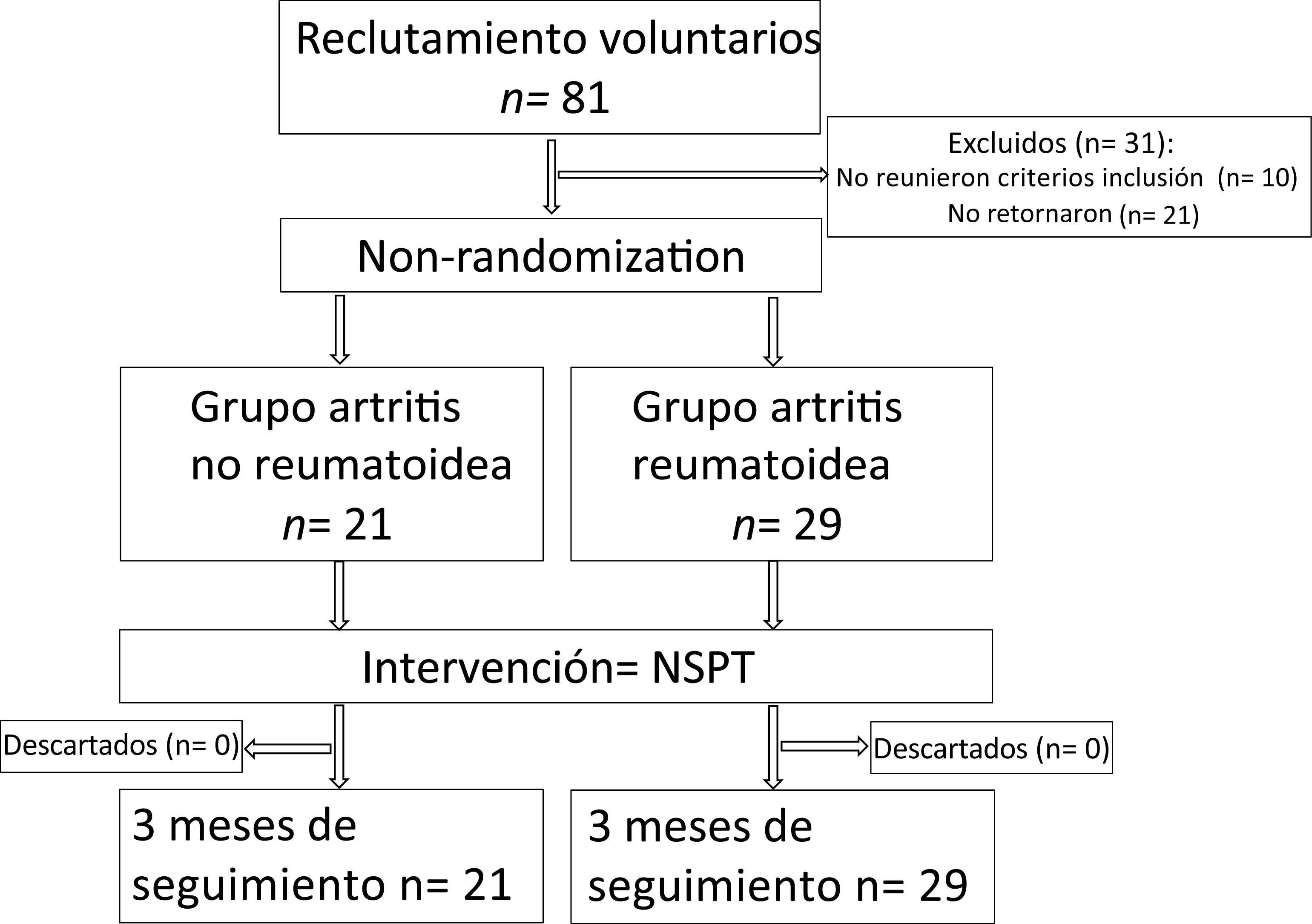
El reclutamiento y la descripción demográfica de los participantes del estudio se presentan en la Figura 1 y la Tabla 1. Participaron en el estudio veintiún (21) pacientes sin AR y 29 pacientes con AR con una edad media de 52.3 años. La proporción de mujeres participantes fue mayor en ambos grupos, especialmente en el grupo de AR (p= 0.04). La duración de la AR fue de 11.3 años (IC 95%: 7.7-14.6). Los participantes presentaron un número similar de dientes, pero el estadio IV de la distribución de la periodontitis fue mayor en el grupo sin AR (p= 0.01). La distribución de diabetes, hipertensión y tabaquismo no fue estadísticamente significativa entre los grupos. La osteoporosis fue más frecuente en los participantes con AR.
Tabla 1 Descripción demográfica de la muestra del estudio
| Variable | Sin AR (n= 21) | Con AR (n= 29) | p* |
|---|---|---|---|
| Sexo | |||
| Masculino (%) | 10 (47.6%) | 6 (20.7%) | 0.04 |
| Femenino (%) | 11 (52.4%) | 23 (79.3%) | |
| Edad promedio (95% IC) | 52.3 (47.2-57.3) | 52.3 (49.4-55.1) | NS |
| 27-59 años | 17 (80.9%) | 20 (68.9%) | NS |
| >60 años | 4 (19.1%) | 9 (31.1%) | NS |
| Duración de AR (años); promedio (95% IC) | NA | 11.3 (7.7-14.6) | NA |
| Número de dientes presentes | 24.4 ± 2.9 | 22.6 ± 4.4 | NS |
| Estadio de periodontitis n (%) | |||
| I | 0 | 0 | 0.01 |
| II | 0 | 5 (17.2%) | |
| III | 5 (23.8%) | 16 (55.2%) | |
| IV | 16 (76.2%) | 8 (27.6 %) | |
| Diabetes | 0 (0) | 1 (3.4%) | NS |
| Hipertension | 3 (14.3%) | 10 (34.5%) | NS |
| Osteoporosis | 0 (0) | 8 (27.6%) | 0.008 |
| Cigarrillo | 0 (0) | 1 (3.4%) | NS |
*Ji 2. NS: no significante; IC: intervalo de confianza; AR: artritis reumatoide; NA: no aplicable.
Los cambios en los parámetros periodontales y microbiológicos a los tres meses de la intervención se muestran en la Tabla 2. En general, ambos grupos presentaron una mejoría estadísticamente significativa en los parámetros periodontales (p= 0.001). Los participantes sin AR tenían periodontitis más grave que los participantes con AR y, por lo tanto, la reducción observada a los tres meses en BOP, PAL media y PD media fue mayor que los participantes con AR. Sin embargo, la magnitud relativa (%) de la reducción fue similar entre los grupos (reducción del 15-20%). Hubo un aumento más significativo en el número de sitios con PAL 1-2 mm y PD ≤3 mm, mayor reducción en el número de sitios con PAL 3-5 mm y ≥5 mm en el grupo sin AR. Hubo una mayor reducción en el número de sitios con PD ≥ 4 mm en el grupo sin AR que en el grupo con AR. No obstante, la magnitud relativa (%) de la reducción fue mayor en los participantes con AR que en el grupo sin AR (42% frente a 20%). Los recuentos microbianos totales disminuyeron en ambos grupos a los tres meses de la intervención. Sin embargo, hubo un aumento en los recuentos y la frecuencia de detección de P. gingivalis en ambos grupos, pero estas diferencias no fueron estadísticamente significativas (Tabla 2). Los participantes que dieron positivo para P. gingivalis se mantuvieron positivos después de TPNQ.
Tabla 2 Cambios en los parámetros clínicos periodontales y microbiológicos desde el inicio y a los 3 meses.
| Variable | Sin AR | p* | Con AR | p* | ||||
|---|---|---|---|---|---|---|---|---|
| Inicio | 3 meses | Cambio (∆) | Inicio | 3 meses | Cambio (∆) | |||
| Promedio BOP (95% IC) | 55.6 (44.6-66.5) | 33.9 (21.9-45.9) | 21.6 (15-28.3) | 0.001 | 21.4 (14.6-28.2) | 10.4 (7.5-13.2) | 11 (5.3-16.8) | 0.001 |
| PAL | ||||||||
| Promedio PAL (95% IC) | 4.4 (4.0-4.8) | 3.7 (3.0-4.1) | 0.7 (0.4-1.0) | 0.001 | 2.9 (2.4-3.4) | 2.6 (2.1-3.0) | 0.3 (0.1-0.5) | 0.001 |
| n sitios PAL 1-2 mm (95% IC) | 38.6 (27.4-49.7) | 48.4 (35.8-61.0) | -9.8 (-14.9--4.7) | 0.002 | 27.1 (20.3-33.9) | 28.2 (21.5-34.8) | -1.1(-2.8-0.7) | 0.241 |
| n sitios PAL 3-4 mm (95% IC) | 45.7 (35.2-56.2) | 42.6 (32.7-52.5) | 3.1 (-4.4-10.6) | 0.780 | 33.6 (25.6-41.7) | 34.9 (26.4-43.4) | -1.2 (-2.8-0.4) | 0.127 |
| n sitios PAL ≥5 mm (95% IC) | 39.1 (29.2-48.9) | 31.8 (22.9-40.7) | 7.3 (2.4-12.1) | 0.006 | 16.0 (9.6-22.5) | 14.4 (8.4-20.5) | 1.6 (-0.2-3.3) | 0.095 |
| PD | ||||||||
| Promedio PD (95% IC) | 4.2 (3.7-4.5) | 3.4 (3.0-3.8) | 0.7 (0.4-0.9) | 0.001 | 3.0 (2.6-3.3) | 2.4 (2.2-2.5) | 0.6 (0.3-0.8) | 0.001 |
| n sitios PD ≤3 mm (95% IC) | 104.4 (91.5-117.4) | 112.2 (97.1-127.4) | -7.8 (-17.8-2.2) | 0.019 | 128.9 (117.3-140.5) | 131.7 (120.6-142.7) | -2.7 (-4.9- -0.6) | 0.006 |
| n sitios PD ≥4 mm (95% IC) | 41.3 (30.4-52.3) | 33.2 (18.2-48.3) | 8.1 (-2.0-18.2) | 0.019 | 7.4 (3.41-11.4) | 4.3 (2.0-6.6) | 3.1 (0.6-5.6) | 0.006 |
| Frecuencia P. gingivalis n (%) | 9 (50.0) | 10 (55.5) | -1 (5.5) | 0.077 | 2 (7.4) | 3 (11.1) | -1 (3.7) | 0.786 |
| P. gingivalis CFU / mL (95% IC) | 2.26 x 104 (-2.41 x 104-6.94 x 104) | 1.40 x 105 (-9.46 x 104-3.76 x 105) | -1.18 x 105 (-3.61 x 105-1.25 x 105) | 0.204 | 1.59 x 103 (-1.45 x 103-4.63 x 103) | 8.07 x 103 (-7.12 x 103-2.32 x 104) | -6.48 x 103 (-2.21 x 104 -9.15 x 103) | 0.500 |
| Conteo microbiano total CFU / mL (95% IC) | 4.82 x 106 (2.11 x 106-7.54 x 106) | 4.77 x 106 (-2.15 x 106-1.17 x 107) | 5 x 104 (-6.83 x 106-6.93 x 106) | 0.218 | 2.46 x 106 (2.22 x 105-4.71 x 106) | 1.44 x 106 (6.28 x 105-2.26 x 106) | 1.02 x 106 (-1.29 x 106-3.33 x 106) | 0.284 |
*Paired Wilcoxon test. IC: intervalo de confianza; AR: artritis reumatoide; PAL: nivel de inserción periodontal; PD: profundidad sondaje; CFU: unidades formadoras de colonias. Los valores negativos denotan un aumento en el parámetro.
Los cambios en los parámetros bioquímicos a los tres meses despues de la intervención se informan en la Tabla 3. Hubo una reducción media evidente en los niveles de ACPA y RF en los participantes con AR. Los niveles de RF en pacientes sin AR no cambiaron después de TPNQ. Por el contrario, los niveles de PCR aumentaron en ambos grupos, pero fueron más altos en el grupo con AR. La magnitud relativa de este aumento (%) fue similar entre los grupos (20-25%). La reducción de los niveles de PCR fue más probable que ocurriera en pacientes sin AR.
Tabla 3 Cambios en los parámetros bioquímicos desde el inicio y a los 3 meses.
| Parámetro | Sin AR | p* | Con AR | p* | ||||
|---|---|---|---|---|---|---|---|---|
| Inicio | 3 meses | Cambio (∆) | Inicio | 3 meses | Cambio (∆) | |||
| Promedio PCR mg/L (95% IC) | 2.2 (1.2-3.1) | 2.8 (0.9-4.6) | -0.6 (-2.1-0.9) | 0.670 | 7.2 (03.4-10.9) | 9.0 (5.3-12.6) | -1.8 (-7.1-3.3) | 0.165 |
| Promedio ACPA U/mL (95% IC) | 0.8 (0.4-1.1) | 0.9 (0.4-1.4) | -0.1 (-0.3-0.1) | 0.211 | 190.5 (80.2-300.8) | 118 (65.1-172.5) | 71.7 (-23.9-167.3) | 0.136 |
| Promedio RF U/mL (95% IC) | 15 | 15 | 0 | 1.000 | 213.8 (86.9-340.7) | 166.7 (73.3-259) | 47.7 (-0.1-107.1) | 0.113 |
*Paired Wilcoxon test. IC: interval de confianza; AR: artritis reumatoide; PCR: proteina C recativa; ACPA; anticuerpos anti-proteína citrulinada; RF: factor reumatoide. Los valores negativos denotan un aumento en el parámetro.
Por el contrario, la reducción de los niveles de ACPA fue más probable en pacientes con AR (p= 0.003). De la misma forma, la reducción de los niveles de RF fue más probable en pacientes con AR (p= 0.001) (Tabla 4). En ningún paciente sin AR se observo cambio en el nivel de RF. Esto muestra que en algunos pacientes con AR, la TPNQ puede tener efectos beneficiosos sobre los marcadores bioquímicos.
Tabla 4 Asociación del efecto del tratamiento con los parámetros bioquímicos en pacientes con y sin AR.
| Sin AR | Con AR | RR | p | ||
|---|---|---|---|---|---|
| PCR | Sin cambio / Incremento | 9 (42.9%) | 18 (62.1%) | 0.4 (0.1-1.4) | 0.145 |
| Reducción | 12 (57.1%) | 11 (37.9%) | |||
| ACPA | Sin cambio / Incremento | 18 (85.7%) | 13 (44.8%) | 7.4 (1.8-30.7) | 0.003 |
| Reducción | 3 (14.3%) | 16 (55.2%) | |||
| RF | Sin cambio / Incremento | 21 (100.0%) | 12 (41.4%) | 0.4 (0.2-0.6) | 0.001 |
| Reducción | 0 (0.0%) | 17 (58.6%) |
IC: interval de confianza; AR: artritis reumatoide; PCR: proteina C recativa; ACPA; anticuerpos anti-proteína citrulinada; RF: factor reumatoide; RR: riesgo relativo.
El análisis de subgrupos de participantes con AR evaluó los cambios en los parámetros periodontales según la medicación utilizada (Tabla 5). En general, los parámetros periodontales en los participantes con AR bajo medicación con FARME presentaron una mejoría ligeramente mayor (p = 0.003) excepto para PD en el grupo con FARME no biológicos. Sin embargo, estas diferencias no fueron estadísticamente significativas entre los grupos..
Tabla 5 Cambios en los parámetros clínicos periodontales desde el inicio y a los 3 meses de acuerdo a la medicación en pacientes con AR.
| Parametro | FARME biológicos | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| Si | p* | No | p* | ||||||
| Inicio | 3 meses | Cambio (∆) | Inicio | 3 meses | Cambio (∆) | ||||
| Promedio PAL (95% IC) | 3.3 (1.6-5.0) | 2.8 (1.4-4.1) | 0.5 (-0.3-1.4) | 0.180 | 2.8 (2.2-3.3) | 2.5 (2.0-3.0) | 0.3 (0.1-0.4) | 0.002 | |
| Promedio PD (95% IC) | 3.3 (2.0-4.5) | 2.5 (2.1-3.0) | 0.7 (-0.2-1.6) | 0.109 | 2.9 (2.5-3.3) | 2.3 (2.2-2.5) | 0.5 (0.3-0.8) | 0.002 | |
| FARME no biológicos | |||||||||
| Si | p* | No | p* | ||||||
| Inicio | 3 meses | Cambio (∆) | Inicio | 3 meses | Cambio (∆) | ||||
| Promedio PAL (95% IC) | 2.9 (2.3-3.5) | 2.5 (1.9-3.0) | 0.4 (0.1-0.6) | 0.003 | 3.1 (2.1-4.1) | 2.9 (1.8-3.9) | 0.3 (-0.2-0.8) | 0.109 | |
| Promedio PD (95% IC) | 2.9 (2.5-3.3) | 2.4 (2.2-2.5) | 0.5 (0.2-0.8) | 0.003 | 3.3 (2.4-4.1) | 2.0 (2.1-3.2) | 0.7 (0.2-1.2) | 0.066 | |
*Paired Wilcoxon test. IC: intervalo de confianza; AR: artritis reumatoide; PAL: nivel de inserción periodontal; PD: profundidad sondaje; FARME: fármacos antirreumáticos modificadores de la enfermedad.
Discusión
Este estudio tuvo como objetivo comparar los efectos de la TPNQ sobre los parámetros clínicos en pacientes con y sin AR. Se observó una mejora en los parámetros periodontales clínicos en ambos grupos, reducción de ACPA y RF y aumento de la PCR en los participantes con AR a los tres meses de la intervención. Sin embargo, estos hallazgos deben interpretarse con cautela.
Los parámetros clínicos periodontales mejoraron en ambos grupos después de TPNQ, y este hallazgo fue estadísticamente significativo dentro de cada grupo y en concordancia con otros estudios 22,27,28. Aunque los participantes sin AR presentaron valores más altos en los parámetros periodontales al inicio del estudio en comparación con los participantes con AR y parecieron haber tenido una mejoría más significativa, la magnitud relativa del cambio fue similar entre los grupos. Estudios previos han encontrado que la periodontitis es más severa en pacientes con AR 10,29, pero este no fue el caso de este estudio y por lo tanto marca una diferencia. Una posible explicación es el uso crónico de potentes medicamentos antiinflamatorios como los FARME, que eran exclusivos de los participantes de este estudio con AR. Los resultados de los estudios en animales mostraron una reducción de la inflamación y la pérdida ósea en la periodontitis experimental con la administración de cloroquina 30. Estudios recientes en humanos informaron una menor progresión en la pérdida de inserción periodontal en pacientes con AR bajo medicación FARME 31,32. Además, los pacientes con AR tuvieron acceso a protocolos de manejo para su enfermedad en su centro de tratamiento que incluían cambios en los hábitos diarios y visitas periódicas al médico y al dentista en comparación con los pacientes sin AR en este estudio. Esto podría haber influido en su condición periodontal 33. En este asunto, el análisis de subgrupos de los datos clínicos de los participantes con AR mostró una mejoría levemente mejor en los parámetros periodontales en pacientes bajo FARME biológicos y no biológicos. Por lo tanto, la posibilidad de que la medicación FARME ralentice la progresión de la periodontitis en los participantes con AR es plausible y merece más estudios en ensayos clínicos aleatorios.
Estudios previos han sugerido efectos beneficiosos de la TPNQ sobre los marcadores bioquímicos de la AR y una eventual mejora de la actividad de la enfermedad (22. Pero los cambios en los marcadores bioquímicos en los participantes con AR también pueden estar relacionados con la reacción inmunitaria e inflamatoria alterada característica de la enfermedad 12,15. Encontramos una mayor disminución de ACPA / RF y, por el contrario, un aumento de la PCR a los tres meses después de la TPNQ en los participantes con AR, pero no alcanzó significancia estadística. Además, la respuesta en ACPA y RF en los participantes con AR fue hacia la reducción a pesar de que no hubo cambios en la medicación para la AR durante el estudio. En algunos pacientes, la reducción de la inflamación periodontal por TPNQ puede beneficiar a los marcadores bioquímicos séricos. Aunque las mejorías periodontales fueron comparables en los participantes con y sin AR, una mejora en los niveles de ACPA y RF en los participantes con AR podría explicarse porque tenían niveles aumentados antes del TPNQ y, por lo tanto, más espacio para la reducción. A diferencia del estudio de Cosgarea y cols. 22, la PCR tendió a aumentar después de la TPNQ. Los ACPA y el RF son parámetros muy variables en la AR y pueden mostrar una gran variedad de cambios tras el inicio del tratamiento con FARME en pacientes con periodontitis 34. Por otro lado, la PCR es un indicador inespecífico de inflamación que puede elevarse 24-72 horas después daño tisular severo o infección 35. Además, los pacientes con AR pueden tener períodos de remisión / recaída de la enfermedad y de esta manera, la inflamación sistémica se verá alterada aumentando los niveles de PCR 36. Los resultados concuerdan con otros estudios 22,27,37-39, pero revisiones sistemáticas no han mostrado ningún efecto de TPNQ sobre ACPA y RF 40, por lo tanto, produciendo conclusiones contrastantes. Se ha sugerido que la TPNQ tiene efectos sistémicos al reducir las fuentes inflamatorias periodontales 21. Sin embargo, la compleja respuesta inflamatoria inmunitaria y sistémica en la etiopatogenia de la AR hace que esta suposición sea más complicada a pesar de la mejora de los parámetros clínicos observados en nuestro estudio. Además, este estudio no fue diseñado como un ensayo clínico aleatorizado (ECA) y, por lo tanto, esta reducción no se puede atribuir directamente a TPNQ. Es más probable que los cambios en los parámetros bioquímicos en pacientes con AR sean en cierta medida el resultado combinado de la actividad de la enfermedad, la respuesta a la medicación utilizada y la TPNQ, pero esto requiere más estudios.
Algunos estudios han sugerido una asociación entre P. gingivalis y AR 41. Además, los estudios de intervención periodontal han informado una asociación entre la reducción de los niveles de P. gingivalis y la mejora en la actividad de la enfermedad de AR 42. Aunque el TPNQ resultó en la reducción del recuento microbiano total, los recuentos de P. gingivalis aumentaron a los tres meses después de la terapia en nuestro estudio. Esto puede estar relacionado con el tipo de TPNQ administrado, ya que una sola sesión de raspaje y alisado radicular puede no ser suficiente para suprimir P. gingivalis en casos de periodontitis severa de manera eficaz. Además, se tomaron muestras subgingivales a los tres meses de las bolsas periodontales restantes que aún podrían albergar recuentos altos del microorganismo. Se ha demostrado que P. gingivalis prevalece en sitios que no mejoran después de la terapia 43. Sin embargo, en este estudio no se observó ninguna relación entre P. gingivalis y el cambio en los parámetros bioquímicos de la AR. Otros investigadores 44,45, utilizando métodos de detección molecular, no encontraron asociación significativa entre P. gingivalis y AR y, por lo tanto, la relación entre periodontitis y AR permanece inconclusa debido a la alta heterogeneidad entre los estudios.
El presente estudio tiene las siguientes limitaciones. En primer lugar, el estudio se diseñó como un estudio de antes y después, ya que el propósito era comparar los efectos de la TPNQ en pacientes con y sin AR. Se puede argumentar que solo los ECA proporcionan la única evidencia válida. Pero los beneficios de la TPNQ para restaurar la salud periodontal han sido ampliamente probados y, por lo tanto, parecía más razonable administrar la terapia a todos los participantes 46. Sin embargo, el cálculo del tamaño de la muestra y los criterios de selección cuidadosos y la medición clínica de parámetros importantes nos permitieron hacer comparaciones válidas que son relevantes para su condición periodontal y sistémica. En segundo lugar, el tiempo de seguimiento fue de solo tres meses, y esto se determinó ya que los participantes estaban programados para recibir solo una sesión de TPNQ y era el tiempo esperado para observar los cambios clínicos iniciales 47. Un período de observación más prolongado solo habría retrasado el periodontal adicional tratamiento que los participantes necesitaban para su afección.
Agradecimientos
Dentaid-Colombia amablemente donó paquetes de salud bucal. Los autores agradecen a los pacientes y al personal de Artmédica-IPS que participaron en este estudio.
REFERENCIAS
1. Kassebaum NJ, Bernabé E, Dahiya M, Bhandari B, Murray CJ, Marcenes W. Global burden of severe periodontitis in 1990-2010: a systematic review and meta-regression. J Dent Res. 2014; 93(11): 1045-1053. doi: 10.1177/0022034514552491. [ Links ]
2. Eke PI, Borgnakke WS, Genco RJ. Recent epidemiologic trends in periodontitis in the USA. Periodontol. 2000. 2020; 82 (1): 257-267. doi: 10.1111/prd.12323. [ Links ]
3. Ministerio de Salud y Protección Social. IV Estudio Nacional de Salud Bucal ENSAB IV. Situación en Salud Bucal. Ministerio de Salud y Protección Social; 2015. [ Links ]
4. Almutairi K, Nossent J, Preen D, Keen H, Inderjeeth C. The global prevalence of rheumatoid arthritis: a meta-analysis based on a systematic review. Rheumatol Int. 2021; 41 (5): 863-877. doi: 10.1007/s00296-020-04731-0. [ Links ]
5. Fernández-Ávila DG, Rincón-Riaño DN, Bernal-Macías S, Gutiérrez Dávila JM, Rosselli D. Prevalencia de la artritis reumatoide en Colombia según información del Sistema Integral de Información de la Protección Social. Rev Colomb Reumatol. 2019; 26: 83-87. doi: 10.1016/j.rcreue.2019.01.009. [ Links ]
6. Goh V, Hassan FW, Baharin B, Rosli TI. Impact of psychological states on periodontitis severity and oral health-related quality of life. J Oral Sci. 2021. doi: 10.2334/josnusd.21-0267. [ Links ]
7. Akram A, Georgiou P, Shi W, Proute MC, Serhiyenia T, Pradeep R, Kerolos ME, Kothur N, Khan S. Impact of Change in Lifestyle and Exercise on Cognitive Function in Patients With Rheumatoid Arthritis: A Systematic Review. Cureus. 2021; 13 (9): e18268. doi: 10.7759/cureus.18268. [ Links ]
8. Berthelot JM, Le Goff B. Rheumatoid arthritis and periodontal disease. Joint Bone Spine. 2010;77(6):537-41. doi: 10.1016/j.jbspin.2010.04.015. [ Links ]
9. Mikuls TR, Payne JB, Yu F, Thiele GM, Reynolds RJ, Cannon GW et al. Periodontitis and Porphyromonas gingivalis in patients with rheumatoid arthritis. Arthritis Rheumatol. 2014; 66 (5): 1090-100. doi: 10.1002/art.38348. [ Links ]
10. Disale PR, Zope SA, Suragimath G, Varma AS, Pisal A. Prevalence and severity of periodontitis in patients with established rheumatoid arthritis and osteoarthritis. J Family Med Prim Care. 2020; 9 (6): 2919-2925. doi: 10.4103/jfmpc.jfmpc_398_20. [ Links ]
11. Brandl C, Bucci L, Schett G, Zaiss MM. Crossing the barriers: Revisiting the gut feeling in rheumatoid arthritis. Eur J Immunol. 2021; 51 (4): 798-810. doi: 10.1002/eji.202048876. [ Links ]
12. McInnes IB, Schett G. The pathogenesis of rheumatoid arthritis. N Engl J Med. 2011; 365(23): 2205-2219. doi: 10.1056/NEJMra1004965. [ Links ]
13. Potempa J, Mydel P, Koziel J. The case for periodontitis in the pathogenesis of rheumatoid arthritis. Nat Rev Rheumatol. 2017; 13 (10): 606-620. doi: 10.1038/nrrheum.2017.132. [ Links ]
14. Kondo N, Kuroda T, Kobayashi D. Cytokine Networks in the Pathogenesis of Rheumatoid Arthritis. Int J Mol Sci. 2021; 22 (20): 10922. doi: 10.3390/ijms222010922. [ Links ]
15. Keirns BH, Lucas EA, Smith BJ. Phytochemicals affect T helper 17 and T regulatory cells and gut integrity: implications on the gut-bone axis. Nutr Res. 2020; 83: 30-48. doi: 10.1016/j.nutres.2020.08.006. [ Links ]
16. Yu HC, Lu MC. The roles of anti-citrullinated protein antibodies in the immunopathogenesis of rheumatoid arthritis. Ci Ji Yi Xue Za Zhi. 2019; 31 (1): 5-10. doi: 10.4103/tcmj.tcmj_116_18. [ Links ]
17. Jenning M, Marklein B, Ytterberg J, Zubarev RA, Joshua V, van Schaardenburg D et al. Bacterial citrullinated epitopes generated by Porphyromonas gingivalis infection-a missing link for ACPA production. Ann Rheum Dis. 2020; 79 (9): 1194-1202. doi: 10.1136/annrheumdis-2019-216919. [ Links ]
18. Hitchon CA, Chandad F, Ferucci ED, Willemze A, Ioan-Facsinay A, van der Woude D et al. Antibodies to porphyromonas gingivalis are associated with anticitrullinated protein antibodies in patients with rheumatoid arthritis and their relatives. J Rheumatol. 2010; 37 (6): 1105-1112. doi: 10.3899/jrheum.091323. [ Links ]
19. Oluwagbemigun K, Yucel-Lindberg T, Dietrich T, Tour G, Sherina N, Hansson M et al. A cross-sectional investigation into the association between Porphyromonas gingivalis and autoantibodies to citrullinated proteins in a German population. Ther Adv Musculoskelet Dis. 2019; 11: 1759720X19883152. doi: 10.1177/1759720X19883152. [ Links ]
20. Perricone C, Ceccarelli F, Saccucci M, Di Carlo G, Bogdanos DP, Lucchetti R, Pilloni A, Valesini G, Polimeni A, Conti F. Porphyromonas gingivalis and rheumatoid arthritis. Curr Opin Rheumatol. 2019; 31 (5): 517-524. doi: 10.1097/BOR.0000000000000638. [ Links ]
21. Gaudilliere DK, Culos A, Djebali K, Tsai AS, Ganio EA, Choi WM et al. Systemic Immunologic Consequences of Chronic Periodontitis. J Dent Res. 2019; 98 (9): 985-993. doi:10.1177/0022034519857714. [ Links ]
22. Cosgarea R, Tristiu R, Dumitru RB, Arweiler NB, Rednic S, Sirbu CI et al. Effects of nonsurgical periodontal therapy on periodontal laboratory and clinical data as well as on disease activity in patients with rheumatoid arthritis. Clin Oral Investig. 2019; 23 (1): 141-151. doi: 10.1007/s00784-018-2420-3. [ Links ]
23. Kaur S, Bright R, Proudman SM, Bartold PM. Does periodontal treatment influence clinical and biochemical measures for rheumatoid arthritis? A systematic review and meta-analysis. Semin Arthritis Rheum. 2014; 44 (2): 113-122. doi: 10.1016/j.semarthrit.2014.04.009. [ Links ]
24. Monsarrat P, Fernandez de Grado G, Constantin A, Willmann C, Nabet C, Sixou M et al. The effect of periodontal treatment on patients with rheumatoid arthritis: The ESPERA randomised controlled trial. Joint Bone Spine. 2019; 86 (5): 600-609. doi: 10.1016/j.jbspin.2019.02.006. [ Links ]
25. Papapanou PN, Sanz M, Buduneli N, Dietrich T, Feres M, Fine DH et al. Periodontitis: Consensus report of Workgroup 2 of the 2017 World Workshop on the Classification of Periodontal and Peri-Implant Diseases and Conditions. J Clin Periodontol. 2018; 45 (Suppl 20): S162- S170. doi: 10.1111/jcpe.12946. [ Links ]
26. Botero JE, Contreras A, Lafaurie G, Jaramillo A, Betancourt M, Arce RM. Occurrence of periodontopathic and superinfecting bacteria in chronic and aggressive periodontitis subjects in a Colombian population. J Periodontol. 2007; 78 (4): 696-704. doi: 10.1902/jop.2007.060129. [ Links ]
27. Kaushal S, Singh AK, Lal N, Das SK, Mahdi AA. Effect of periodontal therapy on disease activity in patients of rheumatoid arthritis with chronic periodontitis. J Oral Biol Craniofac Res. 2019; 9 (2): 128-132. doi: 10.1016/j.jobcr.2019.02.002. [ Links ]
28. Buwembo W, Munabi IG, Kaddumukasa M, Kiryowa H, Mbabali M, Nankya E et al. Nonsurgical oral hygiene interventions on disease activity of Rheumatoid arthritis patients with periodontitis: A randomized controlled trial. J Dent Res Dent Clin Dent Prospects. 2020; 14 (1): 26-36. doi: 10.34172/joddd.2020.004. [ Links ]
29. Tang Q, Fu H, Qin B, Hu Z, Liu Y, Liang Y et al. A Possible Link Between Rheumatoid Arthritis and Periodontitis: A Systematic Review and Meta-analysis. Int J Periodontics Restorative Dent. 2017; 37 (1): 79-86. doi: 10.11607/prd.2656. [ Links ]
30. He S, Zhou Q, Luo B, Chen B, Li L, Yan F. Chloroquine and 3-Methyladenine Attenuates Periodontal Inflammation and Bone Loss in Experimental Periodontitis. Inflammation. 2020; 43 (1): 220-230. doi: 10.1007/s10753-019-01111-0. [ Links ]
31. Heredia-P AM, Lafaurie GI, Bautista-Molano W, Trujillo TG, Chalem-Choueka P, Bello-Gualtero JM et al. Predictive factors related to the progression of periodontal disease in patients with early rheumatoid arthritis: a cohort study. BMC Oral Health. 2019; 19 (1): 240. doi: 10.1186/s12903-019-0939-6. [ Links ]
32. Punceviciene E, Rovas A, Puriene A, Stuopelyte K, Vitkus D, Jarmalaite S, Butrimiene I. Investigating the relationship between the severity of periodontitis and rheumatoid arthritis: a cross-sectional study. Clin Rheumatol. 2021; 40(8):3153-3160. doi: 10.1007/s10067-021-05661-3. [ Links ]
33. Pisano GMM, González PA. Modifying habits and treatment adherence, essential for controlling the chronic disease. Enferm Clin. 2014; 24(1): 59-66. DOI: 10.1016/j.enfcli.2013.10.006. [ Links ]
34. Tachibana M, Yonemoto Y, Okamura K, Suto T, Sakane H, Kaneko T et al. Does periodontitis affect the treatment response of biologics in the treatment of rheumatoid arthritis? Arthritis Res Ther. 2020; 22 (1): 178. doi: 10.1186/s13075-020-02269-x. [ Links ]
35. Sproston NR, Ashworth JJ. Role of C-Reactive Protein at Sites of Inflammation and Infection. Front Immunol. 2018; 139:754. doi: 10.3389/fimmu.2018.00754. [ Links ]
36. Ajeganova S, Huizinga T. Sustained remission in rheumatoid arthritis: latest evidence and clinical considerations. Ther Adv Musculoskelet Dis. 2017; 9 (10): 249-262. doi: 10.1177/1759720X17720366. [ Links ]
37. Yang NY, Wang CY, Chyuan IT, Wu KJ, Tu YK, Chang CW et al. Significant association of rheumatoid arthritis-related inflammatory markers with nonsurgical periodontal therapy. J Formos Med Assoc. 2018; 117 (11): 1003-1010. doi: 10.1016/j.jfma.2017.11.006. [ Links ]
38. Nguyen VB, Nguyen TT, Huynh NC, Nguyen KD, Le TA, Hoang HT. Effects of nonsurgical periodontal treatment in rheumatoid arthritis patients: A randomized clinical trial. Dent Med Probl. 2021; 58 (1): 97-105. doi: 10.17219/dmp/131266. [ Links ]
39. de Smit MJ, Westra J, Posthumus MD, Springer G, van Winkelhoff AJ, Vissink A et al. Effect of Anti-Rheumatic Treatment on the Periodontal Condition of Rheumatoid Arthritis Patients. Int J Environ Res Public Health. 2021; 18 (5): 2529. doi: 10.3390/ijerph18052529. [ Links ]
40. Sun J, Zheng Y, Bian X, Ge H, Wang J, Zhang Z. Nonsurgical periodontal treatment improves rheumatoid arthritis disease activity: a meta-analysis. Clin Oral Investig. 2021; 25(8):4975-4985 doi: 10.1007/s00784-021-03807-w. [ Links ]
41. Sakkas LI, Bogdanos DP, Katsiari C, Platsoucas CD. Anti-citrullinated peptides as autoantigens in rheumatoid arthritis-relevance to treatment. Autoimmun Rev. 2014; 13 (11): 1114-1120. doi: 10.1016/j.autrev.2014.08.012. [ Links ]
42. Moura MF, Cota LOM, Silva TA, Cortelli SC, Ferreira GA, López MM et al. Clinical and microbiological effects of nonsurgical periodontal treatment in individuals with rheumatoid arthritis: a controlled clinical trial. Odontology. 2021; 109 (2): 484-493. doi: 10.1007/s10266-020-00566-0. [ Links ]
43. Socransky SS, Haffajee AD. Dental biofilms: difficult therapeutic targets. Periodontol 2000. 2002; 28: 12-55. doi: 10.1034/j.1600-0757.2002.280102.x. [ Links ]
44. Lee JY, Choi IA, Kim JH, Kim KH, Lee EY, Lee EB, Lee YM, Song YW. Association between anti-Porphyromonas gingivalis or anti-a-enolase antibody and severity of periodontitis or rheumatoid arthritis (RA) disease activity in RA. BMC Musculoskelet Disord. 2015; 12(16): 190. doi: 10.1186/s12891-015-0647-6. [ Links ]
45. Reichert S, Schlumberger W, Dähnrich C, Hornig N, Altermann W, Schaller HG, et al. Association of levels of antibodies against citrullinated cyclic peptides and citrullinated aa-enolase in chronic and aggressive periodontitis as a risk factor of Rheumatoid arthritis: A case control study. J Transl Med. 2015; 13 (1): 1-10. doi: 10.1186/s12967-015-0625-7. [ Links ]
46. Smiley CJ, Tracy SL, Abt E, Michalowicz BS, John MT, Gunsolley J et al. Evidence-based clinical practice guideline on the nonsurgical treatment of chronic periodontitis by means of scaling and root planing with or without adjuncts. J Am Dent Assoc. 2015; 146 (7): 525-35. doi: 10.1016/j.adaj.2015.01.026. [ Links ]
47. Claffey N. Decision making in periodontal therapy. The re-evaluation. J Clin Periodontol. 1991; 18 (6): 384-389. doi: 10.1111/j.1600-051x.1991.tb02305.x. [ Links ]
Notas:
Recibido: 26 de Junio de 2021; Revisado: 09 de Agosto de 2021; Aprobado: 14 de Septiembre de 2021











 text in
text in