Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Colombia Médica
On-line version ISSN 1657-9534
Colomb. Med. vol.53 no.1 Cali Jan./Mar. 2022 Epub Jan 25, 2022
https://doi.org/10.25100/cm.v53i1.5050
articulo original
Epidemiología del cáncer en Cali, 60 años de experiencia
1Universidad del Valle, Registro Poblacional de Cáncer. Cali, Colombia.
2Universidad del Valle, Facultad de Salud, Escuela de Medicina. Departamento de Patología, Cali, Colombia.
3 Hospital Universitario del Valle “Evaristo García” E.S.E., Cali, Colombia.
4 Universidad del Valle, Facultad de Salud, Doctorado en Salud, Cali, Colombia.
5Secretaria de Salud Pública de Cali, Cali, Colombia.
6Universidad del Valle, Facultad de Salud, Escuela de Medicina, Departamento de Otolaringología Cali, Colombia.
Antecedentes:
El registro poblacional de Cáncer de Cali-Colombia, opera desde 1962 divulgando continuamente la información de incidencia en los XI volúmenes de Cancer Incidence in Five Continents.
Objetivo:
Describir las tasas de incidencia y mortalidad del periodo 2011-2020 y los cambios en la tendencia de las tasas de incidencia (1962-2017) y mortalidad por cáncer (1986-2020).
Métodos:
Se utilizó el modelo de Joinpoint y el cambio porcentual anual (APC) como medidas de resumen de los cambios en las tendencias de las tasas de incidencia (ASR-I) y mortalidad (ASR-M) estandarizadas por edad con el método directo.
Resultados:
Durante el periodo 1988-2017 las ASR-I para todas las localizaciones aumentaron anualmente 0.4% (IC 95%: 0.2; 0.6) en los hombres y disminuyeron anualmente 0.2% (IC 95%: -0.3; -0.1) en las mujeres. Las ASR-I de los cánceres relacionados con actividades de tamización de oportunidad (próstata y mama) aumentaron hasta principios del siglo XXI y luego descendieron. Las ASR-I de los canceres relacionados con agentes infecciosos continúan disminuyendo (cérvix, vulva y estómago). Hay evidencias de control de los cánceres relacionados al consumo de tabaco (pulmón, cavidad oral, vejiga). En ambos sexos aumentaron las ASR-I de los cánceres de tiroides, colorrectal y linfomas y disminuyeron las de cáncer de ovario. Entre 1984-2020 las ASR-M para todas las localizaciones disminuyeron anualmente 0.7% (IC 95%: -0.9; -0.5) en los hombres y 1.1% (IC 95%: -1.3; -0.9) en las mujeres. Para ambos sexos, disminuyeron las ASR-M para los cánceres de esófago, estómago, pulmón, vejiga, linfomas y leucemias; y aumentaron en cáncer colorrectal. Las ASR-M por cáncer de cérvix y próstata disminuyeron anualmente 3.5% (IC 95%: -3.9; -3.2) y 0.1% (IC 95%: -0.5; -0.3), respectivamente.
Comentario:
Esta información permite construir algunos indicadores para monitorear la iniciativa City Cancer Challenge y el actual Plan Decenal para el Control del Cáncer en Colombia, 2011-2021.
Palabras clave: Cali; Colombia; cáncer; tendencias de cáncer; epidemiología; adulto; anciano; niños; mujer; humano; incidencia; hombre; morbilidad; mortalidad; neoplasmas; patología; registros; tasa de sobrevivencia; adulto joven
Background:
The population-based Cancer Registry of Cali Colombia operates continuously since 1962, disseminating incidence information in the XI volumes of Cancer Incidence in Five Continents.
Aim:
To describe the incidence and mortality rates for the period 2011-2020 and the changes in the trend of incidence rates (1962-2017) and mortality rates from cancer (1986-2020).
Methods:
The Joinpoint model and the annual percentage change (APC) were used as summary measures of the changes in the trends of incidence rates (ASR-I) and mortality (ASR-M) standardized by age with the direct method.
Results:
Trough 1988-2017 the ASR-I for all locations increased 0.4% annually (95% CI: 0.2, 0.6) in men and decreased annually 0.2% (95% CI: -0.3; -0.1) in women. The ASR-Is of cancers related to opportunity screening activities (prostate and breast) increased until the early 21st century and then decreased. The ASR-I of cancers related to infectious agents continue to decrease (cervix, vulva, and stomach). There is evidence of control of cancer related to tobacco consumption (lung, oral cavity, bladder). In both sexes, the ASR-I of thyroid, colorectal and lymphoma cancers increased and those of ovarian cancer decreased. Between 1984-2020 the ASR-M for all locations decreased annually 0.7% (95% CI: -0.9, -0.5) in men and 1.1% (95% CI: -1.3, -0.9) in women. For both sexes, ASR-M decreased for cancers of the esophagus, stomach, lung, bladder, lymphomas, and leukemias; and increased in colorectal cancer. The ASR-M for cervical and prostate cancer decreased annually by 3.5% (95% CI: -3.9, -3.2) and 0.1% (95% CI: -0.5, -0.3), respectively.
Comment:
This information allows the construction of some indicators to monitor the City Cancer Challenge initiative and the current 10-year plan for cancer control in Colombia, 2011-2021.
Key words: Cali; Cancer; Colombia; trends; neoplasms; epidemiology; adult; age distribution; aged; 80 and over; child; female; humans; incidence; infant; male; middle aged; morbidity; mortality; pathology; registries; survival rate; young adult
Contribución del estudio
| 1) ¿Por qué se realizó este estudio? |
| Actualizar la información de incidencia (2013-2017), mortalidad (2011-2020); y describir los cambios en la tendencia de las tasas de incidencia y mortalidad por cáncer en Cali, Colombia desde 1962 a 2017 y 1984 a 2020, respectivamente. |
| 2) ¿Cuáles fueron los resultados más relevantes del estudio? |
| Las tasas de incidencia de los cánceres relacionados con actividades de tamización (próstata y mama) aumentaron hasta principios del siglo XXI y luego descendieron en la segunda década. Con la implementación de la citología aspirativa y el desarrollo de nuevos métodos de imágenes diagnósticas hubo aumentó del cáncer de tiroides. En contraste, las tasas de incidencia y mortalidad de los canceres relacionados con agentes infecciosos continúan disminuyendo (cérvix y estómago) con aceleración de la tendencia en el último quinquenio. Hay evidencias de control de los cánceres relacionados al consumo de tabaco (pulmón, cavidad oral, vejiga). |
| 3¿Qué aportan estos resultados? |
| Algunos indicadores que servirán para evaluar la iniciativa City Cancer Challenge; y evidencias de avances en el control de la incidencia y mortalidad para algunos tipos de cáncer priorizados por el Plan Decenal para el Control del cáncer colombiano. |
Introducción
Las enfermedades crónicas no transmisibles (ENT) ocasionan anualmente en el mundo el 71% de todas las muertes. Una de cada cinco de estas defunciones es atribuida al cáncer 1,2, un problema de salud pública global en aumento, ocasionado por un grupo de enfermedades de larga duración que son la primera o segunda causa de muerte prematura en personas de 30 a 69 años en 134 países del mundo 3. Para el 2040, se estima la aparición de 30.2 millones de casos nuevos de cáncer en el mundo, dos terceras partes ocurrirán en países de bajos y medianos ingresos, donde las tasas de curación son más bajas; y 20% de los diagnósticos de cáncer sobrevendrán en personas menores de 75 años 4.
"La distribución de los tipos de cáncer varía entre países y las tasas estandarizadas por edad se expresan en casos por 100,000 personas-año de incidencia (ASR-I) y mortalidad (ASR-M). Estas tasas son las medidas de ocurrencia utilizadas para describir cada tipo de cáncer.” En 2020, las ASR-I, para las cinco localizaciones más frecuentes de cáncer en el mundo fueron mama (47.8), próstata (30.7), pulmón (22.4), colorrectal (19.5) y cuello uterino (13.3). El cáncer de pulmón fue la principal causa de muerte por cáncer, (ASR-M = 14.1) 5.
Según la Organización Mundial de la Salud (OMS), entre el 30 y 50% de los cánceres son evitables. Para reducir la carga de la enfermedad es necesario reducir los factores de riesgo conocidos e implementar estrategias de prevención encaminadas al diagnóstico precoz, tratamiento oportuno y cuidado adecuado de los pacientes 6. Estas estrategias coinciden con el tercero de los Objetivos de Desarrollo Sostenible (ODS), que pretende reducir para 2030 un tercio de las muertes prematuras causadas por las ENT 7.
El impacto económico del cáncer sobre la población y los sistemas de salud es significativo; sin embargo, hay evidencias que las inversiones en salud son costo-efectivas. Se estima que para salvar 7.3 millones de vidas a 2030, se requiere una mínima inversión del gasto per cápita que puede variar entre US$ 2.7 dólares en los países de altos ingresos, a US$ 3.95 y US$ 8.15 dólares en los países de altos-medianos y bajos-medianos ingresos, respectivamente 4. Si entre 2020 y 2030 hay un incremento adicional del 6.9%, en los costos del tratamiento para la ampliación integral de los tratamientos, las imágenes y la calidad en la atención contra el cáncer, se evitaría el 12.5% de las muertes en el mundo con 2.9 billones de dólares en beneficios económicos de por vida y un rendimiento por cada dólar invertido de US$12.43 dólares 8.
Uno de cada cinco países de bajos-medianos ingresos cuenta con la información necesaria para impulsar las políticas contra la enfermedad 9. La vigilancia en salud y el control del cáncer requiere gestión de información de calidad. El gobierno colombiano ha organizado el sistema nacional de información en cáncer y determina las funciones y responsabilidades de los actores del sistema de salud indicando las fuentes e integración de información, así como los mecanismos para su mejoramiento 10. Los seis registros regionales de cáncer de base poblacionales hacen parte del sistema nacional de información en cáncer y tienen como finalidad registrar los casos incidentes en áreas geográficas definidas: Cali, Pasto, Manizales, Bucaramanga, Barranquilla y Medellín 11. La información que proporcionan sirve para medir y controlar el impacto del cáncer en la comunidad, representan el estándar de oro para suministrar las cifras de incidencia y supervivencia al cáncer en cada región, y son un elemento clave para el control del cáncer porque proporcionan indicadores para planificar y evaluar las actividades de control del cáncer y realizar investigaciones 12.
El Registro Poblacional de Cáncer de Cali (RPCC) opera continuamente desde 1962 monitoreando el impacto del cáncer en la ciudad 11,13,14. El RPCC es miembro acreditado de la International Association of Cancer Registries (IACR) y cumple con los estándares internacionales de calidad recomendados por la Agencia Internacional de Investigación en Cáncer (IARC, por sus siglas en inglés) 15. Este estudio presenta las tasas estandarizadas por edad en incidencia (2013 a 2017) y mortalidad por cáncer (2011 a 2020); y describe los cambios en las tendencias temporales de las tasas de incidencia y mortalidad por cáncer desde 1962 a 2017 y 1984 a 2020, respectivamente.
Materiales y Métodos
Población y área del registro
Cali es la tercera ciudad de Colombia, capital del Departamento del Valle del Cauca, su estructura demográfica se presenta en la Figura 1 de acuerdo con los censos de 1964 y 2018, se observa cambio en la forma de la pirámide de población, reducción de la base y ensanchamiento de la cúspide, la población se ha cuadruplicado y ha crecido a 2.2 millones de habitantes en 2018, 53.6% son mujeres 16. La población de mayores de 65 años es 11.8% y la de menores de 15 años es 20.9%. Hay 48 adultos mayores (de 65 años y más) por cada 100 niños y jóvenes (menores de 15 años) 16,17. La población de 1964 era considerablemente más joven que la de 2018. Estos datos muestran una notable transformación de la población de Cali en los últimos 60 años. El área de cobertura del registro de cáncer es el municipio de Cali, con una densidad de 40.42 habitantes/hectárea 18.
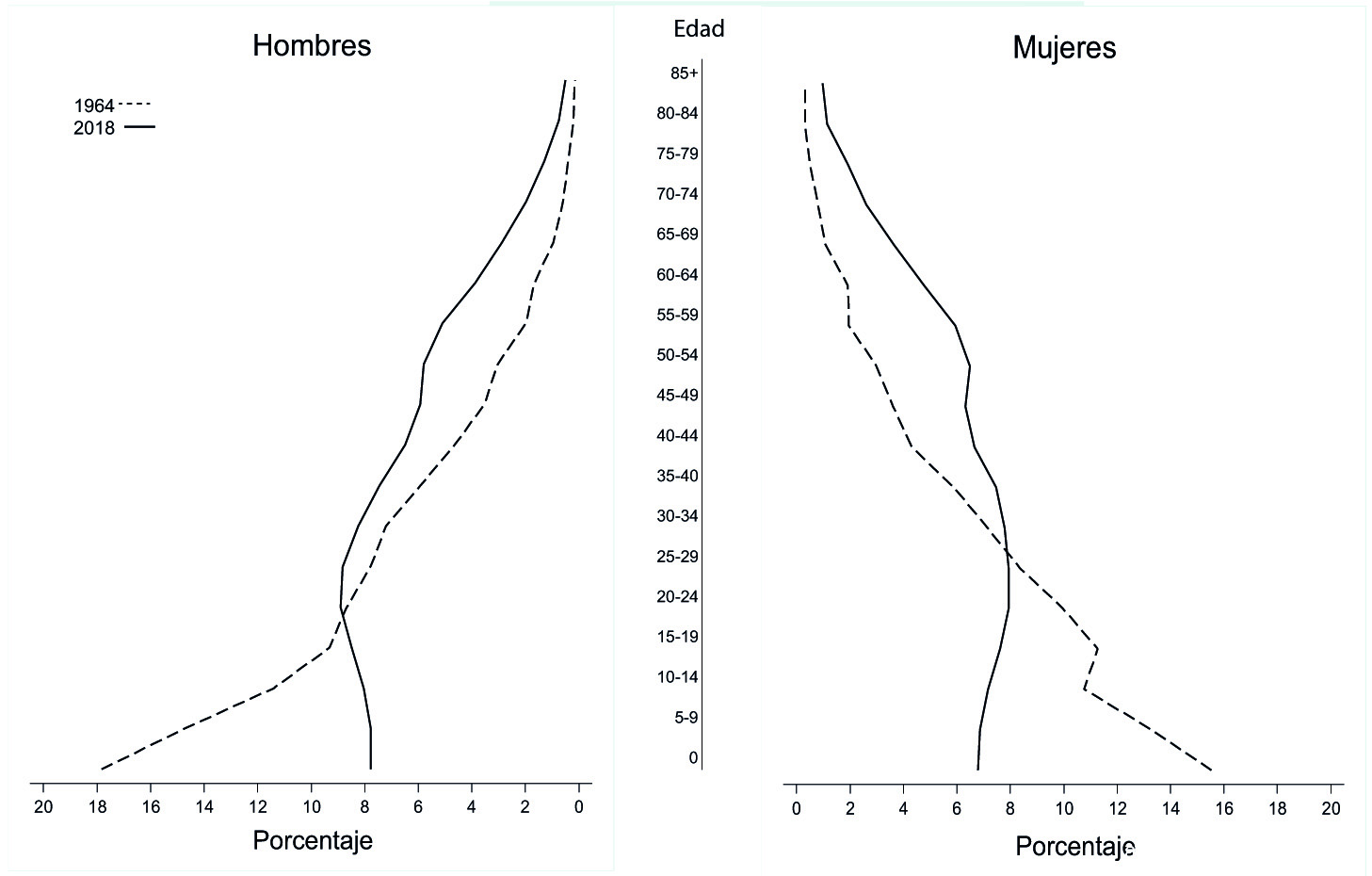
Figura 1 Silueta de las pirámides de población de Cali, 1964 y 2018. La pirámide poblacional de 1964 es expansiva con base amplia y cúspide estrecha. En el 2018 la pirámide poblacional es regresiva, en la base hay menos población que en los tramos intermedios. Por cada 100 menores de 15 años hay 48 personas mayores de 65 años.
Sistema de salud colombiano
Colombia, país de medianos-altos ingresos cuenta con un Sistema General de Seguridad Social en Salud basado en un modelo de aseguramiento solidario fundado bajo los principios de pluralismo estructurado y competencia regulada entre sectores públicos y privados. Este sistema de seguro médico obligatorio y universal, busca dar cobertura a la totalidad de la población independiente de su condición socioeconómica 19,20. Su financiamiento es mixto con aportes de trabajadores, empleadores y gobierno nacional. Aunque la cobertura en salud alcanza el 99% de la población, el sistema aún no es eficiente y continúan existiendo múltiples barreras de oferta y acceso 21.
El modelo de atención oncológica se definió en el Plan Decenal de Control del Cáncer en Colombia 2012-2021, que prioriza los cánceres de cuello uterino, mama, próstata, colorrectal, estómago y cáncer infantil 22. En Cali, la red para la atención oncológica cuenta con 165 servicios oncológicos habilitados, ubicados en el área urbana, donde reside el 95% de la población. La atención es fraccionada y sólo cinco hospitales tienen servicios oncológicos integrados, sólo uno es público 23.
Sistemas de notificación de cáncer
Desde 2014, el Ministerio de Salud estableció un marco regulatorio para notificar de manera obligatoria los casos de cáncer mediante el Sistema de Vigilancia Epidemiología (SIVIGILA) 24 y la Cuenta de Alto Costo (CAC) 25. Se priorizaron todos los casos de cáncer infantil y 11 cánceres de adultos, siete tumores sólidos (mama, próstata, cuello uterino, estómago, colon y recto, pulmón y melanoma) y cuatro neoplasias hematológicas (leucemia aguda linfoblástica y mieloide y linfomas no Hodgkin y Hodgkin). No obstante, se incluyen información de identidad y del tumor para todas las personas con diagnóstico de cáncer ubicado en cualquier sitio anatómico, independientemente de su edad o situación de seguro de salud 26.
La implementación de los sistemas de notificación facilitó las actividades del registro de cáncer durante el periodo 2013-2020 porque la mayoría de las fuentes informaron simultáneamente al sistema de notificación del ministerio de salud y al registro de cáncer.
Extracción de los casos de cáncer
El registro de cáncer de Cali es de base poblacional. Los casos nuevos de cáncer en residentes permanentes de la ciudad se obtienen de manera continua mediante búsqueda activa y notificación. La recolección es continua en los laboratorios diagnósticos (patología, citología, citometría de flujo), hospitales y clínicas; públicas y privadas; y en la Secretaría de Salud Pública Municipal (certificados de defunción y sistemas de notificación de cáncer). Los procedimientos para actualizar la información e incluir los casos nuevos en la base de datos se han descrito previamente 27.
Definición de caso
Hombres y mujeres de cualquier edad, residentes en el área urbana de Cali, con diagnóstico de tumor maligno invasivo por primera vez (incidente), de cualquier localización anatómica, independiente que haya sido confirmado o tratado en forma parcial o total. La base para el diagnóstico puede ser tanto microscópica (citología de líquidos, sangre periférica y médula ósea, histología de tumores primarios y autopsia); como no microscópica (diagnóstico clínico, quirúrgico e imagenológico). Se incluyen tumores malignos primarios únicos o múltiples, todos los tumores del Sistema Nervioso Central (SNC) y cáncer in situ de mama y cérvix. Se excluyen tumores benignos y de comportamiento incierto, tumores malignos de sitio metastásico y carcinoma basocelular y epidermoide de piel (fueron incluidos hasta el año 1986). Los casos que han llegado a la ciudad para fines de tratamiento o diagnóstico no son considerados residentes de Cali 27.
Comparabilidad
Los tumores malignos fueron codificados con la Clasificación Internacional de Enfermedades (CIE) 28. Durante el largo período de registro, 1962-2020, se han utilizado tres versiones (CIE-8, CIE-9 y CIE-10); en 1998 se utilizó el programa IARCTools para hacer la conversión de códigos entre las versiones de la CIE 29. Las principales localizaciones se definieron de acuerdo con las guías sugeridas por la International Agency for Research on Cáncer (IARC) para el análisis de la información de incidencia; y por la OMS para agrupar el sitio primario del tumor y la causa básica de muerte 5,15,27. La fecha de incidencia corresponde a la fecha de la primera confirmación histológica o citológica del cáncer. Para clasificar los tumores primarios múltiples se siguen las guías de la European Network of Cancer Registries (ENCR) y de la IARC/IACR 30,31. Los detalles relativos a la historia, los objetivos, logística, cobertura, procedimientos y métodos para las estimaciones de incidencia, mortalidad y supervivencia en adultos se han descrito previamente 15,27.
Análisis de incidencia y mortalidad
Casos: La información de los casos nuevos de cáncer se obtuvo de la base de datos del RPCC y la información de la mortalidad general se obtiene periódicamente a partir de los certificados individuales de defunción notificados a la Secretaría de Salud Pública Municipal de Cali.
Población a riesgo. La estructura de la población para Cali por sexo y grupos quinquenales de edad para cada año calendario se obtuvo a partir de datos censales oficiales proporcionados por el Departamento Administrativo Nacional de Estadística de Colombia (DANE) 16,18. Se tuvieron en cuenta 18 grupos de edad, usando las categorías 0-4, 5-9, 10-14, 15-19…80-84, 85+).
Estimación de las tasas. Las tasas de incidencia y mortalidad se expresan como tasas promedio anual para un periodo de observación de un quinquenio; el denominador (población total o estrato específico) se convierte en una estimación de personas-año de observación. Se excluyeron del denominador de las tasas de cáncer específicas para un sexo los individuos del sexo opuesto.
Las tasas crudas, tasas estandarizadas, y tasas específicas por edad se expresan por 100,000 personas-año. La estandarización por edad se hizo con el método directo utilizando la población estándar mundial propuesta por Segi (ASR-W, por sus siglas en inglés Age-Standardised Rate) 27,32. Para describir la información de incidencia y mortalidad se utilizarán las siglas ASR-W(I) y ASR-W(M), respectivamente.
La tasa cruda (TC), para todas las edades, se calculó dividiendo el número total de casos de cada tipo de cáncer por el número de personas-año de observación. La tasa específica por edad para cada grupo se calculó dividiendo el número de casos del grupo de edad, por los correspondientes personas-año de observación. Para obtener la ASR-W, las tasas especificas por edad (ai) se multiplicaron por los pesos de la población estándar (pi) resultando el producto aipi, cuya suma se dividió por 100,000.
Análisis de la tendencia de las tasas
La tendencia de las tasas de incidencia y mortalidad por cáncer fue analizada para once quinquenios (1962-2017) y siete quinquenios (1984-2020), respectivamente. La tendencia de las tasas fue examinada mediante el cambio porcentual anual en las tasas (APC) con intervalos de confianza del 95% (IC 95%). Se utilizó el método de mínimos cuadrados ponderados implementado por defecto en el programa SEER * Stat 33. Para identificar el momento en que se produjo los cambios significativos en la tendencia y estimar la tendencia observada en dicho intervalo se utilizó el modelo de regresión de JoinPoint 34. El APC representa el aumento o la disminución porcentual promedio anual en las tasas de cáncer durante un período de tiempo específico. Al describir el cambio, los términos "aumento" o "disminución" se utilizaron cuando el APC fue significativamente diferente de cero (valores de p de dos lados <0.05); de lo contrario, se utilizó el término "estable o plano".
Indicadores de calidad
Información de incidencia
La consistencia interna se evaluó mediante el programa IarcTool 12,29, la validez mediante los métodos de criterio de diagnóstico (porcentaje de casos identificados únicamente por certificados de defunción, proporción de casos verificados morfológicamente y categorizados por sexo y lugar). La completitud se evaluó mediante el análisis de la razón mortalidad: incidencia (M: I) y los análisis de información faltante describen el porcentaje de sitios mal definidos, edad desconocida y base de diagnóstico desconocida.
Información de mortalidad
La calidad de la certificación de la mortalidad se evaluó mediante las siguientes proporciones (%): las muertes por cáncer de útero de sitio no especificado (C55); las muertes por cáncer de primario no establecido, de sitios mal especificados o como consecuencia de un tumor metastásico sin un primario establecido (C76-C80, C97); las muertes por cáncer sin información de edad; las muertes por cáncer que no fueron certificadas por médico; y las muertes por cáncer bien certificadas 35.
Consideraciones éticas
El RPCC sigue las guías de la European Network of Cancer Registries (ENCR) 30. El director del RPCC es responsable de la seguridad de la información. Todos los integrantes del RPCC firman un acuerdo para garantizar la protección de la confidencialidad de los datos sobre las personas cuyo cáncer se informa al RPCC. El acceso al espacio físico del Registro está restringido a las personas autorizadas. La información considerada confidencial se controla mediante claves de acceso a los computadores, archivos cerrados y destrucción de material con identificación cuando ésta ha dejado de ser de utilidad. Una sola persona (administrador) hace los apareamientos iniciales entre bases de datos para detectar casos nuevos y actualizar la información de estado vital y último contacto. A cada caso se le asigna un número de registro y la información que identifica a un paciente se elimina cuando se analizan los datos (nombre y documento de identidad).
Resultados
Casos nuevos de cáncer (2013-2017)
La Tabla 1 muestra las tasas de incidencia de cáncer por cada 100,000 personas-año por sexo y localización para el quinquenio 2013-2017. Durante este periodo se diagnosticaron 24,963 casos nuevos de cáncer en residentes permanentes de Cali, para una media anual de 4,993 casos, 55% (13,772) ocurrieron en las mujeres, la razón mujer/hombre fue de 1.2. Las tasas de incidencia estandarizadas por edad para todas las localizaciones en hombres fueron 191.2; y 175.4 en las mujeres. La proporción de casos de cáncer con verificación morfológica fue 88.8%, y 1.5% tuvieron como única evidencia del diagnóstico de cáncer el certificado de defunción.
Tabla 1 Cali, Colombia. Tasas de incidencia estandarizadas por edad (Población Mundial) por 100,000 per-año y el cambio porcentual anual (APC, por su sigla en inglés) según sexo durante el periodo 2013-2017
| Hombre | Mujer | Hombre | Mujer | Código | |||||
|---|---|---|---|---|---|---|---|---|---|
| Localización | n | ASR | n | ASR | APC | IC 95% | APC | IC 95% | CIE 10 |
| Cavidad oral y faringe | 313 | 5.3 | 241 | 3.1 | -1.0* | (-1.3 ; -0.6) | -1.0* | (-1.5 ; -0.6) | C00-14 |
| Esófago | 117 | 2.0 | 57 | 0.6 | -1.5* | (-2.1 ; -0.8) | ~ | C15 | |
| Estómago | 1,074 | 18.0 | 823 | 9.8 | -1.9* | (-2.1 ; -1.8) | -1.9* | (-2.2 ; -1.7) | C16 |
| Intestino delgado | 44 | 0.7 | 56 | 0.7 | ~ | ~ | C17 | ||
| Colon y Recto | 1,025 | 17.3 | 1,168 | 14.3 | 2.2* | (1.9 ; 2.5) | 1.6* | (1.3 ; 1.9) | C18-20 |
| Ano | 37 | 0.6 | 96 | 1.2 | ~ | ~ | C21 | ||
| Hígado | 272 | 4.7 | 282 | 3.3 | 1.8* | (1.2 ; 2.4) | 0.6 | (-0.1 ; 1.3) | C22 |
| Vesícula biliar | 119 | 2.0 | 244 | 2.9 | -1.3* | (-1.9 ; -0.8) | -2.1* | (-2.6 ; -1.6) | C23-24 |
| Páncreas | 271 | 4.6 | 318 | 3.7 | ~ | 0.0 | (-0.4 ; 0.3) | C25 | |
| Cavidad nasal y oído medio, senos paranasales | 33 | 0.6 | 37 | 0.4 | ~ | ~ | C30-31 | ||
| Laringe | 149 | 2.6 | 28 | 0.3 | -1.5* | (-2.0 ; -1.0) | ~ | C32 | |
| Bronquios y pulmón | 768 | 13.1 | 599 | 6.9 | -1.0* | (-1.5 ; -0.6) | 0.0 | (-0.5 ; 0.5) | C34 |
| Hueso | 97 | 1.6 | 97 | 1.4 | 1.0* | (0.3 ; 1.6) | 0.5 | (-0.3 ; 1.3) | C40-41 |
| Tejido Conectivo | 143 | 2.3 | 143 | 1.9 | ~ | 0.2 | (-0.3 ; 0.7) | C47-49 | |
| Mesotelioma | 14 | 0.2 | 6 | 0.1 | ~ | ~ | C45 | ||
| Sarcoma de Kaposi | 60 | 1.0 | 11 | 0.1 | ~ | ~ | C46 | ||
| Melanoma de piel | 137 | 2.3 | 174 | 2.2 | ~ | 0.4 | (-0.2 ; 1.0) | C43 | |
| Otros de piel | 54 | 0.9 | 68 | 0.9 | ~ | ~ | C44 | ||
| Mama | 58 | 1.0 | 3,546 | 45.9 | ~ | 1.1* | (0.9 ; 1.4) | C50 | |
| Vulva | 47 | 0.5 | -1.9* | (-2.6 ; -1.2) | C51 | ||||
| Vagina | 34 | 0.4 | ~ | C52 | |||||
| Útero, SAI | 62 | 0.8 | ~ | C55 | |||||
| Cuello uterino | 992 | 13.0 | -3.1* | (-3.3 ; -2.9) | C53 | ||||
| Cuerpo Uterino | 400 | 5.1 | 0.2 | (-0.2 ; 0.5) | C54 | ||||
| Ovario | 472 | 6.1 | -0.5* | (-0.8 ; -0.1) | C56 | ||||
| Otros órganos genitales femeninos, placenta | 32 | 0.4 | ~ | C57-58 | |||||
| Pene | 60 | 1.0 | ~ | C60 | |||||
| Próstata | 3,083 | 53.8 | 2.1* | (1.5 ; 2.7) | C61 | ||||
| Testículo | 160 | 2.5 | 1.6* | (1.0 ; 2.2) | C62 | ||||
| Otros órganos genitales masculinos | 7 | 0.1 | ~ | C63 | |||||
| Riñón, pelvis renal, uretra | 298 | 5.1 | 242 | 3.3 | 2.6* | (2.0 ; 3.1) | 2.0* | (1.5 ; 2.5) | C64-66 |
| Vejiga | 301 | 5.1 | 118 | 1.3 | -0.9* | (-1.3 ; -0.5) | -1.4* | (-1.9 ; -0.8) | C67 |
| Otros órganos urinarios | 2 | 0.0 | 0.0 | 0.0 | ~ | ~ | C68 | ||
| Ojo | 78 | 1.3 | 73 | 1.1 | ~ | ~ | C69 | ||
| Sistema nervioso central | 295 | 5.1 | 268 | 3.7 | 1.0* | (0.5 ; 1.4) | 1.5* | (1.0 ; 2.0) | C70-72 |
| Tiroides | 234 | 3.8 | 1,293 | 17.4 | 1.9* | (1.1 ; 2.7) | 2.9* | (2.6 ; 3.3) | C73 |
| Otros endocrinos | 12 | 0.2 | 6.0 | 0.1 | ~ | ~ | C74-75 | ||
| Enfermedad de Hodgkin | 101 | 1.7 | 69 | 1.0 | -1.4* | (-1.9 ; -0.8) | -0.7* | (-1.4 ; -0.1) | C81 |
| Linfoma no Hodgkin | 502 | 8.5 | 467 | 6.0 | 1.5* | (1.0 ; 2.0) | 1.3* | (0.8 ; 1.9) | C82-85, 96 |
| Mieloma múltiple | 187 | 3.1 | 173 | 2.1 | ~ | ~ | C90 | ||
| Leucemia linfocítica | 245 | 4.7 | 177 | 2.6 | 1.9* | (1.4 ; 2.4) | ~ | C91 | |
| Leucemia mieloide y monócitica | 191 | 3.1 | 155 | 2.1 | -0.2 | (-0.8 ; 0.3) | 0.7* | (0.1 ; 1.2) | C92-94 |
| Leucemia inespecífica | 48 | 0.8 | 43 | 0.5 | ~ | ~ | C95 | ||
| Sitios mal definidos | 483 | 8.2 | 528 | 6.4 | -0.5* | (-0.9 ; -0.2) | -1.2* | (-1.6 ; -0.8) | ** |
| Todos los sitios | 11,191 | 191.2 | 13,772 | 175.4 | 0.4* | (0.2 ; 0.6) | -0.2* | (-0.3 ; -0.1) | C00-96 |
| Todos los sitios ¶ | 11,137 | 190.3 | 13,704 | 174.5 | 0.4* | (0.2 ; 0.6) | -0.2* | (-0.3 ; 0.0) | C00-43, 45-96 |
Número de casos (n); Tasa de incidencia estandarizada por edad (ASR, por su sigla en inglés).
APC: Por su sigla en inglés Annual Percent Change. APC es calculado para periodo 1962-2017
*El APC es significativamente diferente de cero (p<0,05)
**C26, C39, C48, C76, C80 - CIE :998_/3
~ El APC no pudo ser calculado
¶Todos los sitios excluyendo cáncer de piel no melanoma
Las cinco principales localizaciones de cáncer primario en hombres fueron próstata (ASR: 53.8), estómago (ASR: 18.0), colon y recto (ASR: 17.3), linfomas (ASR: 13.3) y pulmón (ASR: 13.1), siendo el 60,4% de todos los casos nuevos durante el periodo. En las mujeres, las localizaciones más frecuentes fueron mama (ASR: 45.9), tiroides (ASR: 17.4), colon y recto (ASR: 14.3), cuello uterino (ASR: 13.0), y estómago (ASR: 9.8), correspondiendo al 56.8% de todos los casos nuevos diagnosticados en el periodo.
En la Figura 2 se presentan las tasas específicas por edad de incidencia y mortalidad para todas las localizaciones según sexo durante el periodo 2013-2017.
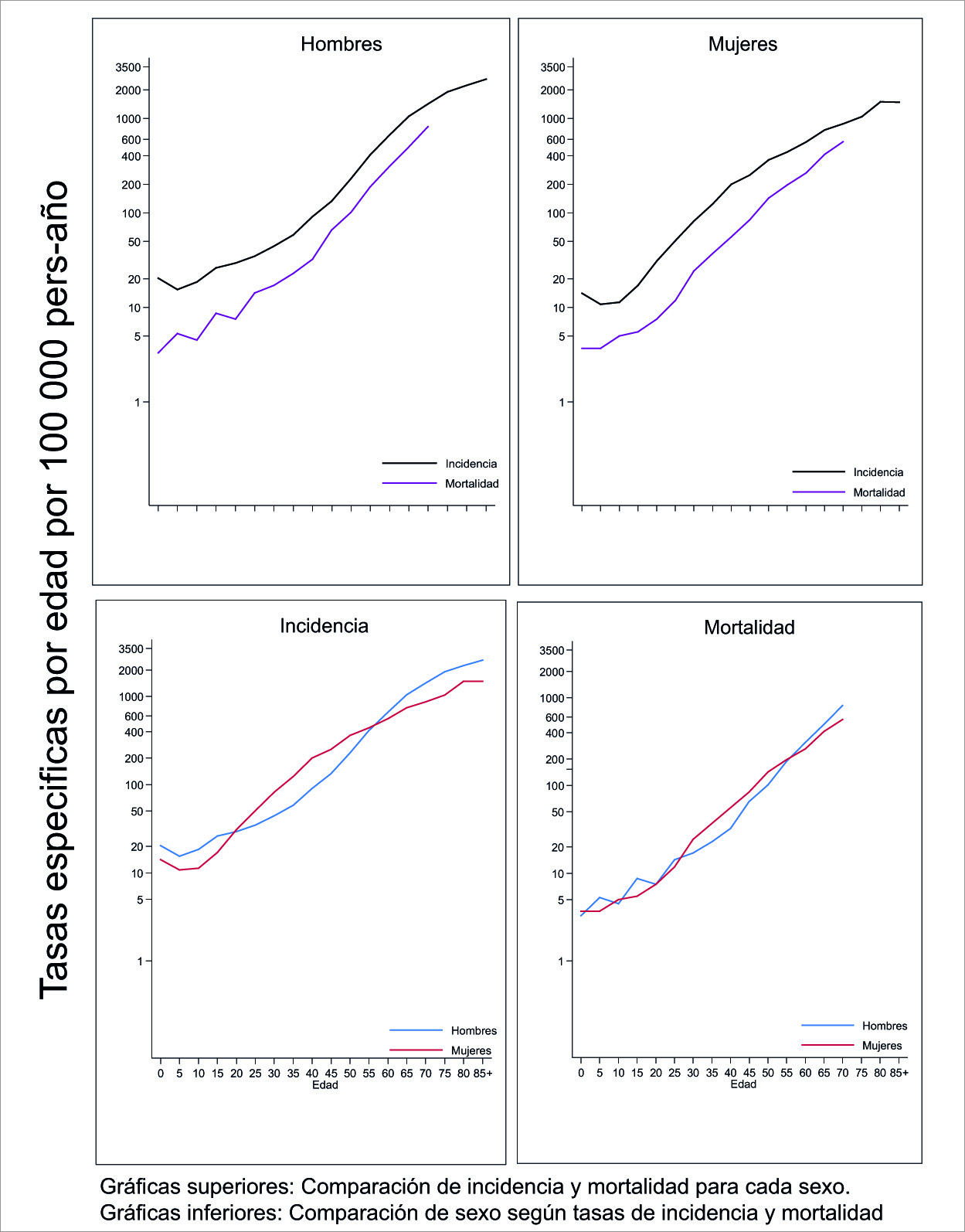
Figura 2 Cali, Colombia. Tasas específicas por edad de incidencia y mortalidad para todas las localizaciones según sexo. 2013-2017. En el panel superior se observan las tasas especificas por edad de la incidencia y la mortalidad para todas las localizaciones de cáncer para cada sexo. Las curvas de incidencia y mortalidad por sexo siguen un curso paralelo y tienden a converger con el envejecimiento siendo más acentuado en las mujeres. El panel inferior muestra que las tasas de incidencia y mortalidad especificas por edad en menores de 50 años son más altas en las mujeres porque el cáncer de cuello uterino y tiroides se desarrolla en edades más tempranas. En los adultos mayores las tasas de incidencia y mortalidad son más altas en los hombres por la influencia de los cánceres aerodigestivos y de próstata. En la infancia las tasas de incidencia son mayores en los hombres.
La Figura 3 muestra las curvas de las tasas de incidencia especificas por edad (C-TEE) y sexo en escala logarítmica para las principales localizaciones, las tasas se expresan por 100,000 personas-año. La Tabla suplementaria 1S muestra las tasas de incidencia y mortalidad especificas por edad durante el quinquenio 2013-2017 y 2016-2020, respectivamente. La mayoría de los cánceres presentan un patrón característico, las C-TTE en menores de 50 años son similares en hombres y mujeres; luego son mayores en los hombres, con excepción de cáncer de tiroides. Se observó aumento de la magnitud de las tasas de incidencia específicas por edad en todas las localizaciones en la medida en que aumenta la edad, excepto en cáncer de tiroides que tiende a disminuir en las mujeres mayores de 60 años. Los cánceres de ovario, tiroides y hematolinfoides se manifiestan desde temprana edad y son infrecuentes por debajo de los 50 años los cánceres de próstata, esófago y laringe.
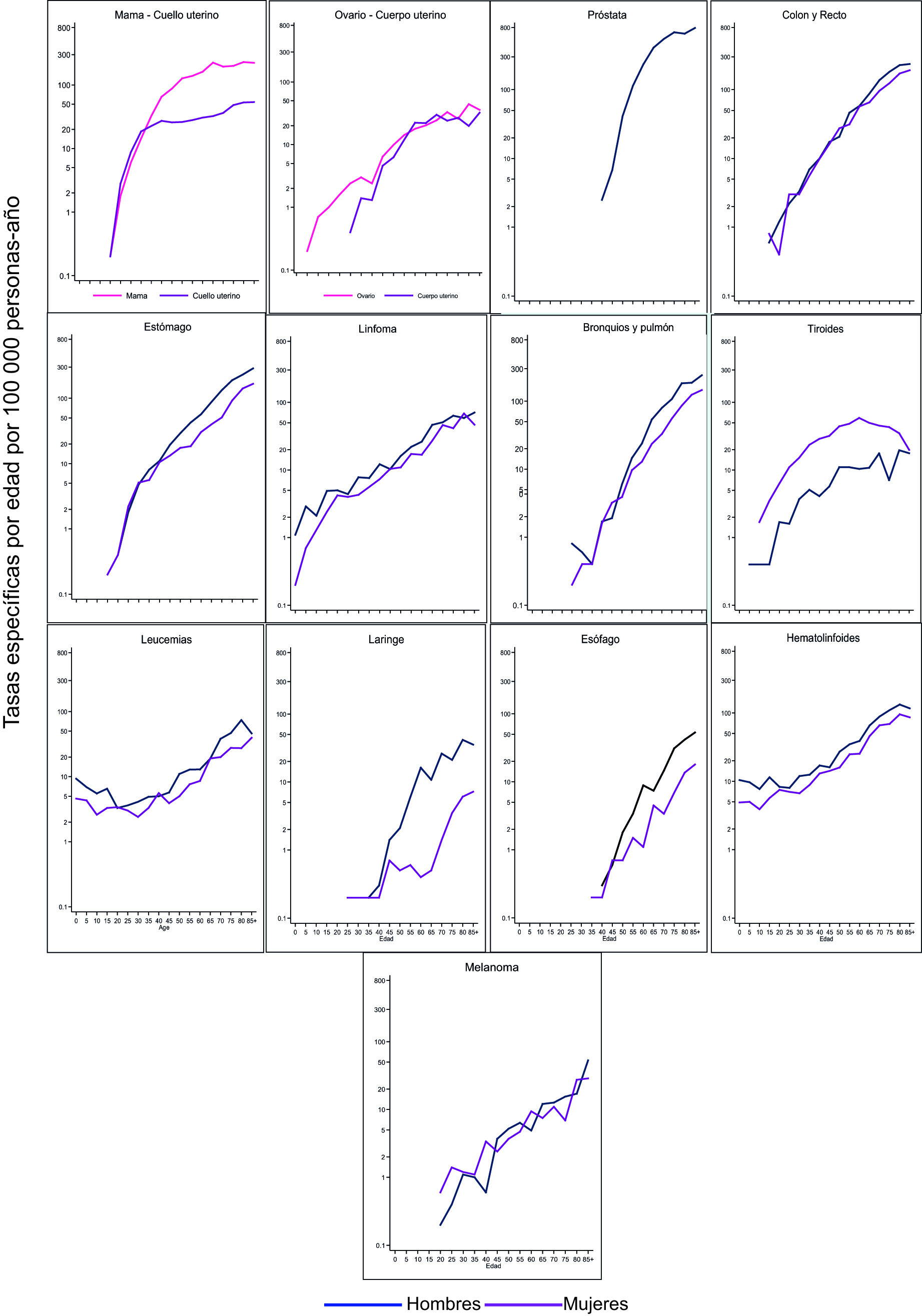
Figura 3 Cali, Colombia. Tasas especificas por edad de incidencia según tipo de cáncer y sexo. 2013-2017
La curva de las tasas especificas por edad de los cánceres hematolinfoides (leucemias y linfomas) tiene forma de U, disminuyendo desde los primeros años de la infancia hasta la adolescencia y luego aumentando desde la adultez hasta la vejez. El patrón es dado por las leucemias, debido a que en los linfomas las tasas incrementan de manera sostenida desde la infancia hasta la vejez.
En el melanoma y en los cánceres aerodigestivos (estómago, colorrectal, esófago, laringe y pulmón) la curva de las tasas de incidencia especificas por edad tiende a ser recta. Se diferencian entre sí, por la pendiente de la curva y por la edad en que empiezan aparecer los casos. Estos cánceres son infrecuentes antes de la cuarta década.
Las curvas de los cánceres específicos de las mujeres empiezan desde la primera década (ovario y tiroides), tercera década (mama y cuello uterino) y más tardíamente el cáncer de cuerpo uterino. Antes de los 50 años es más frecuente el cáncer de cuello uterino que el de mama; luego se invierte la frecuencia. En todos estos cánceres, el ascenso exponencial asociado a la edad se desacelera a partir de la quinta y sexta década, al punto que las mujeres con cáncer de tiroides mayores de 60 años tienen menos riesgo que las menores de esta edad, esta disminución de las ASR sugiere un efecto de cohorte; las mujeres nacidas hace 60 años tenían menos riesgo de morbilidad por cáncer de tiroides. Para analizar exhaustivamente ese componente se necesita apelar a modelos de tipo edad-período-cohorte.
El cáncer de próstata es infrecuente antes de los 50 años, las ASR muestran crecimiento exponencial hasta los 70 y luego se estabilizan alrededor del valor alcanzado en esta edad.
Mortalidad general
Durante la década 2011-2020 ocurrieron 127,797 defunciones en Cali, Tabla 2. El 72% (91,813) fueron ocasionadas por enfermedades crónicas no-transmisibles (Grupo II), el 12% (15,567) por enfermedades comunicables (Grupo I) y 15% (19,422) por lesiones (intensionales y no-intensionales, Grupo III).
Tabla 2 Cali, Colombia. Tasas de mortalidad estandarizadas por edad (Población Mundial) por 100,000 per-año y el cambio porcentual anual (APC, por su sigla en inglés: Annual Percent Change) según sexo durante el periodo 2011-2020
| Localización | 2011-2015 | 2016-2020 | APC | Código CIE 10 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Hombre | Mujer | Hombre | Mujer | Hombre | Mujer | ||||||||
| n | ASR | n | ASR | n | ASR | n | ASR | APC | 95% CI | APC | IC 95% | ||
| Cavidad oral y faringe | 115 | 2.0 | 104 | 1.3 | 148 | 2.3 | 127 | 1.4 | -1.7* | (-2.4 ; -1.0) | 0.2 | (-0.7 ; 1.0) | C00-14 |
| Esófago | 95 | 1.7 | 52 | 0.7 | 130 | 2.0 | 59 | 0.6 | -2.7* | (-3.4 ; -2.0) | -4.0* | (-4.9 ; -3.1) | C15 |
| Estómago | 807 | 14.4 | 659 | 8.2 | 928 | 14.4 | 703 | 7.5 | -2.1* | (-2.4 ; -1.9) | -2.4* | (-2.8 ; -2.1) | C16 |
| Colon y recto | 570 | 10.2 | 606 | 7.5 | 644 | 10 | 770 | 8.1 | 1.7* | (1.2 ; 2.2) | 0.6* | (0.1 ; 1.1) | C18-21 |
| Hígado | 316 | 5.7 | 372 | 4.5 | 366 | 5.7 | 360 | 3.6 | -0.2 | (-0.7 ; 0.2) | -1.8* | (-2.3 ; -1.2) | C22 |
| Páncreas | 252 | 4.5 | 300 | 3.7 | 345 | 5.4 | 430 | 4.5 | 0.2 | (-0.4 ; 0.9) | -0.3 | (-0.9 ; 0.3) | C25 |
| Bronquios y pulmón | 799 | 14.4 | 602 | 7.3 | 839 | 13.1 | 654 | 6.7 | -1.8* | (-2.1 ; -1.5) | -1.0* | (-1.3 ; -0.6) | C34 |
| Melanoma de piel | 152 | 2.7 | 126 | 1.6 | 168 | 2.6 | 152 | 1.6 | 1.8* | (1.1 ; 2.6) | 1.0* | (0.1 ; 1.9) | C43-44 |
| Mama | 7 | 0.1 | 1,054 | 13.8 | 7 | 0.1 | 1,310 | 14.9 | ~ | 0.2 | (-0.2 ; 0.5) | C50 | |
| Cuello uterino | 486 | 6.5 | 516 | 6.0 | -3.5* | (-3.9 ; -3.2) | C53 | ||||||
| Cuerpo uterino | 138 | 1.9 | 223 | 2.5 | -1.2* | (-2.1 ; -0.3) | C54-C55 | ||||||
| Ovario | 302 | 4.0 | 403 | 4.6 | -0.5 | (-1.2 ; 0.2) | C56 | ||||||
| Próstata | 1,012 | 17.4 | 1,114 | 17.1 | -0.1 | (-0.5 ; 0.3) | C61 | ||||||
| Vejiga | 113 | 2.0 | 75 | 0.9 | 141 | 2.2 | 67 | 0.6 | -0.9* | (-1.8 ; -0.1) | -2.6* | (-3.7 ; -1.6) | C67 |
| Linfomas | 330 | 6.0 | 290 | 3.7 | 423 | 6.6 | 355 | 3.9 | -0.3 | (-0.8 ; 0.3) | -0.9* | (-1.5 ; -0.4) | C81-C90.C96 |
| Leucemia | 270 | 4.6 | 246 | 3.5 | 285 | 4.5 | 271 | 3.2 | -0.7* | (-1.2 ; -0.2) | -1.1* | (-1.8 ; -0.3) | C91-95 |
| Otros sitios | 1,193 | 21.0 | 1,333 | 17.2 | 1,452 | 22.7 | 1,520 | 16.7 | -0.4* | (-0.7 ; -0.1) | -1.1* | (-1.4 ; -0.9) | ** |
| Todas las localizaciones | 6,034 | 106.7 | 6,746 | 86.1 | 6,992 | 108.7 | 7,921 | 86.1 | -0.7* | (-0.9 ; -0.5) | -1.1* | (-1.3 ; -0.9) | C00-C97 |
Número de casos (n).
ASR: Tasa de mortalidad estandarizada por edad (ASR, por su sigla en inglés).
APC: Por su sigla en inglés Annual Percent Change. APC es calculado para periodo 1984-2020.
* El APC es significativamente diferente de cero (p<0.05). ~ El APC no pudo ser calculado
** C17. C23. C24. C26-C32. C37-C41. C45-C49. C51. C52. C57-C60. C62-C66. C68-C80. C97
Las causas de muerte varían con la edad, en los niños predominan las enfermedades del grupo I; en los adolescentes y adultos jóvenes menores de 40 años las lesiones (internas y externas), y a partir de la quinta década predominan las enfermedades crónicas no transmisibles. Entre los 30 y 60 años es más frecuente el cáncer, y a partir de la octava década predominan las enfermedades cardiovasculares (Figura 4).
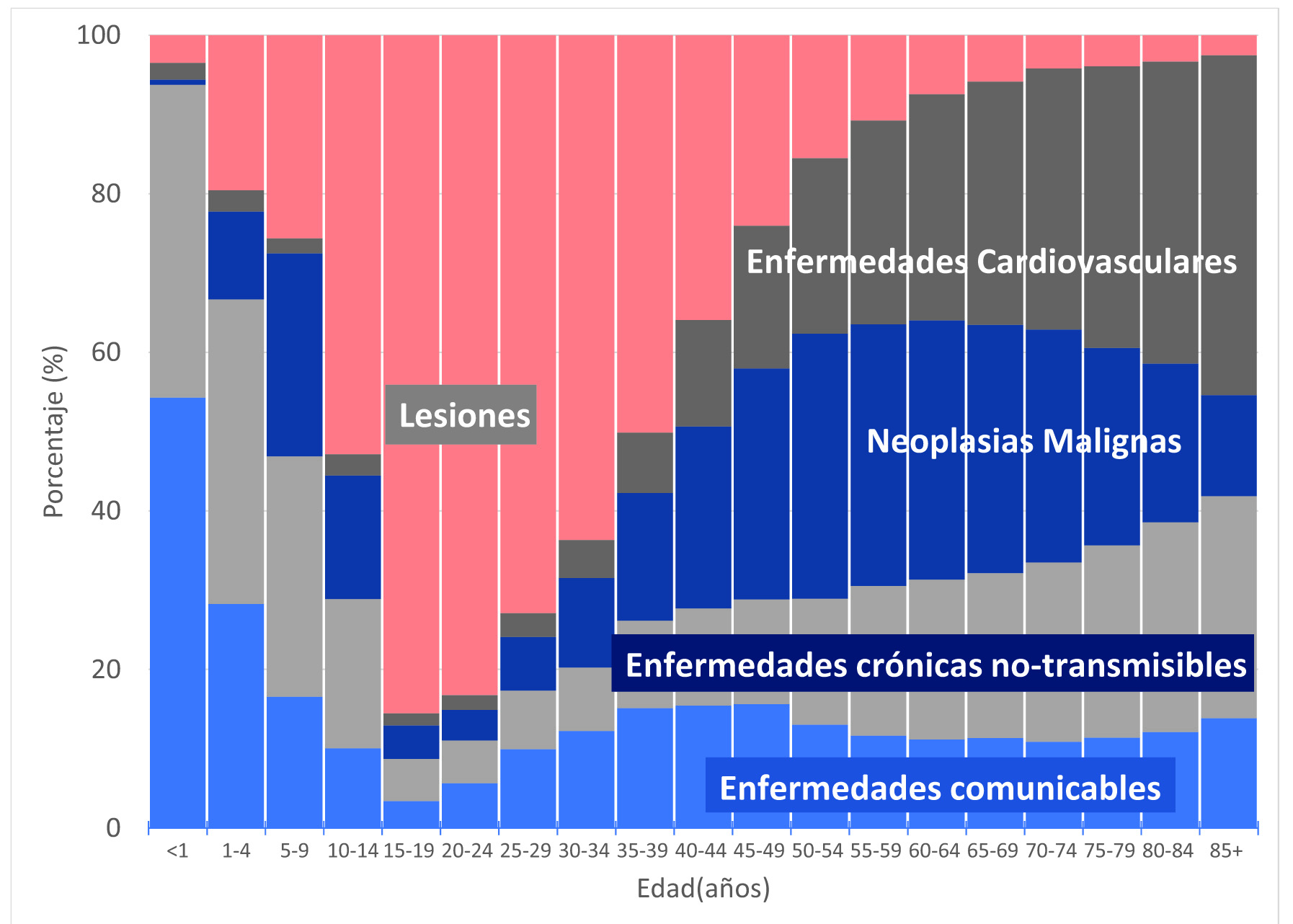
Figura 4 Cali, Colombia. Distribución de frecuencias por edad de las causas de mortalidad agrupadas por las categorías definidas por la OMS, 2011-2020. OMS: Organización Mundial de la Salud. Grupo I: Comunicable, materna, perinatal y nutricional. Grupo II: Enfermedades crónicas no transmisibles (Cáncer, cardiovascular y otras). Grupo III: Lesiones (intensionales y no intensionales).
Mortalidad por cáncer (2011-2020)
Las 27,693 muertes por cáncer ocurridas durante la década representaron el 19.7% de la mortalidad global y el 30.2% de la mortalidad por enfermedades crónicas no-transmisibles. El 53% de las muertes por cáncer ocurrieron en mujeres; 37% en adultos (15-64 años), 62% en mayores de 64 años y 0.8% en niños (0-14 años). La razón de mortalidad incidencia fue 0,56.
La Tabla 2 muestra el número de defunciones y las tasas de mortalidad por cáncer según edad, sexo y periodo durante la década 2011-2020. Aunque el número de muertes fue mayor en las mujeres, las tasas estandarizadas de mortalidad por cáncer por 100,000 personas-año para todas las localizaciones fueron mayores en hombres 108.7; que en las mujeres 86.1; (periodo 2016-2020).
Durante el periodo 2016-2020, en hombres, las cinco principales localizaciones de muerte por cáncer fueron próstata (ASR: 17.1), estómago (ASR: 14.4), pulmón (ASR: 13.1), colon y recto (ASR: 10.0) y linfomas (ASR: 6.6). En mujeres las principales causas de muerte fue cáncer de mama (ASR: 14.9), seguido de cáncer de colon y recto (ASR: 8.1), estómago (ASR: 7.5), pulmón (ASR: 6.7) y cuello uterino (ASR: 6.0).
Cambios en la morbilidad y mortalidad
La Tabla 3 muestra el análisis de tendencia de las tasas de incidencia (ASR-W-I) y mortalidad (ASR-W-M) para el periodo 1962-2017 y 1984-2020, respectivamente. El APC representa el cambio promedio porcentual anual de las tasas. Se definió aumento o disminución cuando el APC fue significativamente diferente de cero (valores de dos colas p <0.05); de lo contrario se consideró una tasa estable o plana. La información de las tasas de incidencia estandarizadas por edad del periodo 1962-2017 y de las tasas de mortalidad del periodo 1984-2020 se describen en las Tablas suplementarias 2S y 3S.
Tabla 3 Cali, Colombia. Cambio porcentual anual (APC, por su sigla en inglés) en incidencia (1962-2017) y mortalidad (1984-2020) según sexo
| Localización | Mortalidad | Código CIE 10 | |||||||
|---|---|---|---|---|---|---|---|---|---|
| Hombre | Mujer | Hombre | Mujer | ||||||
| APC | IC 95% | APC | IC 95% | APC | IC 95% | APC | IC 95% | ||
| Cavidad oral y faringe | -1.0* | (-1.3 ; -0.6) | -1.0* | (-1.5 ; -0.6) | -1.7* | (-2.4 ; -1.0) | 0.2 | (-0.7 ; 1.0) | C00-14 |
| Esófago | -1.5* | (-2.1 ; -0.8) | ~ | -2.7* | (-3.4 ; -2.0) | -4.0* | (-4.9 ; -3.1) | C15 | |
| Estómago | -1.9* | (-2.1 ; -1.8) | -1.9* | (-2.2 ; -1.7) | -2.1* | (-2.4 ; -1.9) | -2.4* | (-2.8 ; -2.1) | C16 |
| Colon y recto | 2.2* | (1.9 ; 2.5) | 1.6* | (1.3 ; 1.9) | 1.7* | (1.2 ; 2.2) | 0.6* | (0.1 ; 1.1) | C18-21 |
| Hígado | 1.8* | (1.2 ; 2.4) | 0.6 | (-0.1 ; 1.3) | -0.2 | (-0.7 ; 0.2) | -1.8* | (-2.3 ; -1.2) | C22 |
| Páncreas | ~ | 0.0 | (-0.4 ; 0.3) | 0.2 | (-0.4 ; 0.9) | -0.3 | (-0.9 ; 0.3) | C25 | |
| Bronquios y pulmón | -1.0* | (-1.5 ; -0.6) | 0.0 | (-0.5 ; 0.5) | -1.8* | (-2.1 ; -1.5) | -1.0* | (-1.3 ; -0.6) | C33-34 |
| Melanoma de piel | ~ | 0.4 | (-0.2 ; 1.0) | 1.8* | (1.1 ; 2.6) | 1.0* | (0.1 ; 1.9) | C43 | |
| Mama | 1.1* | (0.9 ; 1.4) | 0.2 | (-0.2 ; 0.5) | C50 | ||||
| Cuello uterino | -3.1* | (-3.3 ; -2.9) | -3.5* | (-3.9 ; -3.2) | C53 | ||||
| Cuerpo uterino | 0.2 | (-0.2 ; 0.5) | -1.2* | (-2.1 ; -0.3) | C54-C55 | ||||
| Ovario | -0.5* | (-0.8 ; -0.1) | -0.5 | (-1.2 ; 0.2) | C56 | ||||
| Próstata | 2.1* | (1.5 ; 2.7) | ~ | -0.1 | (-0.5 ; 0.3) | C61 | |||
| Vejiga | -0.9* | (-1.3 ; -0.5) | -1.4* | (-1.9 ; -0.8) | -0.9* | (-1.8 ; -0.1) | -2.6* | (-3.7 ; -1.6) | C67 |
| Tiroides | 1.9* | (1.1 ; 2.7) | 2.9* | ( 2.6 ; 3.3) | -0.8 | (-1.9 ; 0.4) | -1.2* | (-2.2 ; -0.1) | C73 |
| Linfoma | 1.0* | (0.6 ; 1.3) | 1.1* | (0.6 ; 1.6) | -0.7* | (-1.3 ; 0.0) | -1.5* | (-2.2 ; -0.9) | C81-C88, C96 |
| Leucemia | 0.8* | (0.4 ; 1.1) | -0.7* | (-1.2 ; -0.2) | -0.7* | (-1.2 ; -0.2) | -1.1* | (-1.8 ; -0.3) | C91-95 |
| Otros sitios | 0.4* | (0.2 ; 0.7) | -0.2 | (-0.4 ; 0.0) | -0.4* | (-0.7 ; -0.1) | -1.1* | (-1.4 ; -0.9) | ** |
| Todas las localizaciones¶ | 0.4* | (0.2 ; 0.6) | -0.2* | (-0.3 ; 0.0) | -0.7* | (-0.9 ; -0.5) | -1.1* | (-1.3 ; -0.9) | C00-C97 |
* El APC es significativamente diferente de cero (p<0.05).
* El APC es significativamente diferente de cero (p<0.05).
**C17, C23, C24, C26-C32, C37-C41, C45-C49, C51, C52, C57-C60, C62-C66, C68-C80, C97
¶ Mortalidad incluye C43-44: Melanoma y otros de piel
Tendencias en las tasas de incidencia 1962-2017
Durante el periodo 1962-2017 la tasa de incidencia de cáncer especifica por sexo para todas las localizaciones mostró una tendencia divergente. En los hombres aumentó con un promedio anual de 0.4% (IC 95%: 0.2; 0.6) y en las mujeres disminuyó con un promedio anual de 0.2% (IC 95%: -0.3; -0.1).
En hombres y mujeres hubo una reducción de las tasas de incidencia de los cánceres de cavidad oral y faringe, estómago, vesícula biliar, vejiga, y enfermedad de Hodgkin. En los hombres disminuyó el cáncer de esófago, pulmón y laringe y en las mujeres el cáncer de ovario y cuello uterino,
Las tasas de incidencia permanecieron estables en mujeres con cáncer de hígado, páncreas, pulmón, hueso, tumores de tejidos blandos, melanoma de piel y cuerpo uterino. En los hombres no hubo cambios en leucemia mielomonocítica.
En hombres y mujeres se encontró aumento de las tasas de incidencia para los cánceres de riñón, pelvis renal y uretra; colorrectal, sistema nervioso central y tiroides. En las mujeres aumentó el cáncer de mama y la leucemia mielomonocítica. En los hombres, el cáncer de próstata, testículo, hígado, hueso y la leucemia linfocítica.
Tendencias en las tasas de mortalidad
Las tasas de mortalidad por cáncer estandarizadas por edad (TM) para todas las localizaciones para el periodo 1984-2020 disminuyeron de manera constante con un promedio anual de 0.7% en hombres (IC 95%: -0.9; -0.5) y 1.1% en mujeres (IC 95%: -1.3; -0.9).
Para ambos sexos hubo aumento de las tasas de mortalidad por cáncer colorrectal y melanomas; y disminución en las TM para los tumores malignos de esófago, estómago, pulmón, vejiga, linfomas y leucemias. En los hombres disminuyeron las TM por cáncer de cavidad oral y en las mujeres las TM por cáncer de cuello y cuerpo uterino.
Permanecieron estables las tasas de mortalidad por cáncer de páncreas en ambos sexos. Tampoco hubo cambio en las TM para los tumores malignos de hígado próstata y tiroides en los hombres; y en cavidad oral, mama y ovario en las mujeres
Cambios en la tendencia
Tumores asociados a agentes infecciosos
Las tasas de incidencia y mortalidad por cáncer de cuello uterino y estómago disminuyeron durante el periodo evaluado, Figura 5. En cáncer de cuello uterino hubo un cambio en la tendencia de las tasas de incidencia y mortalidad alrededor del 2002 y 2005, respectivamente. Antes del 2002, la tasa de incidencia disminuyó con un cambio medio anual del 2.8% (IC95: -3.1; -2.5); y luego se aceleró al 4.6% (IC95: -5.6; 3.5). En contraste, la tendencia de las tasas de mortalidad mostró desaceleración; antes del 2005 la disminución media anual fue del 4.4% (IC95%: -5.2; -3.7) y luego disminuyó al 2% (IC95%: -3.2; -0.8).
Las tasas de mortalidad por cáncer de estómago en ambos sexos, y las tasas de incidencia en hombres disminuyeron de manera monótona (Figura 5). La disminución media anual de las tasas de mortalidad fue 2.4% (IC95%: -2.8; -2.1) en las mujeres y 2.1% en los hombres (IC95%: -2.2; -1.8).
La disminución media anual de las tasas de incidencia de cáncer de estómago en hombres fue del 2% (IC95%: -2.2; - 2.8). En las mujeres hubo un punto de cambio en la tendencia alrededor de 1995. Antes de este año, el descenso medio anual fue del 1.3% (IC95%: -1.8; -0.8) y después aumentó al 2.9% (IC95%: -3.5; -2.3).
Tumores asociados con actividades de diagnóstico y tamización
Cáncer de mama: Dos puntos de cambio en la tendencia de las tasas de incidencia se presentaron alrededor de los años 1996 y 2001 que determinaron tres periodos. Hasta 1996 las tasas de incidencia aumentaron en promedio 1.3% anual (IC95%: 0.1; 2.5). Luego hubo aceleración del cambio y el aumento fue del 5.1% (IC95%: -2; 11.8) hasta el 2001. Desde entonces hay una disminución media anual del 0.6% (IC95%: -2; 0) (Figura 5). La tasa de mortalidad mostró un cambio alrededor del 2005.
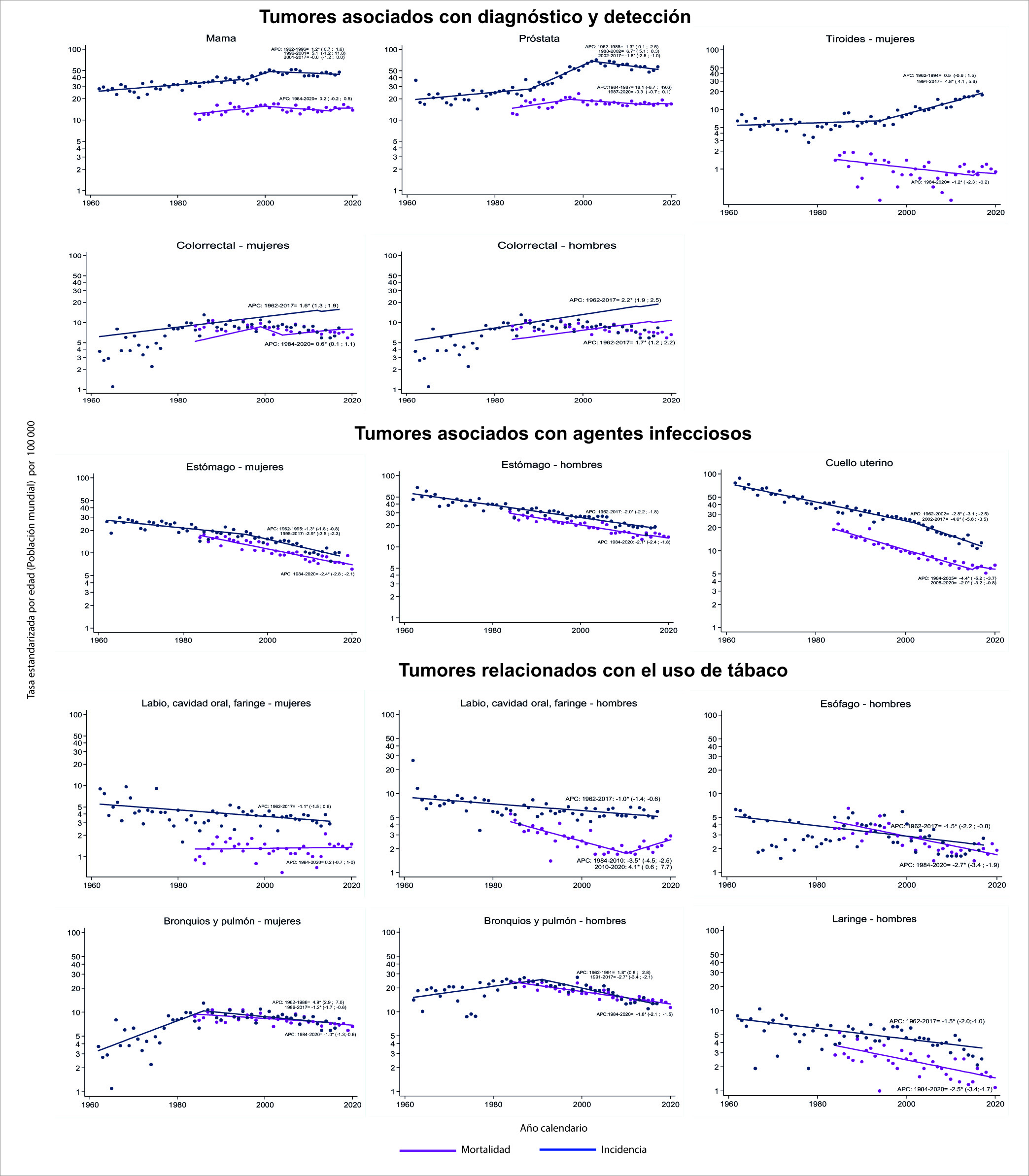
Figura 5 Cali, Colombia. Tendencia de las tasas de incidencia de cáncer (1962-2017) y las tasas de mortalidad por cáncer (1986-2020).
Cáncer de próstata: El comportamiento fue similar con dos puntos de cambio en la tendencia de las tasas de incidencia alrededor de los años 1988 y 2002 que determinaron tres periodos. Hasta 1988 las tasas de incidencia aumentaron en promedio 1.3% anual (IC95%: 0.1; 2.5); luego se aceleró el crecimiento hasta un 6.7% anual (IC95%: 5.1; 8.3). Desde el 2002 hay un descenso medio anual del 1.8% (IC95%: -2.6; -1) (Figura 5).
Cáncer de tiroides: Las tasas de incidencia mostraron un cambio en la tendencia alrededor de 1994 que determinaron dos periodos de crecimiento con un aumento medio anual del 0.5% (IC95%: -0.6; 1.5) y 4.6% (IC95%: 4.1; 5.6). En contraste, las tasas de mortalidad evidenciaron una disminución media anual del 1.2% (IC95%: -2.3; -0.2) (Figura 6).
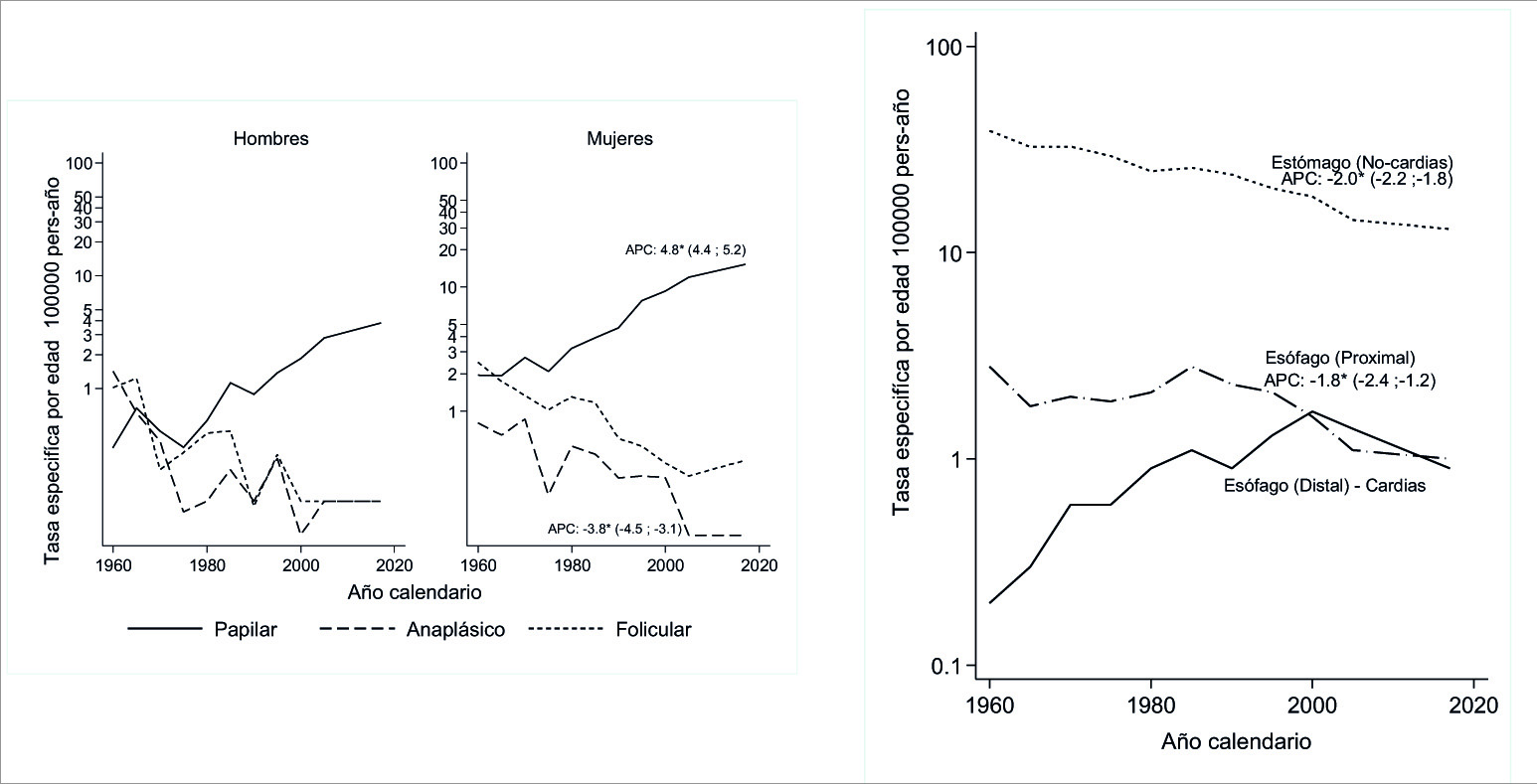
Figura 6 A. La tendencia de las tasas de incidencia de cáncer de tiroides difiere según el tipo histológico. Los carcinomas papilares han aumentado, especialmente en mujeres. Los carcinomas foliculares y anaplásicos han disminuido con el tiempo. B. Las tasas de incidencia de los cánceres de esófago proximal y estómago distal han disminuido desde los sesenta. Las tasas de incidencia del cáncer de la unión gastroesofágica han aumentado desde 1970.
Cáncer relacionados con el consumo de tabaco
La Tabla 3 muestra en ambos sexos disminución de las tasas de incidencia y mortalidad por cáncer de esófago, bronquios y pulmón, y vejiga. Las TM de cáncer de laringe y cavidad oral disminuyeron únicamente en los hombres (Figura 5).
En cáncer de tráquea, bronquios y pulmón hubo cambios en la tendencia de las tasas de incidencia alrededor de 1986 en las mujeres y 1991 en los hombres que determinaron dos periodos de tendencia divergente. Antes de 1986 y 1991, las tasas de incidencia aumentaron un promedio anual de 1.8% (IC95%: 0.8; 2.8) y 4,9% (IC95%: 2.9; 7) en hombres y mujeres respectivamente. Después de estas fechas hubo un descenso medio anual de 2.7% (IC95%: -3.4; -2.1) en los hombres y 1.2% (IC95%: -1.7; -0.6) en las mujeres (Figura 5).
El descenso en las tasas de mortalidad por cáncer de pulmón fue monótono en ambos sexos con un cambio medio anual de 2.7% (IC95%: -3.4; -2.1) en los hombres y 1.2% (IC95%: -1.7; -0.6) en las mujeres (Figura 5).
Indicadores de calidad
La Tabla 4S presenta los indicadores de calidad para los casos nuevos en localizaciones seleccionadas para el periodo 2013-2017, cerca al 100% de los casos se conoce la edad. Para todas las localizaciones de cáncer el porcentaje de casos con verificación morfológica (VM) fue de 86.1% en hombres y 88.8% en mujeres con un rango de 80-99%, excepto en hígado (75.4% en hombres y 73.1% en mujeres), pulmón (67.3% en hombres y 69.7% en mujeres) y páncreas (58.7% en hombres y 59.4% en mujeres).
Se observa en la razón mortalidad incidencia valores consistentes a excepción de hígado (1.26 en hombres y 1.47 en mujeres), pulmón (1.09 hombres y 1.05 mujeres) y páncreas (1.06 hombres y 1.08 mujeres). En estas localizaciones, el número de defunciones fue mayor que el número de casos detectados en vida.
El porcentaje de casos con certificado de defunción como única evidencia del diagnóstico de cáncer (DCO) varió entre 0-3% excepto en páncreas (8.1% en hombres), hígado (6.4% en mujeres), vejiga (5.1% en mujeres) y pulmón (5.1%). Las localizaciones más frecuentes presentan un bajo porcentaje de casos con certificado de defunción como única evidencia del diagnóstico de cáncer.
Para el periodo 2011-2020 el 99.9% de las defunciones fueron certificadas por un médico, la proporción de cánceres con sitio mal definido (C76-C80, C97) fue 4.8% y 0.8% para cáncer de útero no especificado (C55). Solo 2 (0.007%) de los certificados de defunción no tuvieron información de edad. La proporción de muertes clasificadas como signos, síntomas y causas mal definidas (R00-R99) fue 0.9%.
Discusión
Los registros de cáncer de base poblacional son una herramienta indispensable para el control del cáncer 12. En Cali, el registro de cáncer opera desde 1962 proporcionando información válida y continua sobre los casos nuevos de todos los tipos de cáncer, en residentes permanentes de Cali mediante búsqueda activa y notificación. Este artículo complementa los cambios observados en las tendencias temporales de las tasas de incidencia y mortalidad por cáncer en Cali durante 60 años 14,36. Esta información puede ser utilizada por las autoridades sanitarias regionales y nacionales para construir algunos indicadores que permitan monitorear la iniciativa City Cancer Challenge 37,38 y el actual plan decenal para el control del cáncer en Colombia (PDCC) 22.
En otras regiones de América Latina hay dificultad para evaluar las intervenciones para el control del cáncer por la escasez de información de calidad 39; y porque hay inequidad en la cobertura del registro de cáncer. En África, Asia y América Latina, la cobertura de los registros de cáncer de alta calidad es inferior al 9% de la población. En contrastaste, la cobertura equivalente en América del Norte y Europa es del 83% y 32%, respectivamente. Para disminuir esta brecha y mejorar la calidad de los registros de cáncer en los países de bajos y medianos ingresos, la iniciativa Global para el Desarrollo de Registros de Cáncer (GICR, por su sigla en inglés) busca construir infraestructura local y sostenible mediante el establecimiento de centros regionales de experiencia 40.
Claves del éxito del registro de cáncer de Cali
Colombia, con su registro de cáncer de Cali, hace parte del selecto grupo de 17 registros de cáncer de doce países que han divulgado la información de incidencia de cáncer de calidad durante medio siglo en los once volúmenes de Cancer Incidence in Five Continents. Los otros países son Japón, Israel, Dinamarca, Finlandia, Eslovenia, Noruega, Suecia, Nueva Zelanda, Reino Unido, Estados Unidos y Canadá 41.
Varios factores han sido determinantes para garantizar la continuidad de las operaciones del RPCC. Tener a la Universidad del Valle como patrocinador permanente, definir de manera clara el caso de cáncer, el área de registro, la población a riesgo e implementar métodos estándar para garantizar la calidad 27. En el modelo colombiano ha sido exitoso que los registros de cáncer estén vinculados con centros académicos universitarios con el apoyo y financiación parcial de las Secretarías de Salud Municipales y del Instituto Nacional de Cancerología de Colombia 42. Las universidades favorecen la sostenibilidad del equipo de trabajo y facilitan la formulación de proyectos de investigación para solucionar problemas específicos del entorno. El RPCC ha sido dirigido por profesores investigadores del Programa de especialización en Patología de la Universidad del Valle. La Universidad y el programa de posgrado tienen acreditación de alta calidad ante el Ministerio de Educación de Colombia 43. En la Facultad de Salud, decenas de estudiantes de posgrado han realizado su trabajo de grado; y los estudiantes de pregrado han participado en la encuesta periódica (quinquenal) que hace el registro de cáncer a los servicios oncológicos de la ciudad y que tiene como objetivo mejorar la exhaustividad. Los 75 patólogos egresados del programa durante el último medio siglo, constituyen una formidable red de apoyo para el registro de cáncer porque actualmente dirigen los laboratorios de patología de alta y mediana complejidad de Cali y como profesores universitarios contribuyen con la formación del talento humano en salud en las seis universidades de la ciudad.
Cali: Interpretación de los cambios en las tendencias de cáncer
Los datos presentados aquí pueden reflejar muchos hechos y tendencias que tienen lugar en la actualidad en muchos países de Latinoamérica. En Cali, durante el quinquenio 2013-17, aumentaron las tasas globales de incidencia de cáncer para todas las localizaciones en los hombres APC= 0.4 (IC 95%: 0.2; 0.6); y disminuyeron en las mujeres, APC= -0.2 (IC 95%: -0.3; -0.1). Los cánceres de próstata, estómago, colorrectal, pulmón y hematolinfoides fueron los más comunes en los hombres (55.4% de los casos); y en las mujeres fueron mama, colorrectal, tiroides, cuello uterino, estómago y hematolinfoides (64.4% de los casos). El cáncer representa el 23% de las 6,4851 muertes ocurridas en Cali durante el periodo 2016-2020. Los cambios demográficos, en los estilos de vida y en los factores de riesgo conocidos determinan variaciones en la tendencia del cáncer que se reflejan en la información aquí presentada.
La interpretación de los cambios en las tendencias de la incidencia y mortalidad por cáncer se centra en los canceres de mama, cuello uterino, estómago, próstata y colorrectal; priorizados por el actual PDCC 2011-2021; y en los cánceres relacionados con el consumo del tabaco. Se describe el rol del RPCC en la identificación y resolución de problemas de salud pública de los cánceres relacionados con agentes infecciosos (estómago y cuello uterino) mediante proyectos específicos de investigación transdisciplinaria que han permitido la apropiación social del conocimiento.
Cambios en la población y en los factores de riesgo
Cali es un centro de inmigración del suroccidente colombiano. La población se ha cuadruplicado en los últimos 60 años y en la actualidad hay 48 mayores de 65 años por cada 100 adultos menores de 15 años, el 95 % de las personas viven en el área urbana. Las tasas de fecundidad cayeron a valores levemente inferiores a lo que se conoce como nivel de reemplazo (2.05 hijos por mujer); y la esperanza de vida aumentó a 76 años; este promedio equivale al que tenían los países de altos ingresos hace 25 años 16,44.
En Colombia la carga de morbimortalidad ha cambiado desde un predominio de enfermedades infecciosas a una contribución creciente de las enfermedades crónicas no transmisibles. Esta dinámica epidemiológica y demográfica transforma la estructura etaria por crecimiento y envejecimiento de la población. Al igual que en otros países Latinoamericanos, hay cambios en los estilos de vida asociados con la urbanización, el aumento de los ingresos, estructuras sociales y familiares alteradas, y actividades y ocupaciones diarias más sedentarias; estos cambios modifican la exposición a los factores de riesgo. El consumo de alcohol y el exceso de peso corporal, a través de cambios en la dieta y la actividad física, son carcinógenos establecidos 45. Otros factores conocidos son sexo sin protección, contaminación del aire, humo en interiores e inyecciones contaminadas, representan el 35% de las muertes por cáncer en todo el mundo 46,47. Aún no se conoce la causa principal de algunos tipos de cánceres. La genética, dieta y obesidad explican una pequeña fracción del cáncer de mama, próstata y colon, y la raza negra una fracción mínima del cáncer de próstata.
Cánceres hormono-dependientes asociados con tamización
Las células tumorales del cáncer de mama y el cáncer de próstata son hormono-dependientes y requieren estrógenos y testosterona para su crecimiento. Para los programas de cribaje poblacional de estos tumores se utiliza la mamografía y el tacto rectal con detección sérica de PSA. Las pruebas de diagnóstico con imágenes cada vez mejores y el cribaje poblacional de personas asintomáticas detectan cánceres indolentes con crecimiento limitado o nulo durante largos periodos que no producirán la muerte del paciente. Como resultado habrá sobrediagnóstico y sobretratamiento como consecuencia de la no progresión tumoral o de la mortalidad competitiva debido a otras causas. Es imperativo desarrollar para cada tipo de cáncer, biomarcadores específicos para diagnóstico, pronostico, dianas terapéuticas, y para predecir el comportamiento biológico de los tumores.
Cáncer de próstata
En Cali 30% de la población se auto reconoce como de etnia afrocolombiana. Las tasas de incidencia del cáncer de próstata aumentaron durante los últimos 60 años, de manera acelerada entre 1986 y 2002 11,48, alcanzaron una meseta alrededor del 2005 y luego disminuyeron en la última década. Una vez estabilizado el uso de las pruebas de detección, las tasas tenderán a estabilizarse en los próximos años como ha ocurrido en los países de alto índice de desarrollo humano (HDI). Para interpretar las tendencias de las tasas de incidencia y mortalidad por CP hay que tener en cuenta las actividades de detección temprana y que existen factores de riesgo conocidos en la etiología del cáncer de próstata (edad, grupo racial y antecedente familiar), mientras que hay otros que parecen estar asociados, pero sin evidencia robusta como la dieta y la obesidad 5,6.
El aumento fue mayor en el grupo de edad objeto de tamización con PSA. Cambios similares han ocurrido en Europa, Norteamérica y Australia y se asocian con la determinación sérica del PSA como prueba de tamización y con nuevos métodos diagnósticos (obtención de biopsias en sextantes mediante agujas finas guiadas por ecografía transrectal) y de tratamiento. La resección transuretral y los procedimientos mínimamente invasivos modificaron la práctica urológica y los tejidos obtenidos son llevados a revisión histopatológica y como hallazgo incidental se puede presentar el cáncer.
Para el control del cáncer de próstata es ineficiente la detección de todos los casos prevalentes porque la frecuencia del cáncer de próstata aumenta con la edad y en las muestras de autopsia seccionadas por pasos oscila entre el 68% y el 77% para los hombres de 60 a 79 años 49. Los métodos actuales de tamización no diferencian los canceres indolentes de los agresivos. Para optimizar el cribaje poblacional del cáncer de próstata es urgente el desarrollo de biomarcadores que detecten las formas agresivas de la enfermedad para evitar el sobrediagnóstico y sobretratamiento de los pacientes.
Cáncer de mama
En Cali, al igual que en la mayoría de los países del mundo, las tasas de incidencia de cáncer de mama aumentaron 5.1% anual desde los noventa hasta principios del siglo XXI, (IC95%: -1.2; 11.8). Este aumento coincidió con la disminución de la fecundidad, la menarquia más joven, la edad más avanzada del primer embarazo a término, el uso de la terapia hormonal de reemplazo postmenopáusica y el aumento de las actividades de tamización de oportunidad con mamografía. Desde el 2005 la curva se estabilizó por un corto periodo y en la última década hubo reversión de la tendencia con descenso del 0.6% anual en las tasas de incidencia (IC95%: -1.2; 0.0). Este patrón de cambio fue más evidente en la población objeto de la tamización 50-69 años y parte del incremento puede estar concentrado en los casos con estadios tempranos de la enfermedad. Una vez estabilizado el uso de las pruebas de detección, las tasas de incidencia de cáncer de mama tienden a estabilizarse siempre y cuando otros factores causantes de la enfermedad no hayan cambiado 15,50,51.
Es la primera vez que se documenta este patrón de tendencia en un registro de cáncer latinoamericano. La disminución del riesgo de cáncer de mama se observó hace 20 años en los países de altos ingresos coincidiendo con la disminución del uso de hormonas para la terapia de la menopausia y la saturación de las actividades de cribado 50,52.
Si bien las tasas de incidencia del cáncer de mama han aumentado en el curso de las últimas décadas, los valores son bajos en relación con las notorias transformaciones demográficas en Cali (con aumento considerable de la expectativa de vida). El 30% de la población de Cali se auto reconoce como afrocolombiana. La incidencia de cáncer de mama es seis veces mayor en las mujeres blancas en comparación con las mujeres negras. Las tasas de incidencia de cáncer de mama en Uganda y Argelia, se ha duplicado en los últimos años, pero es mucho más baja que en las mujeres negras de EE. UU. y otros países occidentales. Otros determinantes sociodemográficos y biológicos de la diferencia del riesgo de cáncer de mama entre países de altos y bajos ingresos están por aclararse 53.
En Europa, Asia Central y el Norte América la mortalidad por BC ha disminuido alrededor del 20% (IC95%: 11; 27) por avances en los tratamientos y detección temprana por cribado mamográfico. En las otras regiones del mundo, incluyendo África y Latinoamérica, las tasas de mortalidad han aumentado 0.23% por año (95% CI: 0.20; 0.25) durante los últimos 27 años por aumento en las tasas de incidencia y porque el diagnóstico se hace en etapa tardía, por carencia de programas de cribado poblacional, y por las barreras para el tratamiento y la atención del cáncer 54,55.
Cali muestra avances en el control del cáncer de mama, la mortalidad ha permanecido estable los últimos 30 años a pesar del aumento en las tasas de incidencia porque las actividades de tamización de oportunidad han contribuido a detectar los casos en etapas menos avanzadas 14,15. Como en todos los países de bajos y medianos ingresos. La supervivencia al cáncer de mama en Cali aun es baja, para el quinquenio 2013-2017 fue 81.1% (IC 95%: 78.7; 83.3), nueve puntos porcentuales, más baja que la observada en Estados Unidos y Europa 51.
Los países de medianos-bajos ingresos tienen dificultades para establecer programas organizados de tamización poblacional porque carecen de recursos económicos para formar el talento humano requerido e implementar la infraestructura eficiente para detectar y tratar de manera oportuna y adecuada los casos de cáncer detectados 56. Para reducir la carga de morbilidad hay que aumentar los comportamientos saludables porque el 20% de los cánceres de mama en todo el mundo se deben a factores de riesgo modificables, incluido el consumo de alcohol, exceso de peso corporal e inactividad física. Aunque la evidencia es limitada, el examen de las mamas en las mujeres de los países de ingresos bajos y medianos ha demostrado que puede reducir el estadio del cáncer de mama en el momento del diagnóstico 54.
Cáncer colorrectal
El cáncer colorrectal es considerado como un marcador del desarrollo humano. Las ASR son al menos seis veces mayores en países con IDH muy alto en comparación con países con IDH bajo, probablemente se relaciona con los cambios en la prevalencia de los factores de riesgo vinculados a estilos de vida occidentales: aumento del consumo de carnes rojas y procesadas, carbohidratos refinados, consumo de alcohol y tabaco, obesidad e inactividad física 57.
En Colombia, el índice de desarrollo humano (IDH) en 2019 fue 0.767 puntos, lo que supone una mejora de 0.164 puntos respecto a 1990 58. Coincidiendo con este aumento, en Cali, las tasas de incidencia de cáncer colorrectal (ASR/100,000) casi se triplicaron, pasaron de 6.6 en 1964, a 17.3 en 2017, igual ocurrió con las tasas de mortalidad. Sin embargo, las tasas de incidencia continúan siendo más bajas que las observadas en países con muy alto IDH (Estados Unidos (36) y Reino Unido (38.3)) 59. Durante los últimos 60 años las tasas de incidencia y mortalidad por CCR en Cali, aumentaron un promedio anual de 2.2% (IC 95: 1.9; 2.5) y 1.7% (IC 95%: 1.2; 2.2), respectivamente. En contraste, los países con alto IDH tienen evidencias de control del CCR porque la mortalidad prematura por CCR es evitable; y desde 1985 y 1976 hay disminución significativa de las tasas de incidencia y mortalidad respectivamente.
En Cali, la supervivencia neta a 5 años del CCR fue más baja que la divulgada por el SEER, 54% vs 64.7%. Esta brecha de 10 puntos pone en evidencia las deficiencias de los servicios de salud para el control del riesgo, detección temprana y tratamiento integral de los pacientes con CRC. Teniendo en cuenta la tendencia ascendente de la incidencia y mortalidad de la enfermedad, es prioritario fortalecer las actividades de tamización de oportunidad en las pequeñas ciudades colombianas; y establecer un programa de cribaje población en las grandes capitales para garantizar el acceso oportuno y de calidad al diagnóstico y tratamiento de pacientes con esta enfermedad.
Cánceres relacionados con el uso del tabaco
En Cali hubo un punto de cambio en la tendencia de las tasas de incidencia de cáncer de pulmón alrededor de 1986 en las mujeres y 1991 en los hombres. Antes de estos años, las tasas de incidencia aumentaron un promedio anual de 1.8% (IC95%: 0.8; 2.,8) en los hombres y 4.9% (IC 95%: 2.9; 7) en las mujeres. Después de estas fechas hubo un descenso medio anual de 2.7% (IC95%: -3.4; -2.1) en los hombres y 1.2% (IC 95%: -1.7; -0.6) en las mujeres (Figura 5). La tendencia de las tasas de incidencia de cáncer de pulmón para ambos sexos en Cali se puede interpretar como un reflejo de una epidemia fallida relacionada con el tabaquismo que comenzó en los sesenta y se interrumpió en los ochenta. Este fenómeno está relacionado con una campaña muy fuerte contra el tabaquismo que ha tenido lugar en Colombia desde la década de los setenta 14. Las tasas de incidencia y mortalidad de otros cánceres relacionados con el uso del tabaco (esófago, pulmón y vejiga) también han disminuido en ambos sexos. Las tasas mortalidad por cáncer de laringe y cavidad oral disminuyeron sólo en los hombres.
La asociación causal entre el cáncer de pulmón y el tabaquismo está bien documentada. El cáncer de pulmón es más frecuente en los hombres, pero la brecha entre géneros ha disminuido. Las tasas de incidencia y mortalidad del cáncer de pulmón han ido disminuyendo en los hombres y aumentando en las mujeres a nivel mundial. Esto puede ser explicado por la disminución de la prevalencia del tabaquismo en los hombres, que fue seguida por una aceptación del tabaquismo por parte de las mujeres en muchos países. La exposición en interiores a los humos de cocinar y calentar usando carbón o materiales combustibles en estufas sin ventilación también podría aumentar el riesgo de cáncer de pulmón en poblaciones de mujeres que tenían un bajo nivel de tabaquismo 60.
Apropiación social del conocimiento. Los problemas de salud pública se resuelven con investigación
En los años sesenta del siglo pasado el RPCC identifico que el cáncer gástrico y de cuello uterino; ahora relacionados con agentes infecciosos; eran la principal causa de morbilidad y mortalidad por cáncer en la población de Cali. Para resolver las inquietudes se crea un grupo de investigación que ha persistido en el tiempo proporcionando información válida de las medidas de ocurrencia de cáncer y resolviendo los problemas mediante proyectos de investigación específicos.
Cáncer gástrico: Investigación transdisciplinaria
En la primera publicación correspondiente al periodo 1962-1966, el RPCC divulga que el 75% de la población de Cali eran inmigrantes de otras regiones colombianas. Las tasas de incidencia de cáncer gástrico especificas por lugar de procedencia mostraron que los emigrantes de Nariño, una población localizada en las regiones montañosas de los andes del sur occidente colombiano, tenían la tasa más alta de cáncer gástrico: más de tres veces superior a la de los nativos de Cali y cinco veces más alta que la de los nacidos en las costas 61. Coincidiendo con el estudio interamericano de mortalidad, más del 30% de los adultos que morían en Cali eran sometidos a autopsia y se documentó la presencia de metaplasia intestinal en la mucosa gástrica de 1,500 autopsias en adultos. La más alta prevalencia se encontró en los inmigrantes de Nariño (58%), de nuevo tres veces superior a la de los nativos de Cali (19%) o los nacidos en las costas (21%) 61.
Las investigaciones se centraron en Nariño durante los últimos 50 años y el RPCC coordinó las actividades del trabajo de campo de los proyectos y los sucesivos directores del RPCC fueron los investigadores principales de las diferentes investigaciones. En los setenta, el estudio detallado de las biopsias gástricas condujo a la caracterización de las etapas del proceso precanceroso, denominada "la cascada de Correa" 62. Las lesiones histopatológicas representan los siguientes cambios secuenciales: gastritis crónica activa, atrofia (perdida glandular) multifocal, metaplasia intestinal (completa e incompleta) y displasia; y las encuestas dietéticas ponen en evidencia que las poblaciones con alto riesgo de cáncer tienen dos cosas en común: un consumo excesivo de sal 63 y un deficiente consumo de frutas y vegetales frescos no procesados 64,65. En los ochenta, se describen la dinámica de los cambios del proceso precanceroso, caracterizada por una progresión lenta con múltiples episodios parciales de progresión hacia lesiones más avanzadas y regresión a lesiones menos avanzadas 66.
Desde los noventa, se replantea la hipótesis de los compuestos n-nitrosos como determinantes del cáncer gástrico y re-orienta todos los esfuerzos hacia la investigación de la relación del H. pylori-cáncer gástrico 67. En Nariño, se documenta que la infección empieza en los primeros meses de edad 68 y alcanza una prevalencia de 50% a los dos años y cercana al 90% a los 9 años. En adultos, por métodos serológicos se demuestra que la infección se mantiene en más del 90% por toda la vida. Estudios sobre el método de trasmisión concluyeron que la infección inicial estaba relacionada con la presencia en el hogar de hermanos mayores infectados 69.
Aplicando los conocimientos obtenidos durante 30 años de investigación se conduce en Nariño un ensayo clínico controlado que documenta una disminución de la frecuencia de lesiones precancerosas con suplementos dietéticos antioxidantes y antibióticos para erradicar la infección por H. pylori70. Esta investigación demuestra que el efecto protector de estar libre de la infección solamente es evidente a partir de los 6 años de seguimiento, y persiste años después de terminada la intervención 71. Esta estrategia de prevención primaria mediante quimioprevención es una alternativa ante los resultados discordantes y baja costo-efectividad de la detección temprana del cáncer gástrico en América Latina y los esfuerzos infructuosos de obtener una vacuna contra el H. pylori70.
En los últimos 15 años se avanzó en el conocimiento de los mecanismos de la carcinogénesis gástrica al integrarse de manera dinámica la línea conductora epidemiológica con los equipos multidisciplinarios de ciencias básicas 72-74. Se dilucidaron algunos de los mecanismos del daño oxidativo y la genotoxicidad ocasionada por la infección por H. pylori y se logró trazar el origen ancestral de las cepas bacterianas 75,76. Se demostró que la ruptura brusca de la co-evolución entre una bacteria y el ser humano causa más daño que los factores conocidos de virulencia del H. pylori77.
Cáncer de cuello uterino
En los años sesenta del siglo pasado el RPCC en el informe del periodo 1962-1966 publicó que el cáncer de cuello uterino era la primera causa de morbi-mortalidad por cáncer en las mujeres de Cali 14. La secretaria de Salud Pública Municipal implementó un programa de detección temprana de cáncer de cuello de útero mediante el uso de la citología repetida como prueba primaria de tamización para realizar el diagnóstico definitivo y el tratamiento. El control de calidad en el laboratorio central de referencia de la SSPM fue realizado por patólogos de la Universidad del Valle quienes documentaron a mediados de los ochenta, que el riesgo de desarrollar carcinoma invasivo es al menos 10 veces mayor en las mujeres no sometidas a cribado que en las sometidas a cribado 78. Las tasas de incidencia de cáncer invasivo han disminuido consistentemente los últimos 60 años y desde el 2000 son más bajas que las de lesiones precursoras de cáncer de cuello (Figura 7).
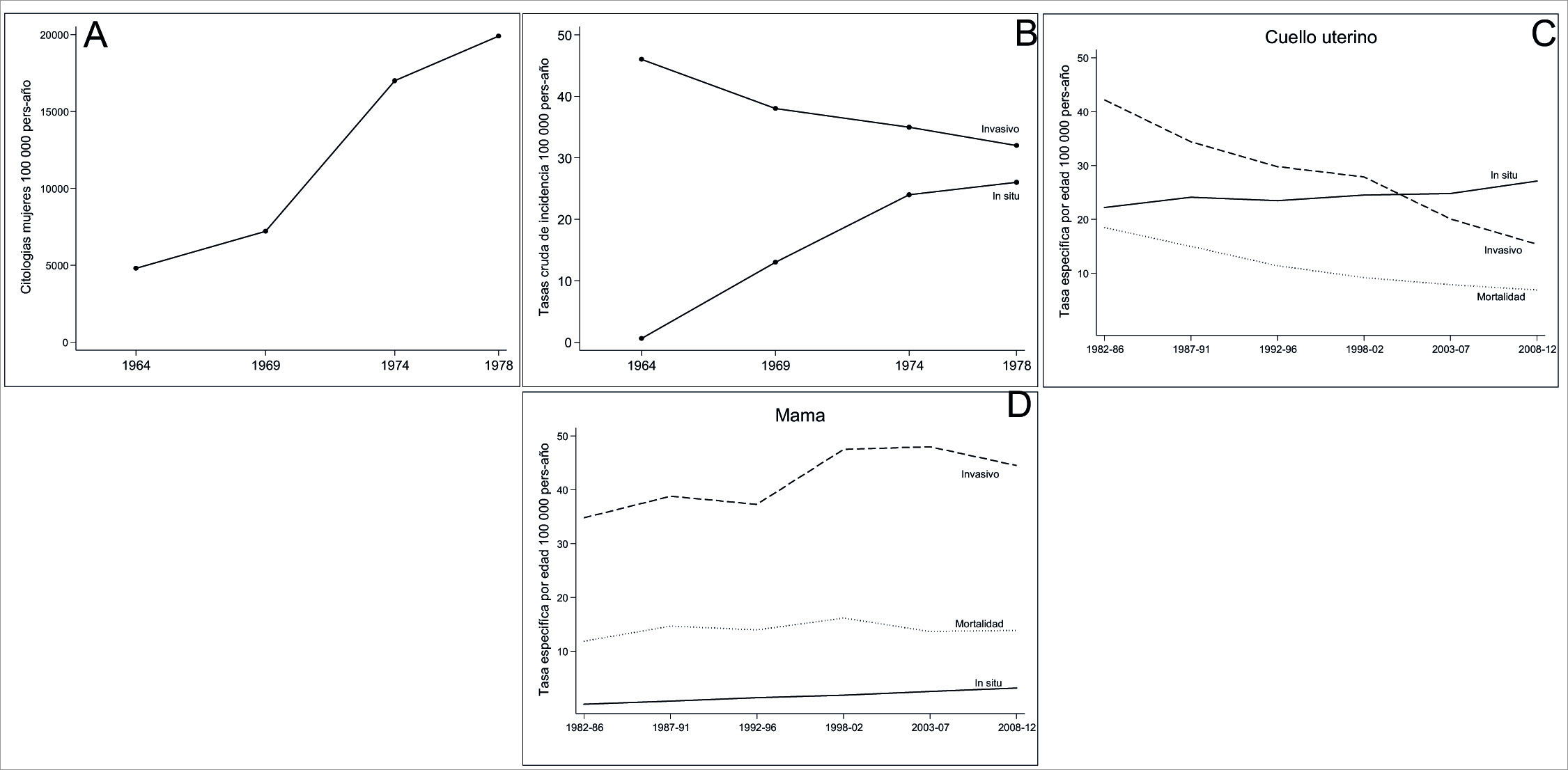
Figura 7 Cali, Colombia. Impacto de la citología vaginal en el riesgo de cáncer de cuello uterino. A. Cali, Colombia. Tasa de prevalencia del cribado de citología va ginal (1964-1978). B-C. Comparación con las tasas de incidencia de carcinoma in situ e invasivo de cuello uterino, entre 1964-2012. El riesgo de desarrollar carcinoma invasivo es al menos 10 veces mayor en mujeres no examinadas que en mujeres examinadas. Se observa una disminución marcada, constante y significativa en las tasas de incidencia y mortalidad durante el periodo 1964-2012. D. Cáncer de mama. Las tasas de incidencia aumentan constantemente, más marcadamente después de 1996, y luego disminuyen.
Alrededor de los años noventa del siglo pasado ocurrieron dos eventos en Cali que impactaron el programa de detección del cáncer de cuello uterino. La Secretaría de Salud descentralizó el laboratorio de citología y deterioró el control de calidad. Con la reforma a la salud del año 93 se deterioró el programa organizado de cribado poblacional y la detección temprana del cáncer, perdió su carácter vertical y centralizado y pasó a ser un conjunto de actividades de tamización de oportunidad a cargo de las aseguradoras y sus redes de servicios que tienen fragmentada la atención oncológica 79. Estos fenómenos podrían explicar porque hay desaceleración en el descenso de las tasas de mortalidad en la segunda década del siglo XXI. Antes del año 2005 la disminución media anual fue del 4.4% (IC 95%: -5.2; -3.7) y luego disminuyó al 2% (IC 95%: -3.2; -0.8).
En los años noventa, la doctora Nubia Muñoz, demostró la asociación causal entre el VPH y el cáncer de cuello uterino. Los primeros estudios de casos y controles poblacionales sobre VPH y cáncer de cuello uterino fueron conducidos en España y Colombia, dos países con tasas de cáncer cervicouterino contrastantes, por 100,000 mujeres año; España con una de las de menor incidencia (5.7) y Cali con una alta incidencia (48.2) 80. El Registro de Cáncer poblacional de Cali fue fundamental en la identificación de los casos incidentes de cáncer cervicouterino diagnosticados durante el período de estudio en esta ciudad. Los resultados de estos estudios han sido considerados como la primera evidencia epidemiológica molecular inequívoca de la asociación causal entre el VPH y el cáncer de cuello uterino 81. La demostración de que la infección por ciertos tipos de VPH es la causa principal y necesaria del CaCu, modificó la prevención primaria mediante el uso de vacunas profilácticas contra el VPH en las adolescentes, y la prevención secundaria mediante la introducción de la prueba del VPH como prueba de detección primaria 82,83.
En 2012, Colombia introdujo el programa de vacunación contra el VPH en las escuelas que alcanzó una cobertura del 90% de la población objetivo durante el primer año. En 2014, algunas adolescentes de una escuela en Carmen de Bolívar presentaron una reacción psicógena masiva a la vacunación. La respuesta del gobierno a la crisis fue tardía e inapropiada, para 2016, la aceptación de la vacuna contra el VPH entre las niñas elegibles disminuyó al 14% para la primera dosis y al 5% para el ciclo completo 84.
La SSPM de Cali, con una estrategia de trabajo intra e intersectorial y con compromiso político a nivel municipal y nacional, con medidas presupuestales necesarias para el fortalecimiento de las coberturas logró para el 2019 que las coberturas alcanzaron el 75% en población de 9 años con la primera dosis 85. Desafortunadamente, la pandemia del Covid-19 interfirió con la continuidad del programa de reactivación de vacunación contra el VPH.
En 2017, el RPCC evaluó el efecto de la vacunación sobre la infección oral por VPH-16 en estudiantes de secundaria de Cali, mediante la detección de ADN del VPH-16 en muestras de la cavidad oral y la garganta de 1,784 estudiantes de secundaria de ambos sexos de 14 a 17 años, en 21 escuelas de la ciudad. Las estudiantes inmunizadas con dos dosis tuvieron una reducción del 72% (IC95%: 0.07; 0.88), en la detección del VPH-16 en comparación con las no vacunados 86.
Interacción del Registro de cáncer de Cali con su entorno
Por los avances de Colombia en el control del cáncer y por la fortaleza del RPCC, Cali fue priorizada entre centenares de urbes y fue la primera ciudad en el mundo en implementar la iniciativa City Cancer Challenge (C/Can). El objetivo de C/Can es ampliar la cobertura y mejorar la calidad de la atención oncológica en las urbes de los países de bajos y medianos ingresos 37,38. Los servicios de patología diagnóstica son fundamentales para los sistemas de salud oncológica y la verificación morfológica de los tumores es uno de los principales criterios de calidad en los registros de cáncer; desafortunadamente en los países de ingresos bajos y medianos, existen limitaciones para implementar los estándares mínimos de calidad en los laboratorios de patología.
Para superar las limitaciones descritas el registro de cáncer de Cali colaboró estrechamente con las autoridades sanitarias locales y con los patólogos de la ciudad para identificar e implementar soluciones sostenibles adaptadas al contexto local. El RPCC participó activamente en la implementación de la iniciativa C/Can y contribuyó para mejorar los recursos y la infraestructura del laboratorio de patología del principal hospital universitario público (HUV) de la ciudad. Con base en el perfil epidemiológico del cáncer de Cali, se implementó la inmunohistoquímica y con la orientación de la American Society for Clinical Pathology (ASCP) se organizó un taller para mejorar la calidad del diagnóstico de patología, con la participación de patólogos y tecnólogos en citología e histología 87. Tras el taller, se elaboró un manual de control de calidad, que incluye los estándares mínimos de calidad para todos los laboratorios de patología de mediana y baja complejidad de Cali. En el HUV se implementó los protocolos del College of American Pathologists (CAP) para generar informes sinópticos de patología de todas las escisiones de tumores 88, un programa de control de calidad interno y un programa externo con el Royal College of Pathologist of Australasia Quality Assurance Programs (RCPAQAP) 89. Paralelamente, y como primer paso hacia el objetivo de mejorar e integrar los sistemas de información en Cali, el RPCC ha promovido el uso de sistemas de notificación de cáncer y ha apoyado la creación de registros hospitalarios de cáncer en cuatro hospitales de nivel terciario con servicios oncológicos integrados 87.
Rol de los registros de cáncer en el control de cáncer
El PDCC tiene como objetivo disminuir la morbilidad y mortalidad de este grupo de enfermedades. Los registros de cáncer proporcionan las estimaciones de incidencia, mortalidad y supervivencia que sirven como indicadores de línea de base para monitorear el impacto de las intervenciones 42. Mediante trabajo colaborativo con los sistemas de notificación nacional puede contribuir con la construcción y seguimiento de las cohortes de supervivientes al cáncer. La estimación de la supervivencia es una medida resumen que nos muestra la eficacia de la atención oncológica y de las intervenciones para el control del riesgo y la detección temprana de la enfermedad. Es prioritario que los registros de cáncer recolecten la información del estadio tumoral para los canceres priorizados por el PDCC y que realicen análisis oportunos de la situación de cáncer en el área de influencia para contribuir a la gestión del conocimiento. Con la información de los registros de cáncer las autoridades sanitarias tienen insumos objetivos para planificar las necesidades de infraestructura y talento humano de la red de servicios oncológicos.
Fortalezas y limitaciones
La interacción del RPCC con la academia y el trabajo colaborativo con la red de servicios oncológicos públicos y privados; las autoridades sanitarias regionales y nacionales han sido determinantes en la continuidad de las operaciones del registro de cáncer durante los últimos 60 años en Cali. La información divulgada en el presente artículo representa el riesgo promedio de enfermar y morir por cáncer en Cali, una urbe de 2.2 millones de habitantes con 30% de población afrocolombiana.
Los sistemas de notificación del ministerio de salud colombiano facilitan la recolección de la información de incidencia de cáncer y contribuyen para que la información sea oportuna. Desafortunadamente la información de cáncer en los laboratorios de patología de mediana complejidad continua en formatos no estructurados y se requiere grandes esfuerzos para consolidar la información. Es importante fortalecer los registros hospitalarios de cáncer en las instituciones que tienen integrados los servicios oncológicos. Sin embargo, se requiere estandarizar los métodos para lograr comparabilidad e implementar esquemas y estándares de interoperabilidad para la transferencia de la información.
Una de las mayores limitaciones de este estudio es la carencia de información sobre estadiaje al momento del diagnóstico y seguimiento activo a los casos de cáncer prevalentes.
La razón mortalidad:incidencia fue mayor a uno en los tumores de hígado, pulmón y páncreas. Este fenómeno puede tener varias causas como la falta de exhaustividad en la extracción de información en el registro de cáncer, dificultades de los pacientes para el acceso y disponibilidad en la atención oncológica oportuna, pacientes que no consultan por razones personales y falta de diagnóstico, debido a que pacientes con tumores de rápido crecimiento pueden morir entre el intervalo de consultas sin llegar a ser detectados a tiempo.
Se requiere investigaciones específicas para detectar y corregir los determinantes de este subregistro. El trabajo colaborativo interinstitucional con los registros hospitalarios de cáncer y las entidades encargadas de la notificación de cáncer (SIVIGILA y CAC) permitirá corregir esta limitación de la información de cáncer en Cali.
Agradecimientos:
A todos los pacientes y a todos los servicios de atención oncológica de Cali.
REFERENCIAS
1. World Health Organization. Non-communicable diseases; 2021. Cited: 2021 May 26. available from: https://www.who.int/news-room/fact-sheets/detail/noncommunicable-diseases [ Links ]
2. World Health Organization. 10 facts on noncommunicable diseases . World Health Organization; 2013. Cited: 2021 Sep 21. Available from: https://www.who.int/features/factfiles/noncommunicable_diseases/en/ [ Links ]
3. The Cancer Atlas. The Burden of Cancer. Vol. 2018, The Cancer Atlas; 2019. Cited: 2021 May 26. Available from: https://canceratlas.cancer.org/the-burden/the-burden-of-cancer/ [ Links ]
4. World Health Organization. WHO report on cancer: setting priorities, investing wisely and providing care for all; 2020. Available from: https://www.who.int/publications/i/item/who-report-on-cancer-setting-priorities-investing-wisely-and-providing-care-for-all [ Links ]
5. Global Cancer Observatory. Estimated age-standardized incidence rates (World) in 2020, worldwide, both sexes, all ages . IARC Publications. 2020. Cited: 2021 May 26. Available from: https://gco.iarc.fr/today/data/factsheets/populations/900-world-fact-sheets.pdf [ Links ]
6. World Health Organization. Cancer Prevention. 2021. Cited: 2021 Sep 21. p. 1-13. Available from: https://www.who.int/health-topics/cancer#tab=tab_2 [ Links ]
7. United Nations. Sustainable Development Goals United Nations Development Programme. Goals 3 Good health and well-being. 2015. Cited: 2021 May 26. Available from: https://www.undp.org/sustainable-development-goals#good-health [ Links ]
8. Ward ZJ, Scott AM, Hricak H, Atun R. Global costs, health benefits, and economic benefits of scaling up treatment and imaging modalities for survival of 11 cancers: a simulation-based analysis. Lancet Oncol. 2021;22(3):341-50. [ Links ]
9. World Health Organization. Cancer. 2021. Cited: 2021 May 26. Available from: https://www.who.int/en/news-room/fact-sheets/detail/cancer [ Links ]
10. Rivillas JC, Huertas Quintero JA, Montaño Caicedo JI, Ospina Martínez ML. Advances in eHealth in Colombia: Adoption of the National Cancer Information System. Pan Am J public Heal. 2014;35(5-6):446-52. [ Links ]
11. Bravo LE, Muñoz N. Epidemiology of cancer in Colombia. Colomb Med (Cali). 2018; 49(1): 09-12. [ Links ]
12. Bray F, Znaor A, Cueva P, Korir A, Ullrich A, Swaminathan R, et al. Planning and developing population-based cancer registration in low- and middle-income settings. IARC technical Publications No.43. International Agency for Research on Cancer. Lyon (Fr); 2014. [ Links ]
13. Correa P, Llanos G. Morbidity and mortality from cancer in cali, colombia. J Natl Cancer Inst. 1966;36(4):717-45. [ Links ]
14. Bravo LE, Collazos T, Collazos P, García LS, Correa P. Trends of cancer incidence and mortality in Cali, Colombia. 50 years experience. Colomb Med. 2012; 43: 246-55. [ Links ]
15. Bravo LE, García LS, Collazos P, Carrascal E, Ramírez O, Collazos T, et al. Reliable information for cancer control in Cali, Colombia. Colomb Med (Cali). 2018;49(1):23-34. [ Links ]
16. Departamento Administrativo Nacional de Estadística. Estimaciones y proyecciones de poblacion. DANE. 2021. Cited: 2021 May 30. p. 1-9. Available from: https://www.dane.gov.co/index.php/estadisticas-por-tema/demografia-y-poblacion/proyecciones-de-poblacion [ Links ]
17. World Bank. Population ages 65 and above. Browse by Country or Indicator Data Bank Microdata Data Catalog. 2020. Cited: 2021 Sep 20. p. 1-18. Available from: https://data.worldbank.org/indicator/SH.STA.DIAB.ZS?view=chart [ Links ]
18. Departamento Administrativo de Planeación Municipal. Documentos de Cali en Cifras; 2020. Available from: https://www.cali.gov.co/planeacion/publicaciones/137803/documentos-cali-en-cifras/ [ Links ]
19. Alberto C, Calderón A, Botero JC. Colombian healthcare system: 20 years of achievements and problems. Cien Saude Colet. 2011;16(6):2817-28. [ Links ]
20. Gómez-Arias RD, Nieto E. Colombia: What has happened with its health reform? Rev Peru Med Exp Salud Publica. 2014;31(4):733-9. [ Links ]
21. Lamprea E, García J. Closing the gap between formal and material health care coverage in Colombia. Heal Hum Rights J . 2016;18(2):49-65. [ Links ]
22. Ministerio de Salud y Protección Social. Plan Decenal para el Control del Cancer en Colombia 2012-2020; 2012. Available from: https://www.minsalud.gov.co/Documents/Plan-Decenal-Cancer/PlanDecenal_ControlCancer_2012-2021.pdf [ Links ]
23. Murcia E, Aguilera J, Wiesner C, Pardo C. Oncology services supply in Colombia. Colomb Med (Cali). 2018; 49(1): 89-96. [ Links ]
24. Instituto Nacional de Salud. Sistema Nacional de Vigilancia en Salud Pública -SIVIGILA. Vigilancia Lineamientos y documentos. Cited: 2021 Sep 21. Available from: https://www.ins.gov.co/Direcciones/Vigilancia/Paginas/Lineamientos-y-documentos.aspx [ Links ]
25. Ministerio de Salud y Protección Social de Colombia. Cuenta de Alto Costo. Quiénes somos; 2021. Cited: 2021 Sep 21. Available from: https://cuentadealtocosto.org/site/quienes-somos/ [ Links ]
26. Ministerio de Salud y Protección Social. Resolución número 000247 de 2014. Por la cual se establece el reporte para el registro de pacientes con cáncer. Colombia; 2014. Available from: https://cuentadealtocosto.org/site/wp-content/uploads/2020/06/resolucion_000247_de_2014.pdf. [ Links ]
27. García LS, Bravo LE, Collazos P, Ramírez O, Carrascal E, Nuñez M, et al. Cali cancer registry methods. Colomb Med (Cali). 2018;49(1):109-20. [ Links ]
28. World Health Organization. International Statistical Classification of Diseases and Related Health Problems. Vol. 2 Instruct, ICD-10. World Health Organization; 2010 [ Links ]
29. Ferlay J. Chapter 6 : Processing of data. Situ. 2009; IX(230):95-8. [ Links ]
30. Tyczynski JE, Démaret E, Parkin DM. Standards and Guidelines for Cancer Registration in Europe: The ENCR recommendations. International Agency for Research on Cancer, World Health Organization: Lyon; 2003. Available from: https://publications.iarc.fr/Book-And-Report-Series/Iarc-Technical-Publications/Standards-And-Guidelines-For-Cancer-Registration-In-Europe-2003 [ Links ]
31. Parkin DM, Bray F. Evaluation of data quality in the cancer registry: Principles and methods Part II. Completeness. Eur J Cancer. 2009; 45(5): 756-64. [ Links ]
32. Lin HN, Gu XY, Zhang SW, Zeng HM, Wei WW, Zheng RS. Analysis on incidence and mean age at diagnosis for Global Cancer. Zhonghua Zhong Liu Za Zhi. 2018; 40(7): 543-9. [ Links ]
33. National Cancer Institute Bethesda. Program SR. National Cancer Institute SEER Stat software. 2015. [ Links ]
34. Kim H, Fay MP, Feuer EJ, Midthune DN. Permutation tests for joinpoint regression with applications to cancer rates. Stat Med. 2000; 19(3): 335-51. [ Links ]
35. Cendales R, Pardo C. Quality of death certification in Colombia. Colomb Med (Cali). 2018; 49(1): 121-7. [ Links ]
36. Bravo LE, García LS, Collazos PA. Cancer survival in Cali, Colombia: A population-based study, 1995-2004. Colomb Med (Cali). 2014; 45(3): 110-6. [ Links ]
37. Bravo LE, Arboleda OL, Ramirez O, Durán A, Rendler-García M, Frech S, et al. Cali, Colombia, key learning city C/Can 2025: City cancer challenge. Colomb Med (Cali). 2017; 48(2): 39-40. [ Links ]
38. Adams C, Henshall S, Torode J, D'Cruz AK, Kumar HS, Aranda S. C/Can 2025: City Cancer Challenge, a new initiative to improve cancer care in cities. Lancet Oncol. 2017;18(3):286-7. [ Links ]
39. Gupta S, Howard SC, Hunger SP, Antillon FG, Metzger ML, Israels T, et al. Treating Childhood Cancer in Low- and Middle-Income Countries. Chapter 7. In: Gelband P, Jha RS, Horton. S. Disease Control Priorities, Cancer. 3rd ed. Washington, DC: World Bank.; 2015. Available from: http://dcp-3.org/chapter/900/treating-childhood-cancers-low-and-middle-income-countries [ Links ]
40. Piñeros M, Abriata MG, Mery L, Bray F. Cancer registration for cancer control in Latin America: a status and progress report. Pan Am J Public Health. 2017;41(e2):1-8. [ Links ]
41. Forman D, Bray F, Brewster DH, Mbalawa CG, Kohler B, Piñeros M, et al. Cancer Incidence in Five Continents Vol. X. Vol. 164, IARC Scientific Publications. 2014. [ Links ]
42. Ministerio de Salud y Protección Social. Resolución 1383 de 2013 Plan Decenal para el Control del Cáncer en Colombia, 2012-2021. Available from: https://www.minsalud.gov.co/sites/rid/Lists/BibliotecaDigital/RIDE/DE/DIJ/resolucion-1383-de-2013.pdf. [ Links ]
43. Ministerio de Educación Nacional. Resolución 003149 01 Mar 2021 Acreditación en Alta Calidad al Programa de Especialización en Anatomía Patológica y Patología Clínica de La Universidad del Valle, Colombia; 2021. [ Links ]
44. Departamento nacional de estadísticas. DANE. Resultados Censo Nacional de Población y Vivienda 2018 . Cali, Valle del Cauca. 2019. Available from: https://www.dane.gov.co/index.php/estadisticas-por-tema/demografia-y-poblacion/censo-nacional-de-poblacion-y-vivenda-2018 [ Links ]
45. Bosetti C, Malvezzi M, Chatenoud L, Negri E, F. Levi, Vecchia LC. Trends in cancer mortality in the Americas, 1970-2000. Ann Oncol. 2005;3(16):489-511. [ Links ]
46. United Nations. Sustainable Development Goals. 17 Goals to Transform Our World. 2016. Cited: 2021 Sep 22. p. 1-7. Available from: https://www.un.org/sustainabledevelopment/ [ Links ]
47. Naciones Unidas. Asamblea General de las Naciones Unidas. Vol. 66172, Informe de síntesis del Secretario General sobre la agenda de desarrollo sostenible después de 2015; 2014. Available from: https://www.un.org/en/development/desa/publications/files/2015/01/SynthesisReportSPA.pdf [ Links ]
48. Restrepo JA, Bravo LE, Garcia-Perdomo HA, García LS, Collazos P, Carbonell J. Incidencia, mortalidad y supervivencia al cáncer de próstata en Cali, Colombia, 1962-2011. Salud Publica Mex. 2014;56(5):440-7. [ Links ]
49. Sandhu GS, Andriole GL. Overdiagnosis of prostate cancer. J Natl Cancer Inst - Monogr. 2012;2011(45):146-51. [ Links ]
50. Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2018;68(6):394-424. [ Links ]
51. Allemani C, Matsuda T, Di Carlo V, Harewood R, Matz M, Niksic M, et al. Global surveillance of trends in cancer survival 2000-14 (CONCORD-3): analysis of individual records for 37 513 025 patients diagnosed with one of 18 cancers from 322 population-based registries in 71 countries. Lancet. 2018;391(10125):1-53. [ Links ]
52. Allemani C, Matsuda T, Di Carlo V, Harewood R, Matz M, Niksic M, et al. Global surveillance of trends in cancer survival: analysis of individual records for 37,513,025 patients diagnosed with one of 18 cancers during 2000-2014 from 322 population-based registries in 71 countries (CONCORD-3). Physiol Behav. 2019;176(3):139-48. [ Links ]
53. Francies FZ, Hull R, Khanyile R, Dlamini Z. Breast cancer in low-middle income countries: abnormality in splicing and lack of targeted treatment options. Am J Cancer Res. 2020;10(5):1568-91. [ Links ]
54. Marmot MG, Altman DG, Cameron DA, Dewar JA, Thompson SG, Wilcox M. The benefits and harms of breast cancer screening: An independent review. Br J Cancer. 2013;108(11):2205-40. [ Links ]
55. Torre LA, Siegel RL, Ward EM, Jemal A. Global cancer incidence and mortality rates and trends - An update. Cancer Epidemiol Biomarkers Prev. 2016;25(1):16-27 [ Links ]
56. Shah SC, Kayamba V, Peek RM, Heimburger D. Cancer control in low- And middle-income countries: Is it time to consider screening? J Glob Oncol. 2019;2019(5):1-8. [ Links ]
57. Cortés A, Eduardo Bravo L, Stella García L, Collazos P. Incidencia, mortalidad y supervivencia por cáncer colorrectal en Cali, Colombia, 1962-2012. Rev Salud pública México. 2014;56(5):457-64. [ Links ]
58. United Nations Development Programmehttps (UNDP). The Next Frontier: Human Development and the Anthropocene. Human Development Report 2020. 2020. Available from: http://hdr.undp.org/en/2020-report [ Links ]
59. International Agency for Research on Cancer (IARC). GLOBOCAN 2020. Estimation and provision of global cancer indicators descriptive epidemiological cancer research. 2020. Cited: 2021 Sep 23. Available from: https://gco.iarc.fr/today/home [ Links ]
60. Wong MCS, Lao XQ, Ho KF, Goggins WB, Tse SLA. Incidence and mortality of lung cancer: Global trends and association with socioeconomic status. Nature Sci Reports. 2017;7: 14300(1):1-9. [ Links ]
61. Correa P, Cuello C, Duque E. Carcinoma and intestinal metaplasia of the stomach in Colombian migrants. J Natl Cancer Inst. 1970;44(2):297-306. [ Links ]
62. Correa P, Haenszel W, Cuello C, Tannenbaum S, Archer M. A Model for Gastric Cancer Epidemiology. Lancet. 1975;2(7924):58-60. [ Links ]
63. Joossens J V., Hill MJ, Elliott P, Stamler R, Stamler J, Lesaffre E, et al. Dietary salt, nitrate and stomach cancer mortality in 24 countries. Int J Epidemiol. 1996;25(3):494-504. [ Links ]
64. Subar A, Patterson B. Fruit, Vegetables, and Cancer Prevention: A Review of the Epidemiological Evidence. Nutr Cancer. 1992;18(1):1-29. [ Links ]
65. Kobayashi M, Tsubono Y, Sasazuki S, Sasaki S, Tsugane S. Vegetables, fruit and risk of gastric cancer in Japan: A 10-year follow-up of the JPHC study cohort I. Int J Cancer. 2002;102(1):39-44. [ Links ]
66. Cuello C, Correa P, Haenszel W, Gordillo G, Brown C, Archer M, et al. Gastric cancer in Colombia. I. cancer risk and suspect environmental agents. J Natl Cancer Inst. 1976;57(5):1015-20. [ Links ]
67. Correa P, Haenszel W, Cuello C, Zavala D, Fontham E, Zarama G, et al. Gastric Precancerous Process in a High Risk Population: Cohort Follow-up. Cancer Res. 1990;50(15):4737-40. [ Links ]
68. Nithola C, Chamorro MCY. Factores asociados con la infección por Helicobacter Pylori en lactantes. Univ Salud. 2000;1(1):21-3. [ Links ]
69. Goodman KJ, Correa P. Transmission of Helicobacter pylori among siblings. Lancet. 2000;355(9201):358-62. [ Links ]
70. Correa P, Fontham ETH, Bravo JC, Bravo LE, Ruiz B, Zarama G, et al. Chemoprevention of gastric dysplasia: Randomized trial of antioxidant supplements and anti-Helicobacter pylori therapy. J Natl Cancer Inst. 2000;92(23):1881-8. [ Links ]
71. Mera RM, Bravo LE, Camargo MC, Bravo JC, Delgado AG, Romero-Gallo J, et al. Dynamics of Helicobacter pylori infection as a determinant of progression of gastric precancerous lesions: 16-year follow-up of an eradication trial. Gut. 2018;7(67):1239-46. [ Links ]
72. Yépez MC, Jurado DM, Bravo LM, Bravo LE. Trends in cancer incidence, and mortality in pasto, Colombia. 15 years experience. Colomb Med (Cali). 2018;49(1):42-54. [ Links ]
73. Rugge M, Genta RM, Di Mario F, El-Omar EM, El-Serag HB, Fassan M, et al. Gastric Cancer as Preventable Disease. Clin Gastroenterol Hepatol. 2017;15(12):1833-43. [ Links ]
74. Sugano K. Strategies for Prevention of Gastric Cancer: Progress from Mass Eradication Trials. Dig Dis. 2016;34(5):500-4. [ Links ]
75. Schneider BG, Camargo MC, Ryckman KK, Sicinschi LA, Piazuelo MB, Zabaleta J, et al. Cytokine polymorphisms and gastric cancer risk: An evolving view. Cancer Biol Ther. 2008;7(2):157-62. [ Links ]
76. Parsonnet J, Friedman GD, Orentreich N, Vogelman H. Risk for gastric cancer in people with CagA positive or CagA negative Helicobacter pylori infection. Gut. 1997;40(3):297-301. [ Links ]
77. Kodaman N, Pazos A, Schneider BG, Blanca Piazuelo M, Mera R, Sobota RS, et al. Human and Helicobacter pylori coevolution shapes the risk of gastric disease. Proc Natl Acad Sci U S A. 2014;111(4):1455-60. [ Links ]
78. Aristizabal N, Cuello C, Correa P, Collazos T, Haenszel W. The impact of vaginal cytology on cervical cancer risks in Cali, Colombia. Int J Cancer. 1984;34:5-9. [ Links ]
79. Murillo R. Control del cáncer de cuello uterino en Colombia: triunfos y desafíos de la tamización basada en la citología cérvico-uterina (Editorial). Biomedica. 2008;28(4):1-4. [ Links ]
80. Muñoz N, Bosh F, de Sanjosé S, Tafur L, Izarzugaza I, Gili M, et al. The causal link between human papillomavirus and invasive cervical cancer: a population-based case-control study in Colombia and Spain. Int J Cancer. 1992;52:743-9. [ Links ]
81. Muñoz N, Bravo LE. Epidemiología del cáncer de cuello uterino en Colombia. Colomb Med (Cali). 2012;43(4):298-304. [ Links ]
82. Muñoz N, Xavier Bosch F. Cervical cancer and human papillomavirus: Epidemiological evidence and perspectives for prevention. Salud Publica Mex. 1997;39(4):274-82. [ Links ]
83. Palacios R. Considerations on immunization anxiety-related reactions in clusters. Colomb Med (Cali). 2014; 45(3):131-6. [ Links ]
84. Palencia-Sánchez F, Echeverry-Coral SJ. Social considerations affecting acceptance of HPV vaccination in Colombia. A systematic review. Rev Colomb Obstet Ginecol. 2020;71(2):178-94. [ Links ]
85. Castillo A, Osorio JC, Fernández A, Méndez F, Alarcón L, Arturo G, et al. Effect of vaccination against oral HPV-16 infection in high school students in the city of Cali, Colombia. Papillomavirus Res. 2019;7(100):112-7. [ Links ]
86. Alcaldia de Santiago de Cali. Cáncer de cuello uterino Vacunación VPH- Rendición de cuentas Secretaría de Salud. Cali; 2019. [ Links ]
87. Frech S, Bravo LE, Rodriguez I, Pomata A, Aung KT, Soe AN, et al. Strengthening Pathology Capacity to Deliver Quality Cancer Care in Cities in LMICs. JCO Glob Oncol. 2021;(7):917-24. [ Links ]
88. College of American Pathologists. Cancer Case Summaries; 2018. Cited: 2021 Sep 23. Available from: https://www.cap.org/search?q=Cancer Case Summaries. [ Links ]
89. Royal College of Pathologists of Australasia Quality Assurance Programs. RCPAQAP. Products; 2021. Cited: 2021 Sep 23. Available from: https://rcpaqap.com.au/. [ Links ]
Notas:
Financiación: Esta investigación fue financiada por la Universidad del Valle, y en forma parcial por Univalle-Vandervilt University-NIH-USA (Prime Award No.2 P01 CA028842, Subaward No. VUMC3239) inscrito en el Centro información Universidad del Valle: 1641.
Tablas suplementarias
Tabla 1S Cali, Colombia. Tasas (por 100,000 personas-año) de incidencia (2013-2017) y mortalidad (2016-2020) específicas por edad y sexo
| Incidencia | Mortalidad | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Localización | 15-49 | 50-59 | 60-69 | 70+ | 15-49 | 50-59 | 60-69 | 70+ | ||||||||
| ♂ | ♀ | ♂ | ♀ | ♂ | ♀ | ♂ | ♀ | ♂ | ♀ | ♂ | ♀ | ♂ | ♀ | ♂ | ♀ | |
| Cavidad oral y faringe | 2.0 | 1.6 | 11.6 | 6.6 | 25.7 | 12.4 | 44.4 | 19.0 | 0.4 | 0.6 | 3.5 | 3.3 | 12.2 | 4.8 | 24.1 | 12.1 |
| Esófago | 0.1 | 0.1 | 3.0 | 1.1 | 8.6 | 3.0 | 29.3 | 6.9 | 0.3 | 0.1 | 2.0 | 0.9 | 8.9 | 1.3 | 27.5 | 8.5 |
| Estómago | 5.6 | 5.0 | 38.9 | 17.8 | 75.8 | 35.3 | 198.4 | 96.3 | 3.5 | 2.9 | 28.0 | 13.8 | 53.0 | 25.7 | 161.3 | 76.0 |
| Colon y recto | 5.3 | 4.9 | 31.0 | 29.1 | 71.8 | 59.5 | 188.1 | 133.2 | 2.2 | 2.4 | 12.0 | 13.2 | 40.6 | 26.2 | 123.0 | 94.8 |
| Hígado | 0.5 | 0.3 | 5.1 | 4.4 | 28.9 | 12.4 | 61.0 | 51.1 | 0.8 | 0.3 | 6.0 | 5.3 | 26.2 | 13.0 | 73.7 | 50.3 |
| Páncreas | 1.0 | 0.6 | 8.8 | 5.9 | 21.5 | 18.0 | 53.7 | 42.0 | 0.9 | 0.8 | 8.2 | 6.5 | 26.7 | 20.0 | 59.6 | 52.9 |
| Bronquios y pulmón | 1.5 | 1.1 | 19.0 | 11.2 | 67.5 | 27.2 | 157.1 | 88.7 | 0.9 | 1.1 | 14.3 | 10.3 | 59.5 | 27.3 | 179.6 | 83.3 |
| Melanoma de piel | 1.0 | 1.2 | 5.4 | 4.0 | 7.7 | 7.5 | 22.7 | 17.1 | 0.5 | 0.3 | 2.7 | 0.9 | 5.1 | 2.6 | 12.8 | 7.4 |
| Mama | 0.4 | 25.7 | 3.7 | 131.0 | 6.6 | 193.8 | 14.8 | 208.3 | 0.1 | 7.1 | 0.0 | 38.5 | 0.0 | 55.0 | 1.8 | 102.3 |
| Cuello uterino | 13.6 | 28.4 | 34.0 | 47.7 | 4.1 | 14.0 | 18.2 | 34.8 | ||||||||
| Cuerpo uterino | 1.7 | 16.0 | 26.1 | 28.0 | 0.6 | 4.7 | 12.3 | 22.1 | ||||||||
| Ovario | 3.6 | 15.2 | 22.0 | 35.3 | 1.5 | 10.1 | 21.0 | 37.0 | ||||||||
| Tiroides | 3.2 | 15.4 | 12.1 | 44.0 | 16.6 | 51.1 | 16.2 | 40.2 | 0.2 | 0.2 | 0.4 | 1.4 | 2.8 | 4.1 | 5.1 | 11.3 |
| Próstata | 1.4 | 71.5 | 307.2 | 648.7 | 0.2 | 6.1 | 48.3 | 325.4 | ||||||||
| Vejiga | 0.5 | 0.2 | 8.4 | 1.1 | 23.7 | 7.9 | 62.4 | 18.2 | 0.1 | 0.1 | 1.9 | 0.6 | 6.1 | 1.9 | 38.4 | 10.5 |
| Linfomas | 6.8 | 4.8 | 18.5 | 11.9 | 31.2 | 20.3 | 62.6 | 47.3 | 1.8 | 1.1 | 8.1 | 2.9 | 19.1 | 8.5 | 37.7 | 23.8 |
| Leucemias | 4.2 | 3.3 | 9.9 | 6.3 | 13.2 | 12.8 | 41.6 | 25.6 | 2.4 | 1.8 | 4.9 | 5.3 | 13.7 | 6.5 | 39.3 | 25.7 |
| Otros sitios | 23.5 | 15.3 | 77.1 | 69.1 | 161.2 | 119.8 | 348.6 | 249.1 | 7.6 | 5.9 | 37.9 | 31.1 | 91.9 | 62.1 | 281.4 | 184.5 |
| Todas las localizaciones | 57.1 | 98.6 | 324.3 | 403.2 | 867.6 | 663.2 | 1950.0 | 1154.2 | 21.6 | 30.9 | 135.8 | 162.8 | 413.9 | 310.6 | 1391.3 | 837.5 |
Tasas por 100,000 personas-año
Tabla 2S Cali, Colombia. Tasas de incidencia estandarizadas por edad (Población Mundial) por 100,000 personas-año durante el periodo 1962-2017
| Localización | Tasa de incidencia estandarizada por edad (Población mundial) según periodo | |||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1962-1967 | 1968-1977 | 1978-1987 | 1988-1997 | 1998-2007 | 2008-2017 | |||||||||||||||||||
| Hombre | Mujer | Hombre | Mujer | Hombre | Mujer | Hombre | Mujer | Hombre | Mujer | Hombre | Mujer | |||||||||||||
| n | ASR | n | ASR | n | ASR | n | ASR | n | ASR | n | ASR | n | ASR | n | ASR | n | ASR | n | ASR | n | ASR | n | ASR | |
| Cavidad oral y faringe | 87 | 11.0 | 64 | 5.6 | 147 | 7.3 | 142 | 5.3 | 202 | 6.2 | 133 | 3.0 | 329 | 6.3 | 264 | 4.0 | 437 | 5.6 | 361 | 3.5 | 621 | 5.6 | 480 | 3.3 |
| Estómago | 434 | 56.3 | 267 | 25.9 | 839 | 43.4 | 618 | 24.4 | 1,141 | 35.3 | 822 | 19.8 | 1,619 | 31.5 | 1,228 | 18.7 | 2,041 | 26.7 | 1,557 | 14.8 | 2,211 | 19.9 | 1,657 | 10.6 |
| Colon y Recto | 57 | 6.6 | 59 | 5.6 | 136 | 6.5 | 181 | 6.7 | 289 | 8.5 | 366 | 8.6 | 603 | 11.6 | 785 | 11.8 | 1,165 | 14.9 | 1,421 | 13.7 | 1,909 | 17.2 | 2,211 | 14.4 |
| Hígado | 33 | 4.1 | 47 | 4.8 | 40 | 1.9 | 38 | 1.5 | 83 | 2.4 | 64 | 1.6 | 155 | 3.0 | 157 | 2.4 | 278 | 3.7 | 304 | 3.0 | 553 | 5.2 | 533 | 3.3 |
| Páncreas | 19 | 2.6 | 38 | 3.6 | 81 | 4.2 | 73 | 3.0 | 139 | 4.3 | 163 | 4.1 | 251 | 5.0 | 267 | 4.1 | 308 | 4.0 | 385 | 3.7 | 514 | 4.7 | 582 | 3.7 |
| Laringe | 53 | 7.1 | 8 | 0.8 | 109 | 6.0 | 28 | 1.1 | 150 | 4.8 | 38 | 0.9 | 261 | 5.2 | 67 | 1.1 | 351 | 4.7 | 84 | 0.9 | 356 | 3.3 | 69 | 0.4 |
| Bronquios y pulmón | 127 | 17.6 | 40 | 4.0 | 306 | 16.2 | 121 | 4.8 | 748 | 23.6 | 371 | 9.3 | 1,140 | 23.0 | 613 | 9.6 | 1,561 | 20.7 | 939 | 9.4 | 1,546 | 14.2 | 1,211 | 7.6 |
| Mama | 2 | 0.2 | 318 | 27.7 | 2 | 0.1 | 790 | 28.1 | 7 | 0.2 | 1,447 | 32.8 | 11 | 0.2 | 2,641 | 39.4 | 31 | 0.4 | 4,933 | 48.9 | 120 | 1.1 | 6,597 | 45.8 |
| Cérvix uterino | 837 | 68.9 | 1,604 | 53.8 | 1,768 | 38.5 | 2,187 | 31.2 | 2,502 | 23.7 | 2,090 | 14.5 | ||||||||||||
| Cuerpo Uterino | 49 | 4.8 | 104 | 4.0 | 196 | 4.8 | 395 | 6.3 | 552 | 5.7 | 758 | 5.3 | ||||||||||||
| Ovario | 99 | 8.1 | 268 | 8.8 | 347 | 7.8 | 636 | 9.3 | 929 | 9.2 | 1,010 | 7.0 | ||||||||||||
| Próstata | 155 | 23.7 | 355 | 20.7 | 797 | 26.5 | 2,004 | 41.7 | 4,953 | 67.2 | 6,147 | 57.8 | ||||||||||||
| Testículo | 23 | 1.5 | 45 | 1.3 | 75 | 1.4 | 162 | 2.1 | 269 | 2.7 | 323 | 2.6 | ||||||||||||
| Vejiga | 67 | 9.1 | 28 | 2.8 | 160 | 8.6 | 56 | 2.3 | 245 | 7.7 | 119 | 2.9 | 354 | 7.1 | 146 | 2.2 | 594 | 7.8 | 241 | 2.3 | 628 | 5.7 | 255 | 1.6 |
| Tiroides | 31 | 3.4 | 76 | 6.3 | 42 | 1.8 | 176 | 5.5 | 60 | 1.6 | 297 | 5.8 | 106 | 1.8 | 511 | 6.6 | 200 | 2.3 | 1,112 | 10.6 | 449 | 3.9 | 2,154 | 15.3 |
| Linfoma | 100 | 8.1 | 72 | 5.4 | 210 | 7.2 | 117 | 3.5 | 311 | 7.4 | 281 | 6.0 | 567 | 9.3 | 465 | 6.9 | 1,053 | 12.7 | 993 | 9.7 | 1,209 | 10.8 | 1,123 | 7.7 |
| Leucemia | 74 | 5.1 | 51 | 3.0 | 195 | 6.1 | 145 | 3.9 | 278 | 5.9 | 259 | 4.7 | 457 | 7.3 | 435 | 5.9 | 672 | 8.0 | 668 | 6.7 | 871 | 8.1 | 839 | 6.5 |
Número de casos (n); Tasa de incidencia estandarizada por edad (ASR, por su sigla en inglés).
¶Todos los sitios excluyendo cáncer de piel no melanoma
Tabla 3S Cali, Colombia. Tasas de mortalidad estandarizadas por edad (Población Mundial) por 100,000 personas-año durante el periodo 1984-2020
| Localización | Tasa de mortalidad estandarizada por edad (Población mundial) según periodo | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1984-1990 | 1991-2000 | 2001-2010 | 2011-2020 | |||||||||||||
| Hombre | Mujer | Hombre | Mujer | Hombre | Mujer | Hombre | Mujer | |||||||||
| n | ASR | n | ASR | n | ASR | n | ASR | n | ASR | n | ASR | n | ASR | n | ASR | |
| Cavidad oral y faringe | 112 | 3.9 | 43 | 1.2 | 158 | 2.7 | 106 | 1.4 | 174 | 2.0 | 140 | 1.2 | 263 | 2.2 | 231 | 1.3 |
| Esófago | 104 | 3.8 | 57 | 1.7 | 195 | 3.5 | 119 | 1.6 | 185 | 2.1 | 101 | 0.8 | 225 | 1.9 | 111 | 0.6 |
| Estómago | 720 | 26.1 | 556 | 15.4 | 1,317 | 22.9 | 998 | 13.1 | 1,567 | 18.0 | 1,140 | 9.4 | 1,735 | 14.4 | 1,362 | 7.8 |
| Colon y recto | 149 | 5.3 | 212 | 5.9 | 442 | 7.5 | 580 | 7.5 | 715 | 8.2 | 837 | 6.9 | 1,214 | 10.1 | 1,376 | 7.8 |
| Hígado | 179 | 6.3 | 219 | 6.3 | 331 | 5.7 | 434 | 5.9 | 525 | 6.1 | 555 | 4.7 | 682 | 5.7 | 732 | 4.0 |
| Páncreas | 132 | 4.7 | 163 | 4.6 | 279 | 4.9 | 323 | 4.4 | 343 | 3.9 | 418 | 3.5 | 597 | 5.0 | 730 | 4.1 |
| Bronquios y pulmón | 605 | 22.1 | 302 | 8.7 | 1,095 | 19.5 | 650 | 9.0 | 1,384 | 16.0 | 945 | 8.0 | 1,638 | 13.7 | 1,256 | 7.0 |
| Melanoma y otros de piel | 37 | 1.3 | 43 | 1.1 | 105 | 1.8 | 95 | 1.2 | 192 | 2.2 | 172 | 1.4 | 320 | 2.6 | 278 | 1.6 |
| Mama | 10 | 0.3 | 462 | 12.5 | 14 | 0.2 | 1,108 | 14.8 | 14 | 0.2 | 1,679 | 14.5 | 14 | 0.1 | 2,364 | 14.4 |
| Cérvix uterino | 654 | 17.4 | 923 | 12.0 | 916 | 7.9 | 1,002 | 6.2 | ||||||||
| Cuerpo uterino | 93 | 2.5 | 247 | 3.4 | 227 | 1.9 | 361 | 2.2 | ||||||||
| Ovario | 161 | 4.6 | 359 | 5.0 | 566 | 4.9 | 705 | 4.3 | ||||||||
| Próstata | 429 | 16 | 1,078 | 19.1 | 1,543 | 17.1 | 2,126 | 17.3 | ||||||||
| Vejiga | 83 | 3.0 | 61 | 1.7 | 132 | 2.3 | 71 | 1.0 | 192 | 2.2 | 100 | 0.8 | 254 | 2.1 | 142 | 0.7 |
| Tiroides | 20 | 0.7 | 45 | 1.3 | 30 | 0.5 | 83 | 1.1 | 47 | 0.6 | 86 | 0.7 | 62 | 0.5 | 173 | 1.0 |
| Linfoma | 185 | 5.4 | 139 | 3.7 | 302 | 4.8 | 258 | 3.4 | 360 | 4.0 | 324 | 2.8 | 526 | 4.4 | 412 | 2.4 |
| Leucemia | 194 | 5.2 | 187 | 4.3 | 399 | 5.7 | 376 | 4.6 | 489 | 5.3 | 500 | 4.4 | 555 | 4.6 | 517 | 3.3 |
| Otros sitios** | 747 | 24.8 | 820 | 22.8 | 1,582 | 26.2 | 1,649 | 22.1 | 1,994 | 22.6 | 2,245 | 19.2 | 2,810 | 23.3 | 2,913 | 17.2 |
| Todas las localizaciones sin otros de piel | 3,688 | 128.3 | 4,194 | 115.2 | 7,405 | 126.4 | 8,337 | 110.9 | 9,644 | 109.5 | 10,862 | 92.3 | 12,857 | 106.4 | 14,523 | 85.3 |
Número de casos (n)
ASR: Tasa de mortalidad estandarizada por edad (ASR, por su sigla en inglés).
**C17, C23, C24, C26-C32, C37-C41, C45-C49, C51, C52, C57-C60, C62-C66, C68-C80, C90, C97
Tabla 4S Cali, Colombia. Indicadores de calidad de la información de incidencia según sexo durante el periodo 2013-2017.
| Localización | Hombre | Mujer | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Casos | Edad desc. | MV | DCO | MI | Casos | Edad desc. | MV | DCO | MI | ||
| (%) | (%) | (%) | (%) | ||||||||
| Todos los sitios excepto cáncer de piel no melanoma | C00-96 * | 11,137 | 13 | 86.1 | 1.7 | 0.57 | 13,704 | 9 | 88.8 | 1.4 | 0.53 |
| Cavidad oral y faringe | C00-14 | 313 | 0 | 95.2 | 0.6 | 0.39 | 241 | 0 | 92.1 | 0.8 | 0.53 |
| Esófago | C15 | 117 | 0 | 80.3 | 0.0 | 0.95 | 57 | 0 | 89.5 | 3.5 | 0.91 |
| Estómago | C16 | 1,074 | 3 | 84.0 | 1.9 | 0.80 | 820 | 3 | 82.4 | 3.9 | 0.85 |
| Colon, recto y ano | C18-21 | 1,062 | 1 | 88.7 | 1.0 | 0.59 | 1,264 | 0 | 88.2 | 1.3 | 0.55 |
| Hígado | C22 | 272 | 0 | 75.4 | 2.9 | 1.26 | 282 | 0 | 73.1 | 6.4 | 1.47 |
| Páncreas | C25 | 271 | 0 | 58.7 | 8.1 | 1.06 | 318 | 0 | 59.4 | 3.8 | 1.08 |
| Laringe | C32 | 149 | 0 | 95.3 | 0.0 | 0.68 | 28 | 0 | 82.1 | 0.0 | 0.86 |
| Bronquios y pulmón | C34 | 768 | 1 | 67.3 | 5.0 | 1.09 | 599 | 2 | 69.7 | 5.2 | 1.05 |
| Melanoma | C43 | 137 | 1 | 99.3 | 0.0 | 0.58 | 174 | 0 | 100.0 | 0.0 | 0.37 |
| Mama | C50 | 58 | 94.8 | 1.7 | 0.19 | 3,546 | 1 | 95.8 | 0.2 | 0.33 | |
| Cuello uterino | C53 | 992 | 0 | 92.3 | 1.0 | 0.51 | |||||
| Cuerpo uterino | C54 | 400 | 0 | 94.6 | 0.4 | 0.38 | |||||
| Ovario | C56 | 472 | 0 | 79.5 | 2.5 | 0.74 | |||||
| Próstata | C61 | 3,083 | 3 | 89.3 | 1.2 | 0.33 | |||||
| Testículo | C62 | 160 | 0 | 95.6 | 0.0 | 0.16 | |||||
| Riñón y órganos urinarios NOS | C64-66, 68 | 300 | 1 | 85.3 | 2.3 | 0.46 | 242 | 1 | 88.0 | 1.7 | 0.38 |
| Vejiga | C67 | 301 | 0 | 84.7 | 2.7 | 0.41 | 118 | 0 | 80.5 | 5.1 | 0.69 |
| Cerebro, sistema nervioso central | C70-72 | 295 | 0 | 85.8 | 2.7 | 0.95 | 268 | 0 | 78.4 | 3.0 | 1.13 |
| Tiroides | C73 | 234 | 0 | 97.9 | 0.4 | 0.14 | 1,293 | 0 | 98.1 | 0.2 | 0.06 |
| Linfoma | C81-90, C96 | 804 | 1 | 98.3 | 0.1 | 0.45 | 738 | 0 | 98.9 | 0.1 | 0.45 |
| Leucemia | C91-95 | 484 | 0 | 98.4 | 0.0 | 0.56 | 374 | 1 | 98.1 | 0.0 | 0.66 |
Edad desc.: Edad desconocida
MV: Proporción de casos verificados microscópicamente
DCO: Death Certificate Only, por su sigla en inglés. Única evidencia certificado de defunción
MI: Mortality-incidence ratio
*Excluye piel C44
Recibido: 24 de Septiembre de 2021; Revisado: 26 de Noviembre de 2021; Aprobado: 13 de Diciembre de 2021











 text in
text in 



