Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Colombia Médica
versión On-line ISSN 1657-9534
Colomb. Med. vol.53 no.1 Cali ene./mar. 2022 Epub 09-Feb-2022
https://doi.org/10.25100/cm.v53i1.4929
Articulo original
Incidencia y mortalidad por cáncer en Quito: información para monitorear las políticas de control del cáncer
1 Sociedad de Lucha contra el Cáncer, Registro Nacional de Tumores, Quito Ecuador
2 Sociedad de Lucha contra el Cáncer, Dirección Médica, Quito Ecuador
Introducción:
El cáncer representa un desafío para la salud pública global, ya que requiere de una estrategia integral para su control. En este contexto los Registros de Cáncer de Base Poblacional (RCBP) son actores clave para la generación de políticas públicas que garanticen su implementación.
Objetivo:
Este estudio analiza las tasas de incidencia y mortalidad por cáncer en la ciudad de Quito durante el período 1985-2017 y las discute en el marco de la Estrategia Nacional contra el cáncer propuesta en 2017 para Ecuador.
Métodos:
Se establecieron las tasas de incidencia y mortalidad estandarizadas por edad utilizando datos del RCBP de Quito. Para el análisis de las tendencias, de ubicaciones seleccionadas, se utilizó la regresión de join point y el cambio porcentual anual (CPA).
Resultados:
Durante todo el período de estudio, hubo un incremento sostenido tanto en las tasas de incidencia (CPA hombres= 2.0, IC 95%: 1.7-2.4; CPA mujeres= 2.0%, IC 95%: 1.4-2.6), como en las tasas de mortalidad (CPA hombres= 2.0%, IC 95%: 1.8-2.3; CPA mujeres= 1.3%, IC 95%: 1.1-1.6). La incidencia y mortalidad de los cánceres de mama, próstata, colon-recto, tiroides y linfoma se incrementaron, mientras que las tasas de incidencia de cáncer de cuello uterino y estómago disminuyeron inicialmente, luego se observó un estancamiento.
Conclusión:
La información presentada por el PBCR de Quito sirve como referencia para el pronóstico del cáncer en el país y como línea de base para su control. Son urgentes acciones para fortalecer las estrategias de prevención y promoción del cáncer.
Palabras clave: Incidencia; mortalidad; tendencia; cáncer; Ecuador
Introduction:
Cancer represents a challenge for global public health, since it requires a comprehensive strategy for its control. In this context, the Population-Based Cancer Registries (PBCR) are key actors for the generation of public policies that guarantee their implementation.
Objective:
This study analyses the trend in cancer incidence and mortality rates in the city of Quito during the period 1985-2017 and discusses them within the framework of the National Strategy against cancer proposed in 2017 for Ecuador.
Methods:
Age-standardized incidence and mortality rates are established using data from the Quito PBCR. For trend analysis of selected locations, joinpoint regression and annual percentage change (APC) are used.
Results:
Throughout the study period, there was a sustained increase in both incidence rates (APC male= 2.0, 95% CI: 1.7-2.4; APC female= 2.0%, 95% CI: 1.4-2.6), as in mortality rates (APC male= 2.0%, 95% CI: 1.8-2.3; APC female= 1.3%, 95% CI: 1.1-1.6). Cancer incidence and mortality rates of the breast, prostate, colon-rectum, thyroid, and lymphoma increased, while the incidence rates of cervical and stomach cancer initially decreased, then stagnation was observed.
Conclusion:
The information presented by the PBCR of Quito serves as a reference for the prognosis of cancer in the country and as a baseline for its control. Actions are urgently required to strengthen cancer prevention and promotion strategies.
Key words: Incidence; mortality; trend; cancer; Ecuador
Contribución del estudio
| 1) ¿Por qué se realizó este estudio? |
| Con la finalidad de actualizar la información de la situación del cáncer en la ciudad de Quito, como instrumento en la planificación de políticas públicas y su continuo monitoreo, para evaluar su cumplimiento. |
| 2) ¿Cuáles fueron los resultados más relevantes del estudio? |
| Se evidencia un incremento sostenido en las tasas de incidencia y mortalidad por cáncer durante todo el período de estudio. Preocupa el estancamiento en el descenso de los cánceres de cuello de útero y de estómago. Llama la atención el incremento sostenido de la incidencia del cáncer de tiroides, mama, próstata y colon-recto, situación que hace urgente la implementación sostenible de la Estrategia Nacional para la Atención Integral del Cáncer en Ecuador. |
| 3¿Qué aportan estos resultados? |
| Información que permite evaluar las políticas de control del cáncer y valorar su impacto sanitario en la carga de esta enfermedad. |
Introducción
El cáncer representa un desafío para la salud pública mundial, no solo por el incremento continuo de sus tasas de incidencia y mortalidad a lo largo de las últimas décadas, que lo ubican entre las principales causas de morbimortalidad, sino, sobre todo, porque requiere de un plan integral, transdisciplinario, multisectorial, participativo y sostenible para su control, que busque impactar en todas las etapas del cáncer continuum: promoción, prevención primaria, detección, diagnóstico, tratamiento oportuno y cuidados paliativos 1; al tiempo que reduzca la brecha de desigualdad social relacionada con esta enfermedad 2.
Se estima que, en todo el mundo, se produjeron 19.3 millones de nuevos casos de cáncer (18.1 millones sin incluir el cáncer de piel no melanoma) y casi 10.0 millones de muertes por cáncer (9.9 millones sin incluir el cáncer de piel no melanoma) en el año 2020 3. Se espera que la carga mundial de cáncer sea de 28.4 millones de casos en 2040, es decir, un aumento del 47% con respecto a 2020 4. Para abordar esta creciente carga de la enfermedad, la Asamblea Mundial de la Salud recomienda el desarrollo de Planes Nacionales de Control del Cáncer (PNCC) en todos los países, como documentos estratégicos de salud pública que sirvan como hoja de ruta para la prevención y el control del cáncer 4.
En este contexto, los registros de cáncer de base poblacional (RCBP) como sistemas de vigilancia continuos que recopilan casos nuevos de cáncer en una población definida, para el cálculo de la incidencia y mortalidad, son actores clave y confiables para la planificación de políticas a la medida, así como para evaluar y monitorear su progreso 5,6.
En Quito, en el año 1984 se creó el Registro Nacional de Tumores (RNT) como un RCBP para recolectar, procesar, analizar y divulgar regularmente la información de los casos nuevos de cáncer diagnosticados en la ciudad 7. Su implementación fue delegada a la Sociedad de Lucha contra el Cáncer (SOLCA) mediante Acuerdo Ministerial 6345 8. Con la finalidad de proveer información actualizada sobre el perfil del cáncer en la ciudad y así aportar al monitoreo de las políticas de control. Este estudio analiza el comportamiento de los principales tipos de cáncer en la ciudad de Quito, en términos de su incidencia y mortalidad, desde 1985 hasta 2017.
Materiales y Métodos
Población y área de registro
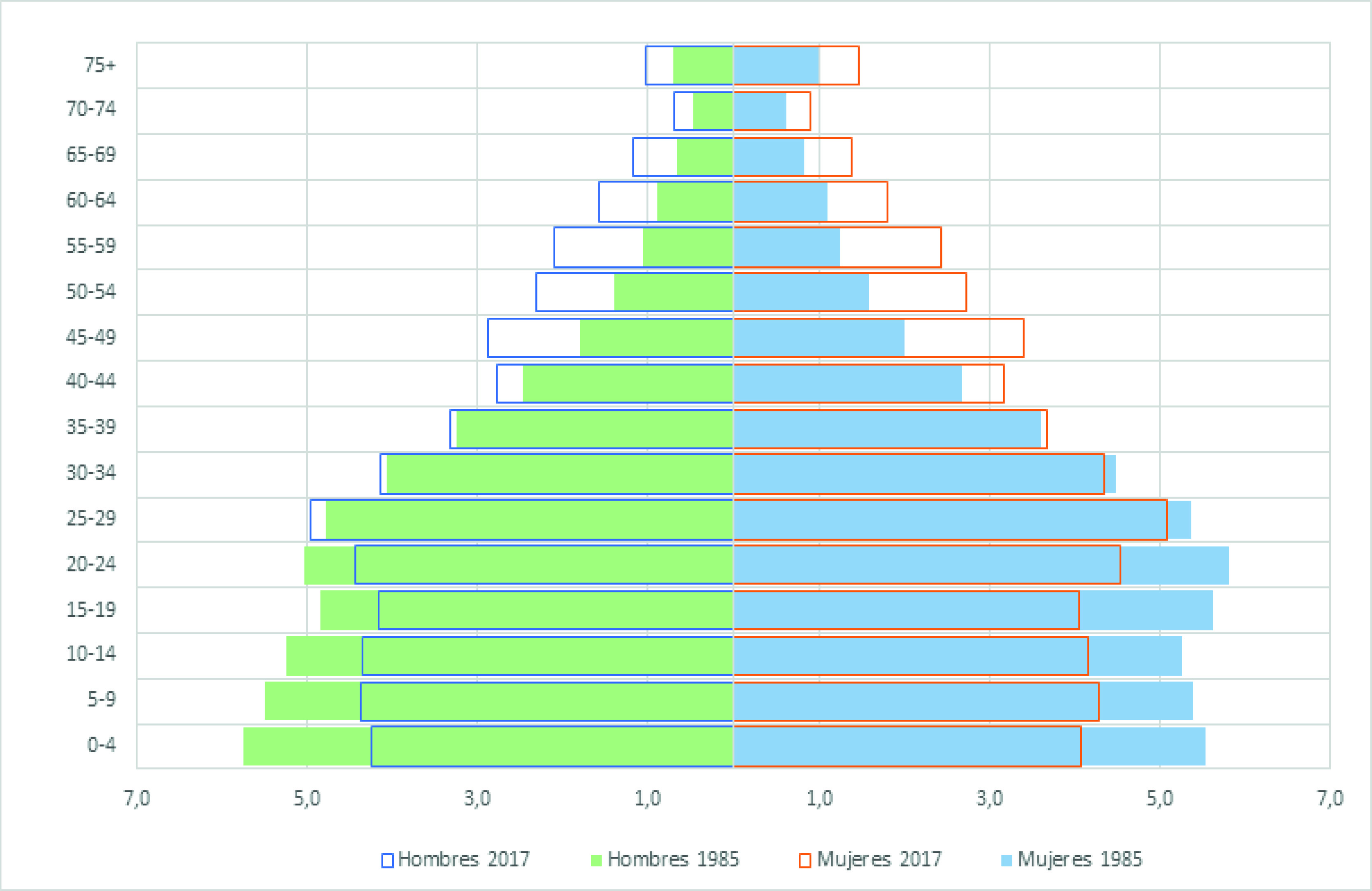
La ciudad de Quito es la capital del Ecuador, es la segunda ciudad más grande y poblada del país, su población para el año 2017, de acuerdo con las proyecciones del censo de 2010 es de 1,911,966 habitantes 9. En el contexto de la transición demográfica, la población ha experimentado cambios en la estructura poblacional, en donde prima el incremento de la población adulta mayor y la reducción de la población menor de 15 años. En Quito en 1985, los mayores de 65 años representaron el 4.3% y en el 2017, el 6.7% (Figura 1).
Registro y análisis de información
El RCBP de Quito capta todos los casos de cáncer diagnosticados en la ciudad. Las fuentes de información son los laboratorios de patología y hematología, tanto de servicios de salud públicos, como privados, que se complementan con egresos hospitalarios y defunciones ocurridas por cáncer. Los datos de mortalidad se obtienen de los reportes oficiales del Instituto Nacional de Estadísticas y Censos (INEC), y son validados con la información captada por el RCBP en las fuentes primarias (historia clínica), por lo que constituye un dato de mortalidad corregido.
El Registro de Quito es uno de los 5 RCBP del país considerado como de alta calidad por la Asociación Internacional de Registros del Cáncer (IACR por sus siglas en inglés), en conjunto cubren el 41.4% de la población del Ecuador 10. Información sobre su historia, objetivos y metodología ha sido descrita ampliamente en publicaciones previas 7,11. En relación con los indicadores de calidad, para el periodo 2013-2017 estos alcanzan cifras adecuadas: 89.6% de verificación histológica, 5.1% de casos que ingresaron solo por certificados de defunción y una relación Mortalidad/Incidencia (M/I) de 52.6% para ambos sexos (Tabla 1).
Tabla 1 Quito, Ecuador. Indicadores de calidad para localizaciones seleccionadas. 2013-2017
| Localización | Verificación histológica VH | Solo certificado de defunción SCD | Razón mortalidad incidencia M/I |
|---|---|---|---|
| Porcentaje | |||
| Estómago | 85.8 | 9.7 | 85.1 |
| Colon recto | 91.4 | 4.5 | 61.4 |
| Pulmón | 76.1 | 13.0 | 88.7 |
| Mama | 97.1 | 1.5 | 36.4 |
| Cuello del útero | 97.1 | 1.9 | 53.4 |
| Próstata | 92.6 | 5.3 | 46.3 |
| Tiroides | 97.3 | 0.5 | 7.8 |
| Linfoma No Hodgkin | 96.8 | 1.5 | 59.2 |
| Todos los casos (-C44) | 89.6 | 5.1 | 52.6 |
Los datos de cáncer se presentan de acuerdo con la Clasificación Internacional de Enfermedades CIE 10. Las tasas estandarizadas por edad (TEE) y sexo, de incidencia y mortalidad para el periodo 2013-2017, fueron calculadas por el método directo haciendo uso de la población estándar mundial de Segi 12. Se presenta también tasas crudas (TC), tasas acumulativas (TA) y la frecuencia relativa (FR) de las localizaciones más frecuentes. Se muestran los datos de cáncer de piel no melanoma (C44), pero se los excluye en los resultados de tasas globales.
Para estudiar la tendencia de las tasas de incidencia y mortalidad se estimó el cambio porcentual anual (CPA) desde 1985 hasta 2017 en localizaciones seleccionadas. Se utilizó modelos de regresión Joinpoint para identificar puntos de cambio en las tendencias, de manera que los términos ''aumenta'' o ''disminuye'' se usaron cuando el CPA fue significativamente diferente de cero (valores de p <0.05); de lo contrario, se utilizó el término "estable". Las pruebas de significancia se realizaron usando la técnica de permutación de Monte Carlo. Todos los análisis se realizaron en el Programa de Regresión Joinpoint versión 4.9.0.0, del Programa de Investigación de Vigilancia del Instituto Nacional del Cáncer de los Estados Unidos 13. El CPA y los puntos de cambio se determinaron en función de las TEE transformadas logarítmicamente y sus errores estándar. Se especificó un máximo de cuatro puntos de cambio con al menos cinco observaciones.
Resultados
Desde 1985 hasta 2017 se diagnosticaron 93,821 casos nuevos de cáncer entre los residentes en la ciudad de Quito (Figura 2). El número de casos pasó de 1,355 en el año 1985 a 5,846 en el año 2017. La tendencia a lo largo de todo el período fue hacia un incremento, con ritmos diferentes en dos períodos, pasando de un CPA de 3.1 (IC 95%: 2.2-4.1) en el periodo 1985-1995, a un CPA de 5.6 (IC 95%: 5.3-6.0) a partir de 1996 (Figura 2).
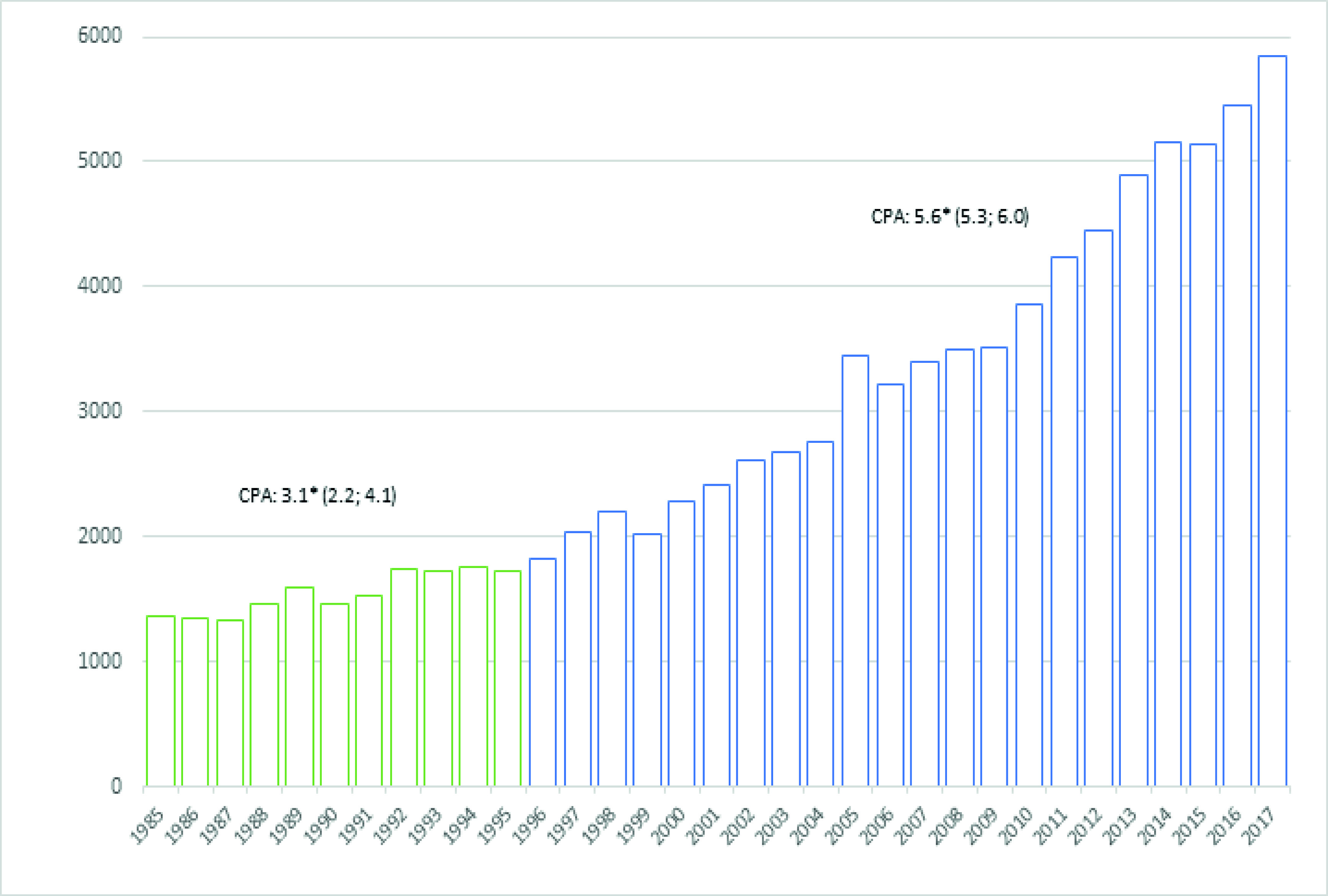
Figura 2 Casos nuevos diagnosticados en residentes en Quito, 1985 - 2017. Y: Número de casos; X: año del diagnóstico. CPA: Cambio porcentual anual obtenido a partir de modelos de regresión de Joinpoint, las cifras entre paréntesis son Intervalos de Confianza al 95% de CPA; una estrella indica una significación estadística de 0.05.
Incidencia
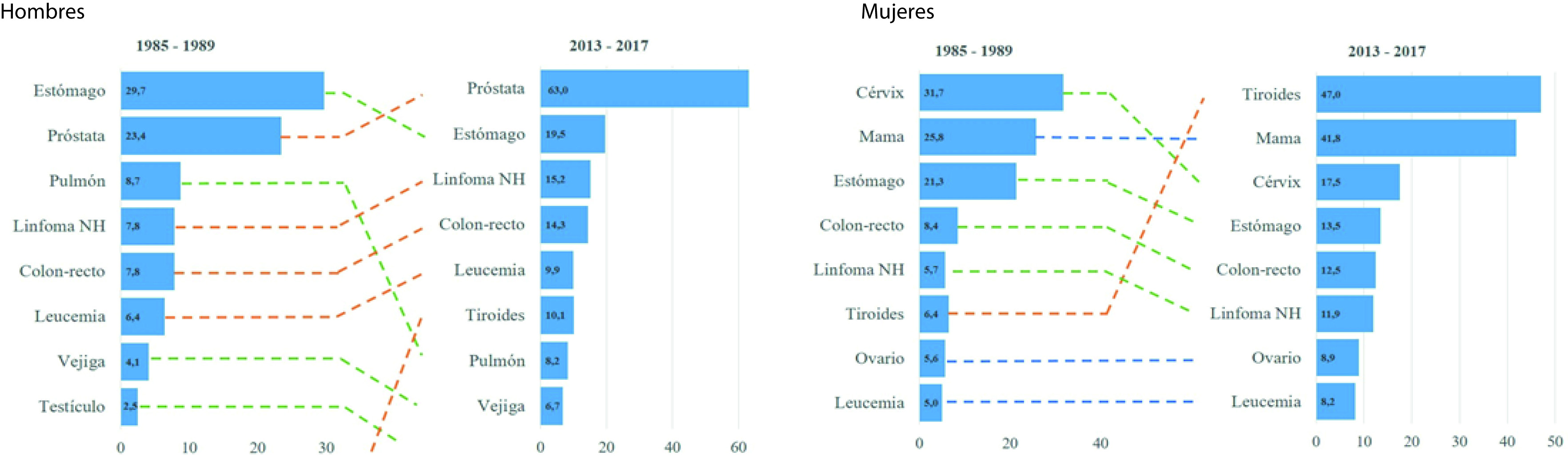
Las tasas de incidencia estandarizadas para todas las localizaciones de cáncer, en el último periodo 2013-2017, fueron 212.2 en hombres; y 227.3 en mujeres (Tabla 2). En los hombres, las cinco localizaciones más frecuentes fueron: próstata (TEE: 63.0), estómago (TEE: 19.5), linfoma no Hodgkin (TEE: 15.2), colon - recto (TEE: 14.3) y tiroides (TEE: 10.1). En las mujeres, las localizaciones más frecuentes fueron: tiroides (TEE: 47.0), mama (TEE: 41.8), cuello uterino (TEE: 17.5), estómago (TEE: 13.5), y colon - recto (TEE: 12.5).
Tabla 2 Tasas de Incidencia estandarizadas por edad, según sexo. Quito, 2013 - 2017
| Código | Localización | Hombres | Mujeres | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Casos | TC | TEE | TA % | FR % | Casos | TC | TEE | TA % | FR % | ||
| C00-C14 | Labio, cavidad bucal y faringe | 91 | 2.0 | 2.2 | 0.2 | 1.0 | 113 | 2.4 | 2.2 | 0.2 | 1.0 |
| C15 | Esófago | 72 | 1.6 | 1.7 | 0.2 | 0.8 | 31 | 0.7 | 0.6 | - | 0.3 |
| C16 | Estómago | 802 | 17.9 | 19.5 | 2.1 | 9.2 | 708 | 14.9 | 13.5 | 1.4 | 6.2 |
| C17 | Intestino delgado | 68 | 1.5 | 1.7 | 0.2 | 0.8 | 68 | 1.4 | 1.4 | 0.2 | 0.6 |
| C18-C20 | Colon recto | 594 | 13.3 | 14.3 | 1.5 | 6.8 | 641 | 13.5 | 12.5 | 1.4 | 5.6 |
| C21 | Ano y del conducto anal | 22 | 0.5 | 0.5 | 0.1 | 0.3 | 50 | 1.1 | 0.9 | 0.1 | 0.4 |
| C22 | Hígado y de vías biliares intrahepáticas | 236 | 5.3 | 5.9 | 0.7 | 2.7 | 257 | 5.4 | 4.9 | 0.5 | 2.2 |
| C23-C24 | Vesícula biliar y vías biliares | 165 | 3.7 | 4.1 | 0.5 | 1.9 | 282 | 5.9 | 5.4 | 0.6 | 2.5 |
| C25 | Páncreas | 146 | 3.3 | 3.6 | 0.4 | 1.7 | 227 | 4.8 | 4.3 | 0.4 | 1.9 |
| C30-C31 | Nariz, senos, etc. | 28 | 0.6 | 0.6 | 0.1 | 0.3 | 13 | 0.3 | 0.2 | 0.0 | 0.1 |
| C32 | Laringe | 58 | 1.3 | 1.5 | 0.2 | 0.7 | 17 | 0.4 | 0.3 | - | 0.1 |
| C33-C34 | Tráquea bronquios y pulmón | 333 | 7.4 | 8.2 | 1.0 | 3.8 | 342 | 7.2 | 6.8 | 0.8 | 2.9 |
| C40-C41 | Hueso | 81 | 1.8 | 1.8 | 0.2 | 0.9 | 61 | 1.3 | 1.3 | 0.1 | 0.5 |
| C43 | Melanoma maligno de piel | 195 | 4.4 | 4.7 | 0.5 | 2.2 | 212 | 4.5 | 4.1 | 0.4 | 1.9 |
| C44 | Otros tumores malignos de piel | 1,813 | 40.5 | 43.7 | 4.7 | - | 2,018 | 42.5 | 38.2 | 3.9 | - |
| C45 | Mesotelioma | 13 | 0.3 | 0.3 | - | 0.1 | 9 | 0.2 | 0.2 | - | 0.1 |
| C46 | Sarcoma de Kaposi | 67 | 1.5 | 1.4 | 0.1 | 0.8 | 13 | 0.3 | 0.2 | - | 0.1 |
| C47+C49 | Tej. Conectivo y blandos | 150 | 3.4 | 3.6 | 0.4 | 1.7 | 157 | 3.3 | 3.2 | 0.3 | 1.4 |
| C50 | Mama | 23 | 0.5 | 0.6 | 0.1 | 0.3 | 2,057 | 43.3 | 41.8 | 4.8 | 17.9 |
| C51 | Vulva | - | - | - | - | - | 30 | 0.6 | 0.5 | 0.1 | 0.3 |
| C52 | Vagina | - | - | - | - | - | 24 | 0.5 | 0.5 | 0.1 | 0.2 |
| C53 | Cuello del útero | - | - | - | - | - | 905 | 19.0 | 17.5 | 1.8 | 7.8 |
| C54 | Cuerpo del útero | - | - | - | - | - | 308 | 6.5 | 6.3 | 0.8 | 2.7 |
| C55 | Útero; parte no especif. | - | - | - | - | - | 46 | 1.0 | 0.9 | 0.1 | 0.4 |
| C56 | Ovario | - | - | - | - | - | 448 | 9.4 | 8.9 | 0.9 | 3.9 |
| C58 | Placenta | - | - | - | - | - | 12 | 0.3 | 0.2 | - | 0.1 |
| C60 | Pene | 47 | 1.1 | 1.1 | 0.1 | 0.5 | - | - | - | - | - |
| C61 | Próstata | 2,472 | 55.3 | 63.0 | 8.0 | 28.3 | - | - | - | - | - |
| C62 | Testículo | 280 | 6.3 | 5.6 | 0.4 | 3.2 | - | - | - | - | - |
| C64 | Riñón; excepto de pelvis renal | 260 | 5.8 | 6.5 | 0.8 | 2.9 | 182 | 3.8 | 3.8 | 0.4 | 1.5 |
| C65 | Pelvis renal | 3 | 0.1 | 0.1 | - | 0.0 | 2 | - | - | - | 0.0 |
| C67 | Vejiga urinaria | 272 | 6.1 | 6.7 | 0.7 | 3.1 | 95 | 2.0 | 1.8 | 0.2 | 0.8 |
| C69 | Ojo y sus anexos | 33 | 0.7 | 0.8 | 0.1 | 0.3 | 29 | 0.6 | 0.6 | - | 0.3 |
| C70-C72 | Cerebro y Sistema Nervioso Central | 257 | 5.7 | 5.9 | 0.5 | 2.9 | 248 | 5.2 | 5.2 | 0.5 | 2.1 |
| C73 | Tiroides | 443 | 9.9 | 10.1 | 1.1 | 5.1 | 2,402 | 50.5 | 47.0 | 4.8 | 20.9 |
| C81 | Enfermedad de Hodgkin | 65 | 1.5 | 1.5 | 0.1 | 0.7 | 50 | 1.1 | 1.0 | 0.1 | 0.4 |
| C82-C86,C96 | Linfomas no Hodgkin | 641 | 14.3 | 15.2 | 1.6 | 7.3 | 595 | 12.5 | 11.9 | 1.3 | 5.1 |
| C90 | Mieloma múltiple y T. M. de células plasmáticas | 147 | 3.3 | 3.6 | 0.4 | 1.7 | 104 | 2.2 | 2.1 | 0.3 | 0.9 |
| C91 | Leucemia linfoides | 217 | 4.9 | 5.2 | 0.3 | 2.5 | 161 | 3.4 | 3.6 | 0.3 | 1.4 |
| C92 | Leucemias mieloides | 178 | 4.0 | 4.2 | 0.4 | 2.0 | 168 | 3.5 | 3.4 | 0.3 | 1.5 |
| Todos los sitios | 10,543 | 235.7 | 255.9 | 28.4 | - | 13,485 | 283.7 | 265.5 | 28.0 | - | |
| Todos los sitios - C44 (Piel) | 8,730 | 195.2 | 212.2 | 23.7 | 100 | 11,467 | 241.3 | 227.3 | 24.1 | 100 | |
TC: tasa cruda; TEE: tasa estandarizada por edad; TA: tasa acumulativa; FR: frecuencia relativa
Mortalidad
Las tasas de mortalidad estandarizadas para todas las localizaciones de cáncer, en el último periodo 2013-2017, fueron 123.6 en hombres; y 107.9 en las mujeres (Tabla 3). En hombres, el cáncer de próstata (TEE: 27.7) y el de estómago (TEE: 16.8) presentan las tasas de mortalidad más altas; en mujeres, fueron el cáncer de mama (TEE: 15.1), el de estómago (TEE: 11.3) y cuello de útero (TEE: 9.6).
Table 3 Tasas de Mortalidad estandarizadas por edad, según sexo. Quito, 2013-2017.
| Código | Localización | Hombres | Mujeres | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Casos | TC | TEE | TA % | FR % | Casos | TC | TEE | TA % | FR % | ||
| C00-C14 | Labio, cavidad bucal y faringe | 53 | 1.2 | 1.2 | 0.1 | 1.0 | 64 | 1.3 | 1.2 | 0.1 | 1.2 |
| C15 | Esófago | 68 | 1.5 | 1.6 | 0.1 | 1.3 | 28 | 0.6 | 0.5 | 0.1 | 0.5 |
| C16 | Estómago | 690 | 15.4 | 16.8 | 1.8 | 13.5 | 595 | 12.5 | 11.3 | 1.2 | 10.8 |
| C17 | Intestino delgado | 39 | 0.9 | 1.0 | 0.1 | 0.8 | 49 | 1.0 | 1.0 | 0.1 | 0.9 |
| C18-C20 | Colon recto | 364 | 8.1 | 8.7 | 0.9 | 7.1 | 394 | 8.3 | 7.5 | 0.8 | 7.2 |
| C21 | Ano y del conducto anal | 11 | 0.2 | 0.3 | - | 0.2 | 28 | 0.6 | 0.5 | 0.1 | 0.5 |
| C22 | Hígado y de vías biliares intrahepáticas | 218 | 4.9 | 5.5 | 0.6 | 4.3 | 249 | 5.2 | 4.7 | 0.5 | 4.5 |
| C23-C24 | Vesícula biliar y vías biliares | 139 | 3.1 | 3.4 | 0.4 | 2.7 | 254 | 5.3 | 4.9 | 0.5 | 4.6 |
| C25 | Páncreas | 135 | 3.0 | 3.4 | 0.4 | 2.6 | 196 | 4.1 | 3.7 | 0.4 | 3.6 |
| C30-C31 | Nariz, senos, etc. | 22 | 0.5 | 0.5 | 0.1 | 0.4 | 14 | 0.3 | 0.3 | - | 0.3 |
| C32 | Laringe | 41 | 0.9 | 1.0 | 0.1 | 0.8 | 11 | 0.2 | 0.2 | - | 0.2 |
| C33-C34 | Tráquea bronquios y pulmón | 300 | 6.7 | 7.4 | 0.8 | 5.9 | 299 | 6.3 | 5.8 | 0.6 | 5.4 |
| C40-C41 | Hueso | 46 | 1.0 | 1.0 | 0.1 | 0.9 | 42 | 0.9 | 0.9 | 0.1 | 0.8 |
| C43 | Melanoma maligno de piel | 92 | 2.1 | 2.2 | 0.2 | 1.8 | 86 | 1.8 | 1.7 | 0.2 | 1.6 |
| C44 | Otros tumores malignos de piel | 595 | 13.3 | 14.1 | 1.2 | - | 563 | 11.8 | 9.7 | 0.7 | - |
| C45 | Mesotelioma | 8 | 0.2 | 0.2 | - | 0.2 | 8 | 0.2 | 0.1 | - | 0.1 |
| C46 | Sarcoma de Kaposi | 25 | 0.6 | 0.5 | - | 0.5 | 2 | - | - | - | - |
| C47+C49 | Tejidos conectivo y blandos | 97 | 2.2 | 2.3 | 0.2 | 1.9 | 84 | 1.8 | 1.7 | 0.2 | 1.5 |
| C50 | Mama | 12 | 0.3 | 0.3 | - | 0.2 | 745 | 15.7 | 15.1 | 1.8 | 13.6 |
| C51 | Vulva | - | - | - | - | - | 15 | 0.3 | 0.2 | - | 0.3 |
| C52 | Vagina | - | - | - | - | - | 14 | 0.3 | 0.3 | - | 0.3 |
| C53 | Cuello del útero | - | - | - | - | - | 483 | 10.2 | 9.6 | 1.1 | 8.8 |
| C54 | Cuerpo del útero | - | - | - | - | - | 121 | 2.5 | 2.5 | 0.3 | 2.2 |
| C55 | Útero; parte no especifica. | - | - | - | - | - | 35 | 0.7 | 0.7 | 0.1 | 0.6 |
| C56 | Ovario | - | - | - | - | - | 248 | 5.2 | 4.9 | 0.5 | 4.5 |
| C58 | Placenta | - | - | - | - | - | 14 | 0.3 | 0.3 | - | 0.3 |
| C60 | Pene | 20 | 0.4 | 0.5 | - | 0.4 | - | - | - | - | - |
| C61 | Próstata | 1,145 | 25.6 | 27.7 | 2.7 | 22.4 | - | - | - | - | - |
| C62 | Testículo | 58 | 1.3 | 1.2 | 0.1 | 1.1 | - | - | - | - | - |
| C64 | Riñón; excepto de pelvis renal | 115 | 2.6 | 2.9 | 0.3 | 2.2 | 75 | 1.6 | 1.5 | 0.2 | 1.4 |
| C65 | Pelvis renal | 4 | 0.1 | 0.1 | - | 0.1 | - | - | - | - | - |
| C67 | Vejiga urinaria | 148 | 3.3 | 3.6 | 0.4 | 2.9 | 60 | 1.3 | 1.1 | 0.1 | 1.1 |
| C69 | Ojo y sus anexos | 13 | 0.3 | 0.4 | - | 0.3 | 12 | 0.3 | 0.2 | 0.0 | 0.2 |
| C70-C72 | Cerebro y Sistema Nervioso Central | 196 | 4.4 | 4.6 | 0.4 | 3.8 | 168 | 3.5 | 3.5 | 0.3 | 3.1 |
| C73 | Tiroides | 63 | 1.4 | 1.6 | 0.2 | 1.2 | 158 | 3.3 | 3.2 | 0.4 | 2.9 |
| C80 | Sitios no especificados | 94 | 2.1 | 2.2 | 0.2 | 1.8 | 164 | 3.5 | 3.3 | 0.4 | 3.0 |
| C81 | Linfoma de Hodgkin | 30 | 0.7 | 0.7 | 0.1 | 0.6 | 21 | 0.4 | 0.4 | - | 0.4 |
| C82-C86,C96 | Linfomas no Hodgkin | 370 | 8.3 | 8.9 | 1.0 | 7.2 | 343 | 7.2 | 6.7 | 0.7 | 6.2 |
| C90 | Mieloma múltiple y tumores malignos de células plasmáticas | 104 | 2.3 | 2.6 | 0.3 | 2.0 | 82 | 1.7 | 1.7 | 0.2 | 1.5 |
| C91 | Leucemia linfoides | 137 | 3.1 | 3.2 | 0.2 | 2.7 | 95 | 2.0 | 2.0 | 0.2 | 1.7 |
| C92-C95 | Leucemias mieloides | 144 | 3.2 | 3.4 | 0.3 | 2.8 | 110 | 2.3 | 2.2 | 0.2 | 2.0 |
| Todos los sitios | 5,712 | 127.7 | 137.6 | 13.9 | - | 6,061 | 127.5 | 117.6 | 12.3 | - | |
| Todos los sitios - C44 (piel) | 5,117 | 114.4 | 123.6 | 12.7 | 100 | 5,498 | 115.7 | 107.9 | 11.6 | 100 | |
TC: tasa cruda; TEE: tasa estandarizada por edad; TA: tasa acumulativa; FR: frecuencia relativa
Principales tipos de cáncer
El análisis de los principales tipos de cáncer diagnosticados en la ciudad a lo largo del tiempo se puede observar en la Figura 3, construida a partir de una contrastación de las incidencias del periodo 1985-1989 y el último 2013-2017. Se evidencia cambios importantes en la ubicación que serán comentados más adelante.
Análisis de tendencia
Se encontró un aumento significativo en las tasas de incidencia para todas las localizaciones de cáncer combinadas, a partir del año 2001 en mujeres y 1996 en hombres. En relación con la mortalidad global se observó un incremento significativo durante todo el periodo de análisis, con un CPA de 1.3% en mujeres y 2.0% en hombres (Figura 4).
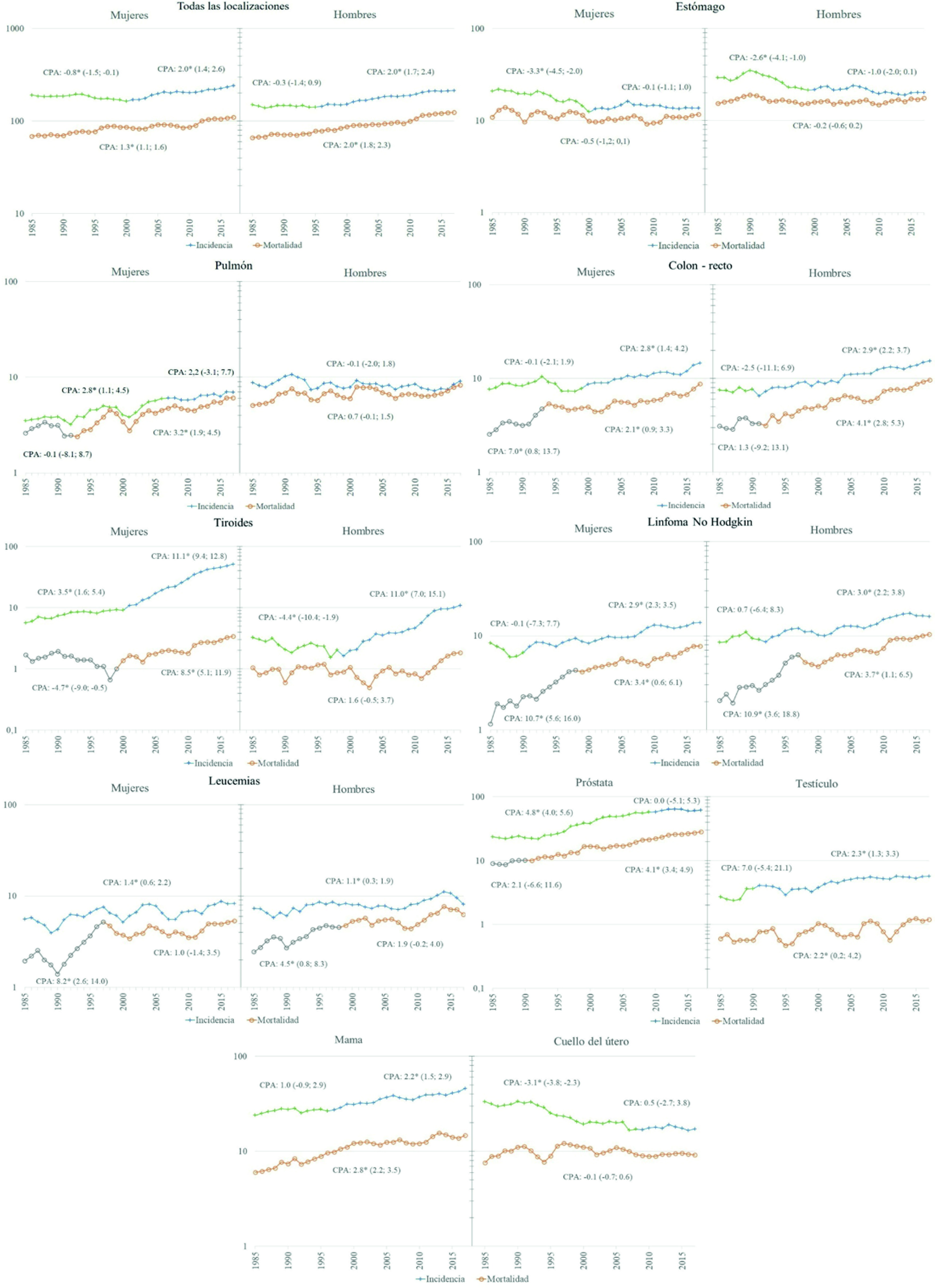
Figura 4 Tendencia de incidencia y mortalidad en Quito 1985 - 2017, localizaciones seleccionadas. Y: Tasa estandarizada por 10,000 años persona; X: año del diagnóstico/muerte. CPA: Cambio porcentual anual obtenido a partir de modelos de regresión de Joinpoint, las cifras entre paréntesis son Intervalos de Confianza al 95% de CPA; una estrella indica una significación estadística de 0.05.
Discusión
Durante los 33 años de análisis, las tasas de incidencia y mortalidad por cáncer en Quito se han incrementado de manera continua. Ecuador elaboró la Estrategia Nacional para la Atención Integral del Cáncer en 2017 14, con la finalidad de disminuir la morbimortalidad y mejorar la calidad de vida de las personas afectadas por cáncer, pero, además, para orientar al Sistema Nacional de Salud en su compromiso de promoción, prevención y control del cáncer y promover las acciones coordinadas de los diferentes segmentos. Si bien evaluar el impacto de esta estrategia no es posible, es necesario ponerla como referente, de frente al perfil epidemiológico dinámico del cáncer.
A lo largo de todo el período evaluado, el incremento de los casos de cáncer en la ciudad de Quito ha sido sostenido. Este aumento de casos es producto, en parte, de la transformación demográfica de la población ecuatoriana que, desde 1985 a 2017, se ha duplicado y ha envejecido, aumentando su expectativa de vida al nacimiento de 66 a 76 años respectivamente 9.
El cáncer entre adultos mayores de 65 años representó el 43.7% del total de casos diagnosticados en Quito para el periodo 2013-2017. Comportamiento similar se observa en la región de América Latina y el Caribe, en donde los nuevos casos de cáncer entre adultos mayores representaron casi la mitad (48%) de la carga de incidencia total (43% en Centroamérica, 49% en Sudamérica y 52% en el Caribe) en el año 2018. De acuerdo a estimaciones actualizadas de GLOBOCAN para 2018, se espera que el número de nuevos casos de cáncer entre los adultos mayores en la región latinoamericana se duplique para el año 2040 15.
A nivel mundial se ha visto una reducción de los cánceres relacionados con infecciones (cáncer de estómago y de cuello uterino) y un incremento de los cánceres relacionados con la occidentalización de los estilos de vida (cáncer de mama, próstata y colorrectal). En Quito, el análisis de tendencia permitió identificar este patrón de comportamiento. El cáncer de próstata, mama y colorrecto presentaron ritmos de crecimiento cada vez más acelerados, en tanto que, estómago y cuello de útero inicialmente disminuyeron seguido de un periodo de estancamiento.
Estómago
La disminución de las tasas de incidencia y mortalidad hace parte del comportamiento histórico de reducción durante el último medio siglo en la mayoría de las poblaciones. Este patrón se atribuye al efecto no planificado del mejoramiento de las condiciones higiénico-sanitarias, incluida una disminución de la prevalencia de Helicobacter pylori y mejoras en la conservación y almacenamiento de los alimentos 3. En Quito, sin embargo, la disminución significativa sucedió hasta el año 2000, posterior a la cual las tasas no decrecieron.
Investigaciones recientes aportan a explicar este estancamiento, probablemente tendría que ver con el tipo histológico, incremento del tipo difuso en comparación con el intestinal y cuya historia natural tendría connotaciones diferentes, también se ha reportado incremento de este cáncer en menores de 50 años en países como Estados Unidos, Canadá, Reino Unido, Chile y Colombia 16,17. Otra razón tiene que ver con el impacto de las desigualdades sociales en este tipo de cáncer, en donde el riesgo de desarrollar y morir es mayor en personas con una posición socio-económica (PSE) baja, quienes se beneficiarían en menor proporción de los avances en la promoción, prevención y tratamiento de la enfermedad 18,19.
Pese a la disminución de las tasas de incidencia, Quito continua, tanto en hombres como en mujeres, ubicándose entre las regiones con las tasas de incidencia más altas en el mundo 3, con una relación M/I del 85.1%, que refleja la alta letalidad de la enfermedad.
La Estrategia Nacional para la Atención Integral del Cáncer en el Ecuador plantea realizar el tamizaje en la población de más de 50 años, mediante la combinación de exámenes serológicos para determinación de Helicobacter pylori y pepsinógeno combinado con endoscopia digestiva alta. El intervalo de los estudios endoscópicos se determinaría mediante el método de estratificación ABC 14. Si bien estas acciones aportarían al control de este tipo de cáncer, es necesario repensar las estrategias a la luz de estos resultados, sin perder de vista la determinación que las inequidades sociales tienen en esta enfermedad 18.
Pulmón
Las tasas de incidencia se mantuvieron estables en los hombres durante todo el periodo, y se vio un patrón de crecimiento significativo en las mujeres entre 1985 y 2005 que posteriormente se estabilizó. Este comportamiento ha impactado en la relación hombre mujer, pasando de 2.4:1 en el primer periodo, a 1.2:1 en el último, reflejando probablemente los perfiles de tabaquismo históricos y específicos por sexo, con una prevalencia del tabaquismo entre los hombres más temprana frente a una tasa de tabaquismo más tardía entre las mujeres 3.
Las tasas de mortalidad permanecieron estables entre los hombres y hubo un crecimiento significativo entre las mujeres desde 1993. Tanto en hombres como en mujeres, la mortalidad sigue de cerca a la incidencia, con un índice de M/I de 88.7% que explica el mal pronóstico de este cáncer, como es mundialmente conocido. En el contexto mundial, las tasas encontradas en Quito, nos ubica entre los países de más baja incidencia 3.
Más del 70% de casos se puede atribuir al tabaco, por lo que, sin duda, las políticas de control del tabaco y la aplicación de leyes antitabaco son claves para disminuir las tasas de incidencia y mortalidad. En Ecuador, las medidas antitabáquicas empezaron en la década de 1980 y se profundizaron luego de la ratificación del Convenio Marco de la OMS para el Control del Tabaco (CMCT OMS) en el año 2006 11,20.
La evaluación nacional de salud más reciente evidencia que la prevalencia del consumo de tabaco para el año 2012 fue de 35.1% en la población de 20 a 59 años, y de 28.4% en la población de 10 a 19 años 21. Reducir la prevalencia de consumo de tabaco se ha convertido en un objetivo nacional, no solo porque implica un costo sanitario y social, sino por el hecho de ser un factor de riesgo susceptible de prevención.
Cuello uterino
En Quito, las tasas de incidencia disminuyeron significativamente hasta el año 2008, a partir de ahí estas se estancan. Como en la mayoría de los países la disminución se puede atribuir, en parte, al cambio en la vida de las mujeres en contextos urbanos 3. Es importante también destacar el programa piloto de tamizaje que permaneció activo entre 1996 y 2007 22. Sin embargo, además del estancamiento en la incidencia, preocupa más el hecho de que las tasas de mortalidad no disminuyeron en los 33 años de análisis, con un índice M/I de 53.4%, lo que refleja las dificultades de acceso en un Sistema Nacional de Salud fragmentado y segmentado, como el ecuatoriano 23.
De acuerdo con la Estrategia Nacional de Atención Integral del Cáncer, se debe promover la salud sexual y reproductiva enmarcada en derechos humanos, y fortalecer el programa de inmunización universal contra el Virus del Papiloma Humano (VPH) desde los 9 años de edad. En relación con el tamizaje, plantea realizar cribado en mujeres de 21 a 65 años con Papanicolaou cada 3 años. En mujeres de 30 a 65 años realizar el tamizaje con citología y pruebas moleculares para VPH cada 5 años 14.
En el contexto de lanzamiento de la Estrategia Global para acelerar la eliminación del cáncer de cuello uterino en el mundo, las altas tasas de incidencia observadas en Quito, que la ubica en el grupo de ciudades con más alta incidencia en el mundo 24, y una mortalidad que no muestra cambios significativos en los 33 años de análisis, es urgente implementar las recomendaciones de la Estrategia Nacional 25.
Mama
Desde los años 80 se evidencia un incremento en las tasas de incidencia, inicialmente adjudicado a una mayor detección a través de la adopción generalizada de la mamografía, y posteriormente a la epidemia de obesidad, dada la asociación más fuerte y consistente del exceso de peso corporal con el cáncer con receptor de estrógeno positivo 3.
En Quito, el incremento de la incidencia ha sido significativo desde finales de los años noventa. El cáncer de mama siempre ha ocupado el segundo lugar entre las mujeres quiteñas, en los años ochenta después del cáncer de cérvix, y actualmente después del cáncer de tiroides. Las tasas de mortalidad se han incrementado de manera sostenida durante todo el periodo de estudio, actualmente ocupa el primer lugar como causa de muerte. A nivel mundial, Quito presenta tasas intermedias en relación a los demás países 3.
El enunciado oficial plantea realizar el tamizaje en mujeres sanas, desde los 50 años hasta los 69 con mamografía, e individualizar e iniciar detección más temprana en mujeres con antecedentes, riesgo o sintomáticas cada dos años 14. Tomando en consideración la magnitud y su comportamiento en el tiempo es indispensable pasar de la propuesta a la implementación del programa de tamizaje en cáncer de mama.
Tiroides
El crecimiento del cáncer de tiroides es un fenómeno mundial, que se inicia a finales de los 90 e inicios de los 2000, cuya explicación inicial basada en el incremento de factores de riesgo como la radiación y la obesidad, no fue suficiente para comprender la magnitud del incremento. La comparación de las curvas de incidencia por edad antes y después de la introducción del ultrasonido, muestra un incremento que se atribuye a la búsqueda intensa de nódulos en individuos de mediana edad. Varios estudios estiman que este aumento se debe al sobrediagnóstico 26-28, pues se trataría de lesiones autolimitadas que no conducen a la muerte. El incremento por sobrediagnóstico se observó inicialmente en los países de mayor desarrollo económico y ahora se extendió a los países de mediano y bajo ingresos, especialmente en aquellos en los que un componente importante de los servicios de salud es privado 26.
En Quito, la incidencia mostró un continuo incremento durante todo el periodo de estudio, que se acentuó en mujeres a partir del año 2001 con un CPA de 11.1 (IC 95%: 9.4-12.8), y en hombres en el año 1999 con un CPA de 11.0 (IC 95%: 7.0-15.1). A lo largo del tiempo este tipo de cáncer escaló posiciones entre los tipos más frecuentes, pasando a ocupar el primer lugar entre las mujeres y el sexto en hombres. Las tasas de mortalidad también se incrementaron en mujeres a partir del 2002, no ocurrió lo mismo entre los hombres, en los que durante todo el período se mantuvo estable.
El incremento de cáncer de tiroides constituye un grave problema de salud pública que necesita mayor profundización y toma de decisiones, sobre todo por las implicaciones económicas, tratamientos innecesarios y efectos indeseables que se puede estar provocando en la población. A nivel mundial, las tasas de Quito están entre las más altas del mundo. Si bien la Estrategia Nacional de Atención Integral del Cáncer en Ecuador no ha priorizado este tipo de cáncer para emitir intervenciones integrales, se requiere de lineamientos técnicos al respecto.
Próstata
A nivel mundial existen importantes diferencias en relación con la incidencia, que fluctúan entre tasas de 6 a más de 100 casos por 100,000 hombres. En la mayoría de los países la tendencia es al incremento, las grandes diferencias, al parecer, no solamente están ligadas al incremento de factores de riesgo, como obesidad, alimentación, sino, fundamentalmente a diferencias en las políticas de prevención y diagnóstico. La implementación del Antígeno Prostático Específico (PSA por sus siglas en inglés) y la ecografía dispararon las tasas desde los ochenta hasta los años 2000, cuando hacen una curva de descenso atribuible a la recomendación de no usar el PSA en pacientes asintomáticos 3,29.
En Quito, ese fenómeno se puede observar desde finales de siglo, diez años más tarde que en países con altos Índice de Desarrollo Humano (IDH), y se mantiene hasta el 2010, luego de lo cual se estabiliza. Este comportamiento ha ubicado a este tumor en el primer lugar entre los cánceres más frecuentes, distanciándose del cáncer de estómago que hasta principios de los noventa ocupaba el primer lugar. La tasa de incidencia pasó de 23.4 en el periodo 1985-1989 a 63.0 casos por 100.000 hombres en 2013-2017, valor promedio para América Latina 3.
Al momento no se ha alcanzado un consenso sobre el tamizaje y la detección precoz del cáncer de próstata en la población. La Organización Mundial de la Salud todavía no ha desarrollado recomendaciones específicas al respecto. En Ecuador, la Estrategia Nacional para la Atención Integral del cáncer, afirma que no es apropiado el tamizaje colectivo generalizado del cáncer de próstata, debido a que se pueden hacer diagnósticos innecesarios y provocar efectos indeseables 7. Esta estrategia se centra más bien, en la promoción de estilos de vida saludables. Así, una elección individual de los hombres después de recibir información sobre las incertidumbres, los riesgos y los beneficios potenciales asociados con la detección, tal y como lo recomienda el Grupo de Trabajo de Servicios Preventivos de Estados Unidos, se convierte en una opción para complementar el control de este tipo de cáncer 30.
Colon-recto
A nivel mundial, el aumento de las tasas del cáncer colorrectal ha estado vinculado al aumento del IDH, de ahí que se lo considera un marcador de desarrollo socioeconómico 31. En Quito, durante el periodo de análisis, se evidenció un incremento constante tanto en sus tasas de incidencia como de mortalidad, y tanto en hombres como en mujeres, con la diferencia de que el incremento de la incidencia empezó más temprano en los hombres, 1991 y 2000 respectivamente. Este incremento en el número de casos nuevos probablemente refleja cambios en los estilos de vida, particularmente en la dieta, es decir, cambios hacia una mayor ingesta de alimentos de origen animal y un estilo de vida más sedentario, incluyendo el consumo excesivo de alcohol, el tabaquismo y el consumo de carne roja o procesada 32.
Al respecto, la prevención primaria sigue siendo la estrategia clave para reducir la creciente carga de este tipo de cáncer a lo que, evidencia actual, sugiere sumar la detección temprana con métodos asequibles y no invasivos (pruebas de guayaco y pruebas inmunoquímicas fecales), al menos en algunos entornos de economías emergentes, y así ofrecer opciones para controlar la creciente carga de la enfermedad 3. En Ecuador esta metodología menos invasiva, después de un proyecto piloto desarrollado en un hospital público de Quito 33,34, ha sido asumido a todo el país a través del manual de tamizaje publicado en el año 2017 35.
Leucemias
Recientemente se ha destacado las marcadas disparidades geográficas en la incidencia de leucemia y su relación con el desarrollo humano, explicadas en parte por la calidad y el acceso a los sistemas de salud, a diversos factores etiológicos, incluidas las interacciones entre genes y medio ambiente 36. En Quito, las tendencias de la incidencia y mortalidad por leucemias, tanto mieloides como linfoides, muestran un incremento constante que la ubica entre los principales tipos de cáncer tanto en hombres como en mujeres. Se requiere profundizar el estudio para comprender los factores subyacentes y así respaldar las futuras estrategias de prevención de este tipo de cáncer.
Linfoma no Hodgkin
A pesar de una comprensión cada vez mayor de la patología y la genética de los linfomas, los informes globales sobre variaciones en la incidencia siguen siendo limitados en su número y alcance 37. Las marcadas diferencias en las tasas de incidencia por país y región pueden estar relacionadas en parte con niveles contrastantes de acceso a la atención y la disponibilidad de servicios de diagnóstico.
En Quito, los linfomas No-Hodgkin, ocupan el tercer cáncer más común en hombres y el sexto en mujeres, para el último periodo de estudio. Su incidencia y mortalidad muestran un continuo incremento, a partir de los años 90, con cifras superiores en hombres que en mujeres. Análisis a profundidad son necesarios para justificar acciones de control para este tipo de cáncer.
Conclusión
El presente artículo describe el perfil epidemiológico del cáncer en la ciudad de Quito. Información indispensable, como línea de base, para formular y retroalimentar las estrategias para controlar esta enfermedad. Es de suma importancia priorizar las acciones sobre los tipos de cáncer de alta incidencia y susceptibles de impacto como el cáncer de cuello uterino, estómago y el de mama, avanzar en el tamizaje de cáncer colorrectal y delinear la política de diagnóstico de los cánceres de tiroides y próstata.
La promoción y la prevención primaria son una forma particularmente eficaz para combatir al cáncer, ya que tienen varias ventajas: la eficacia podría tener beneficios para las personas distintas de las directamente dirigidas 38. Aunque se ha establecido que, sobre la base del conocimiento actual de los factores de riesgo, entre un tercio y la mitad de los cánceres se pueden prevenir; contrasta la poca inversión que se ha dado a esta área, en comparación con otras. Incluso en países de ingresos altos el presupuesto destinado para la prevención del cáncer apenas alcanza el 10% 39.
La mayor fortaleza de este estudio radica en la consistencia del RCBP de Quito como sistema de información que se ha mantenido en el tiempo y ha recibido el reconocimiento de la IACR calificándolo como un registro de alta calidad. Una limitación podría ser que los datos corresponden a una región del país, por lo que el reto a cumplir en el futuro será establecer estimaciones nacionales, con base en la información de los 6 RCBP existentes en el país.
Agradecimientos:
Un especial a todas aquellas personas involucradas en la gestión de información estadística en los diferentes centros de atención oncológica de la ciudad, así como al INEC y la Dirección General de Registro Civil, Identificación y Cedulación; que a lo largo de los años han nutrido las bases de datos del RCBP de Quito. De manera especial, queremos agradecer a las compañeras registradoras María Belén Morejón, Mónica Galarza, Doris Chauca, Paulina Bedón y Silvia Jacho, por su paciente y perseverante trabajo.
REFERENCIAS
1. Gelband H, Sankaranarayanan R, Gauvreau CL, Horton S, Anderson BO, Bray F, et al. Costs, affordability, and feasibility of an essential package of cancer control interventions in low-income and middle-income countries: key messages from Disease Control Priorities. Lancet. 2016; 387(10033): 2133-2144. doi: 10.1016/S0140-6736(15)00755-2. [ Links ]
2. Vaccarella S., Lortet-Tieulent J., Saracci R., Fidler M., Conway D., Vilahur N., Sarfati D., Jemal A. Mackenbach J., Marmot M., Straif K., Wild C. Reducing Social Inequalities in Cancer: Setting Priorities for Research. Ca Cancer J Clin. 2018; 68:324-326. DOI: 10.3322/caac.21463 [ Links ]
3. Sung H, Ferlay J, Siegel RL, Laversanne M, Soerjomataram I, Jemal A, Bray F. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin. 2021; 71(3): 209-249. doi: 10.3322/caac.21660. [ Links ]
4. World Health Organization. World Health Assembly, 70?. Cancer prevention and control in the context of an integrated approach. World Health Organization; 2017. https://apps.who.int/iris/handle/10665/275676. [ Links ]
5. Piñeros M, Abriata MG, Mery L, Bray F. Cancer registration for cancer control in Latin America: a status and progress report. Rev Panam Salud Publica. 2017;41:e2. doi: 10.26633/RPSP.2017.2. [ Links ]
6. World Health Organization. Sixty-sixth World Health Assembly. Draft comprehensive global monitoring framework and targets for the prevention and control of noncommunicable disease. Geneva: WHO; 2013. Available from: http://apps. who.int/gb/ebwha/pdf_files/WHA66/A66_8-en.pdf. [ Links ]
7. Corral F., Cueva P., Yépez J., Tarupi W. Trends in cancer incidence and mortality over three decades in Quito - Ecuador. Colombia Médica (Cali). 2018; 49(1):35-41. doi: 10.25100/cm.v49i1.3785. [ Links ]
8. República del Ecuador, Registro Oficial 784. Acuerdo Ministerial 6345. Ecuador; 1984 [ Links ]
9. INEC. Resultados del Censo 2010 de población y vivienda en el Ecuador. Quito; 2011. Disponible en: http://www.inec.gob.ec/estadisticas/ [ Links ]
10. Piñeros M, Abriata MG, de Vries E, Barrios E, Bravo LE, Cueva P, et al. Progress, challenges and ways forward supporting cancer surveillance in Latin America. Int J Cancer. 2021; 149(1): 12-20. doi: 10.1002/ijc.33407. [ Links ]
11. Cueva AP, Yépez MJ, Tarupi W. Epidemiología del Cáncer en Quito 2011-2015. 16 ed. Sociedad de Lucha contra el Cáncer, Registro Nacional de Tumores: Quito; 2019. Disponible en: http://www.dspace.uce.edu.ec/handle/25000/21183. [ Links ]
12. Segi M, Nippon TK, Tohoku DI. Cancer Mortality for Selected Sites in 24 Countries (1950-57). Department of Public Health Tohoku University School of Medicine; 1960. [ Links ]
13. National Cancer Institute. Joinpoint Trend Analyses software; 2015. https://surveillance.cancer.gov/joinpoint/. [ Links ]
14. Ministerio de Salud Pública. Estrategia Nacional para la Atención Integral del Cáncer en el Ecuador. Quito, Ecuador; 2017. Disponible en: https://aplicaciones.msp.gob.ec/salud/archivosdigitales/documentosDirecciones/dnn/archivos/ac_0059_2017.pdf. [ Links ]
15. Pilleron S, Sarfati D, Janssen-Heijnen M, Vignat J, Ferlay J, Bray F, et al. Global cancer incidence in older adults, 2012 and 2035: A population-based study. Int J Cancer. 2019; 144(1): 49-58. doi: 10.1002/ijc.31664. [ Links ]
16. Tarupi W, de Vries E, Cueva P, Yépez J. Stagnation in Decreasing Gastric Cancer Incidence and Mortality in Quito: Time Trend Analysis, 1985-2013. J Cancer Epidemiol. 2019; 2019: 1504894. doi: 10.1155/2019/1504894. [ Links ]
17. Assumpção PP, Fernandes BW, Ishak G, Gonzaga VCL, Fernandez CFJ, Carioca FH, et al. The diffuse-type gastric cancer epidemiology enigma. BMC Gastroenterol. 2020; 20: 223. Doi: 10.1186/s12876-020-01354-4 [ Links ]
18. Vaccarella S, Lortet-Tieulent J, Saracci R, Conway DI, Straif K, Wild CP. Reducing social inequalities in cancer: evidence and priorities for research. IARC Scientific Publication No. 168. Lyon, France: International Agency for Research on Cancer. 2019. Available from: http://publications.iarc.fr/580. [ Links ]
19. Tarupi W, Guarnizo C, de Vries E. Educational inequalities in gastric cancer incidence and mortality, Quito 1996-2013. International Association of Cancer Registries, Annual Conference; Arequipa, Peru; 2018. [ Links ]
20. Organización Mundial de la Salud. Convenio Marco para el Control del Tabaco - Protocolo para la eliminación del comercio ilícito de productos de tabaco. Geneva; 2013 [ Links ]
21. Freire WB, Ramírez-Luzuriaga MJ, Belmont P, Mendieta MJ, Silva-Jaramillo MK, Romero N, et al. Tomo I: Encuesta Nacional de Salud y Nutrición de la población ecuatoriana de cero a 59 años. ENSANUT-ECU 2012. Ministerio de Salud Pública/Instituto Nacional de Estadísticas y Censos. Quito-Ecuador; 2014. Disponible en: https://www.ecuadorencifras.gob.ec/documentos/web-inec/Estadisticas_Sociales/ENSANUT/MSP_ENSANUT-ECU_06-10-2014.pdf [ Links ]
22. Montes SE. Detección y control de cáncer de cuello uterino. ElHospital; 2005. Citado: 2021 mayo. Disponible en: https://www.elhospital.com/temas/Deteccion-y-control-del-cancer-del-cuello-uterino+8037347?pagina=1 [ Links ]
23. Ruales J, Checa F. La atención del cáncer en el Ecuador: pasado, presente y future. Rev Fac Cien Méd. 2018; 43(1) :46-59. [ Links ]
24. Arbyn M, Weiderpass E, Bruni L, de Sanjosé S, Saraiya M, Ferlay J, Bray F. Estimates of incidence and mortality of cervical cancer in 2018: a worldwide analysis. Lancet Glob Health. 2020 Feb;8(2):e191-e203. doi: 10.1016/S2214-109X(19)30482-6. [ Links ]
25. OMS. Estrategia mundial para acelerar la eliminación del cáncer del cuello uterino como problema mundial de salud pública y sus objetivos y metas conexos para el periodo 2020-2030. OMS; 2020. Disponible en: https://apps.who.int/gb/ebwha/pdf_files/WHA73/A73_R2-sp.pdf. [ Links ]
26. Li M, Dal Maso L, Vaccarella S. Global trends in thyroid cancer incidence and the impact of overdiagnosis. Lancet Diab Endocrinol. 2020; 8(6): 468-470. doi: 10.1016/S2213-8587(20)30115-7. [ Links ]
27. Vaccarella S, Franceschi S, Bray F, Wild CP, Plummer M, Dal Maso L. Worldwide Thyroid-Cancer Epidemic? The Increasing Impact of Overdiagnosis. N Engl J Med. 2016; 375(7): 614-7. doi: 10.1056/NEJMp1604412. [ Links ]
28. Borges AKDM, Miranda-Filho A, Koifman S, Koifman RJ. Thyroid cancer incidences from selected south america population-based cancer registries: an age-period-cohort study. J Glob Oncol. 2018; 4: 1-11. doi: 10.1200/JGO.17.00024. [ Links ]
29. Zhou CK, Check DP, Lortet-Tieulent J, Laversanne M, Jemal A, Ferlay J, et al. Prostate cancer incidence in 43 populations worldwide: an analysis of time trends overall and by age group. Int J Cancer. 2016; 138:1388-1400. doi: 10.1002/ijc.29894. [ Links ]
30. US Preventive Services Task Force, Grossman DC, Curry SJ, Owens DK, Bibbins-Domingo K, Caughey AB, Davidson KW, et al. Screening for prostate cancer: US Preventive Services Task Force recommendation statement. JAMA. 2018;319:1901-1913. doi: 10.1001/jama.2018.3710. [ Links ]
31. Bray F, Piñeros M. Cancer patterns, trends and projections in Latin America and the Caribbean: a global context. Salud Publica Mex. 2016; 58(2): 104-17. doi: 10.21149/spm.v58i2.7779. [ Links ]
32. World Cancer Research Fund; American Institute for Cancer Research. The Continuous Diet, Nutrition, Physical Activity and Cancer: Colorectal Cancer. Update Project Expert Report; 2017. Accessed: 2020 October 23. https://www.wcrf.org/wp-content/uploads/2021/02/Colorectal-cancer-report.pdf. [ Links ]
33. Cuesta CWP. Prueba de sangre oculta en tamizaje de cáncer colorrectal, método inmunoquímico frente al guayacol pacientes 50 a 75 años, HPAS-2018. Tesis pregrado. Carrera de Bioquímica Clínica, Facultad de Ciencias Químicas, Universidad Central del Ecuador: Quito, 2019. [ Links ]
34. Montalvo TMA, Echeverria R. Detección temprana del Cáncer Colorrectal mediante la estrategia de tamizaje protocolizada en personas entre los 50 y 75 años de edad asintomáticos en el área de influencia del Hospital Pablo Arturo Suárez. Especialista en Gerencia de Salud, Colegio de Posgrados, Escuela de Salud Pública. Universidad San Francisco de Quito. Quito, 2014. [ Links ]
35. Ministerio de Salud Pública del Ecuador. Tamizaje de cáncer colorrectal mediante sangre oculta en heces fecales por método inmunoquímico cuantitativo, más colonoscopia, biopsia y estudio histopatológico en la población ecuatoriana entre 50 y 75 años de edad. Manual. Quito: Ministerio de Salud Pública, Dirección Nacional de Estrategias de Prevención y Control, MSP; 2017 [ Links ]
36. Miranda-Filho A, Piñeros M, Ferlay J, Soerjomataram I, Monnereau A, Bray F. Epidemiological patterns of leukaemia in 184 countries: a population-based study. Lancet Haematol. 2018;5(1): e14-e24. doi: 10.1016/S2352-3026(17)30232-6. [ Links ]
37. Miranda-Filho A, Piñeros M, Znaor A, Marcos-Gragera R, Steliarova-Foucher E, Bray F. Global patterns and trends in the incidence of non-Hodgkin lymphoma. Cancer Causes Control. 2019; 30(5): 489-499. doi: 10.1007/s10552-019-01155-5. [ Links ]
38. Vaccarella S, Lortet-Tieulent J, Saracci R, Fidler M, Conway D, Vilahur N, et al. Reducing social inequalities in cancer: setting priorities for research. Ca Cancer J Clin. 2018; 68: 324-326. DOI: 10.3322/caac.21463 [ Links ]
39. Vineis P, Wild CP. Global cancer patterns: causes and prevention. Lancet. 2014; 383(9916): 549-57. doi: 10.1016/S0140-6736(13)62224-2. [ Links ]
Recibido: 30 de Junio de 2021; Revisado: 25 de Noviembre de 2021; Aprobado: 14 de Enero de 2022











 texto en
texto en