Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Colombia Médica
versão On-line ISSN 1657-9534
Colomb. Med. vol.53 no.3 Cali jul./set. 2022 Epub 20-Jul-2022
https://doi.org/10.25100/cm.v53i3.5187
Reporte de caso
Daño hepático inducido por fármacos después de la vacuna RNAm PARA COVID-19: reporte de caso
1 Especialización en Medicina Interna, Departmento de Medicina Interna, Facultad Ciencias de la Salud, Universidad Libre, Cali. Colombia.
2 Departmento de Medicina Interna, , Facultad Ciencias de la Salud, Universidad Libre, Cali. Colombia.
3 Facultad Ciencias de la Salud, Universidad Libre, Cali. Colombia.
4 Medicina, Facultad Ciencias de la Salud, Universidad Libre, Cali. Colombia.
5 Especialización en Gastroenterologia, Facultad de Medicina, Universidad Militar Nueva Granada, Bogotá, Colombia.
6 Maestria en Ciencias Biologicas, Facultad de Ciencias, Pontificia Universidad Javeriana. Bogotá. Colombia.
Descripción del caso:
Paciente femenina de 22 años, quien recibió primera dosis de vacuna Pfizer-BioNTech (RNAm) contra COVID-19; presenta 6 días después, dolor abdominal localizado en hipocondrio derecho y epigastrio, asociado a episodios eméticos. Reconsulta a los 21 días por la misma sintomatología; tres días posteriores a la aplicación de la segunda dosis de la vacuna.
Hallazgos clínicos:
dolor a la palpación en hipocondrio derecho. Los laboratorios reportaron lesión hepatocelular y colestasis, con amilasa, estudios para virus hepatotrópos y hepatitis autoinmune negativos. La ecografía de hígado, vías biliares y colangioresonancia fueron normales.
Tratamiento y Resultados:
hioscina 20 mg vía oral cada 8 horas y líquidos endovenosos como terapia de soporte. Presentó mejoría del dolor abdominal y descenso progresivo de transaminasas y bilirrubinas, hasta su normalización y se dio egreso al quinto día de hospitalización. Se consideró probable diagnóstico de hepatotoxicidad asociada a medicamentos (DILI), en este caso, secundario a la vacunación contra COVID-19.
Relevancia Clínica:
La pandemia actual por el virus SARS CoV-2 ha impulsado el desarrollo de nuevas vacunas, cuya seguridad sigue siendo un motivo de preocupación. En este caso clínico, hay una probable relación causal entre la vacunación y el compromiso hepático, en lugar de una simple aparición esporádica.
Palabras clave: COVID-19; vacuna de RNAm; hepatitis autoinmune; hepatotoxicidad; medicamentos y quimicos que inducen daño hepatico; prueba de función del higado; farmacovigilancia; reacción adversa a las vacunas
Case description:
A 22-year-old female patient received the first dose of Pfizer-BioNTech vaccine (RNAm) against COVID-19; 6 days later, she presented abdominal pain located in the right hypochondrium and epigastrium, associated with emetic episodes. Re-consultation 21 days later due to the same symptoms; three days after the second dose of the vaccine was administered.
Clinical findings:
Pain on palpation in the right hypochondrium. Laboratories reported hepatocellular lesion and cholestasis, with negative amylase, hepatotropic virus and autoimmune hepatitis tests. Liver and biliary tract ultrasound and cholangioresonance were normal.
Treatment and Results:
Hyoscine and intravenous fluids as support therapy. She presented improvement in abdominal pain and progressive decrease of transaminases and bilirubin levels until normalization, and was discharged on the fifth day of hospitalization. A drug-associated hepatotoxicity (DILI) diagnosis was considered probable, in this case, secondary to vaccination against COVID-19.
Clinical Relevance:
The current SARS CoV-2 pandemic has spurred the development of new vaccines, the safety of which remains a concern. There is a likely causal relationship between vaccination and liver involvement in this clinical case, rather than simply a sporadic occurrence.
Keywords: COVID-19; mRNA vaccine; autoimmune hepatitis; hepatotoxicity; Chemical and Drug Induced Liver Injury; Liver Function Tests; Pharmacovigilance; Adverse vaccine reaction
Introducción
A finales del 2019 emergió una nueva neumonía en Wuhan, China, por el virus SARS-CoV-2 (Síndrome Respiratorio Agudo Severo-Coronavirus-tipo 2) cuya propagación no se ha interrumpido hasta ahora, representando una crisis sanitaria que alcanzó el estatus epidemiológico de pandemia en marzo de 2020 1. Según la Organización Mundial de la Salud (OMS), se reportan hasta la fecha de la concepción de este manuscrito, más de 350 millones de casos y alrededor de 5.5 millones de muertes a nivel mundial 2. En este contexto, la crisis global generada ha impulsado el desarrollo de múltiples vacunas para disminuir el impacto del virus.
Los ensayos clínicos de la vacuna Pfizer/BioNTech han demostrado un perfil de seguridad favorable y eficacia para la prevención de la COVID-19 3. Se han reportado reacciones locales y sistémicas posteriores a la aplicación de la vacuna, principalmente fiebre, cefalea, fatiga, escalofríos, mialgias y artralgias 4,5; sin embargo, de forma infrecuente se han informado casos de miocarditis, trombocitopenia trombótica inmune, Guillain-Barré y hepatitis autoinmune 5,6. También se ha descrito lesión hepatocelular en relación con la vacunación para SARS-CoV-2 en ausencia de autoinmunidad 7. Las manifestaciones de lesión hepática varían desde la elevación sérica de las enzimas alanino transferasa (ALT), aspartato transferasa (AST) y bilirrubinas hasta falla hepática aguda en los casos severos 8.
A continuación, se presenta el caso de una paciente de 22 años quien desarrolla lesión hepática inducida por medicamentos (DILI) posterior a la aplicación de la primera y segunda dosis de vacuna Pfizer/BioNTech. El propósito de este artículo es fomentar su sospecha clínica para una adecuada vigilancia y monitorización de los pacientes que puedan manifestar compromiso hepático y si es necesario, se recomienda no aplicar este tipo de vacunas y remplazar por aquellas que tengan un mecanismo de acción diferente al RNAm.
Descripción del caso
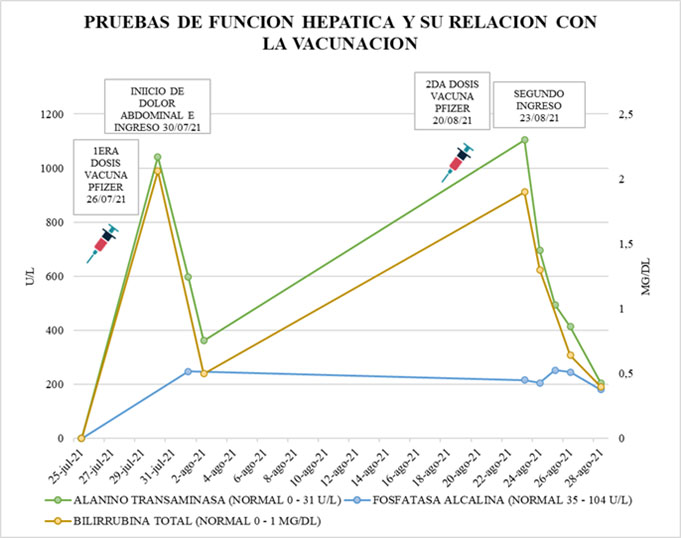
Paciente femenina de 22 años, raza mestiza, procedente del área urbana de la ciudad de Cali, quién labora en una papelería. Asistió al servicio de urgencias por 6 días de dolor abdominal tipo cólico en hipocondrio derecho y epigastrio, asociado a emésis de contenido alimentario, sin cambios en la orina, ni en las heces. En los antecedentes de importancia refirió haber recibido la primera dosis de vacuna Pfizer-BioNTech (RNAm) para COVID-19, seis días antes de su ingreso. Durante el periodo previo y posterior a la vacunación no recibió ningún analgésico tipo acetaminofén u otro medicamento analgésico posterior a las dos dosis. Niega ingesta de otros medicamentos hepatotóxicos, suplementos herbales o venta libre, consumo de alcohol y sustancias psicoactivas. Paciente no refiere síntomas para COVID-19, nexo epidemiológico con un paciente positivo confirmado por RT-PCR y prueba para la identificación del virus de SARS-CoV-2 negativa. Al examen físico, se encontró estable, afebril, escleras y mucosas anictéricas. Presentó dolor abdominal a la palpación profunda en epigastrio, sin signos de irritación peritoneal, heces y orina sin cambios en la coloración y composición. Se encontró elevación de las transaminasas (AST 1.050 U/L (0-32), ALT 1.042 U/L (0-31), elevación de las bilirrubinas BT 2.06 mg/dL (0-1) BD 1.94 mg /dL (0-0.3) y la fosfatasa alcalina 248 U/L (35-104),dos veces su valor normal, con amilasa y estudios para virus hepatotrópos, anticuerpos anti-nucleares (ANA) y anti-músculo liso negativos (Figura 1). La ecografía de vías biliares y la colangioresonancia fueron normales. Dos días posteriores a su ingreso la paciente presentó mejoría clínica, con normalización de pruebas hepáticas y se le dio egreso.
Paciente que consulta por cuadro clínico de características similares 21 días después de la primera dosis y posterior a la colocación de segunda dosis de vacuna Pfizer hace 3 días. Durante este periodo de tiempo no ingirió ningún analgésico incluyendo acetaminofén y AINES o sustancias hepatotóxicas y herbales. Los exámenes de laboratorio mostraron lesión hepatocelular (AST 1.128 U/L (0-32), ALT 1.104 U/L (0-31), BT 1.9 mg/dL (0-1) BD 1.83 mg/dL (0-0.3) fosfatasa alcalina 216 U/L (35-104), GGT 218 U/L (5-36)) (Figura 1), con amilasa y estudios para virus hepatotrópos negativos. Dentro del estudio de autoinmunidad presentó anticuerpos anti-músculo liso en 1:80 pero con anticuerpos antinucleares, anticuerpos anti-microsomales y niveles de inmunoglobulinas séricas negativas. No se realizó prueba molecular para identificación de virus SARS-CoV-2 dada la ausencia de síntomas. Las imágenes abdominales que incluyeron ecografía de hígado y vías biliares y colangioresonancia sin alteraciones. Se instauró tratamiento con hioscina simple 20 mg vía oral cada 8 horas y líquidos endovenosos como terapia de soporte y manejo expectante. Presentó mejoría del dolor abdominal y descenso progresivo de transaminasas y bilirrubinas a partir de las 24 horas de su ingreso, con normalización de estas, al 5 día de hospitalización por lo que se dio egreso.
Durante el seguimiento, ha sido valorada cuatro semanas después por gastroenterología con nuevos laboratorios que incluyen pruebas de función hepática y anticuerpos anti-músculo liso de control, los cuales se encuentran dentro de los parámetros normales y se confirma diagnóstico probable de DILI secundario a la vacunación.
La paciente refiere sentirse satisfecha con el personal médico por amparar su vida y la atención prestada durante la estancia hospitalaria.
Discusión
Se presenta el caso de una paciente joven sin comorbilidades, que desarrolló signos clínicos y de laboratorio compatibles con daño hepático inducido por fármacos con patrón hepatocelular 9. Para llegar a al diagnóstico etiológico se descartaron causas de elevación moderada de pruebas hepáticas asociadas al patrón descrito en ausencia de criterios de insuficiencia hepática aguda, las cuales incluían entre los diagnósticos diferenciales: hepatitis virales, hígado graso asociado a disfunción metabólica, hepatitis autoinmune y alteraciones hepáticas secundarias a procesos estructurales y obstructivos, sin embargo, existía la posibilidad diagnóstica de hepatotoxicidad. Se realizó un interrogatorio completo descartando antecedentes relacionados con el consumo de fármacos; entre los cuales, se incluyó suplementos herbales, analgésicos tipo acetaminofén y antiinflamatorios no esteroideos (AINES); así como el consumo de alcohol o drogas de abuso, con el fin de buscar el agente causal que pudiera explicar el daño hepático. Se considera que dada la relación temporal con la vacunación previa con vacuna Pfizer-BioNTech (RNAm) para SARS-CoV-2, fue el agente desencadenante del daño hepático.
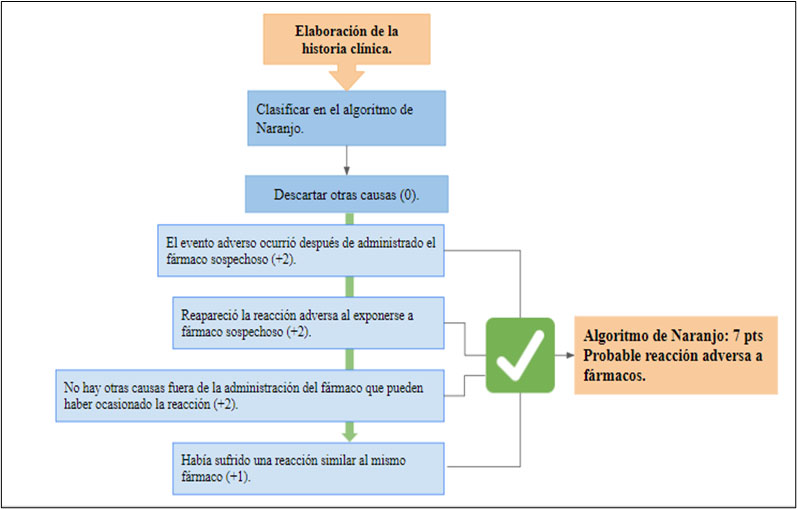
Para establecer la causalidad entre la RAM secundaria y la vacuna, se utilizó el algoritmo de Naranjo et al10 (Figura 2). En ese sentido, los estudios de eficacia y seguridad de la vacuna BNT162b2 Pfizer-BioNTech (RNAm) 11, que incluyen población latina y evalúan la presencia de reacciones adversas con las dos aplicaciones de la misma, muestran que las reacciones locales fueron las más frecuentes, estas tan sólo ocurrieron en menos del 1 % de los casos. Dentro de los eventos adversos reportados, no se encontraron reportes de la alteración de las pruebas de función hepática o reacciones de hepatotoxicidad. Así mismo cuando se describe la población con enfermedad hepática, sólo se incluyó un 0.6% del total de pacientes 11. Los estudios de seguridad y efectividad de las demás vacunas disponibles para SARS-CoV-2, no se encuentran eventos adversos relacionados con patología hepática o afectación de la vía biliar 11-13; excepto, el estudio de la vacuna Moderna que reporta <0.1 % de casos de colecistitis aguda sin hepatitis 14. En la literatura especializada, existen algunos estudios de lesión hepatocelular que han sido relacionados con la vacunación 15,16. En ese orden de ideas, en un estudio realizado en el Reino Unido se evidenció algún tipo de alteración de pruebas hepáticas después de la vacunación con Pfizer/BioNTech BNT162b2 RNAm 15. Igualmente, se ha realizado la descripción de pacientes (13/16 casos) que recibieron primera o segunda dosis de vacuna Pfizer o Moderna, quienes presentaron elevación de transaminasas con un patrón hepatocelular, tres de los cuales desarrollaron lesión hepática aguda 16. Los autores de este estudio sustentada en la propuesta por otros investigadores y dada la evidencia en la literatura, sugieren la posibilidad de reacciones inmunomediadas contra la proteína Spike que favorece a una condición hepática aberrante 16. Por otro lado, Alqarni et al. y Mann et al. 17,18, informan casos con lesión hepática inducida por medicamentos (DILI) posterior a la vacuna RNAm de Pfizer/BioNTech BNT162b2 muy similares al descrito en este artículo.
De acuerdo al algoritmo de Naranjo et al. 10, se logró establecer que la reacción adversa ocurrió después de la administración del fármaco sospechoso; a los 7 días después de la vacunación y reapareció a los 3 días después de colocar la segunda dosis de la misma vacuna, sin otros factores o causas asociadas subyacentes, con un cuadro clínico y laboratorio similar (Figura 2).
Dentro de las limitaciones del estudio, no se pudo establecer el evento adverso mediante pruebas objetivas como el estudio histopatológico por biopsia hepática que permita demostrar cambios de lesión hepática aguda relacionados con hepatotoxicidad 19. De igual manera no se cuentan con estudios experimentales que demuestren este tipo de cambios en tejido por vacunas, sólo reportes de casos de pacientes vacunados para SARS-CoV-2, en los cuales se encontraron diferentes patrones inflamatorios con compromiso portal o hepatitis de interface atribuidos a la asociación de otros fármacos causantes de DILI en los pacientes estudiados 16. Por tal razón, con base en el algoritmo realizado, se puede considerar que la reacción adversa a la vacuna es probable (Figura 2).
Por todo lo anterior, creemos que el diagnóstico probable de la paciente es de una RAM asociada a la vacunación, estableciendo el diagnóstico de DILI dado el compromiso hepático. Se podría constatar que se trataba de un patrón de lesión hepatocelular, basados en los estudios de bioquímica hepática. Además, de la evidente elevación de la ALT 2 veces por encima del límite superior normal y un índice R mayor de 5, siendo R la relación entre ALT y FA 20. Posteriormente, se realiza la escala CIOMS/RUCAM (método de evaluación de causalidad de Roussel Uclaf) (Tabla 1) para determinar la relación de causalidad, obteniendo un puntaje de 10 para una probabilidad alta de DILI 21. Finalmente, se considera que debido a las características, el tiempo de elevación de las enzimas hepáticas y las manifestaciones clínicas de la paciente posterior a la vacunación, se trata de un tipo de DILI idiosincrático dada su baja frecuencia, la ausencia de relación con una dosis definida, impredecible y no reproducible en modelos animales hasta el momento 22.
Tabla 1 Escala CIOMS/RUCAM (Método de evaluación de causalidad de Roussel Uclaf)
| CIOMS/RUCAM | ||||||
|---|---|---|---|---|---|---|
| Tipo de lesión hepática | Hepatocelular | Valor | Colestásico/mixto | Valor | ||
| Criterios cronológicos | Primera exposición | Segunda exposición | Primera exposición | Segunda exposición | ||
| Tiempo de la ingesta del medicamento al inicio de los síntomas | 5-90 días | 1-15 días | 2 | 5-90 días | 1-90 días | 2 |
| <5 o >90 días | >15 días | 1 | <5 o >90 días | > 90 días | 1 | |
| Tiempo de retiro del medicamento al inicio de los síntomas | <15 días | >=15 días | 1 | <= 30 días | <= 30 días | 1 |
| Curso de la enfermedad | Diferencia entre valor máximo de ALT y límite superior normal | valor | Diferencia entre valor máximo de ALP y límite superior normal | Valor | ||
| Al retiro del medicamento | Mejoría >50% en 8 días | 3 | Mejoría >50% en 180 días | 2 | ||
| Mejoría >50% en 30 días | 2 | Mejoría <50% en 180 días | 1 | |||
| Falta información o no hay mejoría | 0 | Falta información o no hay mejoría | 0 | |||
| Empeoramiento o mejoría <50% en 30 días. | -1 | |||||
| Factores de riesgo | Edad (≥55 años) | 1 | Edad (≥55 años) | 1 | ||
| Consumo de alcohol | 1 | Consumo de alcohol o embarazo | 1 | |||
| Terapia concomitante | Ninguno o se desconoce | 0 | Ninguno o se desconoce | 0 | ||
| Fármaco con contribución sugestiva | -1 | Fármaco con contribución sugestiva | -1 | |||
| Hepatotoxicidad conocida, contribución sugestiva | -2 | Hepatotoxicidad conocida, contribución sugestiva | -2 | |||
| Rol probado en el caso | -3 | Rol probado en el caso | -3 | |||
| No hay información disponible | 0 | No hay información disponible | 0 | |||
| Exclusión de otras causas no medicamentosas | Descartada | 2 | Descartada | 2 | ||
| Posible a no investigada | -2 a 1 | Posible a no investigada | -2 a 1 | |||
| Otra causa probable | -3 | Otra causa probable | -3 | |||
| Información de hepatotoxicidad previa | Reacción desconocida | 0 | Reacción desconocida | 0 | ||
| Publicada pero no etiquetada en el medicamento | 1 | Publicada pero no etiquetada en el medicamento | 1 | |||
| Etiquetada en las características del medicamento | 2 | Etiquetada en las características del medicamento | 2 | |||
| respuesta a Re administración del medicamento | Positiva | 3 | Positiva | 3 | ||
| Compatible | 1 | Compatible | 1 | |||
| Negativa | -2 | Negativa | -2 | |||
| No disponible o no interpretable | 0 | No disponible o no interpretable | 0 | |||
| Concentraciones en plasma conocidas como tóxicas | 3 | Concentraciones en plasma conocidas como tóxicas | 3 | |||
| Pruebas de laboratorio validadas con buenos valores predictivos | Positivos | 3 | Positivos | 3 | ||
| Negativos | -3 | Negativos | -3 | |||
| No disponibles o no interpretables | 0 | No disponibles o no interpretables | 0 | |||
Fuente: Tomado y adaptado de Danan, G., & Teschke, R 22.
De igual manera, se habría propuesto la realización de la biopsia hepática de forma hospitalaria para evaluar cambios relacionados con hepatotoxicidad y descartar otras etiologías como enfermedades autoinmunes en una mujer joven sin comorbilidades, como en el caso presentado. Según Kleiner et al. 19, la biopsia hepática no es requerida para evaluar a los pacientes con sospecha de DILI. Sin embargo, plantea algunas directrices para la realización de la biopsia y que puede direccionarse cuando se piensa si los hallazgos histopatológicos son debidos al DILI o se cree en otra patología, si la biopsia contribuye en aclarar cuál es el agente causal del DILI, si la severidad de la injuria y el patrón inflamatorio se resuelve por la administración de esteroides y si brinda una información adicional con respecto al pronóstico del paciente. Así mismo, sugiere que el DILI es un diagnóstico de exclusión, haciendo énfasis en la identificación del agente causal y la correlación con la historia clínica y los exámenes de laboratorio. Del mismo modo, propone que los cambios histopatológicos son muy variados y su espectro comprende la inflamación, necrosis, colestasis, fibrosis, regeneración nodular, la injuria vascular y destrucción del ductus biliar, entre otros 19.
En cuanto al tratamiento, en caso de que los síntomas de la paciente persistan a pesar de las medidas de soporte como la hidratación en conjunto con antiespasmódicos y/o que las pruebas hepáticas persistan elevadas, se sugiere un curso corto de esteroides a bajas dosis, lo cual está descrito en el tratamiento del DILI idiosincrático que no mejora espontáneamente con el retiro del agente causal 22.
Por tal motivo se sugiere evaluar la relación riesgo/beneficio de acuerdo al contexto clínico en caso de requerir nuevas aplicaciones de vacunas, por el cual, se debe individualizar en la toma de decisiones y tener en cuenta como alternativa la aplicación de vacunas con mecanismo de acción diferente al RNAm.
References
1. WHO. Emergency Committee on Novel Coronavirus (2019-nCoV); WHO, 2020. Available on https://www.who.int/director-general/speeches/detail/who-director-general-s-statement-on-ihr-emergency-committee-on-novel-coronavirus-(2019-ncov). [ Links ]
2. Bril F, Al Diffalha S, Dean M, Fettig DM. Autoimmune hepatitis developing after coronavirus disease 2019 (COVID-19) vaccine: Causality or casualty? J Hepatol. 2021; 75: 222-224. doi: 10.1016/j.jhep.2021.04.003. [ Links ]
3. Mulligan MJ, Lyke KE, Kitchin N, Absalon J, Gurtman A, Lockhart S, et al. . Phase I/II study of COVID-19 RNA vaccine BNT162b1 in adults. Nature. 2020; 586(7830): 589-593. doi: 10.1038/s41586-020-2639-4. [ Links ]
4. Rocco A, Sgamato C, Compare D, Nardone G. Autoimmune hepatitis following SARS-CoV-2 vaccine: May not be a casualty. J Hepatol. 2021; 75(3): 728-729. doi: 10.1016/j.jhep.2021.05.038 [ Links ]
5. Tan CK, Wong YJ, Wang LM, Ang TL, Kumar R. Autoimmune hepatitis following COVID-19 Vaccination: true causality or mere association? J Hepatol. 2021; 75(5):1250-1252. doi: 10.1016/j.jhep.2021.06.009. [ Links ]
6. McShane C, Kiat C, Rigby J, Crosbie O. The mRNA COVID-19 vaccine - a rare trigger of Autoimmune Hepatitis? J Hepatol. 2021; 75(5):1252-1254. doi: 10.1016/j.jhep.2021.06.044. [ Links ]
7. Zhou T, Fronhoffs F, Dold L, Strassburg CP, Weismüller TJ. New-Onset Autoimmune Hepatitis following mRNA Covid-19 Vaccination in a 36- year-old woman with Primary Sclerosing Cholangitis - should we be more vigilant? J Hepatol. 2022; 76(1):218-220. doi: 10.1016/j.jhep.2021.08.006. [ Links ]
8. Jothimani D, Venugopal R, Abedin MF, Kaliamoorthy I, Rela M. COVID-19 and the liver. J Hepatol. 2020; 73:1231-1240. doi: 10.1016/j.jhep.2020.06.006. [ Links ]
9. Kwo PY, Cohen SM, Lim JK. ACG clinical guideline: Evaluation of abnormal liver chemistries. Am J Gastroenterol. 2017;112(1):18-35. Doi: 10.1038/ajg.2016.517. [ Links ]
10. Naranjo CA, Busto U, Sellers E, Sandor P, Ruiz I,Roberts EA,. et al. A method for estimating the probability of adverse drug reactions. Clin Pharmacol Therapeut. 1981; 30(2): 239-245. Doi: 10.1038/clpt.1981.154. [ Links ]
11. Polack FP, Thomas SJ, Kitchin N, Kitchin N, Absalon J, Gurtman A, et al. Safety and efficacy of the BNT162b2 mRNA Covid-19 vaccine. NEJM. 2020; 383(27): 2603-2615. Doi: 10.1056/NEJMoa2034577. [ Links ]
12. Falsey AR, Sobieszczyk ME, Hirsch I, Sproule S, Robb ML, Corey L, et al. Phase 3 safety and efficacy of AZD1222 (ChAdOx1 nCoV-19) Covid-19 vaccine. NEJM. 2021;385(25):2348-2360. Doi: 10.1056/NEJMoa2105290. [ Links ]
13. Tanriover MD, Doganay HL, Akova M, Rahmet GH, Azap A, Akhan S, et al. Efficacy and safety of an inactivated whole-virion SARS-CoV-2 vaccine (CoronaVac): interim results of a double-blind, randomized, placebo-controlled, phase 3 trial in Turkey. Lancet. 2021;398(10296): 213-222. Doi: 10.1016/S0140-6736(21)01429-X. [ Links ]
14. El Sahly HM, Baden LR, Essink B, Doblecki-Lewis S, Martin JM, Anderson EJ, et al. Efficacy of the mRNA-1273 SARS-CoV-2 vaccine at completion of blinded phase. New Engl J Med. 2021; 385(19): 1774-1785. Doi: 10.1056/NEJMoa2113017. [ Links ]
15. Print C-mPBva: COVID-19 mRNA Pfizer- BioNTech vaccine analysis print. 2022. Available from: https://assets.publishing.service.gov.uk/government/uploads/system/uploads/attachment_data/file/1072043/COVID-19_mRNA_Pfizer-_BioNTech_vaccine_analysis_print.pdf [ Links ]
16. Shroff H, Satapathy SK, Crawford JM, Todd NJ, VanWagner LB. Liver injury following SARS-CoV-2 vaccination: A multicenter case series. J Hepatol. 2022; 76(1): 211-214. Doi: 10.1016/j.jhep.2021.07.024. [ Links ]
17. Alqarni MM, Faloudah AZ, Alsulaihebi AS, Halawani HK, Khan AS. A Case of Hepatotoxicity After Receiving a COVID-19 Vaccine. Cureus. 2021;13(12): e20455. DOI: 10.7759/cureus.20455. [ Links ]
18. Mann R, Sekhon S, Sekhon S. Drug-induced liver injury after COVID-19 vaccine. Cureus. 2021;13: e16491. doi: 10.7759/cureus.16491. [ Links ]
19. Kleiner DE. Drug-induced liver injury: The hepatic pathologist's approach. Gastroenterol Clin North Am. 2017; 46(2), 273-296. Doi: 10.1016/j.gtc.2017.01.004. [ Links ]
20. Morales ML, Vélez LN, Muñoz MO. Hepatotoxicidad: Drug-induced cholestatic pattern. Rev Colomb Gastroenterol. 2016; 31(1): 36. Doi: 10.22516/25007440.71. [ Links ]
21. Danan G, Teschke R. RUCAM in drug and herb induced liver injury: The update. Int J Mol Sci. 2015; 17(1): 14. Doi: 10.3390/ijms17010014. [ Links ]
22. Hoofnagle JH, Björnsson ES. Drug-induced liver injury-types and phenotypes. New Engl J Med. 2015; 381(3): 264-273. Doi: 10.1056/NEJMra1816149 [ Links ]
Recibido: 20 de Febrero de 2022; Revisado: 05 de Mayo de 2022; Aprobado: 14 de Junio de 2022











 texto em
texto em