Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Colombia Médica
On-line version ISSN 1657-9534
Colomb. Med. vol.54 no.2 Cali Apr./June 2023 Epub June 28, 2023
https://doi.org/10.25100/cm.v54i2.5494
Articulo original
Cambios detectados por citometría de flujo en la anemia megaloblástica secundaria a la deficiencia de cobalamina
1 Universidad de Concepción, Facultad de Medicina, Departamento de Medicina, Concepción, Chile.
2 Hospital Guillermo Grant Benavente, Servicio de Hematología, Concepción, Chile.
Introducción:
Anemias megaloblásticas secundarias a la deficiencia de vitamina B12 son patologías producidas por una síntesis defectuosa del ADN nuclear.
Objetivo:
Describir las alteraciones madurativas encontradas en precursores hematopoyéticos de la médula ósea de una serie de pacientes con anemia megaloblástica.
Métodos:
Se incluyeron pacientes atendidos en el Hospital Regional de Concepción con muestras de médula ósea enviadas para estudio de citopenias por citometría de flujo cuyo diagnóstico fue anemia megaloblástica. El inmunofenotipo se realizó con CD45, CD34, CD117, HLA-DR, marcadores de maduración de serie de neutrófilo (CD13, CD11b, CD10, CD16) y/o eritroblasto (CD105, CD71, CD36).
Resultados:
Se identificaron 8 pacientes con anemia megaloblástica y como controles se utilizaron síndromes mielodisplásicos (n=9) y médula ósea normal o reactiva (n=10). El 44% eran hombres, con una mediana de edad de 58 años. La anemia megaloblástica se asoció con una mayor proporción de tamaño y complejidad de progenitores eritroides y mieloides con respecto de los linfocitos en comparación a los controles. El porcentaje total de eritroblastos y la proporción de células mieloides CD34+ comprometidas con el linaje eritroide fue mayor en anemia megaloblástica, asociado a una parada madurativa en la etapa de precursor CD105+ (69% vs 19% y 23%, p <0.001). La heterogeneidad de CD36 y CD71 en anemia megaloblástica fue similar a los síndromes mielodisplásicos.
Conclusiones:
la anemia megaloblástica produce una afectación heterogénea de la hematopoyesis, caracterizada por un mayor tamaño y complejidad celulares de precursores de la serie neutrófilo y eritroide y una detención madurativa de los eritroblastos.
Palabras clave: Anemia megaloblástica; citometría de flujo; célula de médula ósea; deficiencia de cobalamina; deficiencia de ácido fólico; deficiencia de vitamina B12; hematopoyesis; eritroblastos
Introduction:
Megaloblastic anemias secondary to Vitamin B12 deficiency are a group of pathologies produced by defective nuclear DNA synthesis.
Objective:
To describe the maturation alterations found in hematopoietic precursors of the bone marrow in a series of patients with megaloblastic anemia.
Methods:
Were included patients attended at the Regional Hospital of Concepción with bone marrow samples sent for the study of cytopenia by flow cytometry whose final diagnosis was megaloblastic anemia. The immunophenotype was performed with CD45, CD34, CD117, HLA-DR, markers of neutrophil (CD13, CD11b, CD10, CD16) and/or erythroblast (CD105, CD71, CD36) maturation.
Results:
From the flow cytometry laboratory database, 8 patients with megaloblastic anemia were identified, and myelodysplastic syndromes (n=9) and normal or reactive bone marrow (n=10) were used as controls. 44% were men, with a median age of 58 years. Megaloblastic anemia was associated with a higher proportion of size and complexity of erythroid and myeloid progenitors compared to lymphocytes compared to controls. The total percentage of erythroblasts and the proportion of CD34+ myeloid cells associated with erythroid lineage was higher in megaloblastic anemia, associated with a maturation arrest in the CD105+ precursor stage (69% vs 19% and 23%, p<0.001). The heterogeneity of CD36 and CD71 in megaloblastic anemia was similar to myelodysplastic syndromes.
Conclusions:
Megaloblastic anemia produces a heterogeneous involvement of hematopoiesis, characterized by a greater size and cellular complexity of precursors of the neutrophil and erythroid series and a maturation arrest of the erythroblasts.
Keywords: Anemia, Megaloblastic; cytometry, flow; marrow, bone; Vitamin B 12 Deficiency; cobalamin
Contribución del estudio
| 1) ¿Por qué se realizó este estudio? |
| Este estudio se realizó para describir las alteraciones propias de la anemia megaloblástica encontradas por citometría de flujo en médula ósea, luego de no encontrar información relacionada al tema en la literatura |
| 2) ¿Cuáles fueron los resultados más relevantes del estudio? |
| Los resultados del estudio describen un patrón característico de alteraciones (parada madurativa asociada a aumento de la relación FSC/SSC) en precursores de médula ósea de pacientes con anemia megaloblástica que afectan principalmente a la serie eritroide. |
| 3¿Qué aportan estos resultados? |
| Estos resultados permiten el diagnóstico de este trastorno aún antes de tener los niveles plasmáticos de vitamina B12 y por ende orientar el tratamiento, especialmente en centros donde la disponibilidad de este recurso no es permanente. |
Introducción
La anemia megaloblástica corresponde a un grupo de patologías producidas por una síntesis defectuosa del ADN nuclear secundarios a la deficiencia de vitamina B12 o ácido fólico 1,2. Las manifestaciones clínicas son multisistémicas, pudiendo ser hematológicas, neurológicas y psiquiátricas. El diagnóstico habitualmente es clínico, apoyado en exámenes generales como hemograma, evidencia indirecta de hematopoyesis ineficaz en el perfil bioquímico (elevación de LDH y bilirrubina indirecta), asociado a niveles plasmáticos bajos de vitamina B12 y la elevación de metabolitos como el ácido metilmalónico y la homocisteína 2-4.
El estudio de la médula ósea en pacientes con anemia megaloblástica no es de rutina y se realiza en casos en que se deben descartar otras causas de insuficiencia medular, como las hemopatías malignas. Los hallazgos morfológicos incluyen una médula ósea hipercelular, con aumento del tamaño de los precursores hematopoyéticos en la médula ósea y asincronía madurativa núcleo-citoplasmática. Estas características deben ser interpretadas con cuidado, debido a que se solapan con las que se pueden observar en otras patologías como los síndromes mielodisplásicos 5.
La citometría de flujo es una herramienta de diagnóstico complementaria que tiene la capacidad de describir la maduración de los progenitores mieloides de a médula ósea y es empleada a menudo en el abordaje diagnóstico inicial del paciente con insuficiencia medular.
El objetivo del presente trabajo es describir las alteraciones madurativasen las células hematopoyéticas de la médula ósea de pacientes con anemia megalobástica observadas con citometría de flujo
Material y Métodos
Se realizó un estudio retrospectivo. Se obtuvieron de la base de datos contenida en el programa informático FileMaker del laboratorio de citometría de flujo del Hospital Regional de Concepción, casos de pacientes derivados para estudio de citopenias y que finalmente fueron diagnosticados de anemia megaloblástica. Para estos fines se emplearon las palabras “anemia” y “megaloblástica” en muestras enviadas en el periodo comprendido entre Enero de 2015 y Diciembre de 2018.
Se definió anemia megaloblástica a la presencia de anemia asociada a una ó más citopenias en presencia de niveles plasmáticos descendidos de vitamina B12.
Las muestras de médula ósea de cada paciente fueron tomadas en tubos acondicionados con anticoagulante (EDTA) y procesadas antes de 48 horas, de acuerdo con el protocolo de marcaje de superficie habitual (stain-lyse-wash).
Para el inmunofenotipo se utilizó un panel de 2 tubos de 8 colores que incluyeron las fluorescencias (V450, V500, FITC, PE, PerCP-Cy5.5, PE-cy7, APC y APC-H7), con marcadores de precursor hematopoyético inmaduro (HLA-DR, CD45, CD34 y CD117), asociados a marcadores de diferenciación a neutrófilo (CD16, CD13, CD11b, CD10), y/o eritroblasto (CD36, CD105, CD71) 6. Para medir la diferenciación a línea eritroide en células CD34+ se consideró la proporción CD36+ CD71+ sin expresión de CD13 y CD33. En la serie neutrófilo y eritroblasto se realizó clasificación inmunofenotípica de estadios madurativos de acuerdo los patrones de adquisición de los marcadores señalados previamente, según lo publicado por otros autores 7-9. La heterogeneidad en la expresión de CD36 y CD71 en eritroblastos se evaluó midiendo la proporción negativa a ambos marcadores en la población eritroide en el dot/plot entre ambos, una vez excluidas las plaquetas (CD45-CD36+CD71-). Los parámetros físicos se estimaron realizando una proporción entre el canal pico de complejidad (side scatter, SSC) y de tamaño celular (forward scatter, FSC) de neutrófilos y eritroblastos, en relación a similar parámetro de los linfocitos totales.
La adquisición se realizó en citómetro FACSCantoII® mediante software DIVA (BD Biosciences, San José, California). El análisis de citometría se realizó mediante software Infinicyt® (Cytognos, Salamanca, España). El estudio contó con la aprobación del comité de ética institucional.
Análisis estadístico
Los datos categóricos fueron presentados como mediana, n y porcentajes y los datos numéricos como mediana y rango. Se utilizó la prueba de Ji 2 para analizar diferencias entre variables categóricas y la prueba de Kruskal-Wallis para variables numéricas. El análisis estadístico se realizó con software estadístico SPSS, considerando significativa una p <0.05.
Resultados
Se identificaron 8 pacientes con anemia megalobástica y como controles se utilizaron muestras de pacientes estudiados con diagnósticos de síndrome mielodisplásico (n= 9) y médula ósea normal/reactiva o no comprometida por patología de linaje mieloide (n= 10). En la serie global, 12/27 (44%) fueron hombres y 15/27 (36%) fueron mujeres, con una mediana de edad de 58 años (19-81). Las demás características de los pacientes con anemia megalobástica se muestran en la Tabla 1.
Tabla 1 Características demográficas y clínicas de los pacientes con anemia megalobástica (n= 8).
| Parametros | Medidas |
|---|---|
| Parámetro clínico | |
| Edad, años (rango) | 61 (40-81) |
| Sexo masculino, (n) | 5 |
| Parámetros de laboratorio | |
| Leucocitos, células/mm3 (rango) | 2,680 (1,120-6,970) |
| Hemoglobina, g/dL (rango) | 6.1 (4.6-7.9) |
| Hematocrito, % (rango) | 17.6 (14.0-22.0) |
| Plaquetas, células/mm3 (rango) | 92,000 (21,000-155,000) |
| VCM, fL (rango) | 113 (99-125) |
| LDH, U/L (rango) | 2,819 (996-4,568) |
| Eritroblastos en médula ósea, % | 39 (9-54) |
Los diagnósticos de referencia en el grupo de síndromes mielodisplásicos fueron citopenia refractaria con displasia multilineal (n= 4), anemia refractaria con exceso de blastos (n= 4) y síndromes mielodisplásicos inclasificable (n= 1) y en médula ósea normal linfoma no Hodgkin (n= 2), linfoma de Hodgkin (n= 2), y médula ósea reactiva (n= 6).
Los resultados del análisis inmunofenotípico se muestran en la Tabla 2. La proporción de células hematopoyéticas inmaduras (CD34+ y CD34-/CD117+) fue similar en los tres grupos. Se observó una mayor proporción de células CD34+ sin expresión de CD13 respecto de médula ósea normal y síndromes mielodisplásicos (58% vs 50% y 29%, p= 0.03), lo que se asoció a una mayor diferenciación de células CD34+ a línea eritroide respecto de médula ósea normal y síndromes mielodisplásicos (29% vs 16% y 14%, p <0.005), hallazgo que no se observó en los progenitores CD34-/CD117+.
Tabla 2 Resumen de resultados de análisis de citometría de flujo.
| Parámetro | Anemia megaloblástica (n= 8) | Médula ósea normal/reactiva (n= 10) | Síndrome mielodisplásico (n= 9) |
|---|---|---|---|
| Células mieloides inmaduras | |||
| %CD34+ totales | 1.8 | 1.1 | 3.7 |
| %CD34+CD13- | 58 | 50 | 29* |
| %CD34+ CD36+CD71+ | 29* | 16 | 14 |
| %CD34-CD117+ totales | 4.0 | 1.2** | 3.1 |
| %CD34-CD117+ CD13- | 45 | 29 | 37 |
| Precursores de serie neutrófilo | |||
| % Neutrófilos totales | 35 | 68** | 43 |
| % estadio I | 10.0* | 1.3 | 2.8 |
| % estadio II | 26 | 13** | 35 |
| % estadios I + II | 35 | 14** | 40 |
| Precursores de serie eritroblasto | |||
| % eritroblastos totales CD34- | 35 | 68** | 43 |
| % precursores CD105+ | 69** | 19 | 23 |
| % eritroblastos CD36-CD71- | 23.0 | 3.3** | 25.0 |
| Parámetros físicos | |||
| FSC-A eritroide/linfocito | 0.8 | 0.7 | 0.7 |
| SSC-A eritroide/linfocito | 1.0* | 0.5 | 0.5 |
| FSC-A neutrófilo/linfocito | 4.7* | 2.4 | 2.4 |
| SSC-A neutrófilo/linfocito | 18.0** | 4.8 | 6.8 |
FSC-A (forward scatter): tamaño celular; SSC-A (side scatter): complejidad celular;* <0.05; ** <0.01
La serie neutrófilo se encontró en menor cantidad en anemia megalobástica respecto de médula ósea normal y síndromes mielodisplásicos (35% vs 68% y 43%, p <0.001). Se observó parada madurativa, con aumento de estadios I y II en anemia megaloblástica y síndromes mielodisplásicos, respecto de médula ósea normal (35% vs 40% y 14%, p >0.0001).
En anemia megaloblástica se observó una importante expansión de progenitores eritroides, respecto de médula ósea normal y síndromes mielodisplásicos (29% vs 8% y 16% p <0.001). Asimismo, se observó un mayor porcentaje de precursores CD105+ que en médula ósea normal y síndromes mielodisplásicos (69% vs 19% y 23%, p <0.001) (Figura 1). La heterogeneidad en la expresión de CD36 y CD71 fue similar a la observada en síndromes mielodisplásicos y a su vez mayor respecto a la médula ósea normal (23% vs 25% y 3.3%, p <0.001). Los parámetros físicos demostraron una mayor ratio de tamaño (FSC) y complejidad celular (SSC) en población de neutrófilos y eritroblastos en anemia megaloblástica respecto de síndromes mielodisplásicos y médula ósea normal.
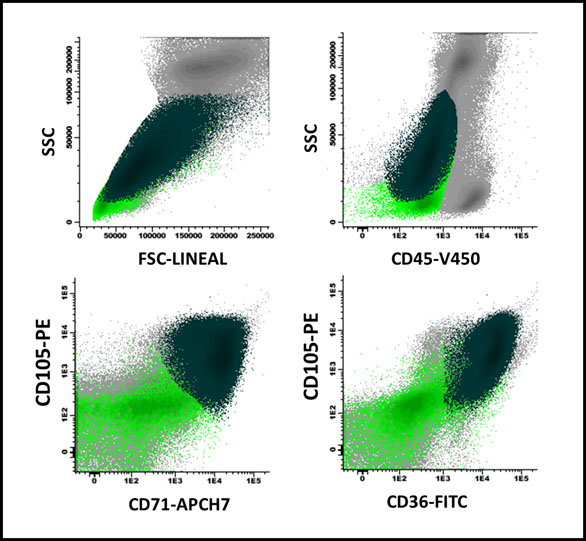
Figura 1 Parada madurativa en serie eritroide en paciente con anemia megaloblástica: Se puede apreciar un predominio de precursores CD105+ (81% del total de eritroblastos) en verde oscuro, por sobre los más maduros (verde claro), los que a su vez se expresan de forma heterogénea para CD36 y CD71 (porción inferior de la figura).
En un caso se documentó resolución de las alteraciones fenotípicas descritas una vez administrada la vitamina B12 vía intramuscular (10,000 UI por día por 3 días), con 9 días de diferencia entre ambos estudios (Figura 2).

Figura 2 Efecto de administración de vitamina B12 en relación FSC/SSC de precursores de serie eritroblasto (verde claro) y neutrófilos (rojo) en paciente con anemia megaloblástica. A y B: previo a administración de B12; C y D: 9 días después hay un aumento proporcional de neutrófilos y reducción de relación FSC/SSC de ambos grupos celulares, incluso antes de la recuperación de cifras periféricas del hemograma.
Discusión
En el presente estudio se observa que los pacientes con anemia megaloblástica se produce una alteración global de la médula ósea, que afecta principalmente a la serie eritroide y se manifiesta por una expansión de la población total secundaria a una mayor diferenciación de células inmaduras con una acumulación de precursores en estadios intermedios que no maduran. Fisiopatológicamente esto se traduce en una hematopoyesis ineficaz, con evidencia clínica y de laboratorio de insuficiencia medular.
La presentación clínica de la anemia megaloblástica es variable, y la mayoría de las veces no se requiere de un estudio medular. En pacientes con sintomatología y alteraciones de laboratorio características, los bajos niveles séricos de vitamina B12 permiten confirmar el diagnóstico. Otras mediciones que se utilizan son los niveles de ácido metilmalónico y homocisteína, siendo esta última más específica, sin embargo ambos estudios no se encuentran disponibles en la mayoría de los centros y además se pueden ver alterados por otros factores 3,5,10. Sin embargo, en algunos casos se presentan con citopenias profundas que obligan al descarte de otras causas de insuficiencia medular (ej. leucemias agudas, síndromes mielodisplásicos, etc) y se requiere de un estudio invasivo, como en nuestra serie 5. En este proceso diagnóstico, la Citometría de flujo es una herramienta de diagnóstico complementaria con resultados en corto tiempo, especialmente en casos donde la morfología es poco específica y no existe disponibilidad permanente para la medición de niveles plasmáticos de vitamina B12, como en nuestro centro.
El principal diagnóstico diferencial por morfología para la anemia megaloblástica es el síndromes mielodisplásicos, sin embargo ambos trastornos pueden presentar características similares. La Citometría de flujo en los síndromes mielodisplásicos se utiliza como herramienta complementaria a la morfología para el diagnóstico. Sin embargo, en nuestro conocimiento, no se han descrito a la fecha hallazgos relacionados al diagnóstico diferencial con anemia megaloblástica 11. En este sentido, lo demostrado en nuestra serie puede aportar a la diferenciación entre ambos trastornos.
Entre las limitaciones de nuestro reporte se encuentran el bajo número de casos, lo que refleja lo señalado anteriormente respecto de la falta de necesidad de estudio medular en la mayoría de los casos de sospecha de anemia megaloblástica y asimismo no se corresponde con la realidad del espectro clínico de la deficiencia de vitamina B12 que abarca desde casos asintomáticos a aquellos con insuficiencia medular y síntomas de otros sistemas. Por otro lado, el carácter retrospectivo y unicéntrico del estudio puede no reflejar la realidad de todos los hospitales públicos del país, por lo cual sería de interés la incorporación de más centros en futuras investigaciones sobre este tema.
References
1. Koury MJ, Horne DW, Brown ZA, et al. Apoptosis of late-stage erythroblasts in megaloblastic anemia: association with DNA damage and macrocyte production. Blood. 1997; 89(12): 4617-4623. doi:10.1182/blood.V89.12.4617 [ Links ]
2. Ballas SK, Pielichowski HJ, Stoll DB. Further characterization of the erythrocyte membrane protein abnormality in megaloblastic anemia. J Med. 1982;13(1-2):15-34. [ Links ]
3. Stabler SP. Vitamin B12 Deficiency. N Engl J Med. 2013; 368(2): 149-160. doi:10.1056/NEJMcp1113996 [ Links ]
4. Green R. Vitamin B12 deficiency from the perspective of a practicing hematologist. Blood. 2017; 129(19): 2603-2611. doi:10.1182/blood-2016-10-569186 [ Links ]
5. Sutton L, Mba N. Hematogones detected by flow cytometry in a child with vitamin B12 deficiency: a case report. Pediatr Dev Pathol. 2017; 20(2):172-175. doi:10.1177/1093526616686241 [ Links ]
6. van Dongen JJM, Lhermitte L, Böttcher S, Almeida J, van der Velden VHJ, Flores-Montero J, et al. EuroFlow antibody panels for standardized n-dimensional flow cytometric immunophenotyping of normal, reactive and malignant leukocytes. Leukemia. 2012; 26(9): 1908-1975. doi:10.1038/leu.2012.120 [ Links ]
7. Matarraz S, López A, Barrena S, Fernandez C, Jensen E, Flores-Montero J,et al. Bone marrow cells from myelodysplastic syndromes show altered immunophenotypic profiles that may contribute to the diagnosis and prognostic stratification of the disease: a pilot study on a series of 56 patients. Cytometry B Clin Cytom. 2010; 78(3): 154-168. doi:10.1002/cyto.b.20513 [ Links ]
8. Orfao A, Matarraz S, Pérez-Andrés M, Almeida J, Teodosio C, Berkowska MA, et al. Immunophenotypic dissection of normal hematopoiesis. J Immunol Methods. 2019;475:112684. doi:10.1016/j.jim.2019.112684 [ Links ]
9. Mello FV, Land MGP, Costa ES, Teodósio C, Sanchez ML, Bárcena P, et al. Maturation-associated gene expression profiles during normal human bone marrow erythropoiesis. Cell Death Discov. 2019;5(1):1-12. doi:10.1038/s41420-019-0151-0 [ Links ]
10. Green R, Datta Mitra A. Megaloblastic anemias: nutritional and other causes. Med Clin North Am. 2017;101(2):297-317. doi:10.1016/j.mcna.2016.09.013 [ Links ]
11. Matarraz S, López A, Barrena S, Fernandez C, Jensen E, Flores J, et al. The immunophenotype of different immature, myeloid and B-cell lineage-committed CD34+ hematopoietic cells allows discrimination between normal/reactive and myelodysplastic syndrome precursors. Leukemia. 2008; 22(6): 1175-1183. doi:10.1038/leu.2008.49 [ Links ]
Recibido: 28 de Diciembre de 2022; Revisado: 02 de Marzo de 2023; Aprobado: 25 de Junio de 2023











 text in
text in 



