Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Colombia Médica
On-line version ISSN 1657-9534
Colomb. Med. vol.54 no.2 Cali Apr./June 2023 Epub June 28, 2023
https://doi.org/10.25100/cm.v54i2.5466
Reporte de caso
Síndrome coronario agudo recurrente tras infusión de infliximab en paciente con artritis reumatoide: Reporte de un caso
1 Pontificia Universidad Javeriana Departmento de Medicina Interna, Bogota, Colombia
2 Pontificia Universidad Javeriana, Medicina Interna, Unidad de Reumatología, Bogota, Colombia
Descripción del caso:
Paciente masculino de 61 años con artritis reumatoide no controlada, en manejo con infliximab, quién presentó en tres oportunidades síndrome coronario agudo menos de 48 horas posterior a la aplicación del medicamento.
Hallazgos clínicos:
Presentó infarto con elevación del ST en dos ocasiones y síndrome coronario agudo sin elevación del ST en una oportunidad, encontrándose enfermedad coronaria multivaso.
Tratamiento y resultado:
Se realizó intervención coronaria con tromboaspiración, implante de stents medicados y angioplastia con balón medicado, suspensión del infliximab y modificación y optimización de manejo farmacológico cardiovascular.
Relevancia clínica:
Los pacientes con artritis reumatoide tienen enfermedad cardiovascular subclínica y mayor riesgo cardiovascular. La evidencia respecto a la relación entre infliximab y cardiopatía isquémica es controversial. En reportes de caso se encuentra un amplio espectro clínico de compromiso cardíaco con la infusión de infliximab, que va desde la angina estable hasta el síndrome coronario agudo con elevación del segmento ST. La fisiopatología no está claramente dilucidada, con hipótesis que proponen la ruptura de placa, reacciones alérgicas y la vasoconstricción como posibles mecanismos de enfermedad. La asociación directa entre la infusión de infliximab y el síndrome coronario agudo necesita más investigación clínica con el fin de optimizar el manejo y pronóstico de los pacientes que presentan este tipo de complicaciones.
Palabras clave: Artritis reumatoide; isquemia miocárdica; infliximab; reporte de caso
Case description:
A 61-year-old male patient with uncontrolled rheumatoid arthritis presented acute coronary syndrome on three occasions, less than 48 hours after infliximab infusion.
Clinical findings:
He presented with ST-elevation myocardial infarction on two occasions and non-ST-elevation acute coronary syndrome on one, with the identification of multivessel coronary disease.
Treatment and outcome:
Coronary intervention was performed with thrombus aspiration, medicated stent implantation, medicated balloon angioplasty, discontinuation of infliximab, and modification and optimization of cardiovascular pharmacological management.
Clinical relevance:
Patients with rheumatoid arthritis have subclinical cardiovascular disease and increased cardiovascular risk. The evidence regarding the relationship between infliximab and ischemic heart disease is controversial. A wide clinical spectrum of cardiac involvement with infliximab infusion is found in case reports, ranging from stable angina to ST-segment elevation acute coronary syndrome. The pathophysiology is not elucidated, with hypotheses proposing plaque rupture, allergic reactions, and vasoconstriction as possible disease mechanisms. The direct association between infliximab infusion and acute coronary syndrome needs more clinical research to optimize the management and prognosis of patients presenting with this type of complication.
Keywords: Rheumatoid arthritis; myocardial ischemia; infliximab; case report
Introducción
Los pacientes con artritis reumatoide tienen mayor riesgo de enfermedad cardiovascular comparado con la población general, se presume en relación a mayor prevalencia de factores de riesgo cardiovascular tradicionales, junto con efectos de la enfermedad inflamatoria no controlada sobre el endotelio vascular. La enfermedad cardiovascular ocupa el primer lugar en causas de muerte en este grupo de pacientes 1,2. Se cree que a mayor evolución y actividad de la enfermedad, mayor riesgo cardiovascular, con posible desarrollo de enfermedad ateroesclerótica subclínica. Es importante destacar que el tratamiento efectivo de la inflamación podría disminuir la carga de enfermedad cardiovascular. Sin embargo, ciertos biológicos, como el infliximab, un anticuerpo monoclonal anti TNF quimérico, pueden presentar efectos adversos cardiovasculares, tales como falla cardiaca congestiva o eventos isquémicos, debido a la interferencia con la función endotelial y la coagulación, especialmente en pacientes con antecedentes de enfermedad cardiaca o factores de riesgo cardiovascular 3,4.
A pesar de que algunos estudios sugieren que los anti-TNF presentan un menor riesgo de síndrome coronario agudo a mediano plazo en comparación con los antirreumáticos modificadores de la enfermedad sintéticos convencionales 5, las tasas de síndrome coronario agudo siguen siendo elevadas en pacientes que reciben terapia biológica, en comparación con la población general, según estudios poblacionales observacionales 6. En un estudio observacional de cohorte retrospectiva de 47,193 pacientes con artritis reumatoide, se encontró que los anti-TNF podrían estar asociados a mayores tasas de eventos coronarios (HR ajustado 1.3; IC 95%: 1.0-1.6) en comparación con abatacept (HR ajustado 0.64; IC 95%: 0.41-0.99) 7.
La incidencia del síndrome coronario agudo como efecto adverso del infliximab no es común, pero existen reportes de caso variables, en general de pacientes con factores de riesgo cardiovascular concomitantes que desarrollan enfermedad coronaria en relación a la aplicación del medicamento. Sin embargo han sido eventos aislados no consecutivos sin clara causalidad establecida, y la mayoría de reportes, en pacientes con otras indicaciones para terapia biológica como espondilits anquilosante o enfermedad de Crohn 6,8-12. Presentamos un caso con mayor sustentación de causalidad entre el medicamento y el evento adverso, tratándose de un paciente con tres episodios de síndrome coronario agudo posterior a infusión de infliximab.
Caso clínico
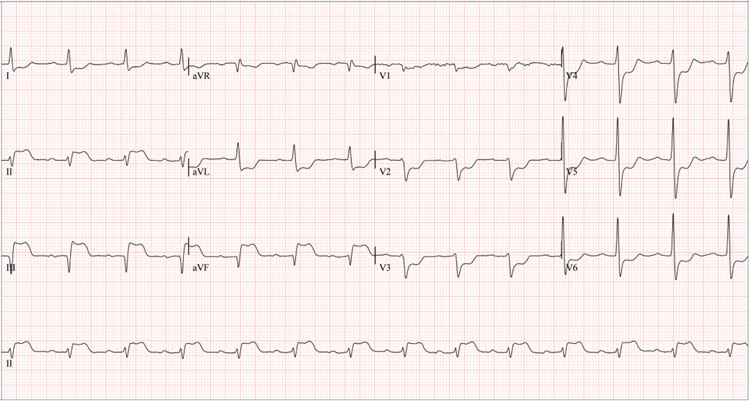
Hombre de 61 años con antecedente de tabaquismo pesado (índice paquete año 22, suspendido hace 27 años). Hipertensión arterial y artritis reumatoide desde los 48 años, en manejo con metotrexato 15 mg/semanal, ácido fólico 1 mg/día, infliximab 3 mg/kg (Remsima dosis ajustada a su peso) cada 8 semanas y amlodipino 5 mg/día. Consultó la primera vez al hospital por dolor torácico anginoso 24 horas posterior a la primera administración de infliximab 300 mg intravenoso (Figura 1). Signos vitales de ingreso con presión arterial 103/60 mmHg, frecuencia cardiaca 74 lpm, frecuencia respiratoria 20 rpm, saturación 92%, índice de masa corporal 24 kg/m2, ruidos cardiacos rítmicos sin soplos, sin signos de falla cardiaca. El electrocardiograma mostró elevación del segmento ST en la pared inferior (Figura 1), con la troponina I elevada (Tabla 1), compatible con un infarto agudo del miocardio. Se decidió hacer reperfusión farmacológica con tenecteplase que fue fallida; por lo que se le realizó un cateterismo de rescate, donde se encontró una lesión del 70% en la arteria descendente anterior, en el segmento medio, arteria coronaria derecha con una alta carga trombótica suboclusiva (segmento medio-distal), y la arteria descendente posterior presento oclusión total. Se realizaron, una intervención coronaria con tromboaspiración, infusión de tirofibán y angioplastia coronaria con balón más implante de dos stents medicados en la arteria coronaria derecha, y angioplastia con balón en la arteria descendente posterior. En un segundo tiempo se realizó angioplastia con balón medicado de la arteria descendente anterior. En el ecocardiograma posterior a la revascularización se encontraron, una fracción de eyección del ventrículo izquierdo (52%), aquinesia del segmento basal inferoseptal y de segmentos basal y mesial de paredes inferior e inferolateral. Por disnea tras el inicio de ticagrelor, se decidió antiagregar con clopidogrel y aspirina.
Tabla 1 Resumen de hallazgos de laboratorio primeras 48 post infusion de infliximab
| Primer evento: | Segundo evento: | Tercer evento: | |
|---|---|---|---|
| Colesterol Total (mg / dl) | 152 | 162 | 137 |
| Colesterol LDL (mg / dl) | 80 | 85 | 28 |
| Triglicéridos (mg / dl) | 189 | 165 | 335 |
| Troponina (ng / L) (Valor normal 0-26) | 144 | <10 | Inicial 27 Control 1,210 |
| Hb1Ac | 5.8 % | 5.8 % | 5.4 % |
| TSH mU / L | 1.33 | 1.13 | 1.22 |
Cinco meses después, se reinicia el manejo con infliximab. 48 horas posterior a la siguiente dosis de biológico, presentó nuevamente dolor torácico anginoso, reingresando a urgencias por un segundo evento coronario agudo (Figura 2). El electrocardiograma presentó bloqueo aurículoventricular de primer grado, inversión de onda T en las derivaciones V4 - V6 con respecto al último electrocardiograma conocido (Figura 3), biomarcador cardiaco negativo (Tabla 1). El ecocardiograma transtorácico encontró trastornos segmentarios de la contractilidad: aquinesia basal y mesial de las paredes inferior e inferoseptal. Se realizó una perfusión miocárdica mostrando una leve isquemia lateral que comprometía el 3% de la masa ventricular izquierda y una necrosis inferior, inferolateral e inferoseptal con compromiso del 30% del ventrículo izquierdo. Se consideró un episodio de síndrome coronario agudo tipo angina inestable, con isquemia no significativa que no ameritaba arteriografía coronaria. Se realizó optimización de manejo farmacológico cardioprotector (betabloqueador, estatina, antagonista del receptor de angiotensina II, antiagregación dual con clopidogrel y aspirina).
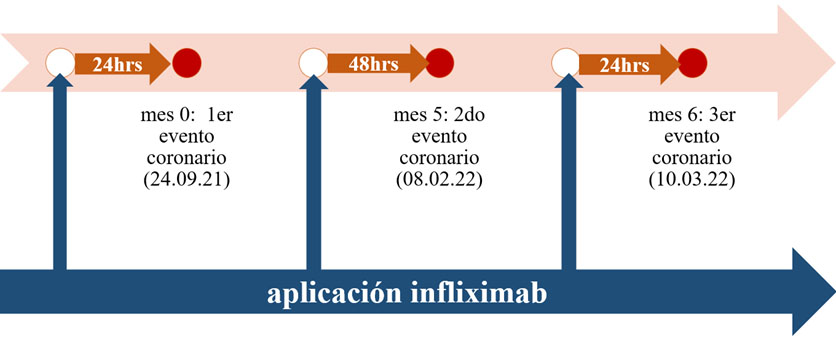
Figura 2 Electrocardiograma de superficie de 12 derivaciones del primer evento, 24 horas posterior a la primera infusión de infliximab. * Elevación significativa del segmento ST en derivaciones DII, DIII y aVF, e infradesnivel del ST en derivaciones precordiales V1-V6, sugestivo de infarto transmural de pared inferior con posible extensión posterior.
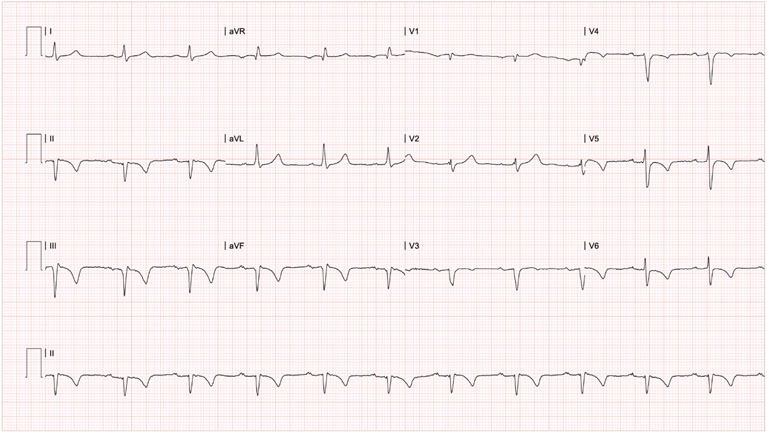
Figura 3 Electrocardiograma de superficie de 12 derivaciones del segundo evento, 5 meses después del primer evento, y 48 horas posterior a la aplicación de la segunda dosis consecutiva de infliximab. * Presenta PR en 220ms, onda Q patológica en derivaciones DII, DIII y aVF, e inversión de onda T en derivaciones DII, DIII, AvF, V4, V5 y V6, compatible con bloqueo aurículoventricular de primer grado, necrosis inferior y posible isquemia subepicárdica inferior y anterolateral.
Seis meses después del primer evento, se administra por tercera vez infliximab y nuevamente 24 horas después de su administración (Figura 2), el paciente presentó un nuevo episodio de dolor torácico anginoso. El electrocardiograma mostró una elevación del segmento ST en la pared inferior (Figura 4), troponina I ultrasensible con delta positivo (Tabla 1), considerándose síndrome coronario agudo tipo infarto agudo de miocardio con elevación del segmento ST. Se realizó arteriografía coronaria que encontró una oclusión, en esta ocasión total, de la arteria coronaria derecha, la angioplastia de la misma fue fallida. El ecocardiograma transtorácico estimó una fracción de eyección del ventrículo izquierdo (51%), y aquinesia de los segmentos basal y mesial inferior e inferoseptal con formación aneurismática inferior. Se realizaron estudios descartando trombofilia o síndrome antifosfolípidos secundario. Llamando la atención con eventos coronarios siempre precedidos de administración de medicamento, se decidió suspender infliximab. Hasta el momento el paciente no ha vuelto a consultar a nuestra institución.
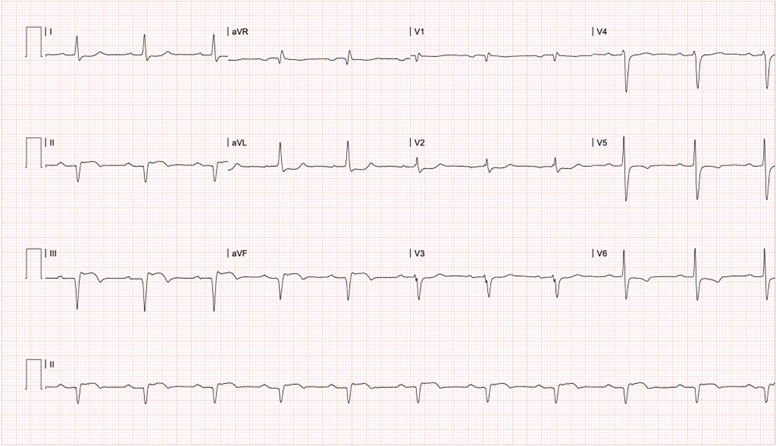
Figura 4 Electrocardiograma de superficie de 12 derivaciones del tercer evento, 6 meses después del primer evento, 24 horas posterior a la tercera administración consecutiva de inflixamab. * Presenta PR en 240ms, elevación del ST y onda Q patológica en derivaciones DII, DIII y aVF, e inversión de onda T en derivaciones V5 y V6, compatible con bloqueo aurículoventricular de primer grado, infarto transmural inferior evolucionado y posible isquemia subepicárdica lateral.
Consideraciones éticas
Los autores declaran que este artículo no contiene información personal que permita identificar al paciente y que se obtuvo el consentimiento informado por escrito del paciente para la publicación de este informe de caso y las imágenes que lo acompañan. El editor en jefe de esta revista tiene disponible una copia del consentimiento por escrito para su revisión.
Discusión
Se describe el caso de paciente con artritis reumatoide establecida (13 años de evolución) con inadecuado control de la enfermedad y compromiso articular deformante, decidiendo inicio de terapia biológica con infliximab, presentando posterior a consecutivas aplicaciones de este antiTNF, tres episodios de síndrome coronario agudo (dos episodios de infarto agudo de miocardio con elevación del segmento ST y un episodio de síndrome coronario agudo sin elevación del ST). Previo al primer evento coronario, tenía factores de riesgo cardiovascular controlados, pero con alta carga de enfermedad reumática con DAS28 en alta actividad. Utilizando el algoritmo desarrollado por Naranjo et al. 13,14, se determinó que la reacción adversa fue probablemente relacionada con el medicamento (Tabla 2), y se indicó la suspensión del mismo.
Tabla 2 Análisis de causalidad entre eventos coronarios y administración de inflixmab con Algoritmo de Naranjo
| Pregunta | Si | No | No Aplica | Respuesta |
| 1. ¿Existen informes previos concluyentes acerca de esta reacción? | 1 | 0 | 0 | 1 |
| 2. ¿El evento adverso apareció después de que se administrara el fármaco sospechoso? | 2 | -1 | 0 | 2 |
| 3. ¿La reacción adversa mejoró al interrumpirse el tratamiento o cuando se administró un antagonista específico? | 1 | 0 | 0 | 0 |
| 4. ¿Reapareció la reacción adversa cuando se volvió a administrar el fármaco? | 2 | -1 | 0 | 2 |
| 5. ¿Hay otras causas (distintas de la administración del fármaco) que puedan por sí solas haber ocasionado la reacción? | -1 | 2 | 0 | -1 |
| 6. ¿La reacción reaparición cuando se administró un placebo? | -1 | 1 | 0 | 0 |
| 7. ¿Se ha detectado el fármaco en sangre (o en otros humores) en una concentración cuya toxicidad es conocida? | 1 | 0 | 0 | 0 |
| 8. ¿Aumentó la gravedad de la reacción al aumentarse la dosis o disminuyó al reducirla? | 1 | 0 | 0 | 0 |
| 9. ¿Había sufrido el paciente una reacción similar al mismo fármaco o a fármacos análogos en alguna exposición previa? | 1 | 0 | 0 | 1 |
| 10. ¿Se confirmó el acontecimiento adverso mediante pruebas objetivas? | 1 | 0 | 0 | 1 |
| Puntuación total: | 6 | |||
*El algoritmo fue modificado al español de la versión original de Naranjo et al. 13,14, y clasifica las reacciones adversas a medicamentos como improbable (0), posible (1-4 puntos), probable (5-8 puntos) y definitivo (≥9 puntos).
La publicación de eventos adversos es de vital importancia como seguimiento en vida real de la seguridad de los medicamentos, con el objetivo de alertar en posibles asociaciones entre el infliximab y eventos cardiovasculares 15. No es posible establecer el riesgo proporcional asociado al infliximab, sin embargo se abre la puerta a una hipótesis de efecto adverso asociado 15. Si bien la relación entre infliximab y cardiopatía isquémica controversial, existe en la literatura y en nuestro caso, evidencia que apoya una relación de causalidad entre el infliximab y los eventos coronarios.
De los antiTNF, el infliximab es el de mayor tasa de efectos adversos, incluyendo cardiovasculares (1%-10%) con bradicardia e hipertensión arterial como más frecuentes 16,17. Un estudio open label para evaluar la seguridad de infliximab en pacientes con AR 18, el 60% de los pacientes reportaron algún efecto adverso, falla cardiaca y eventos cardiovasculares fueron reportados en tan solo el 0.9%. En las advertencias de la FDA para el infliximab 19, se describe la falla cardiaca de nueva instauración o empeoramiento de síntomas, sin incluir síndrome coronario agudo. No obstante, hay reportes de caso que mencionan esta complicación. En ellos se observa la presencia de factores de riesgo cardiovascular no controlados en algunos de los casos, en los cuales la recurrencia de eventos coronarios genera un alerta para el uso de infliximab en pacientes con factores de riesgo cardiovascular 8. Uno describe paciente masculino de 63 años con artritis reumatoide e igualmente con factores de riesgo cardiovascular preexistentes, en este caso diabetes mellitus tipo 2, hipertensión arterial, hipercolesterolemia. Presentó en dos ocasiones síndrome coronario agudo (infarto agudo de miocardio con elevación del segmento ST y luego infarto agudo de miocardio sin elevación del segmento ST) evidenciando enfermedad coronaria obstructiva de dos vasos y con requerimiento de angioplastia con stent, comparable con lo descrito en nuestro caso. Los eventos ocurrieron en las primeras 72 h de aplicado el infliximab (dosis no descrita), sin embargo no fueron con aplicaciones consecutivas, puesto que ocurrieron posterior a la primera y octava infusión, con un periodo en el que se le aplicó infliximab y no presentó la reacción adversa, en contraste con nuestro caso.
Otro reporte 9, una mujer de 49 años con artritis reumatoide e hipertensión arterial, presentó síndrome coronario agudo sin elevación del segmento ST con la infusión del infliximab (dosis de 4.2 mg/kg cada 8 semanas). A diferencia de nuestro caso, el evento ocurrió tras 10 minutos de la décimo quinta infusión de infliximab y en la arteriografía no se encontró enfermedad coronaria obstructiva.
Existen reportes también en entidades distintas a la artritis reumatoidea. Uno de ellos describe un hombre de 41 años con espondilitis anquilosante quien posterior a 18ª infusión de infliximab (dosis no especificada) presentó infarto agudo de miocardio con elevación del segmento ST de pared anterior, con elevación de enzimas cardiacas 10. A diferencia de nuestro caso, el paciente era más joven, no tenía otros factores de riesgo cardiovascular y no se encontró enfermedad coronaria obstructiva. En contraste a nuestro reporte, el evento ocurrió a los pocos minutos de la infusión y no fue en la primera si no en la décimo octava aplicación del medicamento. Otro reporte describe también paciente masculino de 50 años con espondilitis anquilosante, sin otros factores de riesgo cardiovascular asociados, quien a los pocos minutos de iniciada la quinta infusión de infliximab (a dosis de 3 mg/kg cada 8 semanas), presentó angina y elevación del ST en el electrocardiograma, pero a diferencia de nuestro caso, con biomarcador negativo y sin enfermedad coronaria significativa en la arteriografía, con reversión completa de cambios electrocardiográficos, considerándose angina vasoespástica 11. Adicionalmente, encontramos un reporte en enfermedad de Crohn, también de un paciente masculino de 40 años y sin factores de riesgo cardiovascular, quién presentó asimismo a las primeras 72 horas posterior a la primera infusión de infliximab (dosis de 15 mg/kg), infarto agudo de miocardio sin elevación del segmento ST con elevación de troponina, pero no hubo descripción de la anatomía coronaria. Además presentó otras complicaciones que no se vieron en nuestro caso, con fibrilación auricular y disfunción ventricular, describiéndose en el ecocardiograma hipoquinesia del septum interventricular y fracción de eyección del 45% 12.
En el presente reporte existe una clara relación temporal en cada uno de los eventos descritos. Las reacciones ocurrieron en tres ocasiones, con distintas temporalidades entre ellas, cada vez que se volvía a administrar el fármaco. Las dosis del infliximab fueron diferentes en los casos descritos, y no parece haber una clara relación dosis - respuesta claramente establecida. En algunos casos ocurrió en la primera infusión mientras que en otros fue tras varios ciclos previos en los que no había presentado ninguna complicación. A diferencia de los casos reportados anteriormente, nuestro caso es el único en el cual todos los eventos ocurrieron de forma consecutiva, presentando la reacción con cada una de las tres aplicaciones que tuvo. La magnitud del impacto de las reacciones no parece ser fácilmente estimable, como se describió, no en todos los casos se presentó enfermedad coronaria obstructiva, y sólo en uno de los casos, en los que no se describe la anatomía coronaria, se evidenciaron complicaciones como arritmias y disfunción ventricular, lo cual no ocurrió en nuestro caso. Incluso con los eventos repetidos no se encontró disfunción ventricular o arritmia, pero si persistió enfermedad coronaria obstructiva con carga trombótica.
Por último, apoyando la noción causalidad, el evento adverso en nuestro caso fue claramente confirmado por múltiples métodos diagnósticos (electrocardiograma, enzimas cardiacas en sangre y arteriografía). Son varios mecanismos propuestos para explicar la asociación entre síndrome coronario agudo y terapia anti-TNF. Hallazgos de la arteriografía coronaria, características clínicas y laboratorios de nuestro caso (Tabla 1), junto con uno de los reportes descritos, apoyan la noción del mecanismo por ruptura de placa 8. Este fenómeno se cree es explicado por degradación de matriz secundario a desbalance entre concentración y actividad de las metaloproteinasas de matriz extracelular y su inhibidor 8,20,21. La complicación presentada en nuestro paciente con formación aneurismática inferior, podría también estar en relación a este mismo mecanismo. Otros casos sugieren la plausibilidad de distintos mecanismos para el síndrome coronario agudo, entre los cuales están el síndrome de Kounis, caracterizado como un síndrome coronario agudo que se da asociado a activación de basófilos y mastocitos, resultando en reacciones alérgicas / anafilácticas, generando vasoespasmo coronario, erosión y / o ruptura de placa con trombosis coronaria 22. La carga trombótica fue significativa en ambos arteriografías realizadas a nuestro paciente, tanto que incluso la trombólisis con tenecteplase en el primer evento y la angioplastia en el tercer evento, fueron fallidas, lo que apoya aún más el componente trombótico causal en estas reacciones. Así mismo, se han descrito fenómenos de vasoconstricción aguda 9-11, y alteraciones lipídicas a largo plazo 10, lo cual no fue demostrado claramente en nuestro caso.
Como limitantes para la asociación causal y de la descripción del caso, se tienen también algunas consideraciones. La dosis no fue modificada por lo que no se podría establecer una clara relación dosis - respuesta. No se administró un antagonista específico ni tampoco un placebo para evaluar la respuesta. No se determinaron niveles en sangre del fármaco.
Nuestro paciente venia recibiendo metotrexato, considerando que es conocido que el uso de terapia combinada con infliximab disminuye la inmunogenicidad de este medicamento y por ende disminuye el riesgo de presentar reacciones adversas al mismo 23, pero conduce a aumento del nivel de homocisteína en plasma 24. La hiperhomocisteinemia puede ser consecuencia del déficit de vitamina B6 y/o folatos. Niveles elevados de homocisteína se relacionan con daño endotelial, aumento de estrés oxidativo e inflamación, como posibles mecanismos subyacentes en el empeoramiento de la aterosclerosis y generación de enfermedad coronaria 25. Los pacientes con infarto agudo de miocardio en quienes se identifica hiperhomocisteinemia tienen peores desenlaces cardiovasculares a corto y mediano plazo 26. La suplementación concomitante con ácido fólico tal como la recibía el paciente descrito, disminuye niveles de homocisteína, protegiendo contra posibles riesgos cardiovasculares 24. De los medicamentos que se adicionaron para el manejo de la enfermedad cardiovascular, sólo se encontró que infliximab puede disminuir los niveles de estatina en sangre 27 y aumentar el riesgo de neuropatía periférica 28.
No es posible afirmar que no existan otras causas que pudiesen haber generado los eventos coronarios, teniendo en cuenta que pudiesen haber ocurrido de manera espontánea en un paciente con previos factores de riesgo cardiovascular establecidos y que no se realizaron estudios exhaustivos de factores de riesgo cardiovascular no tradicionales como lipoproteina (a), homocisteína, ácido úrico, proteína C reactiva de alta sensibilidad, interleuquina 1, y/o factor de necrosis tumoral - α 29,30. Finalmente, hubo pérdida de seguimiento del paciente entre los eventos y se desestimó el riesgo que hubiese sido prevenible para el segundo, y aún más para el tercer evento. Esto pudo estar en relación a una inicial baja sospecha de este tipo de reacción asociada al infliximab, debido a la baja frecuencia reportada, y la inicialmente mayor probabilidad de que fuera un evento relacionado con sus factores de riesgo cardiovascular.
Conclusión
Nuestro caso sumado a los reportados en la literatura, apoya de forma más contundente una probable relación causal entre el infliximab y síndrome coronario agudo en todo su espectro (infarto agudo de miocardio con elevación del segmento ST, infarto agudo de miocardio sin elevación del segmento ST, infarto del miocardio con enfermedad coronaria no obstructiva “MINOCA” y angina inestable), con predominio de pacientes masculinos, sin que necesariamente exista la presencia de otros factores de riesgo cardiovasculares no controlados. Recalcamos la importancia de tamización y control del riesgo cardiovascular, adicional al adecuado control de la artritis reumatoide y el seguimiento estrecho para identificar tempranamente el riesgo de presentación de este evento adverso, permitiendo una intervención oportuna y evaluación de alternativas farmacológicas.
References
1. Widdifield J, Paterson JM, Huang A, Bernatsky S. Causes of death in rheumatoid arthritis: how do they compare to the general population? Arthritis Care Res (Hoboken). 2018; 70(12): 1748-1755. doi:10.1002/ACR.23548 [ Links ]
2. Jagpal A, Navarro-Millán I. Cardiovascular co-morbidity in patients with rheumatoid arthritis: a narrative review of risk factors, cardiovascular risk assessment and treatment. BMC Rheumatology. 2018; 2(1): 1-14. doi:10.1186/S41927-018-0014-Y [ Links ]
3. Perdriger A. Infliximab in the treatment of rheumatoid arthritis. Biologics. 2009; 3: 183-191. doi:10.2147/BTT.S3189 [ Links ]
4. Carretero CM. Infliximab. Tratamiento de la artritis reumatoide. Offarm. 2008; 27(5): 124-125. [ Links ]
5. Low ASL, Symmons DPM, Lunt M, Mercer LK, Gale CP, Watsonet KD, et al. Relationship between exposure to tumour necrosis factor inhibitor therapy and incidence and severity of myocardial infarction in patients with rheumatoid arthritis. Ann Rheum Dis. 2017; 76(4): 654-660. doi:10.1136/ANNRHEUMDIS-2016-209784 [ Links ]
6. Delcoigne B, Ljung L, Provan SA, et al. Short-term, intermediate-term and long-term risks of acute coronary syndrome in cohorts of patients with RA starting biologic DMARDs: results from four Nordic countries. Ann Rheum Dis. 2022;0:annrheumdis-2021-221996. doi:10.1136/ANNRHEUMDIS-2021-221996 [ Links ]
7. Zhang J, Xie F, Yun H, Chen L, Muntner P, Levitanet EB, et al. Comparative effects of biologics on cardiovascular risk among older patients with rheumatoid arthritis. Ann Rheum Dis. 2016; 75(10): 1813-1818. doi:10.1136/ANNRHEUMDIS-2015-207870 [ Links ]
8. Settergren M, Tornvall P. Does TNF-alpha blockade cause plaque rupture? Atherosclerosis. 2004; 173(1): 149. doi:10.1016/J.ATHEROSCLEROSIS.2003.12.009 [ Links ]
9. Abedin M, Scheurich D, Reimold SC, Reimold AM. Acute coronary syndrome after infliximab infusion. Cardiol Rev. 2006; 14(1): 50-52. doi:10.1097/01.CRD.0000178320.51474.AC [ Links ]
10. Casallo BS, Aragón DA, Marcos SF, Cantalejo MMA, Joya SD, Vicente MC. Infarto agudo de miocardio e infliximab. An Med Interna. 2005; 22(6): 301-302. doi:10.4321/S0212-71992005000600015 [ Links ]
11. Kumar A, Ghose T, Mendiratta N, Prajapati PK, Abrol A. Acute coronary syndrome caused by infliximab in a patient with ankylosing spondylitis. Int J Rheum Dis. 2013; 16(2): 235-236. doi:10.1111/1756-185X.12052 [ Links ]
12. Panteris V, Perdiou A, Tsirimpis V, Karamanolis DG. Acute coronary syndrome after infliximab therapy in a patient with Crohn's disease. World J Gastroenterol. 2006; 12(38): 6235-6238. doi:10.3748/wjg.v12.i38.6235 [ Links ]
13. Naranjo CA, Shear NH, Lanctôt KL. Advances in the diagnosis of adverse drug reactions. J Clin Pharmacol. 1992;32(10):897-904. doi:10.1002/J.1552-4604.1992.TB04635.X [ Links ]
14. Naranjo CA, Busto U, Sellers EM, et al. A method for estimating the probability of adverse drug reactions. Clin Pharmacol Ther. 1981; 30(2): 239-245. doi:10.1038/CLPT.1981.154 [ Links ]
15. Kelly WN, Arellano FM, Barnes J, Barnes J, Bergman U, Ralph IE, et al. Guidelines for submitting adverse event reports for publication. Pharmacoepidemiol Drug Saf. 2007; 16(5): 581-587. doi:10.1002/PDS.1399 [ Links ]
16. Woodrick RS, Ruderman EM. Safety of biologic therapy in rheumatoid arthritis. Nat Rev Rheumatol. 2011; 7(11): 639-652. doi:10.1038/NRRHEUM.2011.145 [ Links ]
17. Janssen Biotech Inc. REMICADE (Infliximab). U.S. Food and Drug Administration website. 2020. Accessed May 14, 2022. https://www.accessdata.fda.gov/drugsatfda_docs/label/2013/103772s5359lbl.pdf [ Links ]
18. Shergy WJ, Isern RA, Cooley DA, Harshbarger JL, Huffstutter JE, Hughes GM, et al. Open label study to assess infliximab safety and timing of onset of clinical benefit among patients with rheumatoid arthritis. J Rheumatol. 2002; 29(4): 667-677. [ Links ]
19. FDA. REMICADE (infliximab) FDA Label; 2013. . Accessed May 31, 2023. https://www.accessdata.fda.gov/drugsatfda_docs/label/2013/103772s5359lbl.pdf [ Links ]
20. Sivasubramanian N, Coker ML, Kurrelmeyer KM, MacLellan WR, DeMayo FJ, Spinale FG, et al. Left ventricular remodeling in transgenic mice with cardiac restricted overexpression of tumor necrosis factor. Circulation. 2001;104(7):826-831. doi:10.1161/HC3401.093154 [ Links ]
21. Kotani T, Takeuchi T, Takai S, Yoshida S, Hata K, Nagai K, et al. Serum levels of matrix metalloproteinase (MMP) 9, a risk factor for acute coronary syndrome, are reduced independently of serum MMP-3 by anti-TNF-a antibody (infliximab) therapy in patients with rheumatoid arthritis. J Pharmacol Sci. 2012; 120(1): 50-53. doi:10.1254/JPHS.12129SC [ Links ]
22. Kounis NG, Kounis GN, Soufras GD, Tsigkas G, Hahalis G. Attention to Infliximab adverse events: chimeric monoclonal antibodies can induce anti chimeric antibodies that may result in Kounis hypersensitivity associated acute coronary syndrome. Eur Rev Med Pharmacol Sci. 2014; 18(24): 3735-3736. [ Links ]
23. Balanescu A, Bojinca V, Bojinca M, Donisan T, Balanescu S. Cardiovascular effects of methotrexate in immune-mediated inflammatory diseases. Exp Ther Med. 2019; 17(2): 1024-1029. doi:10.3892/ETM.2018.6992 [ Links ]
24. Van Ede AE, Laan RFJM, Blom HJ, Boers GHJ, Haagsma CJ, Thomas CMG, et al. Homocysteine and folate status in methotrexate-treated patients with rheumatoid arthritis. Rheumatology (Oxford). 2002; 41(6): 658-665. doi:10.1093/RHEUMATOLOGY/41.6.658 [ Links ]
25. Bajic Z, Sobot T, Skrbic R, Stojiljkovic MP, Ponorac N, Matavulj A, et al. Homocysteine, vitamins B6 and folic acid in experimental models of myocardial infarction and heart failure - how strong is that link?. Biomolecules. 2022; 12(4): 536. doi:10.3390/BIOM12040536 [ Links ]
26. Yan J, Zhou J, Huang J, Zhang H, Deng Z, Du Y. The outcomes of acute myocardial infarction patients comorbidity with hypertension and hyperhomocysteinemia. Scientific Reports. 2021; 11(1): 1-7. doi:10.1038/s41598-021-02340-w [ Links ]
27. Drugs.com. Infliximab and Lipitor Interactions; 2023. Accessed May 31, 2023. https://www.drugs.com/drug-interactions/infliximab-with-lipitor-1336-0-276-128.html?professional=1 [ Links ]
28. Drugs.com. Crestor and infliximab Interactions; 2023. Accessed May 31, 2023. https://www.drugs.com/drug-interactions/crestor-with-infliximab-2031-1316-1336-0.html?professional=1 [ Links ]
29. Lin JS, Evans C V., Johnson E, Redmond N, Coppola EL, Smith N. Nontraditional risk factors in cardiovascular disease risk assessment: updated evidence report and systematic review for the US Preventive Services Task Force. JAMA. 2018; 320(3): 281-297. doi:10.1001/JAMA.2018.4242 [ Links ]
30. Whayne TF. Non-traditional cardiovascular risk markers in the era of established major risk factors and multiple guidelines. Curr Vasc Pharmacol. 2018; 17(3): 270-277. doi:10.2174/1570161116666180123112956 [ Links ]
Recibido: 05 de Diciembre de 2022; Revisado: 15 de Abril de 2023; Aprobado: 02 de Junio de 2023











 text in
text in