Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Colombia Médica
versión On-line ISSN 1657-9534
Colomb. Med. vol.54 no.3 Cali jul./set. 2023 Epub 30-Sep-2023
https://doi.org/10.25100/cm.v54i3.5353
Articulo original
Perfiles de Mutación JAK2, CALR y MPL en Pacientes Colombianos con Neoplasias Mieloproliferativas BCR-ABL Negativas
1 Universidad de Antioquia, Facultad de Medicina, Unidad de Genética Médica, Medellín, Colombia
2 Universidad de Antioquia, Grupo Académico de Epidemiología Clinica, Medellin, Colombia,
3 Hospital Pablo Tobón Uribe, Medellín, Colombia
4 Hospital Alma Mater, Medellín, Colombia
5 Hospital Universitario San Vicente Fundación, Medellín, Colombia
Antecedentes:
Entre las neoplasias mieloproliferativas crónicas no asociadas con mutaciones BCR-ABL se encuentran la policitemia vera, la mielofibrosis primaria y la trombocitemia esencial. Estas enfermedades están causadas por mutaciones en genes, como los genes JAK2, MPL y CALR, que participan en la regulación de la vía de señalización JAK-STAT.
Objetivo:
Establecer las frecuencias de mutaciones en los genes JAK2, MPL y CALR en un grupo de pacientes colombianos con diagnóstico clínico negativo de NMP BCR-ABL.
Metodos:
Se analizaron las mutaciones y deleciones o inserciones JAK2 V617F y MPL W515K en el exón 9 del gen CALR en 52 pacientes colombianos con policitemia vera, mielofibrosis primaria y trombocitemia esencial.
Resultados:
La mutación JAK2V617F la portaban el 51.9% de los pacientes, la mutación CALR el 23.0% y la mutación MPL el 3.8%; El 23.0% fueron triple negativos para las mutaciones analizadas. En estas neoplasias se identificaron seis tipos de mutación en CALR, uno de los cuales no ha sido reportado previamente. Además, un paciente presentó una doble mutación tanto en el gen CALR como en el JAK2. En cuanto a los resultados hematológicos para las mutaciones, se encontraron diferencias significativas en el nivel de hemoglobina, el nivel de hematocrito y el recuento de plaquetas entre las tres neoplasias.
Conclusiones:
Así, este estudio demuestra la importancia de la caracterización molecular de las mutaciones JAK2, CALR y MPL en pacientes colombianos (cuyo contexto genético aún no está claro en las neoplasias antes mencionadas) para lograr un diagnóstico certero, un buen pronóstico, un manejo adecuado y una mejoría del paciente. supervivencia.
Palabras clave: JAK2; CARL; MPL; Colombia; Desorden mieloproliferativo; policitemia vera; mielofibrosis primaria; trombocitemia esencial
Background:
Among the chronic myeloproliferative neoplasms (MPNs) not associated with BCR-ABL mutations are polycythemia vera, primary myelofibrosis, and essential thrombocythemia. These diseases are caused by mutations in genes, such as the JAK2, MPL, and CALR genes, which participate in regulating the JAK-STAT signaling pathway.
Objective:
This study aimed to establish the frequencies of mutations in the JAK2, MPL, and CALR genes in a group of Colombian patients with a negative clinical diagnosis of BCR-ABL chronic myeloproliferative neoplasms.
Methods:
The JAK2 V617F and MPL W515K mutations and deletions or insertions in exon 9 of the CALR gene were analyzed in 52 Colombian patients with polycythemia vera, primary myelofibrosis, and essential thrombocythemia.
Results:
The JAK2V617F mutation was carried by 51.9% of the patients, the CALR mutation by 23%, and the MPL mutation by 3.8%; 23% were triple-negative for the mutations analyzed. In these neoplasms, 6 mutation types in CALR were identified, one of which has not been previously reported. Additionally, one patient presented a double mutation in both the CALR and JAK2 genes. Regarding the hematological results for the mutations, significant differences were found in the hemoglobin level, hematocrit level, and platelet count among the three neoplasms.
Conclusion:
Thus, this study demonstrates the importance of the molecular characterization of the JAK2, CALR and MPL mutations in Colombian patients (the genetic context of which remains unclear in the abovementioned neoplasms) to achieve an accurate diagnosis, a good prognosis, adequate management, and patient survival.
Keyword: JAK2; CARL; MPL; Colombia; myeloproliferative disorder; polycythemia vera; primary myelofibrosis; thrombocythemia essential
Contribución del estudio
| 1) ¿Por qué se realizó este estudio? |
| Este estudio se realizó debido a la falta de información molecular relacionada con las mutaciones conductoras en los genes JAK2, MPL y CALR en pacientes colombianos. Se sabe que estas mutaciones están asociadas con el diagnóstico y pronóstico de patologias como policitemia vera, mielofibrosis primaria y trombocitemia esencial |
| 2) ¿Cuáles fueron los resultados más relevantes del estudio? |
| Los resultados más relevantes de este estudio se pueden resumir de la siguiente manera: a pesar del tamaño relativamente pequeño de la población seleccionada, pudimos encontrar un paciente con doble mutación en los genes JAK2 y CALR. Además, nuestra investigación muestra una mutación en el gen CALR que no había sido previamente informada. Finalmente, cabe destacar que nuestro estudio representa un esfuerzo pionero para describir la frecuencia mutacional de estas tres mutaciones genéticas en pacientes colombianos diagnosticados con neoplasia mieloproliferativa.. |
| 3¿Qué aportan estos resultados? |
| Hasta la fecha, este es el primer estudio en describir el perfil mutacional de estos tres genes en neoplasias myeloproliferativas BCR-ABL1 negativas en Colombia lo cual permite a investigadores y clínicos entender la importancia del perfilamiento molecular en el diagnóstico y pronóstico de pacientes con estas patologías. |
Introducción
Las neoplasias mieloproliferativas crónicas (NMP) no asociadas con mutaciones BCR-ABL o Filadelfia negativas son un conjunto de enfermedades cuya principal característica es la proliferación clonal de células mieloides con madurez morfológica y eficiencia hematopoyética variables. Las neoplasias más comunes de este grupo son la policitemia vera, la mielofibrosis primaria y la trombocitemia esencial 1. Según Shallis et al. 2, la incidencia de neoplasias mieloproliferativas crónicas BCR-ABL negativas es de 0.44-5.87 casos por 100,000 habitantes, con tasas de 0.84, 1.03 y 0.47 casos por 100,000 habitantes para policitemia vera, trombocitemia esencial y mielofibrosis primaria, respectivamente 2.
Los estudios sobre neoplasias BCR-ABL negativas en Colombia son escasos. El único estudio que investigó las características clínicas de estas neoplasias fue presentado en el primer informe del registro colombiano de neoplasias mieloproliferativas realizado por la Asociación Colombiana de Hematología y Oncología (ACHO), que comprende 79 pacientes de diferentes hospitales del país entre 2013 y 2017. En este grupo, la trombocitemia esencial fue la enfermedad más frecuente de las tres patologías con 93 pacientes (51.9%), seguida de la policitemia vera con 55 pacientes (30.7%) y la mielofibrosis primaria con 31 pacientes (17.3%) 3. Sin embargo, hasta la fecha no se han publicado estudios moleculares de estas neoplasias en la población colombiana.
Las mutaciones en los genes que regulan la vía de señalización JAK-STAT, como los genes JAK2, MPL y CALR, causan neoplasias mieloproliferativas crónicas BCR-ABL negativas. Por ejemplo, la mutación sin sentido de la tirosina quinasa JAK2 V617F conduce a un intercambio de valina por fenilalanina en la posición 617, lo que produce la fosforilación constitutiva de JAK2 y Ba/F3 o Ba/F3-EpoR, lo que permite que varias líneas celulares sobrevivan y proliferen independientemente de las citocinas 4. Asimismo, mutaciones en el gen MPL, como el cambio W > L o W > K en el codón 515, provocan la activación espontánea de la vía JAK-STAT 5. Además, han sido informadas mutaciones somáticas para el gen CALR que implican cambios en el marco de lectura causados por deleciones o inserciones en el exón 9 6.
La principal característica clínica de la policitemia vera es el aumento de la producción de glóbulos rojos independiente de los mecanismos que normalmente regulan la eritropoyesis 7. El noventa y cinco por ciento de los pacientes con esta patología presentan la mutación V617F u otra mutación en el gen JAK2, lo que resulta en el rápido aumento del linaje eritroide y otras líneas mieloides (panmielosis). Sin embargo, la trombocitemia esencial compromete principalmente el linaje megacariocítico y se caracteriza por trombocitosis sostenida (recuento de plaquetas > 450 x 109/L) en la sangre periférica y un número creciente de megacariocitos maduros grandes, que forman grupos 8. Los pacientes con trombocitemia esencial tienen una mutación JAK2 en 50 a 60% de los casos, mutaciones CALR en 30% y mutaciones MPL en 3%; aproximadamente el 12% son triple negativos. Ninguna de estas mutaciones es específica de TE, pero su presencia excluye la trombocitosis reactiva (el principal diagnóstico diferencial de TE) (4. Finalmente, la mielofibrosis primaria se caracteriza por el rápido aumento de granulocitos y megacariocitos en la médula ósea relacionado con el depósito de tejido conectivo fibroso y la hematopoyesis extramedular en las últimas etapas de la enfermedad (9. La mutación JAK2 V617F se observa en el 50-60% de los casos independientemente del estadio de la enfermedad, la mutación CALR en el 24% de los casos y las mutaciones MPL en el 8 %; Aproximadamente el 12% de los casos son triple negativos 5.
Las mutaciones en los genes JAK2, MPL y CALR son fundamentales para el diagnóstico, pronóstico y seguimiento de pacientes con neoplasias mieloproliferativas crónicas y fueron propuestas y revisadas por la OMS en 2008-2016 (10. Ninguna publicación ha identificado la frecuencia y el tipo de estas mutaciones en estos tres genes en pacientes con neoplasias mieloproliferativas crónicas BCR-ABL negativas en Colombia. Este estudio está dirigido a establecer las frecuencias de mutaciones en los genes JAK2, MPL y CALR en pacientes colombianos con diagnóstico clínico negativo de neoplasias mieloproliferativas crónicas BCR-ABL. El análisis genético permite determinar un diagnóstico molecular más preciso en estos pacientes colombianos para establecer el pronóstico y tratamiento más adecuado que impacte en su supervivencia.
Materiales y métodos
Se realizó un estudio descriptivo, transversal. La población de estudio estuvo compuesta por una muestra por conveniencia de pacientes con diagnóstico clínico e histopatológico de neoplasias mieloproliferativas crónicas BCR-ABL negativas según los criterios de la Organización Mundial de la Salud (OMS) (10 y mayores de 16 años. Los criterios de exclusión fueron: diagnóstico <15 años, no hubo estudios moleculares de muestras de sangre total y los pacientes no estaban dispuestos a participar en el estudio. Las muestras se obtuvieron de pacientes al momento del diagnóstico y de pacientes que recayeron en cualquiera de las tres enfermedades consideradas en este estudio. Los parámetros clínicos y de laboratorio se obtuvieron desde el momento del diagnóstico o recayeron mediante la revisión de sus historias clínicas. Las muestras fueron remitidas a la Unidad de Genética Médica de la Universidad de Antioquia desde tres hospitales de Medellín-Colombia (Hospital San Vicente Fundación, Clínica León XIII, IPS Universitaria y Hospital Pablo Tobón Uribe) entre 2017 y 2021. Después de que los pacientes proporcionaran su consentimiento informado firmado, sus muestras de sangre periférica se utilizaron para el análisis de biología molecular de los genes JAK2, MPL y CALR. El protocolo del estudio y el consentimiento informado fueron aprobados por el Comité de Bioética para experimentación en humanos de la Facultad de Medicina de la Universidad de Antioquia.
Análisis molecular de los genes JAK2, MPL y CALR
La extracción de ADN se realizó utilizando muestras de sangre completa y el kit comercial QIAamp DNA Mini y Blood Mini (Qiagen, Hilden, Alemania) siguiendo las recomendaciones del fabricante.
La mutación p.V617F localizada en el exón 14 del gen JAK2 se detectó mediante PCR en tiempo real (qPCR) y el kit comercial de detección de mutaciones JAK2 de Amoydx (distrito de Haicang, Xiamen, China). Las mutaciones MPL W515L y MPL W515K se detectaron utilizando el kit comercial MPL W515L/K MutaScreen de ipsogen, siguiendo las instrucciones del fabricante Las muestras con mutaciones se confirmaron mediante secuenciación Sanger bidireccional directa utilizando un analizador genético ABI 3500 Applied Biosystems y los cebadores. MPL-F: TGGGCCGAAGTCTGACCCTTT y MPL-R: ACAGAGCGAACCAAGAATGCCTGT, como se informa anteriormente 11.
Para el gen CALR, las inserciones/deleciones (indeles) en el exón 9 se evaluaron analizando el tamaño de los fragmentos amplificados. Se utilizaron los siguientes cebadores para la amplificación: CALR-F: 5'GAGGTGTGTGCTCTGCCTG3' y CALR-R: 5'AGAGACATTATTTGGCGCGG3'. El alelo directo estaba marcado con 6-fluoresceína (6-FAM) y el alelo normal tenía un tamaño de 298 pb, según Jones et al12. El análisis del tamaño de los fragmentos se realizó mediante secuenciación Sanger bidireccional y un analizador genético ABI 3500 Applied Biosystems utilizando el programa Gene Mapper. Las muestras positivas para indeles fueron secuenciadas por el método de Sanger para confirmar los resultados obtenidos mediante análisis de fragmentos. La secuenciación se realizó utilizando los siguientes cebadores: CALR.SF: 5'ACAACTTCCTCATCACCAACG3' and CALR.SR: 5'GGCCTCAGTCCAGCCCTG3' siguiendo las condiciones de Klampfl et al13. En su enfoque, se requiere la amplificación, posterior purificación y secuenciación de los productos de la PCR. Los cromatogramas obtenidos se analizaron mediante el programa Chromas Pro y las secuencias se alinearon con la secuencia de referencia reportada en GenBank mediante el programa Clustal Omega.
Análisis estadístico
Los resultados se muestran como frecuencias absolutas y porcentajes para variables categóricas (sexo, mutación JAK2, mutación CALR, mutación MPL y mutación triple negativa) y medianas y rangos intercuartílicos (percentil 25 y percentil 75) para variables cuantitativas (nivel de hemoglobina, hematocrito). nivel, recuento de plaquetas, recuento de leucocitos, recuento de linfocitos, recuento de neutrófilos). Las comparaciones entre los grupos de mutaciones JAK2, CALR y triple negativo y diferentes tipos de neoplasias en cuanto a los resultados hematológicos se realizaron mediante la prueba de Kruskal-Wallis. Las comparaciones de grupos pareados se realizaron mediante la prueba U de Mann-Whitney. Para todos los análisis se utilizó el entorno R (R Core team 2021) versión 4.0.5 (2021-03-31) y Rstudio versión 1.4.1106 14.
Resultados
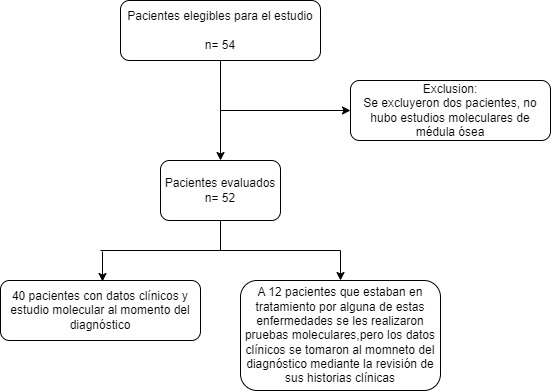
Se incluyeron en el estudio 54 personas con esta patología, de las cuales dos fueron excluidas por no existir estudios moleculares por la baja calidad de las muestras (Figura 1). Veintisiete pacientes (51.9%) eran hombres y 25 mujeres (48.1%). La edad promedio fue de 58 años (DE: 15.8), con un mínimo de 16 y un máximo de 87 años, donde la mielofibrosis primaria se presentó a una edad más tardía del diagnóstico (valor de edad = 68.25 años) (Tabla 1). El diagnóstico más frecuente fue trombocitemia esencial con 20 pacientes (38.5%), seguido de mielofibrosis primaria con 16 pacientes (30.8%) y policitemia vera con 13 pacientes (25.0%). Sin embargo, 3 (5.8%) pacientes no pudieron clasificarse en uno de los diagnósticos y se clasificaron como neoplasias mieloproliferativas crónicas negativas para BCR-ABL1 no clasificables. Se encontraron diferencias significativas en el nivel de hemoglobina, nivel de hematocrito, hematocrito y recuento de plaquetas entre las tres neoplasias (p= <0.001). Los pacientes diagnosticados con policitemia vera tenían los niveles más altos de hemoglobina y hematocrito, los pacientes con trombocitemia esencial tenían el recuento de plaquetas más alto y los pacientes con mielofibrosis primaria tenían los niveles más bajos de hemoglobina (Tabla 1).
Tabla 1 Características demográficas y resultados hematológicos de pacientes con neoplasias mieloproliferativas crónicas BCR-ABL1 negativas según diagnóstico, sexo y edad
| Policitemia vera n= 13 | Trombocitopenia esencial n= 20 | Mielofibrosis primaria n= 16 | Neoplasias mieloproliferativas crónicas negativas para BCR-ABL1 no clasificables n= 3 | |
|---|---|---|---|---|
| N | 13 | 20 | 16 | 3 |
| Edad (media (DE)) | 52.92 (15.98) | 55.45 (16.12) | 68.25 (9.90) | 53.00 (21.38) |
| Mujeres (%) | 5 (38.5) | 13 (65.0) | 6 (37.5) | 1 (33.3) |
| Hombres (%) | 8 (30.0) | 7 (26.0) | 10 (37.0) | 2 (7.0) |
| Nivel de hemoglobina (g/dL) (mediana [QR]) | 17.80 [16.00, 20.00] | 12.90 [11.23, 13.70] | 11.50 [9.55, 13.45] | 14.50 [14.25, 14.75] |
| Nivel de hematocrito (%) (mediana [QR]) | 54.00 [50.00, 60.00] | 38.20 [33.45, 43.20] | 36.15 [28.50, 40.62] | 45.00 [45.00, 45.50] |
| Recuento de plaquetas (número de plaquetas/μL) (mediana [QR]) | 376000.00 [288250.00, 534750.00] | 792500.00 [503750.00, 1278000.00] | 159000.00 [71250.00, 255000.00] | 236000.00 [158500.00, 286000.00] |
| Recuento de plaquetas (número de plaquetas/μL) (mediana [QR]) | 8900.00 [7700.00, 10760.00] | 9300.00 [6730.00, 12435.00] | 7820.00 [4210.00, 10700.00] | 6327.00 [5848.50, 51963.50] |
| Recuento de linfocitos (número de linfocitos/μL) (mediana [QR]) | 2090.00 [1733.75, 2700.00] | 2231.00 [1504.70, 3050.00] | 1120.00 [876.50, 1852.00] | 2505.00 [2397.50, 2612.50] |
| Recuento de neutrófilos (número de neutrófilos/μL) (mediana [QR]) | 6130.00 [3846.25, 7360.00] | 5250.00 [3580.00, 7815.00] | 6710.00 [3752.50, 8612.00] | 3830.00 [3344.50, 11876.50] |
De los 52 pacientes analizados, el 51.9% tenía la mutación JAK2 V617F, el 85.0% policitemia vera, el 35.0% trombocitemia esencial, el 43.7% mielofibrosis primaria y el 67.0% neoplasias mieloproliferativas crónicas BCR-ABL1 negativas no clasificables. Además, se encontraron mutaciones en el exón 9 de CALR en el 35% de los pacientes con trombocitemia esencial y en el 31% de los pacientes con mielofibrosis primaria. Finalmente, la frecuencia de mutación del MPL fue del 12.5% de la mielofibrosis primaria. Además, en el grupo de pacientes diagnosticados de trombocitemia esencial se encontró un caso doble positivo para JAK2 V617F y CALR, contribuyendo doblemente a las frecuencias de estos genes (Tabla 2).
Tabla 2 Frecuencias de mutaciones en los tres genes analizados en pacientes con neoplasias mieloproliferativas crónicas BCR-ABL1 negativas
| Pacientes totales n=52 (%) | JAK2 | CALR | MPL | Triple Negative |
|---|---|---|---|---|
| Frecuencia total n= 52 (%) positivo n (%) | 27 (51.9) | 12 (23.0) | 2 (3.8) | 12 (23.0) |
| Frecuencia por enfermedad | ||||
| Policitemia vera n=13 (%) | 11 (21.1) | 0 | 0 | 2 (3.8) |
| Trombocitopenia esencia n=20 (%) | 7 (13.5) | 7 (13.5) | 0 | 7 (13.5) |
| Mielofibrosis primaria n=16 (%) | 7 (13.5) | 5 (9.6) | 2 (3.8) | 2 (3.8) |
| Neoplasias mieloproliferativas crónicas negativas para BCR-ABL1 no clasificables n=3 (%) | 2 (3.84) | 0 | 0 | 1 (1.9) |
Nota: se tiene un paciente doble positive para CARL y JAK2 y por esto el número de mutaciones es 53
Respecto a la mutación en el exón 10 de MPL, 2 pacientes presentaban la mutación W515K. De los 12 pacientes con mutaciones en CALR exón 9, 7 presentaron una deleción de 52 pb (mutación tipo I - c.1092_1143del; L367fs*46), 2 presentaron una inserción de 5 pb (mutación tipo II - c1154_1155ins- TTGTC; K385fs*47) y 2 tenían mutaciones tipo I "similares" (de 34 pb y 46 pb). En particular, un paciente tenía una triple mutación en el gen CALR: una deleción de 10p (NM_004343.4):c.1130_1139delAAGAGGAGGA); esta ubicación también tenía una inserción de 9 pb (NM_004343.4):c.1130_1131insGCCTCTGTC) y otra eliminación de 9 pb ((NM_004343.4) c.1177_1185delGAGGAUGAG)-(CALR:p.E398_D400del)).
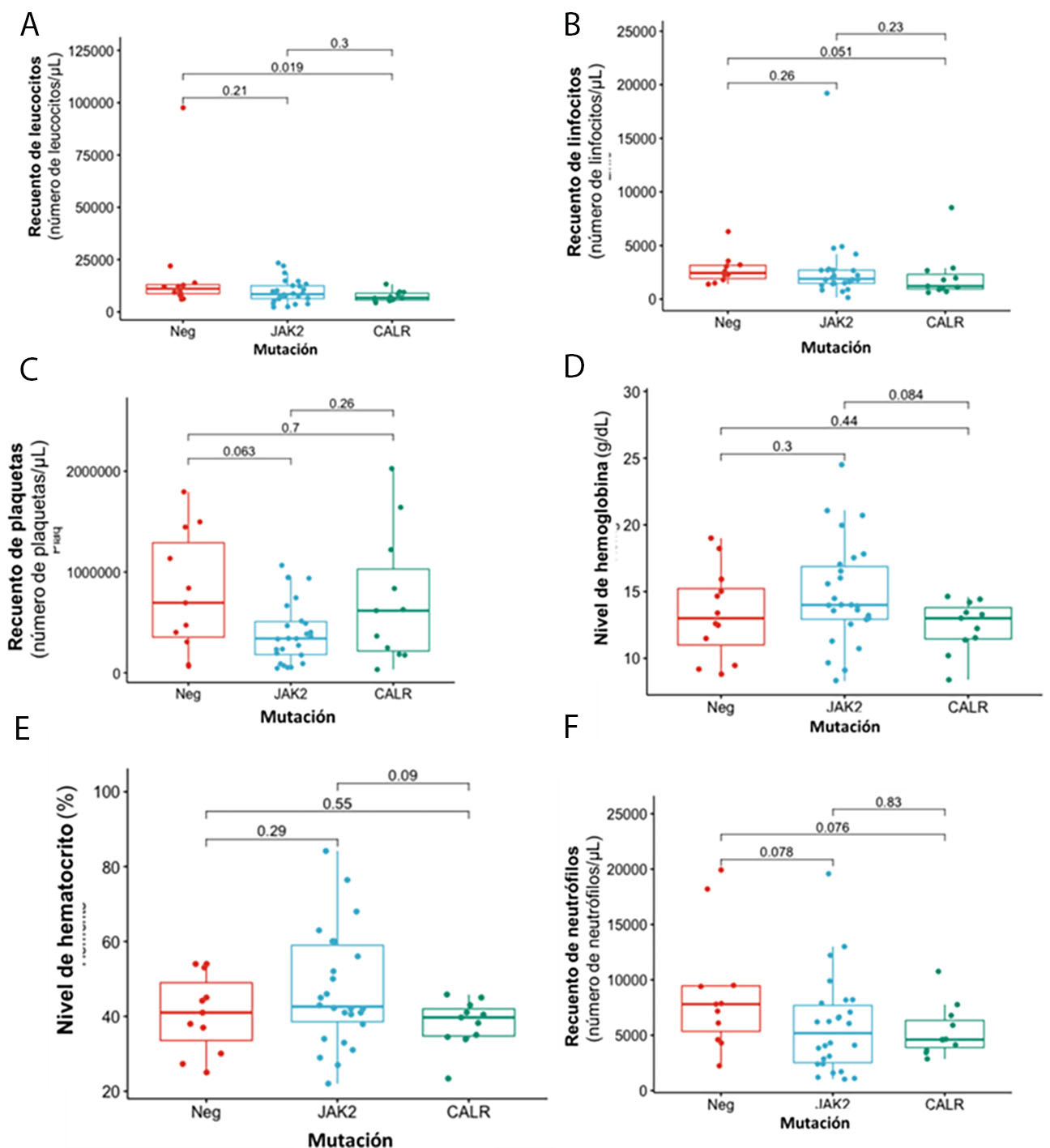
La Figura 2 describe las principales características clínicas y hematológicas de los pacientes con neoplasias mieloproliferativas crónicas negativas para BCR-ABL1 según JAK2, CALR y mutaciones triple negativas en estos genes. Los pacientes con una mutación en MPL fueron excluidos del análisis estadístico debido al pequeño tamaño de la muestra (dos pacientes). En cuanto a los resultados hematológicos, se encontró diferencia significativa entre pacientes triple negativos y aquellos con mutaciones en CALR en los recuentos de leucocitos (p= 0.019) y linfocitos (p= 0.051). Los pacientes positivos para mutaciones CALR tuvieron los recuentos más bajos para estas dos variables hematológicas (Figura 2A y B .). Aunque los pacientes con la mutación JAK2 tenían un recuento de plaquetas más bajo que aquellos con CALR y mutaciones triple negativas (Figura 2C ), tenían valores más altos de hemoglobina y hematocrito (Figura 2D y E ).
Discusión
El presente estudio evaluó las frecuencias de mutaciones en los genes JAK2, MPL y CALR en 52 pacientes colombianos. Hasta la fecha, este estudio es el primero en describir el perfil mutacional de estos tres genes en neoplasias mieloproliferativas crónicas BCR-ABL1 negativas en Colombia. Aunque el tamaño de la muestra fue pequeño, se obtuvieron frecuencias similares a las reportadas en otros estudios de poblaciones latinoamericanas, como los de Argentina y México (Tabla 3) 15,16. Estas similitudes probablemente se debieron a que las poblaciones comparten un trasfondo genético común con un origen triétnico: europeo, amerindio y africano.
Tabla 3 Comparación de las frecuencias de mutaciones en los genes JAK2, CALR y MPL en diferentes poblaciones
| JAK2 | CALR | MPL | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| País | N | PV (%) | ET (%) | PMF (%) | PV (%) | ET (%) | PMF (%) | PV (%) | ET (%) | PMF (%) | |
| 1 | OMS 10 | >95 | 50-60 | 50-60.0 | 0.0 | 30.0 | 24.0 | 0 | 3.0 | 8.0 | |
| 2 | Argentina 15 | 439 | 94.9 | 61.2 | 62.0 | 0.0 | 21.5 | 16.3 | 0 | 2.8 | 6.1 |
| 3 | Mexico 16 | 27 | 62.0 | 36.0 | 25.0 | 0.0 | 29.0 | 25.0 | 0 | 7.0 | 0 |
| 4 | South Korea 17 | 199 | 91.4 | 63.3 | 57.4 | 0.0 | 17.7 | 14.8 | 0 | 2.5 | 9.3 |
| 5 | USA 18 | 3023 | 100 | 61.0 | 67.0 | 0.0 | 15.0 | 3.0 | 0 | 13.3 | 6.0 |
| 6 | Japan 19 | 143 | 97.0 | 59.9 | 60.2 | 0.0 | 26.9 | 21.6 | 0 | 4.7 | 1.1 |
| 7 | Italy 20 | 1282 | NA | 62.0 | 62.0 | NA | 24.0 | 26.0 | NA | 4.0 | 5.0 |
| 8 | Brazil 21 | 73 | 100 | 37.0 | 62.0 | 0.0 | 41.0 | 33.0 | NA | NA | NA |
| 9 | Thailand 22 | 100 | 94.7 | 74.5 | 25.0 | NA | 35.7 | 33.3 | NA | 0 | 0 |
| 10 | China 23 | 492 | 61.5 | 40.4 | 44.2 | 0.0 | 27.9 | 15.4 | 0 | 1.3 | 0 |
| 11 | India 24 | 130 | 100 | 61.7 | 57.6 | 0.0 | 15.1 | 23.7 | 0 | 9.1 | 3.4 |
| 12 | Brazil 25 | 65 | NA | 52.0 | 52.0 | NA | 13.0 | 38.0 | NA | 4.0 | 0 |
| 13 | Egypt 26 | 200 | 48.9 | 44.1 | 32.5 | 0.0 | 19.1 | 17.5 | 0 | 0 | 0 |
| 14 | Este proyecto (Colombia) | 52 | 85.0 | 35.0 | 44.0 | 0.0 | 35.0 | 31.0 | 0 | 0 | 12.5 |
La caracterización genética de pacientes colombianos con neoplasias mieloproliferativas crónicas BCR-ABL1 negativas cuyo contexto genético es diferente al de otras poblaciones es fundamental para un diagnóstico certero, un buen pronóstico y un adecuado manejo y supervivencia del paciente. La mutación JAK2 V617F se asocia con un mayor riesgo de trombosis arterial y un menor riesgo de mielofibrosis postrombocitemia arterial. En la policitemia vera, una mayor frecuencia del alelo mutante JAK2V617F se ha asociado con prurito y transformación fibrótica. En general, la mutación JAK2V617F se asocia con edad avanzada, niveles más altos de hemoglobina, leucocitosis y niveles más bajos de plaquetas. Además, los pacientes con mutación positiva del exón 12 de JAK2 generalmente tienen mielopoyesis predominantemente eritroide, eritropoyetina sérica por debajo de lo normal y una edad más joven en el momento del diagnóstico, pero su pronóstico es similar al del exón 14 JAK2V617F 5. En la trombocitemia esencial, la mutación CALR se asocia con un nivel más bajo de hemoglobina, un recuento más alto de plaquetas, un recuento más bajo de glóbulos blancos y una edad más joven en comparación con la mutación JAK2V617F. Se han observado características similares en pacientes con mielofibrosis primaria. La mutación CALR también se asocia con el género masculino, un menor riesgo de trombosis y una mejor supervivencia general 8.
La mutación JAK2 V617F fue la más común entre las tres neoplasias evaluadas en nuestra cohorte, con frecuencias similares a las reportadas en otras poblaciones (15,16,19. Sin embargo, se observaron pocas diferencias en las frecuencias mutacionales dado que la mutación más común asociada con esta patología fue la mutación JAK2 V617F estudiada en este estudio 13. Esta mutación activa tres receptores principales: el receptor de eritropoyetina, el receptor del factor estimulante de colonias de granulocitos y MPL. Por este motivo, JAK2V617F se asocia con policitemia vera, trombocitemia esencial y mielofibrosis primaria 27. Sin embargo, la mutación MPL W515K se informó sólo en dos pacientes con mielofibrosis primaria. Esta mutación ocurre con baja frecuencia, principalmente en pacientes con ET o mielofibrosis primaria, lo que implica que puede favorecer la determinación del linaje megacariocítico en lugar del eritroide 28.
En este estudio, la frecuencia de mutaciones en el exón 9 de CALR fue del 35% tanto para la trombocitemia esencial como para la mielofibrosis primaria. Se encontraron frecuencias similares en diferentes estudios, como se informa en la Tabla 3. En particular, en pacientes diagnosticados con trombocitemia esencial, se encontró un caso doble positivo para JAK2 V617F y CALR. Recientemente, se informó la coexistencia de mutaciones CALR y JAK2V617F en algunos casos de neoplasias mieloproliferativas crónicas BCR-ABL1 negativas 29-35, así como mutaciones JAK2 V617F y MPL W515L/S 36. La coexistencia entre estos genes se produjo en el 5-15% de los casos de MPL. Estos hallazgos contrastan la hipótesis de que las mutaciones en JAK2, CALR y MPL son mutuamente excluyentes 10. Además, en este estudio se encontraron seis tipos de mutaciones en el exón 9 de CALR, principalmente deleciones; la más prevalente fue la mutación tipo I, seguida por la tipo II 33-35.
Cabe destacar que un paciente presentó tres mutaciones en el gen CALR: una deleción de 10 pb (NM_004343.4):c.1130_1139delAAGAGGAGGA); esta ubicación también tuvo una inserción de 9 pb (NM_004343.4):c.1130_1131insGCCTCTGTC) y otra eliminación de nueve pb en sentido descendente ((NM_004343.4) c.1177_1185delGAGGAUGAG)- (CALR:p.E398_D400del)). La deleción de diez pb se informó en la anemia refractaria como variante patogénica (COSV57120310), cambiando el marco de lectura al de las mutaciones CALR más frecuentes 37. La inserción de 9 pb en este punto no se ha informado hasta la fecha y representa un hallazgo sorprendente en este paciente. Finalmente, la tercera mutación es una deleción de nueve pb informada en un estudio de neoplasias mieloproliferativas. Esta variante está anotada como un polimorfismo de 9 pb (rs550353351; NM_004343.4: c.1177_1185del-GAGGATGAG) que elimina tres aminoácidos (NP_004334.1: p. Glu398_Asp400del) que desplaza el marco de lectura de +1 pb, lo que resulta en el reemplazo del extremo C-terminal normal por una nueva secuencia de aminoácidos 36. La gravedad de estas mutaciones podría explicar la falta de respuesta al tratamiento del paciente y su posterior muerte.
No pudimos comparar las características clínicas y hematológicas estratificadas por enfermedad y mutación, dado el pequeño tamaño de la muestra. Sin embargo, se realizó un análisis de las características clínicas y hematológicas por mutación en la población total de estudio. Los pacientes con mutaciones JAK2 tenían recuentos de plaquetas más bajos que aquellos con CALR y mutaciones triple negativas, hallazgos similares a los publicados en diferentes poblaciones, como las de Brasil y Tailandia. 22,25. Los pacientes con mutaciones en JAK2 también presentaron niveles elevados de hemoglobina y hematocrito, como lo reportan las guías de la OMS de 2017 y otros estudios 10,27,38. Sin embargo, los recuentos de leucocitos y linfocitos fueron más bajos en pacientes con mutaciones CALR que en pacientes triple negativos. Este resultado es consistente con varias poblaciones en América Latina, Corea e Italia y los informes de la OMS 10,15,17,33,34. Cabe destacar que los dos pacientes con mutaciones raras (doble positivo para JAK2 y CALR y triple mutación en CALR) tuvieron un diagnóstico de trombocitemia esencial y presentaron valores de hemoglobina y hematocrito bajos en comparación con los valores de referencia normales en este tipo de pacientes. El paciente con doble positivo para JAK2 y CALR también tenía un recuento bajo de glóbulos blancos. El diagnóstico de trombocitemia esencial en pacientes con mutaciones raras también ha sido reportado en otros estudios de diferentes poblaciones 31,35,39.
En cuanto a la relación entre características hematológicas y neoplasias, los pacientes con policitemia vera presentaron valores elevados de hemoglobina y hematocrito, hallazgo esperable en esta patología asociada a un fenotipo hematológico de eritrocitosis aislada por alteración predominante del linaje eritroide. Además, se observó hiperplasia variable de los linajes megacariocíticos/granulocíticos 9,10,27,40. Los pacientes con trombocitemia esencial presentaron un recuento elevado de plaquetas independientemente de su perfil mutacional, hallazgo que concuerda con lo reportado en las guías de la OMS 10,17,22,33,34. Otra característica de la trombocitemia esencial fue una mayor frecuencia de pacientes diagnosticados de sexo femenino (13 mujeres frente a siete hombres), hallazgo que también se ha informado en otros estudios 41-43. Finalmente, los pacientes con mielofibrosis primaria presentaron niveles bajos de hemoglobina, coincidiendo con otros hallazgos reportados en la literatura 4,18 y considerado un criterio diagnóstico menor en las guías de la OMS. 10.
Este estudio tiene una limitación en el tamaño de la muestra, lo que disminuye el poder para detectar asociaciones significativas y aumenta el riesgo de informar falsos positivos. Sin embargo, las variantes analizadas han sido reportadas previamente, lo que reduce sustancialmente el riesgo y aumenta la confiabilidad de los resultados. Por lo que se sugieren estudios futuros con un tamaño muestral mayor, como un estudio multicéntrico prospectivo para realizar un análisis genético completo y validar los resultados de nuestro estudio y la utilidad del pronóstico en pacientes colombianos con neoplasias mieloproliferativas crónicas BCR-ABL1 negativas.
Agradecimiento
Agradecemos a los pacientes que participaron voluntariamente. Este trabajo fue financiado por el centro de investigaciones de la Facultad de Medicina de la Universidad de Antioquia (CODI: CII-09, código IP 2016,13017) y la IPS Universitaria con la colaboración de los hospitales San Vicente Fundación y Pablo Tobón Uribe.
REFERENCIAS
1. Nann D, Fend F. Synoptic diagnostics of myeloproliferative neoplasms: Morphology and molecular genetics. Cancers. 2021;13(14):1-22. doi: 10.3390/cancers13143528 [ Links ]
2. Shallis RM, Zeidan AM, Wang R, Podoltsev NA. Epidemiology of the Philadelphia Chromosome-Negative Classical Myeloproliferative Neoplasms. Hematology/Oncology Clinics of North America. 2021;35(2):177-89. DOI: 10.1016/j.hoc.2020.11.005 [ Links ]
3. Abello V, Quintero G, Espinosa D, Solano MH, Casas CP, Saavedra D, et al. Descripción de las características clínicas de las neoplasias mieloproliferativas crónicas ( NMPC ) Description of the clinical characteristics of chronic myeloproliferative neoplasms ( MPNs ) First report of the colombian registry of MPNs. Acta Médica Colombiana. 2017;42(1):35-41. [ Links ]
4. Langabeer SE, Andrikovics H, Asp J, Bellosillo B, Carillo S, Haslam K, et al. Molecular diagnostics of myeloproliferative neoplasms. European J Haematol. 2015;95(4):270-9. DOI: 10.1111/ejh.12578 [ Links ]
5. Ferreira Cristina S, Polo B, Lacerda JF. Somatic Mutations in Philadelphia Chromosome-Negative Myeloproliferative Neoplasms. Seminars in Hematology. 2018;55(4):215-22. DOI: 10.1053/j.seminhematol.2018.04.005 [ Links ]
6. Araki M, Komatsu N. The role of calreticulin mutations in myeloproliferative neoplasms. International Journal of Hematology. 2020;111(2):200-5. DOI: 10.1007/s12185-019-02800-0 [ Links ]
7. Vainchenker W, Dusa A, Constantinescu SN. JAKs in pathology: Role of Janus kinases in hematopoietic malignancies and immunodeficiencies. Seminars in Cell and Developmental Biology. 2008;19(4):385-93. DOI: 10.1016/j.semcdb.2008.07.002 [ Links ]
8. Song J, Hussaini M, Zhang H, Shao H, Qin D, Zhang X, et al. Comparison of the Mutational Profiles of Primary Myelofibrosis, Polycythemia Vera, and Essential Thrombocytosis. American Journal of Clinical Pathology. 2017;147(5):444-52. DOI: 10.1093/ajcp/aqw222 [ Links ]
9. Tefferi A, Pardanani A. Myeloproliferative neoplasms: A contemporary review. JAMA Oncology. 2015;1(1):97-105. DOI: 10.1001/jamaoncol.2015.89 [ Links ]
10. Brown NA, Elenitoba-Johnson KSJ. Update from the 4th Edition of the World Health Organization Classification of Head and Neck Tumours: Hematolymphoid Tumours. Head and Neck Pathology. 2017;11(1):96-109. DOI: 10.1007/s12105-017-0802-5 [ Links ]
11. Furtado LV, Weigelin HC, Elenitoba-Johnson KSJ, Betz BL. A Multiplexed fragment analysis-based assay for detection of JAK2 exon 12 mutations. Journal of Molecular Diagnostics. 2013;15(5):592-9. DOI: 10.1016/j.jmoldx.2013.04.006 [ Links ]
12. Jones AV, Ward D, Lyon M, Leung W, Callaway A, Chase A, et al. Evaluation of methods to detect CALR mutations in myeloproliferative neoplasms. Leukemia Research. 2015;39(1):82-7. DOI: 10.1016/j.leukres.2014.11.019 [ Links ]
13. Klampfl T, Gisslinger H, Harutyunyan AS, Nivarthi H, Rumi E, Milosevic JD, et al. Somatic Mutations of Calreticulin in Myeloproliferative Neoplasms. New England Journal of Medicine. 2013;369(25):2379-90. DOI: 10.1056/NEJMoa1311347 [ Links ]
14. R Core Team (2017). R: A language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria. https://www.R-project.org/. [ Links ]
15. Ojeda MJ, Bragós IM, Calvo KL, Williams GM, Carbonell MM, Pratti AF. CALR, JAK2 and MPL mutation status in Argentinean patients with BCR-ABL1- negative myeloproliferative neoplasms. Hematology. 2018;23(4):208-11. DOI: 10.1080/10245332.2017.1385891 [ Links ]
16. Labastida-Mercado N, Galindo-Becerra S, Garcés-Eisele J, Colunga-Pedraza P, Guzman-Olvera V, Reyes-Nuñez V, et al. The mutation profile of JAK2, MPL and CALR in Mexican patients with Philadelphia chromosome-negative myeloproliferative neoplasms. Hematology/ Oncology and Stem Cell Therapy. 2015;8(1):16-21. DOI: 10.1016/j.hemonc.2014.12.002 [ Links ]
17. Kim SY, Im K, Park SN, Kwon J, Kim JA, Lee DS. CALR, JAK2, and MPL mutation profiles in patients with four different subtypes of myeloproliferative neoplasms: Primary myelofibrosis, essential thrombocythemia, polycythemia vera, and myeloproliferative neoplasm, unclassifiable. American Journal of Clinical Pathology. 2015;143(5):635-44. doi: 10.30699/IJP.2021.136458.2495 [ Links ]
18. Szuber N, Mudireddy M, Nicolosi M, Penna D, Vallapureddy R, Lasho TL, et al. 3,023 Mayo Clinic Patients with Myeloproliferative Neoplasms: Risk-Stratified Comparison of Survival and Outcomes Data Among Disease Subgroups. Blood. 2018;132(Supplement 1):3035-3035. DOI: 10.1016/j.mayocp.2018.08.022 [ Links ]
19. Misawa K, Yasuda H, Araki M, Ochiai T, Morishita S, Shirane S, et al. Mutational subtypes of JAK2 and CALR correlate with different clinical features in Japanese patients with myeloproliferative neoplasms. International Journal of Hematology. 2018;107(6):673-80. DOI: 10.1007/s12185-018-2421-7 [ Links ]
20. Pietra D, Rumi E, Ferretti V V., Di Buduo CA, Milanesi C, Cavalloni C, et al. Differential clinical effects of different mutation subtypes in CALR-mutant myeloproliferative neoplasms. Leukemia. 2016;30(2):431-8. DOI: 10.1038/leu.2015.277 [ Links ]
21. Machado-Neto JA, de Melo Campos P, de Albuquerque DM, Costa FF, Lorand-Metze I, Olalla Saad ST, et al. Somatic mutations of calreticulin in a Brazilian cohort of patients with myeloproliferative neoplasms. Revista Brasileira de Hematologia e Hemoterapia. 2015;37(3):211-4. DOI: 10.1016/j.bjhh.2015.03.012 [ Links ]
22. Singdong R, Siriboonpiputtana T, Chareonsirisuthigul T, Kongruang A, Limsuwanachot N, Sirirat T, et al. Characterization and Prognosis Significance of JAK2 (V617F), MPL, and CALR Mutations in Philadelphia-Negative Myeloproliferative Neoplasms. Asian Pacific Journal of Cancer Prevention. 2016;17(10):4647-53. doi: 10.22034/APJCP.2016.17.10.4647 [ Links ]
23. Lang T, Nie Y, Wang Z, Huang Q, An L, Wang Y, et al. Correlation analysis between JAK2, MPL, and CALR mutations in patients with myeloproliferative neoplasms of Chinese Uygur and Han nationality and their clinical characteristics. Journal of International Medical Research. 2018;46(11):4650-9. doi: 10.1177/0300060518787719 [ Links ]
24. Rabade N, Subramanian PG, Kodgule R, Raval G, Joshi S, Chaudhary S, et al. Molecular genetics of BCR-ABL1 negative myeloproliferative neoplasms in India. Indian Journal of Pathology and Microbiology. 2018;61(2):209-13. DOI: 10.4103/IJPM.IJPM_223_17 [ Links ]
25. Nunes DPT, de Lima LT, Chauffaille M de L, Mitne-Neto M, dos Santos MT, Cliquet MG, et al. CALR mutations screening in wild type JAK2V617F and MPLW515K/L Brazilian myeloproliferative neoplasm patients. Blood Cells, Molecules, and Diseases. 2015;55(3):236-40. DOI: 10.1016/j.bcmd.2015.07.005 [ Links ]
26. Soliman EA, El-Ghlban S, El-Aziz SA, Abdelaleem A, Shamaa S, Abdel-Ghaffar H. JAK2, CALR, and MPL Mutations in Egyptian Patients With Classic Philadelphia-negative Myeloproliferative Neoplasms. Clinical Lymphoma, Myeloma and Leukemia. 2020;20(10):e645-51. DOI: 10.1016/j.clml.2020.05.011 [ Links ]
27. Vainchenker W, Kralovics R. Genetic basis and molecular pathophysiology of classical myeloproliferative neoplasms. Blood. 2017;129(6):667-79. DOI: 10.1182/blood-2016-10-695940 [ Links ]
28. Pardanani AD, Levine RL, Lasho T, Pikman Y, Mesa RA, Wadleigh M, et al. MPL515 mutations in myeloproliferative and other myeloid disorders: A study of 1182 patients. Blood. 2006;108(10):3472-6. DOI: 10.1182/blood-2006-04-018879 [ Links ]
29. Lundberg P, Karow A, Nienhold R, Looser R, Hao-Shen H, Nissen I, et al. Clonal evolution and clinical correlates of somatic mutations in myeloproliferative neoplasms. Blood. 2014;123(14):2220-8. DOI: 10.1182/blood-2013-11-537167 [ Links ]
30. Mcgaffin G, Harper K, Stirling D, Mclintock L. JAK2 V617F and CALR mutations are not mutually exclusive; findings from retrospective analysis of a small patient cohort. British Journal of Haematology. 2014;167(2):276-8. DOI: 10.1111/bjh.12969 [ Links ]
31. Jeong JH, Lee HT, Seo JY, Seo YH, Kim KH, Kim MJ, et al. Screening PCR versus sanger sequencing: Detection of CALR mutations in patients with thrombocytosis. Annals of Laboratory Medicine. 2016;36(4):291-9. DOI: 10.3343/alm.2016.36.4.291 [ Links ]
32. Chen CC, Gau JP, Chou HJ, You JY, Huang CE, Chen YY, et al. Frequencies, clinical characteristics, and outcome of somatic CALR mutations in JAK2-unmutated essential thrombocythemia. Annals of Hematology. 2014;93(12):2029-36. DOI: 10.1007/s00277-014-2151-8 [ Links ]
33. Tefferi A, Lasho TL, Finke CM, Knudson RA, Ketterling R, Hanson CH, et al. CALR vs JAK2 vs MPL-mutated or triple-negative myelofibrosis: Clinical, cytogenetic and molecular comparisons. Leukemia. 2014;28(7):1472-7. DOI: 10.1038/leu.2014.3 [ Links ]
34. Tefferi A, Wassie EA, Guglielmelli P, Gangat N, Belachew AA, Lasho TL, et al. Type 1 versus Type 2 calreticulin mutations in essential thrombocythemia: A collaborative study of 1027 patients. American Journal of Hematology. 2014;89(8):121-4. DOI: 10.1002/ajh.23743 [ Links ]
35. Shirane S, Araki M, Morishita S, Edahiro Y, Takei H, Yoo Y, et al. JAK2, CALR, and MPL mutation spectrum in Japanese patients with myeloproliferative neoplasms. Haematologica. 2015; 100(2): e46-8. doi: 10.3324/haematol.2014.115113 [ Links ]
36. Murugesan G, Guenther-Johnson J, Mularo F, Cook JR, Daly TM. Validation of a molecular diagnostic assay for CALR exon 9 indels in myeloproliferative neoplasms: Identification of coexisting JAK2 and CALR mutations and a novel 9 bp deletion in CALR. International Journal of Laboratory Hematology. 2016;38(3):284-97. DOI: 10.1111/ijlh.12484 [ Links ]
37. Broséus J, Lippert E, Harutyunyan AS, Jeromin S, Zipperer E, Florensa L, et al. Low rate of calreticulin mutations in refractory anaemia with ring sideroblasts and marked thrombocytosis. Leukemia. 2014;28(6):1374-6. DOI: 10.1038/leu.2014.49 [ Links ]
38. Cazzola M, Kralovics R. From Janus kinase 2 to calreticulin: The clinically relevant genomic landscape of myeloproliferative neoplasms. Blood. 2014;123(24):3714-9. DOI: 10.1182/blood-2014-03-530865 [ Links ]
39. Kang MG, Choi HW, Lee JH, Choi YJ, Choi HJ, Shin JH, et al. Coexistence of JAK2 and CALR mutations and their clinical implications in patients with essential thrombocythemia. Oncotarget. 2016;7(35):57036-49. doi: 10.18632/oncotarget.10958 [ Links ]
40. Barbui T, Finazzi G, Carobbio A, Thiele J, Passamonti F, Rumi E, et al. Development and validation of an International Prognostic Score of thrombosis in World Health Organization-essential thrombocythemia (IPSET-thrombosis). Blood. 2012;120(26):5128-33. DOI: 10.1182/blood-2012-07-444067 [ Links ]
41. Barbui T, Thiele J, Passamonti F, Rumi E, Boveri E, Ruggeri M, et al. Survival and disease progression in essential thrombocythemia are significantly influenced by accurate morphologic diagnosis: A international study. Journal of Clinical Oncology. 2011;29(23):3179-84. DOI: 10.1200/JCO.2010.34.5298 [ Links ]
42. Tefferi A, Vainchenker W. Myeloproliferative neoplasms: Molecular pathophysiology, essential clinical understanding, and treatment strategies. Journal of Clinical Oncology. 2011;29(5):573-82. DOI: 10.1200/JCO.2010.29.8711 [ Links ]
43. Thiele J, Kvasnicka HM, Müllauer L, Buxhofer-Ausch V, Gisslinger B, Gisslinger H. Essential thrombocythemia versus early primary myelofibrosis: A multicenter study to validate the WHO classification. Blood. 2011;117(21):5710-8. DOI: 10.1182/blood-2010-07-293761 [ Links ]
Recibido: 14 de Julio de 2022; Aprobado: 25 de Abril de 2023; Aprobado: 08 de Septiembre de 2023











 texto en
texto en