Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Biosalud
Print version ISSN 1657-9550
Biosalud vol.8 no.1 Manizales Jan./Dec. 2009
ENSAYO PRELIMINAR SOBRE LOS EFECTOS EN EL HEMOGRAMA DE LOS EXTRACTOS ACUOSO Y METANÓLICO DE PHENAX RUGOSUS (POIR.) WEDD Y TABEBUIA CHRYSANTHA G. NICHOLSON
PRELIMINARY TEST ON THE EFFECTS ON THE HEMATOLOGIC PARAMETERS OF THE AQUEOUS AND METHANOLIC EXTRACTS OF PHENAX RUGOSUS (POIR.) WEDD AND TABEBUIA CHRYSANTHA G. NICHOLSON
Jorge Enrique Pérez Cárdenas1, Gustavo Isaza Mejía1, Sandra Milena Acosta Agudelo2 y Juan Carlos Sepúlveda Arias3
1 Profesores, Departamento de Ciencias Básicas para la Salud, Facultad de Ciencias para la Salud, Universidad de Caldas.
2 Joven investigadora de Colciencias. Departamento de Ciencias Básicas para la Salud, Facultad de Ciencias para la Salud, Universidad de Caldas.
3 Profesor Asistente, Departamento de Ciencias Básicas, Facultad de Ciencias de la Salud, Universidad Tecnológica de Pereira.
Recibido: agosto 31 de 2009 - Aceptado: septiembre 18 de 2009
RESUMEN
Con el fin de validar los hallazgos obtenidos previamente en estudios etnofarmacológicos, se evaluaron los efectos en el hemograma de ratas hembras Wistar de los extractos acuoso y metanólico de las hojas de Phenax rugosus (Poir.) Wedd y Tabebuia chrysantha G. Nicholson, luego de su administración por vía oral durante 10 días consecutivos. Excepto para el recuento de eosinófilos con el extracto acuoso de P. rugosus, no hubo ningún cambio estadísticamente significativo en los demás valores del hemograma tras la administración de extractos acuoso y metanólico. El número de eosinófilos disminuyó a niveles con significancia estadística (p=0,03) cuando se compara el grupo que recibió el extracto acuoso con el grupo control. La administración de los extractos de Tabebuia chrysantha G. Nicholson, no indujo cambios en los diferentes parámetros del hemograma que tuvieran significancia estadística.
PALABRAS CLAVE: Tabebuia chrysantha, Phenax rugosus, extracto metanólico, extracto acuoso, hemograma, productos naturales.
ABSTRACT
In order to validate previous findings in ethnopharmacological studies, the effects on the hemogram of Wistar female rats after the oral administration of aqueous and methanolic extracts from Phenax rugosus (Poir.) Wedd and Tabebuia chrysantha G. Nicholson leaves were evaluated for 10 days. Except for the eosinophils count with the aqueous extract of Phenax rugosus (Poir.) Wedd, no significant changes in the hemogram were observed after the administration of aqueous and methanolic extracts. The absolute number of eosinophils diminished to statistically significant levels (p=0.03) when comparing the group that received the aqueous extract and the control group. The administration of both extracts from Tabebuia chrysantha G. Nicholson does not induce significant changes in the hemogram.
KEY WORDS: Tabebuia chrysantha, Phenax rugosus, methanolic extracts, aqueous extracts, hemogram, natural products.
INTRODUCCIÓN
El desarrollo de fármacos que modulan la respuesta inmune se está empleando cada vez más en el tratamiento de muchas enfermedades como las infecciosas, autoinmunes y cáncer. Entre ellos encontramos las citoquinas, de las cuales se usan actualmente en la clínica las interleuquinas, los interferones, los factores estimulantes de colonias (CSF) y el factor de necrosis tumoral (TNF). Entre los interferones tienen amplia utilización el alfa, beta y gama; entre los CSF se usan la interleuquina 3, y la 7, el CSF para granulocitos, el CSF para monocitos o ambos. (1, 2) Dos productos sintéticos -metisoprinol y levamisol-se usan ocasionalmente como inmunoestimulantes. Estos medicamentos -la mayoría obtenidos mediante procesos biotecnológicos- son costosos, y sus reacciones adversas y toxicidad (RAM) son frecuentes. Poco progreso se ha obtenido en el desarrollo de fármacos inmunoestimulantes de origen sintético, comparado con el desarrollo de inmunosupresores, entre los cuales se encuentran agentes tan eficaces como: ciclosporina, tacrolimus, sirolimus, everolimus y el micofenolato (1-3). Por ello se están investigando otras fuentes de obtención a partir de material vegetal.
Entre algunas de las plantas investigadas que tienen efectos inmunomoduladores se encuentran las hojas de Gualanday (Jacaranda caucana Pittier, de la familia Bignoniaceae Juss) que se usan como antiséptico; el Geranio (Pelargonium sidoides DC), cuyas raíces se emplean como inmunomodulador coadyuvante en el tratamiento de las infecciones agudas y crónicas de las vías respiratorias; y la Equinacea [Echinacea purpurea (L.) Moench.], cuyas raíces se usan como coadyuvantes en el tratamiento del resfriado común. Estas tres especies son las únicas aceptadas oficialmente por el Invima -Instituto Nacional de Vigilancia de Medicamentos y Alimentos- como inmunomoduladores (5). Las dos últimas tienen evidencia experimental y clínica de sus efectos inmunoestimulantes (4, 6).
Otras plantas que se han investigado en diversas partes del mundo, pero que en nuestro medio no se encuentran aún registradas para uso médico como inmunomoduladoras, son: Aloe vera L. ex. Webb, Morinda citrifolia L. (frutos del Noni), Epimedium hunanense Hand.-Mazz, Boerhaavia diffusa Kuntze, Alsophila spinulosa (Wall. ex Hook.) R.M. Tryon, Tinospora cordifolia (Willd.) Miers, Withania somnifera (L.) Dunal, Woodfordia fruticosa (L.) Kurz, Physalis angulata L., Dichrocephala bicolor (Roth) Schltdl, Urtica dioica L., Curcuma longa L., Rudbeckia bicolor Nutt., Larrea divaricada Cav., y muchas especies vegetales más (7-9). Sin embargo, varios estudios multicéntricos en busca de evidencia que sustenten su eficacia, indican que se necesitan estudios clínicos adicionales para poder definir un uso terapéutico específico. Entre los muchos ejemplos se puede citar el caso de los frutos del Noni (M. citrifolia L.), la uña de gato [Uncaria tomentosa (Willd. ex Roem. & Schult.) DC], algunas plantas medicinales de la China y decenas de especies que empíricamente se han usado para tratar la infección por VIH.
Varias de estas plantas han mostrado actividad antiretroviral in vivo pero se requieren muchos estudios para evidenciar su eficacia y seguridad en el humano (10-12).
En la región del Eje Cafetero de Colombia, existe una amplia variedad de plantas autóctonas que hacen parte del armamentario farmacológico para el tratamiento de enfermedades infecciosas o de enfermedades metabólicas. Estudios etnofarmacológicos realizados por nuestro grupo de investigación en personas del área rural y urbana, y en herbolarios de diferentes municipios del Eje Cafetero, han permitido identificar las plantas más utilizadas como antimicrobianos o estimulantes del sistema inmune (13, 14).
Las hojas de T. chrysantha se han empleado en la zona cafetera como antiinfeccioso, y nuestros estudios preliminares han mostrado que los extractos obtenidos de las hojas de esta planta pueden tener un efecto sobre la respuesta inmune al incrementar in vivo en ratas Wistar los niveles de anticuerpos dirigidos contra glóbulos rojos de carnero (15); estudios realizados en otras especies de este género como en T. avellanedae Lorentz ex Griseb. [también denominada como T. rosea (Bertol.) A. DC. o T. impetiginosa (Mart. ex DC) Standl], han demostrado diferentes efectos sobre la respuesta inmune al utilizar extractos obtenidos a partir de la corteza interna del tallo. En estos extractos se han identificado los ciclopentanos, que poseen efecto antiinflamatorio sobre los neutrófilos (16); así como también el lapachol y las naftofurandionas obtenidos de extractos metanólicos y clorofómicos de cortezas y tallos (17). Los extractos acuosos mas no los metanólicos, son capaces de inhibir los linfocitos T luego de ser estimulados con anti CD3. Este efecto se ha asociado con la inhibición en la expresión de CD25 y CD71 en la superficie de estas células, pero no se modifica la secreción de citoquinas tales como TNF-alfa e IL-2 (7), lo anterior demuestra que su efecto antiinflamatorio no depende de la inhibición en la producción de estas citoquinas.
La beta lapachona es una molécula inhibidora de ADN topoisomerasas y por tal razón se asocia con la apoptosis celular induciendo de esta manera una modulación de la respuesta inmune (18). Adicionalmente, los extractos metanólicos poseen actividad inhibitoria sobre la liberación del ácido araquidónico y disminuyen la proliferación de células del músculo liso vascular no asociada con un incremento en la toxicidad del extracto sobre las células, pero sí asociada con la inhibición de kinasas intracelulares tales como ERK 1/2 (19). También se ha demostrado un efecto mieloprotector de los extractos hidrofílicos de esta planta en ratones con tumores ascíticos de Ehrlich (20).
Phenax rugosus (Poir.) Wedd, es una planta perteneciente a la familia Urticaceae; no hay reportes en la literatura sobre su actividad inmunoestimulante o inmunosupresora (13-15, 21).
En la presente investigación se describen los efectos de los extractos acuoso y metanólico de Phenax rugosus (Poir.) Wedd y Tabebuia chrysantha G. Nicholson sobre el hemograma de ratas Wistar.
MATERIALES Y MÉTODOS
Materiales vegetales
Las hojas de Phenax rugosus (Poir.) Wedd, se recolectaron en la vereda El Guayabo, municipio de Cartago (Valle del Cauca, Colombia), a 1400 msnm y 22°C de temperatura promedio; y Tabebuia ghrysantha G. Nicholson, fue recolectada en la vereda Santágueda, municipio de Palestina (Caldas, Colombia), a 1800 msnm y a una temperatura promedio de 20°C. Ambas especies fueron identificadas y clasificadas en el herbario de la Facultad de Ciencias Agropecuarias de la Universidad de Caldas y debidamente comparadas con las muestras de referencia 1016 para la Phenax rugosus (Poir.) Wedd y 1525 para Tabebuia chrysantha G. Nicholson.
Preparación de los extractos
Las hojas se lavaron con abundante agua destilada, se secaron a una temperatura de 40°C durante 48 horas, se molieron y almacenaron a -4°C hasta el momento de ser empleadas.
Las muestras vegetales fueron sometidas a un proceso de maceración en frío con metanol y agua. Se obtuvieron 2 extractos, metanólico y acuoso de las especies objeto de estudio; el extracto metanólico se conservó en estado seco a -4ºC y el acuoso fue liofilizado (22).
Animales de experimentación y tratamiento
Se emplearon ratas Wistar hembras con un peso promedio de 200 g, provenientes del bioterio de la Universidad de Caldas; recibieron alimento especial para roedores y agua ad libitum, con una temperatura promedio de 18°C y con una luminosidad diaria de 12 horas. Los animales fueron mantenidos en cajas plásticas trasparentes.
Se trabajó con 36 animales asignados a tres grupos experimentales, conformados por 6 animales cada uno, distribuidos de la siguiente manera: para evaluar los extractos de Phenax rugosus (Poir.) Wedd, un grupo control; un segundo grupo al que se le administró extracto acuoso; y un tercer grupo al que se le administró extracto metanólico. De igual manera se evaluaron los extractos de Tabebuia chrysantha G. Nicholson.
Los extractos se administraron diariamente en ayunas mediante sonda orogástrica (23) durante 10 días consecutivos a una dosis de 1g/kg de peso, empleando como vehículo una mezcla de glicerina, propilenglicol, solución salina normal, tween 20 en proporción 10:10:10:70. A los animales control se les proporcionó un volumen equivalente del vehículo en las mismas condiciones que los grupos a los que se les administró el extracto. Dicho esquema experimental se repitió tres veces para cada uno de los extractos obtenidos.
Los animales se manejaron bajo los condicionamientos éticos de los Derechos Internacionales de los Animales aprobados por la ONU y la UNESCO (24), las pautas aprobadas por el Ministerio de Salud (25), el Instituto de Biotecnología de la Universidad Nacional de Colombia (26), y el visto bueno del Comité de Ética de la Facultad de Ciencias para la Salud (Universidad de Caldas).
Análisis hematológicos
Las muestras para los estudios hematológicos se obtuvieron del seno venoso orbitario bajo sedación con éter etílico (23). Se analizaron las muestras obtenidas el día 0 y el día 16 del experimento utilizando un analizador para hemogramas marca ADVIA (Roche), a partir del cual se obtuvieron todos los resultados excepto el recuento diferencial de leucocitos que se hizo visualmente por la realización de un extendido de sangre coloreado con Wright.
Análisis estadístico
Se analizaron los datos mediante prueba estadística de ANOVA de dos colas, seguida del test de Tukey y el t de Student para pruebas pareadas de dos colas, con el software GraphPad Instat, versión 3.06 para Windows 95 (San Diego California, USA).
RESULTADOS
Resultados obtenidos con los extractos de Phenax rugosus (Poir.) Wedd
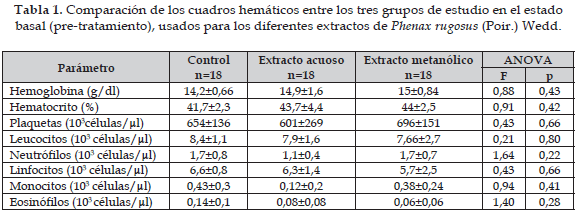
En la Tabla 1 se muestra el promedio de los valores basales del hemograma del grupo control y de los dos grupos que posteriormente recibieron los extractos de ambas plantas (valores pre-tratamiento). Se observa que los tres grupos tenían valores muy uniformes, pues en ninguno de los datos se observó diferencias estadísticamente significativas.
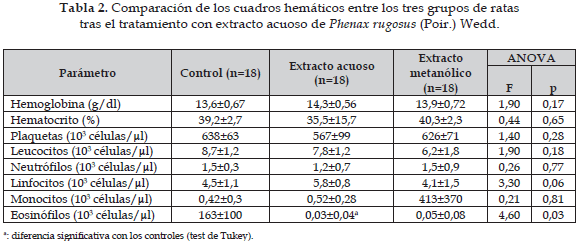
La Tabla 2 muestra que, exceptuando el conteo de eosinófilos tras la administración del extracto acuoso de P. rugosus (Poir.) Wedd, ninguno de los otros valores del cuadro hemático sufrió variaciones que tuvieran significancia estadística con respecto a las cifras obtenidas en el grupo control.
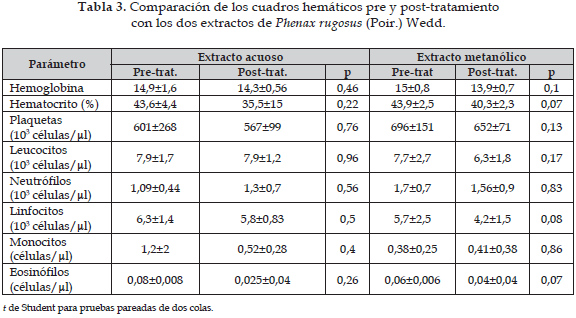
En la Tabla 3, se compara los efectos de los extractos acuoso y metanólico de Phenax rugosus (Poir.) Wedd con el grupo control (pretratamiento); no se observó ningún cambio estadísticamente significativo en los distintos ensayos realizados.
Resultados obtenidos con los extractos de Tabebuia chrysantha G. Nicholson
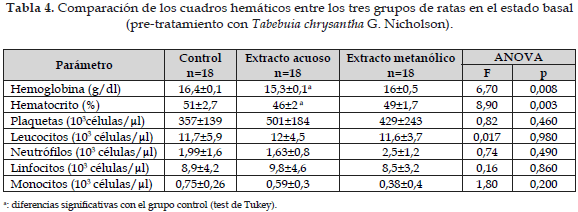
En la Tabla 4 aparece el promedio de los valores basales del cuadro hemático del grupo control y de los dos grupos que posteriormente recibieron los extractos acuoso y metanólico de Tabebuia chrysantha G. Nicholson (valores pretratamiento). Se observa que los tres grupos tenían valores muy uniformes, excepto en la hemoglobina y el hematocrito del grupo que recibiría posteriormente extracto acuoso de Tabebuia chrysantha G. Nicholson.
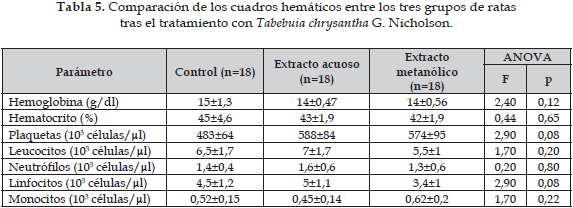
La administración de los extractos acuoso y metanólico de Tabebuia chrysantha G. Nicholson no mostró efectos estadísticamente significativos en ninguno de los valores del hemograma (Tabla 5).
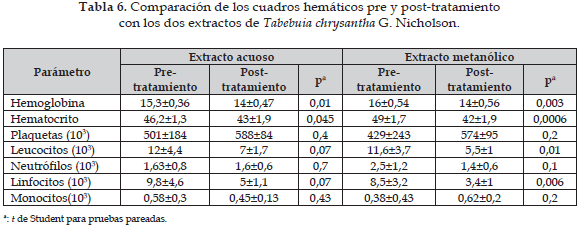
La Tabla 6 muestra que el extracto acuoso de Tabebuia chrysantha G. Nicholson disminuye los niveles de hemoglobina y los valores del hematocrito, ambos descensos son estadísticamente significativos (p=0,01 y p=0,045, respectivamente). Para este extracto los demás valores no muestran cambios estadísticamente significativos. El extracto metanólico de esta planta indujo también la disminución de los valores de la hemoglobina y el hematocrito, con significancia estadística (p=0,003 y p=0,0006, respectivamente). Igualmente, el recuento de leucocitos y linfocitos disminuyó de manera estadísticamente significante luego del tratamiento con los extractos acuoso y metanólico.
DISCUSIÓN
En la presente investigación el extracto acuoso de Phenax rugosus (Poir.) Wedd produjo cambios estadísticamente significativos en el recuento de eosinófilos (p=0,03). Este hallazgo puede indicar un efecto antinflamatorio, si se tiene en cuenta que estas células son importantes mediadoras de la inflamación, principalmente en infecciones por helmintos y en procesos alérgicos (27). De esta manera el extracto acuoso de esta planta podría tener metabolitos secundarios que servirían para este propósito; otra interpretación posible de este resultado es que algunos de estos metabolitos tienen un efecto selectivo sobre la médula ósea para la generación y maduración de eosinófilos; este efecto podría estar relacionado con la producción de diferentes citoquinas tales como la IL-3, la CSF-GM y la IL-5, en donde las dos primeras estarían relacionadas con el cambio de la célula madre hacia el linaje mieloide, mientras que la IL-5 tiene la capacidad de generar precursores que producen eosinófilos y favorece su liberación a sangre periférica (28). Se podría especular entonces una acción del extracto sobre la IL-5 en la generación de eosinófilos ya que las otras líneas de la serie mieloide, es decir los monocitos, los neutrófilos, las plaquetas y los basófilos no mostraron alteración.
Este efecto no sólo podría circunscribirse a la producción de eosinófilos sino también a su movilización donde la inhibición de quimioquinas tales como la eotaxina (29), podrían influir en esta disminución significativa del número absoluto de los eosinófilos.
En la Tabla 3 se observa una caída de los valores de linfocitos al comparar los valores pre-tratamiento y post-tratamiento del extracto metanólico de Phenax rugosus (Poir.) Wedd, este comportamiento no presentó diferencias estadísticamente significativas, sin embargo podría estar evidenciando la presencia de compuestos semejantes a furano naftoquinonas (16) o a la bromelaina (32) que han mostrado tener efectos antiinflamatorios o regulatorios de los linfocitos T. Estos hallazgos requieren de estudios con fracciones de los extractos que permitan detectar aquel compuesto que en una concentración mayor produzca un efecto sobre la médula ósea induciendo linfopenia ya sea directamente, lo cual podría estar indicando un efecto tóxico o indirectamente mediante la inhibición de linfoquinas o quimioquinas.
Una investigación anterior a nuestro grupo, utilizando extractos hidroalcohólicos (50:50) de Phenax rugosus (Poir.) Wedd (15), reportó un aumento estadísticamente significativo en el recuento de leucocitos, linfocitos, eosinófilos y basófilos; este resultado es en gran medida diferente al obtenido en este estudio ya que la naturaleza de los extractos es similar y la metodología de obtención también; es posible que la combinación agua y alcohol a 90º favorezca la extracción de otros compuestos que tengan un efecto contrario sobre el recuento celular con una consecuente potenciación de la respuesta inmune. Ante esta discrepancia de resultados, es necesario entonces, validar los resultados obtenidos con todos los extractos de Phenax rugosus (Poir.) Wedd para posteriormente determinar cuál es el efecto de dicha planta y cuáles son sus potenciales usos de acuerdo a los resultados obtenidos.
Con respecto a Tabebuia chrysantha G. Nicholson, los valores de hemoglobina y hematocrito que difieren de los valores del grupo control -como aparece en la Tabla 4- y que son los del grupo pre-tratamiento, están dentro de valores normales para esta especie animal, por lo que se puede inferir que los grupos destinados a recibir los extractos acuoso y metanólico, eran grupos homogéneos en sus parámetros hematológicos. Cuando se comparan los tres grupos entre sí, según la prueba de Tukey, como aparece en la Tabla 5, no hay diferencias estadísticamente significativas entre ellos. La comparación de los valores de cada uno de los tres grupos con los valores del grupo pre-tratamiento, según la prueba de t de Students, muestra diferencias significativas en la hemoglobina y el hematocrito tanto en el extracto acuoso como en el metanólico; este fenómeno puede explicarse por el hecho de que al hacerse el procedimiento de extracción de la sangre hubo dificultad en obtener una buena hemostasia en algunos de los animales, por lo tanto, este resultado no se puede atribuir a los efectos del extracto de dicha planta.
Adicionalmente, se observa una disminución de los leucocitos y los linfocitos, encontrándose significancia estadística en los extractos metanólicos (p=0,01 y p=0,006, respectivamente); algunas investigaciones han demostrado el efecto de extractos acuoso y metanólico de Tabebuia impetiginosa sobre la respuesta inmune considerándose este efecto como antiinflamatorio donde compuestos del tipo ciclopentanos di aldehidos, furanonaftoquinonas, ácido benzoico, derivados del benzaldehido, el lapacol y las naftofurano dionas obtenidos de la corteza interna del tallo de dicha planta pueden ser responsables de este efecto (16, 17).
Otros estudios han demostrado la capacidad que tienen los extractos acuosos de T. avellanedae en la inhibición de la proliferación celular de los cultivos de linfocitos luego de estimulación de los mismos con anti-CD3, lo cual se asoció con la inhibición en la expresión de CD25 y CD71, pero no se encontró variación en la producción de TNF alfa y de la IL-2; este fenómeno no estuvo relacionado con el beta-lapacol, principal compuesto de los extractos obtenidos de la corteza interna, ya que a concentraciones de 100 nM no produjo ningún efecto en la proliferación de linfocitos T. De la beta lapachona, por su parte, se ha encontrado que tiene la capacidad de inducir apoptosis al inhibir las ADN topoisomerasas (6); por lo tanto es posible que en los extractos obtenidos de las hojas de Tabebuia chrysantha G. Nicholson, se tengan concentraciones adecuadas de algunos de estos compuesto que inducen una depresión selectiva de los linfocitos, lo cual se refleja en el recuento leucocitario, sin embargo no se pueden descartar los efectos que esta planta puede tener sobre la médula ósea por la inhibición de moléculas estimulantes en la generación de la serie linfoide como es el caso de la IL-7 y su receptor, la IL-3, el NOTCH 1 y el factor TSLP o también sobre la producción de quimioquinas que permitan la migración de las células a sangre periférica como es el caso de la CXCL 12 y su receptor CXCR4 (30).
Estudios realizados previamente en nuestro grupo con extractos hidroalcohólicos de las hojas de Tabebuia chysantha (15) no indujeron cambios significativos en ninguno de los valores del hemograma, lo cual puede sugerir la expresión diferencial de diferentes compuestos asociados al método de obtención de los mismos y a diferencias en la expresión de dichas moléculas asociadas a cambios estacionales o a los sitios de recolección del material vegetal tal como se ha documentado en otros estudios (17).
En estudios anteriores en nuestra Línea de Investigación se había demostrado que estas especies vegetales (P. rugosus y T. chrysantha) no tenían efectos antibacterianos ni antimicóticos, cuando se evaluaron en concentraciones hasta de 500 µg/ml frente a Staphyloccocus aureus, Escherichia coli, Pseudomona aeruginosa, Micobacterium chelonae, Salmonella tiphymurium, Candida albicans, Aspergillius flavus y Cryptoccus neoformans (31). Estos resultados del estudio como antimicrobianos no desvirtúan que esta planta pueda tener esas acciones, y para validarlos es necesario hacer ensayos con otras condiciones de partición, cambiando la polaridad de los solventes, haciendo fraccionamiento de los extractos, purificando por cromatografía sus componentes activos.
Por lo anterior se puede suponer que ambas especies tienen una actividad biológica importante, que es necesario evaluar con mayor profundidad usando fracciones cromatográficas y extractos con diferentes solventes, y haciendo ensayos biodirigidos con diversas pruebas inmunológicas tales como ensayos de proliferación de linfocitos, producción de citoquinas o generación de diversos tipos de anticuerpos.
Como quiera que estas plantas se usan en forma tradicional y empírica en diversos estados infecciosos, una hipótesis de trabajo fue la de evaluar su efecto en el hemograma, buscando medir un efecto preliminar que indicara alguna actividad inmunomoduladora. En las presentes condiciones experimentales por los cambios presentados sobre linfocitos y eosinófilos se podría inferir un efecto inmunomodulador, que podría reflejarse en procesos infecciosos, en la respuesta a trasplantes y en enfermedades alérgicas.
BIBLIOGRAFÍA
1. American Society of Health System Pharmacists (ed). American Hospital Farmacology Service (AHFS). Drug Information; 2008. pp. 917, 1103, 1684. [ Links ]
2. Salgado H. Inmunofarmacología. En: Isaza CA, Isaza G, Fuentes J, Marulanda T., (ed). Fundamentos de Farmacología en Terapéutica. 5a ed. Pereira: Postergraph; 2008. pp. 459-472. [ Links ]
3. Sweetman, S.C. Immunosupressants. In: Sweetman, S.C, (ed). Martindale, The complete drug reference. 35th ed. Pharmaceutical Press: New York; 2007. pp. 1660-1689. [ Links ]
4. Kolodziej, H; Kiderlen, AF. In vitro evaluation of antibacterial and immunomodulatory activities of Pelargonium reniforme, Pelargonium sidoides and the related herbal drug preparation EPs 7630. Phytomedicine 2007;14(Suppl 6):18-26. [ Links ]
5. INVIMA, Ministerio de la Protección Social de Colombia (ed.) Normas Farmacológicas de la República de Colombia. 5a ed. Norma 23.1; 2006. [ Links ]
6. Böhler, T; Nolting, J; Gurragchaa, P; Lupescu, A; Neumayer, H.H.; Budde, K; Jamar, N; Klupp, J. Tabebuia avellanedae extracts inhibit IL-2-independent T-lymphocyte activation and proliferation. Transplant immunology 2008;18:319-323. [ Links ]
7. Sánchez, C; Gupta, M; Santana, AI. Actividad inmunomoduladora de las plantas (I). Revista de Fitoterapia 2002;2(2):151:163. [ Links ]
8. Oliveira-C, JF; Kiperstok, A.C; David, JP; David, JM, Giulietti, AM; Queiroz LP; Dos Santos, RR; Soares MBP. Anti-leishmanial and immunomodulatory activities of extracts from Portulaca hirsutissima and Portulaca werdermannii. Fitoterapia 2007;78:510-514. [ Links ]
9. Kovacevic, N; Colic, M; Backovic, A; Doslov-Kokorus, Z. Immunomodulatory effects of the methanolic extract of Epimedium alpinum in vitro. Fitoterapia 2006;77:561-567. [ Links ]
10. Potterat, O; Hamburger, M. Morinda citrifolia (Noni) fruti - phytochemistry, pharmacology, safety. Planta Med 2007;73(3):191-9. [ Links ]
11. Liu, J. The use of herbal medicines in early drug development for the treatment of HIV infections and AIDS. Expert Opin Investing Drugs 2007;16(9):1355-64. [ Links ]
12. Liu, JP; Manheimer, E; Yang, M. Herbal medicines for treating HIV infection and AIDS. Cochrane Database Syst Rev 2005;20(3):CD003937. [ Links ]
13. Bueno, JG; Isaza, G; Gutiérrez, F; Carmona, WD; Pérez, JE. Estudio etnofarmacológico de plantas usadas empíricamente por posibles efectos inmunoestimulantes. Rev. Med. Risaralda 2001;14:845-850. [ Links ]
14. Isaza, G; Bueno, JG; Jaramillo, R; Peñaloza, CA; Posso, CJ, Price, E; Rodríguez, GC. Estudio etnofarmacológico de plantas usadas empíricamente en 4 ciudades del centro-occidente colombiano. Medomai 2001;2(2):8-15. [ Links ]
15. Pérez, JE; Isaza, G; Bueno, JG; Arango, MC; Hincapié, BL, Nieto, AM; Londoño, DP. Efecto de los extractos de Phenax rugosus, Tabebuia chrysantha, Alternantera williamsi y Solanum dolichosepalum sobre el leucograma y la producción de anticuerpos en ratas. Rev. Med. Risaralda 2004;10:13-21. [ Links ]
16. Koyama, J; Morita, I; Tagahara, K; Hirai, K.I. Cyclopentene dialdehydes from Tabebuia impetiginosa. Phytochemesty 2000;53:869-872. [ Links ]
17. Steinert, J; Khalaf, H; Rimpler, M. HPLC separation and determination of naphtho (2,3-  ) furan - 4,9- diones and related compounds in extracts of Tabebuia avellanedae. Journal of Chromatography 1995;693:281-287. [ Links ]
) furan - 4,9- diones and related compounds in extracts of Tabebuia avellanedae. Journal of Chromatography 1995;693:281-287. [ Links ]
18. Li, CJ; Averboukh, L; Pardee, AB. Beta-Lapachone, a novel DNA topoisomerase I inhibitor with a mode of action different from camptothecin. Journal of Biological Chemestry 1993;268:22463-22468. [ Links ]
19. Son, DJ; Lim, Y; Park, YH; Chang, SK; Yun, Y-P; Hong, J-T; Takeoka, GR; Lee, K-G; Lee, S-E; Kim, M-R; Kim, J-H; Park, B-S. Inhibitory effects of Tabebuia impetiginosa inner bark extract on platelet aggregation and vascular smooth muscle cell proliferation through suppressions of arachidonic acid liberation and ERK 1/2 MAPK activation. Journal of Ethnopharmacology 2006;108:148-151. [ Links ]
20. Queiroz, MLS; Valadares, MC; Torello, CO; Ramos, AL; Oliveira, AB; Rocha, FD; Arruda, VA; Accorci, WR. Comparative studies of the effects of Tabebuia avellanedae bark extract and B-lapachone on the hematopoietic response of tumour-bearing mice. Journal of Ethnopharmacology 2008. 117:228-235. [ Links ]
21. NAPRALERT: Profile for Phenax rugosus 08/06/03. [ Links ]
22. Programa Iberoamericano de Ciencia y Tecnología. Actividad inmunomoduladora. En: Manual de técnicas de investigación. Santafé de Bogotá: CYTED; 1995. p. 105. [ Links ]
23. Zúñiga, JM; Tur, JA; Milocco, SN; Piñeiro, R. Vías de administración y obtención de fluidos. En: Zúñiga JM, Tur JA, Milocco SN, Piñeiro R., (ed). Ciencia y tecnología en protección y experimentación animal. 1a ed. España: McGraw-Hill/Interamericana; 2001. pp. 361-375. [ Links ]
24. Derechos Internacionales de los Animales. ONU y UNESCO. Citado el 10-11-2007. Disponible en: http://www.derechoanimal.es/2007/11/01/derechos-internacionales-de-los-animales/ - http://www3.cricyt.edu.ar/mn/etica.htm. Consultado 10-11-2007. [ Links ]
25. Normas Científicas, Técnicas y Administrativas para la Investigación en Salud. Resolución No. 008430. Ministerio de Salud, División de Desarrollo Científico y Tecnológico. Santafé de Bogotá, D.C.: Ministerio de Salud; 1993. [ Links ]
26. Mrad, A; Cardozo, CA. Utilización de animales de laboratorio en la experimentación biológica. Universidad Nacional de Colombia, Instituto de Biotecnología. Bogotá D.C.: Universidad Nacional de Colombia; 2000. [ Links ]
27. Sher, A; Wynn, TA; Sacks, DL. The immune response to parasites. In: Paul, WE, ed. Fundamental Immunology. Fifth edition. New York: Lippincott Williams and Wilkins Publishers; 2003. pp. 2112-2166. [ Links ]
28. Leonard, WJ. Type I cytokines and interferons and their receptors. In: Paul, WE, ed. Fundamental Immunology. Fifth edition. New York: Lippincott Williams and Wilkins Publishers; 2003. pp. 1277-1278. [ Links ]
29. Medzhitoz, R. The innate immune system. In: Paul, WE, ed. Fundamental Immunology. Fifth edition. New York: Lippincott Williams and Wilkins Publishers; 2003. p. 57. [ Links ]
30. Hardy, RR. B-lymphocyte development and biology. In: Paul, WE, ed. Fundamental Immunology. Fifth edition. New York: Lippincott Williams and Wilkins Publishers; 2003. pp. 304-370. [ Links ]
31. Arango, M; Bueno, JG; Isaza, G; Pérez, JE; Álvarez, LF; Osorio, EJ; Rincón, AJ; Duque, AC. Efectos antibacterianos y antimicóticos de Alternanthera williamsii, Solanum dolichosepalum, Baccharis trinervis, Tabebuia chrysantha y Phenax rugosus. Biosalud 2004;3:49-54. [ Links ]
32. Secor Jr, E.R; Carson IV, W.F; Cloutier, M.M; Guernsey, L.A; Schramm, C.M; Wu, C.A; Thrall, R.S. Bromelain exerts anti-inflammatory effects in an ovalbumin-induced murine model of allergic airway disease. Cellular immunology 2005;237:68-75. [ Links ]