Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Biosalud
Print version ISSN 1657-9550
Biosalud vol.8 no.1 Manizales Jan./Dec. 2009
EFECTO DE LOS EXTRACTOS ACUOSOS Y METANÓLICOS DE PHENAX RUGOSUS (POIR.) WEDD. Y TABEBUIA CHRYSANTHA G. NICHOLSON, SOBRE LA PRODUCCIÓN DE ANTICUERPOS TIPO IgG2b E IgM EN RATAS. ESTUDIO PRELIMINAR
EFFECT OF AQUEOUS AND METHANOLIC EXTRACTS OF PHENAX RUGOSUS (POIR.) WEDD. AND TABEBUIA CHRYSANTHA G. NICHOLSON, ON THE PRODUCTION OF IgG2b AND IgM ANTIBODIES IN RATS. A PRELIMINARY STUDY
Jorge Enrique Pérez Cárdenas1, Juan Carlos Sepúlveda-Arias2, Sandra Milena Acosta Agudelo3 y Gustavo Isaza Mejía4
1 Profesor Asociado, Facultad de Ciencias para la Salud, Universidad de Caldas, Colombia.
2 Profesor Asistente, Facultad de Ciencias de la Salud, Universidad Tecnológica de Pereira, Colombia.
3 Médica veterinaria y zootecnista, joven investigadora de Colciencias, Colombia.
4 Profesor Titular, Facultad de Ciencias para la Salud, Universidad de Caldas, Colombia.
Recibido: agosto 31 de 2009 - Aceptado: septiembre 22 de 2009
RESUMEN
Estudios etnofarmacológicos previos han demostrado el uso de las hojas de Phenax rugosus (Poir.) Wedd. y Tabebuia chrysantha G. Nicholson para el tratamiento de enfermedades infecciosas y de procesos inflamatorios. En esta investigación se obtuvieron los extractos acuoso y metanólico de cada una de estas plantas para valorar en ratas Wistar la capacidad de los mismos para inducir cambios significativos en los niveles séricos de anticuerpos del tipo IgM e IgG2b. Los resultados obtenidos muestran que dichos extractos no produjeron una respuesta que tuviera significancia estadística cuando se compararon las concentraciones de las inmunoglobulinas de los grupos tratados con las del grupo control.
PALABRAS CLAVE: Tabebuia chrysantha, Phenax rugosus, anticuerpos, IgM, IgG2b, productos naturales.
ABSTRACT
Previous Ethnopharmacological studies have showed the use of Phenax rugosus (Poir.) Wedd. and Tabebuia chrysantha G. Nicholson leaves for the treatment of infectious diseases and in inflammatory processes. Aqueous and methanolic extracts of each plant was obtained in order to determine the capacity of these extracts to induce significant changes in the seric levels of IgM and IgG2b antibodies in Wistar rats. The results obtained show that these extracts do not produce a response with statistical significance when comparing the antibody levels between the control and treatments groups.
KEY WORDS: Tabebuia chrysantha, Phenax rugosus, antibodies, IgM, IgG2b, natural products.
INTRODUCCIÓN
Los fármacos con acciones moduladoras de la respuesta inmune pueden ser de origen sintético, biológico, biotecnológico o vegetal. La obtención de los tres primeros es, por lo general, bastante costoso y es por ello que cada vez se investiga la posibilidad de obtener desde el reino vegetal moléculas que eventualmente puedan usarse en el humano como inmunomoduladoras (1, 2).
Adicionalmente a la inmunización activa con vacunas o la pasiva con sueros, se usan los agentes inmunoestimulantes como los interferones, los factores estimulantes de colonias, las interleuquinas y el factor de necrosis tumoral, productos obtenidos todos por biotecnología, con técnicas altamente sofisticadas y costosas que sólo unos pocos países del mundo pueden costear y que no las posee el nuestro (3). Sin embargo, sí poseemos una rica flora -la segunda en el mundo sólo superada por Brasil- que es abundante en moléculas bioactivas, pero ha sido poco estudiada (4, 5).
Bastante eficaces han sido también los inmunosupresores como la ciclosporina, el tacrolimus y el sirolimus -productos naturales obtenidos de hongos-, usados para evitar el rechazo en el trasplante de órganos. La ciclosporina se ha usado en el tratamiento de enfermedades autoinmunes como la artritis reumatoidea y la psoriasis, entre otras. Una amplia variedad de anticuerpos monoclonales (bevacizumab, rituximab, trastuzumab, cetuximab, etc.) son usados en muchos tipos de cáncer (6-8). En este grupo de inmunosupresores, que controla aspectos específicos del sistema inmune, también hay aportes de los productos naturales como los ya enumerados obtenidos de hongos, y se espera que las plantas aporten sustancias que puedan ser valiosas en este campo.
Es también muy extensa la investigación actual para obtener fármacos que estimulen el sistema inmune, pues éstos se usan en diferentes patologías como son la hepatitis B y C, leucemias, sarcomas, infección por Papiloma virus (interferón alfa), esclerosis múltiple (interferón beta), neoplasias hematológicas (interferón gama), neutropenias severas (factores estimulantes de colonias) y linfopenias (interleuquina 7) (6). La inmensa variedad de moléculas que poseen las plantas, podrían aportar sustancias similares, quizás con menores costos y toxicidad.
La investigación etnofarmacológica ha conducido al desarrollo de extractos vegetales o fitofármacos que se usan en una gran variedad de patologías; entre los compuestos obtenidos de estas fuentes están la morfina, la atropina, la quinina y el curare para nombrar sólo algunos de los más antiguos; o los taxoles y artemisina entre los más recientes (6, 7). En el campo específico de la inmunofarmacología se cuenta con el Pelargonium sidoides y P. reniforme (umckaloabo) usadas en el sur del África para tratar afecciones diversas como la diarrea, la influenza y la tuberculosis y, basados en estudios preclínicos y clínicos, se usa en varios países de Europa y entre nosotros como coadyuvante en el tratamiento de infecciones respiratorias (9, 10); la Equinacea purpurea (equinácea) se emplea en el tratamiento del resfriado común y cuenta con estudios científicos que han sustentado su uso; el mucílago y el gel del Aloe vera (sábila) usado tópicamente como cicatrizante y del cual se han aislado sustancias que interactúan con el sistema inmune; el gárlico (Allium sativum, ajo) que posee efectos hipotensores, hipolipemiantes y antiagregantes plaquetarios (por lo general en dosis altas) y, más recientemente, se han hecho estudios que explicarían un efecto inmunomodulador útil en el tratamiento del cáncer gástrico (11-13). Muchas otras plantas se encuentran en fase experimental para definir eficacia y seguridad como inmunomoduladores en el humano tales como Eupatorium perfoliatum, Schisandra chinensis, Pfaffia paniculada, Morinda citrifolia (frutos del Noni), Epimedium hunanense, Boerhaavia diffusa, Alsopghila spinulosa, Tinospora cordifolia, Withania somnifera, Woodfordia fruticosa, Physalis angulata, Dichrocephala bicolor, Urtica dioica, Curcuma longa, Rudbeckia bicolor, Larrea divaricada. También de algas y hongos -como Cordyceps sinensis (de amplio uso tradicional en la China)-, se han extraído principios activos con buena actividad inmunomoduladora (14-20).
Se han realizado diversos estudios etnofarmacológicos en el área rural y urbana y en herbolarios de diferentes municipios del Eje Cafetero con el objetivo de identificar las plantas más utilizadas como antimicrobianas o estimulantes del sistema inmune (21, 22). Phenax rugosus y Tabebuia chrysantha hacen parte de un grupo de plantas que la población usa tradicional y empíricamente para tratar infecciones, y se ha encontrado que los extractos de hojas de Tabebuia chrysantha G. Nicholson incrementan in vivo en ratas Wistar los niveles de anticuerpos dirigidos contra glóbulos rojos de carnero (23); sin embargo, estudios recientes de nuestro grupo han demostrado la inducción de linfopenia por parte de extractos metanólicos de ambas plantas (datos sin publicar).
Estudios realizados con extractos obtenidos de la corteza de especies como Tabebuia avellanedae (también denominada como T. rosea o T. impetiginosa) han demostrado diferentes efectos sobre la respuesta inmune (34). Los extractos acuosos mas no los metanólicos, inhibieron los linfocitos T luego de ser estimulados con anti CD3, efecto asociado con la inhibición en la expresión de CD25 y CD71 en la superficie de estas células sin modificación en la secreción de citoquinas tales como TNF-alfa e IL-2 (35). La beta lapachona, por su parte, posee la capacidad de inducir apoptosis al inhibir las ADN topoisomerasas (36). Es probable que otras especies relacionadas con Tabebuia avellanedae, como Tabebuia chrysantha, presenten compuestos activos en sus hojas.
Phenax rugosus (SW) Wedd. es una planta perteneciente a la familia Urticaceae; en la literatura científica no se han encontrado referencias de la actividad de la misma sobre la respuesta inmune (24). Esta especie vegetal se ha empleado tradicionalmente como antiinfeccioso tópico para tratar principalmente infecciones por hongos, y estudios preliminares realizados indican que extractos obtenidos de las hojas de esta planta poseen actividad contra dermatofitos in vitro (25). Experimentos realizados en ratas Wistar han indicado que los extractos de esta planta incrementan el número de linfocitos, monocitos y eosinófilos, así como también los niveles de anticuerpos dirigidos contra glóbulos rojos de carnero (23); aunque estudios más recientes han demostrado una disminución estadísticamente significativa en el número de eosinófilos (datos sin publicar).
El objetivo de la presente investigación fue el de profundizar en el posible efecto sobre el sistema inmune de estas dos plantas, midiendo los niveles séricos de IgG2b e IgM en ratas tratadas con extractos acuosos y metanólicos de las hojas de Phenax rugosus (Poir.) Wedd. y Tabebuia chrysantha.
MATERIALES Y MÉTODOS
Materiales vegetales
Phenax rugosus (Poir.) Wedd. se recolectó en la vereda El Guayabo, municipio de Cartago, Valle del Cauca, a 1400 msnm y 22°C de temperatura promedio, y Tabebuia chrysantha G. Nicholson fue recolectada en la vereda Santágueda, municipio de Palestina, Caldas, a 1800 msnm y a una temperatura promedio de 20°C. Ambas especies fueron identificadas y clasificadas en el herbario de la Facultad de Ciencias Agropecuarias de la Universidad de Caldas y debidamente comparadas con las muestras de referencia 1016 para la Phenax rugosus (Poir.) Wedd. y 1525 para Tabebuia chrysantha G. Nicholson.
Preparación de los extractos
Las hojas se lavaron con abundante agua destilada, se secaron a una temperatura de 40°C durante 48 horas, y se almacenaron a -4°C hasta el momento de ser empleadas.
Las muestras vegetales fueron sometidas a un proceso de maceración en frío con metanol y agua. Se obtuvieron 2 extractos, metanólico y acuoso, de las especies objeto de estudio; el extracto metanólico se conservó en estado seco a -4ºC y el acuoso fue liofilizado (29).
Animales de experimentación y tratamiento
Se emplearon ratas Wistar hembras con un peso promedio de 200 g, provenientes del bioterio de la Universidad de Caldas; recibieron alimento especial para roedores y agua ad libitum, con una temperatura promedio de 18°C y con una luminosidad diaria de 12 horas. Los animales fueron mantenidos en cajas plásticas transparentes.
Se trabajó con 36 animales asignados a tres grupos experimentales, conformados por 6 animales cada uno, distribuidos de la siguiente manera: para evaluar los extractos de Phenax rugosus, un grupo control; un segundo grupo al que se le administró extracto acuoso, y un tercer grupo al que se le administró extracto metanólico; de igual manera se evaluaron los extractos de Tabebuia chrysantha. Cada experimento se repitió tres veces.
Los extractos se administraron diariamente en ayunas mediante sonda orogástrica (30) durante 10 días consecutivos a una dosis de 1g/kg de peso, empleando como vehículo una mezcla de glicerina, propilenglicol, solución salina normal y tween 20 en proporción 10:10:10:70. A los animales control se les proporcionó un volumen equivalente del vehículo en las mismas condiciones que los grupos a los que se les administró extracto.
Los animales se manejaron bajo los condicionamientos éticos de los Derechos Internacionales de los Animales aprobados por la ONU y la UNESCO (31), las pautas aprobadas por el Ministerio de Salud (32), el Instituto de Biotecnología de la Universidad Nacional de Colombia (33) y el visto bueno del Comité de Ética de la Facultad de Ciencias para la Salud (Universidad de Caldas).
Determinación de los niveles de anticuerpos
Las muestras para la determinación de IgM e IgG2b se obtuvieron del seno venoso orbitario bajo sedación con éter etílico (30). Se analizaron las muestras obtenidas el día 0 y el día 16 del experimento.
Los niveles de anticuerpos se determinaron por ELISA en microplacas de 96 pozos. Se estandarizó una curva de calibración para cada ensayo, utilizando en la fase sólida anti IgM monoclonal purificada (BD PharmingenTM) o anti IgG2b monoclonal (Sigma ®) y diferentes concentraciones de un patrón de IgM e IgG2b de rata (BD PharmingenTM).
Las placas se sensibilizaron con el antianticuerpo por un periodo de 24 horas a 4°C, en buffer carbonato-bicarbonato 0,1 M; se retiró el exceso de anticuerpo no unido mediante lavados con PBS-Tween 20, se bloquearon los sitios de unión inespecífica con una solución al 1% de albúmina sérica bovina durante una hora; se lavó y se incubó con la muestra de suero diluida (1:10000 para la determinación de la IgM y 1:20000 para la determinación de la IgG2b) en PBS-albúmina sérica bovina (1%). Se incubó a 37°C durante una hora y se lavó cuatro veces con PBS-Tween. Se eliminó el exceso de solución de lavado y se agregó la anti IgM monoclonal o anti IgG marcada con biotina (BD PharmingenTM) a una concentración de 2µg/ml; se incubó por una hora a 37°C, se lavó con PBS-Tween y se agregó una dilución (1:3000) de avidina y fosfatasa alcalina (Sigma ®); se incubó nuevamente por una hora a 37°C para luego agregar una solución de paranitrofenil fosfato (Sigma ®). Se incubó 40 minutos a temperatura ambiente, se detuvo la reacción con ácido clorhídrico 3N y se realizó la lectura en un lector de ELISA (Titertek-Multiscan) a una longitud de onda de 450 nm, comparando las absorbancias con el blanco localizado en el primer pozo de la placa. Se estableció la concentración de IgM e IgG2b (µg/ml) en cada una de las muestras, empleando una curva de calibración.
Para comparar los valores de los tres grupos (controles, acuoso y metanólico) antes de la administración de los extractos o del vehículo, se hizo el análisis estadístico mediante pruebas no paramétricas de Kruscal-Wallis; cuando los valores de p resultaron significativos se aplicó la prueba "Post-hoc" del test de comparaciones múltiples de Dunn's para definir cuáles eran las parejas diferentes. El análisis estadístico de los resultados obtenidos, luego de realizada la administración de los extractos y el vehículo, se realizó mediante la prueba no paramétrica Test de Wilcoxon. Para el análisis de los datos se empleó el software GraphPad PRISM, versión 5.0 for Window (San Diego, CA).
RESULTADOS
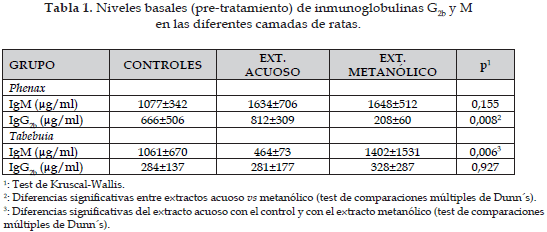
Los niveles basales de las concentraciones de IgG2b e IgM en los grupos control y en los tratados con los extractos metanólico y acuoso de ambas plantas, aparecen en la Tabla 1. Se observan diferencias estadísticamente significativas en los niveles de IgG2b del grupo Phenax y de IgM del grupo Tabebuia, tal como aparece explicado en dicha Tabla.
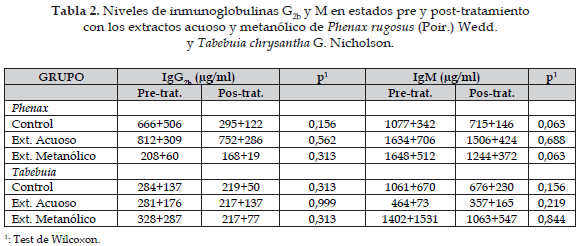
En la Tabla 2 se muestran los valores de IgG2b e IgM antes y después del tratamiento con los extractos acuosos y metanólicos de Phenax rugosus y Tabebuia chrysantha; con ninguno de los extractos se obtuvo diferencias estadísticamente significativas en los niveles séricos de ambas inmunoglobulinas en las ratas que recibieron dichos extractos comparados con los valores pre-tratamiento.
DISCUSIÓN
Las grandes transnacionales farmacéuticas están derivando una parte importante de sus recursos destinados a la investigación, al desarrollo y producción de productos biotecnológicos, una empresa que es supremamente compleja y costosa. Ninguno de los medicamentos de origen sintético, semi-sintético o natural que hay disponibles en la actualidad, poseen los altísimos costos de producción de los obtenidos por medios biotecnológicos por varias razones: son moléculas heterogéneas y complejas, con pesos moleculares cien veces mayores a los de los fármacos tradicionales, producidas a través de clones o células vivas con características fisicoquímicas y biológicas difíciles de manipular y con delicados procesos biológicos y tecnológicos necesarios para su extracción, conservación, empaque, etc. Si se agrega que estos productos no tienen genéricos y que la producción de biosimilares es también altamente costosa, con altos estándares en los controles de eficacia y calidad, se entiende la gran preocupación de los distintos países del mundo, dado el gran impacto en los presupuestos para la salud que esto está generando (26-28). Una posible alternativa, es buscar en las plantas, algas y hongos, sustancias químicas que puedan reproducir mecanismos de acción similares a los obtenidos por otras fuentes.
Los resultados obtenidos en la presente investigación son concordantes con resultados previos obtenidos por nosotros con estos extractos al evaluar los cambios inducidos sobre el hemograma en ratas Wistar. Encontramos que no se observaban cambios significativos en el número de células linfoides al administrar los extractos metanólicos de Phenax rugosus, y cambios significativos con los extractos metanólicos de Tabebuia chrysantha, en donde se encontró una caída en el recuento de estas células. En la presente investigación, se observa una tendencia no significativa a disminuir los niveles séricos de IgM tanto con el extracto metanólico de Phenax, como con los extractos acuosos de Tabebuia. Estudios realizados por otros investigadores con los extractos acuosos de Tabebuia avellanedae han demostrado un efecto supresor en la proliferación de los linfocitos T, independiente de IL-2, de CD25 y de CD71 (36). El efecto observado en el presente estudio podría estar asociado con el bloqueo de factores de señalización a nivel intracelular ya sea inhibiendo moléculas importantes en la activación de linfocitos B presentes en la membrana del mismo o por un efecto tóxico sobre estas células. Las diferencias en los niveles basales de IgG2b entre los grupos tratados con los extractos acuoso y metanólico de P. rugosus puede ser explicado por el hecho de emplear en los experimentos cepas de ratas Outbred, las cuales tienen una base genética heterogénea; estudios previos en dichos animales han indicado que los niveles séricos totales de IgM pueden variar y afectar los niveles séricos totales de otros isotipos de Inmunoglobulinas (37). Adicionalmente, es conocido que la edad de los animales experimentales puede influir en los niveles basales de IgM e IgG en ratas. En general, las ratas incrementan gradualmente sus niveles séricos de inmunoglobulinas con la edad (38). En nuestro caso, a pesar de haber empleado animales experimentales con peso promedio de 200 g, es posible haber tenido diferencias en la edad de los animales entre los distintos grupos experimentales.
A pesar de que se ha demostrado que la beta lapachona, un constituyente de T. avellanedae, tiene un efecto citotóxico o apoptótico sobre un amplio número de células(36, 39), en el presente estudio se observa que los niveles de anticuerpos varían muy poco luego de administrar los diferentes extractos; este hallazgo puede estar indicando que hay bajos niveles de este compuesto en las hojas de T. chrysantha, molécula que es la de mayor importancia no sólo para la modulación de la respuesta inmune sino también para la eliminación de diferentes tipos de tumores (39). Por lo tanto, es necesario llevar a cabo estudios fitoquímicos que determinen la concentración de esta molécula en las hojas de T. chrysantha.
Hay que resaltar el hecho de que plantas del género Tabebuia han sido declaradas en vías de extinción por efecto de la tala de los bosques, de la urbanización y de las enfermedades que eventualmente las aquejan. El uso de la corteza interna de dicha planta, donde se han identificado sus compuestos activos, puede ser un factor que contribuya a la disminución de los miembros de este género, razón por la cual es necesario buscar los compuestos activos en partes de la planta que al removerse no le generen traumatismos mayores. Por esta razón, la búsqueda de los compuestos activos en las hojas es una muy buena alternativa y validaría el uso empírico de las mismas por las comunidades que así las utilizan.
BIBLIOGRAFÍA
1. Reichert, JM. Trends in US approvals: new biopharmaceuticals and vaccines. Trends Biotechnol 2006;24:293-298. [ Links ]
2. Schellenks, H. Follow-on biologics: challenges of the next generation. Nephrol Dial Transplant 2005;20(Suppl 4):31-36. [ Links ]
3. Salgado, H. Inmunofarmacología. En: Isaza CA, Isaza G, Fuentes J, Marulanda T. ed. Fundamentos de Farmacología en Terapéutica. 5a ed. Pereira: Postergraph; 2008. pp. 459-472. [ Links ]
4. Franco, GC. Memorias del Seminario Internacional de Plantas Medicinales y sus Derivados. Bogotá, 20, 21 nov. 2003. Bogotá: Despacho Viceministro de Ambiente - Grupo Mercados Verdes. pp.11-12. [ Links ]
5. Sanabria, A. Biodiversidad, tradiciones e investigación al servicio de la salud. Memorias del Seminario Internacional de Plantas Medicinales y sus Derivados. Bogotá, 20, 21 nov. 2003. Bogotá: Despacho Viceministro de Ambiente - Grupo Mercados Verdes. pp. 22-31. [ Links ]
6. Salgado, H. Inmunofarmacología. En: Isaza, CA, Isaza G, Fuentes J, Marulanda T. ed. Fundamentos de Farmacología en Terapéutica. 5a ed. Pereira: Postergraph; 2008. pp. 501-519. [ Links ]
7. Sweetman, S.C. Immunosupressants. In: Sweetman, S.C, ed. Martindale, The complete drug reference. 35th ed. Pharmaceutical Press; 2007. pp. 1660-1689. [ Links ]
8. American Society of Health System Pharmacists (ed). American Hospital Pharmacology Service (AHFS) Drug Information; 2008. pp. 917, 1103, 1684. [ Links ]
9. Kayser, O; Kolodziej, H. Antibacterial Activity of Extracts and Constituents of Pelargonium sidoides and Pelargonium reniforme. Planta Médica 1997;63:508-510. [ Links ]
10. Kolodziej, H; Kiderlen, AF. In vitro evaluation of antibacterial and immunomodulatory activities of Pelargonium reniforme, Pelargonium sidoides and the related herbal drug preparation EPs 7630. Phytomedicine 2007;14(Suppl 6):18-26. [ Links ]
11. Foster, S; Tyler, VE. Aloe, Boneset, Garlic and other Alliums, Schisandra. In: Foster, S; Tyler, VE, ed. Tayler's Honest Herbal. 4a. ed. The Haworth Herbal Press; 1999. pp. 27-31, 57-58, 172, 347. [ Links ]
12. Kuttan, G. Inmunomodulatory effect of some naturally ocurring sulphur-containing compounds. J of Ethnopharmacology 2000;72:93-99. [ Links ]
13. Invima. Ministerio de la Protección Social de Colombia (ed.). Normas Farmacológicas de la República de Colombia. 5a ed. Norma 23.1; 2006. [ Links ]
14. Sánchez, C; Gupta, M; Santana, AI. Actividad inmunomoduladora de las plantas (I). Revista de Fitoterapia 2002;2:151-163. [ Links ]
15. Oliveira-C, JF; Kiperstok, A.C; David, JP; David, JM; Giulietti, AM; Queiroz LP; Dos Santos, RR; Soares, MBP. Anti-leishmanial and immunomodulatory activities of extracts from Portulaca hirsutissima and Portulaca werdermannii. Fitoterapia 2007;78:510-514. [ Links ]
16. Kovacevic, N; Colic, M; Backovic, A; Doslov-Kokorus, Z; Immunomodulatory effects of the methanolic extract of Epimedium alpinum in vitro. Fitoterapia 2006;77:561-567. [ Links ]
17. Potterat, O; Hamburger, M. Morinda citrifolia (Noni) fruti - phytochemistry, pharmacology, safety. Planta Med 2007;73:191-199. [ Links ]
18. Liu, J. The use of herbal medicines in early drug development for the treatment of HIV infections and AIDS. Expert Opin Investing Drugs 2007;16:1355-1364. [ Links ]
19. Liu, JP; Manheimer, E; Yang, M. Herbal medicines for treating HIV infection and AIDS. Cochrane Database Syst Rev 2005;20:CD003937. [ Links ]
20. Zhang, W; Li, J Qiu, S; Chen, J; Zheng, Y. Effects of the exopolysaccharide fraction (EPSF) from cultivated Cordyceps sinensis on immunocytes of H22 tumor bearing mice. Fitoterapia 2008;79:168-173. [ Links ]
21. Bueno, JG; Isaza, G; Gutiérrez, F; Carmona, WD; Pérez, JE. Estudio etnofarmacológico de plantas usadas empíricamente por posibles efectos inmunoestimulantes. Rev. Med. Risaralda 2001;14:845-850. [ Links ]
22. Isaza, G; Bueno, JG; Jaramillo, R; Peñaloza, CA; Posso, CJ, Price, E; Rodríguez, GC. Estudio etnofarmacológico de plantas usadas empíricamente en 4 ciudades del centro-occidente colombiano. Medomai 2001;2:8-15. [ Links ]
23. Pérez, JE; Isaza, G; Bueno, JG; Arango, MC; Hincapié, BL, Nieto, AM; Londoño, DP. Efecto de los extractos de Phenax rugosus, Tabebuia chrysantha, Alternantera williamsi y Solanum dolichosepalum sobre el leucograma y la producción de anticuerpos en ratas. Rev. Med. Risaralda 2004;10:13-21. [ Links ]
24. Napralert: Profile for Phenax rugosus 08/06/03. [ Links ]
25. Arango, M; Bueno, JG; Isaza, G; Pérez, JE; Álvarez, LF; Osorio, EJ; Rincón, AJ; Duque, AC. Efectos antibacterianos y antimicóticos de Alternanthera williamsii, Solanum dolichosepalum, Baccharis trinervis, Tabebuia chrysantha y Phenax rugosus. Biosalud 2004;3:49-54. [ Links ]
26. Emea, The European Agency for the Evaluation of Medicinal Products. Note for guidance on comparability of medicinal products containing biotechnology-derived proteins as drug substance. London, 20 september 2001. CPMP/BWP/3207/00. [ Links ]
27. Mellstedt, H; Niederwieser, D; Ludwig, H. The challenge of biosimilars. Annals of Oncology 2008;19:411-419. [ Links ]
28. Díaz-Q, A. Costos de Investigación y Desarrollo de Medicamentos Biotecnológicos. Cost of Biotech Drugs, mar, 03, 2007; lectura 566. [ Links ]
29. Programa Iberoamericano de Ciencia y Tecnología. Actividad inmunomoduladora. En: Manual de técnicas de investigación. Santafé de Bogotá: CYTED; 1995. p. 105. [ Links ]
30. Zúñiga, JM; Tur, JA; Milocco, SN; Piñeiro, R. Vías de administración y obtención de fluidos. En: Zúñiga JM, Tur JA, Milocco SN, Piñeiro R., eds. Ciencia y tecnología en protección y experimentación animal. 1a ed. España: McGraw-Hill/Interamericana; 2001. pp. 361-375. [ Links ]
31. Derechos Internacionales de los Animales. ONU y UNESCO. Disponible en: http://www.derechoanimal.es/2007/11/01/derechos-internacionales-de-los-animales/. Consultado 10-11-2007. [ Links ]
32. Normas Científicas, Técnicas y Administrativas para la Investigación en Salud. Resolución No. 008430, Ministerio de Salud, División de Desarrollo Científico y Tecnológico. Santafé de Bogotá, D.C.: Ministerio de Salud; 1993. [ Links ]
33. Mrad, A; Cardozo, CA. Utilización de animales de laboratorio en la experimentación biológica. Universidad Nacional de Colombia, Instituto de Biotecnología. Bogotá, D.C.: Universidad Nacional de Colombia; 2000. [ Links ]
34. Koyama, J; Morita, I; Tagahara, K; Hirai, K.I. Cyclopentene dialdehydes from Tabebuia impetiginosa. Phytochemistry, 2000; 53:869-872. [ Links ]
35. Sánchez, C; Gupta, M; Santana, AI. Actividad inmunomoduladora de las plantas (I). Revista de Fitoterapia 2002;2(2):151:163. [ Links ]
36. Böhler, T; Nolting, J; Gurragchaa, P; Lupescu, A; Neumayer, H.H.; Budde, K; Jamar, N; Klupp, J. Tabebuia avellanedae extracts inhibit IL-2-independent T-lymphocyte activation and proliferation. Transplant immunology 2008;18:319-323. [ Links ]
37. Bazin, H; Platteau, B; Kints, J.P; Malache, J.M; Pauwels, R. Genetic regulation of immunoglobulin synthesis: selection of two rats lines with respectively a high or low IgM serum level. J Immunogenetics 1983;10:293-304. [ Links ]
38. Salauze, D; Serre, V; Perrin, C. Quantification of total IgM and IgG levels in rat sera by a sandwich ELISA technique. Comp Haemathol Int 1994;4:30-33. [ Links ]
39. Queiroz, M.L.S; Valadares, M.C; Torello, C.O; Ramos, A.L; Oliveira, A.B; Rocha, F.D; Arruda, V.A; Accorci, W.R. Comparative studies of the effects of Tabebuia avellanedae bark extract and B-lapachone on the hemapoietic response of tumor-bearing mice. Journal of Etnopharmacology 2008;117:228-235. [ Links ]