Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Biosalud
versión impresa ISSN 1657-9550
Biosalud v.8 n.1 Manizales ene./dic. 2009
USO DE LA ESPECTROMETRÍA DE MASAS EN TÁNDEM PARA LA DETERMINACIÓN DE AMINOÁCIDOS EN CANINOS
SEROPREVALENCE AND SEROTYPIFICATION OF CANINE LEPTOSPIROSIS IN BUENAVENTURA (VALLE DEL CAUCA)
Jose Henry Osorio1 y Luis Fernando Uribe-Velásquez2
1 Laboratorio de Bioquímica Clínica y Patología Molecular, Departamento de Ciencias Básicas de la Salud, Universidad de Caldas, Manizales (Colombia). E-mail: jose.osorio_o@ucaldas.edu.co.
2 Departamento de Salud Animal, Universidad de Caldas, Manizales (Colombia).
Recibido: septiembre 17 de 2009 - Aceptado: noviembre 10 de 2009
RESUMEN
La determinación de aminoácidos en sangre, es una prueba fundamental en la detección de errores hereditarios de la degradación de algunos aminoácidos y algunas acidurias orgánicas. El objetivo del presente trabajo, ha sido establecer valores de referencia para aminoácidos en sangre de caninos adultos mediante espectrometría de masas en tándem. Fueron obtenidas muestras de sangre de 60 caninos normales mayores de 18 meses (30 machos y 30 hembras). Las muestras fueron tomadas en papel de filtro y analizadas mediante espectrometría de masas en tándem. No fue encontrada diferencia significativa entre machos y hembras. Son reportados valores de referencia en caninos usando esta técnica. La espectrometría de masas en tándem constituye una herramienta importante para el diagnóstico de metabolopatías.
PALABRAS CLAVE: ESI-MS/MS, perros, metabolismo, aminoácidos, acidurias orgánicas.
ABSTRACT
The measurement of blood amino acids is a basic test for the detection of inherited inborn errors related to some amino acids metabolism and organic acidurias. The objective of the present study was to establish reference values for amino acids in blood of canines using tandem mass spectrometry. Blood samples from 60 normal canines over 18 moths of age (30 male and 30 female) were obtained, and dried blood spots were prepared for amino acids analysis by tandem mass spectrometry. No significant differences between sexes were found. Reference values for amino acids in canines using this technique are provided. Tandem mass spectrometry is an important tool for the diagnosis of metabolic disorders.
KEY WORDS: ESI-MS/MS, dogs, metabolism, amino acids, organic acidurias.
INTRODUCCIÓN
En humanos el número de errores innatos del metabolismo reportados en la literatura científica se aproxima a 600 (1). Es de suponer que este tipo de enfermedades también se presentan en caninos, pero en la mayoría de los casos el diagnóstico es erróneo o simplemente pasan desapercibidas (2). Se hace necesario mediante estudios bioquímicos y de genética molecular, establecer la presencia o no de estas alteraciones, con miras a realizar consejo genético y recomendar el manejo respectivo a los portadores, debido al auge de la zootecnia en caninos y al papel del médico veterinario en el cuidado de las mascotas, pero para esto se necesitan parámetros de referencia en animales normales. El presente trabajo tuvo como objetivo establecer valores de referencia para algunos aminoácidos por espectrometría de masas en tándem, para buscar posteriormente una correlación entre el animal normal y el que se encuentra posiblemente afectado por un error congénito del metabolismo (ECM), ya que esta novedosa técnica permite la detección de hasta 30 desórdenes metabólicos en un sólo análisis (3).
MATERIALES Y MÉTODOS
El presente estudio es de tipo descriptivo. Se tomaron muestras de sangre en papel de filtro de 60 caninos mayores de 18 meses (30 machos y 30 hembras) clínicamente sanos, de diferentes razas, y que recibían una dieta estándar. Estos pacientes fueron admitidos en el Hospital Veterinario de la Universidad de Caldas (Colombia) para análisis clínico de rutina. El estudio cumple con la aprobación del Comité de Ética de la Universidad de Caldas. La sangre fue recolectada en tubos que contenían EDTA (23,5 µmol/tubo). Se dejaron caer alícuotas de 20 microlitros sobre papel de filtro (No. 903, 1,88 mm Schleicher & Schuell). Las muestras se dejaron secar a temperatura ambiente durante la noche y fueron empacadas al vacío y selladas, para ser guardadas a -80ºC hasta el momento de análisis. La metodología seguida ha sido reportada anteriormente (4). Las manchas de sangre fueron recortadas del papel de filtro en círculos (6,35 mm o 0,25 pulgadas de diámetro para cada uno, que corresponden a 12 µl de sangre) y se depositó un círculo en cada pozo. A cada uno fueron adicionados 100µl de estándar interno y metanol puro. Las bandejas fueron depositadas en un agitador orbital (750 rpm) durante 30 min y luego se llevaron a un baño de ultrasonido durante 15 min. Posteriormente fueron agitadas nuevamente durante dos horas y se llevaron al baño de ultrasonido por 30 min. El papel de filtro fue removido de cada pozo y el sobrenadante evaporado bajo aire a 45ºC hasta secarse. A cada muestra se le agregaron 50 µl de HCL butanólico 1M y se incubaron a 60ºC durante 15 min (derivatización). Las muestras fueron evaporadas inmediatamente bajo aire a 45ºC y redisueltas en 100 µl de acetronitrilo al 70% en agua para ser inyectadas al espectrómetro de masas. Todos los análisis fueron realizados en un equipo Quattro II, triple quadrupole tandem mass spectrometer (Micromass UK), equipado con una fuente de ionización en espray (ESI), y sistema de análisis datos "micro mass MassLynx".
La introducción de las muestras a la fuente se hizo mediante el dispositivo automático Jasco AS980 acoplado a una bomba Jasc PU980 HPLC. Para obtener los niveles de aminoácidos se registró pérdida neutral de m/z 102 (NTL 102). Esta técnica utiliza métodos de fragmentación de moléculas positivamente cargadas mediante ionización electrodifusora de ésteres butilados. Las concentraciones son calculadas después de obtener la relación entre la intensidad de la señal correspondiente para cada compuesto y la intensidad de la señal producida por un estándar interno (IS) el cual es adicionado a las muestras como patrón de referencia.
El cálculo de la concentración de acilcarnitinas, se hace conociendo la concentraciones del estándar interno (I/S) en 100 µl; para [d9]cn = 3,6 µM, [d3]C2cn = 1,2 µM, [d3]C3cn = 0,24 µM, [d9]C8cn = 0,12 µM y [d9]C16cn = 0,24 µM adicionados a 12 µl de sangre extraídos de la tarjeta. Para el análisis estadístico fue utilizada la prueba t de student, para establecer las posibles diferencias entre machos y hembras, al comparar los valores de los diferentes aminoácidos.
RESULTADOS
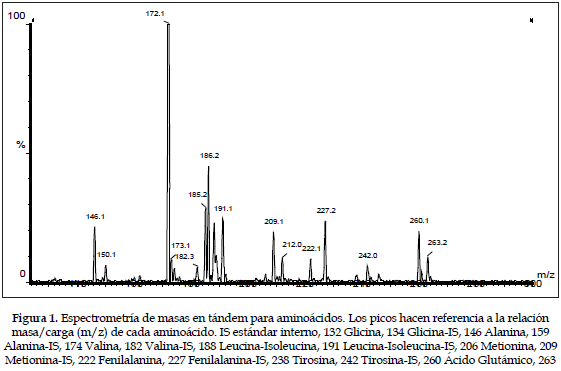
No se encontró diferencia estadísticamente significativa entre machos y hembras, al analizar las muestras mediante espectrometría de masas en tándem para varios aminoácidos. Los valores obtenidos en milimoles/litro (promedio±desviación estándar) fueron los siguientes: glicina 0,261±0,096, alanina 0,363±0,42, valina 0,105±0,108, Leucina+isoleucina 0,313±0,111, metionina 0,030±0,013, fenilalanina 0,055±0,018, tirosina 0,075±0,099, ácido glutámico 0,275±0,104 (Tabla 1). La Figura 1 muestra la distribución de los aminoácidos de acuerdo a la relación masa/carga.
DISCUSIÓN
El espectrómetro de masas es un equipo que ioniza moléculas, separa estos iones según su relación masa/carga (m/z) y finalmente detecta y cuantifica los iones de una masa particular. Los resultados son expresados en un gráfico conocido como espectro de masas, donde se presentan los valores m/z a lo largo del eje X y la cantidad de iones está representada por la altura de los picos en el eje Y (Figura 1). Las bases para el análisis por espectrometría de masas en tándem (MS/MS, MS2) son la producción de especies moleculares intactas a partir de una mezcla compleja usando una técnica de ionización suave seguida por la identificación de fragmentos moleculares de componentes específicos inducidos con moléculas neutras de nitrógeno o argón. El análisis de aminoácidos por espectrometría de masas en tándem es posible gracias a que los aminoácidos, después de butilarse, se ionizan óptimamente dentro del espectrómetro de masas. Después de someter estos iones a disociación por colisión inducida (al chocar con un gas, generalmente argón o neón), se genera butilformato (102 Da), el cual es común a todos los alfa-aminoácidos; el butilformato se pierde dentro del proceso, debido a que es una molécula -sin carga- y no un ion (5).
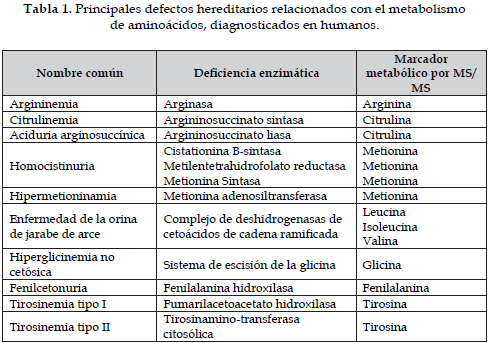
En las alteraciones del metabolismo de los aminoácidos, la espectrometría de masas en tándem juega un papel diagnóstico importante, ya que pueden ser detectadas las siguientes alteraciones: fenilcetonuria, hiperfenilalaninemia, leucinosis (enfermedad de la orina de jarabe de arce), tirosinemia (tipo II y III), citrulinemia, hipermetioninemia, hiperglicinemia, citrulinemia y la aciduria arginosuccínica (Tabla 1), además de ser una técnica potencial para el diagnóstico de la hiperornitinemia, hiperamonemia, hiperhomocitrulinemia (síndrome HHH) (6).
Los errores congénitos del metabolismo se deben a mutaciones de genes que como resultado darán lugar a proteínas alteradas en su estructura y función, lo cual interfiere en la vía metabólica respectiva provocando el acumulo o deficiencia de ciertos metabolitos (7). Por esto, el estudio de los errores congénitos del metabolismo se puede abordar a varios niveles: por detección de un gen anormal, un producto del gen anormal, una actividad anormal de este producto o por la presencia anormal de metabolitos (8, 9).
El perfil de acilcarnitinas por espectrometría de masas en tándem también puede ser útil en el diagnóstico de acidurias orgánicas (10). En algunas acidemias orgánicas, pueden ser encontrados patrones característicos, por ejemplo en la aciduria glutárica tipo I (GA I) el perfil de acilcarnitinas muestra una prominente acumulación de glutarilcarnitina (m/z 388), y en la acidemia isovalérica (IVA) está altamente incrementado el nivel de iso-C5 (isovaleril)-carnitina (m/z 302). En la acidemia metilmalónica (MMA) y en la acidemia propiónica (PA) se presenta siempre acumulación de propionilcarnitina (m/z 274), mientras que en la mayoría de los pacientes con MMA un ión adicional correspondiente a metilmalonilcarnitina (m/z 374) puede ser detectado. Éste es el primer reporte de valores de referencia para aminoácidos en sangre de caninos por espectrometría de masas en tándem. Algunos autores han reportado valores de referencia para acilcarnitinas y aminoácidos de muestras obtenidas por punción del talón, para programas de tamizaje metabólico en humanos (6). Los diagnósticos realizados a través de estos programas de tamizaje han sido previamente reportados (11, 12, 13). Cabe anotar que la espectrometría de masas en tándem no puede reemplazar los programas de tamizaje para deficiencia de biotinidasa, hipotiroidismo, hemoglobinopatías, hiperplasia adrenal congénita, galactosemia, fibrosis quística, y distrofia muscular de Duchenne; estas condiciones no pueden ser identificadas por MS/MS por ahora, y deben ser detectadas por otros medios (14, 15). Por ser de carácter cuantitativo, esta técnica permite una buena discriminación entre perfiles normales y anormales, así como el monitoreo de la terapia adecuada, y la confirmación en casos positivos falsos (14).
Se concluye entonces que la espectrometría de masas en tándem es una técnica eficaz para la determinación de aminoácidos en sangre de caninos y se aportan valores de referencia como una posible ayuda diagnóstica de algunas enfermedades metabólicas.
AGRADECIMIENTOS
Los autores agradecen a la Vicerrectoría de Investigaciones y Posgrados de la Universidad de Caldas por financiar este trabajo de investigación (Proyecto de Investigación Cód. 1223206).
REFERENCIAS BIBLIOGRÁFICAS
1. Chace, D.H.; Naylor, E.W. Expansion of newborn screening programs using automated tandem mass spectrometry. Mental Retardation and Developmental Disabilities 1999;5:150-154. [ Links ]
2. Lahjouji, K.; Mitchell, G.A.; Qureshi, I.A. Carnitine transport by organic cation transporters and systemic carnitine deficiency. Molecular Genetics and Metabolism 2001;73:287-297. [ Links ]
3. Clague, A.; Thomas, A. Neonatal biochemical screening for disease. Clinica Chimica Acta 2002;315:99-110. [ Links ]
4. Millington, D.S.; Chace, D.H.; Hillman, S.L. et al. Diagnosis of metabolic disease. In: Matsuo, T.; Caprioli, R.M.; Gross, M.L. et al., eds. Biological mass spectrometry: present and future. New York: Wiley; 1994. pp. 559-579. [ Links ]
5. Vreken, P.; Van Lint, A.E.M.; Bootsma, A.H. et al. Quantitative plasma acylcarnitine analysis using electrospray tandem mass spectrometry for the diagnosis of organic acidaemias and fatty acid oxidation defects. Journal of Inherited Metabolic Disease 1999;22(3):302-306. [ Links ]
6. Winter, S.C.; Linn, L.S.; Helton, E. Plasma carnitine concentrations in pregnancy, cord blood, and neonates and children. Clinica Chimica Acta 1995;243:87-93. [ Links ]
7. Stanley, C.A. New genetic defects in mitochondrial fatty acid oxidation and carnitine deficiency. Advances in Pediatrics 1987;34:59-88. [ Links ]
8. Bartlett, K.; Pourfarzam, M. Defects of 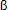 -oxidation including carnitine deficiency. International Review of Neurobiology 2002;53:469-505. [ Links ]
-oxidation including carnitine deficiency. International Review of Neurobiology 2002;53:469-505. [ Links ]
9. Bartlett, K.; Eaton, S. Mitochondrial  -oxidation. European Journal of Biochemistry 2004;271:462-469. [ Links ]
-oxidation. European Journal of Biochemistry 2004;271:462-469. [ Links ]
10. Osorio, J.H.; Uribe-Velásquez, L.F.; Giraldo, C.E. Perfil de acilcarnitinas en caninos mediante el uso de espectrometría de masas en tándem. Revista Colombiana de Ciencias Pecuarias 2005;18:376. [ Links ]
11. De Sousa, C.; English, N.R.; Stacey, T.E. et al. Measurements of L-carnitine and acylcarnitines in body fluids and tissues in children and in adults. Clinica Chimica Acta 1990;187:317-328. [ Links ]
12. Meyburg, J.; Schulze, A.; Kohlmueller, D. et al. Postnatal changes in neonatal acylcarnitine profile. Pediatric Research 2001;49(1):125-129. [ Links ]
13. Novak, M.; Monkus, E.F.; Chung, D. et al. Carnitine in perinatal metabolism of lipids I. Relationship between maternal and fetal plasma levels of carnitine and acylcarnitines. Pediatrics 1981;67(1):95-100. [ Links ]
14. Chace, D.H.; Millington, D.S.; Terada, N. et al. Rapid diagnosis of phenylketonuria by quantitative analysis for phenylalanine and tyrosine in neonatal blood spots by tandem mass spectrometry. Clinical Chemistry 1993;39:66-71. [ Links ]
15. Chace, D.H.; Sherwin, J.E.; Hillman, S.L. et al. Use of phenylalanine-to-tyrosine ratio determined by tandem mass spectrometry to improve newborn screening for phenylketonuria of early discharge specimens collected in the first 24 h. Clinical Chemistry 1998;44:2405-2409. [ Links ]