Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Biosalud
versão impressa ISSN 1657-9550
Biosalud v.8 n.1 Manizales jan./dez. 2009
DIAGNÓSTICO "IN VITRO" DE LA DEFICIENCIA DE ACIL-CoA DESHIDROGENASA DE CADENA CORTA
"IN VITRO" DIAGNOSIS OF SHORT CHAIN ACYL Co-A DEHYDROGENASE DEFICIENCY
José Henry Osorio1, Antonia Ribes2 y Montse Lluc2
1 Universidad de Caldas, Laboratorio de Bioquímica Clínica y Patología Molecular, Departamento de Ciencias Básicas de la Salud, Manizales, Colombia.
2 Instituto de Bioquímica Clínica. Corporació Sanitaria Clínic. Barcelona (España).
Recibido: octubre 01 de 2009 - Aceptado: noviembre 17 de 2009
RESUMEN
La acil-CoA deshidrogenasa de cadena corta (SCAD) cataliza la primera reacción de la degradación de ácidos grasos de 4 a 6 átomos de carbono. Su deficiencia debe ser siempre confirmada por estudios de laboratorio. En el presente trabajo, fueron incubados fibroblastos de pacientes que presentaban la deficiencia de SCAD, en presencia de sustratos tritiados. Fue encontrada diferencia significativa (p<0,05) al comparar la degradación de palmitato y miristato tritiado entre controles y pacientes con deficiencia de SCAD.
PALABRAS CLAVE: SCAD, ácidos grasos, metabolismo, errores innatos del metabolismo, fibroblastos.
ABREVIATURAS: SCAD: acil-CoA deshidrogenasa de cadena corta; MAD: múltiples acil-CoA deshidrogenasas; MCAD: acil-CoA deshidrogenasa de cadena media.
ABSTRACT
Short-chain acyl-CoA dehydrogenase (SCAD) is the key enzyme for degrading fatty acids with a 4-6 atoms carbon chain. It is necessary to always confirm this deficiency using laboratory methods. Fibroblasts of patients suffering SCAD deficiency were incubated with tritiated palmitate and miristatesubstrates. A significant difference (p<0.05) was found when comparing tritiated palmitate and miristate degradation between controls and patients suffering SCAD deficiency.
KEY WORDS: SCAD, fatty acids, metabolism, inherited inborn metabolic errors, fibroblasts.
INTRODUCCIÓN
La deficiencia hereditaria de SCAD fue reportada inicialmente en 1987 (1), esta deficiencia es considerada un raro error congénito del metabolismo mitocondrial de los ácidos grasos y ha sido relacionada con retardo en el crecimiento, muchas veces asociado a disfunciones neuromusculares y elevada excreción urinaria de ácido etilmalónico (EMA). Menos de 20 pacientes con deficiencia primaria de SCAD han sido documentados y reportados (2). Deficiencias secundarias de SCAD pueden ser observadas en defectos múltiples de la deshidrogenación de acil-CoA, donde la actividad SCAD se encuentra afectada por deficiencias en la flavoproteína de transferencia de electrones (3), flavoproteína de transferencia de electrones-ubiquinona oxidoreductasa (4), o flavina adenino dinucleótido mitocondrial (5).
Dado que la deficiencia primaria o secundaria de SCAD resulta en acumulación intracelular de butiril-CoA, el cual puede ser convertido en EMA mediante la acción de la propionil-CoA carboxilasa y posterior hidrólisis del etilmalonil-CoA (6), el análisis de EMA por cromatografía de gases-espectrometría de masas ha sido considerado un marcador bioquímico de la deficiencia funcional primaria o secundaria de SCAD (7), sin embargo, este hallazgo es común además en pacientes con signos predominantemente neuromusculares y deficiencias en la cadena respiratoria mitocondrial (8), en pacientes con síndrome de encefalopatía etilmalónica (9), y en la enfermedad de los vómitos de Jamaica (10).
Por esta razón el diagnóstico por laboratorio se hace necesario para confirmar la deficiencia. Los estudios in vitro son útiles, sobre todo para realizarlos en familias donde se presentan individuos identificados previamente y en los centros donde no se cuenta con técnicas avanzadas como la espectrometría de masas en tándem para la determinación de acilcarnitinas, donde se presenta típicamente elevación de la tetranoilcarnitina en estos pacientes (11).
MATERIALES Y MÉTODOS
El presente estudio es de tipo experimental. El material biológico empleado en el presente estudio ha sido fibroblastos de 3 pacientes con deficiencia de SCAD. Esta deficiencia fue confirmada por estudios enzimáticos, moleculares, o ambos. Como controles se utilizaron 20 cultivos diferentes de fibroblastos de personas normales. El trabajo cumple con los requisitos y aprobaciones de los respectivos comités de ética.
Fibroblastos de pacientes y controles (4-20 pasajes) fueron cultivados en bicarbonate-HEPESbuffered Eagle's minimal essential médium (MEM), suplementado con 10% (v/v) newborn calf serum, y 1% (v/v) de antibiótico (gentamicina) a 370C, en estufa con 5% CO2/95% de aire. Después de alcanzar el punto de confluencia (80-100%), las células fueron lavadas dos veces con PBS y la solución se tripsinizó (1 ml de tripsina-EDTA a 370C), y posteriormente se neutralizó mediante la adición de 3-5 ml de MEM (Minimun Esential Medium). Las células fueron transferidas y centrifugadas a 337 X g (5 min, 20°C) en tubos cónicos de 10 ml (0,8-1,2 mg proteína), quedando listas para ser incubadas en presencia de sustratos tritiados. Se utilizó el método de Lowry y col. (12) para la determinación de la proteína.
El método utilizado fue el de Manning (13) con modificaciones. Para obtener las mezclas radioactivas se prepararan las siguientes soluciones: Solución A: Ácido palmítico 12,5 mg/1 ml de etanol al 95% o ácido mirístico 12,5 mg/1 ml etanol 95%; Solución B: Albúmina 25 mg/ml = 75 mg/30 ml de PBS 1. Reactivo C: ácido [9,10)(n)-3H] palmítico (diluido en tolueno, 50-62 mCi/mmol, 1 mCi/ml) (Amersham) o ácido [9,10)(n)-3H] mirístico (diluido en tolueno, 40-60 mCi/mmol, 1 mCi/ml) (Amersham). Se mezcla en un tubo plástico de 3 ml, 25 µL de A + 3,8 µL de C (3,8 µCi), y el solvente se evapora bajo gas nitrógeno. Se agregan 2,5 ml de B y se analiza la mezcla en el contador de centelleo (LS3801-Beckman), [50 µl de la solución + 10 ml de líquido de centelleo (Ready Safe)]. Luego la mezcla es puesta en baño de ultrasonido durante 15 min y se lleva a incubación al baño a 370C durante 40 min, posteriormente se coloca nuevamente en el baño de ultrasonido durante 30 min, y se centrifuga durante 20 min a 5000 rpm. Se traspasa el máximo de volumen sobrenadante a otro tubo plástico de 3 ml, y se analizan 50 µL de la solución, como se describió anteriormente.
Para preparar las columnas de intercambio iónico pueden ser usadas las resinas Dowex 1 X 8-200 o Dowex 1 X 2-400, se le agrega agua destilada a la resina hasta que se hidrate. Se sellan al mechero pipetas Pasteur, aproximadamente a 3 cm de la punta, y se aísla el cuerpo de la pipeta de la punta, mediante la introducción de algodón comprimido, tratando de que el volumen de algodón ocupe aproximadamente 1 cm.
Se toma aparentemente, igual volumen de agua que de resina, se lleva a agitación suave y mientras se agita, se toman 2,5 ml y se depositan cuidadosamente en la pipeta, habiendo previamente humedecido totalmente el algodón con agua milli Q para evitar la retención de burbujas de aire que puedan posteriormente hacer caminos en la resina. Es recomendable conservar las pipetas en posición vertical. Después de depositar la resina, se debe verificar que no queden burbujas de aire y que la pipeta no pierda agua, para que la resina permanezca hidratada, luego las columnas pueden ser conservadas en refrigeración hasta su uso.
Para evaluar la oxidación de sustratos tritiados por los fibroblastos se toma el pellet de células previamente resuspendido en 500 µL de PBS 1. Se utilizan bandejas de incubación con capacidad para 24 pozos. El blanco, contiene 40 µL (0,05 Ci) de mezcla radioactiva y 160 µL de PBS 2, las muestras contienen 60 µL de células resuspendidas, 40 µL (0,05 µCi) de mezcla radioactiva, y 100 µL de PBS 2. La bandeja se envuelve en papel de aluminio y se Incuba a 370C durante 4 horas en cámara de CO2 5%, aire 95%. La reacción se detiene, colocando la bandeja en hielo y agregando a cada pozo 200 µL de TCA 10 %. El contenido de los pozos se traspasa al tubo para microcentrífuga y se centrífuga a 5000 rpm durante 5 min. 360 µL de la mezcla son transferidos de nuevo a un tubo de microcentrífuga nuevo que contiene 50 µL de NaOH 1 M. Esta mezcla se mantiene en hielo hasta el momento de aplicar a la columna. Para la aplicación a la columna de intercambio iónico la punta sellada de la pipeta Pasteur (columna) se parte cuidadosamente, se coloca un vial bajo la misma, y se deja escurrir su contenido, aplicando luego cuidadosamente 455 µL de mezcla de reacción a la columna, dejando escurrir nuevamente. Cuando para el goteo, se lava la columna tres veces con 500 µL agua milli Q, recogiendo todo el producto del lavado. Se desecha la columna y se agrega a cada vial 10 ml de líquido de centelleo, agitando fuertemente para su posterior análisis. La prueba t de student fue utilizada para comparar los valores obtenidos de la incubación de fibroblastos controles y los de los pacientes que sufren la deficiencia de MCAD.
RESULTADOS
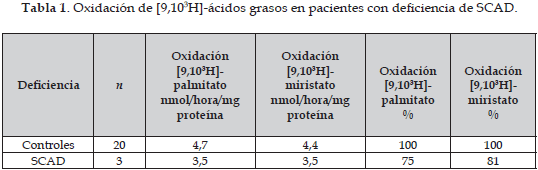
La Tabla 1 muestra los valores promedio (5 determinaciones por cada muestra), para la oxidación de palmitato y miristato tritiados en nmol/hora/mg proteina y el porcentaje de oxidación de los sustratos tritiados por parte de los fibroblatos de los pacientes con deficiencia de SCAD comparados con los controles paralelos. Fue encontrada diferencia significativa (p<0,05) al comparar la degradación de palmitato y miristato tritiado entre controles y pacientes con deficiencia de SCAD.
DISCUSIÓN
Durante la realización de los experimentos del presente trabajo, cada vez que era preparada una nueva mezcla radioactiva se obtenía mucha variabilidad en las dpm resultantes, probablemente debido a que la unión con la albúmina no era muy constante. Este hecho daba lugar a un rango de valores control muy amplio. Después de estudiar 20 controles, se decidió hacer cálculos en función de los controles paralelos, tal como lo sugirieron Olpin y cols. (14) (3 controles paralelos como mínimo). Los primeros trabajos basados en la medición del 14CO2 liberado por incubación de células con [1-14C]-ácidos grasos (15, 16, 17) para evaluar la oxidación de ácidos grasos fueron poco eficientes debido a que sólo una pequeña proporción (aproximadamente un 20%) de los grupos acetilo producidos por la β-oxidación se convierten inmediatamente a CO2, mientras que el remanente se incorpora a intermediarios metabólicos no volátiles (17). Posteriormente Rhead y Moon (17), desarrollaron un método de valoración de 3H2O en fibroblastos con ácidos grasos tritiados. Manning y cols. (8) postularon que [9,10)(n)-3H]-miristato posee claras ventajas sobre [9,10-3H]-palmitato para la detección de trastornos tales como la deficiencia de MCAD y las formas leves de la deficiencia MAD donde la β-oxidación se encuentra detenida a nivel de los sustratos con 8 átomos de carbono. Por otro lado, estos mismos autores demostraron que miristato es menos sensible que el palmitato para la detección de deficiencias específicas relacionadas con ácidos grasos de cadena larga. En el presente estudio encontramos deprimida la oxidación de sustratos tritiados en pacientes que presentan la deficiencia de SCAD, sin embargo, contrario a lo reportado por otros (18), en este caso, la oxidación del miristato no está más deprimida que la de palmitato.
Dentro de los métodos diagnósticos utilizados en el caso de la deficiencia de SCAD, también se encuentra la espectrometría de masas en tándem, mediante la cual se determinan las acilcarnitinas acumuladas en esta deficiencia. Las acilcarnitinas contienen un grupo funcional de amonio cuaternario, que hace que se comporten como iones positivos preformados (cationes) polares y no volátiles (19). Los butilésteres derivativos y no derivativos de la carnitina y las acilcarnitinas muestran un producto iónico común con una masa de 85 Da, lo cual permite identificarlos (20). En la deficiencia SCAD se detectan elevaciones en sangre de C4 y C6, sin embargo en Colombia no contamos con esta metodología para el diagnóstico de esta deficiencia.
Se puede concluir que la valoración de agua tritiada, es un buen método para sugerir una deficiencia acil-CoA deshidrogenasa de cadena corta, al encontrarse deprimida la oxidación de los ácidos grasos tritiados utilizados en el presente estudio.
REFERENCIAS
1. Amendt BA, Greene C, Sweetman L, Cloherty J, Shih V, Moon A, et al. Short-chain acyl-coenzyme A dehydrogenase deficiency. Clinical and biochemical studies in two patients. J Clin Invest 1987;79:1303-1309. [ Links ]
2. Corydon MJ, Vockley J, Rinaldo P, Rhead WJ, Kjeldsen M, Winter V, et al. Role of common gene variations in the molecular pathogenesis of short-chain acyl-CoA dehydrogenase deficiency. Pediatr Res 2001;49;1:18-23. [ Links ]
3. Rhead WL, Wolff JA, Lipson M, Falace P, Desai N, Fritchman K, et al. Clinical and biochemical variation and family studies in the multiple acyl-CoA dehydrogenation disorders. Pediatr Res 1987;21:371-376. [ Links ]
4. Rinaldo P, Welch RD, Previs SF, Schmidt-Sommerfeld E, Gargus JJ, O'Shea JJ, et al. Ethylmalonic/adipic aciduria: effect of oral medium chain triglycerides, carnitine and glycine on urinary excretion of organic acids, acylcarnitines and acylglycines. Pediatr Res 1991;30:216-221. [ Links ]
5. Gregersen N, Rhead W, Christensen E. (1990) Riboflavin responsive Glutaric Aciduria type II. In: Tanaka K, Coates PM, eds. Clinical, Biochemical and Molecular Aspects of Fatty Acid Oxidation. Alan R Liss Inc. New York: pp. 477-494. [ Links ]
6. Hegre CS, Halenz DR, Lane MD. The enzymatic carboxylation of butyryl-coenzyme A. J Am Chem Soc 1959;81:6526-6527. [ Links ]
7. Gregersen N, Winter VS, Corydon MJ, Corydon TJ, Rinaldo P, Ribes A, et al. Identification of four new mutations in the short-chain acyl-CoA dehydrogenase (SCAD) gene in two patients: one of the variant alleles, 511C-->T, is present at an unexpectedly high frequency in the general population, as was the case for 625G-->A, together conferring susceptibility to ethylmalonic aciduria. Hum Mol Genet 1998;7(4):619-27. [ Links ]
8. Christensen E, Brandt NJ, Schmalbruch H, Kamieniecka Z, Hertz B, Ruitenbeek W. Muscle cytochrome C oxidase deficiency accompanied by a urinary organic acid pattern mimicking multiple acyl-CoA dehydrogenase deficiency. J Inherit Metab Dis 1993;16:553-556. [ Links ]
9. García-Silva MT, Ribes A, Campos Y, Garavaglia B, Arenas J. Syndrome of encephalopathy, petechiae, and ethylmalonic aciduria. Pediatr Neurol 1997;17(2):165-70. [ Links ]
10. Tanaka K, Kean EA, Johnson B. Jamaican vomiting sickness: Biochemical investigation of two cases. New Engl J Med 1976;295:461-467. [ Links ]
11. Osorio JH. Patología molecular de los errores hereditarios de la  -oxidación mitocondrial de los ácidos grasos: alcances en el diagnóstico y tratamiento. Biosalud 2006;5:71-83. [ Links ]
-oxidación mitocondrial de los ácidos grasos: alcances en el diagnóstico y tratamiento. Biosalud 2006;5:71-83. [ Links ]
12. Lowry OH, Rosebrough NJ, Farr Al, Randall RJ. Protein measurement with the Folin phenol reagent. J Biol Chem 1951;193:265-275. [ Links ]
13. Manning NJ, Olpin SE, Pollit RJ, Webley JA. Comparison of 9.10-3HPalmitic and 9.10-3Hmyristic acids for the detection of defects of fatty acid oxidation in intact cultured fibroblasts. J Inher Metab Dis 1990;13:58-68. [ Links ]
14. Olpin SE, Manning NJ, Carpenter K, Middleton B, Pollit RJ. Differential diagnosis of hydroxydicarboxylic aciduria based on release of 3H2O from (9,10-3H)-myristic and (9,10-3H)-palmitic acids by intact cultured fibroblasts. J Inher Metab Dis 1992;15:883-890. [ Links ]
15. Kolvraa S, Gregersen N, Christiensen E, Hobolth N. In vitro fibroblasts studies in a patient with C6-C10 dicarboxilic aciduria: evidence for a defect in general acyl-CoA dehydrogenase. Clin Chim Acta 1982;126: 53-67. [ Links ]
16. Saudubray JM, Coude FX, Demaugre F, Johnson C, Gibson KM, Nyhan WL. Oxidation of fatty acids in cultured fibroblasts: a model system for the detection and study of defects in oxidation. Pediatr Res 1982;16:877-881. [ Links ]
17. Rhead WJ, Moon A, Oettger V, Henkle K. 14CO2-Labelled sustrate catabolism by human diploid fibroblasts derived from infants and adults. Biochem Med 1985;34:182-188. [ Links ]
18. Veerkamp JH, Van Moerkerk HTB, Glatz JFC, Zuurveld JGEM, Jacobs AEM, et al. 14CO2 production is no measure of (14C)fatty acid oxidation. Biochem. Med Metab Biol 1986;16:248-259. [ Links ]
19. Zytkovicz TH, Fitzgerald EF, Marsden D, Larson CA, Shih VE, Johnson DM, et al. Tandem mass spectrometric analysis for amino, organic, and fatty acid disorders in newborn dried blood spots: a twoyear summary from the New England newborn screening program. Clin Chem 2001;47:194-195. [ Links ]
20. Levy HL. Newborn screening by tandem mass spectrometry: a new era. Clin Chem 1998;44:24012. [ Links ]