Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Biosalud
versão impressa ISSN 1657-9550
Biosalud v.8 n.1 Manizales jan./dez. 2009
EL DIAGNÓSTICO DE LA LEISHMANIASIS VISCERAL CANINA: DILEMAS Y RETOS
THE DIAGNOSIS OF CANINE VISCERAL LEISHMANIASIS: DILEMMAS AND CHALLENGES
Marlyn Hellen Romero Peñuela1 y Jorge Alberto Sánchez Valencia1
1 Profesores Departamento Salud Animal, Facultad de Ciencias Agropecuarias, Universidad de Caldas, Calle 65 No. 26-10 Manizales, Tele-fax: 8781516. marlyn.romero@ucaldas.edu.co, jorge.sanchez@ucaldas.edu.co.
Recibido: octubre 01 de 2009 - Aceptado: noviembre 19 de 2009
RESUMEN
La leishmaniasis visceral (LV) es una enfermedad infecciosa de evolución crónica, causada por un protozoario, Leishmania infantum, que afecta al hombre y a los caninos; es transmitida principalmente por la picadura del vector Lutzomyia longipalpis, con incriminación de Lutzomyia evansi en partes de Colombia y Venezuela. El perro actúa como el principal reservorio doméstico del parásito en todo el mundo, haciendo parte del ciclo epidemiológico de transmisión humana. Dada la importancia epidemiológica de los caninos en el control de la LV y la necesidad de determinar el impacto real de la infección en las zonas endémicas, es fundamental el empleo de pruebas diagnósticas eficientes, que no subestimen la incidencia, ni la prevalencia de la enfermedad, y que permitan además obtener resultados confiables, que minimicen las reacciones falsas positivas y la reacción cruzada con otros parásitos relacionados. El presente artículo revisa las técnicas diagnósticas para la leishmaniasis visceral canina (LVC) y establece de forma general algunas prioridades de investigación y desarrollo en esta área.
PALABRAS CLAVE: Leishmania infantum, leishmaniasis visceral canina, pruebas diagnósticas.
ABSTRACT
Visceral leishmaniasis is an infectious disease of chronic evolution caused by the protozoan Leishmania infantum (Leishmania chagasi), which affects humans and canines. It is transmitted mainly by the vector Lutzomyia longipalpis, with incrimination of Lutzomyia evansi in parts of Colombia and Venezuela. Dogs are considered the main domestic reservoir of the parasite, constituting part of the epidemiological cycle of human transmission. Given the epidemiological importance of canines in the control of visceral Leishmaniasis and the need to determine the real impact of the infection in the endemic areas, the employment of diagnostic efficient tests is fundamental. These tests shouldn't underestimate the incidence, or the prevalence of the disease; they should also allow the obtainment of reliable results that minimize the false-positive reactions and the cross-reactions with other related parasites. The present article revises the diagnostic methods for canine visceral leishmaniasis and establishes some research and development priorities in this topic.
KEY WORDS: Leishmania infantum, canine visceral leishmaniasis, diagnostic tools.
INTRODUCCIÓN
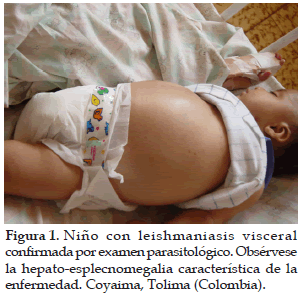
La leishmaniasis visceral zoonótica (LVZ) es una de las 10 enfermedades de interés que la Organización Mundial de Salud Animal (OIE) ha definido dentro de sus prioridades, porque los casos se han incrementado por su asociación con el VIH-SIDA, especialmente en el África y América del Sur (1, 2), reportándose cerca de 500.000 casos nuevos anuales en el mundo (2). La LVZ en América es una enfermedad sistémica causada por protozoarios intracelulares del género Leishmania infantum (=L. chagasi) y transmitida por la picadura de insectos flebotomíneos del género Lutzomyia (Lu.) longipalpis y esporádicamente Lu. evansi en América (3, 4, 5). La LVZ es endémica en Colombia, pero el mayor número de casos se presentan en los departamentos de Córdoba, Sucre, Bolívar, Tolima y Huila (6). Los reservorios de mayor importancia son Didelphis marsupialis (chucha, fara, runcho) y Canis familiares (4, 7, 8). La enfermedad afecta principalmente a niños menores de 5 años (Figura 1) y a pacientes inmunosuprimidos (3, 9, 10), produciendo una letalidad del 95% cuando no es tratada a tiempo (11, 12, 13). Así mismo, la enfermedad en los caninos, presenta repercusiones en la salud pública, por su carácter zoonótico y por la dificultad de realizar un diagnóstico precoz, por el riesgo que representan en la transmisión de la enfermedad los animales asintomáticos y la relativa falta de eficiencia del tratamiento, que hacen de la enfermedad un problema importante en las zonas en donde los caninos infectados, se convierten en la principal fuente de infección (2, 11, 14).
No sólo a los perros domésticos, sino a los cánidos en general, se les ha reconocido su papel como eficientes reservorios de L. infantum, porque permiten el mantenimiento del ciclo de transmisión de los parásitos en su calidad de portadores (5, 15). Debido al estrecho contacto con el hombre, el perro ha sido implicado como el reservorio doméstico más importante de L. infantum en China, el Mediterráneo y las Américas (15). Los criterios que se han tenido en cuenta para definirlo como "reservorio doméstico" son: a) alta susceptibilidad al parásito; b) en las áreas en donde la LVZ es endémica, la prevalencia de la infección canina es alta, con una elevada proporción de animales asintomáticos; c) debido a su permanencia en la vivienda y en el peridomicilio, favorece el mantenimiento del ciclo de transmisión; d) pueden permanecer en condición de portador, sin mostrar signos clínicos de LVC durante muchos años, o durante toda su vida; e) el Zymodemo MON-1 de L. infantum responsable de la mayoría de los casos de LVZ en el Mediterráneo, ha sido aislado con mayor frecuencia en esta especie (15).
Dada la importancia epidemiológica de los caninos en la transmisión de la LVZ en las zonas endémicas, es fundamental seleccionar las pruebas utilizadas para el diagnóstico precoz de la enfermedad, como soporte a las estrategias de control. Tradicionalmente los métodos de control de la LVZ se han basado en cuatro estrategias: a) búsqueda activa de casos; b) el tratamiento de las personas afectadas; c) disminución de la densidad del vector, y d) control de los reservorios domésticos (identificación y eliminación de caninos infectados) (6, 10, 14, 16).
El presente artículo tiene como objetivo realizar una revisión sobre las principales metodologías utilizadas para el diagnóstico de la leishmaniasis visceral canina (LVC) y hacer una discusión crítica al respecto, a fin de orientar la selección de las técnicas diagnósticas, conocer sus limitaciones y los retos que tenemos los profesionales de la salud en la investigación en este tópico.
El diagnóstico de la LVC
Debido a la variedad de signos clínicos presentes en la leishmaniasis visceral canina el diagnóstico es complejo e impreciso, motivo por el cual se han desarrollado variados procedimientos para facilitar esta tarea. Es esencial el conocimiento de las bases de cada prueba, sus limitaciones y su interpretación clínica, teniendo en cuenta además que se recomienda el uso de más de una prueba diagnóstica (17, 18). El diagnóstico definitivo algunas veces depende del aislamiento del parásito en medios de cultivo o por la detección del DNA parasitario por la técnica PCR a partir de biopsias de médula ósea o nódulos linfáticos. Sin embargo estas técnicas son invasivas, costosas y requieren mucho tiempo para su desarrollo (19, 20). A continuación se describen los métodos más viables para ser usados en nuestro medio.
Diagnóstico clínico
La leishmaniasis visceral canina presenta un extraordinario pleomorfismo de signos clínicos, que se caracterizan por formas latentes asintomáticas hasta formas patentes agudas, subagudas o crónicas regresivas, cuyas manifestaciones dependen de la fase de infección, del estado inmunológico del hospedero y de si se instauró o no un tratamiento específico previo (21, 22). Las formas latentes son las más comunes y se asocian con una adecuada respuesta inmunológica de tipo celular por parte del canino infectado, lo contrario sucede en las formas agudas o crónicas donde se ha deteriorado la respuesta celular frente al parásito a pesar de existir una marcada respuesta inmune de tipo humoral (21, 23, 24).
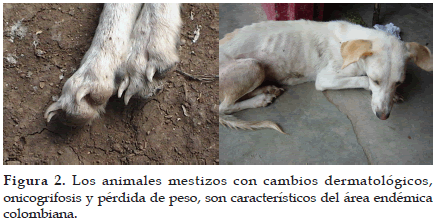
El periodo de incubación es variable, oscila entre 30 días hasta varios años, aún en los casos experimentales. Después del periodo de incubación, la infección se disemina e involucra progresivamente los tejidos subcutáneo, linfático, médula ósea y finalmente órganos internos como el hígado y el bazo (23, 24). En los casos agudos se presenta únicamente fiebre (temperaturas mayores a 40°C) y linfadenomegalia (24). Los signos clínicos encontrados más frecuentes son linfadenomegalia, pérdida de peso, cambios dermatológicos, que incluyen alopecia con desecación y escamación excesiva, así como úlceras en orejas y extremidades (25) (Figura 2). Se observa además, crecimiento excesivo de las uñas (onicogrifosis) y edema de las extremidades, cara y abdomen (22, 26).
A pesar de que los tejidos más afectados durante el desarrollo de la enfermedad son la piel, el hígado, el bazo, la médula ósea y los ganglios linfáticos, es posible encontrar lesiones oculares que involucran principalmente la cámara anterior del ojo y cuyas manifestaciones más comunes son queratoconjuntivitis seca, reducción en la secreción del aparato lagrimal por efecto directo del parásito e inflamación de tipo granulomatoso en todas las estructuras internas del ojo, especialmente el iris (24).
A nivel gastrointestinal se presenta gastritis y enteritis hemorrágica especialmente a nivel del colon. Dentro del cuadro hemorrágico no sólo está involucrado el tracto gastrointestinal ya que se han descrito epistaxis, hematuria y pancreatitis hemorrágica. Todas estas manifestaciones producto de disturbios en la hemostasis primaria causados por vasculitis, trombocitopenias y defectos en la función plaquetaria (16, 23).
A nivel renal debido a la deposición de complejos inmunes, IgG y fracción C3 del complemento a nivel de la membrana basal glomerular y áreas mesangiales se producen alteraciones como glomerulonefritis, nefritis intersticial, nefropatía tubular y amiloidosis, lesiones que debido a la alta capacidad compensatoria del riñón no alteran parámetros de función renal básicos como nitrógeno ureico sanguíneo y creatinina. No obstante, el daño tisular incrementa la excreción de enzimas urinarias como γ-glutamiltranspeptidasa, N-acetil-β-D-glucosamidasa y β-glucoronidasa, las cuales pueden emplearse para el diagnóstico del daño renal en los caninos infectados (16, 23, 25).
La disminución de parámetros clínico patológicos como el hematocrito, los recuentos de plaquetas y los recuentos totales de células blancas no son constantes en los caninos enfermos, mientras que la inversión de la relación albúmina-globulina es común en los casos crónicos debido al marcado deterioro del animal y al fuerte incremento en los niveles de gamaglobulinas (16, 23, 26). En estados terminales, los caninos manifiestan deterioro marcado del estado general, emaciación y finalmente caquexia (16, 21, 23).
Desde el punto de vista clínico y epidemiológico varios investigadores han propuesto un criterio para caracterizar el examen físico de los caninos. Un canino con dos o más signos clínicos de LVC como pérdida de peso, dermatitis, alopecia, úlceras en boca y piel, onicogrifosis, artritis y conjuntivitis, es clasificado como polisintomático; mientras que un animal que presente sólo un signo clínico se define como oligosintomático, y el que no presente ninguno, asintomático (2, 7, 8, 27).
Debido al cuadro clínico variado e inespecífico, es necesario hacer diagnóstico diferencial con otras enfermedades infecciosas y desórdenes inmunomediados; además, se ha demostrado que no existe asociación entre los signos clínicos y los resultados serológicos, por tanto se recomienda que el examen médico de los animales sospechosos de sufrir LVC, no puede ser tenido en cuenta como criterio único para la definición de caso sospechoso o definitivo, siendo necesario para tal fin, emplear pruebas diagnósticas complementarias (28).
Métodos parasitológicos
Son los métodos más antiguos usados en la detección de amastigotes en frotis teñidos de aspirados de médula espinal, bazo, hígado o nódulos linfáticos, implementados para el diagnóstico humano y canino a partir de los años 30 (12). Las impresiones citológicas se pueden realizar también con lesiones mucosas o dermales. Las técnicas inmunohistoquímicas para detectar Leishmania en tejidos seccionados (normalmente biopsias de piel) también son usadas. La limitación de este método de diagnóstico, es que es invasivo y poco exitoso para detectar parásitos en caninos asintomáticos (19, 20). Sin embargo, en estudios efectuados en Brasil se hizo el diagnóstico directo usando biopsias de piel tomadas de las orejas y de la región sub-escapular de caninos seropositivos para L. infantum, sugiriéndose que la piel intacta puede ser una buena muestra para efectuar la confirmación de la infección (29). Investigadores colombianos usando el examen parasitológico directo, mediante el frotis de linfa obtenida del ganglio poplíteo, han demostrado que presenta una alta especificidad, pero una sensibilidad inferior al 26%, siendo necesario incluirlo como prueba complementaria al examen físico del animal, y de otras técnicas diagnósticas (28, 30).
Métodos serológicos
Teniendo en cuenta que el espectro clínico y la respuesta celular en LVC son muy variables, y que las pruebas parasitológicas directas son muy poco sensibles, las pruebas serológicas se constituyen en una herramienta esencial para detectar portadores asintomáticos y monitorear el esquema de control (17). Los métodos serológicos sugieren la presencia de parásitos a partir de la detección de los anticuerpos circulantes en el suero de los caninos sospechosos, los cuales pueden persistir durante años en los caninos que no manifiesten la enfermedad clínica y son fundamentales en el diagnóstico de LVC en los casos de infecciones tempranas y en evaluaciones epidemiológicas dirigidas a controlar individuos infectados en áreas endémicas, así como para establecer la seroprevalencia, debido al largo período de incubación y a las características de cronicidad de la enfermedad (31, 32, 33). Este grupo incluye las técnicas: Inmunofluorescencia indirecta (IFI), Aglutinación directa, Inmunoensayo ligado a enzimas (ELISA), ELISA competitiva, Dot-ELISA, Inmunodifusión y Western Blot (WB). Procederemos a describir las técnicas más usadas en Colombia: IFI, ELISA y WB (7, 8, 28, 30).
Inmunofluorescencia indirecta (IFI)
Esta técnica empezó a ser utilizada para el diagnóstico de la LVC a partir de la década de los 60, y desde entonces ha sido reconocida universalmente como la "prueba de oro", así mismo, es la técnica recomendada en el Manual de pruebas diagnósticas de la Organización Mundial de Salud Animal (OIE) (34). Se ha reportado que presenta buenos valores de sensibilidad (varía entre el 90 y el 100%) y especificidad (80%) (12), pero en estudios realizados en Colombia, usando antígenos totales de la cepa colombiana de Leishmania infantum (infantum) MHOM/CO/CL044B en animales experimentalmente infectados y procedentes de zona endémica (35), se establecieron valores de sensibilidad y especificidad más bajos. La baja especificidad de IFI es debida a la presencia de reacciones cruzadas con enfermedades causadas por otros tripanosomátidos como la enfermedad de Chagas y la leishmaniasis tegumentaria (11, 12, 17). Se ha propuesto el uso de formas amastigotas de Leishmania donovani, como antígeno, aumentando significativamente la sensibilidad, sin perder la especificidad de la prueba, aspectos que han permitido sugerirla para el diagnóstico precoz de animales asintomáticos y oligosintomáticos, y para realizar el monitoreo de la evaluación clínica de animales tratados (12, 17).
Como ventajas de IFI se han citado: su facilidad de ejecución, rapidez en la emisión de los resultados y bajo costo. Los inconvenientes que presenta, están relacionados con su precisión (27). Los valores predictivos son indicadores utilizados para la interpretación de resultados de las pruebas de diagnóstico, siendo influenciados por los valores de sensibilidad y especificidad de éstas. Teniendo en cuenta los valores de sensibilidad y especificidad de la prueba de IFI, los autores afirman que existe una elevada confianza en un resultado negativo de un animal, porque el valor predictivo negativo de la prueba es alto; a diferencia de lo que se puede afirmar, cuando un canino presenta un resultado positivo para LVC, porque la técnica permite identificar un alto número de animales falsos positivos, debido a su baja especificidad (12, 15).
Otro aspecto importante que debe ser tenido en cuenta para evaluar una técnica diagnóstica, es el límite de reactividad o el punto de corte (cut off), que se entiende como la región de corte de los resultados de una prueba serológica, es decir el valor a partir del cual se considera un resultado positivo (36). Se ha sugerido que no hay consenso sobre las diluciones a las cuales un suero puede ser considerado positivo usando la prueba de IFI. Los reportes presentan títulos que varían entre 1/20 hasta 1/160, sugiriendo la existencia de una zona gris, es decir, títulos cercanos al punto de corte; indicando que estos bajos títulos pueden ocurrir debido a reacciones cruzadas, formas resolutivas o latentes de la infección o baja respuesta humoral en el animal o contacto con diferentes parásitos hospederos (infecciones mixtas) (31, 37). En el caso que se den estas situaciones, es necesario confirmar el resultado con otra prueba convencional para asegurar el verdadero diagnóstico del paciente (36).
Así mismo, en la prueba IFI se utilizan preparaciones de antígenos crudos, que no pueden ser correlacionados con el nivel de parasitismo, ni con el estatus de la infección de los caninos de las zonas endémicas (31). Otra de las desventajas descritas para esta técnica, es que no tiene ningún valor la titulación obtenida sobre la progresión de la enfermedad, no revela la intensidad de transmisión por parte de los reservorios caninos y no discrimina los caninos susceptibles de aquellos resistentes (32, 33).
Inmunoensayo ligado a enzimas (ELISA)
La prueba ELISA se empezó a utilizar en el diagnóstico de la LVC en la década de los 70, teniendo variaciones de Dot-ELISA, Ligandos de Fucosa Manosa-ELISA (FML-ELISA), mucina submaxiliar bovina-ELISA (BSM-ELISA), Fast ELISA, micro ELISA, entre otras (38). Esta prueba ha presentado valores de sensiblidad que oscilan entre el 85 y el 96% y de especificidad del 86% al 98%, valores muy similares a los presentados por la prueba IFI (7, 39, 40). La utilización de antígenos recombinantes o purificados como las glicoproteínas de membrana (gp63, gp72 o rK39) específicas del género Leishmania, han mejorado la sensibilidad y especificidad de la técnica (32, 41, 42).
Las variaciones en la sensibilidad y especificidad de la prueba de ELISA se deben a modificaciones introducidas en la preparación de los antígenos completos o el empleo de antígenos purificados recombinantes (38). Las preparaciones de antígenos crudos elaboradas con promastigotes completos o sus extractos solubles limitan la estandarización de las pruebas y la reproducibilidad de los resultados (40, 41, 42, 43). Los antígenos crudos son derivados de promastigotes cultivados in vitro y consisten en una amplia variedad de antígenos somáticos y componentes de superficie. Se ha reportado además, que la prueba de ELISA permite la reacción antigénica cruzada entre Leishmania spp. y Trypanosoma cruzi, aportando información epidemiológica confusa que interfiere en el diagnóstico específico y el tratamiento (43, 44).
La técnica ELISA usando antígeno crudo colombiano, ha demostrado en trabajos recientes valores de sensibilidad y especificidad bajos del 51,5% y 57,5%, respectivamente (35); de otra parte, identificó el 37,5% de animales evaluados como seropositivos cuando se procesaron sueros provenientes de zona no endémica para la leishmaniasis visceral; aspectos que favorecen la aparición de animales tanto falsos negativos, como falsos positivos (43, 44). Así mismo, se ha descrito que ELISA es una prueba sensible para diagnosticar la infección en caninos infectados, pero es menos sensible para los caninos en el período de latencia de la enfermedad (45).
Western Blot (WB)
La prueba de inmunoblot ha sido propuesta para el estudio de LVC en trabajos experimentales y de campo, porque las fracciones antigénicas obtenidas con esta prueba, permitirían detectar animales infectados y discriminar las fases iniciales de la infección (46, 47). A pesar de que con esta técnica se han desarrollado numerosos estudios con animales experimentalmente infectados, son escasos los realizados en zonas endémicas de América con L. infantum y aún no existe consenso en cuanto al patrón de reconocimiento antigénico requerido para obtener valores altos de sensibilidad y especificidad (31, 47). Se han descrito como desventajas del WB, que es una técnica que requiere de experiencia para su desarrollo y que está limitada a investigaciones de laboratorio, no siendo aplicable como rutina de diagnóstico (1).
Se han sugerido patrones de reconocimiento antigénico obtenidos por WB, relacionados con antígenos de bajo peso molecular, descritos como muy sensibles en el diagnóstico de los casos asintomáticos de LVC, reportando que aparecen mucho antes que los títulos de seropositividad establecidos por las pruebas de IFI y ELISA. Posiblemente estas mismas bandas, permitirían evaluar la evolución del tratamiento de la enfermedad, porque desaparecen cuando el tratamiento es efectivo o cuando se presenta mejora del estado clínico del canino (46).
Usando animales provenientes de zonas endémicas de LVC en España, se estableció que los caninos con la infección natural, presentan anticuerpos que revelan entre 3 y 33 fragmentos de polipéptidos del antígeno de Leishmania con una masa molecular que se encuentra en el rango entre 12 y 85 kDa. Las bandas de mayor sensibilidad fueron la 70, 65, 46, 30, 28, 14 y 12 kda. Los autores consideran que en la prueba de WB, un resultado se toma como positivo, cuando una de las bandas de 46, 30, 28, 14 y 12 kDa está presente. La identificación de las bandas de fracciones antigénicas de 12 y 14 kDa en caninos, pueden ser usadas para detectar fases tempranas de la enfermedad, permitiendo realizar el seguimiento y la evaluación de la resolución de la enfermedad (31). Similares resultados se han observado en Colombia, donde recientemente fue estandarizada (35), sugiriéndose que proteínas con pesos moleculares de 14 y 29 kDa podrían ser potencialmente diagnósticas y permitirían desarrollar un antígeno recombinante con una alta especificidad, para discriminar caninos infectados y no infectados localizados en las zonas endémicas (28, 35).
Métodos moleculares
El uso conjunto de la Reacción de la Cadena de la Polymerasa (PCR) y las pruebas serológicas, pueden ayudar a determinar la extensión de la infecciones subclínicas y permiten estimar el número de caninos objeto del programa de control (48). Mientras que el diagnóstico por PCR para la LV en humanos puede ser considerado como eficiente, el diagnóstico de la enfermedad en caninos, sigue presentando inconvenientes, debido por ejemplo, al desconocimiento del tejido que ofrezca más información para ser muestreado, las dificultades encontradas en la preparación del DNA o la alta frecuencia de inhibidores del PCR en presencia de la sangre canina (19).
El uso del PCR para la identificación de DNA de Leishmania spp. en muestras de tejidos de perros, es desarrollada usando primers para amplificar la secuencia del gen de la subunidad pequeña rRNA de Leishmania y la región constante del DNA del kinetoplasto (5, 49), siendo esta última, la más sensible para la detección de Leishmania en caninos asintomáticos (8, 49, 50). Muchos tejidos han sido estudiados: nódulos linfáticos, aspirados de médula ósea, sangre completa, biopsias de piel embebidas en parafina, piel congelada, conjuntiva del ojo, con resultados variados (8, 49, 50).
El PCR basado en médula ósea, nódulos linfáticos y muestras de piel, han sido las muestras diagnósticas con mayor sensibilidad y especificidad para el diagnóstico de la LVC (50). Sin embargo, se recomienda el uso de sangre periférica, porque su obtención requiere de técnicas poco invasivas, produciendo bajo estrés en los animales, facilita su reproducibilidad y su efectividad ha sido demostrada en el diagnóstico molecular en población humana. Su uso en caninos se recomienda porque se ha demostrado la circulación del parásito en sangre periférica (49, 50).
Las técnicas moleculares han demostrado ser técnicas más sensibles que otros métodos parasitológicos como citologías teñidas o el cultivo del parásito (19, 51); aunque otros autores indican, que el uso de médula ósea como muestra para el desarrollo de PCR no es apropiado, por los bajos valores de sensibilidad obtenidos (49). El PCR combinado con sondas específicas de DNA pueden ser herramientas sensibles, en comparación con el aislamiento y la caracterización de parásitos (48, 50). Estudios observacionales prospectivos han demostrado que existe una asociación positiva entre la presencia de signos clínicos de LVC y los resultados positivos por PCR, estando relacionados con las formas clínicas severas (51).
PERSPECTIVAS DE INVESTIGACIÓN
La selección de la "prueba de oro" para el diagnóstico de la LVC continúa sin resolver, más aún, cuando investigadores han indicado que la proporción de portadores asintomáticos de Leishmania en la población canina, puede ser mayor a la previamente descrita. La evolución de estos portadores asintomáticos dentro de la categoría de animales "resistentes" o "clínicamente enfermos", es muy importante, por su rol en el mantenimiento de la endemicidad de la enfermedad. Por tal motivo, se hace necesario desarrollar nuevas pruebas diagnósticas, rápidas, de bajo costo y aplicables a nivel de campo; el Cuadro 1, presenta una breve reseña sobre los requerimientos en este campo.
Es conveniente además, evaluar la aplicabilidad de las nuevas técnicas diagnósticas a las condiciones de campo propias de cada área afectada. Las técnicas de PCR deben ser estandarizadas y hacerlas disponibles comercialmente, para evaluar el nivel parasitario y el seguimiento del tratamiento, éste último en aquellos países donde el tratamiento de los caninos es posible. Adicionalmente, se requieren pruebas rápidas que puedan incrementar la capacidad de diagnóstico de los médicos veterinarios involucrados en los trabajos de campo. El diagnóstico de caninos asintomáticos puede disminuir significativamente el promedio de duración de su capacidad infectante y reducir el riesgo de transmisión de los parásitos a otros caninos, permitiendo un mejor control de la infección en los perros e indirectamente en el hombre.
BIBLIOGRAFÍA
1. Ferroglio, F, Centaro E, Mignone W, Trisciuoglio A. Evaluation of an ELISA rapid device for the serological diagnosis of Leishmania infantum infection in dog as compared with immunofluorescence assay and Western blot. Vet. Parasitol. 2007;144:162-166. [ Links ]
2. Dantas-Torres F, Brandão-Filho SP. Visceral leishmaniasis in Brazil: revisiting paradigms of epidemiology and control. Rev. Inst. Med. Trop. Sao Paulo 2006;48(3):151-156. [ Links ]
3. Chappuis F, Sundar S, Hailu A, Chalib H, Rijai S, Peeling RW, et al. Visceral leishmaniasis: what are the needs for diagnosis, treatment and control? Nature Reviews/Microbiol 2007;5:873-882. [ Links ]
4. Corredor A, Álvarez CA, Agudelo CA, Bueno M, López MC, Cáceres E, et al. Prevalence of Trypanosoma cruzi and Leishmania chagasi infection and risk factors in a Colombian indigenous population. Rev. Inst. Med. Trop. Sao Paulo 1999;41(4):229-234. [ Links ]
5. Travi B. Un enfoque integral al estudio de animales reservorios, con énfasis en las Leishmaniosis del Nuevo mundo. Med UIS 1998;12:311-315. [ Links ]
6. Ministerio de la Protección Social de Colombia. Guía de Atención de la leishmaniasis; 2006 pp:35. [ Links ]
7. Travi B, Tabares C, Cadena H, Ferro C, Osorio Y. Canine Visceral Leishmaniasis in Colombia: relationship between clinical and parasitologic status and infectivity for sand flies. Am. J. Trop. Med. Hyg. 2001;64(3,4):119-124. [ Links ]
8. Travi B, Ferro C, Cadena H, Montoya-Lerma J, Adler GH. Canine visceral leishmaniasis: dog infectivity to sand flies from non-endemic areas. Res Vet Sci 2002;72(1):83-86. [ Links ]
9. Cascio A, Calattini S, Colomba C, Scalamogna Ch, Galazzi M, Pizzuto M, et al. Polymerase chain reaction in the diagnosis and prognosis of Mediterranean visceral leishmaniasis in immunocompetent children. Pediatrics 2002;9(2):1-5. [ Links ]
10. Zerpa O, Ulrich M, Borges R, Rodríguez V, Centeno M, Negrón E, Belizario D, Convit J. Epidemiological aspects of human and canine visceral leishmaniasis in Venezuela. Pan Am J Public Health 2003;13(4):239-245. [ Links ]
11. Savani E, Schimonsky BV, Camargo OMC, D'auria SR. Surveillance of American visceral Leishmaniasis in dogs from a non-endemic area, Brazil. Rev Saude Pública 2003;37(2):260-262. [ Links ]
12. Alves, W.A.; Bevilacqua, P.D. Quality of diagnosis of canine visceral Leishmaniasis in epidemiological surveys: an epidemic in Belo Horizonte, Minas Gerais, Brazil, 1993-1997. Cad. Saude Pública 2004;20(1):259-265. [ Links ]
13. Mueller Y, Mbulamberi DB; Odermatt P, Hoffmann A; Loutan L, Chappuis F. Risk factors for in-hospital mortality of visceral leishmaniasis patients in eastern Uganda. Trop Med Int Health 2009;14(8):910-917. [ Links ]
14. Solano-Gallego L, LLul J, Ramis A, Fernández-Bellon H, Rodríguez A, Ferrer LL, et al. Longitudinal study of dogs living in ana rea of Spain highly endemic for leishmaniasis by serologic análisis and the leishmanin skin test. Am. J. Trop. Med. Hyg. 2005;72(6):815-818. [ Links ]
16. Marzochi MC, Marzochi KBF. Tegumentary and Visceral Leishmaniases in Brazil. Emerging Anthropozoonosis and Possibilities for their control. Cad. Saude Pública 1994;10(Supl 2):359-375. [ Links ]
17. Troncarelli MZ, Camargo JB, Machado JG, Lucheis SB, Langoni H. Leishmania spp. And/or Trypanosoma cruzi diagnosis in dogs from endemic and nonendemic areas for canine visceral leishmaniasis. Vet Parasitol 2009;164(2-4):118-123. [ Links ]
18. Palatnik-De-Sousa CB, Wania R, Franca-Silva JC, Da Costa RT, Reis BA, Palatnik M, Mayrink W, Genaro O. Impact of canine control on the epidemiology of canine and human visceral Leishmaniasis in Brazil. The Am Soc Trop Med Hyg 2001;65(5):510-517. [ Links ]
19. Lachaud L; Marchergui-Hammami S, Chabbert E, Dereure J, Dedet JP, Bastien P. Comparison of six PCR methods using peripheral blood for detection of Canine Visceral Leishmaniasis. J Clin Microbiol 2001;40(1):210-215. [ Links ]
20. Mettler M, Grimm F, Capelli G, Camp H, Deplazes P. Evaluation of enzyme-linked immunosorbent assays, an immunofluorescent-antibody test, and two rapid tests (immunochoromatographic-dipstick and gel tests) for serological diagnosis of symptomatic and asymptomatic Leishmania infections in dogs. J Clin Microbiol 2005;43(11):5515-5519. [ Links ]
21. Pinelli E, Killick-Kendrick R, Wagenaar J, Bernadina W, Del Real G, Ruitenberg J. Cellular and Humoral immune responses in dogs experimentally and naturally infected with Leishmania infantum. Infect Immun 1994;62(1):229-235. [ Links ]
22. Moreira MA, Luvizotto MC, García JF, Corbett CE, Laurenti MD. Comparison of parasitological, immunological and molecular methods for the diagnosis of Leishmaniasis in dogs with different clinical signs. Vet Parasitol 2007;145(3-4): 245-252. [ Links ]
23. Binhazim A, Chpman Jr, Shin S, Hanson W. Determination of virulence and pathogenesis of canine strain of Leishmania leishmania infantum in hamsters and dogs. Am J Vet R 1993;54:13-120. [ Links ]
24. Ciaramella P; Oliva G, De Luna R, Gradoni R, Ambrosio R, Cortese L, et al. A retrospective clinical study of canine leishmaniosis in 150 dogs naturally infected by Leishmania infantum. Vet Rec 1997;141(21):539-543. [ Links ]
25. Dias El; Batista ZDS, Guerra RMS, Calabrese KDS, Lima T, Abreu-Silva AL. Canine visceral Leishmaniasis (CVL): Seroprevalence, clinical, hematological and biochemical findings of dogs naturally infected in an endemic area of São José de Ribamar municipality, Marahão State, Brazil. Ciênc. Anim. Bras. 2008;9(3):740-745. [ Links ]
26. Troncarelli MZ, Camargo JB, Machado JG, Lucheis SB, Langoni H. Leishmania spp. And/or Trypanosoma cruzi diagnosis in dogs from endemic and noendemic areas for canine visceral leishmaniasis. Vet Parasitol 2009;164(2-4):118-123. [ Links ]
27. Silva AV, Paula AA, Cabrera MA, Carreira JC. Leishmaniasis in domestic dogs: epidemiological aspects. Cad. Saude Pública 2005;21(1):324-328. [ Links ]
28. Romero MH, López MC, Echeverry MC, Rivas F. Leishmaniasis visceral canina: pruebas diagnósticas no identifican estados reales de la infección. Rev. Salud Pública 2008;10(2):290-298. [ Links ]
29. Madeira MF, Figueiredo FB, Pinto AGS, Nascimento LD, Furtado M, Mouta-Confort E, et al. Parasitological diagnosis of canine visceral leishmaniasis: Is intact skin a good target? Res Vet Sci 2009;87(2):260-272. [ Links ]
30. Fernández J, Bello F, López MC, Moncada LI, Vargas JJ, Ayala MS, Nicholls RS, Lozano CA. Seroprevalencia de la leishmaniasis visceral canina en la comuna 8 de Neiva y en cuatro municipios del Huila, Colombia. Biomédica 2006;26(Supl 1):121-130. [ Links ]
31. Aisa J, Castellejo S, Gallego M, Fisa R, Riera MC, Colmenares M, et al. Diagnostic potencial of western blot analysis of sera from dogs with Leishmaniasis in endemic areas and significance of the pattern. Am. J. Trop. Med. Hyg. 1998;58(2):54-159. [ Links ]
32. Vercammen F, Fernández-Pérez FJ, Amo C, Alunda JM. Follow-up of Leishmania infantum naturally infected dogs treated with allopurinol: immunofluorescence antibody test, ELISA and Western blot. Acta Trop 2002;84(3):175-181. [ Links ]
33. Iniesta L, Fernández-Barredo S, Bulle B, Gómez MT, Piarroux R, Gállego M, et al. Diagnostic techniques to detect Cryptic Leishmaniasis in dogs. Clin Diagn Lab Immunol 2002;9(5):1137-1141. [ Links ]
34. Gomes YM, Paiva Cavalcanti M, Lira RA, Abath FG, Alves LC. Diagnosis of canine visceral leishmaniasis: Biotechnological advances. Vet J. 2008;175(1):45-52. [ Links ]
35. Vargas JJ. Inmunodiagnóstico de la leishmaniosis visceral zoonótica en caninos infectados con Leishmania (leishmania) chagasi. Tesis de Maestría, Facultad de Medicina, Departamento de Microbiología, Universidad Nacional de Colombia. Bogotá, Colombia; 2005. [ Links ]
36. Guhl S, Nicholls S. Manual de procedimientos para el diagnóstico de la enfermedad de Chagas. Bogotá, Organización Mundial de la Salud, Ministerio de Salud de Colombia, Instituto Nacional de Salud y Universidad de los Andes; 2001. p. 96-98. [ Links ]
37. Cabrera MA, Paula A, Camacho LA, Marzochi MC, Xavier SC, Silva AV, et al. Canine Visceral Leishmaniasis in Barra de Guaratiba, Rio de Janeiro, Brazil: Assesment of risk factors. Rev Inst Med Trop Sao Paulo 2003;45(2):79-83. [ Links ]
38. Alexandre W, Dias P. Reflexõnes sobre a quealidade do diagnòstico da leishmaniose visceral canina em inquéritos epidemiológicos: o caso da epidemia de Belo Horizonte, Minas Gerais, Brasil, 1993-1997. Cad. Saude Pública 2004;20:259-265. [ Links ]
39. Bernardina WE, Luna R, Oliva G, Ciaramella P. An immunodifusion assay for the detection of canine leishmaniosis due to infection with Leishmania infantum. Vet Parasitol 1997;73:207-213. [ Links ]
40. Vega JC, López MC, Vargas J, Ayala M, Nicholls S, Bello F, Fernández J, Escobar J. Estandarización de la prueba de ELISA para el inmunodiagnóstico de la Leishmaiosis visceral canina. En: Agudelo C. (ed.). I Encuentro de Investigadores en Salud Pública de la Universidad Nacional de Colombia. Bogotá: Instituto de Salud Pública; 2003. [ Links ]
41. Lauricella MA, Castanera MB, Gürtler RE, Segura EL. Immunodiagnosis of Trypanosoma cruzi (Chagas' Disease) infection in naturally infected dogs. Mem. Inst. Oswaldo Cruz 1998;93(4);501-507. [ Links ]
42. Braz RF, Nascimento ET, Martins DR, Wilson ME, Pearson RD, et al. The sensitivity and specificity of Leishmania chagasi recombinant k39 antigen in the diagnosis of American Visceral Leishmaniasis and in differentiating active from subclinical infection. Am. J. Trop. Med. Hyg. 2002;67(4):344-348. [ Links ]
43. Bastrenta B, Mita N, Buitrago R, Vargas F, Flores M, Machane M, et al. Human mixed infections of Leishmania spp. and Leishmania-Trypanosoma cruzi in a Sub Andean Bolivian Area: identification by Polymerasa Chain reaction/hybridization and isoenzyme. Mem. Inst. Oswaldo Cruz 2003;98(2):255-264. [ Links ]
44. Maalej I, Chenik M, Louzir H, Salah A, Bahloui CH, et al. Comparative evaluation of ELISAs based on ten recombinant or purified Leishmania antigens for the serodiagnosis of Mediterranean visceral leishmaniasis. Am. J. Trop. Med. Hyg. 2003;68(3):312-330. [ Links ]
45. Courtenay O, Rupert J; Quinnell L, Garcez M, Shaw J, Dye D. Infectiousness in a Cohort of Brazilian dogs: Why culling fails to control visceral leishmaniasis in areas of high transmission. J. Infect. Dis. 2000;186:1314-1320. [ Links ]
46. Riera C, Valladares JE, Gallego M, Aisa MJ, Castillejo S, Fisa R, et al. Serological and parasitological follow-up in dogs experimentally infected with Leishmania infantum and treated with meglumine antimoniate. Vet Parasitol 1999;84:33-47. [ Links ]
47. de Paula A, da Silva A, Fernándes O, Jansen A. The use of immunoblot analysis in the diagnosis of canine visceral leishmaniasis in an endemic área of Rio de Janeiro. J. Parasitol 2003;89:832-836. [ Links ]
48. Reithinger R, Davies C. Is the domestic dog (canis familiaris) a reservoir host of American cutaneous Leishmaniasis? A critical review of the current evidence. Am. J. Trop. Med. Hyg. 1999;61(4):530-541. [ Links ]
49. Solano-Gallego L, Morell P, Arboix M, Alberola J, Ferrer LF. Prevalence of Leishmania infantum infection in dogs living in an area of canine Leishmaniasis endemicity using PCR on several tissues and serology. J Clin Microbiol 2001;39(2):560-563. [ Links ]
50. Quaresma PF, Murta SMF, Ferreira EDC, Da Rocha-Lima AC, Prates AA, Ferreira CM. Molecular diagnosis of canine visceral leishmaniasis: identification of Leishmania species by PCR-RFLP and quantification of parasite DNA by real-time PCR. Acta Trop 2009;111(3):289-94. [ Links ]
51. Manna L, Reale S, Vitale F, Gravino A, Gravino AE. Evidence for a relationship between Leishmania load and clinical manifestations. Res Vet Sci 2009;87(1):76-8. [ Links ]