Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Biosalud
versión impresa ISSN 1657-9550
Biosalud v.8 n.1 Manizales ene./dic. 2009
CARACTERÍSTICAS DEL CRECIMIENTO FOLICULAR OVÁRICO DURANTE EL CICLO ESTRAL EN OVEJAS
CHARACTERISTICS OF OVARIAN FOLLICLE DEVELOPMENT DURING ESTROUS CYCLE IN SHEEP
Luis Fernando Uribe-Velásquez1, Adriana Correa-Orozco2 y José Henry Osorio3
1 Universidad de Caldas, Facultad de Ciencias Agropecuarias, Departamento de Salud Animal. Correspondencia: Universidad de Caldas, Calle 65 No. 26-10, Manizales, Caldas (Colombia). E-mail: lfuribe@ucaldas.edu.co.
2 Universidad de Caldas, Facultad de Ciencias Agropecuarias, Programa de Maestría en Ciencias Veterinarias. Manizales, Colombia.
3 Universidad de Caldas, Facultad de Ciencias para la Salud, Departamento de Ciencias Básicas. Manizales, Colombia.
Recibido: septiembre 25 de 2009 - Aceptado: octubre 21 de 2009
RESUMEN
En la mayoría de los animales domésticos los últimos estadios del desarrollo folicular se presentan en un patrón de ondas durante el ciclo estral. Una onda folicular es caracterizada por el crecimiento sincrónico de un grupo de folículos, uno (o un número especie-específico) de ellos continúa creciendo (folículo dominante) mientras los otros regresan por inhibición de su desarrollo (folículos subordinados). La función folicular ha sido estudiada en la oveja, aunque la descripción del patrón de desarrollo folicular ha sido controvertido en los estudios iníciales. Algunos autores describieron el crecimiento folicular como continuo e independiente de la fase del ciclo. Otros estudios apoyaron un patrón de ondas. Actualmente, hay un acuerdo general que reconcilia ambos puntos de vista; el cual es basado sobre la alta variabilidad en el número de grupos desarrollándose en cada onda (el grupo de folículos) y la alta variabilidad en el número de grupos desarrollándose en cada ciclo estral. De esta forma, folículos > 5 mm de diámetro exhibirán un patrón de onda mientras folículos menores a 4 mm crecerán al azar. Muchos estudios describen dos a cuatro ondas foliculares durante el ciclo estral, con uno describiendo hasta seis ondas por ciclo. La selección folicular es el proceso por el cual se disminuye el número de folículos en crecimiento en una onda de acuerdo al número de folículos especie-específicos que ovulan. Durante el ciclo estral, el folículo dominante y el folículo subordinado mayor alcanzan diámetros máximos de 5-7 y 3-5 mm, respectivamente. En muchos casos los folículos ovulatorios se desarrollan desde un grupo de folículos desde la última onda folicular, pero también pueden originarse desde la penúltima onda folicular. Comprender los mecanismos que involucran el desarrollo folicular es importante para diseñar estrategias que mejoren los aspectos reproductivos y productivos en pequeños rumiantes.
PALABRAS CLAVE: cuerpo lúteo, ecografía, folículos, onda folicular.
ABSTRACT
In most domestic animals, the later stages of follicle development appear to have a wave-like pattern during the estrous cycle. A follicle wave is characterized by the synchronous growth of a cohort of follicles, one (or a species-specific number) which continues growing (dominant follicle), while the others regress due to development inhibition (subordinate follicles). Follicular function has been widely studied in sheep, although the description of the follicular development pattern has been controversial in early studies. Some authors described follicular growth as continuous and independent of the cycle stage. Other studies were supportive of a wave-like pattern. Currently, there is a general agreement that reconciles both viewpoints, which is based on the high variability in the number of cohorts developing in each wave (the cohort of follicles) and the high variability in the number of cohorts developing in each estrous cycle. In this way, follicles > 5 mm in diameter would exhibit a wave-like pattern, whilst follicles smaller than 4 mm would grow randomly. Most studies describe two to four follicle waves during the estrous cycle, with one study describing up to six waves per cycle. Follicular selection is the process that results in a decrease in the number of growing follicles in a wave according to the species-specific number of follicles that ovulate. During the estrous cycle, the dominant and largest subordinate follicles reach maximum diameters of 5-7 and 3-5 mm, respectively. In many cases the ovulatory follicles develop from a cohort of follicles from the last follicular wave. However, the ovulatory follicles can also derive from the second-to-last follicular wave. Understanding the pattern of follicle development in small ruminants is increasingly important for designing improved methods to manipulate reproduction and production.
KEY WORDS: corpus luteum, follicles, ultrasonography, follicular wave.
INTRODUCCIÓN
Dos fases han sido definidas durante el ciclo estral (día cero = estro) en hembras ovinas: una fase luteal desde el segundo hasta el día 13, y una fase folicular, comprendiendo el día 14 hasta el primer día (1). Con todo ello, la duración media del ciclo estral es de 16,5±0,2 a 17,8±0,2 días (1-9), siendo más corto en corderas comparado con las ovejas adultas deslanadas, con una duración de 16,8 y 17,2 días, respectivamente (10).
El uso de la ecografía como instrumento de investigación proporcionó, en la última década, un significativo cambio en los conceptos vigentes sobre la fisiología ovárica y, particularmente, sobre uno de sus aspectos más importantes, la dinámica folicular. Una onda es caracterizada por el crecimiento sincrónico de un grupo de folículos (emergencia), que inicialmente aumenta en tamaño durante una fase de crecimiento común y subsecuentemente se diferencia en un sólo folículo dominante que continúa creciendo, mientras múltiples folículos subordinados cesan el crecimiento durante una fase estática (11, 12). La comprensión del patrón exacto día a día del crecimiento folicular en la oveja ha resultado en un debate considerable en la literatura en años recientes (11). Algunos autores han propuesto que hay una secuencia organizada de eventos, mientras otros han sugerido que el crecimiento folicular ocurre como un evento al azar (11).
El mecanismo general de la foliculogénesis ovárica en mamíferos es razonablemente bien entendido, el cual implica una comunicación endocrina compleja entre el sistema nervioso central y el ovario, y varios reguladores paracrinos intraováricos (13).
El desarrollo de métodos más efectivos para inducir el estro y la ovulación, y para manipular la tasa de ovulación, dependerán de un mejor entendimiento de los mecanismos responsables del desarrollo y diferenciación folicular (14).
El objetivo del presente artículo es revisar algunas investigaciones en hembras ovinas que relacionan la foliculogénesis, el crecimiento folicular y la sensibilidad de los folículos a las hormonas.
Desarrollo folicular
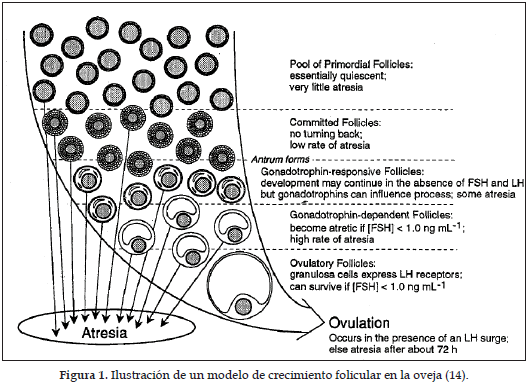
La foliculogénesis es controlada por las relaciones complejas entre los esteroides intrafoliculares, factores de crecimiento y el sistema de feedback del eje hipotálamo-hipófisis-ovario (15). En la mayoría de los mamíferos, el proceso de foliculogénesis involucra la formación de folículos pre-ovulatorios a partir de un pool de folículos primordiales, los cuales iniciarán su etapa de crecimiento a lo largo de la vida reproductiva (Figura 1). El ovario ovino prepúber contiene 40.000 a 300.000 folículos primordiales, de los cuales algunos abandonan este estadio durante la vida fetal; ya el ovario de la oveja adulta posee, según la raza, entre 12.000 y 86.000 folículos primordiales, y entre 100 y 400 folículos en crecimiento en cada ciclo, siendo que solamente 10 a 40 son visibles en la superficie ovárica (16). Así, durante la mayor parte del ciclo estral, cada ovario en la oveja adulta contiene 10 folículos mayores a 2 mm de diámetro, de los cuales las 2/3 partes sufren atresia (17).
Del conjunto de folículos primordiales establecidos al nacimiento, gradualmente pequeños folículos inician el crecimiento. El mecanismo que controla este inicio de crecimiento folicular es desconocido, y parece involucrar una compleja interacción de factores genéticos, orgánicos y medioambientales. El proceso de crecimiento folicular es continuo e independiente de la fase del ciclo estral (18, 19). Una vez iniciado, el folículo se desarrollará de su estado primordial (100 µm) hasta la ovulación (mayor que 5 mm en la oveja) o en la mayoría de los casos hasta su atresia (Figura 1), así los folículos que ovularon iniciarán su crecimiento durante la estación anestral, aproximadamente 180 días antes del inicio de la nueva estación reproductiva (15, 20). Se ha reportado en experimentos realizados con ovejas que una mayor tasa de ovulación puede ser atribuida a una mayor cantidad de folículos dominantes al momento de la ovulación (21).
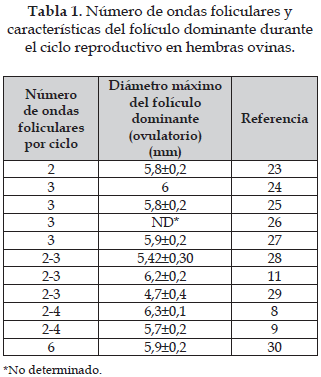
Desde el punto de vista fisiológico, la primera etapa de crecimiento se presenta desde la fase de folículo primordial hasta la fase de folículo respondiendo a las gonadotrofinas o folículo pre-antral, presentando proliferación celular en la granulosa y el aparecimiento de receptores para la hormona folículo estimulante (FSH) y hormona luteinizante (LH) en la granulosa y en la teca, respectivamente. La segunda fase es caracterizada por la intensa proliferación y diferenciación celular y por la adquisición de la capacidad esteroidogénica, dando lugar a folículos que dependen absolutamente del aporte gonadotrófico. Esta segunda fase es también llamada de reclutamiento folicular, que permite el paso para el estadio de selección folicular, al final del cual emerge un folículo dominante con un diámetro entre 5 y 6 mm destinado a ovular (Tabla 1). Cada una de estas etapas es caracterizada por los diversos requerimientos en FSH y LH y, consecuentemente, por un índice de atresia folicular diferente, cuando el nivel gonadotrófico para la estimulación es insuficiente (22).
El proceso continuo de crecimiento y de regresión de los folículos antrales que permiten el desarrollo del folículo pre-ovulatorio es denominado "dinámica folicular" (31), mecanismo que ocurre en dos fases, anterior y posterior a la formación del antro. El patrón de crecimiento en el período pre-antral es poco conocido. En esta fase el desarrollo folicular es independiente de la estimulación gonadotrófica, y parece estar bajo el control de las hormonas o factores intraováricos (Figura 1) (32, 33).
Estudios in vivo mostraron que en la especie ovina, 70 días después de hipofisectomía, el número de folículos pre-antrales con diámetro inferior a 0,2 mm disminuye, mostrando así que están sometidos, de cierta forma, al control de las gonadotrofinas a largo plazo (34). Al contrario, folículos mayores a 2 mm fueron totalmente dependientes de las gonadotrofinas, necesitando apenas 4 días para tornarse atrésicos.
Las fases iníciales del crecimiento folicular en las diferentes especies domésticas parecen ocurrir de forma lenta cuando se comparan con la fase final (35). En la mayoría de las especies, la formación del antro ocurre en los folículos midiendo en torno de 0,2 a 0,4 mm. El tiempo correspondiente a dos ciclos estrales parece ser necesario para que un folículo al inicio de la fase antral (0,4 mm) alcance su tamaño pre-ovulatorio, calculado con base en el índice mitótico de las células de la granulosa (36). Por otro lado, el crecimiento final de los folículos ocurre de manera mucho más rápida, resultante de la gran expansión del antro folicular, regulado además por la presencia de un cuerpo lúteo activo. Se ha observado que la tasa de crecimiento del folículo ovulatorio es elevada (de 0,8 a 2,3 mm/24 h), con alta variabilidad entre animales (37).
En el folículo pre-ovulatorio, el proceso final de la maduración resulta en una serie de cambios endocrinos y morfológicos. Estas alteraciones están íntimamente relacionadas con la descarga pre-ovulatoria de la LH. La concentración intrafolicular del estrógeno, normalmente elevada, decrece gradualmente después del pico de LH, en cuanto que la concentración de progesterona (P4) muestra un comportamiento opuesto, aumentando de manera acentuada 20 a 24 horas después del pico (38).
El crecimiento folicular no es un fenómeno continuo y aleatorio, como inicialmente fue sugerido en estudios en ovarios de novillas obtenidos en Centrales de Sacrificio (39) o por el acompañamiento folicular vía laparoscopia en vacas lecheras (40), mas sí un proceso continuo a través del ciclo estral en hembras ovinas (18, 41).
El patrón de crecimiento folicular en ondas hace que la población de folículos de diversas clases de tamaño se altere a lo largo del ciclo (42). Entretanto, la duración de la fase luteal parece determinar el número de ondas durante el ciclo (Tabla 1). Los ciclos con tres ondas de crecimiento presentaron fases luteales más largas que ciclos con dos, siendo que el folículo dominante presente al momento de la luteólisis se tornó en folículo ovulatorio (43).
En ovejas Finn fue descrito que el folículo destinado a ovular fue determinado después de la luteólisis, en torno de 48 a 72 horas antes del aparecimiento del pico pre-ovulatorio de LH (44). En bovinos la prolongación artificial de la fase luteal utilizando progestágenos exógenos provocó ciclos con cuatro o cinco ondas de crecimiento folicular (45). El número de ondas en un determinado ciclo parece estar influenciado también por factores genéticos, nutricionales, estrés térmico y medio ambiente (43, 46-48).
El crecimiento folicular en ondas ocurre simultáneamente en ambos ovarios, siendo más evidente en el ovario derecho, en función del mayor número de folículos en crecimiento normalmente presentes en esta gónada (49). La mayor actividad constatada en el ovario derecho está relacionada con una mayor tasa ovulatoria. En una investigación usando laparoscopia en 2.806 ovejas Merino y mestizas Border Leicester con Merino (50), los autores observaron un número significativamente mayor de ovulaciones en el ovario derecho (53,4%) que en el ovario izquierdo (46,6%).
La presencia del cuerpo lúteo (CL) parece afectar el patrón de desarrollo folicular en el mismo ovario, mediante un mecanismo complejo y de difícil caracterización. En este sentido, fue constatado en ovejas Blackface (51), que los ovarios conteniendo el CL al octavo día del ciclo estral presentaron mayor cantidad de folículos mayores que 1 mm, comparados con el número de folículos del mismo tamaño en el otro ovario contralateral al CL presente. En un estudio realizado en ovejas adultas se demostró que el folículo dominante en el ovario con la presencia del CL tuvo mayor diámetro que el folículo dominante del ovario sin CL (52). Entretanto, en ovejas Suffolk no se observó alguna relación entre el número de cuerpos lúteos (uno, dos o tres) y la cantidad de folículos (6). Contradictoriamente, en ovejas africanas se encontró que el número de folículos era diferente en el ovario conteniendo el CL en comparación con el ovario sin la presencia de él (9). Así, la cantidad total de folículos grandes durante la fase luteal fue menor en el ovario conteniendo el CL (0,9±0,5) cuando se comparó con el ovario contralateral (2,7±0,3). Estos autores concluyeron además que la presencia de un CL funcional puede ejercer efectos sistémicos y locales en la población folicular afectando la dominancia ejercida por los folículos grandes.
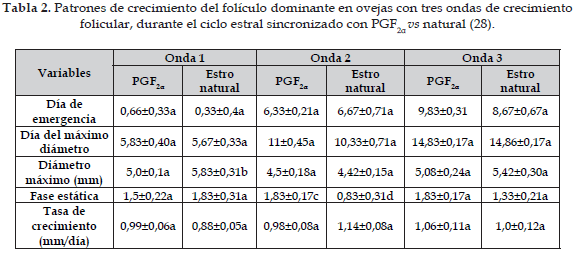
Por el contrario, en un estudio realizado con ovejas Bergamacia (28), las prostaglandinas (PG) no tuvieron un efecto sobre la dinámica de crecimiento folicular. De esta investigación se concluyó, que durante el ciclo estral ovino la dinámica folicular es muy semejante en hembras sincronizadas con un análogo de PGF2α en comparación con hembras durante el estro natural (Tabla 2).
Letras diferentes en las líneas dentro de cada onda folicular presentan diferencias estadísticamente significativas a vs b (p<0,01) y c vs d (p<0,05).
Estudios de la dinámica folicular realizados en ovejas utilizando material de frigoríficos o después de laparotomías han sido contradictorios con respecto a la presencia o no de ondas foliculares (17, 24, 53, 54). La literatura muestra que la emergencia folicular ocurre continuamente y que el crecimiento de los folículos grandes (4-6 mm) durante la fase luteal en la oveja ocurre al azar, alcanzando diámetros de 4 a 6 mm y después entran en atresia (55, 56). En ovejas Texel durante el ciclo normal, sacrificadas en diferentes momentos del ciclo estral, se observó la presencia de dos ondas de crecimiento folicular, siendo la primera en los días 1 a 10, y la segunda, desde el sexto día del primer ciclo hasta el primer día del ciclo siguiente (17, 57). Al final de la primera onda, se notó el crecimiento de un folículo mayor. En contraste, al final del segundo crecimiento folicular, se encontraron dos folículos grandes, siendo que por lo menos uno de ellos ovuló.
En una investigación utilizando laparoscopia en ovejas adultas, se describió la presentación de dos ondas foliculares durante el ciclo estral: la primera, al inicio del ciclo; y la segunda, en la segunda mitad (52). En este trabajo, la población folicular presentó mayor cantidad de folículos pequeños (2 mm) en el día 9 cuando se comparó con los días 12 ó 14. Utilizando también laparoscopia en ovejas Suffolk al inicio, mitad y final de la estación reproductiva durante el anestro, se encontraron tres ondas de crecimiento folicular y atresia (dos ondas en la fase luteal y una onda en la fase folicular), siendo que la tercera onda fue la onda ovulatoria en las ovejas cíclicas durante el ciclo estral natural (54). La primera, segunda y tercera onda emergieron en los días 1 a 2, 7 a 8, y 14, respectivamente, después de la ovulación. Los folículos fueron clasificados como pequeños (diámetro de 2-3,5 mm); medios (diámetro 4-5,5 mm) y grandes (diámetro mayor a 6 mm). Las ondas presentaron el mismo comportamiento durante la época del anestro, concluyendo que los patrones cíclicos de crecimiento folicular y atresia observados durante la estación reproductiva, también están presentes durante el período anestral. Así, también se constató que la cantidad de folículos de la primera onda folicular durante la estación reproductiva fue de 4,8±0,4 (pequeños), 3,8±1,8 (medios), y 2,4±1,1 (grandes).
La eficiencia de la técnica ecográfica depende de tres factores: observación total de los folículos, el diámetro de cada uno de ellos, y la posición de los ovarios. Se ha destacado que el límite de detección mínimo para los folículos puede ser de 2 mm de diámetro (68,7%), pudiéndose observar algunos folículos de 1 mm, pero en bajo porcentaje (58). Para los folículos de 3 a 4 mm la observación llegó a ser de 92 a 93%, y 100% para los folículos mayores que 5 mm; y los cuerpos lúteos solamente fueron detectables a partir del día 4 ó 5 del ciclo estral (88,8%). Entretanto, los autores consideraron que fisiológicamente es importante poder detectar los folículos a partir de 2 mm, momento en el cual pasan a ser totalmente dependientes de las gonadotrofinas para su crecimiento folicular.
Con el uso de ecografía en ovejas mestizas Suffolk durante el ciclo estral (día cero = estro) y al inicio de la gestación, se observó que el número de folículos mayores de 2 mm fue semejante en los primeros 16 días para los dos períodos estudiados (6). En este estudio los autores mostraron también un aumento significativo en la cantidad de folículos de 2 y 3 mm entre el primer y tercer día después del estro; aumento en el número de los folículos de 4 y 5 mm durante la fase luteal media y un incremento de los folículos mayores próximo del estro, concluyendo que, posiblemente, hubo dos ondas foliculares durante el ciclo estral, siendo que la primera onda se presentó en los primeros ocho días del ciclo, indicando que el desarrollo folicular es continuo, sin mostrar una evidente dominancia en los rumiantes poliovulatorios.
Al estudiar la dinámica folicular por medio de ecografía en ovejas White-Faced adultas durante el segundo ciclo de la estación reproductiva estral (día cero = ovulación), se describió que en el intervalo interovulatorio (17,2±0,4 días), los folículos antrales (mayores que 2 mm de diámetro) se desarrollaron todos los días, excepto en los días 1, 5, 15, 16 y 17, observando un aumento significativo en la cantidad de folículos emergentes en los días 2 y 11 (7). En la primera onda folicular, el folículo mayor alcanzó un diámetro de 5,5±0,3 mm con un índice de crecimiento de 1 mm/día. El folículo ovulatorio (6,9±0,1 mm de diámetro) emergió el día 11,1±0,3, creciendo por un período de 4,1±0,1 días. Simultáneamente, la cantidad media de folículos antrales mayores que 2 mm de diámetro aumentó de 4,5±0,4 el tercer día para 7,2±0,7 el día 11, mostrando una disminución el día 15 y llegando a 3,5±0,3 el día de la ovulación (día 17,2±0,4). El CL (diámetro medio de 11,5±0,3 mm) se identificó el tercer día del ciclo estral en todas las hembras, y su diámetro llegó hasta 13,3±0,6 mm el quinto día declinando el día 11, para alcanzar 7,5±0,3 mm en el día de la ovulación. Además de presentar elevaciones en las concentraciones de FSH y de E2 antes de la ovulación, no fueron encontradas asociaciones claras entre las concentraciones de estas hormonas y los patrones de crecimiento folicular y regresión, concluyendo también que el crecimiento folicular presentó dos ondas significativas de emergencia en los días 2 y 11, siendo la segunda onda significativamente mayor. Estos autores sólo observaron la dominancia folicular antes de la ovulación, en contraste con lo que sucede en los bovinos.
Utilizando técnicas quirúrgicas, se obtuvieron diferencias en la población folicular a lo largo del ciclo estral, sugiriendo la posibilidad de la existencia de ondas foliculares (59). Ovejas mestizas durante el anestro estacional con autotransplante ovárico, mostraron una y dos ondas de crecimiento folicular con cada onda mostrando una duración media de 7,1±0,2 días (60). Además de ello, fue detectado que el tamaño y la capacidad esteroidogénica de los folículos antrales grandes en las hembras ovinas están relacionados positivamente con los períodos de crecimiento folicular.
Además, fueron descritas tres ondas de crecimiento folicular en el 79% de las ovejas Suffolk adultas investigadas (8). En este estudio, la emergencia de la primera onda fue observada en el día 0,4±0,2 (día cero = ovulación) con un folículo dominante alcanzando un diámetro máximo de 6,1±0,1 mm y con un crecimiento de 0,8±0,1 mm/día. Utilizando también ecografía transrectal (61), se observó que el día de emergencia de la onda folicular no fue diferente entre dos grupos de animales, siendo de 0,57±0,53 y 0,86±0,40, para grupos durante el estro natural y sincronizados con gonadotropina exógena, respectivamente. Además se reportó que el folículo dominante alcanzó su diámetro máximo de 4,29±0,26 mm en el día 4,57±0,43 durante el ciclo natural en hembras ovinas.
En hembras ovinas de razas con alta (Finn) y baja prolificidad (White-faced) se observó mediante ecografía la presentación de cuatro ondas foliculares para los dos grupos de animales, emergiendo aproximadamente cada cuatro días (62). Los mismos autores verificaron una estrecha relación en la emergencia de cada onda folicular con la secreción de FSH y de E2, presentando picos del E2 al final del crecimiento del folículo más grande de cada onda.
Cada onda de crecimiento folicular es caracterizada por el desarrollo simultáneo de un grupo de folículos antrales, los cuales provienen de un pool de folículos previamente reclutados al inicio de la fase antral. El reclutamiento ocurre en grupos contemporáneos, indicando la existencia de una señal que permite la continuación del desarrollo impidiendo la atresia (35, 63). Poco se sabe sobre el mecanismo que determina el número de folículos reclutados en un determinado período de tiempo. Este número podría ser una característica intrínseca del ovario, o ser determinado por una interacción entre las hormonas y factores locales (64).
Regulación hormonal del desarrollo folicular
En la especie ovina el reclutamiento folicular ocurre tanto al inicio de la fase folicular como durante la fase luteínica del ciclo, mecanismo controlado por la FSH hipofisiaria, siendo que solamente los folículos mayores de 2 mm son capaces de ser reclutados, en cuanto que los folículos menores de esa medida son menos sensibles al reclutamiento (1). En ese proceso, los patrones de pulsatilidad de LH son significativamente diferentes durante las dos fases del ciclo estral (55).
En bovinos, la FSH representa un importante papel en el control del crecimiento folicular. Se han encontrado dos elevaciones de FSH durante el ciclo estral bovino; el primero, coincidiendo con el período pre-ovulatorio y pico de LH; y el segundo, comenzando 18-24 horas después del inicio del período pre-ovulatorio (37). También en bovinos (65), se verificó que el surgimiento de FSH de 1 a 2 días es necesariamente precedido por el aparecimiento de una onda folicular y luego disminuyó cuando los folículos de la onda comienzan a diferenciarse en folículo dominante y folículos subordinados (6-7 mm).
En relación a la asociación de la emergencia de la onda folicular y las oscilaciones de FSH durante el ciclo estral (día cero = ovulación) en ovejas Polypay, se describió un aumento en las concentraciones plasmáticas de FSH de 2 a 3 días antes de la emergencia de la onda folicular, a través del intervalo interovulatorio, presentándose dos eventos aproximadamente cada 4 días (30). Los mismos autores propusieron la presentación de 3 (8%), 4 (58%) y 5 ó 6 (34%) ondas foliculares, con la primera onda emergiendo en el día antes de la ovulación o en el segundo día, mostrando un folículo grande de 6,2±0,1 mm creciendo 0,8 mm/día. De acuerdo a estos hallazgos, los autores concluyeron que la dominancia es menos fuerte en las ovejas que en las hembras bovinas. Otros estudios también sugieren que la dominancia es menor o no está presente durante la fase luteal del ciclo estral de la oveja (6, 7). Por otro lado, en una investigación se concluyó que los aumentos en las concentraciones séricas medias y basales de FSH están estrechamente acoplados con los días de emergencia de la onda folicular, y ellos también coinciden con el final de la fase de crecimiento de los folículos más grandes de una onda previa (23).
Investigando también la asociación de FSH y el crecimiento folicular, se observó que las concentraciones de FSH son elevadas durante la emergencia de los folículos grandes, disminuyendo con el crecimiento y manteniéndose bajas mientras los folículos de la primera onda secretaron activamente estradiol (25). Reducciones similares se observaron en la segunda onda de crecimiento folicular. Así, posiblemente la alta secreción de estradiol y de androstenediona durante la primera onda de crecimiento folicular es debida a que la frecuencia de los pulsos de LH es más elevada en comparación con la secreción durante la fase luteal.
Otros autores investigaron el efecto del fluido folicular ovino desprovisto de esteroides (66), encontrando que éste inhibía el crecimiento de los folículos ováricos, representado por la disminución de los folículos mayores a 4 mm y con aumento en la proporción de los folículos menores que 2 mm, inclusive en presencia de gonadotrofinas exógenas (gonadotrofina coriónica equina - eCG). Es claro que el folículo dominante es marcadamente sensible al FSH comparado con los pequeños, lo que puede estar estrechamente relacionado con la secreción de factores autocrinos del tipo IGF-I (Factor de crecimiento semejante a insulina - I), que posiblemente media esa mayor sensibilidad, mas no siempre ese factor está presente en altas concentraciones en los folículos grandes (67).
Otro grupo de investigadores constataron que dosis de somatotropina recombinante bovina elevaron las concentraciones del IGF-I, factor que aumentó la respuesta al FSH de los folículos independientes de gonadotrofinas, resultando en un aumento en la población de los folículos dependientes de gonadotrofinas (con diámetro mayor que 2 mm) y, al mismo tiempo, los folículos independientes de gonadotrofinas fueron disminuidos (68). Por tanto, ese factor podría estar estimulando la proliferación celular de la granulosa en conjunto con el aumento de E2, síntesis de inhibina y aumento de receptores para LH (55). Asimismo, los factores de crecimiento probablemente juegan un importante papel en este control, pues los factores de crecimiento semejantes a insulina (IGF) provocan aumentos de la esteroidogénesis en respuesta a las gonadotropinas in vitro, mientras que el factor de crecimiento epidermal tiene efectos opuestos (27).
En un estudio con aplicación de la insulina en dosis superiores a lo normal y los factores de crecimiento IGF-I e IGF-II, se describió que los efectos de la insulina en esas dosis son mediados por el IGF-I (15). Este factor, parece ser más importante, por ser cerca de 5 veces más potente que el IGF-II para estimular la proliferación celular y producción hormonal. Entretanto, al investigar los factores periféricos y locales reguladores de la foliculogénesis, se concluyó que la activina representa un importante papel en el desarrollo y mantenimiento de los folículos estrogénicos sanos, previniendo la prematura luteinización, al contrario de la folistatina, que desencadena efectos opuestos llevando a la luteinización o atresia folicular (69).
Numerosos factores hormonales controlan el desarrollo folicular; la inmunización contra androstenediona aumenta la tasa ovulatoria en un ambiente con aumento en los niveles de FSH, en cuanto que la hormona de crecimiento (GH) provoca efectos similares pero con significativas reducciones en las concentraciones de FSH (27). Factores secundarios son implicados también en este control; la GH suministrada in vivo tiene efectos estimulantes en el crecimiento folicular y acciones inhibitorias sobre la esteroidogénesis in vivo e in vitro.
Relacionando la dinámica folicular y endocrina con la condición corporal, se observó que hubo altas concentraciones de progesterona asociada con una mayor condición corporal (48). Además de ello, el grupo con la mayor condición corporal presentó un mayor número de ondas de crecimiento folicular (2,0±0,0) durante la fase luteal, comparado con el grupo de animales presentando baja condición corporal (1,5±0,2).
Selección folicular
El mecanismo intrínseco de selección del folículo pre-ovulatorio es todavía muy incierto. La existencia de la dominancia folicular en la oveja ha sido bastante discutida, afirmándose que la tasa de crecimiento folicular no varía con la presentación de un folículo grande durante la fase luteal. De la misma forma, los primeros estudios ecográficos no han conseguido documentar con precisión los indicadores utilizados como expresión de la dominancia folicular en la especie ovina, como las diferencias del crecimiento entre los dos folículos más grandes; y la regresión de los folículos menores correlacionada con el crecimiento del folículo grande (70).
Del conjunto de folículos que inician el desarrollo en cada onda, apenas uno continúa el crecimiento y alcanza el tamaño ovulatorio en la vaca (71). Este folículo será seleccionado en un determinado momento de la onda de crecimiento, pasando a controlar el desarrollo de los demás, definido entonces como folículo dominante (42). En otro estudio (9), se encontró que la presencia de un folículo grande o dominante, provoca la disminución de folículos pequeños principalmente en la onda uno (3,4±0,8) y tres (2,3±0,7) de crecimiento en comparación con la segunda onda (6,3±1,0 folículos). También reportaron que la cantidad media de folículos pequeños disminuyó durante el periodo de crecimiento de los folículos dominantes durante la tercera onda de crecimiento folicular, fenómeno que no fue observado en la primera y segunda onda de desarrollo.
Los mecanismos por los cuales el folículo dominante es seleccionado y pasa a controlar el crecimiento de los demás todavía no son claros, probablemente están involucrados mecanismos endocrinos, pues ocurre atresia en folículos subordinados de ambos ovarios. En hembras ovinas, el folículo seleccionado presenta características morfológicas propias (cantidad y calidad de las células de la granulosa) y funcionales (capacidad de las células de la granulosa de dividirse o diferenciarse en receptores para gonadotrofinas) (1).
En ovejas, se han descrito dos etapas para determinar el proceso de selección: una etapa pasiva, donde el folículo dominante reduce los niveles circulantes basales de FSH y de LH, por la secreción de inhibina y E2, privando los folículos subordinados del soporte de gonadotrofinas en un momento crítico de su desarrollo; y la etapa activa, donde el folículo seleccionado inhibe directamente el crecimiento de los folículos menores por la secreción de sustancias que reducen la sensibilidad (55).
Para conocer la existencia de la dominancia folicular en ovejas, se puede administrar gonadotrofinas, en presencia o no de folículos presumiblemente dominantes en el ovario. Para verificar la existencia de la dominancia funcional durante el inicio de la fase luteal fue realizado un trabajo en ovejas Merino (monovulatorias), que recibieron tratamiento de FSH (6 dosis iguales de Folltropin®, una cada 12 horas, dosis total: 100 mg) iniciando el día esperado de la emergencia del folículo grande (día de la ovulación) de la primera onda folicular, o 3 días después de la misma, observándose que el tratamiento iniciado el día de la emergencia de la primera onda determinó un mejor reclutamiento folicular que con el tratamiento tardío, cuando el folículo mayor de la primera onda estaba presente (59). Por tanto, el reclutamiento folicular fue inhibido por la presencia de un folículo probablemente dominante, indicando que la dominancia folicular es funcional durante el inicio de la fase luteal del ciclo estral de la oveja. Otras investigaciones para esclarecer la dominancia folicular en ovinos y bovinos fueron desarrolladas, demostrando que el fluido folicular libre de inhibina, impide el desarrollo folicular y la secreción hormonal en hembras de estas especies (15).
CONCLUSIÓN
El conocimiento del desarrollo folicular y de las complejas interrelaciones endocrinas que lo controlan, permiten diseñar herramientas biotecnológicas que mejoren el desempeño reproductivo y el rendimiento productivo de las explotaciones ovinas.
REFERENCIAS
1. Driancourt MA, Gibson WR, Cahill LP. Follicular dynamics throught the oestrus cycle in sheep. A review. Reprod Nutr Develop 1985;25:1-15. [ Links ]
2. Cunningham NF, Symons AM, Saba N. Levels of progesterone, LH and FSH in the plasma of sheep during the oestrus cycle. J Reprod Fertil 1975;45:177-180. [ Links ]
3. Pant HC, Hopkinson CRN, Fitzpatrick RJ. Concentration of oestradiol, progesterone, luteinizing hormone and follicle-stimulating hormone in the jugular venous plasma of ewes during the oestrus cycle. J Endocrinol 1977;73:247-255. [ Links ]
4. Bindon BM, Blanc MR, Pelletier J, Terqui M, Thimonier J. Periovulatory gonadotrophin and ovarian steroid patterns in sheep of breeds with differing fecundity. J Reprod Fertil 1979;55:15-25. [ Links ]
5. Currie WD, Medhamurthy RJ, Cook SJ, Rawlings NC. Seasonal fluctuation in diurnal rhythms of luteinizing hormone secretion in ewes during the mid-luteal phase of the oestrus cycle. J Reprod Fertil 1993;97:71-74. [ Links ]
6. Schrick FN, Surface RA, Pritchard JY, Dailey RA, Townsend EC, Inskeep EK. Ovarian structures during the estrous cycle and early pregnancy in ewes. Biol Reprod 1993;49:1133-1140. [ Links ]
7. Ravindra JP, Rawlings NC, Evans ACO, Adams GP. Ultrasonographic study of ovarian follicular dynamics in ewes during the estrous cycle. J Reprod Fert 1994;101:501-509. [ Links ]
8. Leyva V, Buckrell BC, Walton JS. Regulation of follicular and ovulation in ewes by exogenous progestagen. Theriogenology 1998;50:395-416. [ Links ]
9. Contreras-Solis I, Diaz T, Lopez G, Caigua A, Lopez-Sebastian, A, Gonzalez-Bulnes A. Systemic and intraovarian effect of corpus luteum on folicular dynamics during estrous cycle in hair breed sheep. Anim Reprod Sci 2008;104:47-55. [ Links ]
10. González-Reyna A, Valencia MJ, Foote WC, Murphy BD. Hair sheep in México: reproduction in the Pelibuey sheep. Anim Breed Abstr 1991;59:509-524. [ Links ]
11. Evans ACO, Duffy P, Hynes N, Boland MP. Waves of follicle development during the estrous cycle in sheep. Theriogenology 2000;53:699-715. [ Links ]
12. Peter AT, Levine H, Drost M, Bergfelt DR. Compilation of classical and contemporary terminology used to describe morphological aspects of ovarian dynamics in cattle. Theriogenology 2009;71:1343-1357. [ Links ]
13. Fabre S, Pierre A, Mulsant P, Bodin L, Di Pasquale E, Persani L, et al. Regulation of ovulation rate in mammals: contribution of sheep genetic models. Reprod Biol Endocrinol 2006;4:20. [ Links ]
14. Scaramuzzi RJ, Adams NR, Baird DT, Campbell BK, Downing JA, Findlay JK, et al. A model for follicle selection and the determination of ovulation rate in the ewe. Reprod Fertil Dev 1993;5:459-478. [ Links ]
15. Campbell BK, Scaramuzzi RJ, Webb R. Control of antral follicle development and selection in sheep and cattle. J Reprod Fertil 1995;49:335-350. [ Links ]
16. Mariana JC, Monniaux D, Driancourt MA, Mauléon P. Folliculogenesis. In: Cupps PT. Reproduction in domestic animals. 4 ed. San Diego: Academic Press; 1991. pp.119-171. [ Links ]
17. Brand A, De Jong WHR. Qualitative and quantitative micromorphological investigations of the tertiary follicle population during the oestrus cycle in sheep. J Reprod Fert 1973;33:431-439. [ Links ]
18. McNeilly AS, Picton HM, Campbell BK, Baird DT. Gonadotrofic control of follicle growth in the ewe. J Reprod Fert 1991;43:177-186. [ Links ]
19. Uribe-Velásquez LF, Oba E, Souza MIL. Población folicular y concentraciones plasmáticas de progesterona (P4) en ovejas sometidas a diferentes protocolos de sincronización. Arch Med Vet 2008;40:83-88. [ Links ]
20. Cahill LP, Mauleón P. Influences of season, cycle and breed on follicular growth rates in sheep. J Reprod Fertil 1980;58:321-328. [ Links ]
21. Cahill LP, Mariana JC, Mauleon P. Total follicular populations in ewes of high and low ovulation rates. J Reprod Fertil 1979;55:27-36. [ Links ]
22. Picazo RA, López AS. Desarrollo folicular en el ovario de la especie ovina. Invest Agrar: Prod Sanid Anim 1995;10:77-93. [ Links ]
23. Bartlewski PM, Beard AP, Rawlings N.C. An ultrasound-aided study of temporal relationships between the pattern of LH/FSH secretion, development of ovulatory-sized antral follicles and formation of corpora lutea in ewes. Theriogenology 2000;54:229-245. [ Links ]
24. Noel B, Bister JL, Pierquin B, Paquay R. Effects of FGA and PMSG on follicular growth and LH secretion in Suffolk ewes. Theriogenology 1994;41:719-727. [ Links ]
25. Souza CJ, Campbell BK, Baird DT. Follicular waves and concentrations of steroids and inhibin A in ovarian venous blood during the luteal phase of the oestrous cycle in ewes with an ovarian autotransplant. J Endocrinol 1998;156:563-572. [ Links ]
26. Barrett DMW, Bartlewski PM, Batista-Arteaga M, Symington A, Rawlings NC. Ultrasound and endocrine evaluation of the ovarian response to a single dose of 500 IU of eCG following a 12-day treatment with progestogen-releasing intravaginal sponges in the breeding and nonbreeding season in ewes. Theriogenology 2004;61:311-327. [ Links ]
27. Bister JL, Noel B, Perrad B, Mandiki SNM, Mbayahaga SNM, Paquay R. Control of ovarian follicles activity in the ewe. Dom Anim Endoc 1999;17:315-328. [ Links ]
28. Uribe-Velásquez LF, Oba E, Souza MIL, Vélez-Marín M. Ondas foliculares durante o ciclo estral em ovelhas Bergamácia sob luteólise natural e induzida. En: Mem. Resúmenes 46º Reunión Anual de la Sociedad Brasilera de Zootecnia. Maringá - Paraná (Brasil); 2009. p. 1-3. [ Links ]
29. Liu X, Dai Q, Hart EJ, Duggavathi R, Barret DMW, Rawlings NC, et al. Ovarian and endocrine responses to prostaglandin F2a (PGF2a) given at the expected time of the endogenous FSH peak at mid-cycle in ewes. Theriogenology 2006;66:811-821. [ Links ]
30. Ginther OJ, Kot K, Wiltbank MC. Associations between emergence of follicular waves and fluctuations in FSH concentrations during the estrous cycle in ewes. Anim Reprod Sci 1995;43:689-703. [ Links ]
31. Lucy MC, Savio JD, Badinga L, De La Sota RL, Thatcher WW. Factors that affect ovarian follicular dynamics in cattle. J Anim Sci 1992;70:3615-3626. [ Links ]
32. Cahill LP, Mauleón P. A study of the population of primordial and small follicles in the sheep. J Reprod Fertil 1981;62:201-206. [ Links ]
33. Ackland JF, Schwartz NB, Mayo NB, Dodson RE. Nonsteroidal signals originating in the gonads. Physiol Rev 1992;73:731-787. [ Links ]
34. Dufour J, Cahill LP, Mauleón P. Short- and long-term effects of hypophysectomy and unilateral ovariectomy on ovarian follicular populations in sheep. J Reprod Fertil 1979;57:301-309. [ Links ]
35. Fortune, J.E. Ovarian follicular growth and development in mammals. Biol Reprod 1994;50:225-232. [ Links ]
36. Lussier JG, Matton P, Dufour JJ. Growth rates of follicles in the ovary of the cow. J Reprod Fertil 1987;81:301-307. [ Links ]
37. Quirk SM, Fortune JE. Plasma concentrations of gonadotrophins, preovulatory follicular development and luteal function associated with bovine follicular fluid-induced delay of oestrus in heifers. J Reprod Fertil 1986;76:609-621. [ Links ]
38. Hyttel P, Callesen H, Greve T, Schmidt M. Oocyte maturation and sperm transport in superovulated cattle. Theriogenology 1991;35:91-108. [ Links ]
39. Dufour J, Whitmore HL, Ginther OJ, Casida LE. Identification of the ovulatory follicle by its size on different days of the estrous cycle in heifers. J Anim Sci 1972;34:85-87. [ Links ]
40. Matton P, Adelakoun V, Couture Y, Dufour JJ. Growth and replacement of the bovine ovarian follicles during the estrous cycle. J Anim Sci 1981;52:813-819. [ Links ]
41. Lahlou-Kassi A, Mariana JC. Ovarian follicular growth during the oestrus cycle in two breeds of ewes of different ovulation rate, the D'Man and the Timahdite. J Reprod Fertil 1984;72:301-310. [ Links ]
42. Pierson RA, Ginther JO. Follicular populations during the estrous cycle in heifers. I - influence of day. Anim Reprod Sci 1987;14:165-176. [ Links ]
43. Ginther OJ, Knopf L, Kastelic JP. Temporal associations among events in cattle during oestrus cycle with two or three follicular waves. J Reprod Fertil 1989;87:223-230. [ Links ]
44. Haresign W, Cooper AC, Khalid M, Hanrahan JP. Patterns of gonadotropin secretion in cyclic Finn ewes selected for low and again high ovulation rate. Anim Sci 1995;61:251-257. [ Links ]
45. Sirois J, Fortune JE. Lengthening of the bovine estrous cycle with low levels of exogenous progesterone: a model for studying ovarian follicular dominance. Endocrinology 1990;127:916-925. [ Links ]
46. Fortune JE. Follicular dynamics during the bovine estrous cycle: A limiting factor in improvement of fertility? Anim Reprod Sci 1993;33:111-125. [ Links ]
47. Badinga L, Thatcher WW, Wilcox CJ, Morris G, Entwistle K, Wolfenson D. Effect of season on follicular dynamics and plasma concentrations of estradiol-17 , progesterone and luteinizing hormone in lactating Holstein cows. Theriogenology 1994;42:1263-1274. [ Links ]
, progesterone and luteinizing hormone in lactating Holstein cows. Theriogenology 1994;42:1263-1274. [ Links ]
48. Viñoles C, Banchero G, Rubianes E. Follicular wave pattern and progesterone concentrations in cycling ewes with high and low body condition score. En: Mem. Resúmenes de la Conferencia Annual de la Sociedad Internacional de Transferencia de Embriones. Québec City - Québec (Canadá); 1999. p. 437. [ Links ]
49. Pierson RA, Ginther JO. Follicular populations during the estrous cycle in heifers. II - Influence of right and left sides and intraovarian effect of the corpus luteum. Anim Reprod Sci 1987;14:177-186. [ Links ]
50. Scaramuzzi RJ, Downing, JA. The distribution of ovulations from the ovaries of Merino and Border Leicester x Merino ewes and its effect on the survival of their embryos. Anim Reprod Sci 1997;47:327-336. [ Links ]
51. Dufour J, Ginther OJ, Casida LE. Intraovarian relationship betwen corpora lutea and ovarian follicles in ewes. Am J Vet Res 1972;33:1445-1446. [ Links ]
52. Dailey RA, Fogwell RL, Thayne WV. Distribution of visible follicles on the ovarian surface in ewes. J Anim Sci 1982;54:1196-1204. [ Links ]
53. Hutchinson JSM, Robertson HA. The growth of the follicle and corpus luteum in the ovary of the sheep. Res Vet Sci 1966;7:17-24. [ Links ]
54. Noel B, Bister JL, Paquay R. Ovarian follicular dynamics in Suffolk ewes at differents periods of the year. J Reprod Fert 1993;99:695-700. [ Links ]
55. Driancourt MA. Follicular dynamics in sheep and cattle. Theriogenology 1991;35:55-68. [ Links ]
56. Driancourt MA, Webb R, Fry RC. Does follicular dominance occur in ewes? J Reprod Fert 1991;93:63-70. [ Links ]
57. Kruip, A.M., Brand, A. Follicular growth during the normal cycle and after treatment with progestagens in the ewe. Ann Biol Anim Biochem Biophys 1975;15:191-204. [ Links ]
58. González-Bulnes A, Moreno JS, García LM, Gomez BA, Lopez SA. Observación del ovario en la oveja y eficacia en la detección de folículos y cuerpos lúteos mediante ecografía transrectal. Invest Agr Prod Sanid Anim 1994;9:319-329. [ Links ]
59. Rubianes E, Castro T, Carbajal B. Effect of high progesterone levels during the growing phase of the dominant follicle of wave 1 in ultrasonically monitored ewes. Can J Anim Sci 1996b;76:1-13. [ Links ]
60. Souza CJH, Campbell BK, Baird DT. Follicular dynamics and ovarian steroid in sheep during anoestrus. J Reprod Fertil 1996;108:101-106. [ Links ]
61. Uribe-Velásquez LF, Oba E, Lara-Herrera LC, Souza MIL, Villa-Velásquez H, Trinca LA, et al. Respostas endócrinas e ovarianas associadas com o folículo dominante da primeira onda folicular em ovelhas sincronizadas com CIDR ou PGF2a. Rev Bras Zootec 2002;31(2):944-953. [ Links ]
62. Bartlewski PM, Beard AP, Rawlings NC. The relationship between ovarian follicular wave development and transient increases in serum FSH and oestradiol concentration throught the ovine oestrus cycle. En: Annual Conference for the Study of Fertility. Glasgow: Society for the Study of Fertility; 1998. pp. 12-13. [ Links ]
63. Evans ACO. Characteristics of ovarian follicle development in domestic animals. Reprod Dom Anim 2003; 38:240-246. [ Links ]
64. Hirshfield AN. Relationship between the supply of primordial follicles and the onset of follicular growth in rats. Biol Reprod 1994;50:421-428. [ Links ]
65. Adams GP, Matteri RL, Kastelic JP, Ko JCH, Ginther OJ. Association between surges of follicle-stimulating hormone and the emergence of follicular waves in heifers. J Reprod Fertil 1992;94:77-88. [ Links ]
66. Cahill LP, Driancourt MA, Chamley WA, Findlay JK. Role of intrafollicular regulators and FSH in growth and development of large antral follicles in sheep. J Reprod Fertil 1985;75:599-607. [ Links ]
67. Driancourt MA, Gougeon A, Royère D, Thibault C. Ovarian function. In: Thibault C, Levasseur MC, Hunter RHF. Reproduction in mammals and man. Paris: Ellipses; 1993. pp. 283-305. [ Links ]
68. Gong JG, Campbell BK, Bramley TA, Webb R. Treatment with recombinant bovine somatotrophin enhances ovarian follicle development and increases the secretion of insulin-like growth factor-I by ovarian follicles in ewes. Anim Reprod Sci 1996;41:13-26. [ Links ]
69. Findlay JK. Peripheral and local regulators of folliculogenese. Reprod Fertil Dev 1996;6:127-139. [ Links ]
70. Rubianes E, Castro T, Ungerfeld R. Ondas de desarrollo folicular y respuesta ovárica en la oveja. En: Simposio Internacional de Reproducción Animal. Córdoba: Instituto de Reproducción Animal Córdoba (IRAC); 1996. pp. 87-97. [ Links ]
71. Roche JF, Boland MP. Turnover of dominant follicles in cattle of differents reproductive states. Theriogenology 1991;35:81-90. [ Links ]