Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Biosalud
Print version ISSN 1657-9550
Biosalud vol.9 no.1 Manizales Jan./June 2010
COMPORTAMIENTO DE LOS NIVELES DE IgM e IgG EN CERDAS DE CRÍA EN VARIAS PORCÍCOLAS DEL EJE CAFETERO COLOMBIANO VACUNADAS CONTRA LEPTOSPIRA CON UNA VACUNA PENTAVALENTE
BEHAVIOR OF IgM and IgG LEVELS IN PREGNANT SOWS IN HERDS OF THE COFFEEGROWING REGION OF COLOMBIA VACCINED AGAINST LEPTOSPIRA WITH A PENTAVALENT VACCINE
Jorge Enrique Pérez Cárdenas1, Héctor Jaime Aricapa Giraldo2, Nicole Andrea Martínez Restrepo3 y Gustavo Adolfo Cifuentes Villaquirán3
1 Profesor del Departamento de Ciencias Básicas para la Salud, Facultad de Ciencias para la Salud, Universidad de Caldas, Manizales (Caldas, Colombia).
2 Profesor del Departamento de Salud Animal, Facultad de Ciencias Agropecuarias, Universidad de Caldas, Manizales (Caldas, Colombia).
3 Estudiantes de Medicina Veterinaria y Zootecnia, Facultad de Ciencias Agropecuarias, Universidad de Caldas, Manizales (Caldas, Colombia).
Recibido: noviembre 10 del 2009 - Aceptado: mayo 24 del 2010
RESUMEN
El objetivo de este estudio fue determinar los niveles de anticuerpos posvacunales contra diferentes serovares de Leptospira en 78 cerdas de cría en dos momentos diferentes de la gestación (días 90 a 95: momento 1 y días 110 a 114: momento 2), mediante el uso de las técnicas de Microaglutinación (MAT) e Inmunofluorescencia Indirecta (IFI). Cada suero fue probado contra seis serovares de Leptospira (Canicola, Hardjo bovis, Pomona, Grippotyphosa, Icterohaemorrhagiae y Bratislava). Los resultados obtenidos muestran un 59% de positividad mediante MAT en el primer muestreo y del 17% en el segundo muestreo, siendo los serovares Icterohaemorrhagiae y Hardjo bovis los más prevalentes; por medio de IFI se encontró un 100% de sueros positivos en ambos muestreos para al menos uno de los serovares estudiados, con títulos entre 1:64 y 1:512, en el primer muestreo y una pronunciada disminución en los títulos en el segundo muestreo o negativización de los mismos; los serovares más prevalentes por IFI fueron Icterohaemorrhagiae y Canicola. Se concluye de esta investigación la baja capacidad protectora de esta vacuna al encontrar un aumento en el número de animales seropositivos para IgM en el segundo muestreo frente a algunos de los serovares estudiados, así como también el aumento de los títulos de IgG frente a Icterohaemorrhagiae en el segundo muestreo y su pobre capacidad de protección a los lechones en sus primeros días de vida al observarse una negativización de ambos tipos de anticuerpos al final de la gestación.
PALABRAS CLAVE: leptospira, técnicas inmunológicas, cerdos, técnica de anticuerpo fluorescente indirecta, pruebas de aglutinación, inmunoglobulina M, inmunoglobulina G.
ABSTRACT
The goal of this study was to determine the levels of postvaccinal antibodies against several serovars of Leptospira in 78 sows in two different gestation moments (day 90 to 95: moment 1, and day 110 to 114: moment 2), using the Micro agglutination (MAT) and Indirect Immunofluorescence (IFI) techniques. Each serum was tested for six serovars of Leptospira (Canicola, Hardjo bovis, Pomona, Grippotyphosa, Icterohaemorrhagiae and Bratislava) donated by the Center of Diagnostics of the Instituto Colombiano Agropecuario (ICA) in Manizales-Caldas-Colombia. The results showed a 59% positive sera using MAT in moment one and a 17% in moment two, with Icterohaemorrhagiae and Hardjo bovis as the most prevalent. By means of the IFI technique 100% of sera were positive in both moments, for at least one of the serovars tested, with titers between 1:64 and 1:512 in the first moment and a strong decrease or absence of the titers in the second moment; the most prevalent serovars for IFI were Icterohaemorrhagiae and Canicola. In conclusion, this vaccine has a low protection capacity since an increase in the number of seropositive sows with IgM was observed against some serovars of Leptospira in the second moment, as well as an increase in the levels of IgG against Icterohaemorrhagiae in the second moment, and its low protection capacity in offspring in their first days of life associated with a decrease of the antibodies at the end of the gestation.
KEY WORDS: Leptospira, immunological techniques, swine, indirect fluorescent antibody technique, agglutination test, immunoglobulin M, immunoglobulin G.
INTRODUCCIÓN
El género Leptospira corresponde a un grupo de bacterias del phyllum Spirochaetes, que se caracteriza por estar formado por bacterias aeróbias o microaerofílicas, similares a las Gram negativas debido a que su pared celular está formada por una membrana celular externa, la cual rodea la capa de peptidoglicano (1, 2). En este género se encuentran tres grupos evolutivos: el saprofítico en el que se incluyen siete especies (Leptospira biflexa, Leptospira wolbachii, Leptospira kmetyi, Leptospira meyeri, Leptospira vanthielii, Leptospira terpstrae and Leptospira yanagawae); el patógeno, conformado por ocho especies (Leptospira interrogans, Leptospira kirschneri, Leptospira borgpetersenii, Leptospira santarosai, Leptospira noguchii, Leptospira weilii, Leptospira alexanderi and Leptospira alstoni) y el grupo denominado como intermedio en el cual se han ubicado cinco especies a las que no se les ha comprobado su capacidad patógena (Leptospira inadai, Leptospira broomii, Leptospira fainei, Leptospira wolffii and Leptospira licerasiae) (35, 39). Leptospira interrogans y Leptospira borgpetersenii, se han considerado como las especies patógenas más representativas, las cuales se caracterizan por infectar un gran número de mamíferos incluyendo al hombre y por tener alrededor de 230 serovariedades y 25 serogrupos (36, 38).
La leptospirosis es una enfermedad primaria frecuente en los animales domésticos de interés zootécnico, que puede incluso transmitirse al hombre (2, 3, 4), y es causante de considerables pérdidas económicas en los predios en los cuales se presenta ya sea de forma aguda o crónica. Es una de las patologías infecciosas de mayor prevalencia en las granjas porcinas de cría (5); los agentes etiológicos más frecuentemente aislados son los serovares: Pomona, Bratislava, Canicola, Tarassovi, Icterohaemorrhagiae y con menor frecuencia los serovares: Grippotyphosa y Sejroe (37). En la forma aguda de la enfermedad se presenta fiebre, mastitis no supurativa focal y leptospiruria; en los animales jóvenes, especialmente en los lechones hay fiebre, anorexia, ictericia, hemoglobinuria y alta mortalidad; usualmente el serovar más asociado con estos síntomas es el Icterohaemorrhagiae, causante además de encefalitis, caracterizada por incoordinación y episodios convulsivos (27).
La leptospirosis crónica es común en cerdos adultos y es frecuente la leptospiruria, asociada principalmente con la variedad Pomona, adquiriendo el animal un estado de portador asintomático; la infertilidad, los abortos y los mortinatos se han asociado con los serovares Canicola, Pomona, Icterohaemorrhagiae y Bratislava (27, 28).
La inmunidad pasiva transferida a los lechones se hace principalmente a través del calostro, ya que en esta especie la placenta es epiteliocorial y no permite la transferencia de los anticuerpos al feto; a pesar de este hecho, experimentos realizados en los que se han inoculado leptospiras vivas atenuadas en la cavidad amniótica a los 60 días de gestación y luego de un embarazo de 101 días, no se observó signos de infección en los fetos, pero sí altos niveles de IgG y anticuerpos aglutinantes; lo cual indica que los fetos dos semanas antes del parto están en condiciones de protegerse contra un ataque infeccioso por leptospiras. La permeabilidad intestinal de los lechones es de corta duración, y por lo tanto gran parte de la inmunidad pasiva se adquiere en las primeras horas de vida del mismo; el anticuerpo que es más absorbido durante estas primeras horas es la IgG (27).
Ya que la leptospirosis es una de las principales causantes de falla reproductiva en porcinos (6, 7), es necesaria la implementación de diferentes medidas de prevención y control de la enfermedad; una de ellas es el uso de vacunas, para lo cual en las granjas objeto de estudio de esta investigación han utilizado una vacuna pentavalente (también denominada bacterina), producida con cinco serovares inactivados de Leptospira: Hardjo, Canicola, Pomona, Grippotyphosa e Icterohaemorrhagiae, utilizando como protocolo de vacunación la aplicación de una dosis de la vacuna a las cerdas a partir de los cinco días luego del parto, con una inseminación 37 días después.
El uso de esta vacuna en otros estudios ha demostrado que genera una inmunidad humoral adecuada, al generar niveles elevados de anticuerpos frente al lipopolisacárido (LPS) de todos los serovares con excepción de la variedad Hardjo; los anticuerpos generados usualmente están dirigidos contra el lipopolisacárido (LPS), anticuerpos que pueden ser transferidos a los lechones para conferir inmunidad pasiva; pero también se ha demostrado que dichos animales, a pesar de haber recibido la vacuna siguen mostrando liberación de bacterias. Se ha descrito la presencia de abortos en otras especies de animales tales como vacas luego del uso de estos tipos de vacunas, razón por la cual se considera que el estímulo de la inmunidad humoral es insuficiente para protegerlos frente a las diferentes serovariedades de Leptospira (25).
El uso de la vacuna multivalente en cerdos ha sido documentada, y se ha demostrado que la utilidad de la misma reside en su capacidad de generar cobertura inmunológica frente a aquellos serovares prevalentes en dicha zona, sin embargo, se ha considerado que la eficacia es dudosa debido a varios factores tales como la disminución de los niveles de IgM al cabo de 28 días luego de la vacunación, y a que no se desarrollan anticuerpos contra todos los serovares inoculados; sin embargo, a pesar de que hay bajos niveles de anticuerpos en el suero de los animales vacunados, estos pueden proteger de la infección con Leptospira spp. (29).
Pocos estudios han analizado los niveles de IgG luego de la aplicación de esta vacuna; estudios realizados en perros con una vacuna bivalente producida con dos serotipos de Leptospira interrogans específicas del perro: los serovares Canicola e Icterohaemorrhagiae, demostraron que los niveles de IgG pueden permanecer hasta por tres meses; a pesar del uso de dos dosis aplicadas con un mes de intervalo, se encontró que no se eliminaba la posibilidad de que los perros fueran portadores asintomáticos ya que se encontró predominantemente el serovar Canicola en la orina, sin que hubiera cambios patológicos a nivel renal como nefritis intersticial (26).
El diagnóstico de la leptospirosis se basa en la medición de IgM por medio de la técnica de microaglutinación lisis (MAT), en la que se acepta que hay infección cuando hay títulos de IgM mayores de 1:100, siendo arbitrarios, ya que excluyen animales con títulos inferiores (8); para la identificación de los niveles de IgG se han utilizado diferentes métodos tales como inmunoensayo enzimático (ELISA) y pruebas en las que se detectan anticuerpos neutralizantes (30); en cualquiera de estas pruebas, se determina la presencia de los mismos frente a una mezcla total de Leptospira, no permitiendo estás técnicas discriminar frente a cuáles serotipos se presentan estos anticuerpos; por esta razón, se hace necesario implementar otros métodos como la inmunofluorescencia indirecta (IFI), capaz de demostrar portadores crónicos, monitorear la enfermedad y evaluar los niveles de anticuerpos luego de un estado posvacunal mediante la detección de IgG.
Con el fin de evaluar la inmunidad adquirida por las cerdas al ser inmunizadas con la vacuna pentavalente, se determinaron los niveles de IgG e IgM al final de la gestación necesarios para la protección de los lechones en sus primeros días de vida, se realizó este estudio midiendo los niveles de ambos tipos de anticuerpos por medio de las técnicas de inmunofluorescencia directa (IFI) y microaglutinación (MAT) respectivamente en dos momentos diferentes de la gestación.
MATERIALES Y MÉTODOS
El estudio se llevó a cabo en nueve granjas porcinas pertenecientes a la Cooperativa de Porcicultores del Eje Cafetero (CERCAFÉ), localizadas en la región centro occidente de Colombia, en los departamentos de Caldas, Risaralda y norte del Valle del Cauca, con altitudes que van desde los 800 msnm hasta los 2000 msnm y temperaturas entre los 18 y 28 ºC, aproximadamente.
OBTENCIÓN DE INFORMACIÓN
Se realizó una encuesta en los sistemas de producción porcinos evaluados con el fin de asociar la positividad obtenida mediante dos pruebas serológicas (MAT e IFI) con los factores de riesgo y los síntomas reproductivos tales como abortos, fallas en la concepción, número de lechones por camada y mortinatos.
OBTENCIÓN DE LOS SUEROS
La recolección de las muestras se realizó durante el periodo comprendido entre septiembre de 2005 a mayo de 2006; se escogieron al azar 78 hembras entre el primer y quinto parto, las cuales contaban con un esquema vacunal para Leptospira (Grippotyphosa, Icterohaemorrhagiae, Canicola, Hardjo bovis y Pomona) aplicado al quinto día posparto. Éstas se sangraron entre los días 90-95 de gestación (momento 1) y entre el día 110-114 (momento 2). De cada cerda se obtuvo sangre de la vena cava anterior, en tubos al vacio (Vacutainer®) sin anticoagulante; las muestras fueron transportadas al Laboratorio de Microbiología de la Universidad de Caldas, en un tiempo máximo de seis horas, para ser centrifugadas a 3500 rpm por cinco minutos. El suero obtenido se depositó en tubos eppendorf de 1,5 ml para luego ser almacenado a menos 30 ºC hasta su procesamiento.
OBTENCIÓN DEL ANTÍGENO
Los seis serovares fueron gentilmente donados por el Centro de Diagnóstico del Instituto Colombiano Agropecuario (ICA) seccional Manizales-Colombia. Dichas cepas se cultivaron en medio EMJH líquido (Ellinghausen- MacCullough-Johnson-Harris) a 27 ºC por 10 días para así ser usadas como antígeno en las pruebas serológicas.
PRUEBA DE MICROAGLUTINACIÓN (MAT)
Las muestras fueron procesadas para Leptospira mediante la prueba de MAT en el Centro de Diagnóstico del ICA seccional Manizales- Colombia, utilizando el protocolo descrito por el Centro Panamericano de Zoonosis, 1985 (11). Los sueros fueron diluidos con solución salina amortiguada con fosfatos (SAF), a un pH de 7,2; se preparó una dilución inicial de suero de 1:25; se depositó 2 ml de la dilución en dos tubos de ensayo uno de los cuales contenía 0,2 ml de buffer; a partir de este segundo tubo, se hicieron las siguientes diluciones: 1:100, 1:200, 1:400, 1:800; se agregó 50 µl del antígeno; las mezclas antígeno-suero se incubaron a temperatura ambiente durante dos horas, tiempo al cabo del cual se determinó el grado de aglutinación de Leptospira en un microscopio de campo oscuro.
El título de aglutinación de los sueros se expresó como la dilución más alta en la cual aglutinaron por lo menos el 50% de las bacterias.
INMUNOFLUORESCENCIA INDIRECTA (IFI)
Preparación del Antígeno
Los cultivos fueron examinados en microscopio de campo oscuro para verificar su homogeneidad y densidad; se ajustó el número de unidades formadoras de colonias frente al tubo 0,5 de la escala estándar media de Mc Farland (108 UFC/ml) (10).
Cada cultivo se depositó en un tubo cónico estéril (Falcon®), para inactivar el microorganismo con formol bufferado al 10% mediante agitación manual durante 10 minutos; se centrifugó durante 20 minutos a 3500 rpm, posteriormente se retiró el sobrenadante y se agregó buffer fosfato salino (PBS) pH 7,2 a partes iguales con el sedimento; se centrifugó a 3500 rpm durante 20 minutos. El procedimiento anterior, se repitió 2 veces más.
Fijación del Antígeno
Para cada serovar se utilizó una dilución 1:4 del antígeno; a cada pozo de la placa de inmunofluorescencia se le depositó 20 µl del serovar evaluado y se dejó secar a temperatura ambiente durante 24 horas; las placas fijadas con antígeno se colocaron en acetona pura durante 15 minutos, luego se dejaron secar a temperatura ambiente, posteriormente se envolvieron en papel seda y se conservaron a -25 ºC hasta su utilización.
Detección de Inmunoglobulina G
Se siguió el método descrito por Pierluigie y Richard, 1980 (13). Se hizo una dilución 1:64 de cada suero; a cada pozo de la placa de inmunofluorescencia se le colocó 15 µl de la dilución; se incubó a 37 ºC durante 30 minutos en baño de agua; posteriormente se lavó el exceso de cada pozo con PBS 0,015 M. pH 7,2 y se colocaron con PBS durante 5 minutos en agitación constante; se hicieron dos lavados más sin agitación por 5 minutos y un cuarto con agua destilada por el mismo periodo de tiempo. Se eliminó el exceso de solución de lavado de la placa y se adicionó a cada pozo 15 µl de IgG anti-pig conjugada a isotiocinato de fluoresceína (Sigma®) en una dilución de 1:64 en azul de Evans 1:8000. Se incubó a 37 ºC durante 30 minutos en baño de agua y se repitió el procedimiento de lavado anteriormente descrito; se colocaron algunas gotas de buffer glicerol fosfato (pH 8,0), las que se dispersaron en la placa al colocar la laminilla cubreobjetos (22 x 60 mm). La reacción se visualizó en un microscopio de epifluorescencia con fuente de luz halógena, utilizando para ello el objetivo de 100x.
En cada placa se incluyó un suero control positivo en una dilución 1:32, un suero control negativo a una dilución 1:64, así como también una alícuota de buffer. Para la interpretación de los resultados obtenidos se consideró como positiva la presencia de fluorescencia homogénea sobre las estructuras espiroquetales, y como reacción negativa: ausencia de fluorescencia.
El criterio para fijar el punto final del título del suero fue la más alta dilución que diera una lectura de fluorescencia comparable al control positivo.
A cada una de las muestras positivas (título mayor o igual a 1:64), se le practicaron diluciones seriadas, con el fin de titular los niveles de lgG para cada serovar.
El análisis estadístico se realizó utilizando el programa SAS (SAS Inst. Inc., Cary, NC); para estimar las prevalencias por parto y momento empleando el PROC FREQ con la prueba de Χ2. Se obtuvieron tablas de contingencia (2x2) de positividad y negatividad para comparar las técnicas diagnósticas MAT e IFI mediante la prueba de Kappa (12). Los datos obtenidos en la encuesta se tabularon en una escala binaria (0= ausencia, 1= presencia) utilizando el PROC CORR, se estimaron correlaciones entre las prevalencias de cada granja para cada serovar.
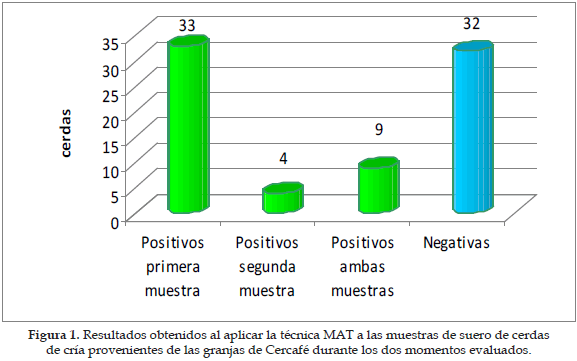
RESULTADOS
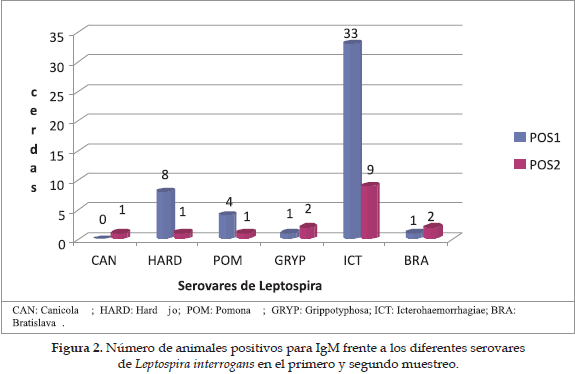
De las 78 muestras evaluadas 46 (59%) fueron positivas para los diferentes serovares de Leptospira mediante el método de MAT. El mayor número de animales positivos se encontró en el primer muestreo (54%), con una pronunciada disminución de estos en el segundo muestreo (17%); solamente 4 muestras fueron positivas para el mismo serovar en ambos muestreos (Icterohaemorrhagiae) (Figura 1); el mayor porcentaje de sueros positivos en el primer muestreo correspondió a Icterohaemorrhagiae (70%), seguido por Hardjo bovis (17%) y Pomona (9%); en el segundo muestreo se observó una variación estadísticamente significativa en el número de animales positivos para los serovares Hardjo bovis, (p<0,05) e Icterohaemorrhagiae, (p<0,01) (Figura 2).
Los títulos de anticuerpos en la prueba de MAT fueron predominantemente bajos (títulos menores o iguales a 1:200 en el 98% de las muestras positivas).
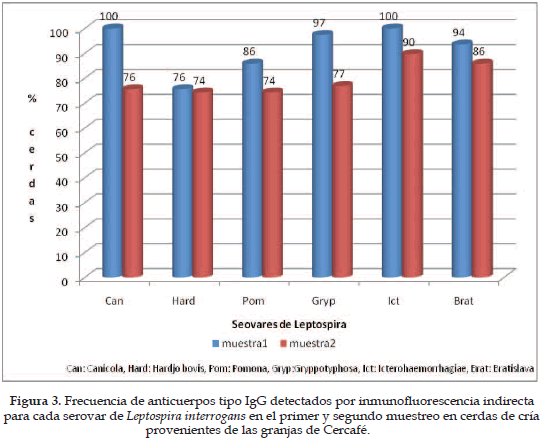
En la Figura 3 se observa la frecuencia de muestras positivas para cada serovar por el método de IFI, tanto en el primero como en el segundo muestreo. En el primer muestreo todos los sueros presentaron títulos de IgG contra al menos dos de los serovares probados; la mayoría fueron positivos para el total de los serovares (68%); en el total de las muestras se encontraron anticuerpos frente a Canicola e Icterohaemorrhagiae. En el segundo muestreo se observa una disminución en el número de animales positivos, presentándose un aumento considerable en el número de animales negativos para Canicola (78 positivas en el primero y 59 en el segundo) y Grippotyphosa (76 positivos en el primero y 60 en el segundo), con una variación altamente significativa (P<0,01).
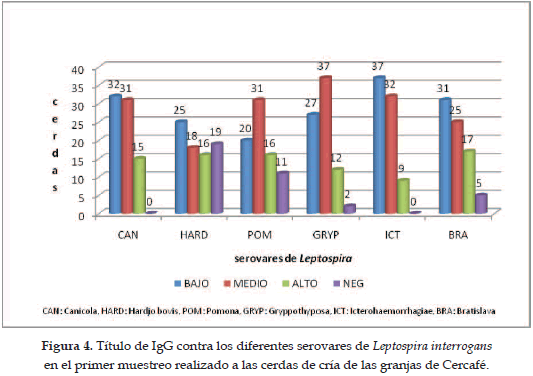
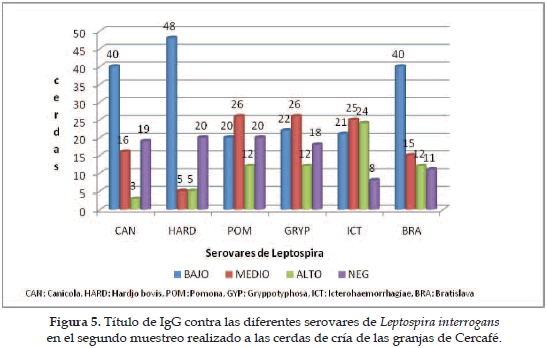
En las Figuras 4 y 5 se muestra el comportamiento de los niveles de IgG en cada muestreo para cada serovar. Se observa que el 80% de las muestras positivas en el primer muestreo presentaron títulos de anticuerpos con valores bajos y medios (valores menores de 1:128 para los títulos bajos, y valores entre 1:128 y 1:512 para los títulos medios), mientras que en el segundo muestreo predominan los títulos bajos, así como también aumenta el número de animales que no presentan anticuerpos contra uno o varios de los serovares; es de resaltar el aumento en el número de animales con títulos altos (títulos mayores de 1:512) para el serovar Icterohaemorrhagiae.
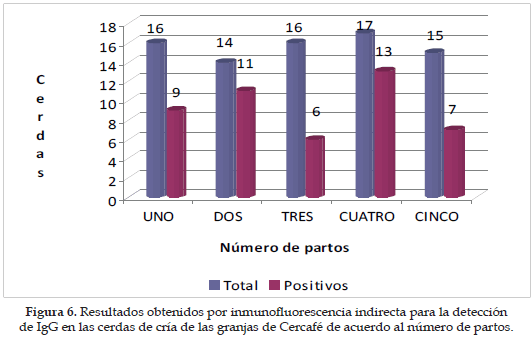
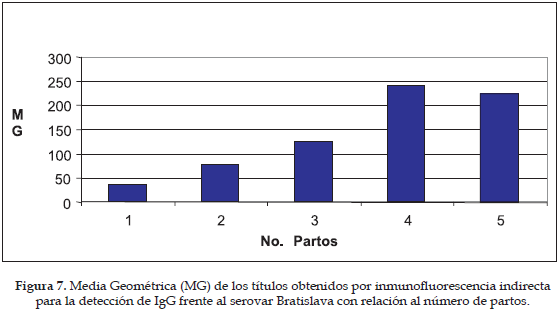
El número de partos osciló entre 1 a 5 para la muestra obtenida, presentando una distribución homogénea; el número de animales seropositivos para IgG según el número de partos osciló entre el 24 y el 44%, siendo el grupo con tres partos el que presentó menor número de cerdas positivas (Figura 6); al analizar individualmente los títulos de anticuerpos obtenidos para cada uno de los serovares con respecto al número de partos, se encontró una diferencia signifi cativa (p<0,05) únicamente en el serovar Bratislava (Figura 7).
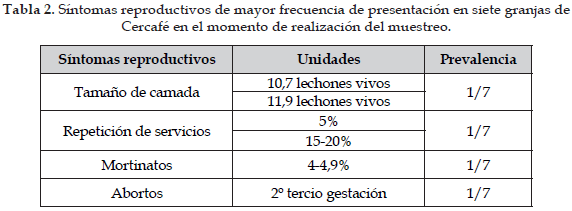
Se realizó una encuesta en siete de las granjas evaluadas con el fin de asociar la presencia de anticuerpos contra los diferentes serovares de Leptospira, con los factores de riesgo, al igual que con los síntomas reproductivos presentes en los sistemas productivos porcinos evaluados; se encontró una diferencia significativa (p<0,05) para Canicola que presentó una relación directa con el tamaño de la camada (11,9 lechones vivos/camada), con el almacenamiento de concentrado en silos, la presencia de perros y roedores; y la repetición de servicios (5%). Así mismo, el serovar Grippotyphosa se relacionó directamente con el tamaño de la camada (10,7 lechones vivos/camada), y el porcentaje de mortinatos (4-4,9 lechones muertos/camada). El serovar Bratislava se relacionó con abortos en el segundo tercio de la gestación y repetición de servicios (15-20%) (Tabla 2).
DISCUSIÓN
Los esquemas de vacunación en cerdas de cría contra Leptospira, se caracterizan por una aplicación de la vacuna pocos días antes del servicio, con varios propósitos: la disminución de la cantidad de servicios por hembra, la disminución del número de abortos y mortinatos, y la generación de una inmunidad pasiva que pueda ser transferida a los lechones y los proteja en sus primeros días de vida. El uso de las bacterinas según resultados obtenidos en investigaciones realizadas en diferentes especies de animales, han mostrado resultados contradictorios ya que aunque los niveles de anticuerpos aglutinantes (IgM) bajan rápidamente, la transferencia pasiva del suero de estos a animales de experimentación han mostrado una protección frente al reto infeccioso generado con diferentes especies de Leptospira; además, también se ha demostrado la ausencia de leptospiras en la orina de los animales vacunados (26, 33).
Algunos estudios realizados han demostrado que la inmunidad frente a Leptospira se mantiene hasta por trece meses cuando se utiliza un esquema de vacunación en el que se emplean dos inoculaciones realizadas con un intervalo de 30 días (26, 33, 34); en el presente estudio, se pretendió observar cómo era el comportamiento de las IgM e IgG en cerdas al final de la gestación cuando se utiliza sólo una dosis de la vacuna pentavalente; cuál es la efectividad de esta dosis y de este tipo de vacuna en el mantenimiento del título de anticuerpos, y cuál es el efecto de la misma sobre algunos indicadores de la presencia de Leptospira tales como el número de abortos y mortinatos.
Al analizar los resultados obtenidos con la prueba de MAT, se observa que en el momento del primer muestreo ya ha habido una disminución en los títulos de IgM frente a Leptospira; el 98% de las muestras positivas, presentan títulos bajos (valores entre 1:100 y 1:200); otros estudios han demostrado la ausencia de IgM en los cerdos al cabo de 30 días de aplicada la vacuna (30), o la disminución de los títulos de IgM por debajo de 1:100 al cabo de 50 días de vacunación (31); en ensayos hechos en otros estudios, en los cuales se aplicó un refuerzo luego de 15 o 30 días de aplicada la primera dosis, se genera una nueva elevación de los anticuerpos aglutinantes por encima de los valores iniciales obtenidos con la primera inoculación (33, 34); en el presente estudio, se observa cómo al cabo de 90 días de gestación (es decir, luego de 127 días de aplicada la vacuna) un serovar (Canicola) no presenta muestras positivas en el primer muestreo; mientras que para los serovares Bratislava y Grippotyphosa sólo una muestra fue positiva. El efecto de este bajo número de reactores positivos en el primer muestreo se evidencia en el segundo muestreo, donde tres animales que eran previamente negativos presentaron seroconversión, indicando este hallazgo una infección reciente precisamente asociada con los serovares Canicola y Grippotyphosa, lo cual está indicando una persistencia alta de estos dos serovares, asociada posiblemente a la baja capacidad protectora de la vacuna por el no mantenimiento de los títulos de IgM en los animales vacunados, efecto observado también en otros estudios (2); la evidencia de que estos dos serovares pueden estar relacionados con efectos adversos en la producción, se observa al encontrar una relación estadísticamente significativa relacionada con la presencia de los mismos y el número de lechones nacidos en cada una de las granjas estudiadas.
Algunos autores han sugerido que el uso de la vacuna pentavalente genera anticuerpos frente a los componentes de la pared celular de Leptospira y puede conferir una protección cruzada frente a otros serovares; en este estudio, se utilizó un serovar que no era cubierto por la vacuna (Bratislava) y se observa que aunque hay un animal que es seropositivo en el primer muestreo, en el segundo muestreo aparece otra cerda más con títulos. Este serovar al igual de lo que ocurre con los serovares Canicola y Grippotyphosa está asociado con infección reciente, con abortos en la segunda etapa de gestación y con repetición de servicios; estos hallazgos indican que dicha protección cruzada no existe y que se deben diseñar vacunas que generen una protección adecuada frente a los diferentes serovares de Leptospira presentes en la región; otras investigaciones, han demostrado que hay diferencias antigénicas pequeñas en la pared celular de algunas de las serovariedades de Leptospira que limitan la protección cruzada (32, 34).
La prevalencia general de anticuerpos encontrada en este estudio fue del 60% mediante la técnica MAT y de 100% por IFI, esto indica que 47 cerdas tenían IgM y el total IgG frente al menos uno de los serovares de Leptospira. Este hallazgo es similar al encontrado en la zona cafetera de Colombia por Orrego et al. (10) donde la prevalencia por MAT fue menor que la hallada por Inhibición del Crecimiento (IC), técnica de neutralización que detecta IgG; en este estudio, la menor frecuencia de IgM está relacionada con el momento en el cual se hizo el muestreo, ya que luego de aproximadamente 127 días después de haberse vacunado a los animales es de esperar que los niveles de IgM vayan cayendo, mientras que los niveles de IgG vayan en aumento; el número de cerdas con títulos de IgG debería aumentar a medida que aumenta el número de partos, ya que luego de cada parto cada cerda ha recibido la vacuna, sin embargo, no se observa que haya un cambio estadísticamente significativo de la frecuencia de animales con IgG con respecto al número de partos y solamente para el serovar Bratislava se observa un aumento del título de anticuerpos con respecto al número de partos; este resultado, puede estar indicando que en la respuesta inmunológica frente a esta vacuna están interviniendo antígenos T-independientes, los cuales se caracterizan porque en cada inoculación hay una elevación de los títulos de IgM semejante a la observada en la respuesta primaria a veces asociada con elevación de los niveles de IgG, pero sin la generación de memoria inmunológica.
Al comparar el cambio en los niveles de anticuerpos en los dos muestreos realizados, se encuentran algunos resultados que es importante resaltarlos: el primero, es la alta frecuencia de animales con títulos bajos o intermedios incluso en aquellos animales que han sido vacunados previamente (cerdas multíparas), este hallazgo refuerza el comentario realizado en el párrafo anterior relacionado con los antígenos T-independientes; algunos autores han demostrado que el uso de las bacterinas genera inmunidad contra el componente principal de la pared celular de este género de bacterias que es el lipopolisacárido (28, 32, 34), molécula que se ha demostrado es un antígeno T-independiente.
Segundo, la disminución pronunciada en el número de reactores positivos para las serovariedades Canicola y Grippotyphosa; está disminución está incidiendo en el aumento de animales positivos a IgM en el segundo muestreo, para estos dos serovares en particular, indicando este hallazgo una reinfección, asociada con efectos reproductivos adversos; este resultado está indicando además la importancia de la capacidad protectora de las IgG frente a reinfecciones por Leptospira, donde es posible que la presencia de IgG sea un factor importante en el proceso de neutralización del microorganismo, tal como lo han afirmado otros autores que han evaluado la respuesta frente a diferentes vacunas determinando los niveles de anticuerpos neutralizantes (30).
Tercero, el alto número de animales positivos a Bratislava, es comparable al obtenido frente a otros serovares incluidos en la vacuna como: Icterohaemorrhagiae, Grippotyphosa y Canicola; este hallazgo está indicando la alta exposición de estos animales a este serovar en particular, aunque no se podría descartar totalmente la presencia de anticuerpos de reacción cruzada, aspecto para el cual habría necesidad de hacer estudios adicionales que mostraran primero la frecuencia de Bratislava en la región y, segundo, si anticuerpos producidos por la vacunación reconocen antígenos presentes en este serovar en particular.
Un cuarto aspecto, se observa al comparar la variación del número de animales en cuanto al título de anticuerpos se refiere; es de esperarse que los niveles de anticuerpos vayan cayendo paulatinamente en el tiempo, sin embargo, al comparar los resultados de los dos muestreos, se observa que para Icterohaemorrhagiae el número de reactores positivos con títulos altos en vez de caer en el segundo muestreo aumentó; este hallazgo puede estar relacionado con reinfecciones, lo cual confirmaría el predominio de animales positivos para IgM para este serovar en particular en el primer muestreo, con una caída significativa en el número de animales seropositivos en el segundo muestreo, animales que posiblemente empezaron a generar IgG o aumentaron el título de este anticuerpo; este número elevado de animales seropositivos por MAT en vez de indicar alta capacidad protectiva de la vacuna frente a este serovar, está indicando más bien, una alta tasa de reinfección lo cual a su vez está relacionado con la presencia de roedores (16, 18) y caninos en las granjas; los primeros, pueden contaminar por medio de su orina el concentrado que sirve de alimento a los cerdos y, los segundos, pueden contaminar fuentes de agua que sirven de abastecimiento a estas granjas (17, 19); estudios seroepidemiológicos, han demostrado la predominancia del serovar Icterohaemorrhagiae en Colombia (10, 15, 20, 21, 22, 23) y en otras partes del mundo (9, 14, 24), donde se demuestra su importancia, debido a que el cerdo no es un reservorio primario para dicho serovar, llegando a producir mayores alteraciones sobre los parámetros productivos.
Dentro de los esquemas de manejo de la leptospirosis en las granjas objeto de estudio de esta investigación, se ha establecido la vacunación de las cerdas aproximadamente 35 días antes del servicio; esto implica entonces que dependiendo del número de partos a cada individuo se le ha aplicado cierto número de refuerzos de la vacuna; se esperaría entonces, que a medida que aumentan los partos el número de animales con IgG aumente, fenómeno que no se observó en esta investigación; este hecho refuerza la hipótesis de la predominancia de antígenos T-independientes en la vacuna ya que implica la ausencia de memoria inmunológica, aunque también puede deberse a factores genéticos asociados con la capacidad de generación de diferentes tipos de respuesta inmunológica frente a un antígeno en particular.
De los resultados obtenidos en la presente investigación, se concluye entonces que dicha vacuna no previene la reinfección frente a los serovares Canicola, Grippotyphosa e Icterohaemorrhagiae; las dos primeras, por presentar un aumento en el número de animales seropositivos para IgM en el segundo muestreo y, la tercera, por presentar un alto número de animales seropositivos en el primer muestreo para IgM y además presentar un aumento significativo de animales con títulos altos de IgG en el segundo muestreo. Hacia el final de la gestación hay una caída altamente significativa de los niveles de IgG para algunos de los serovares descritos, lo cual podría incidir negativamente en la generación de protección pasiva a los lechones frente a Leptospira en sus primeros días de vida. Por último, esta vacuna pentavalente no genera inmunidad cruzada ya que el serovar Bratislava, no cubierto en esta vacuna, presenta un aumento en animales seropositivos para IgM en el segundo muestreo.
Se recomienda el uso de la prueba IFI como complemento de la prueba MAT, ya sea para diagnóstico del estado de evolución de la enfermedad o para monitorear estados postvacunales. Además, se hace necesario validar la prueba de IFI en su reproducibilidad, sensibilidad y especificidad para diagnóstico de Leptospira en las diferentes especies de interés zootécnico y frente a un mayor número de serovares para conocer la frecuencia de los mismos en el país.
AGRADECIMIENTOS
Este trabajo fue apoyado por la Universidad de Caldas. Los autores expresan sus agradecimientos al Centro de Diagnóstico del Instituto Colombiano Agropecuario (ICA) seccional Manizales-Colombia, por la donación de los seis serovares de Leptospira y la ejecución de la prueba de Microaglutinación; igualmente a la Cooperativa de Porcicultores del Eje Cafetero (CERCAFÉ), por facilitar la información técnica de las granjas analizadas.
BIBLIOGRAFÍA
1. Bolin CA, Thiermann AB, Handsaker AL, Foley JW. Effect of vaccination with a pentavalent leptospiral vaccine on Leptospira interrogans serovar Hardjo type hardjo-bovis infection of pregnant cattle. Am J Vet Res 1989;50:161-165. [ Links ]
2. Bolin CA, Zuerner RL, Trueba G. Effect of vaccination with a pentavalent leptospiral vaccine containing Leptospira interrogans serovar Hardjo type hardjo-bovis on type hardjo-bovis infection of cattle. Am J Vet Res 1989;50:2004-2008. [ Links ]
3. Dammert N. Leptospirosis: una revisión bibliográfica. (Internet). Disponible en: http://www.sapuvetnet.org/Pdf%20Files/Monografia_leptospira.pdf. Consultado Octubre de 2008. [ Links ]
4. Hernández P, Escobar M, Rodríguez M. Leptospirosis: una zoonosis que afecta principalmente a humanos y bovinos. Revista de la Universidad de La Salle 2001;32:75-89. [ Links ]
5. Acha NP, Szyfres B. Leptospirosis. En: Acha NP, Szyfres B, eds. Zoonosis y enfermedades transmisibles comunes al hombre y a los animales. 3a ed. Washington: Organización Panamericana de la Salud; 2003. p. 175-184. [ Links ]
6. Silva RF. Leptospirosis canina. Seminario de Zoonosis Emergentes Prevención y Perspectivas. Manizales 29 de Febrero de 2004. Memorias del seminario de Zoonosis Emergentes, Prevención y Perspectivas. Manizales; 2004. p. 45-65. [ Links ]
7. Cisneros MA, Moles LP, Gavaldon D, Rojas N, Torres JI. Serología diagnóstica de leptospirosis porcina en México 1995-2000. Revista Cubana de Medicina Tropical 2002;54:28-31. [ Links ]
8. Morilla A. Leptospirosis. En: Morilla A, ed. Manual para el control de las enfermedades infecciosas del cerdo. 2a ed. México: Editorial El Manual Moderno; 2005. p. 221-229. [ Links ]
9. Torres J. Situación de la leptospirosis porcina y bovina en el estado de Yucatán. (Internet). Disponible en: http://www.conasamexico.org/mesa9Situaci%C3%B3n%20de%20la%20leptospirosis.pdf. Consultado Octubre de 2008. [ Links ]
10. Orrego A, Giraldo G, Bohórquez A, Escobar J, Quiceno J, Ríos B, et al. Aproximación a la prevalencia serológica real de la leptospirosis en porcinos-cría. Revista CORPOICA 2001;3:11-16. [ Links ]
11. Myers DM. Prueba de aglutinación microscópica. En: Myers DM, ed. Manual de métodos para el diagnóstico de laboratorio de la leptospirosis, nota técnica. Centro Panamericano de Zoonosis; 1985. p. 24-26. [ Links ]
12. Delgado A, Amich S, Prieto S, Salve M. Pruebas de Sensibilidad a los Antimicrobianos. En: Delgado A, Amich S, Prieto S, Salve M, eds. Laboratorio Clínico Microbiología. Madrid: Interamericana McGraw-Hill; 1994. p. 158-159. [ Links ]
13. Pierluigie EB, Richard CT. Inmunoflorescence and inmunoenzyme procedures. In: Pierluigie EB, Richard CT, eds. Methods in Immunodiagnosis. 2 ed. New York: Editorial A. Wiley Medical publication; 1980. p. 161-202. [ Links ]
14. Pfeiffer DU. Analytical epidemiology. In: Pfeiffer, DU. Veterinary Epidemiology: An Introduction. (Online). (Cited 01 may, 2010). Available from World Wide Web: http://www2.vetmed.wisc.edu/education/courses/epi/Pfeiffer.pdf. [ Links ]
15. Medina A, Negrete L, Almentero C. Prevalencia de leptospirosis porcina en el municipio de Circasia (Quindío). MVZ-Córdoba 2003;8:281. [ Links ]
16. Ramos A, Souza G, Lilenbaum W. Influence of leptospirosis on reproductive performance of sows in Brazil. Magazine Theriogenology 2006;66:1021-1025. [ Links ]
17. Tizard I. Vacunación y vacunas. En: Tizard I, ed. Inmunología Veterinaria. 6a ed. México: Editorial MacGraw-Hill/Interamericana editores; 2002. p. 254-273. [ Links ]
18. Giraldo G, Orrego A, Betancurth AM. Los roedores como reservorios de Leptospiras en planteles porcinos de la zona central cafetera de Colombia. Arch Med Vet 2002;34:69-78. [ Links ]
19. Giraldo G, Orrego A. Leptospirosis. Las aguas de la explotación porcina como vehículo de la Leptospira, en la zona central cafetera de Colombia. Arch Med Vet 2002;34:79-87. [ Links ]
20. Orrego A, Giraldo G, Ríos B, Valencia PA. Leptospirosis en personas de riesgo de quince explotaciones porcinas y de la central de sacrificio de Manizales, Colombia. Arch Med Vet 2003;35:205-213. [ Links ]
21. Guerrero JH, Orozco YJ, Aricapa HJ, Pérez JE. Aplicación de la Técnica de Inmunofluorescencia Indirecta (IFI), para la Detección de Anticuerpos contra Leptospira. Trabajo para optar al título de Medicina Veterinaria y Zootecnia. Universidad de Caldas, Manizales, Colombia; 2004. [ Links ]
22. Cabrera IC, Rivera K, Aricapa HJ, Pérez JE. Valoración de la Respuesta de Anticuerpos Tipo IgM e IgG Frente a Leptospira en Bovinos. Trabajo para optar al título de Medicina Veterinaria y Zootecnia. Universidad de Caldas, Manizales, Colombia; 2007. [ Links ]
23. Agudelo P, Restrepo M, Lotero MA. Evaluación de la prueba de inmunofluorescencia indirecta para el diagnóstico de Leptospirosis humana. Biomédica 2006;26:216-223. [ Links ]
24. Silva RF, Riedemann S. Seroprevalencia de leptospirosis canina en perros atendidos en clínicas veterinarias, mediante aglutinación microscópica y comparación con las técnicas de aislamiento e inmunofluorescencia indirecta. Arch Med Vet 2007;39:269-274. [ Links ]
25. Brown RA, Blumerman S, Gay C, Bolin C, Duby R, Baldwin CL. Comparison of three different leptospiral vaccines for induction of a type 1 immune response to Leptosprira borgpetersenii serovar Hardjo. Vaccines 2003;21:4448-4458. [ Links ]
26. Klaasen HLBM, Molkenboer MJCH, Vrijenhoek MP, Kaashoek MJ. Duration of immunity in dogs vaccinated against leptospirosis with a bivalent inactivated vaccine. Veterinary Microbiology 2003;95:121-132. [ Links ]
27. Martins S, F.R; Pnhero, S.R; Ito, F.H; Moraes, Z.M; Gonçales, A.P; Santos De A, S; Bernardi, F; Rodriguez C, S; Arruda V, S. Evaluation of colostral immunity in swine with commercial antileptospira polyvalent whole-bacteria vaccine. Comparative Immunology, Microbiology and Infectious Diseases, 2008. 31:327-335. [ Links ]
28. Adler B, de la Peña M. A. Leptospira and leptospirosis. Veterinary Microbiology; 2009. In Press, doi:10.1016/j.vetmic.2009.03.012. [ Links ]
29. Srivastava SK. Prospects of developing leptospiral vaccines for animals. Indian Journal of Medical Microbiology 2006;34:331-336. [ Links ]
30. Martins S. FR, Pinheiro SR, Morais ZM, Gonçales AP, Santos de Azevedo S, Bernardi F, Rodriguez C. S, Vasconcellos SA. Comparison of agglutinating and neutralizing antibodies to serovar Hardho in Sows immunized with two comercial whole cultura polivalent anti-leptospira bacterins. Brazilian Journal of Microbiology 2008;39:484-488. [ Links ]
31. Christopher WL, Adler B, Faine S. Immunogenicity of Leptospiral vaccines grown in protein-free medium. Journal Medical Microbiology 1982;15:493-501. [ Links ]
32. Felix SR, Silva EF, Jouglard SDD, Hartmann DM, Grassmann AA, Dellagostin OA. Leptospirosis Vaccine: search for subunit candidates. Procedia in Vaccinology 2009;1:110-114. [ Links ]
33. Schreiber P, Martin V, Najbar W, Sanquer A, Gueguen S, Lebreux B. Prevention of renal infection and urinary shedding in dogs by Leptospira vaccination. Veterinary Microbiology 2005;108:113-118. [ Links ]
34. Srivastava SK. Prospects of developing leptospiral vaccines for animals. Indian Journal of Medical Microbiology 2006;24:331-336. [ Links ]
35. The Leptospirosis Information Center. The Leptospira bacterium. Bacteriológical information. (On line). (Cited, 02 may 2010). Available From Word Wide Web: http://www.leptospirosis.org/bacteria/serovars.php. [ Links ]
36. Leptospira Molecular Biology, Institut Pasteur. What's Leptospirosis. (On line). (Cited, 02 may 2010). Available From Word Wide Web: http://www.pasteur.fr/recherche/Leptospira/LepE.html. [ Links ]
37. The Leptospirosis Information Center. Leptospirosis in animals-Species at risk. (On line). (Cited, 02 may 2010). Available From Word Wide Web: http://www.leptospirosis.org/topic.php?t=47$f=0. [ Links ]
38. World Health Organization, International Leptospire Society. Annex 9: DNA-Based Classification. In: World Health Organization, International Leptospire Society, eds. Human Leptospirosis: Guidance for Diagnosis, Surveillance and Control. World Health Organization; 2003. p. 59-62. [ Links ]
39. Ko AI, Goarant C, Picardeau M. Leptospira: the dawn of the molecular genetics for an emerging zoonotic pathogen. Nature Reviews Microbiological 2009;7:736-746. [ Links ]